随着水产养殖业的迅速发展,海水养殖中幼苗的培育成为最困难的阶段之一。海洋幼鱼从内源性到外源性摄食的关键过渡期也是幼鱼的高死亡率发生期[1],为了提高幼鱼的存活率并满足幼鱼的营养需求,提供高质量营养价值高的饵料至关重要[2]。在自然环境中,原生动物可作为海洋鱼类的开口饵料[3],但目前短时间高密度培养原生动物在养殖中会遇到亟需解决的问题。盐蚕豆虫(Fabrea salina)隶属于纤毛虫门(Ciliophora)多膜纲(Polyhymenophora)异毛目(Hetootricha)蚕豆虫属(Henneguy)[4],其生长周期短,繁殖速度快,能够在短时间内大量培养,且适应性强,在多种生境下都能够生长繁殖。盐蚕豆虫细胞内蛋白质含量为56.66%,脂肪含量为36.66%,且盐蚕豆虫体内还含有油酸、亚油酸和亚麻酸等脂肪酸,Rhodes等[5]研究发现,使用盐蚕豆虫投喂红鲷鱼(Lutjanus campechanus)时能明显提高其存活率。
温度变化对自然资源和生态系统造成的压力是影响生物生存的重要环境因素之一[6-8]。海洋生物倾向生存在温度相对稳定的环境中[9],全球变暖导致海洋的温度发生变化,海洋生物通过调节机体的免疫应答来维持正常的生命活动[10],当温度变化超过海洋生物生存的阈值温度时,就会影响到海洋生物的生长与繁殖[11-12]。因此,探究温度变化对盐蚕豆虫生长情况的影响至关重要。
纤毛虫的生长率是理解其种群动力学的重要参数,也是评价纤毛虫种群受上行控制(饵料不足)和下行控制(摄食压力过大)影响的重要参考指标[13],许多学者应用种群自然增长率和世代时间评估纤毛虫的生长情况[14-16]。本试验中以盐蚕豆虫为研究对象,探究了在15、25、35 ℃温度条件下,喂食杜氏盐藻(Dunaliella salina)、等鞭金藻(Isochrysis galbana)、普通小球藻(Chlorella vulgaris)和牟式角毛藻(Chaetoceros muelleri)对盐蚕豆虫生长率的影响,并应用Montagnes等[17]生长率模型对盐蚕豆虫的生长率进行数值拟合,评估盐蚕豆虫的生长,以期为盐蚕豆虫的规模化培养提供数据支持。
1 材料与方法
1.1 材料
本试验所用的盐蚕豆虫、等鞭金藻、普通小球藻、牟式角毛藻、杜氏盐藻由天津农学院渔业生态量化评估与管理实验室提供。试验前将盐蚕豆虫置于盐度为55,孔径为0.22 μm滤膜抽滤的人工海水中扩大培养[18],当盐蚕豆虫的密度达到4×104 ind./L,等鞭金藻、普通小球藻、牟式角毛藻和杜氏盐藻的密度分别达到4×109、9×109、6×109、4×109 ind./L时,方可开始本试验[19]。试验所用等鞭金藻、普通小球藻、杜氏盐藻和牟式角毛藻,培养条件为温度25 ℃,光照25 μmol/(m2·s1),光照周期L∶D=14∶10(即白昼与黑夜分别为14、10 h)的恒温光照培养箱中以f/2为培养液进行扩大培养。试验前将常温25 ℃下摄食杜氏盐藻、等鞭金藻、牟式角毛藻和普通小球藻的盐蚕豆虫分别在35 ℃、15 ℃提前适应7 d,然后开展试验。
1.2 方法
1.2.1 不同温度对盐蚕豆虫摄食率的测定 摄食率遵循Li等[20]的方法,随机选择盐蚕豆虫放置于六孔板(costar)中,每孔接种盐蚕豆虫15 ind.,盐度为55,试验在黑暗条件下进行,试验设置3个温度处理组(35 ℃、25 ℃、15 ℃),每组设置3个平行。用等鞭金藻、普通小球藻、牟式角毛藻和杜氏盐藻进行投喂,最终培养体积为5 mL,投喂2 h后摇匀,用微量毛细管在液面下取10 μL,每孔取样3次,取样品和鲁哥试剂按体积比1∶1进行混合摇匀,对样品中的藻计数,重复计数3次,通过盐蚕豆虫的消耗来确定其摄食率。
1.2.2 不同温度对盐蚕豆虫出生速率的测定 试验在六孔板中进行,盐度为55,每孔加5 mL培养液,每孔接种盐蚕豆虫10 ind.,分别设置35 ℃、25 ℃、15 ℃ 3个温度条件处理组,每组设置3个平行,试验持续7 d。每隔24 h在解剖镜(XTL-400,桂光)下对六孔板中的盐蚕豆虫计数,重复计数3次,计数后随机选择盐蚕豆虫10 ind.转移至相同饵料浓度的新鲜培养液中,以保证盐蚕豆虫在相同浓度的饵料中连续培养。
1.2.3 不同温度对盐蚕豆虫的死亡率测定 试验在24孔板(nest)中进行,随机选择盐蚕豆虫放置在24孔板中,每孔放置盐蚕豆虫1 ind.,盐度为55,试验在黑暗条件下进行。试验设置35 ℃、25 ℃、15 ℃ 3个温度处理组,每隔24 h在解剖镜下对24孔板中的盐蚕豆虫计数,重复计数3次。持续7 d观察记录盐蚕豆虫的死亡率,且每天随机选择一个存活个体转移到新的含有同样浓度藻液的24孔板中,每孔的最终培养体积为1 mL。
1.3 数据处理
采用Excel 2010软件计算盐蚕豆虫的摄食率(G)[20]、出生率(B)[21]和死亡率(D)[22],计算公式为
G=V/N×[(R0-Rt)/t1],
(1)
B=ln(Ct/C0)/t2,
(2)
D=lnd/t。
(3)
式中:G为摄食率(ind./h),即每只盐蚕豆虫单位时间内摄食的饵料;V为试验溶液体积(mL);N为每孔中的盐蚕豆虫个体数(ind.);t1为摄食时间(h);B为出生率;t2为纤毛虫培养时间;C0和Ct(ind./mL)分别为初始盐蚕豆虫丰度和t时盐蚕豆虫的丰度;D为盐蚕豆虫死亡率,d为盐蚕豆虫在试验t时的死亡个数(ind.),R0为初始饵料浓度(ind./mL);Rt为摄食后的饵料浓度(ind./mL)。
采用Montagnes种群模型[17]对盐蚕豆虫的摄食率[fI(R)]、出生率[fb(R)]、死亡(R)和转换效率(e)在origin 2021中拟合,计算公式为
fI(R)=ImaxR/(k+R),
(4)
fb(R)=Bmax(R-Rβ)/(kβ+R-Rβ),
(5)
fd(R)=αkδ/(kδ+R)+Dmin,
(6)
e=b/I。
(7)
式中:b为出生率(d);R为饵料浓度(ind./mL);Rβ为阈值饵料浓度(ind./mL),即捕食者出生率为0时的饵料浓度(ind./mL);Bmax为最大出生率(d);k、kδ、kβ为常数;I为摄食率;Imax为最大摄食率;R为被捕食者浓度;Dmin为饱和食物浓度下的最小死亡率;dmin+α=d0,d0为饵料浓度为0时盐蚕豆虫的死亡率;e为转换效率。
2 结果与分析
2.1 温度对盐蚕豆虫摄食率的影响
盐蚕豆虫摄食率的拟合曲线如图1所示,摄食不同饵料的盐蚕豆虫在35 ℃、25 ℃、15 ℃的摄食率符合Montagnes摄食率模型,模型拟合状态良好,R2值为0.88~0.98。35 ℃下盐蚕豆虫摄食率趋于平稳的杜氏盐藻、等鞭金藻、普通小球藻和牟式角毛藻浓度较15 ℃下分别高88%、95%、80%、35%,较25 ℃下高18%、40%、87.5%、58.6%。
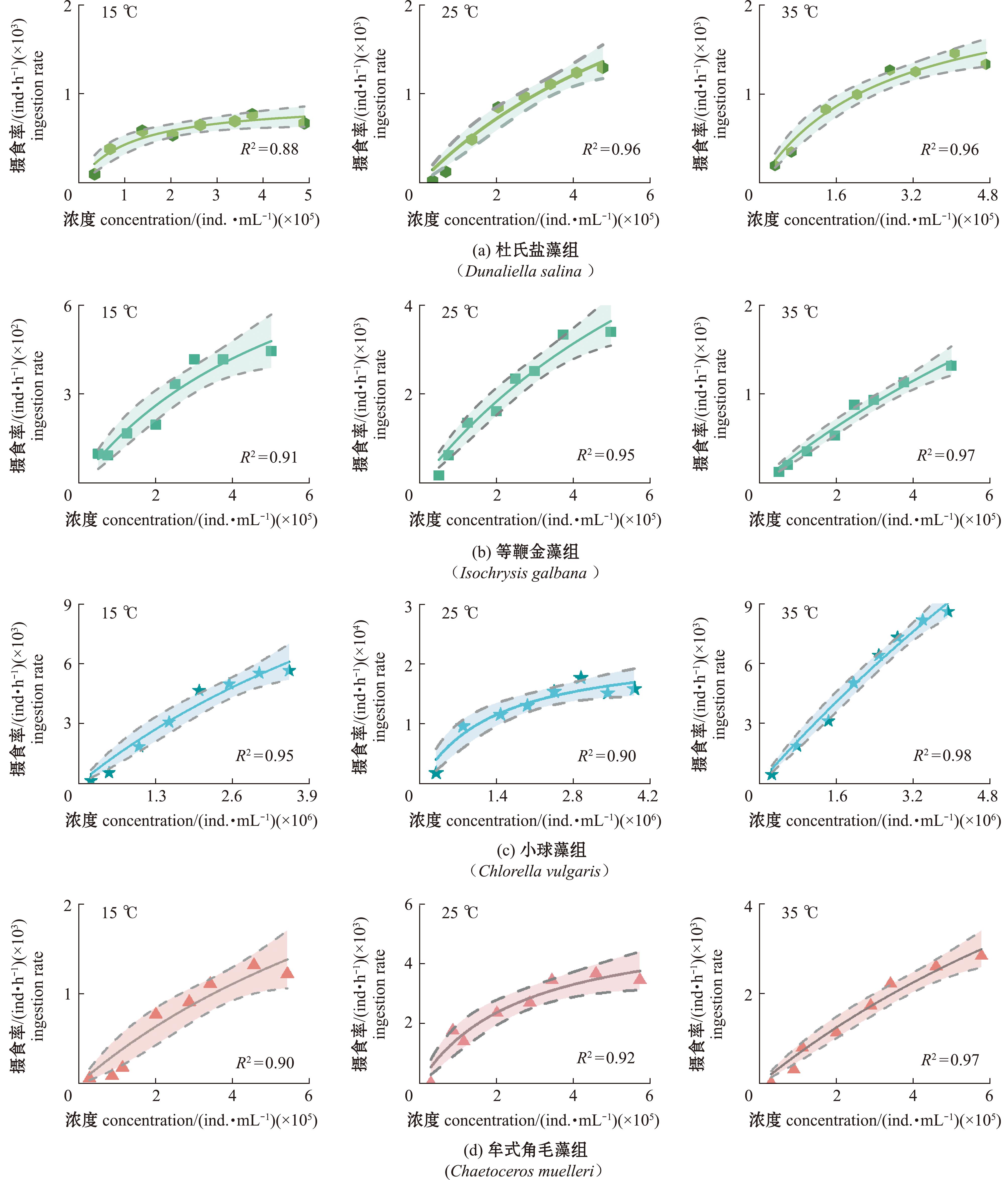
实线为数据的最优拟合曲线;短虚线代表95%置信区间,下同。
The solid line is the best fitting curveof the data;and the short,dashed line represents the 95% confidence interval,et sequentia.
图1 不同温度(15 ℃、25 ℃、35 ℃)下盐蚕豆虫摄食4种饵料时摄食率拟合曲线
Fig.1 Fitting curve of ingestion rate of four kinds bait by Fabrea salina at different temperatures (15 ℃,25 ℃,35 ℃)
不同温度下盐蚕豆虫的摄食率拟合参数见表1。摄食杜氏盐藻和等鞭金藻的最大摄食率(Imax)随着温度的升高呈现先上升后下降的趋势,牟式角毛藻和普通小球藻的Imax随着温度的升高呈现逐渐增大的趋势。
表1 在15 ℃、25 ℃、35 ℃下,盐蚕豆虫摄食4种饵料的出生率、摄食率和死亡率曲线拟合参数
Tab.1 Curve fitting parameters of birth rate,ingestion rate and mortality of four kinds bait by Fabrea salina at 15 ℃,25 ℃,35 ℃
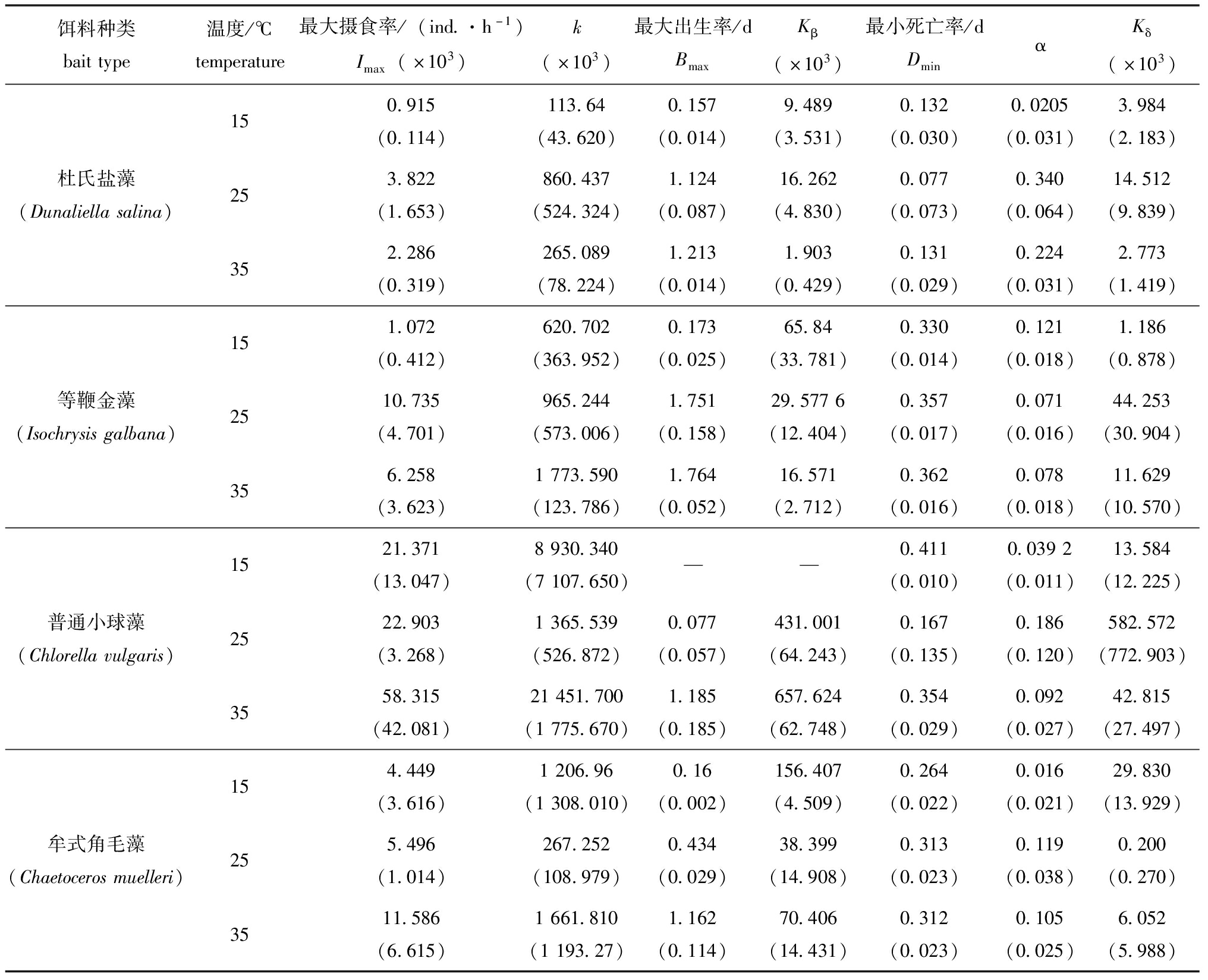
饵料种类baittype温度/℃temperature最大摄食率/(ind.·h-1)Imax(×103)k(×103)最大出生率/dBmaxKβ(×103)最小死亡率/dDminαKδ(×103)150.915(0.114)113.64(43.620)0.157(0.014)9.489(3.531)0.132(0.030)0.0205(0.031)3.984(2.183)杜氏盐藻(Dunaliellasalina)253.822(1.653)860.437(524.324)1.124(0.087)16.262(4.830)0.077(0.073)0.340(0.064)14.512(9.839)352.286(0.319)265.089(78.224)1.213(0.014)1.903(0.429)0.131(0.029)0.224(0.031)2.773(1.419)151.072(0.412)620.702(363.952)0.173(0.025)65.84(33.781)0.330(0.014)0.121(0.018)1.186(0.878)等鞭金藻(Isochrysisgalbana)2510.735(4.701)965.244(573.006)1.751(0.158)29.5776(12.404)0.357(0.017)0.071(0.016)44.253(30.904)356.258(3.623)1773.590(123.786)1.764(0.052)16.571(2.712)0.362(0.016)0.078(0.018)11.629(10.570)1521.371(13.047)8930.340(7107.650)——0.411(0.010)0.0392(0.011)13.584(12.225)普通小球藻(Chlorellavulgaris)2522.903(3.268)1365.539(526.872)0.077(0.057)431.001(64.243)0.167(0.135)0.186(0.120)582.572(772.903)3558.315(42.081)21451.700(1775.670)1.185(0.185)657.624(62.748)0.354(0.029)0.092(0.027)42.815(27.497)154.449(3.616)1206.96(1308.010)0.16(0.002)156.407(4.509)0.264(0.022)0.016(0.021)29.830(13.929)牟式角毛藻(Chaetocerosmuelleri)255.496(1.014)267.252(108.979)0.434(0.029)38.399(14.908)0.313(0.023)0.119(0.038)0.200(0.270)3511.586(6.615)1661.810(1193.27)1.162(0.114)70.406(14.431)0.312(0.023)0.105(0.025)6.052(5.988)
注:各参数含义详见材料与方法,其中各参数拟合误差值在“()”给出。
Note:Refer to materials and methods for the meaning of each parameter,the fitting error value of each parameter is given in “()”.
4种饵料投喂下Montagnes摄食率拟合参数的k值在35 ℃较15 ℃下高,杜氏盐藻组高温k值较低温高1.333倍,等鞭金藻组高温k值较低温高1.857倍,普通小球藻组高温k值较低温高1.402倍,牟式角毛藻组高温k值较低温高0.377倍。
2.2 温度对盐蚕豆虫出生率的影响
不同温度下盐蚕豆虫出生率的拟合曲线如图2所示,盐蚕豆虫在35 ℃、25 ℃、15 ℃的出生率符合Montagnes出生率模型,模型拟合状态较好,R2值为0.62~0.99。在15 ℃、25 ℃、35 ℃下盐蚕豆虫摄食杜氏盐藻、等鞭金藻和牟式角毛藻均可生长,摄食普通小球藻的盐蚕豆虫在25 ℃、35 ℃可生长,但在15 ℃其出生率为负值。35 ℃下,盐蚕豆虫摄食杜氏盐藻、等鞭金藻、牟式角毛藻出生率趋于稳定时的浓度比在15 ℃分别高58.11%、52.13%、26.24%。在15 ℃下,盐蚕豆虫摄食普通小球藻出生率为负值,在35 ℃下,普通小球藻的浓度高于6×105 ind./mL时,盐蚕豆虫的出生率持续升高。不同温度下盐蚕豆虫摄食不同饵料的最大出生率(Bmax)见表1,随着温度的升高,杜氏盐藻组、等鞭金藻组、普通小球藻组和牟式角毛藻组的Bmax呈现逐渐增大的趋势。在15 ℃下,摄食4种饵料盐蚕豆虫的最大出生率Bmax相对较低。
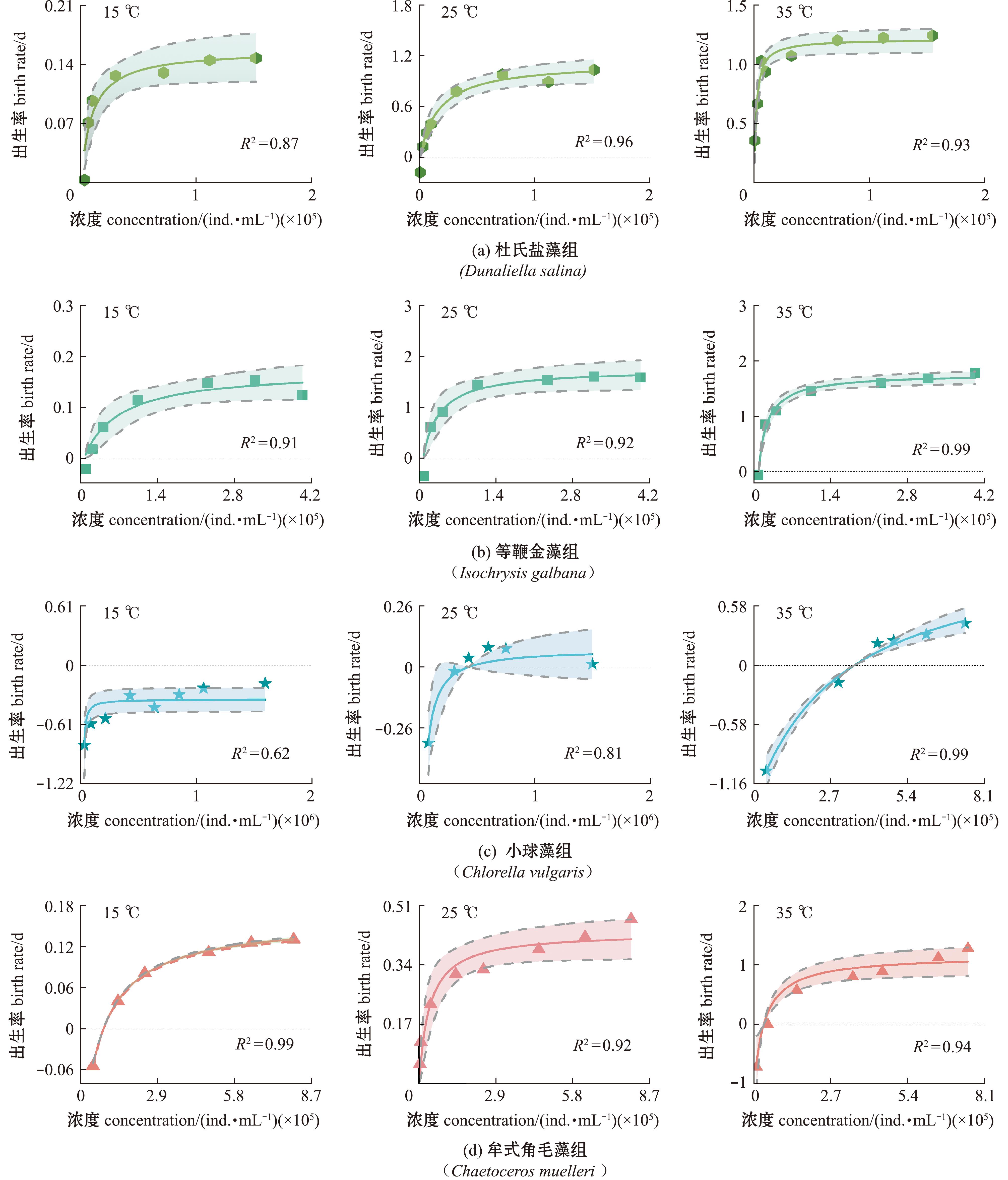
图2 不同温度(15 ℃、25 ℃、35 ℃)盐蚕豆虫摄食4种饵料时出生率拟合曲线
Fig.2 Fitting curve of birth rate of four kinds bait by Fabrea salina at different temperatures (15 ℃,25 ℃,35 ℃)
2.3 温度对盐蚕豆虫死亡率的影响
不同温度下盐蚕豆虫死亡率的拟合曲线如图3所示,摄食不同饵料的盐蚕豆虫在15 ℃、25 ℃、35 ℃的死亡率符合Montagnes死亡率模型,模型拟合状态较好,R2值为0.70~0.97。不同温度下盐蚕豆虫摄食不同饵料对其死亡率有影响,盐蚕豆虫在15 ℃、35 ℃下摄食等鞭金藻、杜氏盐藻、牟式角毛藻和15 ℃下摄食普通小球藻的死亡率均随饵料浓度的升高逐渐降低,当饵料浓度达到一定数值时盐蚕豆虫死亡率逐渐趋于平稳,在35 ℃时盐蚕豆虫摄食普通小球藻其死亡率持续增长。
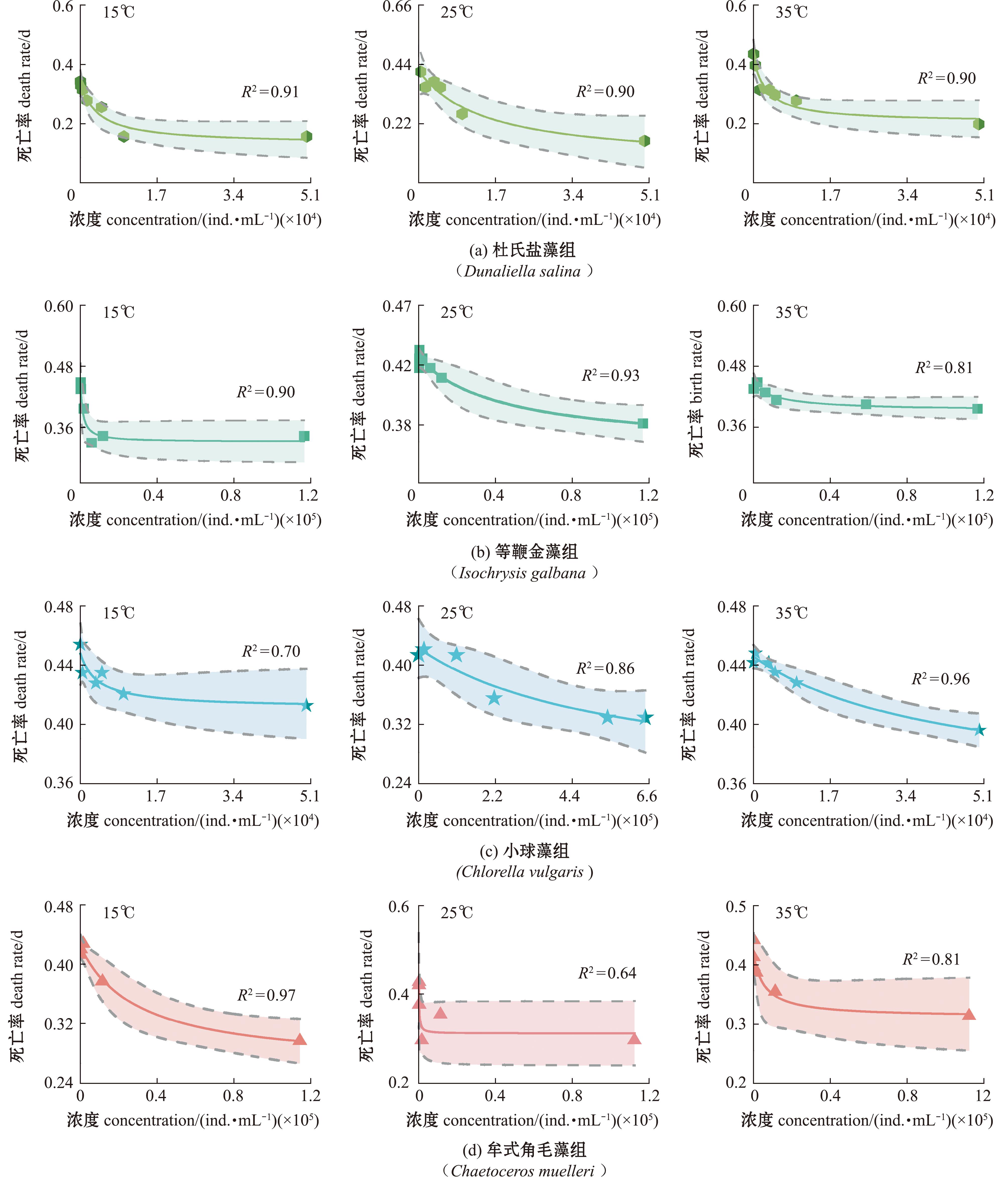
图3 不同温度(15 ℃、25 ℃、35 ℃)盐蚕豆虫摄食4种饵料时死亡率拟合曲线
Fig.3 Fitting curve of mortality of four kinds of bait by Fabrea salina at different temperatures (15 ℃,25 ℃,35 ℃) when eating four kinds of bait
不同温度下盐蚕豆虫摄食不同饵料的最小死亡率(Dmin)见表1,从表1可见,随着温度的升高,杜氏盐藻组和普通小球藻组盐蚕豆虫Dmin呈现先下降后上升的趋势,等鞭金藻组和牟式角毛藻组的盐蚕豆虫Dmin随温度升高呈现上升趋势。
杜氏盐藻组盐蚕豆虫的Dmin的最小值出现在25 ℃,为0.077 ind./d,等鞭金藻组的Dmin最小值出现在15 ℃,为0.331 ind./d,普通小球藻组的Dmin最小值出现在25 ℃,为0.167 ind./d,牟式角毛藻组的Dmin最小值出现在15 ℃,为0.264 ind./d。
2.4 温度对盐蚕豆虫的转换效率的影响
不同温度下投喂4种饵料时盐蚕豆虫的转换效率(e)如图4所示,不同温度对盐蚕豆虫的转换效率有一定影响。总体上,盐蚕豆虫的转换效率随着饵料浓度的上升而升高,当饵料浓度高于盐蚕豆虫生长的阈值浓度Rβ时,随着饵料浓度的升高,转换效率开始下降。转换效率与温度有关,杜氏盐藻组、等鞭金藻组、牟式角毛藻和普通小球藻组盐蚕豆虫的转换效率(e)随着温度的升高逐渐增大,其中,等鞭金藻组、普通小球藻组和牟式角毛藻组在35 ℃时转换效率随着饵料浓度的升高维持在较高水平。牟式角毛藻组盐蚕豆虫的转换效率在25 ℃和35 ℃相差较小。
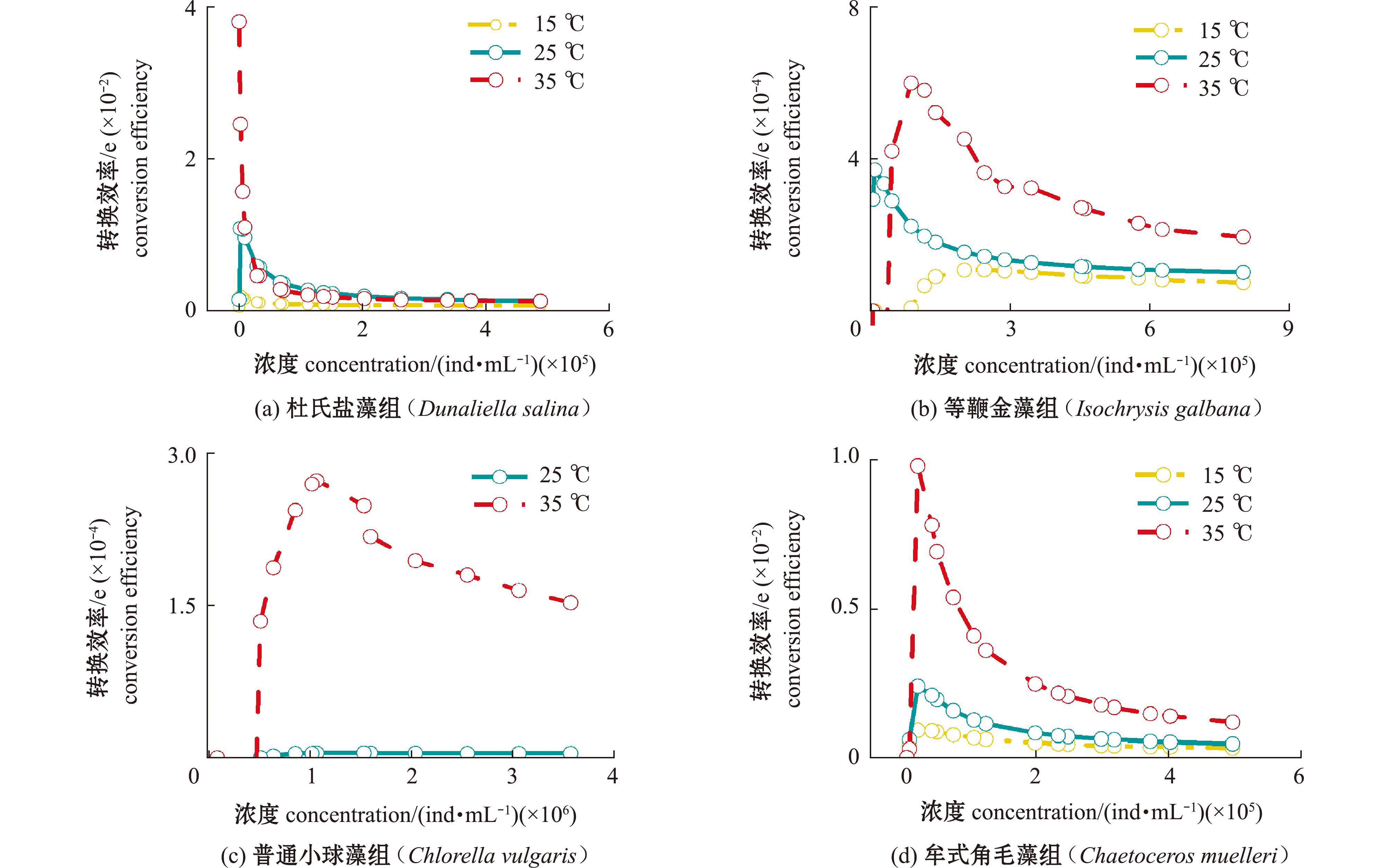
图4 不同温度(15 ℃、25 ℃、35 ℃)盐蚕豆虫摄食4种饵料的转换效率(e)
Fig.4 Conversion efficiency of four kinds of bait by Fabrea salina at different temperatures(15 ℃,25 ℃,35 ℃)(e)
3 讨论
3.1 温度与盐蚕豆虫摄食率的关系
摄食率是研究海洋纤毛虫摄食强度的重要指标,浮游动物的摄食行为通常被认为是生物体受到环境干扰时的第一响应指标[23],盐蚕豆虫作为潜在的饵料生物,探究不同温度对其摄食率的影响至关重要。温度的升高可以增强生物体中的酶活性和代谢速率[24],并提高捕食者对其猎物的摄食能力[25],这在本研究中也有所体现,即盐蚕豆虫的摄食率随温度的升高而增加。此外,不同温度下Montagnes摄食率拟合参数不同,k值随着温度的升高逐渐增大,15 ℃时4种饵料投喂下的盐蚕豆虫的摄食率均低于35 ℃组,表明海水变暖有利于加强异养消费者对初级生产者的自上而下的控制[26],在试验过程中,观察到在35 ℃时盐蚕豆虫的游动速度相对于15 ℃下显著加快,推测是由于在温度较高的状态下,盐蚕豆虫的游动速度变快,维持种群稳定的能量消耗显著增高,促使盐蚕豆虫需要大量摄食。
3.2 温度与盐蚕豆虫出生率的关系
温度对盐蚕豆虫的出生率有一定的促进作用,提高温度会增加盐蚕豆虫的出生率,在温度的作用下,盐蚕豆虫摄食杜氏盐藻、等鞭金藻、普通小球藻和牟式角毛藻对其出生率总体上呈现促进作用,在相同饵料浓度的作用下,15 ℃时盐蚕豆虫的出生率低于35 ℃,由此推测在高温下盐蚕豆虫的出生率随着饵料浓度的升高较低温下更为显著。盐蚕豆虫的生长反应随着温度的变化而变化,在低温状态下盐蚕豆虫的出生率表现出持久性的策略,即盐蚕豆虫在低温状态下也可长时间存活,且随着温度的恢复可以迅速达到最大生长速率,在低温状态下适合保种和运输。高温可以维持种群稳定性,本试验中盐蚕豆虫在35 ℃下依旧可以保持较高的出生率,与Liu等[27]研究中纤毛虫生长速率随着温度升高而增加的结果一致,这可能与高温下酶活性和代谢速率的加快有关[24],盐蚕豆虫的出生速率呈指数增长,并增大了盐蚕豆虫的种群密度,这充分表明了盐蚕豆虫易于培养的优势。
3.3 温度与盐蚕豆虫生长率与死亡率的关系
徐孟杰等[28]研究表明,在10 ℃时会对冬青叶马尾藻(Sargassum hollandii)的生长造成低温胁迫,推测可能是当细胞受到低温胁迫时,其生长速率和酶反应速率均会受限[29],这也可以合理解释本试验中盐蚕豆虫在低于10 ℃时,几乎不生长,且会形成包囊;同样,李承春等[30]研究发现,不同温度对叶状突口虫(Condylostoma spatiosum)生长有显著影响,在15 ℃下生长率为最低;潘莹等[31]研究表明,缩原克鲁虫(Protocruzia contrax)、拉氏游仆虫(Euplotes raikovi)和中华游仆虫(Euplotes sinica)在17 ℃下生长缓慢。温度对盐蚕豆虫的死亡率也会产生影响,在25 ℃下,盐蚕豆虫摄食杜氏盐藻和普通小球藻时出现最小死亡率(Dmin)的最小值,在15 ℃下,摄食等鞭金藻和牟式角毛藻出现最小死亡率的最小值,推测造成此现象的原因是受到了温度改变的影响,从而导致盐蚕豆虫摄食后产生不同的响应。盐蚕豆虫摄食4种饵料时,在35 ℃下最小死亡率(Dmin)普遍最大,推测是在高温状态下盐蚕豆虫的能量消耗较快,从而加速了盐蚕豆虫的死亡率,而在低温状态下,盐蚕豆虫的活动量较少,从而减少了能量的消耗,最小死亡率(Dmin)降低。
3.4 温度与盐蚕豆虫转换效率的关系
本试验中盐蚕豆虫在低温下有较高的摄食率,但低温下的生长率相对较低,这可能是由于盐蚕豆虫的高摄食率并未转换为盐蚕豆虫的高生长率。从转换效率(e)可以看出,低温状态下盐蚕豆虫的转换效率低于高温状态和常温状态。Rose等[32]研究表明,急游虫(Strombidium sp.)的生长速率也会受到低温的限制,这与本试验结果基本一致。35 ℃下盐蚕豆虫生长速率加快,温度升高会进一步限制盐蚕豆虫的生长,这可能是在盐蚕豆虫消化过程中,随着温度升高盐蚕豆虫的代谢速度加快,因此,在35 ℃下随着饵料浓度的升高,盐蚕豆虫在投喂等鞭金藻、牟式角毛藻和普通小球藻时,转换效率维持在较高的水平。同时,盐蚕豆虫的死亡率也会随着温度的升高而升高。本试验结果表明,35 ℃下短期内可以将盐蚕豆虫培养到较高密度,但长时间的高温胁迫下,盐蚕豆虫的种群会出现衰败的现象。
4 结论
1)35 ℃时,盐蚕豆虫摄食杜氏盐藻的转换效率最高,同时在饱和饵料浓度下的最小死亡率(Dmin)也最大,这可作为快速短时高密度培养盐蚕豆虫的条件。
2)25 ℃时,盐蚕豆虫摄食杜氏盐藻的转换效率(e)相对其他3种饵料投喂下较高,最小死亡率(Dmin)较低,此可作为长时间大规模高密度盐蚕豆虫的培养条件。
[1] ANNUNCIAÇ O W F,OHS C L,TSUZUKI M Y.Influence of food concentration and abiotic parameters on population density growth of the ciliated marine protozoan Euplotes sp.under controlled conditions[J].Aquaculture Research,2020,51(2):523-534.
O W F,OHS C L,TSUZUKI M Y.Influence of food concentration and abiotic parameters on population density growth of the ciliated marine protozoan Euplotes sp.under controlled conditions[J].Aquaculture Research,2020,51(2):523-534.
[2] LEE I S,OHS C L,BROACH J S,et al.Determining live prey preferences of larval ornamental marine fish utilizing fluorescent microspheres[J].Aquaculture,2018,490:125-135.
[3] HOLT G J,HOLT S A.Vertical distribution and the role of physical processes in the feeding dynamics of two larvalsciaenids Sciaenops ocellatus and Cynoscion nebulosus[J].Marine Ecology Progress Series,2000,193:181-190.
[4] 宋微波,WARREN A,胡晓钟.中国黄勃海的自由生纤毛虫[M].北京:科学出版社,2009.SONG W B,WARREN A,HU X Z.Marine free-living ciliates in the Bohai and Yellow Sea,China[M].Beijing:Science Press,2009.(in Chinese)
[5] RHODES M A,PHELPS R P.Ciliated protozoans as alternative live food for first feeding red snapper,Lutjanus campechanus,larvae[J].Environmental Science,Biology,2006,963-974.
[6] 何静怡,郑伟,黄卉,等.不同温度、盐度条件对草鱼暂养及应激保活的影响[J].大连海洋大学学报,2024,39(4):597-605.HE J Y,ZHENG W,HUANG H,et al.Effects of different temperature and salinity conditions on temporary culture and stress preservation of Ctenopharyngodon idellus[J].Journal of Dalian Ocean University,2024,39(4):597-605.(in Chinese)
[7] 丰超杰,刘霞飞,张颖,等.高温胁迫下黑龙江茴鱼幼鱼肝脏组织结构变化及转录组表达特征[J].大连海洋大学学报,2023,38(4):603-614.FENG C J,LIU X F,ZHANG Y,et al.Histological structure and transcriptome characteristics in liver of juvenile Amur grayling (Thymallus arcticus grubei) runder high temperature stress[J].Journal of Dalian Ocean University,2023,38(4):603-614.(in Chinese)
[8] 李宁,聂鸿涛,黎强,等.低温胁迫对不同群体菲律宾蛤仔存活率及脂肪酸代谢相关基因SCD、FAD和ACC表达的影响[J].大连海洋大学学报,2022,37(4):636-642.LI N,NIE H T,LI Q,et al.Effects of low temperature stress on survival rate and expression of fatty acid metabolism related genes SCD,FAD and ACC in different populations of Ruditapes philippinarum[J].Journal of Dalian Ocean University,2022,37(4):636-642.(in Chinese)
[9] 杨嘉樑,黄洪亮,刘健,等.智利竹筴鱼渔场海表温度及叶绿素浓度分布特征[J].中国农业科技导报,2017,19(10):113-120.YANG J L,HUANG H L,LIU J,et al.Characteristics of Trachurus murphyi mackerel fishing ground distribution and sea surface temperature and chlorophyll-A[J].Journal of Agricultural Science and Technology,2017,19(10):113-120.(in Chinese)
[10] HOGG O T,BARNES D K A,GRIFFITHS H J.Highly diverse,poorly studied and uniquely threatened by climate change:an assessment of marine biodiversity on South Georgia’s continental shelf[J].PLoS One,2011,6(5):e19795.
[11] 白思琦,邹晓荣,丁鹏,等.基于环境因子的东南太平洋智利竹筴鱼剩余产量模型建立[J].中国农业科技导报,2022,24(7):197-204.BAI S Q,ZOU X R,DING P,et al.Surplus production model for Trachurus murphyi in the southeast Pacific Ocean based on the environmental factors[J].Journal of Agricultural Science and Technology,2022,24(7):197-204.(in Chinese)
[12] 刘炜炜,温少薇,谭烨辉.海水养殖水域纤毛虫多样性及其生态效应研究进展[J].热带海洋学报,2024,43(4):1-19.LIU W W,WEN S W,TAN Y H.Progress in studies on diversity and ecological role of ciliates in mariculture[J].Journal of Tropical Oceanography,2024:43(4):1-19.(in Chinese)
[13] KHROMECHEK E B,BARKHATOV Y V,ROGOZIN D Y.Community structure and vertical distribution of planktonic ciliates in the saline meromictic Lake Shira during breakdown of meromixis[J].Ecohydrology and Hydrobiology,2021,21(1):142-152.
[14] 汤荣成,齐红莉,王红宇,等.不同食物及食物密度对盐蚕豆虫种群动力学特征的影响[J].动物学杂志,2019,54(4):529-537.TANG R C,QI H L,WANG H Y,et al.Effects of different food densities on the population dynamics of Fabrea salina[J].Chinese Journal of Comparative Medicine,2019,54(4):529-537.(in Chinese)
[15] HONG H P,CHOI J K.Can the halophilic ciliate Fabrea salina be used as a bio-control of microalgae blooms in solar salterns?[J].Ocean Science Journal,2015,50(3):529-536.
[16] 石雪,齐红莉,吕湘琳,等.不同盐度和饵料对盐蚕豆虫生长的影响[J].经济动物学报,2022,26(4):335-341.SHI X,QI H L,LÜ X L,et al.Effects of different salinities and diets on the growth of Fabrea salina[J].Journal of Economic Animal,2022,26(4):335-341.(in Chinese)
[17] MONTAGNES D J S,ZHU X X,GU L,et al.False exclusion:a case to embed predator performance in classical population models[J].The American Naturalist,2019,194(5):654-670.
[18] 汤荣成,徐海龙,王茜,等.盐度和食物对海洋纤毛虫——盐田蚕豆虫种群增长的影响[C].第一届微藻与水族高峰论坛,天津:天津农学院水产学院,2017.TANG R C,XU H L,WANG Q,et al.Effects of salinity and food supply on population growth of marine benthic ciliate,Fabrea salina[C].The First Microalgae and Aquarium Summit Forum,Tianjin:College of Aquaculture,Tianjin:Tianjin Agricultural University,2017.(in Chinese)
[19] WEISSE T,KARSTENS N,MEYER V,et al.Niche separation in common prostome freshwater ciliates:the effect of food and temperature[J].Aquatic Microbial Ecology,2001,26:167-179.
[20] LI J Q,MONTAGNES D J S.Restructuring fundamental predator-prey models by recognising prey-dependent conversion efficiency and mortality rates[J].Protist,2015,166(2):211-223.
[21] MONTAGNES D.Growth responses of planktonic ciliates in theGenera Strobilidium and Strombidium[J].Marine Ecology Progress Series,1996,130:241-254.
[22] MINTER E J A,FENTON A,COOPER J,et al.Prey-dependent mortality rate:a critical parameter in microbial models[J].Microbial Ecology,2011,62(1):155-161.
[23] 张武昌,陈雪,李海波,等.海洋浮游桡足类摄食纤毛虫的研究[J].海洋与湖沼,2014,45(4):764-775.ZHANG W C,CHEN X,LI H B,et al.Marine planktonic copepods grazing on ciliates:a review[J].Oceanologia et Limnologia Sinica,2014,45(4):764-775.(in Chinese)
[24] CLARKE A,FRASER K P P.Whydoes metabolism scale with temperature?[J].Functional Ecology,2004,18(2):243-251.
[25] YANG Z,ZHANG L,ZHU X X,et al.An evidence-based framework for predicting the impact of differing autotroph-heterotroph thermal sensitivities on consumer-prey dynamics[J].The ISME Journal,2016,10(7):1767-1778.
[26] ABERLE N,BAUER B,LEWANDOWSKA A,et al.Warming induces shifts in microzooplankton phenology and reduces time-lags between phytoplankton and protozoan production[J].Marine Biology,2012,159(11):2441-2453.
[27] LIU K L,JIANG S Y,MONTAGNES D J S,et al.Do marine planktonic ciliates follow Bergmann’s rule?[J].Ecography,2023,2023(6):e6452.
[28] 徐孟杰,李青楠,姚丹丹,等.温度、光照强度和盐度对冬青叶马尾藻生长和光合生理的影响[J].南方水产科学,2023,19(6):127-133.XU M J,LI Q N,YAO D D,et al.The effects of temperature,light intensity,and salinity on the growth and photosynthetic physiology of Sargassum hollandii[J].South China Fisheries Science,2023,19(6):127-133.(in Chinese)
[29] 王婧一,吴婷婷,蔡春尔,等.不同温度和光照强度对浒苔光合作用的短期交互影响[J].大连海洋大学学报,2024,39(5):819-828.WANG J Y,WU T T,CAI C E,et al.Effects of different temperatures and light lntensity on photosynthesis of Enteromotpha prolifera[J].Journal of Dalian Ocean University,2024,39(5):819-828..(in Chinese)
[30] 李承春,徐奎栋,类彦立.食物和温度对海洋底栖纤毛虫:叶状突口虫种群增长的影响[J].应用与环境生物学报,2010,16(4):545-549.LI C C,XU K D,LEI Y L.Effects of temperature and food supply on population growth of marine benthic ciliate,Condylostoma spatiosum[J].Chinese Journal of Applied and Environmental Biology,2010,16(4):545-549.(in Chinese)
[31] 潘莹,姜勇,张伟,等.不同温度对3种海洋纤毛虫种群增长的影响[J].应用与环境生物学报,2010,16(6):807-811.PAN Y,JIANG Y,ZHANG W,et al.Effect of temperature on population growth of three marine ciliates[J].Chinese Journal of Applied and Environmental Biology,2010,16(6):807-811.(in Chinese)
[32] ROSE J M,FITZPATRICK E,WANG A N,et al.Low temperature constrains growth rates but not short-term ingestion rates of Antarctic ciliates[J].Polar Biology,2013,36(5):645-659.