凡纳滨对虾(Litopenaeus vannamei)因其适应性强、生长速度快、营养价值高等特点,目前已成为中国主要水产养殖品种之一。2022年,中国凡纳滨对虾养殖总产量134万t,占全国对虾海水养殖产量的80%[1]。但近年来,随着凡纳滨对虾养殖密度不断提高,养殖生物和养殖环境压力显著增加[2],养殖水环境日益恶化已成为威胁对虾生存和生长的关键因素,养殖水体中氨氮、亚硝酸盐等有害物质的积累,对对虾的存活、生理代谢和免疫功能有较强的毒性作用,严重制约了对虾养殖业的健康可持续发展[3-4],因此,寻求有效且经济的水产养殖系统脱氮技术已成为目前对虾养殖业的重要任务之一。
有研究表明,向水产养殖水环境中添加脱氮菌可以有效改善水质,促进养殖生物生长,改善其肠道内环境平衡,在维护养殖动物健康中发挥着至关重要的作用,生产过程中常常以单一或复合制剂的形式应用于水产养殖过程中[5-11]。然而,脱氮菌种类繁多、分布环境复杂多样,因此,不同脱氮菌的相关氮代谢途径及脱氮机理差异较大。与此同时影响细菌异养硝化和好氧反硝化的因素众多,已有研究表明,脱氮菌调节水质的效率很大程度上取决于施用方式、溶解氧、pH值、盐度、温度和C/N等因素[12-16]。与外来菌群相比,本土菌群具有更好的适应性,若使菌株在目标环境中定植并成为优势菌群且在养殖生产中得到实际应用仍需进一步探究。
本研究中,从对虾生物絮团养殖水体中富集筛选出具有高效降解亚硝酸盐氮特性的枯草芽孢杆菌XYB4,评估了候选菌株的生物安全性,探究了不同理化因子对该菌株脱氮效果的影响。此外,本研究中分析了该菌作为微生态制剂运用于凡纳滨对虾养殖试验对水质指标、凡纳滨对虾生长指标和微生物群落结构的影响,以期寻找具有益生菌特性的池塘土著芽孢杆菌,为水产养殖安全绿色可持续发展提供技术支持。
筛选分离菌株水体样本采集于对虾生物絮团养殖水体。试验用的凡纳滨对虾选自广东海洋大学海洋生物研究基地,体长为(5.76±0.18)cm,体质量为(2.14±0.21)g。菌株的筛选采用氨氮-硝化液体(固体)培养基、亚硝酸盐-反硝化液体(固体)培养基、2216E液体(固体)培养基。血琼脂平板购自北京陆桥技术股份有限公司;MHA培养基购自青岛高科园海博生物技术有限公司。
1.2.1 菌株的分离与筛选 将水体样品按10%比例接入氨氮-硝化液体培养基和亚硝酸盐氮-反硝化液体培养基中,28 ℃下以180 r/min富集培养2~3 d。将富集后的培养液置于含有4.5 mL灭菌海水的无菌离心管中振荡均匀,用PBS稀释到10-3~10-6倍,均匀涂布于平板上,倒置于28 ℃控温摇床中培养48~72 h。根据群落形态、颜色等挑选出单菌落,把挑选出来的单菌落分离到新的培养基中划线培养,重复多次直至获得纯菌。将分离出的纯菌分别接种到氨氮-硝化液体培养基和亚硝酸盐-反硝化液体培养基中,在28 ℃下以160 r/min继续培养48 h,以不加菌株的培养基为空白对照组,每组设置3个平行,分别在24、48 h取上清液测定分离菌对![]() 和
和![]() 的降解性能,最终挑选出具有良好脱氮效果的菌株。
的降解性能,最终挑选出具有良好脱氮效果的菌株。
1.2.2 菌株的形态观察及生理生化鉴定 通过平板画线法观察菌落的形态,参照《伯杰氏细菌鉴定手册》[17]、《常见细菌系统鉴定手册》[18]对细菌进行生理生化测定。
1.2.3 菌株的分子生物学鉴定 将菌株活化后,采用细菌基因组DNA提取试剂盒(TIANGEN)提取目标菌株的DNA,以该DNA作为模板进行PCR扩增。扩增引物序列如下,正向引物为(27F):5′AGAGTTTGATCCTGGCTCAG 3′;反向引物为(1 492R):5′TACGGCTACCTTGTTACGACTT 3′。PCR反应程序为94 ℃下预变性5 min;94 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸1 min,共进行33个循环;最后在72 ℃下再延伸5 min。PCR扩增结束后产物经过10 g/L琼脂糖凝胶电泳检测,送至生物工程(上海)股份有限公司进行测序。将测序结果在NCBI上进行BLAST比对分析,构建系统进化树[19],推测菌株的种属关系。
1.2.4 菌株安全性评估试验
1) LD50浸泡感染试验。试验共分6组,每组设置3个平行,在18个规格为60 L养殖桶进行,每桶置入20尾凡纳滨对虾,菌液浓度分别为104、105、106、107、108 CFU/mL,试验周期14 d。试验开始前暂养7 d。试验正式开始后,每日观察对虾存活情况,每3 d换1次水,日换水量为80%,每次换水后加入对应浓度菌液,试验结束后用改良的寇氏法计算菌株的LD50值。
2)溶血试验。将目的菌点种于陆桥(北京)血琼脂培养基,37 ℃下培养48 h,观察平板上菌落周围是否出现溶血圈,判断该菌株是否具有溶血性。
3)药敏试验。采用纸片扩散法测定菌株对17种抗菌药物的药物敏感性。取100 μL处于对数期的菌液,均匀涂布于2216E固体培养基,每个培养基均匀放置3片药敏试纸,倒置平板,30 ℃±1 ℃培养24 h,用直尺测量抑菌圈直径,判定标准参照杭州微生物试剂有限公司的药敏试验纸片法抑菌范围解释标准。
1.2.5 菌株在不同条件下的脱氮效果 为研究菌株在不同温度、盐度、pH和C/N条件下的最优脱氮效果,每个影响因子分别设置6个不同梯度,每组设置3个重复。采用控温培养箱调整温度梯度,采用添加NaCl升高盐度或添加纯水降低盐度,采用添加HCl和NaOH调整pH,采用添加葡萄糖调整C/N。各因子设置条件如下:温度为15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃;盐度为5、10、20、30、40、50;pH值为6.5、7.0、7.5、8.0、8.5、9.0;C/N比为0、2、5、10、15、20,除了设定影响因子外,其他试验条件分别为温度30 ℃,盐度30,pH 7.5和C/N 10。恒温培养24 h,测定各个培养基中![]() 和
和![]() 浓度,确定菌株XYB4氨氮降解最优条件。
浓度,确定菌株XYB4氨氮降解最优条件。
1.2.6 作为微生态制剂应用于凡纳滨对虾养殖试验及效果评价 试验在0.3 m3养殖桶中进行,养殖水体积为0.25 m3,放置70尾凡纳滨对虾/桶,试验周期71 d。试验分3组,分别是拌料组(B7)、泼洒组(P7)及空白对照组(DZ),每组设置3个平行。将浓度为107 CFU/mL的菌液分别以拌料投喂和直接泼洒的方式施用于凡纳滨对虾养殖池,步骤如下:在投喂的前1天拌料,准确称量基础饲料,将制得的活菌液按比例稀释后,均匀喷洒在基础饲料上,使得饲料中枯草芽孢杆菌XYB4的最终浓度为1×107 CFU/g,喷洒同时充分搅拌,混合均匀,待干后再用,现用现配。将制得的活菌液结合水体容积按比例泼洒于凡纳滨对虾试验桶中,使养殖水体中枯草芽孢杆菌XYB4含量为1×107 CFU/mL,每天进行排污并检测水体理化因子。试验结束统计对虾存活率、体长和体质量增长率,采集水体和对虾肠道样本测定微生物群落结构。
采用SPSS 21.0软件进行统计分析,采用 SPSS 22.0软件的Tukey’s HSD对检测结果进行多重比较,显著性水平设为 0.05。
菌株在固体2216E平板上形成表面光滑湿润、边缘整齐的黄色圆形菌落(图1)。生理生化试验结果表明,XYB4为革兰氏阳性菌,能分解葡萄糖,还原硝酸盐,具有脲酶能分解尿素,不可分解色氨酸,不能液化明胶(表1)。
表1 菌株XYB4生化鉴定
Tab.1 Biochemical identification results of strain XYB4

生化项目biochemicalproject结果result革兰氏染色gramstain+接触酶试验contactasetest+葡萄糖氧化发酵试验glucoseoxidativefermentationtest+M.R试验M.Rtest-V.P试验V.Ptest-硝酸盐还原试验nitratereductiontest+脲酶试验ureasetest+吲哚试验indoletest-明胶液化试验gelatinliquefactiontest
注:+表示为阳性;-表示阴性。
Note:+ means positive;-means negative.
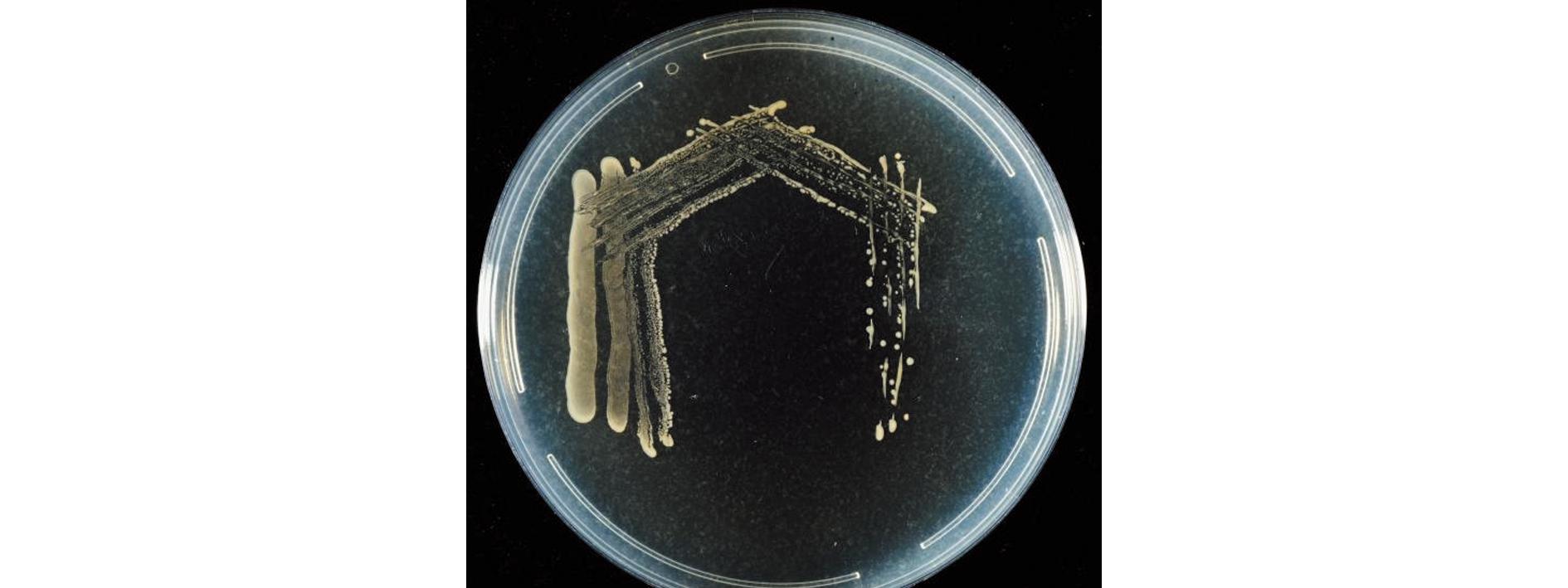
图1 菌株XYB4的菌落形态
Fig.1 Colony morphology of strain XYB4
对菌株16S rDNA片段进行扩增测序得到大小为1 457 bp的基因片段,在NCBI数据库进行比对分析,选取数据库中相似度最高的菌株构建系统进化树,发现XYB4与枯草芽孢杆菌AU03(JMF 590125.1)聚为一支,一致性高达99.96%,经鉴定该菌株为枯草芽孢杆菌(图2)。
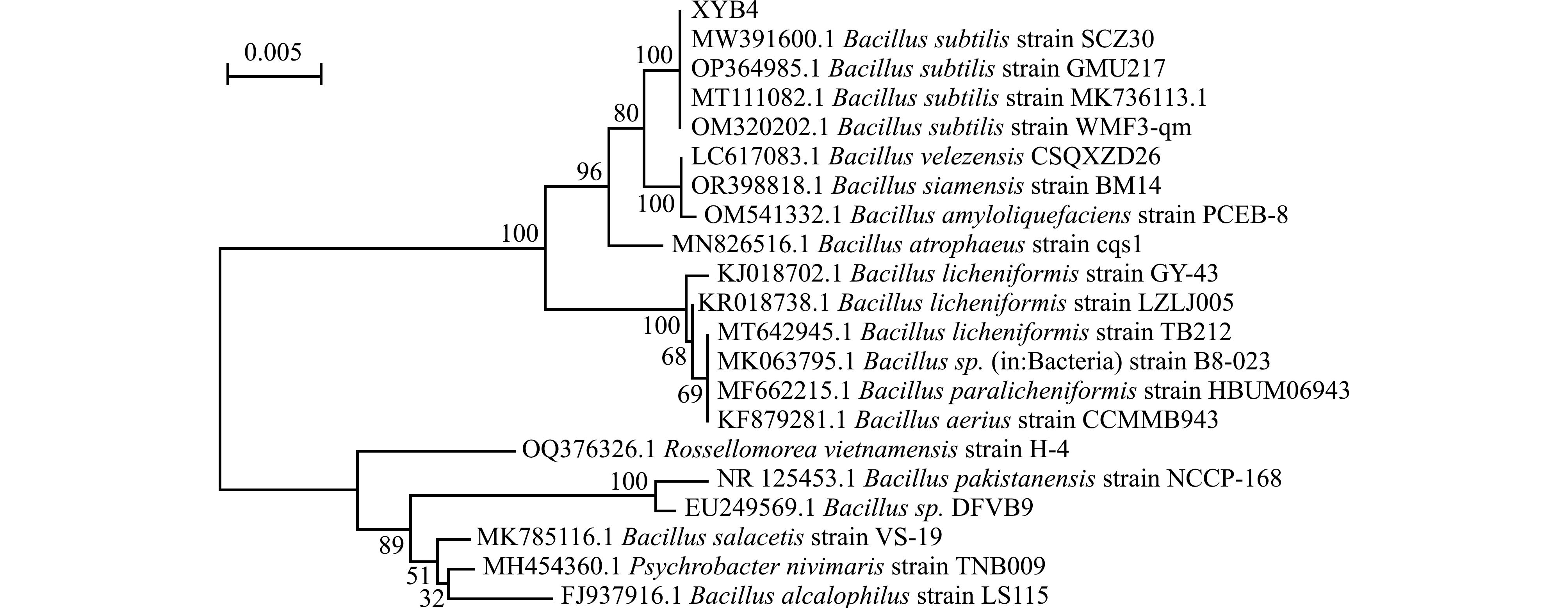
图2 基于16S rDNA序列构建的菌株XYB4系统发育树
Fig.2 Phylogenetic tree of strain XYB4 based on 16S rDNA sequence
2.3.1 LD50浸泡感染试验结果 从表2可见,菌株XYB4不同菌液浓度对凡纳滨对虾存活率均达到95%以上,与空白对照组无显著性差异(P>0.05)。菌株XYB4 LD50达到4.89×1028 CFU/mL。菌株XYB4对凡纳滨对虾存活不存在危害性。
表2 菌株XYB4不同菌液浓度对对虾存活率的影响
Tab.2 Effects of different concentrations of strain XYB4 on survival rate of shrimp

各浸泡浓度存活率survivalrateofeachimmersionconcentration/%菌株104CFU/mL105CFU/mL106CFU/mL107CFU/mL108CFU/mL对照组LD50XYB495.56±1.92a95.56±3.85a95.14±1.92a97.57±1.92a97.38±3.85a92.72±1.92a4.89×1028a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
2.3.2 溶血试验 菌落周围无溶血抑菌圈的出现,说明菌株XYB4无溶血能力(图3)。
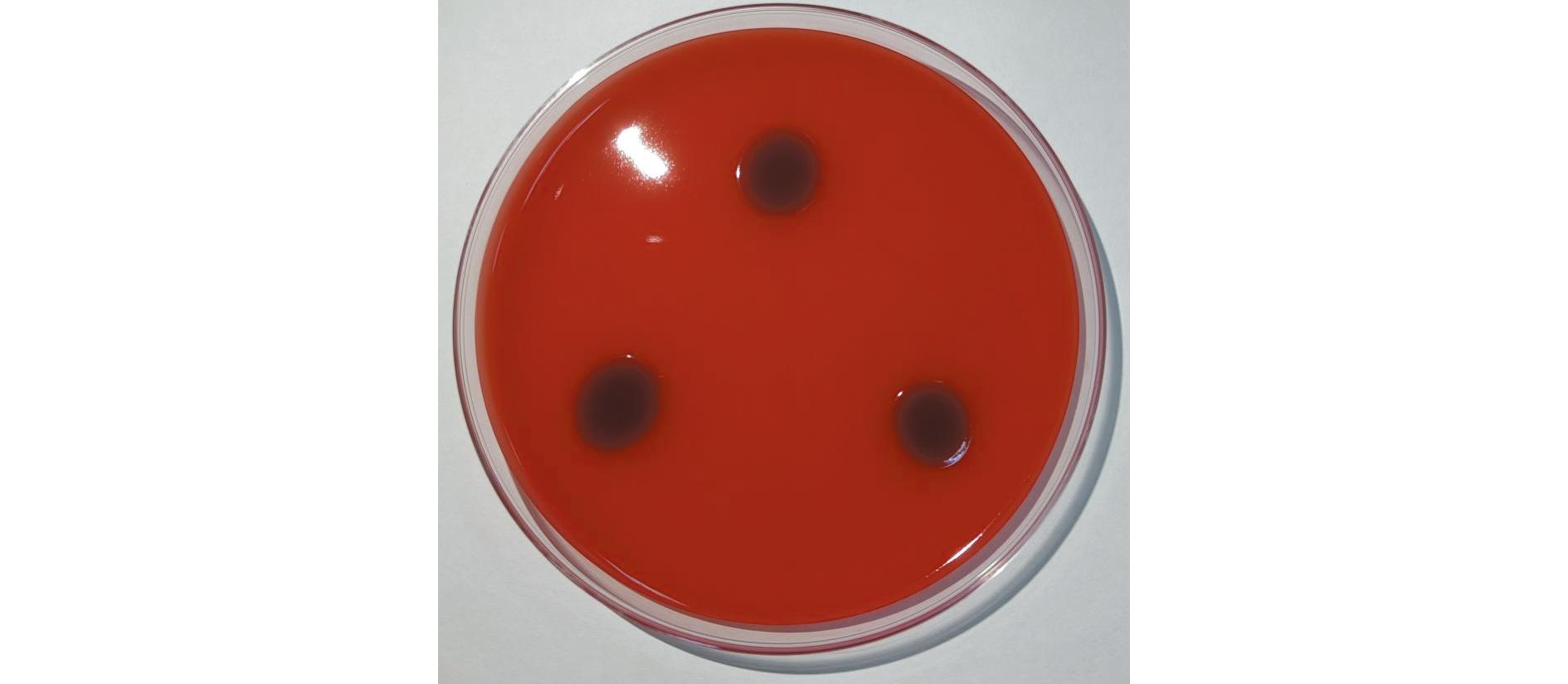
图3 菌株XYB4溶血试验
Fig.3 Hemolysis test results of strain XYB4
2.3.3 药敏试验 测定了菌株XYB4对17种抗菌药物的药物敏感性,从表3可见,菌株XYB4对大部分药物高度敏感,耐药性低。
表3 菌株XYB4的药敏试验
Tab.3 Drug sensitivity test results of strain XYB4
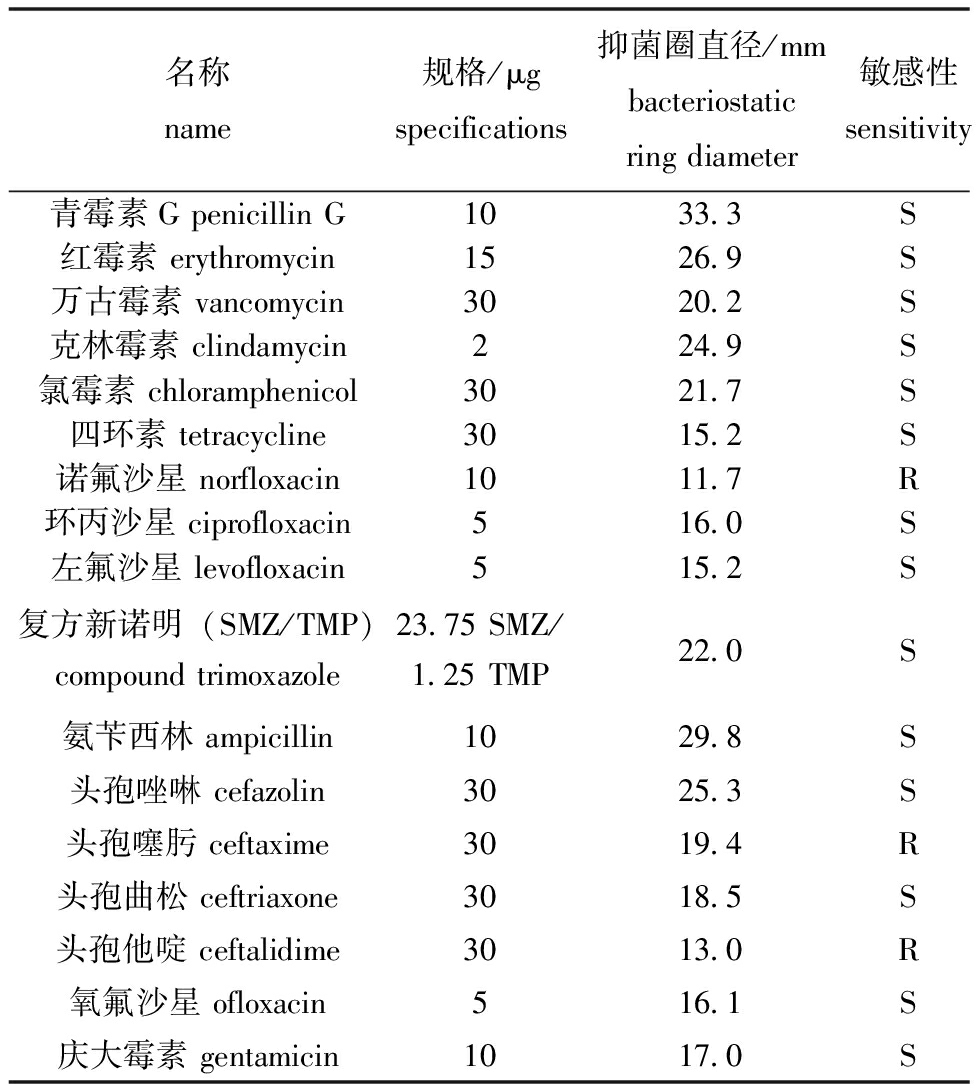
名称name规格/μgspecifications抑菌圈直径/mmbacteriostaticringdiameter敏感性sensitivity青霉素GpenicillinG1033.3S红霉素erythromycin1526.9S万古霉素vancomycin3020.2S克林霉素clindamycin224.9S氯霉素chloramphenicol3021.7S四环素tetracycline3015.2S诺氟沙星norfloxacin1011.7R环丙沙星ciprofloxacin516.0S左氟沙星levofloxacin515.2S复方新诺明(SMZ/TMP)compoundtrimoxazole23.75SMZ/1.25TMP22.0S氨苄西林ampicillin1029.8S头孢唑啉cefazolin3025.3S头孢噻肟ceftaxime3019.4R头孢曲松ceftriaxone3018.5S头孢他啶ceftalidime3013.0R氧氟沙星ofloxacin516.1S庆大霉素gentamicin1017.0S
注:R—耐药;S—敏感。
Note:R—resistant;S—sensitive.
温度变化对菌株XYB4的脱氮效果有显著性影响(P<0.05),菌株XYB4脱氮效率在15 ℃~30 ℃上升,30 ℃~40 ℃下降,说明该菌株培养温度在25 ℃~35 ℃时脱氮效率较好,其中,30 ℃时脱氮效率最高,![]() 和
和![]() 的降解率分别可达到96.11%和85.12%(图4(a))。
的降解率分别可达到96.11%和85.12%(图4(a))。
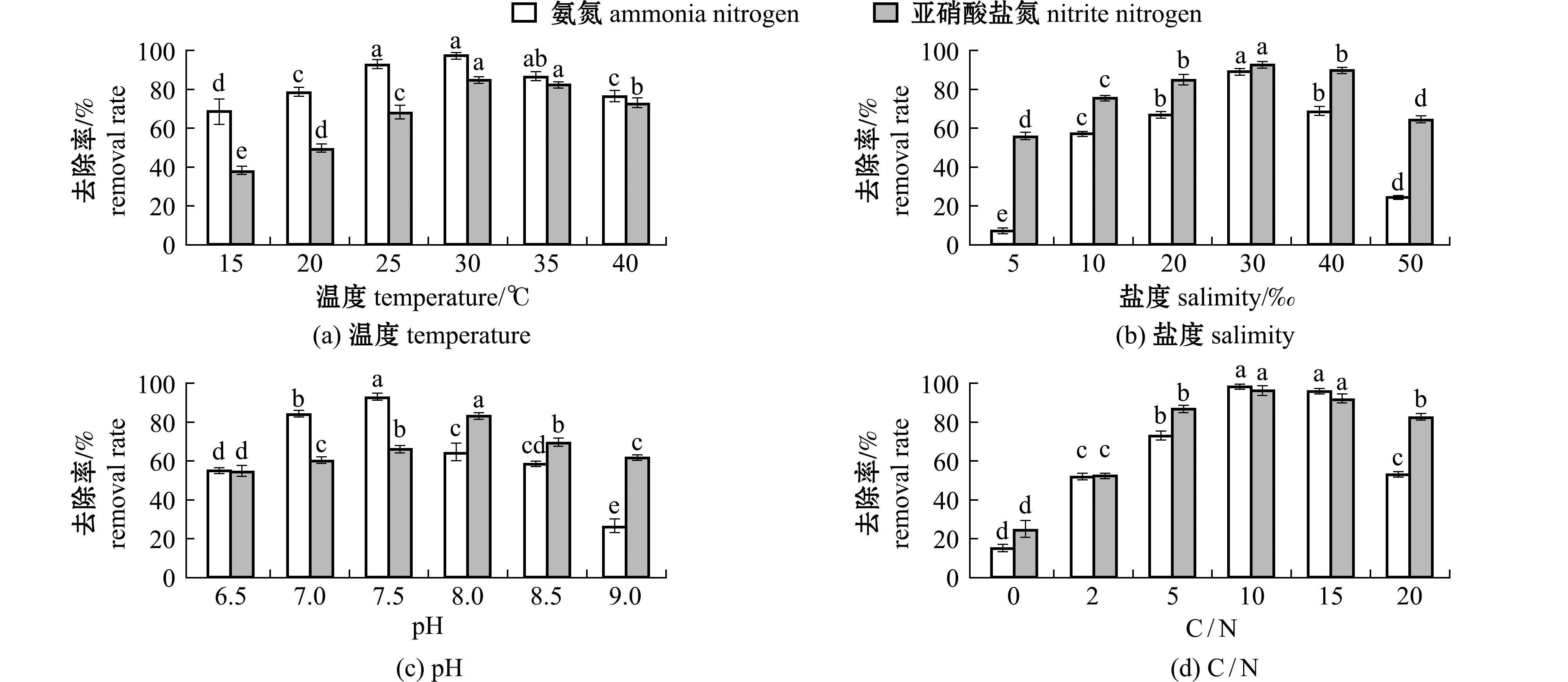
图4 不同理化因子下菌株XYB4对![]() 和
和![]() 降解率的影响
降解率的影响
Fig.4 Effects of strain XYB4 on degradation rates of ![]() under different physicochemical factors
under different physicochemical factors
盐度对菌株XYB4脱氮效果有显著性影响(P<0.05),XYB4脱氮效率在盐度5~30范围内上升,在盐度30~50范围内下降,盐度在30时,![]() 和
和![]() 的脱氮效果均为最高,分别为85.99%和91.01%(图4(b))。
的脱氮效果均为最高,分别为85.99%和91.01%(图4(b))。
pH变化对![]() 脱除率影响较大,对
脱除率影响较大,对![]() 脱除率影响较小,降氮效果相对稳定。pH为7.5时,
脱除率影响较小,降氮效果相对稳定。pH为7.5时,![]() 的脱氮率最高为91.82%;pH为8.0时,
的脱氮率最高为91.82%;pH为8.0时,![]() 的脱氮率最高为82.50%(图4(c))。
的脱氮率最高为82.50%(图4(c))。
C/N对菌株XYB4的脱氮效果有显著性影响(P<0.05),C/N为0~10时,菌株XYB4的脱氮能力呈上升趋势,C/N达到10时,菌株XYB4脱氮效果最好,![]() 和
和![]() 的降解率分别为98.02%和94.06%。当C/N大于10时,菌株XYB4的脱氮能力随C/N的升高而降低(图4(d))。
的降解率分别为98.02%和94.06%。当C/N大于10时,菌株XYB4的脱氮能力随C/N的升高而降低(图4(d))。
最终得出XYB4脱氮效果最优的环境条件为盐度30,温度30 ℃,pH 7.5,C/N 10~15。
2.5.1 水质指标变化趋势 菌株XYB4在养殖后期能有效降低![]() 含量。从图5可见,试验组
含量。从图5可见,试验组![]() 含量显著低于对照组(P<0.05);0~12 d,3组的
含量显著低于对照组(P<0.05);0~12 d,3组的![]() 含量均呈上升趋势,P7上升最快;13~44 d,3组
含量均呈上升趋势,P7上升最快;13~44 d,3组![]() 含量均较为平稳,组间无显著性差异(P>0.05);45~61 d,DZ组
含量均较为平稳,组间无显著性差异(P>0.05);45~61 d,DZ组![]() 含量升高,最高达0.438 mg/L,而试验组
含量升高,最高达0.438 mg/L,而试验组![]() 含量仍维持在0.060 mg/L以下(图5(a))。DZ、B7和P7组
含量仍维持在0.060 mg/L以下(图5(a))。DZ、B7和P7组![]() 最终含量分别为9.748、0.013、0.005 mg/L,试验组和对照组间具有显著性差异(P<0.05),说明菌株能有效降解
最终含量分别为9.748、0.013、0.005 mg/L,试验组和对照组间具有显著性差异(P<0.05),说明菌株能有效降解![]() ;0~24 d时,3组
;0~24 d时,3组![]() 含量均呈上升趋势,其中P7组
含量均呈上升趋势,其中P7组![]() 最高,达14.127 mg/L;试验组
最高,达14.127 mg/L;试验组![]() 含量持续下降,最后降至0.01 mg/L;DZ组在66 d时降至最低,后续
含量持续下降,最后降至0.01 mg/L;DZ组在66 d时降至最低,后续![]() 含量升高至9.748 mg/L(图5(b))。DZ、B7和P7组
含量升高至9.748 mg/L(图5(b))。DZ、B7和P7组![]() 含量最终结果无显著性差异(P>0.05)(图5(c))。
含量最终结果无显著性差异(P>0.05)(图5(c))。
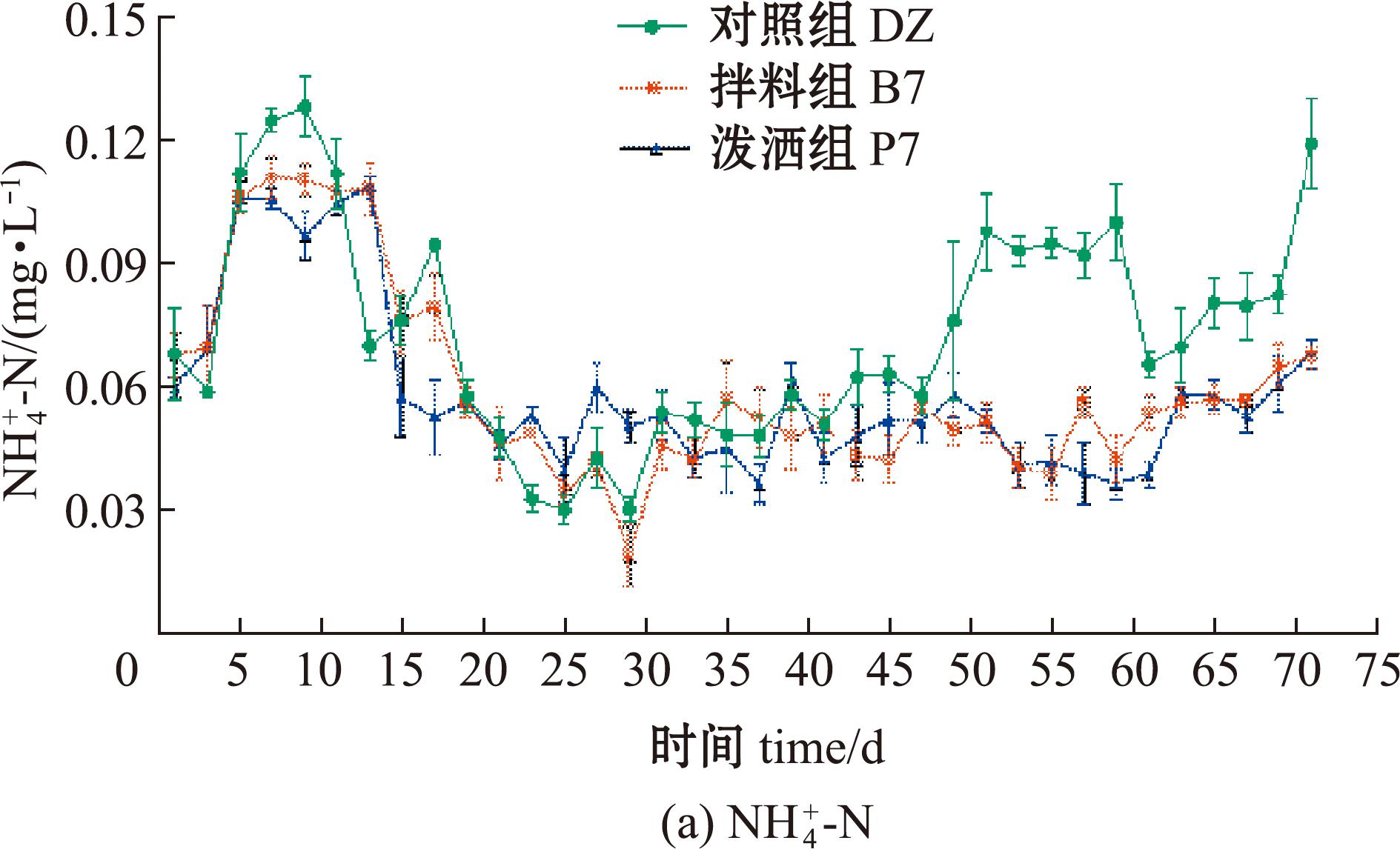
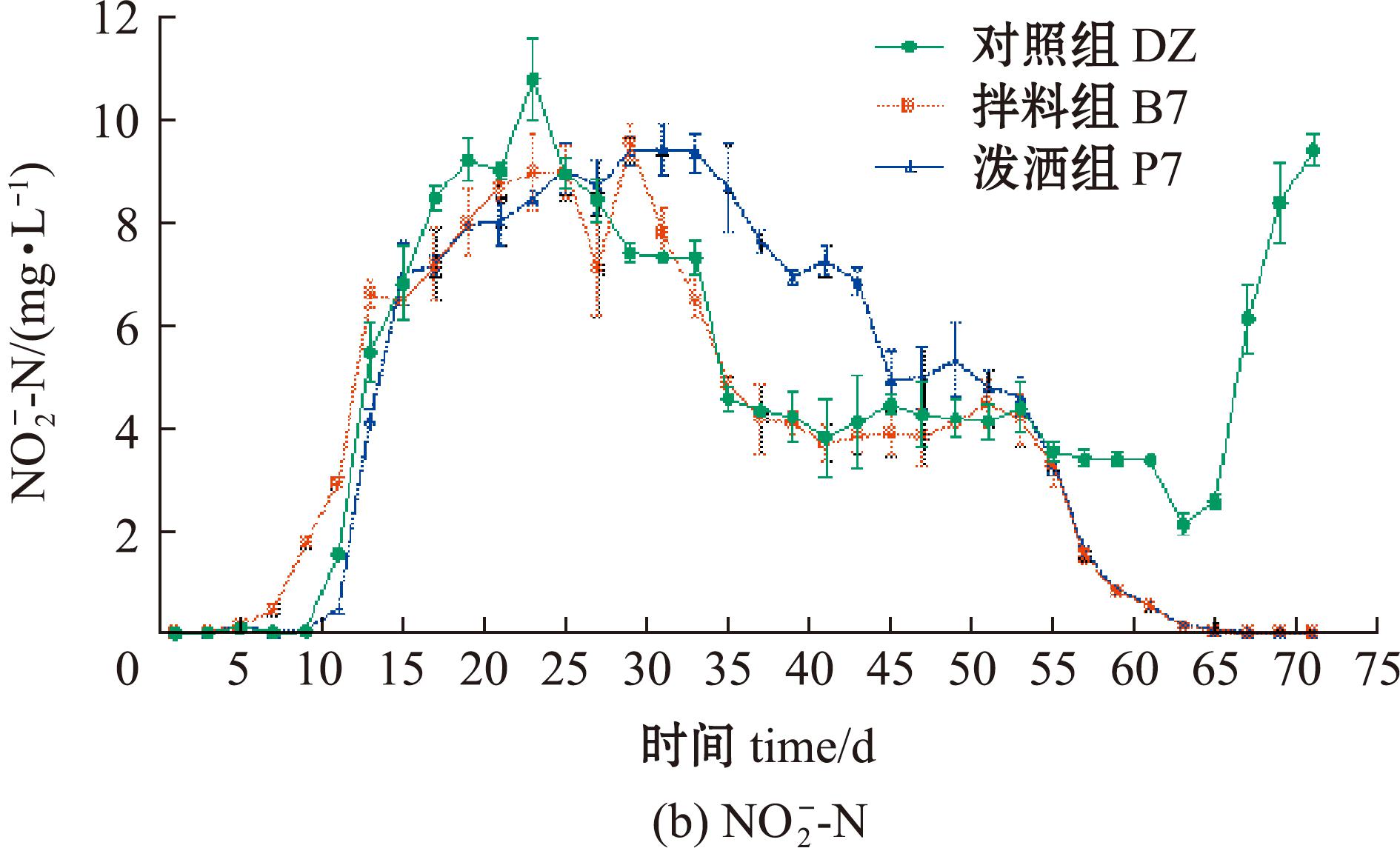
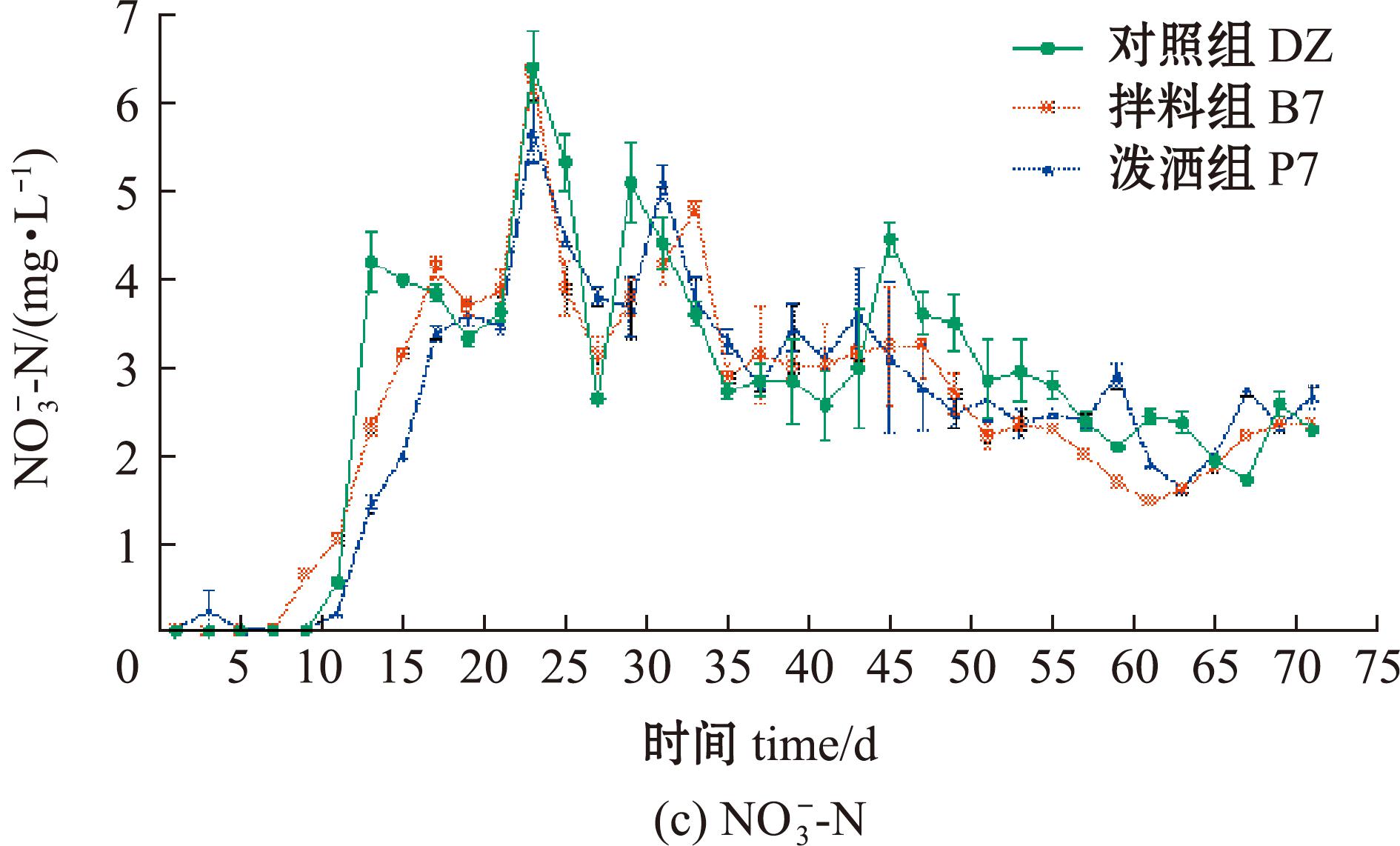
图5 菌株XYB4对养殖水体中三态氮含量的影响
Fig.5 Effect of strain XYB4 on the content of tri-state nitrogen in culture water
2.5.2 凡纳滨对虾生长指标 B7组与P7组的凡纳滨对虾体长增长率分别为31.36%、30.16%,体质量增长率分别为62.12%、62.24%,均显著高于DZ组(P<0.05),3组凡纳滨对虾存活率无显著性差异(P>0.05)(表4)。
表4 各组凡纳滨对虾生长性能测定
Tab.4 Measurement results of growth performance of Litopenaeus vannamei in different groups
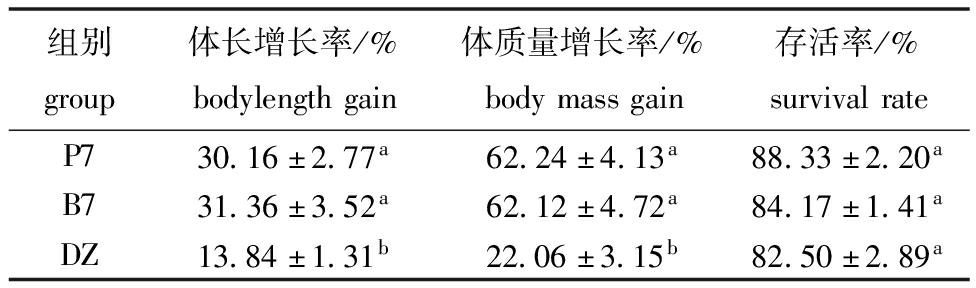
组别group体长增长率/%bodylengthgain体质量增长率/%bodymassgain存活率/%survivalrateP730.16±2.77a62.24±4.13a88.33±2.20aB731.36±3.52a62.12±4.72a84.17±1.41aDZ13.84±1.31b22.06±3.15b82.50±2.89a
所有样品的有效OTU数为388~735个。3个试验组在水体微生物区系中共有315个OUTs,拌料组(WB7)中独特的OTUs最高(图6(a))。凡纳滨对虾肠道菌群OTUs总数为795个,3组间共有189个OTUs,IB7、IP7和IDZ组特有的OUTs分别为90、116、196个(图6(b))。
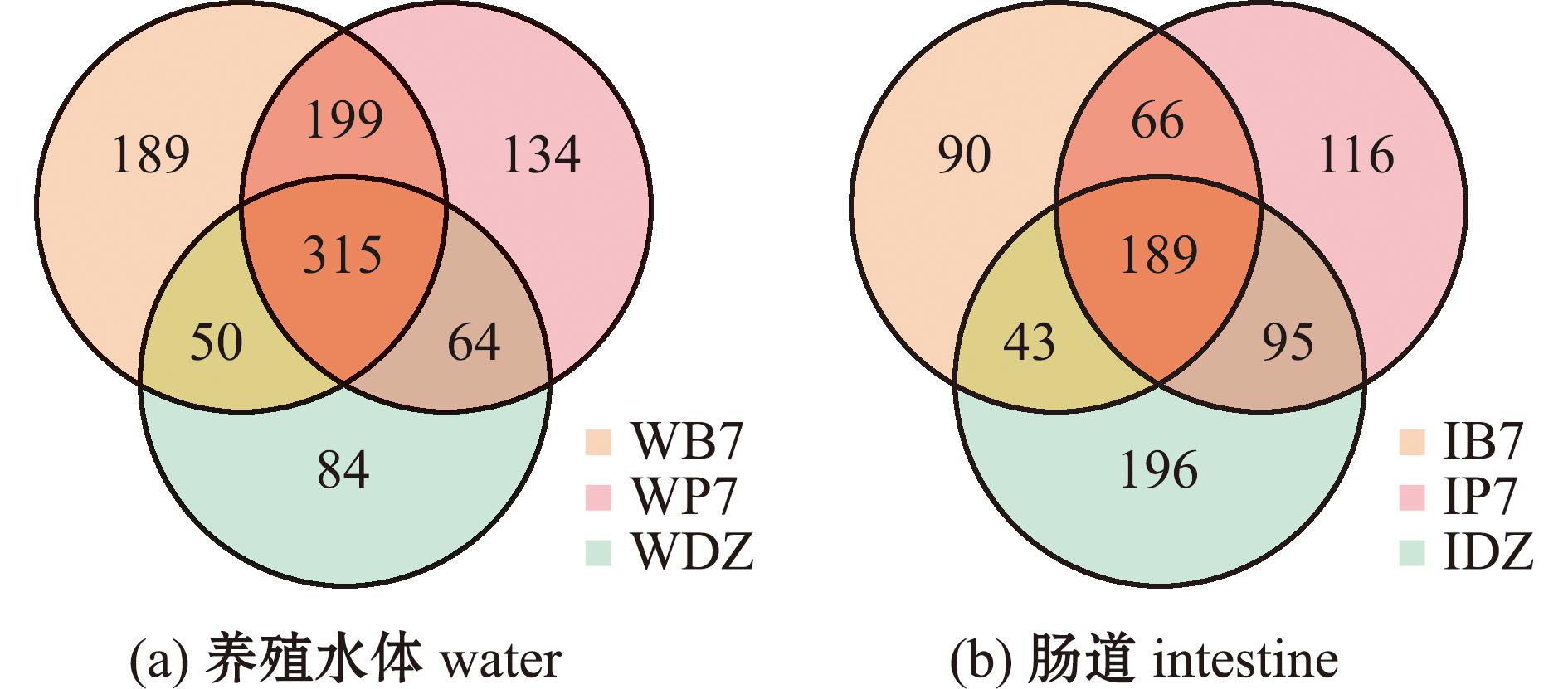
图6 各组养殖水体和肠道微生物分类venn图
Fig.6 Venn diagram of microorganism classification in water and intestine of each group
对水体菌群和凡纳滨对虾肠道的Alpha指数进行分析,对于水体菌群,试验组Chao1、Ace、Shannon和Simpson指数显著高于对照组(P<0.05),说明养殖水体菌群丰富度和多样性显著提高(P<0.05);对于肠道菌群,各组Chao1、Ace、Shannon和Simpson指数无显著性差异(表5)。
表5 对虾肠道和水体菌群Alpha指数
Tab.5 Alpha index of intestinal flora and water body of shrimp
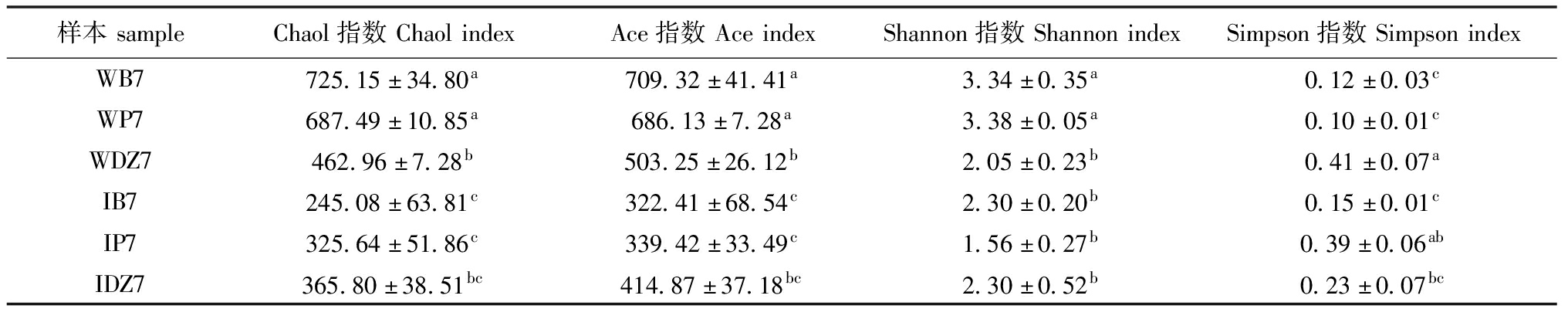
样本sampleChaol指数ChaolindexAce指数AceindexShannon指数ShannonindexSimpson指数SimpsonindexWB7725.15±34.80a709.32±41.41a3.34±0.35a0.12±0.03cWP7687.49±10.85a686.13±7.28a3.38±0.05a0.10±0.01cWDZ7462.96±7.28b503.25±26.12b2.05±0.23b0.41±0.07aIB7245.08±63.81c322.41±68.54c2.30±0.20b0.15±0.01cIP7325.64±51.86c339.42±33.49c1.56±0.27b0.39±0.06abIDZ7365.80±38.51bc414.87±37.18bc2.30±0.52b0.23±0.07bc
凡纳滨对虾水体微生物区系中有21门,其中变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)为优势门。变形菌门(57.53%~76.33%)为数量最丰富的门,但各组间无显著性差异(P>0.05)。两个试验组均出现了对照组没有的硝化螺旋菌门(Nitrospirae)(图7(a))。属水平下,与DZ组相比,试验组中多种病原菌丰度下降,如分枝杆菌属(Mycobacterium)丰度显著下降(P<0.05),沃雷氏菌属(Olleya)丰度下降(P>0.05),3组弧菌(Vibrio)丰度无显著性差异(P>0.05)(图7(b))。
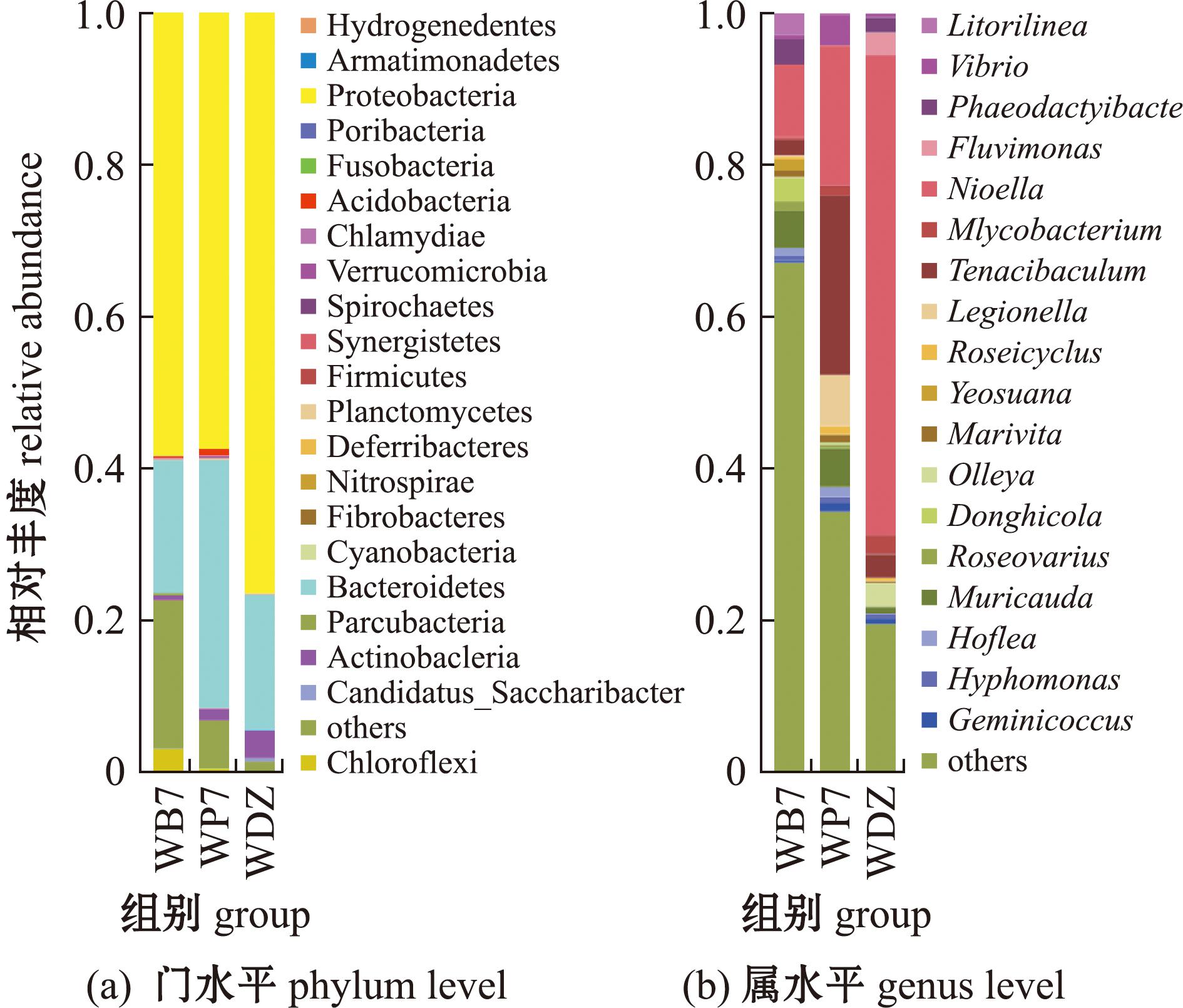
图7 水体菌群在门和属水平的物种丰度柱状图
Fig.7 Composition of water flora at phylum and genus levels
凡纳滨对虾肠道微生物区系中有23门,主要菌门为变形菌门、拟杆菌门和厚壁菌门(Firmicutes)(图8(a))。属水平下,3组弧菌数量无显著性差异(P>0.05),B7组中具有致病性的发光杆菌属(Photobacterium)丰度显著下降(P<0.05),试验组中黏着杆菌属(Tenacibaculum)丰度下降(P>0.05)(图8(b))。
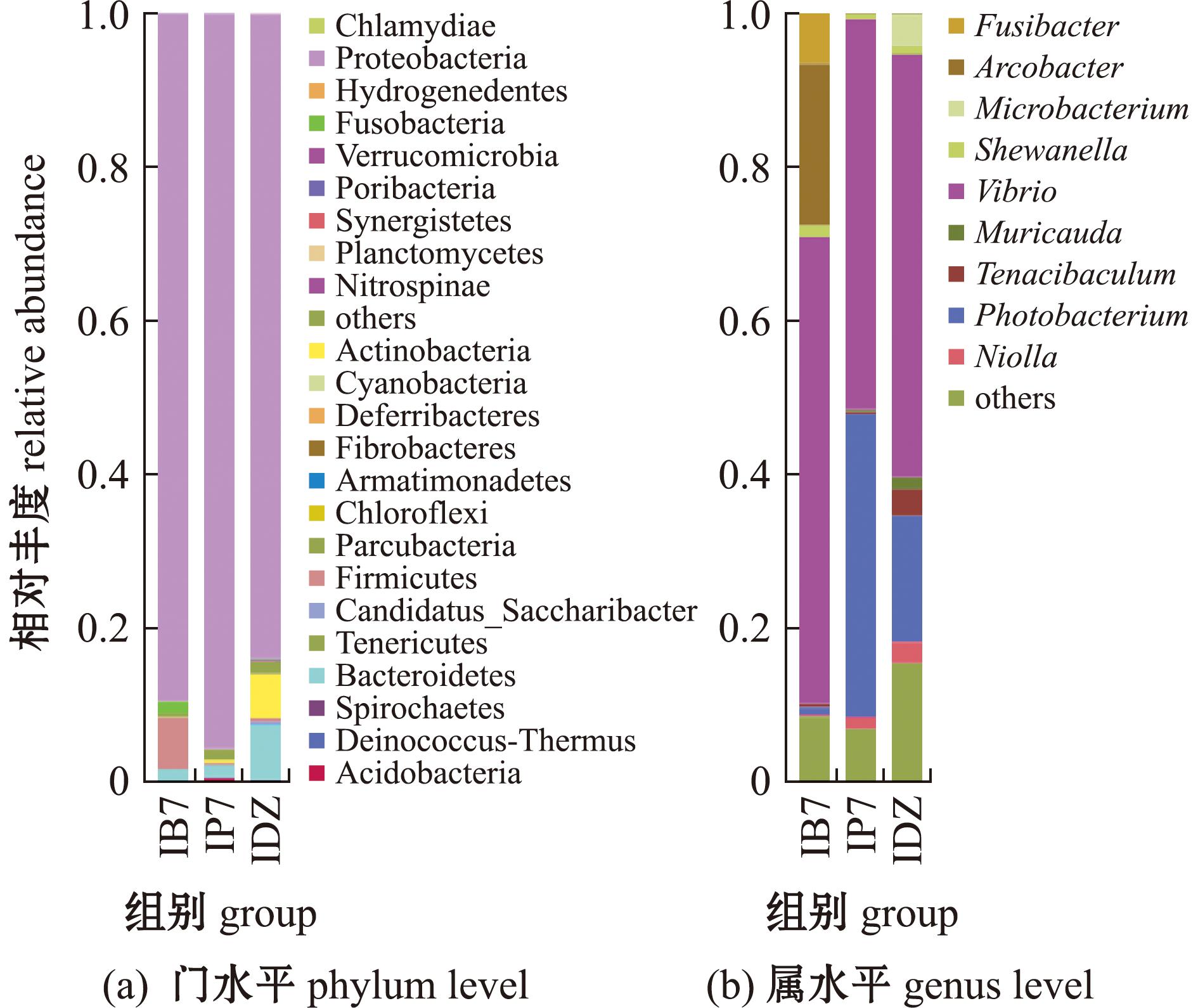
图8 对虾肠道菌群在门和属水平的物种丰度柱状图
Fig.8 Composition of intestinal flora of shrimp at phylum and genus levels
水产养殖水体中过量的氨氮和亚硝酸盐氮不仅会引起水体中藻类和其他微生物大量繁殖,造成水体富营养化,严重时会对养殖生物产生毒害作用,限制了水产养殖业可持续发展。研究表明,长时间氨氮胁迫会造成凡纳滨对虾鳃和肝胰腺损伤[20]。因此,如何有效降解养殖水体中氨氮和亚硝酸盐含量逐渐成为研究关注的焦点。微生物脱氮以无污染、高效率等优点被认为是去除水体中氮素的有效途径。目前,有关脱氮菌类型有较多报道,如枯草芽孢杆菌、地衣芽孢杆菌(Bacillus licheniformis)、泛养硫球菌(Thiosphaera pantotropha)和假单胞菌(Pseudomonas sp.)等,但各菌株的降氮能力均存在较大差异,某些脱氮菌可能引发水产动物疾病[21-23],因此分离出的菌株运用于养殖生产前,需进行安全性评估。此外,从养殖环境下分离出的益生菌会表现出较高的适应性,能快速成为优势菌群,具有更好的益生作用[19,24-25]。本研究中对对虾生物絮团养殖池塘水体中的脱氮菌进行富集、分离和初步筛选,最终得到了一株具有高效脱氮效果的氮代谢功能菌XYB4,经生理生化及分子生物学鉴定,确定该菌为枯草芽孢杆菌,对分离菌依次进行了溶血试验、药敏试验和LD50浸泡试验,证实菌株XYB4无溶血能力、耐药性低,对凡纳滨对虾的存活无危害性。然而不同养殖品种对菌的耐受能力不同,因此除凡纳滨对虾外,菌株XYB4对其他养殖种类是否具有危害性还需进一步研究。
与复杂多变的实际养殖环境情况不同,在实验室筛选的脱氮菌株具有理想状态的生长条件,存在在新的环境难以生长和脱氮不佳等问题[15]。大量研究表明,芽孢杆菌的使用效果与温度、盐度和pH等因素密切相关[26],为了在最大程度上提高菌株XYB4的脱氮效果,本试验中通过观察不同条件对分离菌脱氮效果的影响,发现温度、盐度、pH和C/N都会显著影响菌株XYB4的脱氮效果。盐度和pH变化对![]() 的脱除效果影响较大,对
的脱除效果影响较大,对![]() 的脱除效果影响较小。最终得出菌株XYB4脱氮效果的最佳条件为盐度30,温度30 ℃,pH 7.5,C/N 10~15。
的脱除效果影响较小。最终得出菌株XYB4脱氮效果的最佳条件为盐度30,温度30 ℃,pH 7.5,C/N 10~15。
养殖水质的优劣是养殖成功与否的关键,水体中氨氮、亚硝酸盐氮和硝酸盐氮含量水平是水质衡量的重要指标,当水体中氨氮超过对虾耐受限度时,会影响对虾的正常生理功能,导致对虾抗病性下降[27]。益生菌虽然能净化水质,但存在特定菌株只能降解特定有害物质的现象。本试验结果表明,菌株XYB4对养殖水体中亚硝酸盐氮的降解效果最佳,这是因为芽孢杆菌对小分子有机物的分解有限,同化氨氮的能力较弱,而光合细菌对氨氮具有较好的降解效果,但对水中亚硝酸盐氮降解效果不佳[28-29]。目前,为了更好地发挥微生物制剂的作用,在养殖生产中往往使用复合微生物制剂,从而达到全面调节水质的效果,本试验中筛选分离出的菌株XYB4具备良好的净水能力,可作为水产养殖微生物制剂的候选菌株,关于该菌株与其他益生菌配合使用的效果还有待进一步研究。
动物肠道内微生物种类繁多,群落结构复杂[30]。添加枯草芽孢杆菌能促进对虾生长和提高饵料利用率[31]。本试验结果表明,施用菌株XYB4能显著提高水体菌群丰富度和多样性(P<0.05),同时促使有益菌出现,如试验组中均出现了对照组没有的硝化螺旋菌门;此外,施用菌株XYB4能显著提高肠道菌群相似性和丰富度(P<0.05),且发光杆菌属和黏着杆菌属等有害菌丰度下降,同时出现具有反硝化作用的Fusibacter,这与Daniels等[32]和Luis-Villase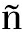 or等[33]的发现相同。综上所述,菌株XYB4能够抑制凡纳滨对虾肠道部分的有害微生物种群,在一定程度上提高了来自养殖环境中有益微生物物种的流入,增加了细菌群落的分化。
or等[33]的发现相同。综上所述,菌株XYB4能够抑制凡纳滨对虾肠道部分的有害微生物种群,在一定程度上提高了来自养殖环境中有益微生物物种的流入,增加了细菌群落的分化。
1)从对虾生物絮团养殖池分离出一株具有高效脱氮功能的菌株,并从形态学观察、生理生化鉴定、分子生物学鉴定,判定该菌为枯草芽孢杆菌(命名为“XYB4”)。通过评估菌株XYB4安全性,发现XYB4对凡纳滨对虾存活率不存在危害,且对大部分药物高度敏感,耐药性低,能够应用于水产养殖业中。
2)通过改变盐度、温度、pH和C/N,探究理化因子对菌株脱氮能力的影响,得出菌株XYB4脱氮效果的最佳条件为盐度30,温度30 ℃,pH 7.5,C/N 10~15,该结果与对虾养殖的最适理化因子范围基本一致,说明菌株XYB4在实际养殖生产过程中也能发挥理想效果,具有较高的研究潜力。
3)将菌株XYB4作为微生物制剂运用于凡纳滨对虾养殖过程中,无论拌料投喂还是直接泼洒,菌株XYB4都能有效降解养殖水体中的![]() 和
和![]() ,具有出色的水质调控能力。
,具有出色的水质调控能力。
4)施用菌株XYB4,能显著提高水体和肠道菌群丰富度,能够抑制凡纳滨对虾肠道部分有害微生物种群,在一定程度上提高了来自养殖环境中有益微生物物种的流入,在养殖生产中具有较高的应用价值。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2023中国渔业统计年鉴[M].北京:中国农业出版社,2023.Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2023 China fishery statistical yearbook[M].Beijing:China Agriculture Press,2023.(in Chinese)
[2] TOVAR A,MORENO C,M NUEL-VEZ M P,et al.Environmental impacts of intensive aquaculture in marine waters[J].Water Research,2000,34(1):334-342.
NUEL-VEZ M P,et al.Environmental impacts of intensive aquaculture in marine waters[J].Water Research,2000,34(1):334-342.
[3] WANG T,LI W H,SHAN H W,et al.Responses of energy homeostasis and lipid metabolism in Penaeus vannamei exposed to ammonia stress[J].Aquaculture,2021,544:737092.
[4] 李忠帅,马甡,单洪伟,等.亚硝态氮胁迫下凡纳滨对虾体内亚硝态氮的积累与能量代谢响应[J].水产学报,2021,45(11):1825-1834.LI Z S,MA S,SHAN H W,et al.Accumulation of nitrite and responses of energy metabolism exposed to nitrite stress in Litopenaeus vannamei[J].Journal of Fisheries of China,2021,45(11):1825-1834.(in Chinese)
[5] HURA M U D,ZAFAR T,Borana K,et al.Effect of commercial probiotic Bacillus megaterium on water quality in composite culture of major carps[J].International Journal of Current Agricultural Sciences,2018,8(1):268-273.
[6] VERSCHUERE L,ROMBAUT G,SORGELOOS P,et al.Probiotic bacteria as biological control agents in aquaculture[J].Microbiology and Molecular Biology Reviews:MMBR,2000,64(4):655-671.
[7] YAN J,LI Y,LIANG X,et al.Effects of dietary protein and lipid levels on growth performance,fatty acid composition and antioxidant‐related gene expressions in juvenile loach Misgurnus anguillicaudatus[J].Aquaculture research,2017,48(10):5385-5393.
[8] EL-SAADONY M T,ALAGAWANY M,PATRA A K,et al.The functionality of probiotics in aquaculture:an overview[J].Fish &Shellfish Immunology,2021,117:36-52.
[9] BALCAZAR J,BLAS I,RUIZZARZUELA I,et al.The role of probiotics in aquaculture[J].Veterinary Microbiology,2006,114(3/4):173-186.
[10] KESARCODI-WATSON A,KASPAR H,LATEGAN M J,et al.Probiotics in aquaculture:the need,principles and mechanisms of action and screening processes[J].Aquaculture,2008,274(1):1-14.
[11] MORIARTY D J W.Control of luminous Vibrio species in penaeid aquaculture ponds[J].Aquaculture,1998,164(1/2/3/4):351-358.
[12] KUYPERS M M M,MARCHANT H K,KARTAL B.The microbial nitrogen-cycling network[J].Nature Reviews Microbiology,2018,16(5):263-276.
[13] ETTWIG K F,BUTLER M K,LE PASLIER D,et al.Nitrite-driven anaerobic methane oxidation by oxygenic bacteria[J].Nature,2010,464(7288):543-548.
[14] KARTAL B,MAALCKE W J,DE ALMEIDA N M,et al.Molecular mechanism of anaerobic ammonium oxidation[J].Nature,2011,479(7371):127-130.
[15] HLORDZI V,KUEBUTORNYE F K A,AFRIYIE G,et al.The use of Bacillus species in maintenance of water quality in aquaculture:a review[J].Aquaculture Reports,2020,18:100503.
[16] LAZADO C C,CAIPANG C M A,ESTANTE E G.Prospects of host-associated microorganisms in fish and penaeids as probiotics with immunomodulatory functions[J].Fish &Shellfish Immunology,2015,45(1):2-12.
[17] 布坎南,吉本斯.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984.BU K N,JI B S.Bergey’s manual of determinative bacteriology[M].8th ed.Beijing:Science Press,1984.(in Chinese)
[18] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.DONG X Z,CAI M Y.Handbook of identification of common bacterial systems[M].Beijing:Science Press,2001.(in Chinese)
[19] HALL B G.Building phylogenetic trees from molecular data with MEGA[J].Molecular Biology and Evolution,2013,30(5):1229-1235.
[20] 顾楠.氨氮胁迫对凡纳滨对虾生长、生理指标、鳃和肝胰腺显微结构和相关基因表达的影响[D].上海:上海海洋大学,2020.GU N.Effects of ammonia nitrogen stress on growth,physiological indexes,gill and hepatopancreas microstructure and related gene expression of Litopenaeus vannamei[D].Shanghai:Shanghai Ocean University,2020.(in Chinese)
[21] GUPTA S.Quantitative estimation of Thiosphaera pantotropha from aerobic mixed culture[J].Water Research,2000,34(15):3765-3768.
[22] 黄志坚,陈勇贵,翁少萍,等.多种细菌与凡纳滨对虾肝胰腺坏死症(HPNS)爆发有关[J].中山大学学报(自然科学版),2016,55(1):1-11.HUANG Z J,CHEN Y G,WENG S P,et al.Multiple bacteria species were involved in hepatopancreas necrosis syndrome (HPNS) of Litopenaeus vannamei[J].Acta Scientiarum Naturalium Universitatis Sunyatseni(Natural Science Edition),2016,55(1):1-11.(in Chinese)
[23] 徐振权,韩国威,任静,等.凡纳滨对虾肠道中地衣芽孢杆菌的分离鉴定及其生物学特性[J].大连海洋大学学报,2024,39(1):74-82.XU Z Q,HAN G W,REN J,et al.Isolation,identification and biological characteristics of Bacillus licheniformis from the intestine of Pacific white leg shrimp (Litopenaeus vannamei)[J].Journal of Dalian Ocean University,2024,39(1):74-82.(in Chinese)
[24] NINAWE A S,SELVIN J.Probiotics in shrimp aquaculture:avenues and challenges[J].Critical Reviews in Microbiology,2009,35(1):43-66.
[25] SHARIFUZZAMAN S M,AUSTIN B.Influence of probiotic feeding duration on disease resistance and immune parameters in rainbow trout[J].Fish &Shellfish Immunology,2009,27(3):440-445.
[26] GUEIMONDE M,S NCHEZ B,DE LOS REYES-GAVIL
NCHEZ B,DE LOS REYES-GAVIL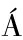 N C G,et al.Antibiotic resistance in probiotic bacteria[J].Frontiers in Microbiology,2013,4:202.
N C G,et al.Antibiotic resistance in probiotic bacteria[J].Frontiers in Microbiology,2013,4:202.
[27] ZHOU X X,WANG Y B,LI W F.Effect of probiotic on larvae shrimp (Penaeus vannamei) based on water quality,survival rate and digestive enzyme activities[J].Aquaculture,2009,287(3/4):349-353.
[28] 王彦波,邓岳松.微生态制剂对虾池水质影响的研究[J].水利渔业,2003,23(2):16-17.WANG Y B,DENG Y S.Effect of microecological preparation on water quatily of culture shrimp in pond[J].Journal of Hydroecology,2003,23(2):16-17.(in Chinese)
[29] 谢航.水产养殖功能微生物的筛选与多菌种混合培养条件的研究[D].福州:福州大学,2005.XIE H.Screening of functional microorganisms in aquaculture and study on mixed culture conditions of multiple strains[D].Fuzhou:Fuzhou University,2005.(in Chinese)
[30] LUIS-VILLASE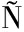 OR I E,CASTELLANOS-CERVANTES T,GOMEZ-GIL B,et al.Probiotics in the intestinal tract of juvenile whiteleg shrimp (Litopenaeus vannamei):modulation of the bacterial community[J].World Journal of Microbiology &Biotechnology,2013,29(2):257-265.
OR I E,CASTELLANOS-CERVANTES T,GOMEZ-GIL B,et al.Probiotics in the intestinal tract of juvenile whiteleg shrimp (Litopenaeus vannamei):modulation of the bacterial community[J].World Journal of Microbiology &Biotechnology,2013,29(2):257-265.
[31] WU Z X,FENG X,XIE L L,et al.Effect of probiotic Bacillus subtilis Ch9 for grass carp,Ctenopharyngodon idella(Valenciennes,1844),on growth performance,digestive enzyme activities and intestinal microflora[J].Journal of Applied Ichthyology,2012,28(5):721-727.
[32] DANIELS C L,MERRIFIELD D L,BOOTHROYD D P,et al.Effect of dietary Bacillus spp.and mannan oligosaccharides (MOS) on European lobster (Homarus gammarus L.) larvae growth performance,gut morphology and gut microbiota[J].Aquaculture,2010,304(1/2/3/4):49-57.
[33] LUIS-VILLASE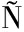 OR I E,MAC
OR I E,MAC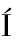 AS-RODR
AS-RODR GUEZ M E,G
GUEZ M E,G MEZ-GIL B,et al.Beneficial effects of four Bacillus strains on the larval cultivation of Litopenaeus vannamei[J].Aquaculture,2011,321(1/2):136-144.
MEZ-GIL B,et al.Beneficial effects of four Bacillus strains on the larval cultivation of Litopenaeus vannamei[J].Aquaculture,2011,321(1/2):136-144.