据世界卫生组织数据统计,目前全世界亚健康人口总占比高达75%,中国亚健康人数占中国总人口70%[1]。因此,增强机体免疫力具有十分重要的意义。有研究表明,食源性蛋白水解物通过提高或者降低炎症因子的分泌效果,刺激免疫脏器细胞的吞噬能力,增强巨噬细胞和NK细胞的活性,进而调节机体免疫应答作用[2-4]。
目前,海洋生物由于蛋白质含量较高,已成为免疫活性肽研究的重要来源。据报道,红虾头低分子量肽能有效改善小鼠的脾脏和胸腺指数,促进血清细胞因子和免疫球蛋白的产生,上调脾淋巴细胞和腹腔巨噬细胞的增殖活性,通过促进脾组织中NF-κB和MAPK通路相关蛋白的表达水平可提高小鼠免疫功能[5];海参肽显著提高了小鼠细胞免疫、体液免疫、单核-巨噬细胞吞噬功能及NK细胞活性、并显著提高脾脏CD3+百分比和CD4+百分比[6];日本黄姑鱼多肽能显著提高免疫抑制小鼠的免疫器官指数,增强巨噬细胞的吞噬作用,显著增加免疫球蛋白浓度水平[7]。这些海洋生物来源的活性肽针对调节机体免疫作用具有高效性和专一性,且成本低、安全性高。因此,海洋生物免疫活性肽在食品和保健品行业具有巨大的开发潜力。
双齿围沙蚕(Perinereis aibuhitensis)又名“海蜈蚣”“海蚯蚓”,营养价值较高。沙蚕营养学分析结果表明,沙蚕的粗蛋白质含量高达60%,人体的17种常见氨基酸在总氨基酸中占比高达50%,其中,必需氨基酸含量约占37%,因此,沙蚕属于低脂肪、高蛋白的海洋生物[8]。据《本草纲目》中记载:“沙蚕可全体入药,久服补虚羸,令人光泽,轻身延年不老”[9]。已有研究表明,双齿围沙蚕具有多种生物活性,如抗氧化活性[10]、抗血栓作用[11]、抗肿瘤作用[12]及抗菌作用[13]。朱国萍等[14]研究发现,沙蚕超高压提取物具有较好的DPPH·和·OH自由基清除能力,证实沙蚕超高压物具有抗氧化活性。已有研究表明具有抗氧化功效的活性物质通常具有较好的免疫调节作用,Zeng等[15]研究表明,鲐多肽对DPPH·和·OH自由基具有较强的清除率,证实鲐多肽具有较强的抗氧化活性,鲐多肽也能显著提高小鼠脾淋巴细胞相对增殖率与小鼠单核巨噬细胞RAW 264.7相对增殖率,证实鲐多肽也具有较强的免疫活性。双齿围沙蚕具有较好的抗氧化活性,但其是否具有免疫活性功效未见报道。本研究中通过建立免疫抑制小鼠模型,探讨了双齿围沙蚕酶解产物的体内免疫调节作用,以期丰富双齿围沙蚕免疫功效活性方面的研究,为其在食品、保健品中的开发和利用提供有益参考。
1 材料与方法
1.1 材料
1.1.1试验动物 健康SPF级雄性BALB/c小鼠4周龄,体质量为18~20 g,购自珠海百试通生物科技有限公司[许可证号:SCXK(粤)2020-0051]。动物试验经广东海洋大学实验动物伦理委员会批准许可(伦理委员会批准许可号:GDOU-LAE-2023-011)。试验垫料、饮用水、笼具均经高压灭菌处理,饲料经紫外辐照杀菌处理。[25]
1.1.2 材料与试剂 双齿围沙蚕,购自遂溪腾飞生物科技有限公司;碱性蛋白酶(200 U/mg)购自上海源叶生物科技有限公司;环磷酰胺(Cyclophosphamide,CTX)、17种氨基酸混合标准品(2.5 μmol/mL,sigma)购自上海sigma有限公司;免疫球蛋白(immunoglobulin)IgA、IgM、IgG酶联免疫吸附测定试剂盒、流式染色缓冲液、FITC-CD3e+、APC-CD4+和PE-CD8a+,购自联科生物科技有限公司;BCA蛋白定量试剂盒购自Vazyme Biotech公司;牛血清白蛋白V(BSA-V)购自北京Solarbio科技有限公司;其他试剂均为国产分析纯级。
1.1.3 仪器与设备 LGJ-18冷冻干燥机(河南兄弟仪器有限公司);906GP-80 ℃超低温冰箱、Varioskan LUX全波长扫描式多功能酶标仪(均为美国Thermo公司);IC1000自动细胞计数仪(上海艾力特生物科技有限公司);DF-101T集热式恒温加热磁力搅拌器(上海科升仪器有限公司);FA2004B电子分析天平(上海恒平科学仪器有限公司);JIDI-20D台式高速冷冻离心机(广州吉迪仪器有限公司);Cytoflex全自动流式细胞仪(美国Beckman Coulter公司);LC20-AD高效液相色谱仪(日本岛津公司);L-8080A氨基酸全自动分析仪(日本日立公司)。
1.2 方法
1.2.1双齿围沙蚕酶解产物3种超滤冻干组分的制备 称取一定量的双齿围沙蚕,匀浆后按3 000 U/g 比例加入碱性蛋白酶,料水比为1∶5(g∶g),调节为pH 8.5,进行酶解(50 ℃,7 h),酶解完成后进行灭酶(100 ℃,10 min)。灭酶完成后常温冷却至室温后离心(8 000 r/min,4 ℃,20 min)取上清液。通过超滤、旋蒸浓缩、冷冻干燥沙蚕酶解液获得3种规格相对分子质量(>8 000、5 000~8 000、<5 000)的冻干粉。
1.2.2 双齿围沙蚕酶解产物3种超滤冻干组分的氨基酸组成分析 氨基酸组成的分析参考 GB5009.124—2016《食品安全国家标准 食品中氨基酸的测定》[16]的方法进行测定,采用氨基酸自动分析仪进行测定。
1.2.3 分组与处理 80只 SPF 级雄性 BALB/c 健康小鼠饲养于动物房屏障区,昼夜交替时间为12 h,环境温度为22 ℃±2 ℃,相对湿度为50%~60%,适应性饲养7 d,动物自由饮食。检疫合格后,按体质量随机分为8组,每组10只,分别为空白(CT)组;环磷酰胺模型(MD)组;(<5 000、5 000~8 000、>8 000)-L 组(0.5 g/kg·bw );(<5 000、5 000~8 000、>8 000)-H组(2.0 g/kg·bw)。
分组后,记录小鼠初始体质量,试验中于第7天、第14天、第21天、第30天记录每只小鼠体质量的变化。小鼠的灌胃剂量为0.2 mL/10 g·bw,给予相应样品液,空白组及环磷酰胺模型组给予等量纯净水,每天1次,连续给药30 d。除空白对照组外,其他组小鼠分别在给药的19、21、23、25、27 d进行造模,按0.2 mL/10 g·bw剂量腹腔注射2.5 mg/mL 环磷酰胺药液,空白组按0.2 mL/10 g·bw剂量腹腔注射生理盐水,共注射5次,建立免疫抑制小鼠模型。末次给药24 h后,进行处理及测定相关指标。
1.2.4 免疫脏器指数计算 记录共80只小鼠建模前、建模后及处死前的体质量,处死前一晚对小鼠禁食不禁水。末次给药24 h后,称重,摘取小鼠眼球收集血液,采用颈椎脱臼法处死小鼠,解剖取其脾脏和胸腺,并置于生理盐水中洗净血,用滤纸吸干器官表面水分,清除结缔组织后称量脏器质量。免疫脏器指数(mg/g)的计算公式为
(1)
1.2.5 脾脏 T 淋巴细胞亚群的测定 使用流式细胞术分析脾脏T淋巴细胞。小鼠处死解剖后,摘取脾脏组织,于70 μm的筛网中研磨脾脏,转移至15 mL离心管中,并补加PBS至终体积为10 mL,离心(4 ℃,1 500 r/min,5 min),弃上清,采用2.0 mL的1.0%PBS-BSA重悬细胞沉淀,浓度调整到1×106 cells/mL左右,并取100 μL于新的1.5 mL EP管中。加入1 mL 1.0%PBS-BSA,离心(4 ℃,1 500 r/min,5 min)底部保留约100 μL样品,分别加入5.0 μL FITC-CD3e+、APC-CD4+和PE-CD8a+抗体,充分吹打混匀,在2 ℃~8 ℃避光孵育30 min,加1 mL的染色缓冲液离心(4 ℃,400 g,5 min),弃上清,加入500 μL染色缓冲液重悬,吹打混匀后,采用流式细胞仪检测和分析T淋巴细胞亚群。
1.2.6 小鼠血浆白细胞总数测定 小鼠摘取眼球取血于抗凝管后,加入1.49 mL浓度为4.0%的盐酸溶液和10 μL眼球血混合,摇匀后放置5 min后观察红细胞是否完全破坏,30 min后取20 μL于细胞计数仪中读取白细胞总数。
1.2.7 外周血免疫球蛋白含量测定 小鼠摘取眼球取血于离心管内,室温孵育60 min后,以3 000 r/min离心20 min。仔细收集上清液,根据酶联免疫吸附测定(ELISA)试剂盒的操作说明,测定小鼠血清中IgA、IgG、IgM免疫球蛋白的质量浓度。
1.3 数据处理
采用 IBM SPSS Statistics 27 软件对数据进行单因素方差(ANOVA)分析,试验结果以平均值±标准误(mean±S.E.)表示。显著性水平设为0.05;采用GraphPad Prism 6软件作图。
2 结果与分析
2.1 沙蚕酶解产物超滤冻干组分的得率
通过对沙蚕酶解产物进行8 000和5 000超滤板分离,得到>8 000、5 000~8 000和<5 000这3种沙蚕酶解产物超滤组分进行浓缩、冻干,最终>8 000、5 000~8 000和<5 000的得率分别为14.47%±1.16%、17.87%±0.52%、25.99%±0.86%。
2.2 沙蚕酶解产物超滤冻干组分的氨基酸组成
从表1可见,3种沙蚕酶解产物超滤组分均富含必需氨基酸,含量均为40%以上,符合FAO/WHO提出的质量较好蛋白质理想模式的要求[17]。3种沙蚕酶解产物超滤组分的水解氨基酸主要是谷氨酸、天冬氨酸、赖氨酸、丙氨酸、亮氨酸和精氨酸,游离氨基酸富含谷氨酸、丙氨酸、亮氨酸、赖氨酸和精氨酸。
表1 3种沙蚕酶解产物超滤组分的氨基酸组成
Tab.1 Amino acid compositions of ultrafiltration components of three kinds of enzymolysis products in Perinereis aibuhitensis mg/g
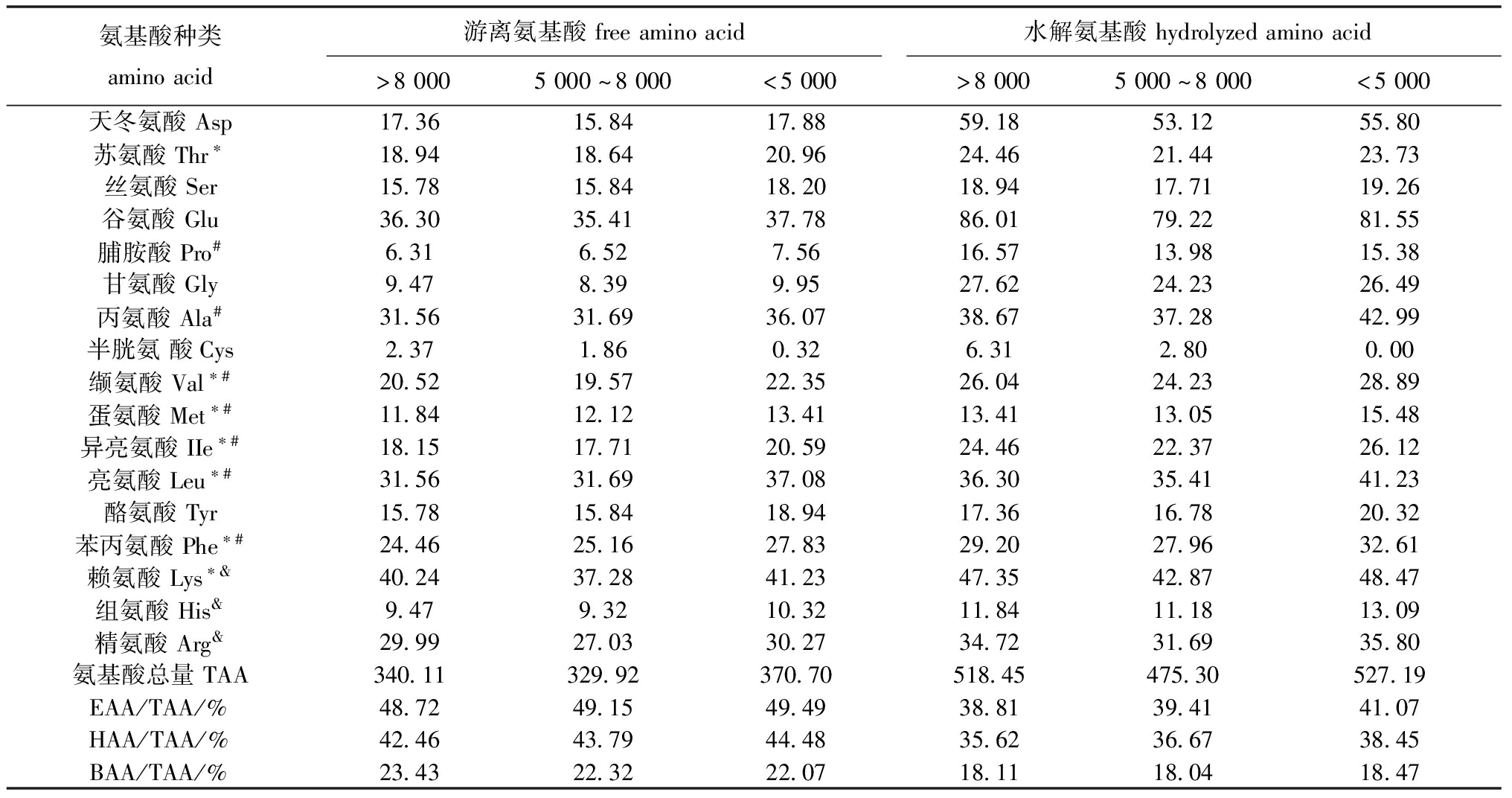
氨基酸种类aminoacid游离氨基酸freeaminoacid水解氨基酸hydrolyzedaminoacid>80005000~8000<5000>80005000~8000<5000天冬氨酸Asp17.3615.8417.8859.1853.1255.80苏氨酸Thr∗18.9418.6420.9624.4621.4423.73丝氨酸Ser15.7815.8418.2018.9417.7119.26谷氨酸Glu36.3035.4137.7886.0179.2281.55脯胺酸Pro#6.316.527.5616.5713.9815.38甘氨酸Gly9.478.399.9527.6224.2326.49丙氨酸Ala#31.5631.6936.0738.6737.2842.99半胱氨酸Cys2.371.860.326.312.800.00缬氨酸Val∗#20.5219.5722.3526.0424.2328.89蛋氨酸Met∗#11.8412.1213.4113.4113.0515.48异亮氨酸IIe∗#18.1517.7120.5924.4622.3726.12亮氨酸Leu∗#31.5631.6937.0836.3035.4141.23酪氨酸Tyr15.7815.8418.9417.3616.7820.32苯丙氨酸Phe∗#24.4625.1627.8329.2027.9632.61赖氨酸Lys∗&40.2437.2841.2347.3542.8748.47组氨酸His&9.479.3210.3211.8411.1813.09精氨酸Arg&29.9927.0330.2734.7231.6935.80氨基酸总量TAA340.11329.92370.70518.45475.30527.19EAA/TAA/%48.7249.1549.4938.8139.4141.07HAA/TAA/%42.4643.7944.4835.6236.6738.45BAA/TAA/%23.4322.3222.0718.1118.0418.47
注:EAA—必需氨基酸;HAA—疏水性氨基酸;BAA—碱性氨基酸。*表示必需氨基酸;#表示疏水性氨基酸;&表示碱性氨基酸。
Note:EAA—essential amino acids;HAA—hydrophobic amino acids;BAA—basic amino acid.* means essential amino acids;# means hydrophobic amino acids;&means basic amino acids.
其中,>8 000、5 000~8 000和<5 000 3种沙蚕酶解产物超滤组分的疏水性氨基酸含量各占总氨基酸的38.33%、39.58%、40.94%,其含量较高;支链氨基酸(亮氨酸、异亮氨酸、缬氨酸)各占总氨基酸的18.29%、18.75%、19.63%;碱性氨基酸各占总氨基酸的20.22%、19.79%、19.96%,表明3种沙蚕酶解产物超滤组分均富含支链氨基酸、疏水性氨基酸和碱性氨基酸。
2.3 小鼠体质量的变化
从图1可见,各组小鼠初始体质量无显著性差异(P>0.05),在19 d开始腹腔注射环磷酰胺造模5次后,模型组小鼠体质量与空白组相比显著性降低(P<0.05),连续给药30 d后<5 000沙蚕酶解产物高剂量组小鼠终末体质量与模型组相比显著性升高(P<0.05),相较于模型组,其他样品组的体质量降低较小,但与空白组无显著性差异(P>0.05)。
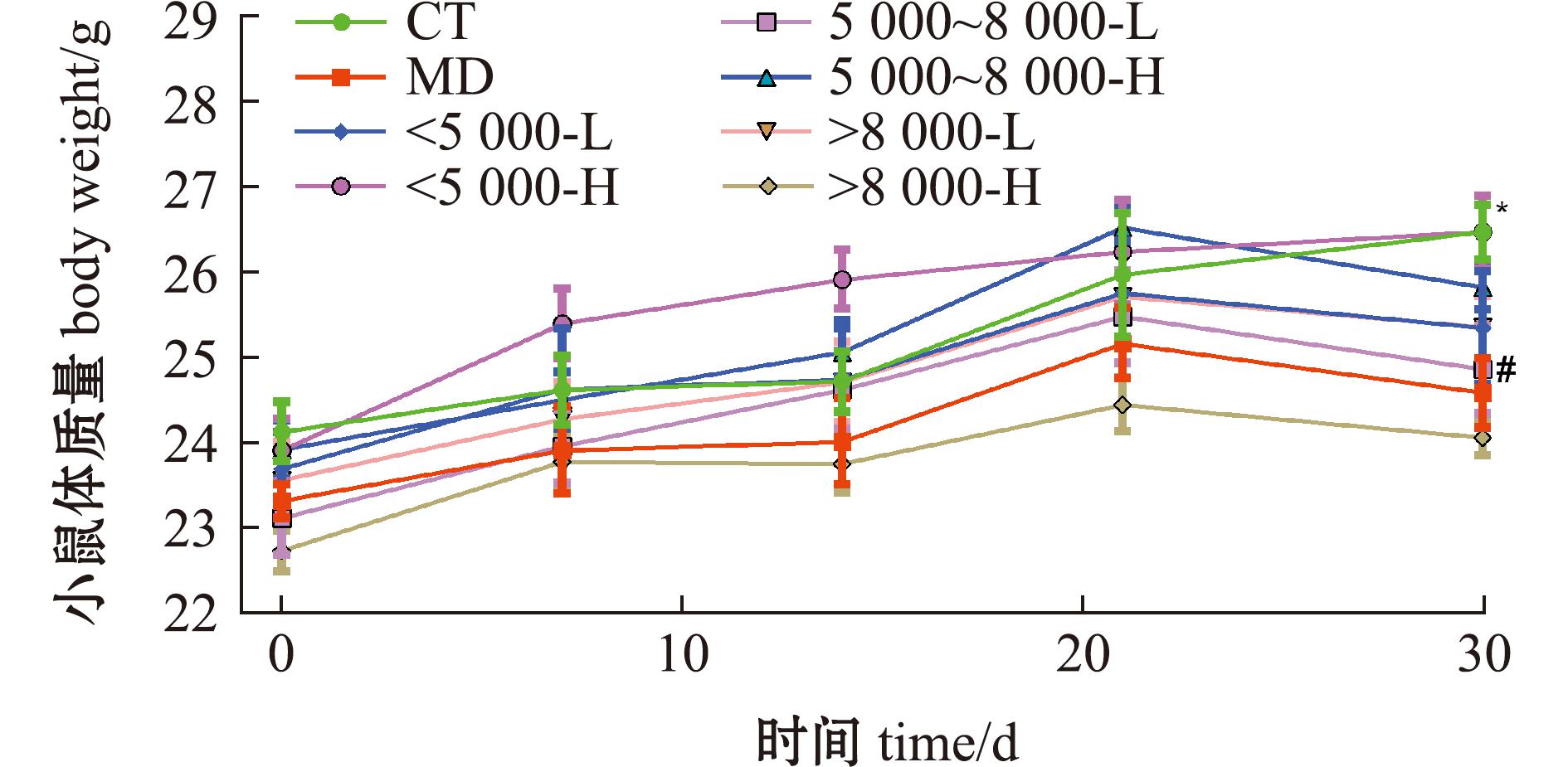
#表示与空白组有显著性差异(P<0.05);##表示与空白组有极显著性差异(P<0.001);*表示与模型组有显著性差异(P<0.05);**表示与模型组有极显著性差异(P<0.001),下同。
# means significant difference compared with the blank group (P<0.05);## means very significant difference compared with the blank group(P<0.001);*means significant difference compared with the model group(P<0.05);**means very significant difference compared with the model group(P<0.001),et sequentia.
图1 沙蚕酶解产物对免疫抑制小鼠体质量指数的影响
Fig.1 Effects of enzymolysis products in Perinereis aibuhitensis on body weight of immunosuppressed mice
2.4 小鼠免疫脏器指数的变化
从图2(a)可见,与空白组相比,模型组脾脏指数极显著性降低(P<0.001);与模型组相比,灌胃沙蚕酶解产物的小鼠脾脏指数均有所增大,其中<5 000沙蚕酶解产物低剂量组的脾脏指数极显著性增大(P<0.01),而<5 000沙蚕酶解产物高剂量组、5 000~8 000低、高剂量组脾脏指数显著性增大(P<0.05),其余组与模型组相比无显著性差异(P>0.05);从图2(b)可见,与空白组相比,模型组胸腺指数极显著性降低(P<0.001);与模型组相比,<5 000低剂量组的胸腺指数显著性增大(P<0.01),而<5 000高剂量组的胸腺指数极显著性增大(P<0.001),5 000~8 000与>8 000组无显著性差异(P>0.05)。
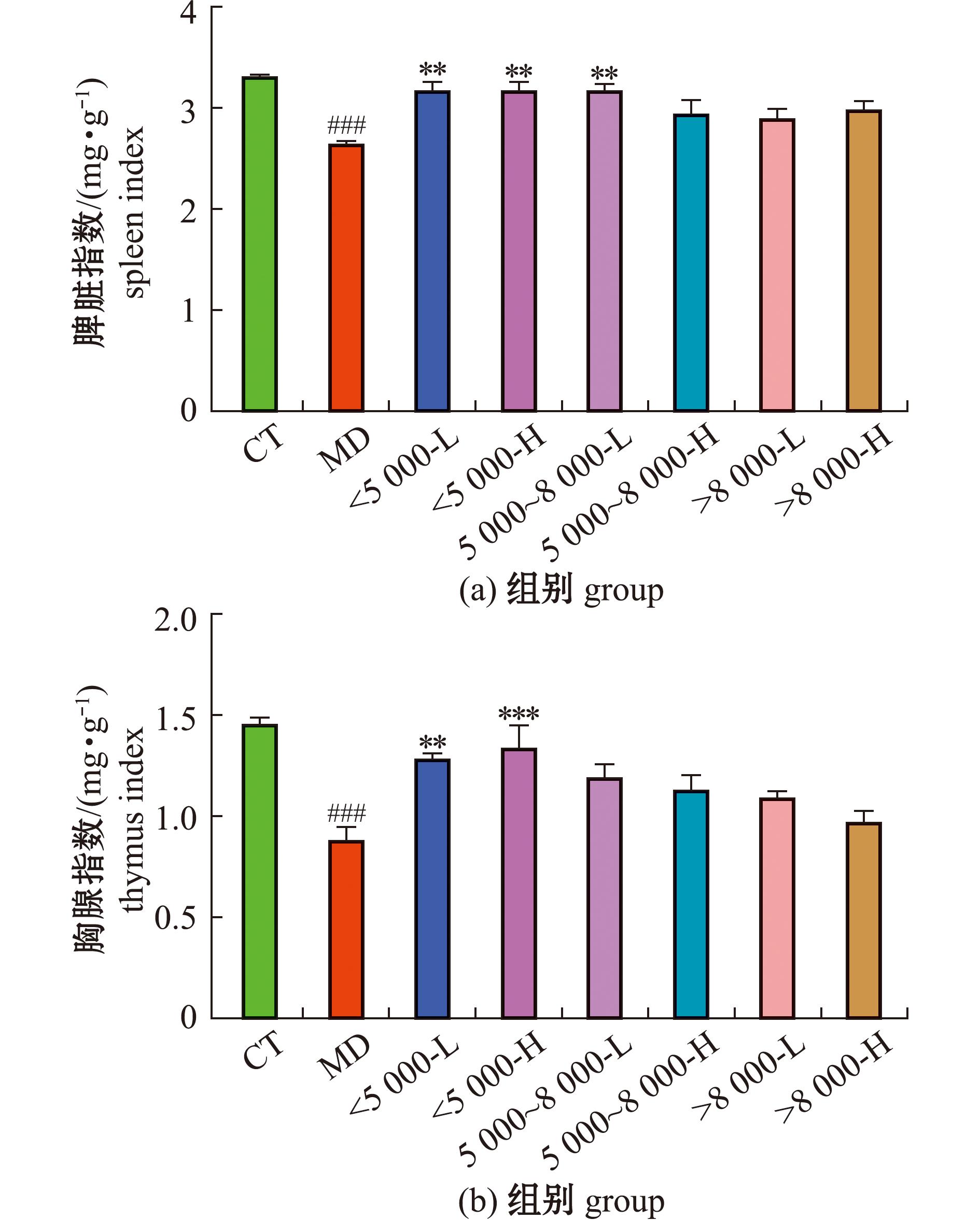
图2 沙蚕酶解产物对免疫抑制小鼠免疫脏器指数的影响
Fig.2 Effects ofenzymolysis products in Perinereis aibuhitensis on immune organ indexes of immunosuppressive mice
2.5 脾脏T淋巴细胞亚群的变化
使用流式细胞术分析脾脏T淋巴细胞亚群,以确定脾脏相关免疫细胞分化的情况(图3(a))。从图3(b)可见,与空白组相比,模型组脾脏中CD3e+T淋巴细胞的数量和CD4+/CD8a+T淋巴细胞的比例均极显著性降低(P<0.01);与模型组相比,>8 000沙蚕酶解产物的CD3e+T淋巴细胞的数量极显著性减少(P<0.001),但>8 000沙蚕酶解产物的CD4+/CD8a+T淋巴细胞数量的比例显著性增加(P<0.05),这可能与环磷酰胺免疫抑制的机制相关,因为环磷酰胺使T淋巴细胞绝对数目减少,对外周血中成熟的淋巴细胞更具有直接杀伤效果,导致CD3e+T淋巴细胞数量减少[18],而>8 000沙蚕酶解产物并不能避免这种免疫抑制现象。5 000~8 000沙蚕酶解产物高剂量组CD3e+T淋巴细胞的数量显著性增加(P<0.05),而<5 000沙蚕酶解产物低剂量组的CD4+/CD8a+T淋巴细胞的比例显著性增加(P<0.05),<5 000沙蚕酶解产物高剂量组的CD3e+T淋巴细胞的数量和CD4+/CD8a+T淋巴细胞的比例均极显著性增加(P<0.01),这可能是因为T淋巴细胞及其表达的受体具有识别抗原上小分子肽的特异性,通过抗原呈递细胞激活适应性免疫系统,刺激T淋巴细胞的完全增殖和分化,促使T细胞表面表达各种膜蛋白,如CD3、CD4和CD8分子等[19-20],这与脾脏指数和胸腺指数结果一致,这是因为环磷酰胺可使小鼠脾淋巴细胞总数减少导致小鼠的脾脏和胸腺质量明显降低[21]。其余组相较于模型组均有所增加,但无显著性差异(P>0.05)。
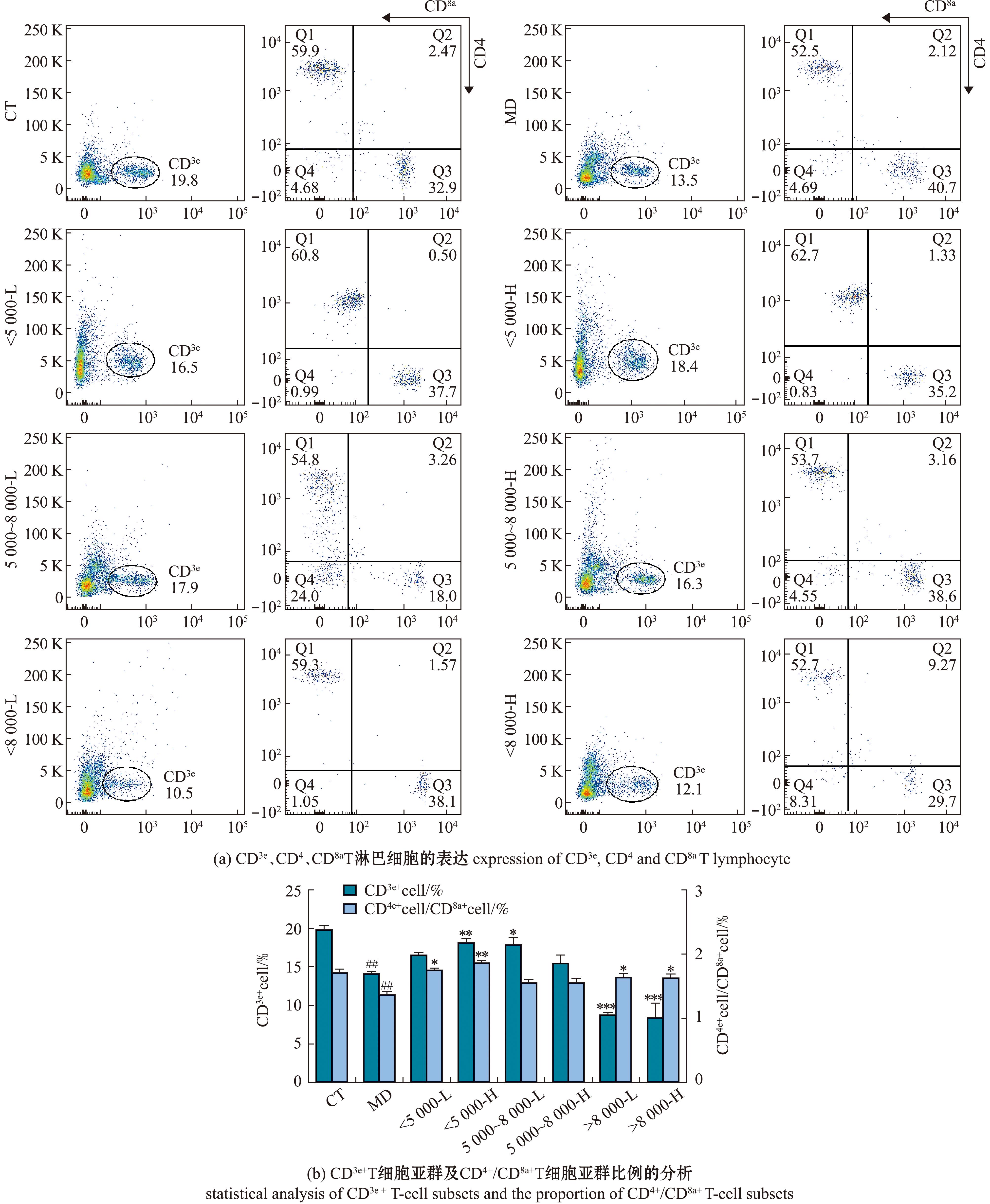
图3 沙蚕酶解产物对小鼠脾脏T淋巴细胞亚群的影响
Fig.3 Effects ofenzymolysis products in Perinereis aibuhitensis on spleen T-lymphocyte subcohorte of mice
2.6 小鼠血浆白细胞总数的变化
从图4可见,与空白组相比,模型组的小鼠血浆白细胞总数极显著性减少(P<0.001),说明环磷酰胺免疫抑制建立成功;与模型组相比,灌胃沙蚕酶解产物的小鼠血浆白细胞总数均有所增大,其中<5 000沙蚕酶解产物低剂量组的血浆白细胞总数极显著性增大(P<0.001),而5 000~8 000沙蚕酶解产物低、高剂量组和>8 000沙蚕酶解产物低、高剂量组的小鼠血浆白细胞总数显著增大(P<0.05),<5 000沙蚕酶解产物高剂量组相较于模型组无显著性差异(P>0.05),这可能是在环磷酰胺免疫抑制过程中,与中性粒细胞占白细胞总数的50%~70%有关。巨噬细胞在免疫效应初期调节中性粒细胞[22-23]。中期阶段,巨噬细胞能够吞噬凋亡和未凋亡的中性粒细胞,而当巨噬细胞吞噬大量凋亡的中性粒细胞,其功能被抑制时,正常的中性粒细胞会代替巨噬细胞吞噬病原菌[24-25]。在免疫效应消退后期阶段,集聚的中性粒细胞会减少,同时中性粒的减少也会导致白细胞数量的减少[26]。以上结果同后期的免疫球蛋白IgA的<5 000沙蚕酶解产物高剂量组结果相似,这可能与白细胞数量的减少,减缓B细胞向浆细胞的转化过程,导致<5 000沙蚕酶解产物高剂量组IgA质量浓度水平与模型组相比无显著性差异有关。
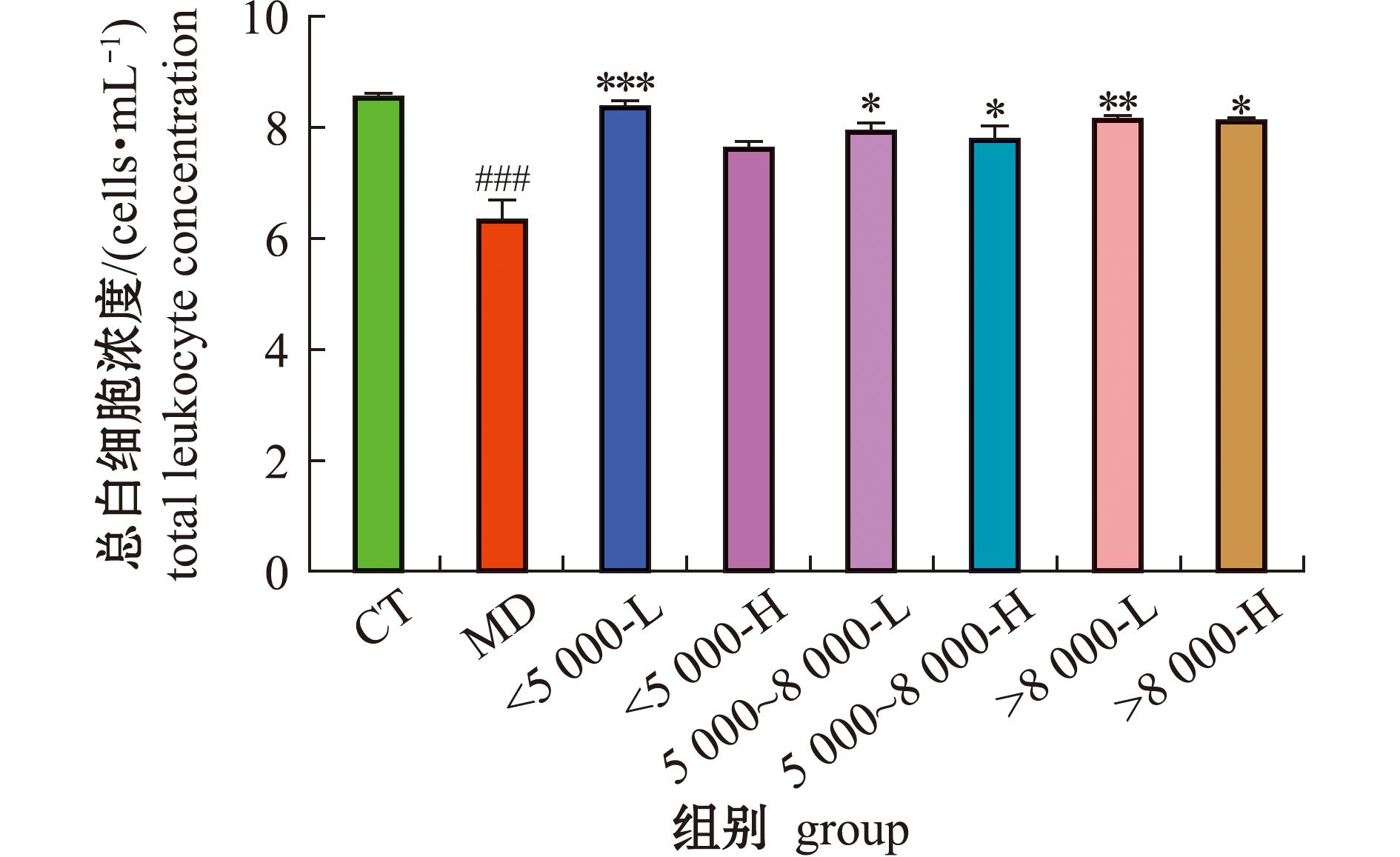
图4 沙蚕酶解产物对免疫抑制小鼠血浆白细胞总数的影响
Fig.4 Effects of enzymolysis products in Perinereis aibuhitensis on the total number of plasma leukocytes of immunosuppressed mice
2.7 小鼠外周血免疫球蛋白含量的变化
从图5可见,与空白组相比,模型组小鼠的外周血IgA、IgM质量浓度均极显著性降低(P<0.01),IgG质量浓度有所增加但无显著性差异(P>0.05);相较于模型组的IgA质量浓度,<5 000低剂量组、>8 000高剂量组质量均为极显著性增加(P<0.001),>8 000低剂量组极显著性增高(P<0.01),其余组均有所增加,但无统计学意义(P>0.05);相较于模型组的IgM质量浓度,<5 000沙蚕酶解产物高剂量组极显著性增加(P<0.01),5 000~8 000低剂量组显著性增加(P<0.05),其余组无显著性差异(P>0.05);相较于空白组,灌胃沙蚕酶解产物小鼠的IgG质量浓度均有显著性差异(P<0.05)。
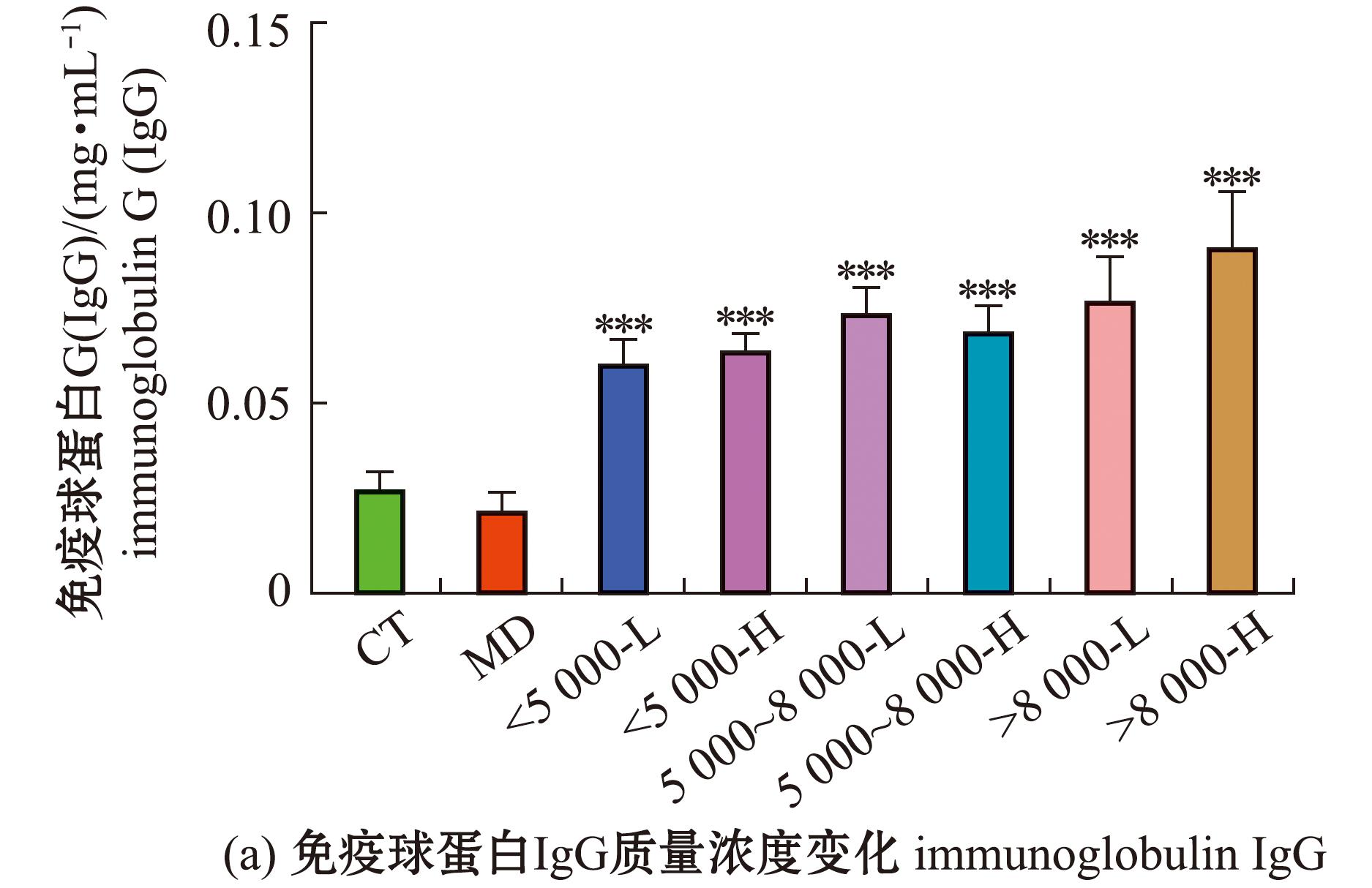
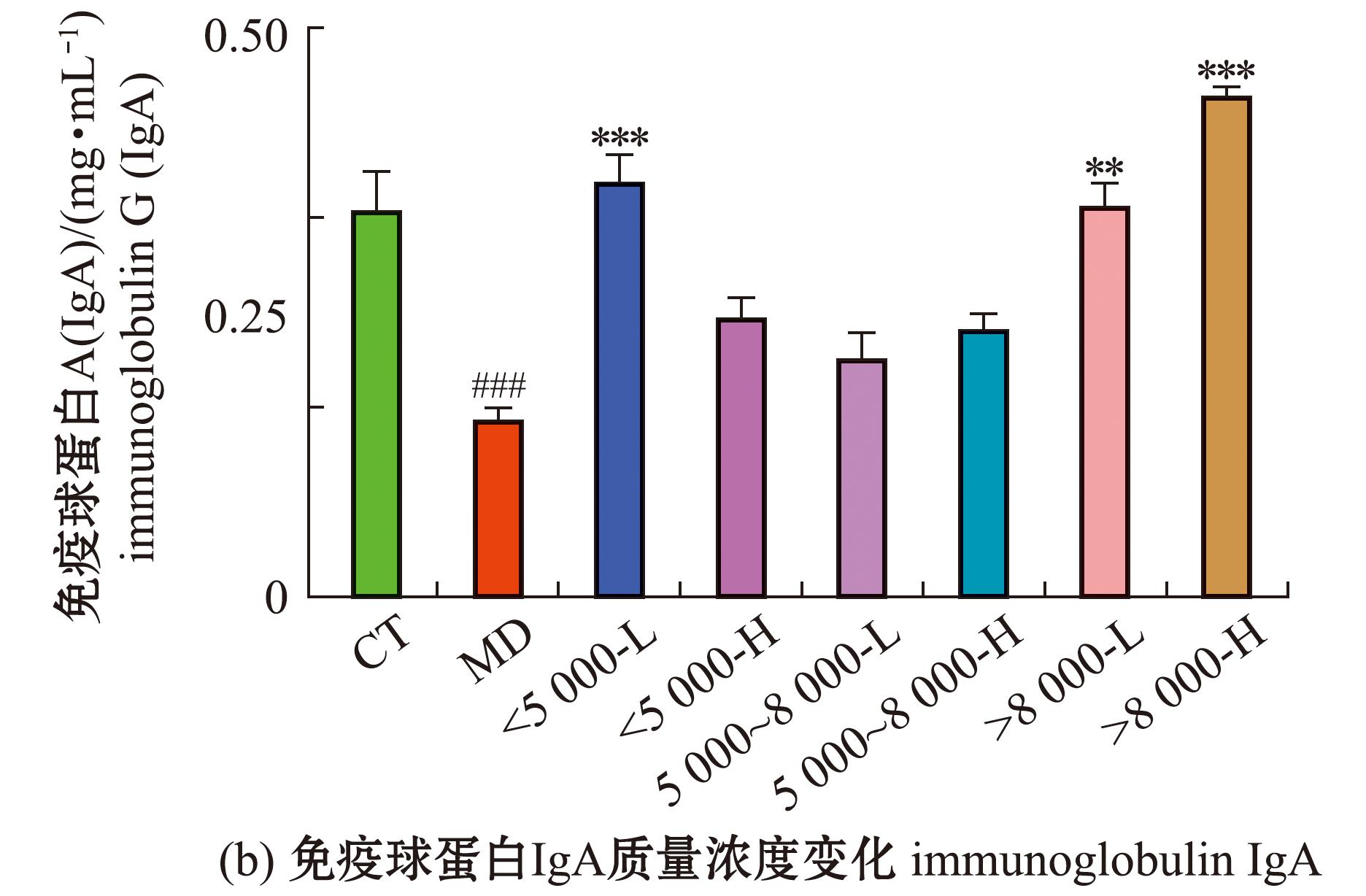
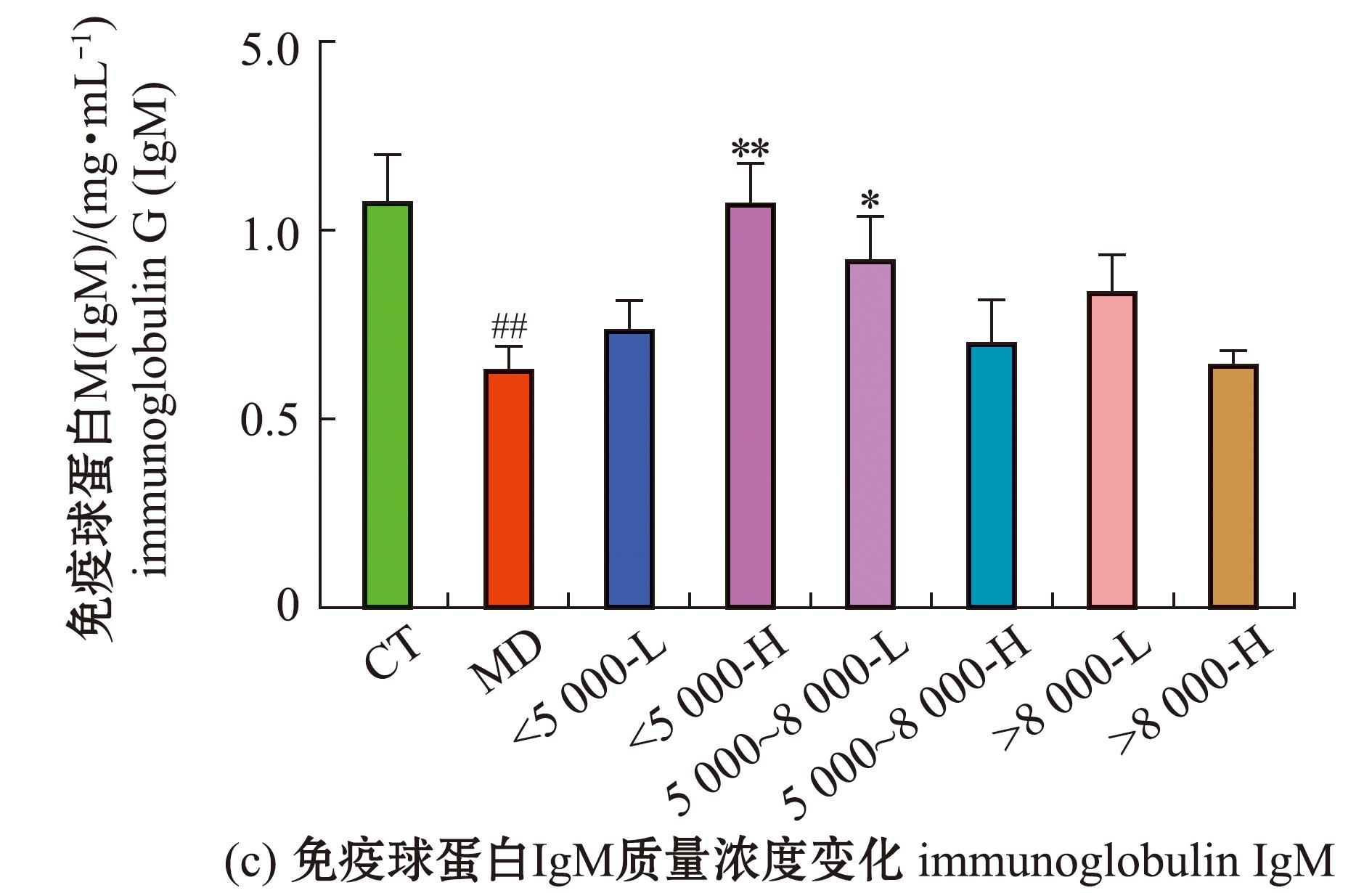
图5 沙蚕酶解产物对免疫抑制小鼠外周血免疫球蛋白IgG、IgA、IgM质量浓度的影响
Fig.5 Effects of enzymolysis products in Perinereis aibuhitensis on Peri Pheral blood immunoglobulin IgG,IgA,IgM mass concentrations of immunosuppressedmice
3 讨论
3.1 沙蚕酶解产物3种超滤组分的氨基酸组成分析
研究表明,生物活性肽的免疫调节特性不仅和免疫细胞因子的调节、抗体的产生及免疫系统中活性氧的刺激有关[27],而且特征氨基酸序列和疏水性氨基酸含量等也与免疫调节活性密切相关[28]。其中,低分子量蛋白质水解物和多肽序列中经常出现的氨基酸残基为疏水性氨基酸或碱性氨基酸,均已被证明可具有免疫调节作用[29-30]。此外,支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)已被证明可以激活参与增强先天性和适应性免疫反应的m-TOR信号通路[31],支链氨基酸所含有的疏水结构也证实其免疫调节肽的特性。在本研究中,沙蚕酶解产物含有丰富的碱性氨基酸、疏水性氨基酸,同时也含有大量的支链氨基酸:>8 000(亮氨酸67.86 mg/g;缬氨酸46.56 mg/g;异亮氨酸42.61 mg/g)、5 000~8 000(亮氨酸67.10 mg/g;缬氨酸43.80 mg/g;异亮氨酸40.08 mg/g)和<5 000(亮氨酸78.31 mg/g;缬氨酸51.24 mg/g;异亮氨酸46.71 mg/g),这可能是有助于沙蚕酶解产物免疫增强的另一个原因。与本研究相似,Liu等[32]发现,由含17.40%(占总氨基酸)支链氨基酸和57.7%(占总氨基酸)疏水性氨基酸组成的罗非鱼肽能够增强免疫抑制小鼠的细胞免疫和体液免疫功能,具有良好的免疫活性。因此,本研究中所制备的3种沙蚕酶解产物均由具有免疫活性肽的特征氨基酸组成。
3.2 小鼠体质量变化分析
为进一步探究3种沙蚕酶解产物的免疫调节作用,本研究中以3种沙蚕酶解产物超滤组分为原料,构建了环磷酰胺免疫抑制小鼠模型,探讨了双齿围沙蚕酶解产物对环磷酰胺诱导的免疫抑制小鼠免疫功效的调节作用。环磷酰胺常用于治疗癌症,对免疫细胞有毒性,可导致免疫功能丧失和肠道功能受损,并增加继发感染的可能性[33],在动物试验中常用于免疫抑制模型的建立。环磷酰胺会诱导免疫抑制小鼠的生长代谢能力发生阻滞,引起动物食欲下降[34],从而导致小鼠体质量下降,从侧面反映了小鼠机体的免疫状况。在本研究中环磷酰胺会使小鼠食欲降低并最终导致其体质量下降,这与田恒群等[35]的研究一致。相较于模型组,<5 000高剂量组的小鼠体质量显著性升高,其他样品组无显著性差异,但均能降低小鼠体质量下降的程度,提示沙蚕酶解产物可改善环磷酰胺诱导引起小鼠食欲不振的问题,并提供营养,帮助提高小鼠体质量,其中<5 000酶解产物具有最好的改善作用。
3.3 小鼠免疫脏器指数和T淋巴细胞亚群变化分析
脾脏和胸腺是机体重要的免疫器官,含有T淋巴细胞和B淋巴细胞,能影响机体的免疫作用,脾脏指数和胸腺指数的下降直接反映机体免疫力下降程度[36]。脾脏T淋巴细胞通过分泌分子标志物CD3对机体产生免疫应答,可细分为CD4+T和CD8a+T细胞,CD4+T细胞能促进T淋巴细胞表达,CD8a+T细胞可以抑制T细胞表达[37]。在本研究中,环磷酰胺诱导会引发小鼠脾脏和胸腺指数显著性降低;利用脾脏T淋巴细胞进一步证明,模型组中CD3e+T淋巴细胞的数量及CD4+/CD8a+T淋巴细胞的比例显著性降低,而CD3e+T淋巴细胞数量和CD4+/CD8a+T淋巴细胞的比值降低说明机体的细胞免疫功能下降[23],可能因为环磷酰胺是烷化剂,会破坏DNA的结构,干扰脾脏T细胞的增殖和分化,最终导致T细胞减少并抑制细胞免疫反应[38-39]。有研究发现,脾脏和胸腺质量的增加可能与免疫细胞增殖、分化和活化的增加有关[40],研究结果表明,灌胃<5 000和5 000~8 000沙蚕酶解产物的小鼠脾脏、胸腺指数、CD3e+T淋巴细胞的数量及CD4+/CD8a+T淋巴细胞的比例均有所增加,因此推测<5 000和5 000~8 000沙蚕酶解产物通过刺激T淋巴细胞和B淋巴细胞增殖分化来改善免疫抑制剂诱导小鼠免疫器官的损伤,增强小鼠的免疫功能。
3.4 小鼠白细胞总数变化分析
白细胞也是免疫系统的重要组成部分,它是具有防御和免疫功能的无色有核球形细胞,其数量常作为临床判断机体抵抗力的重要血液学指标[41]。免疫低下造模对小鼠血液中的白细胞影响显著,也会影响小鼠自身的防御和免疫功能。在本研究中,沙蚕酶解产物能使环磷酰胺导致免疫抑制小鼠的白细胞总数明显增加,其中<5 000超滤组分低剂量组的白细胞总数相较于模型组极显著性增加,与这项研究相似,Dong等[42]研究发现,口服长蜥蜴鱼的酶解产物显著增加了环磷酰胺诱导的小鼠中的白细胞数量。此外,Tian等[43]的研究证实驴胶补血颗粒通过抑制支链氨基酸降解途径,增加缬氨酸、亮氨酸和异亮氨酸的水平来改善环磷酰胺诱导的白细胞减少症。因此,猜测沙蚕酶解产物对免疫抑制小鼠的白细胞减少症改善机制也可能涉及氨基酸代谢,然而,这需要进一步的研究来验证这一假设。
3.5 小鼠免疫球蛋白变化分析
血清免疫球蛋白作为反映机体免疫效应的重要标志物,是介导体液免疫的主要抗体。通常,血清中的免疫球蛋白IgM、IgG和IgA可用于表示血清免疫球蛋白的总体水平[44]。本研究结果显示,沙蚕酶解产物干预免疫抑制小鼠后不同程度地促进了血清IgM、IgG、IgA的形成,通过促进白细胞生成,并加速B细胞向浆细胞的转化以释放抗体,从而显著提高了抗体水平,达到了改善体液免疫功能的效果。其中<5 000沙蚕酶解产物对血清IgM、IgG、IgA质量浓度均具有显著提高作用,有研究证明,红虾头肽能显著增加了血清免疫球蛋白(IgA、IgG和IgM)水平,增强体液免疫,从而对免疫抑制小鼠发挥免疫调节作用。
4 结论
1)双齿围沙蚕酶解产物经过超滤分级得到>8 000超滤组分、5 000~8 000超滤组分和<5 000超滤组分,各超滤组分氨基酸分布齐全,且富含必需氨基酸,其中>8 000、5 000~8 000和<5 000这3种超滤组分的疏水性氨基酸、碱性氨基酸和支链氨基酸含量丰富,表明3种超滤组分均富含免疫调节作用的特征性氨基酸。
2)体内动物试验结果表明:双齿围沙蚕酶解产物可以通过影响机体细胞和体液免疫系统增强环磷酰胺诱导的免疫抑制小鼠的免疫能力,提示双齿围沙蚕酶解产物具有一定的免疫调节功效。<5 000、5 000~8 000、>8 000沙蚕酶解产物均具有提高小鼠细胞和体液免疫功效,其中<5 000高剂量组对小鼠的免疫调节功效最佳。本研究结果可为双齿围沙蚕酶解产物在食品和保健品行业的开发利用提供科学参考,但有关双齿围沙蚕免疫调节的具体功效因子有待进一步研究。
[1] WAGAR L E,CHAMPAGNE C P,BUCKLEY N D,et al.Immunomodulatory properties of fermented soy and dairy milks prepared with lactic acid bacteria[J].Journal of Food Science,2009,74(8):423-430.
[2] CHALAMAIAH M,HEMALATHA R,JYOTHIRMAYI T,et al.Chemical composition and immunomodulatory effects of enzymatic protein hydrolysates from common carp (Cyprinus carpio) egg[J].Nutrition,2015,31(2):388-398.
[3] ZHAO R,JIANG S Q,TANG Y P,et al.Effects of low molecular weight peptides from red shrimp (Solenocera crassicornis) head on immune response in immunosuppressed mice[J].International Journal of Molecular Sciences,2023,24(12):10297.
[4] JOSHI I,MOHIDEEN H S,NAZEER R A.A Meretrix meretrix visceral mass derived peptide inhibits lipopolysaccharide-stimulated responses in RAW264.7 cells and adult zebrafish model[J].International Immunopharmacology,2021,90:107140.
[5] 廖慧琦,杨留明,张慧恩,等.鲐鱼为原料制备低分子质量肽及其功能特性[J].食品与发酵工业,2023,49(11):155-162.LIAO H Q,YANG L M,ZHANG H E.Preparation and functional properties of low molecular weight peptides from chub mackerel[J].Food and Fermentation Industries,2023,49(11):155-162.(in Chinese)
[6] 何丽霞,陈启贺,刘睿,等.海参寡肽:免疫调节作用及机制研究[J].科技导报,2016,34(11):42-47.HE L X,CHEN Q H,LIU R,et al.Sea cucumber oligopeptides:immunomodulatory effects and its mechanism[J].Science &Technology Review,2016,34(11):42-47.(in Chinese)
[7] 孙瑞平,黄猛,杨德渐,等.沙蚕养殖与开发[M].青岛:中国海洋大学出版社,2006:10-15.SUN R P,HUANG M,YANG D J,et al.Breeding and design of Nereisdiversicolor[M].Qingdao:Ocean University of China Ocean University Press,2006:10-15.(in Chinese)
[8] 高仁姣,饶杰,张硕,等.双齿围沙蚕与日本刺沙蚕营养成分比较及安全性评价[J].安徽农业科学,2020,48(22):99-102.GAO R J,RAO J,ZHANG S,et al.Comparison of nutritional components and safety evaluation of Nereis succinea and Neanthes japonica[J].Journal of Anhui Agricultural Sciences,2020,48(22):99-102.(in Chinese)
[9] 孙瑞平.沙蚕养殖与开发[M].青岛:中国海洋大学出版社,2006:10-15.SUN R P.Breeding and development of Nereis[M].Qingdao:China Ocean University Press,2006:10-15.(in Chinese)
[10] WU X J,ZHOU Z Z,WU W,et al.A temperature resistant extracts prepared from the Perinereis aibuhitensis and its antioxidative characterization[J].Aquatic Science and Technology,2019,7(2):17.
[11] 贾盈露,闫海强,丁国芳,等.沙蚕提取物药理活性的研究进展[J].浙江海洋学院学报(自然科学版),2016,35(3):253-256.JIA Y L,YAN H Q,DING G F,et al.Research progress about Nereis succinea’s biological activity[J].Journal of Zhejiang Ocean University (Natural Science Edition),2016,35(3):253-256.(in Chinese)
[12] 丁国芳,贾盈露,杨最素,等.一种双齿围沙蚕抗肺癌多肽及其用途[P].浙江省:CN106632634B,2020-03-20.DING G F,JIA Y L,YANG Z S,et al.A Nereis succinea anti-lung cancer peptide and its use[P].Zhejiang province:CN106632634B,2020-03-20.
[13] WILMES M,STOCKEM M,BIERBAUM G,et al.Killing of staphylococci by θ-defensins involves membrane impairment and activation of autolytic enzymes[J].Antibiotics,2014,3(4):617-631.
[14] 朱国萍,陈自豪,叶宁.响应面优化沙蚕抗氧化物的超高压提取及其抗氧化活性研究[J].水产科技情报,2018,45(5):267-274.ZHU G P,CHEN Z H,YE N.Optimization of ultra-high pressure extraction and antioxidant activity of Nereis by response surface methodology[J].Fisheries Science &Technology Information,2018,45(5):267-274.(in Chinese)
[15] ZENG Y,HU X Y,YU Z Y,et al.Immune enhancement and antioxidant effects of low molecular-weight peptides derived from Nibea japonica muscles on immune-deficient mice induced by cyclophosphamide[J].Process Biochemistry,2021,102:42-50.
[16] 中华人民共和国卫生部.食品中氨基酸的测定 GB5009.124-2016[M].北京,中国标准出版社.2016.Ministry of Health of the People's Republic of China.Determination of amino acids in foods GB5009.124-2016[M].Beijing:Standards press of China.2016.(in Chinese)
[17] VITER I,CASTR O,OSBOR N,et al.Energy and protein requirements:report of a joint FAO/WHO/UNU expert consultation[M].World Health Organization technical report series,1985.
[18] AHLMANN M,HEMPEL G.The effect of cyclophosphamide on the immune system:implications for clinical cancer therapy[J].Cancer Chemotherapy and Pharmacology,2016,78(4):661-671.
[19] SADIGHI AKHA A A.Aging and the immune system:an overview[J].Journal of Immunological Methods,2018,463:21-26.
[20] 吴春艳.高压静电场对雏鸡血液和免疫器官免疫变化的影响及机理[D].哈尔滨:东北农业大学,2004.WU C Y.Effect and mechanism of high voltage electrostatic field on immune changes of blood and immune organs in chicks[D].Harbin:Northeast Agricultural University,2004.(in Chinese)
[21] PAHWA H,SHARAN K.Food and nutrition as modifiers of the immune system:a mechanistic overview[J].Trends in Food Science &Technology,2022,123:393-403.
[22] BORREGAARD N.Neutrophils,from marrow to microbes[J].Immunity,2010,33(5):657-670.
[23] GORDON S,TAYLOR P R.Monocyte and macrophage heterogeneity[J].Nature Reviews Immunology,2005,5(12):953-964.
[24] LIU G W,BI Y J,WANG R N,et al.Self-eating and self-defense:autophagy controls innate immunity and adaptive immunity[J].Journal of Leukocyte Biology,2013,93(4):511-519.
[25] LIU G W,YANG H.Modulation of macrophage activation and programming in immunity[J].Journal of Cellular Physiology,2013,228(3):502-512.
[26] 蔡莎莎.免疫调节肽CATHPb1抗耐药金葡菌感染及其机制研究[D].大连:大连理工大学,2018.CAI S S.The protective effect and multiple mechanisms of immunomodulatory peptide CATHPbl against drug-resistant S. aureus infections[D].Dalian:Dalian University of Technology,2018.(in Chinese)
[27] ZAKY A A,SIMAL-GANDARA J,EUN J B,et al.Bioactivities,applications,safety,and health benefits of bioactive peptides from food and by-products:a review[J].Frontiers in Nutrition,2022,8:815640.
[28] KANG H K,LEE H H,SEO C H,et al.Antimicrobial and immunomodulatory properties and applications of marine-derived proteins and peptides[J].Marine Drugs,2019,17(6):350.
[29] HE P,PAN L M,WU H,et al.Isolation,identification,and immunomodulatory mechanism of peptides from Lepidium meyenii (maca) protein hydrolysate[J].Journal of Agricultural and Food Chemistry,2022,70(14):4328-4341.
[30] 王凯凯.绿豆肽的结构鉴定及对小鼠巨噬细胞免疫活性物质的影响作用研究[D].大庆:黑龙江八一农垦大学,2016.WANG K K.Structureidentification of mungs bean peptides and its effect on the immunoreactive substances of macrophage in mice[D].Daqing:Heilongjiang Bayi Agricultural University,2016.(in Chinese)
[31] ZHANG S H,ZENG X F,REN M,et al.Novel metabolic and physiological functions of branched chain amino acids:a review[J].Journal of Animal Science and Biotechnology,2017,8:10:501-502.
[32] LIU K Y,KUO I P,CHEN Y J,et al.Oral administration of tilapia hydrolysate peptides ameliorates the immune-related side effects of cyclophosphamide in BALB/c mice[J].Food Bioscience,2023,56:103428.
[33] XIE J H,NIE S P,YU Q,et al.Lactobacillus plantarum NCU116 attenuates cyclophosphamide-induced immunosuppression and regulates Th17/treg cell immune responses in mice[J].Journal of Agricultural and Food Chemistry,2016,64(6):1291-1297.
[34] 伍维高,钟金凤.环磷酰胺构建动物免疫抑制模型的研究进展[J].中国兽医杂志,2019,55(2):87-89.WU W G,ZHONG J F.Progress in the research of immunosuppression model in cyclophosphamide animals[J].Chinese Journal of Veterinary Medicine,2019,55(2):87-89.(in Chinese)
[35] 田恒群,何康,郑平安,等.厚壳贻贝低分子质量肽对免疫抑制小鼠免疫调节作用[J].广东海洋大学学报,2022,42(2):112-119.TIAN H Q,HE K,ZHENG P A,et al.Immunomodulatory effects of low molecular weight peptides from Mytilus coruscus in immunosuppressive mice[J].Journal of Guangdong Ocean University,2022,42(2):112-119.(in Chinese)
[36] KHAYAL E E S,ALI ALABIAD M,ELKHOLY M R,et al.The immune modulatory role of marjoram extract on imidacloprid induced toxic effects in thymus and spleen of adult rats[J].Toxicology,2022,471:153174.
[37] 吴姗姗,严峰,邓玉玲,等.小细胞和非小细胞肺癌晚期患者 CD3+CD4+及CD3+CD8+T淋巴细胞亚群的差异[J].中国免疫学杂志,2015,31(1):114-116,121.WU S S,YAN F,DENG Y L,et al.Difference of CD3+CD4+and CD3+CD8+T cells between patients with advanced small cell lung cancer and non-small cell lung cancer[J].Chinese Journal of Immunology,2015,31(1):114-116,121.(in Chinese)
[38] 张海璐.胸腺肽联合奥沙利铂对NSCLC合并恶性胸腔积液患者外周血CD3+,CD4+水平的影响[J].吉林医学,2024,45(2):433-436.ZHANG H L.Effect of thymosin combined with Oxaliplatin on peripheral blood CD3+,CD4+ levels in NSCLC patients with malignant pleural effusion[J].Jilin medical science,2024,45(2):433-436.(in Chinese)
[39] PARK Y M,LEE H Y,SHIN D Y,et al.Immune-enhancing effects of Co-treatment with Kalopanax pictus nakai bark and Nelumbo nucifera gaertner leaf extract in a Cyclophosphamide-induced immunosuppressed rat model[J].Frontiers in Nutrition,2022,9:898417.
[40] TANAHASHI T,SEKIGUCHI N,MATSUDA K,et al.A screening method with lymphocyte percentage and proportion of granular lymphocytes in the peripheral blood for large granular lymphocyte (LGL) leukemia[J].International Journal of Hematology,2017,105(1):87-91.
[41] YU W,QIN L I,YUHAI W.Study on effect of anoectochilus roburghii on improving immune function in mice immunized by cyclo Phos Phamide[J].The Journal of Medical Theory and Practice,2017,30(22):3293-3295.
[42] DONG Y L,SHENG G Y,FU J M,et al.Chemical characterization and anti-anaemia activity of fish protein hydrolysate from Saurida elongata[J].Journal of the Science of Food and Agriculture,2005,85(12):2033-2039.
[43] TIAN J S,ZHAO H L,GAO Y,et al.Branched-chain amino acids catabolism pathway regulation plays a critical role in the improvement of leukopenia induced by cyclophosphamide in 4T1 tumor-bearing mice treated with lvjiaobuxue granule[J].Frontiers in Pharmacology,2021,12:657047.
[44] 杨志艳,惠婷婷,祝宝华,等.中国毛虾活性肽对免疫抑制小鼠免疫调节作用的影响[J].食品工业科技,2023,44(9):380-386.YANG Z Y,HUI T T,ZHU B H,et al.Effects of peptides from Acetes chinensis on immunoregulation in immunocompromised mice[J].Science and Technology of Food Industry,2023,44(9):380-386.(in Chinese)