青海湖裸鲤(Gymnocypris przewalskii)属鲤形目(Cypriniformes)鲤科(Cyprinidae)裸鲤属(Gymnocypris),是青海湖主要的经济鱼类,处于青海湖整个生态系统的核心地位[1]。青海湖裸鲤具有耐盐碱、耐高寒、耐低氧等优良特性,受到广泛关注[2]。环境胁迫通常被认为是环境对鱼类所处的正常生存状态所引起的压力,环境因子变化可导致鱼体产生不同程度的应激反应,并引发机体的一系列生理活动,且通常需要消耗大量的能量[3]。
糖代谢途径是能量代谢的重要方式,研究表明,各种胁迫均对水生生物糖代谢产生影响。高温胁迫条件下,虾夷扇贝主要依赖糖原的无氧糖酵解为机体提供能量[4]。不同浓度的氟苯尼考暴露可以通过扰乱斑马鱼体内糖异生、糖原分解与合成,以及糖酵解等糖代谢过程,影响血糖的来源和去路,最终破坏血糖平衡[5]。水体锌暴露能通过时间依赖和剂量效应影响鱼类胚胎糖代谢关键酶和相关基因的表达[6]。邢晓丹[7]研究了盐度胁迫的糖代谢模式,发现盐度胁迫加速了大弹涂鱼(Boleophthalmus pectinirosris)肝糖原的分解,大弹涂鱼通过提高糖代谢活动为机体提供能量;在急性盐度胁迫下,大弹涂鱼鳃组织能够通过分解糖原为机体提供能量;而外源补充葡萄糖能够提高盐胁迫下大弹涂鱼肝脏糖酵解的作用。在急性盐胁迫下,鳃组织中的糖代谢、氨基酸代谢及脂肪代谢更为活跃,从而为机体提供更多的能量,研究发现,饲料中添加15%~20%糖可促进凡纳滨对虾生长和抗逆能力,表明在盐胁迫下,糖代谢具有重要作用[8]。
青海湖碱度为26~32 mmol/L,pH为9.1~9.5,且由于蒸发和灌溉等因素,湖水碱度逐年升高[9]。Wei等[10]已通过蛋白质组和转录组分析了不同碱度下青海湖裸鲤生理调节机制。许保可等[11]通过TNNI1、TNNI2基因的克隆与表达提示了青海湖裸鲤在盐碱胁迫下生长缓慢的相关因素。在盐碱胁迫下,GpANN3在肾组织中的表达显著上调,而GpANN2则显著下调,证明膜联蛋白参与青海湖裸鲤盐碱应激[12]。张海琛等[13]通过组学相关技术,筛选出了青海湖裸鲤盐碱耐受过程中发挥作用的代谢、免疫和渗透相关基因,表明青海湖裸鲤可通过这些方面适应盐碱环境,这为深入研究青海湖裸鲤盐碱耐受机制提供了基础数据。青海湖裸鲤作为国内少数耐碱的鱼种,其耐碱机理的研究目前还相对较少,本研究中以鱼体糖代谢通路为突破点,通过不同浓度的碱度胁迫,对糖代谢过程中关键物质含量及关键酶活性进行检测,并从中探究了青海湖裸鲤耐碱过程中的能供关系,以期为研究青海湖裸鲤耐碱机制提供有益参考。
1 材料与方法
1.1 材料
试验用青海湖裸鲤取自青海湖,试验用鱼均为3~4龄鱼,体长为(25.33±4.06)cm,体质量为(126.67±8.88)g。试验地点为青海大学国家重点实验室高原冷水鱼循环水车间。试验用盐为青岛海科通用海水素有限公司生产的海量星海水素,碱为无水碳酸钠(国药集团化学试剂有限公司)和碳酸氢钠(上海广诺化学科技有限公司);饲料为四川斯特佳饲料有限公司生产的淡水鱼膨化配合饲料,主要成分为进口鱼粉,豆粕,小麦粉,玉米粉,精制鱼油,复合维生素等,产品编号为G5。
1.2 方法
1.2.1 试验设计 试验期间,每日9:00投喂一次,饲喂量为鱼体体质量的5%。试验用鱼在碱胁迫处理前用0.5‰海水晶处理的淡水驯化14 d以适应车间环境。驯化结束后,随机取出健康、大小相近的成鱼90尾,设置3个平行组,开始进行碱梯度胁迫试验。碱胁迫用NaHCO3和Na2CO3(NaHCO3∶Na2CO3=9∶1)配制成不同浓度的自来水进行,设置J25%组、J50%组、J75%组、J100%组(碱度32 mmol/L)4个碱度组和淡水组(CK),共5个处理组,碱浓度配料见表1[14]。胁迫试验开始后根据表1的浓度梯度,胁迫从0 mmol/L开始每天增加5%(每天以1.55 mmol/L递增),在淡水对照组(CK)和对应的碱胁迫组持续养殖24 h,取样前24 h禁食,每个平行组取3尾鱼进行取样。将鱼麻醉快速处死,取鳃、肾脏、肝胰脏、背部肌肉等组织于-80 ℃冰箱保存备用。本胁迫试验在规格为85 cm×56 cm×62 cm的养殖箱中进行,根据每箱试验用鱼的数量及最高碱度的可溶性确定养殖水的总体积为40 L。
表1 碱浓度配料表
Tab.1 Alkali water ingredients
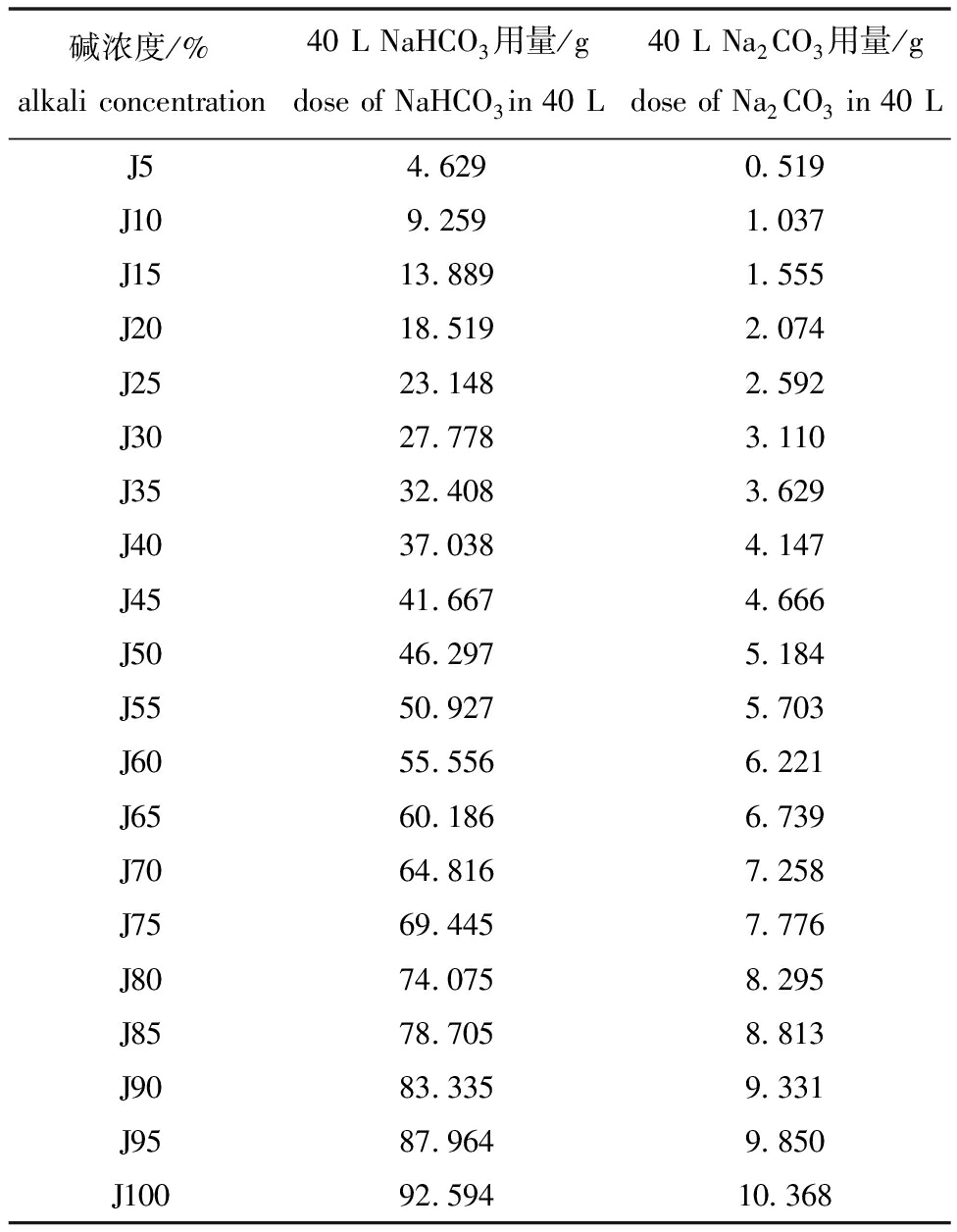
碱浓度/%alkaliconcentration40LNaHCO3用量/gdoseofNaHCO3in40L40LNa2CO3用量/gdoseofNa2CO3in40LJ54.6290.519J109.2591.037J1513.8891.555J2018.5192.074J2523.1482.592J3027.7783.110J3532.4083.629J4037.0384.147J4541.6674.666J5046.2975.184J5550.9275.703J6055.5566.221J6560.1866.739J7064.8167.258J7569.4457.776J8074.0758.295J8578.7058.813J9083.3359.331J9587.9649.850J10092.59410.368
1.2.2 糖代谢指标的测定 采用糖原(Glycogen)测定试剂盒、葡萄糖(GLU)测试盒、己糖激酶(HK)试剂盒、丙酮酸激酶(PK)测试盒、丙酮酸测试盒、蛋白定量(TP)测定试剂盒(南京建成生物工程研究所)及果糖-1,6-二磷酸醛缩酶(FBA)ELISA检测试剂盒、磷酸烯醇式丙酮酸羧激酶(PEPCK)ELISA检测试剂盒和葡萄糖-6-磷酸脱氢酶(G6PD)ELISA检测试剂盒等(江苏苏酶科生物科技有限公司)测定青海湖裸鲤的鳃、肾、肝和肌中的糖代谢相关指标。
1.2.3 总RNA提取及反转录 采用TRIzol法提取组织总RNA,按照cDNA合成(TaKaRa,6210A)试剂盒操作说明,将组织总RNA反转录成cDNA模板。采用RNA浓度检测仪和凝胶电泳检测RNA质量和浓度。采用检测合格的RNA进行cDNA合成,合成产物稀释后置入-80 ℃冰箱保存备用。
1.2.4 荧光引物设计与验证 根据青海湖裸鲤转录组数据[13]获得基因果糖-1,6-二磷酸醛缩酶C(fba-c),采用Oligo 7.0 软件设计荧光引物,之后进行引物验证,确保引物特异性。引物的合成及PCR产物测序均在生工生物工程(上海)有限公司进行。经验证对于具有特异性的引物,选出进行荧光定量PCR,引物序列见表2。
表2 荧光定量PCR引物
Tab.2 Fluorescent quantitative PCR primer
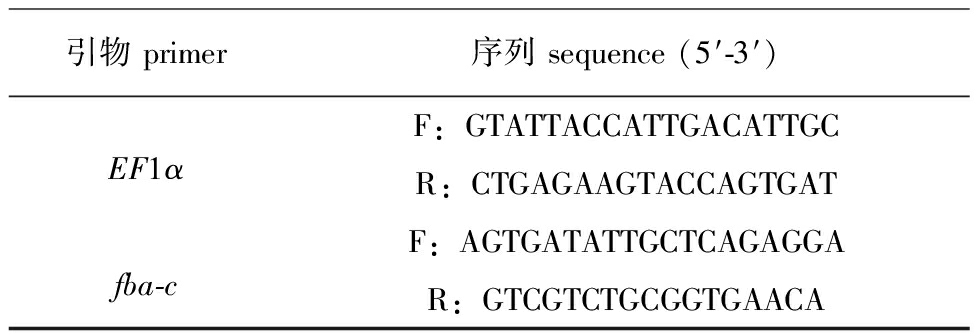
引物primer序列sequence(5′-3′)EF1αF:GTATTACCATTGACATTGCR:CTGAGAAGTACCAGTGATfba-cF:AGTGATATTGCTCAGAGGAR:GTCGTCTGCGGTGAACA
1.2.5 实时荧光定量PCR 通过荧光定量PCR,检测淡水中青海湖裸鲤不同组织的fba-c表达情况,同时检测不同碱度下鳃、肾中fba-c表达情况。具体操作方法如下:使用Prime ScriptTM RT Master Mix(Perfect real time)试剂盒将RNA反转录为qRT-PCR模板,按照TB GreenTMPremix Ex TaqTM Ⅱ (TliRNaseH Plus)说明配置20 μL反应体系,EF-1α为内参基因。荧光PCR程序包括:95 ℃下预变性30 s;95 ℃下变性5 s;55 ℃下退火30 s;72 ℃下延伸30 s;4 ℃下保存;共进行40个循环,每个样品设置3个重复。
1.2.6 糖代谢指标热图分析 为探究鱼体糖代谢随碱浓度上升的变化过程,采用Spearman方法对本试验测定的所有指标进行热图分析;通过Adobe Illustrator 2022软件制作网络代谢图进而明确本试验所涉及的糖代谢过程,进一步探索糖代谢随碱度上升的响应变化。
1.3 数据处理
本研究中,只对不同碱度下、同一组织内的差异性进行比较分析,采用SPSS 27软件进行数据分析。数据均采用平均值±标准误(mean±S.E.)表示,采用单因素方差分析(ANOVA),然后进行Duncan检验,以确定组内显著性差异,显著性差异设为0.05;基因表达情况使用2-ΔΔCt方法计算[15],采用Origin 2021软件作图。
2 结果与分析
2.1 碱度对青海湖裸鲤糖原、葡萄糖和丙酮酸的影响
从表3可见,随碱度的增加,糖原(Gn)含量呈先增加再降低的变化趋势;肝糖原与肌糖原均在J25%组有最大值,且显著高于其他处理组(P<0.05),CK组含量最低且显著低于其他处理组(P<0.05)。此外,在所有处理组中肝糖原含量均明显高于肌糖原含量。
表3 碱度对青海湖裸鲤糖原、葡萄糖及丙酮酸含量水平的影响
Tab.3 Effect on alkalinity on glycogen,glucose and pyruvic acid contents in Gymnocypris przewalskii

组别group糖代谢相关物质substancesrelatedtoglucosemetabolism糖原Gn/(mg·g-1)葡萄糖GLU/(mmol·gprot-1)丙酮酸PA/(μmol·gprot-1)肝糖原liverglycogen肌糖原muscleglycogen鳃葡萄糖gillglucose肾葡萄糖kidneyglucose肝葡萄糖liverglucose肌葡萄糖muscleglucose鳃丙酮酸gillpyruvicacid肾丙酮酸kidneypyruvicacid肝丙酮酸liverpyruvicacid肌丙酮酸musclepyruvicacidCK3.74±0.36d1.48±0.08d0.10±0.00b0.11±0.00e0.59±0.01d0.20±0.01a38.40±4.20c111.42±3.84c139.55±3.26b363.48±9.70aJ25%80.79±0.87a13.65±0.86a0.14±0.04b0.92±0.07b1.92±0.07a0.14±0.00b151.59±5.00a106.44±4.41c22.75±4.62c154.43±19.43cJ50%66.35±0.21b4.28±0.25c0.12±0.02b1.09±0.03a1.36±0.03b0.13±0.01b112.45±3.71b126.02±2.96b8.21±0.68d105.58±5.62cJ75%9.90±0.94c7.16±0.10b0.45±0.03a0.54±0.08d0.92±0.02c0.04±0.01c44.01±6.51c78.47±7.19d8.97±3.52d108.06±23.52cJ100%8.04±0.31c5.31±0.18c0.18±0.03b0.74±0.02c0.55±0.01d0.07±0.01c40.08±2.94c241.76±17.51a153.91±2.65a247.99±35.45b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences.
随碱度的增加,鱼鳃、肾和肝中葡萄糖(GLU)含量呈先增加再降低的变化趋势,肌肉中GLU呈逐渐降低的变化趋势。鳃中J75%组GLU含量最高,显著高于其他处理组(P<0.05),CK组最低;肾中J50%组GLU含量最高,CK组最低(P <0.05);肝中J25% 组GLU含量最高(P<0.05),J100%组最低;肌肉中CK组GLU含量最高(P<0.05),J75%组最低。综上所述,4个组织中,肝中GLU含量整体高于其他组织。
鱼鳃中丙酮酸(PA)含量随碱度的增加呈先增加再降低的变化趋势,J25%组最高,显著高于其他处理组(P<0.05),CK组最低。肾中PA含量无明显变化趋势,CK~J75%组间呈波动变化,J100%组显著上升,显著高于其他处理组(P<0.05)。肝脏和肌肉中PA含量随碱度呈先降低再升高的变化趋势,肝中J50%组最低,J100%组最高(P<0.05);肌中J50%组最低,CK组最高(P<0.05)。此外,肌中PA含量较其他3种组织高。
2.2 碱度对青海湖裸鲤糖代谢酶活性的影响
从图1可见,随碱度升高,鳃中己糖激酶(HK)活性逐渐升高,其中,J100%组最高,且与J75%组无显著性变化,但显著高于其他处理组(P<0.05),CK组最低;肾、肝和肌肉中HK活性随碱度呈先升高再降低的变化趋势,其中,肾中J50%组最高,显著高于其他组(P<0.05),J75%组最低;肝中J75%组HK活性最高,且显著高于其他组(P<0.05),CK组最低(P<0.05);肌中HK活性在J50%组最高,J100%最低。4种组织中,HK活性由高至低依次为鳃>肾>肝>肌。
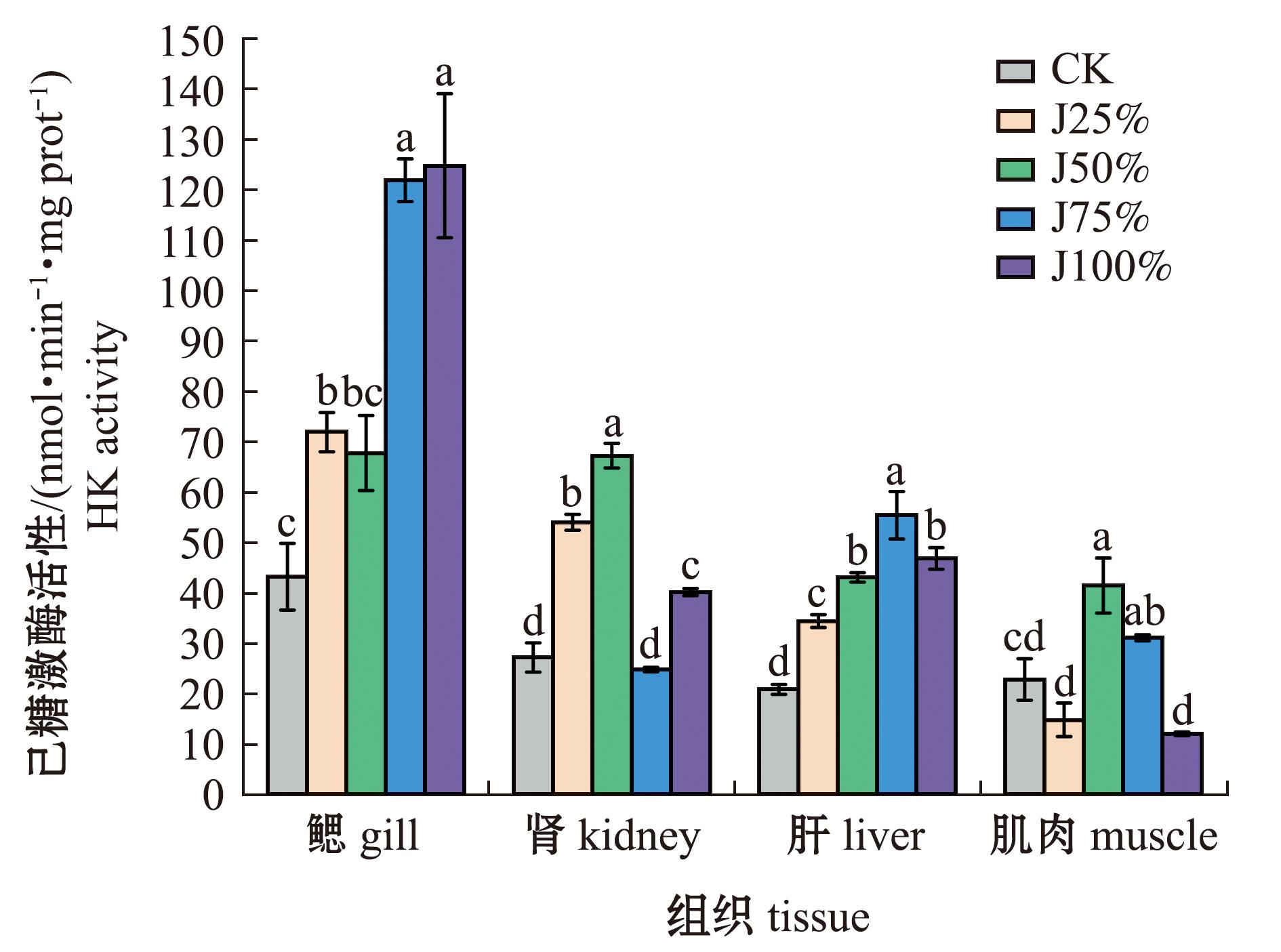
标有不同字母者表示同一组织中不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P> 0.05),下同。
The means with different letters in same tissue are significant differences in different groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图1 碱度对青海湖裸鲤HK活性的影响
Fig.1 Effects of alkalinity on HK activity in Gymnocypris przewalskii
从图2可见,随碱度升高,鱼鳃中丙酮酸激酶(PK)活性逐渐升高,J75%组最高,与J100%组无显著性变化,且显著高于其他处理组(P<0.05),CK组最低;肾中PK活性随碱度呈先升高再降低再升高的变化趋势,其中,J50%组最高,且与J100%组无显著性差异,显著高于其他处理组(P<0.05),CK组最低(P<0.05);肝中PK活性随碱度呈先升高再降低的变化趋势,J75%组活性最高,且显著高于其他处理组(P<0.05),J100%组最低。肌肉中PK活性则随碱度呈逐渐降低的变化趋势,其中,CK组最高(P<0.05),J100%最低。综合来看,鳃、肾、肝中PK活性随碱度呈升高趋势,肌中PK活性随碱度增加呈降低趋势。
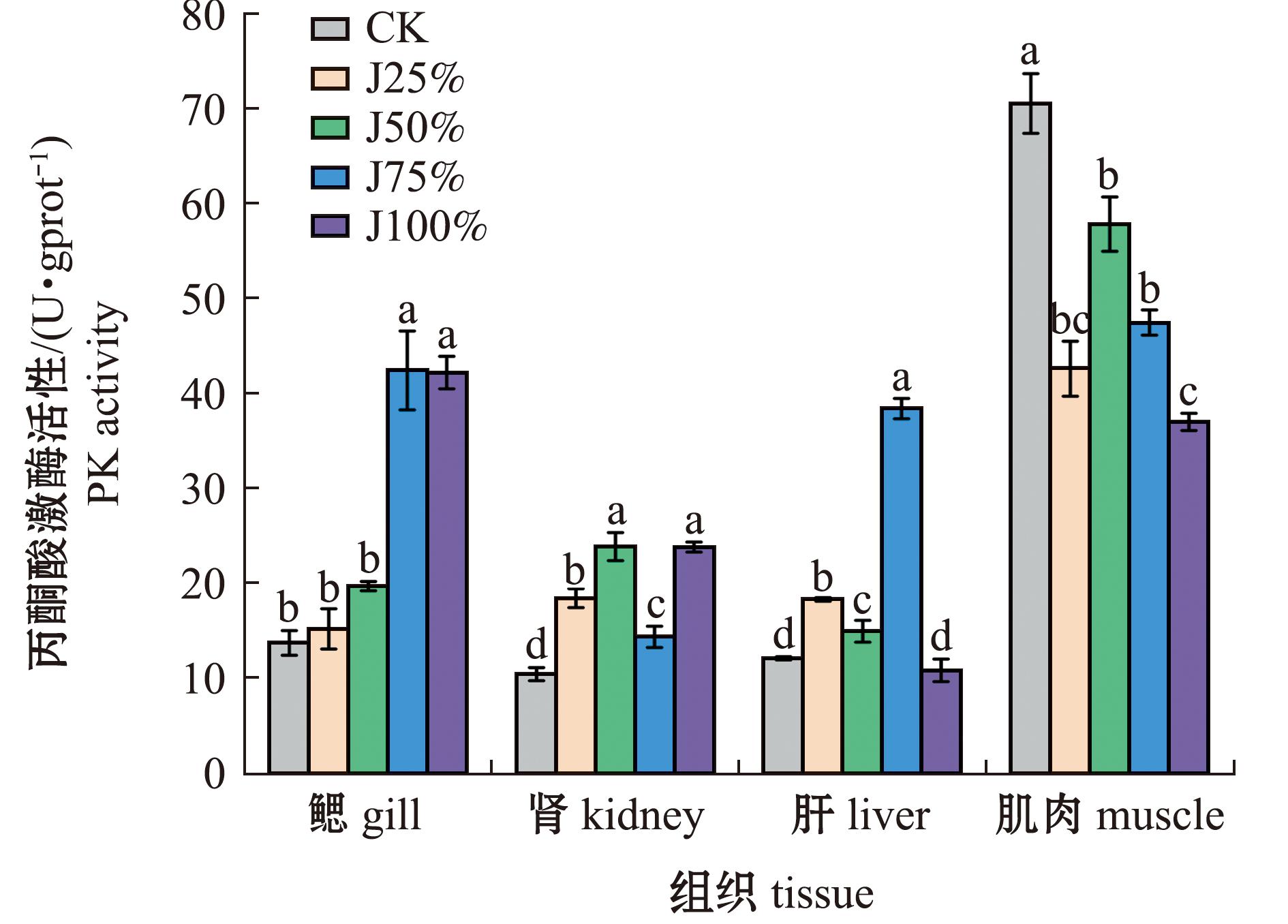
图2 碱度对青海湖裸鲤PK活性的影响
Fig.2 Effects of alkalinity on PK activity in Gymnocypris przewalskii
从图3可见,鱼鳃、肝中磷酸烯醇式丙酮酸羧激酶(PEPCK)活性随碱度呈先上升再降低再上升的变化趋势,鳃中J50%组PEPCK活性最高,与J100%组无显著性差异,且显著高于其他处理组(P>0.05),CK组最低;肝中J100%组最高,且显著高于其他处理组(P<0.05),J75%组最低;肾中PEPCK活性在J25%组和J75%组被显著提升(P<0.05),其他处理组间无显著性变化;肌中PEPCK活性被碱度抑制,在J25%组最强,PEPCK活性略高于CK组,J50%组最弱(P<0.05)。此外,鳃与肝中的PEPCK活性明显高于肾和肌。
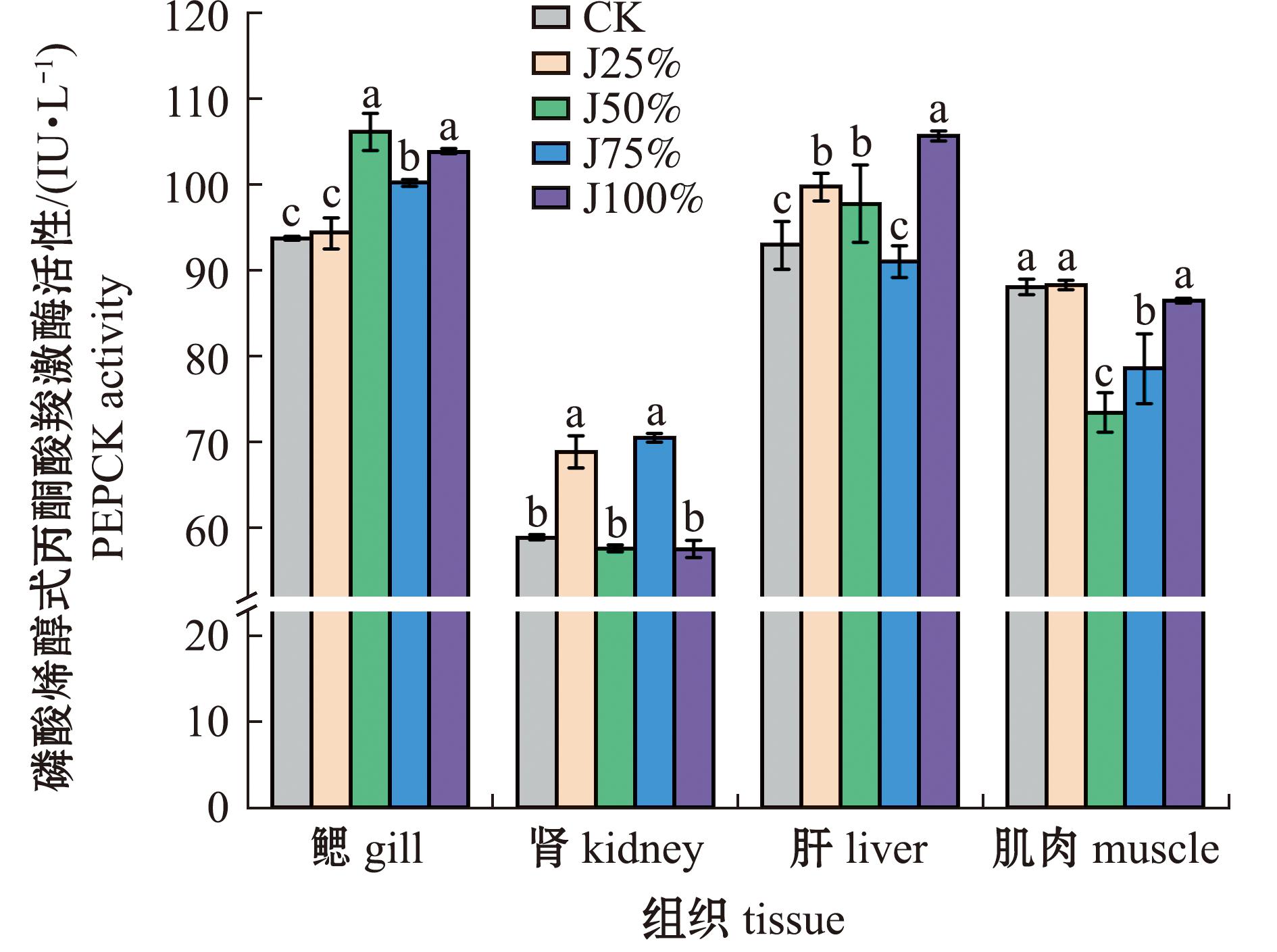
图3 碱度对青海湖裸鲤PEPCK活性的影响
Fig.3 Effects of alkalinity on PEPCK activity in Gymnocypris przewalskii
从图4可见,鱼鳃和肌中果糖-1,6-二磷酸醛缩酶(FBA)活性随碱度呈先上升再降低再上升趋势,鳃中J25%组FBA活性最高,与J100%组无显著性差异,J75%组活性最低并显著低于其他处理组(P<0.05);肌中J50%组FBA活性最高,显著高于其他处理组(P<0.05),CK组最低(P<0.05);两组织相比,肌肉中FBA活性随碱度变化更明显。肾和肝中FBA活性均随碱度上升而升高,均表现为CK组最低(P<0.05),J100%组最高。
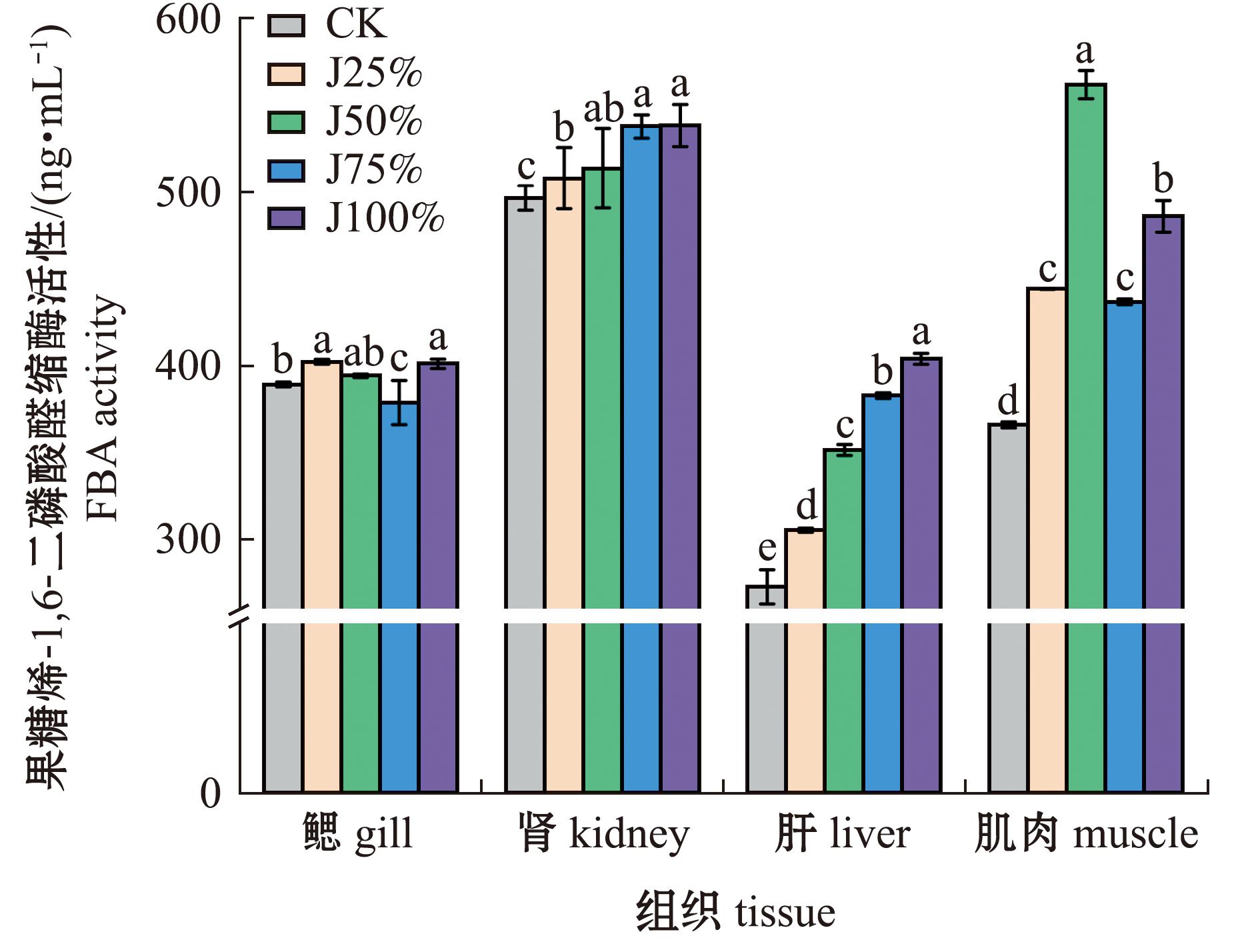
图4 碱度对青海湖裸鲤FBA活性的影响
Fig.4 Effects of alkalinity on FBA activity in Gymnocypris przewalskii
从图5可见,鱼鳃和肾中6-磷酸葡萄糖脱氢酶(G6PD)活性随碱度呈先上升再降低再上升的变化趋势,其中,鳃中G6PD活性在J25%组最高,且显著高于其他处理组(P<0.05),J50%组最低;肾中G6PD活性在J75%组最高(P<0.05),J50%组最低(P<0.05);肝中G6PD活性随碱度呈先升高再降低趋势,G6PD活性在J50%最高(P<0.05),CK组最低(P<0.05);肌中G6PD活性随碱度呈先降低再升高再降低的趋势,G6PD活性在J75%组最高(P<0.05),J100%组最低(P<0.05)。综合来看,鳃、肾、肝中G6PD活性整体被碱度提升,肌中G6PD活性则整体呈降低趋势。
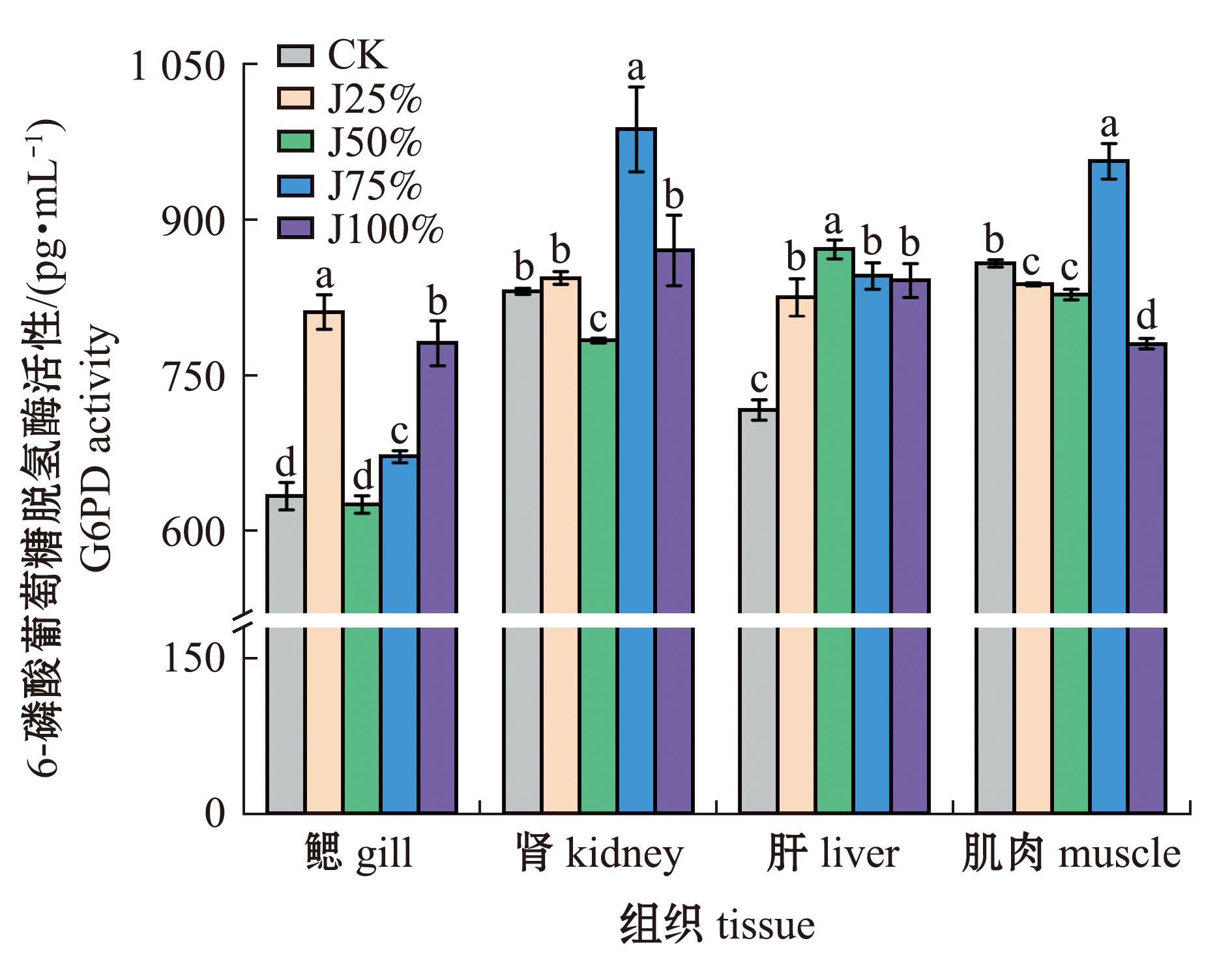
图5 碱度对青海湖裸鲤G6PD活性的影响
Fig.5 Effects of alkalinity on G6PD activity in Gymnocypris przewalskii
2.3 糖代谢热图综合分析
为总体分析各组织随碱度升高过程中糖代谢途径强弱,本研究综合上述指标分别做了热图分析。从图6可见,鳃组织中CK组糖代谢相关物质含量和活性均相对较低,J25%组G6PD、FBA活性和PA含量相对较高,J50%组PEPCK活性、PA含量相对较高,J75%组PK、HK活性和GLU含量相对较高,J100%组HK、PK、PEPCK、FBA和G6PD 五大糖代谢酶均有较高活性。肾组织中CK组糖代谢相关物质含量和活性均相对较低,J25%组PEPCK、HK、PK活性和PA、GLU含量相对较高,J50%组PK、HK活性和GLU含量相对较高,J75%组G6PD、FBA、PEPCK活性相对较高,J100%组除PEPCK活性较低外,其他物质的含量和活性均较高。肝组织中CK组PA含量相对较高,J25%组、J50%组中除PA含量外,所有指标均呈升高趋势。J75%组G6PD、FBA、PK、HK活性相对较高,J100%组G6PD、FBA、PEPCK、HK活性和PA含量相对较高。肌肉组织中CK组PEPCK、PK活性和PA、GLU含量相对较高,J25%组PEPCK活性和Gn含量相对较高,J50%组FBA、PK、HK活性相对较高,J75%组G6PD活性相对较高,J100%组糖代谢各指标均较低,肌肉组织中糖代谢整体呈减缓趋势。
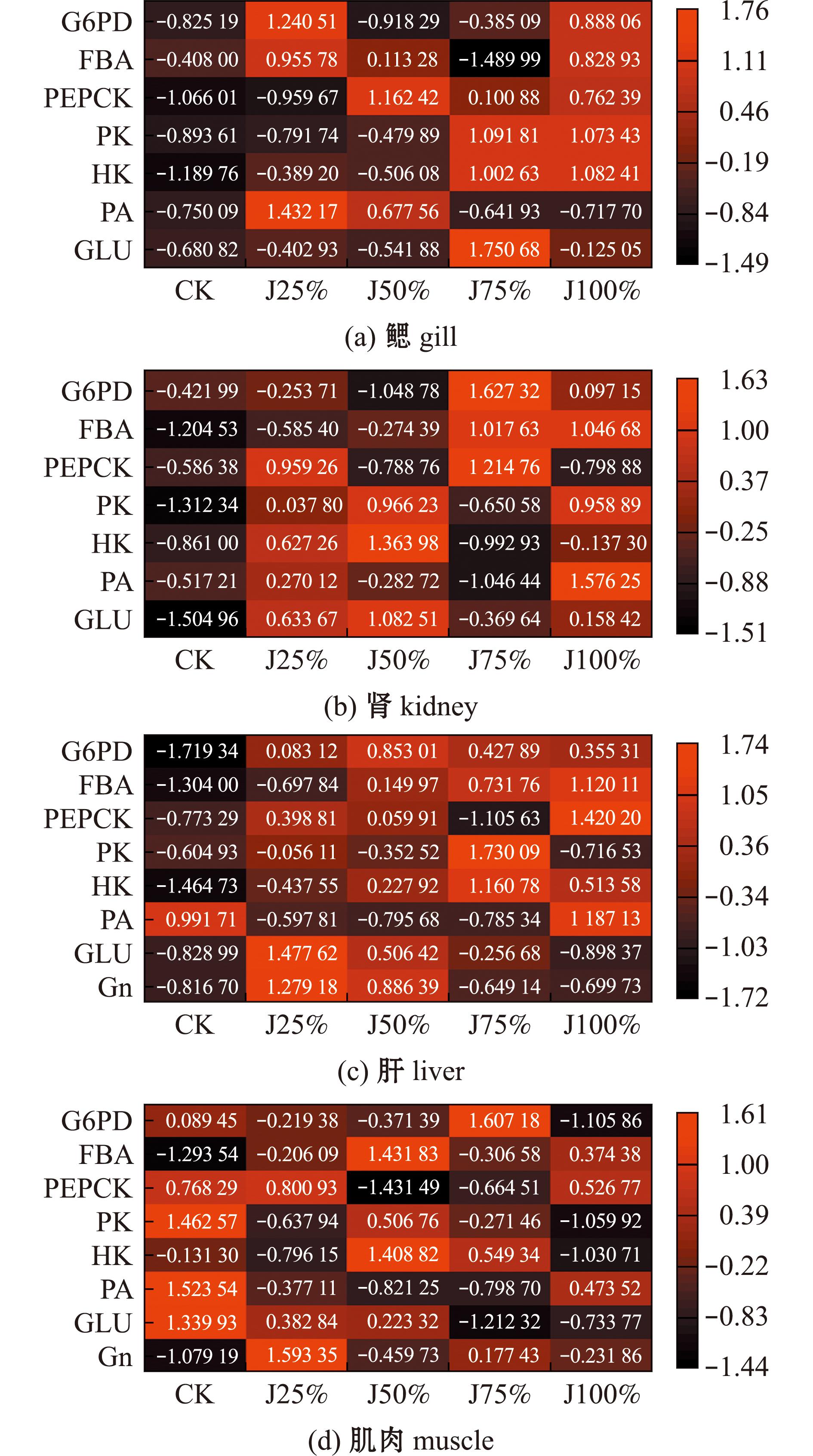
黑色代表物质含量低和酶活性低,红色代表物质含量高和酶活性高,图中数字代表该梯度下物质的相对含量和相对酶活性。
Black represents low substance content and low enzyme activity,while red represents high substance content and high enzyme activity,and the numbers in the graph represent the relative amount of the substance and the relative enzyme activity at that gradient.
图6 4个组织中糖代谢指标的热图分析
Fig.6 Heat map analysis of glucose metabolism indicators in the four major tissues
2.4 碱度对青海湖裸鲤基因fba-c表达的影响
从图7可见,淡水处理下,fba-c在鱼肌肉、鳃、肾、脾脏、心、肝脏、肠和脑等8个组织中均有表达。其中,肾中fba-c表达最高,其次是鳃和肠;在脑中表达最低。从图8(a)可见,随碱度的增加,鳃中fba-c表达量呈先升高再降低的变化趋势。其中,J75%组fba-c表达最高,显著高于其他处理组(P<0.05);J25%组fba-c表达最低。从图8(b)可见,肾中fba-c表达量随碱度呈先升高再降低的变化趋势。其中,J75%组fba-c表达最高,显著高于其他处理组(P<0.05);CK组最低(P<0.05)。随碱度的增加,鳃和肾中fba-c表达的变化趋势较为一致。
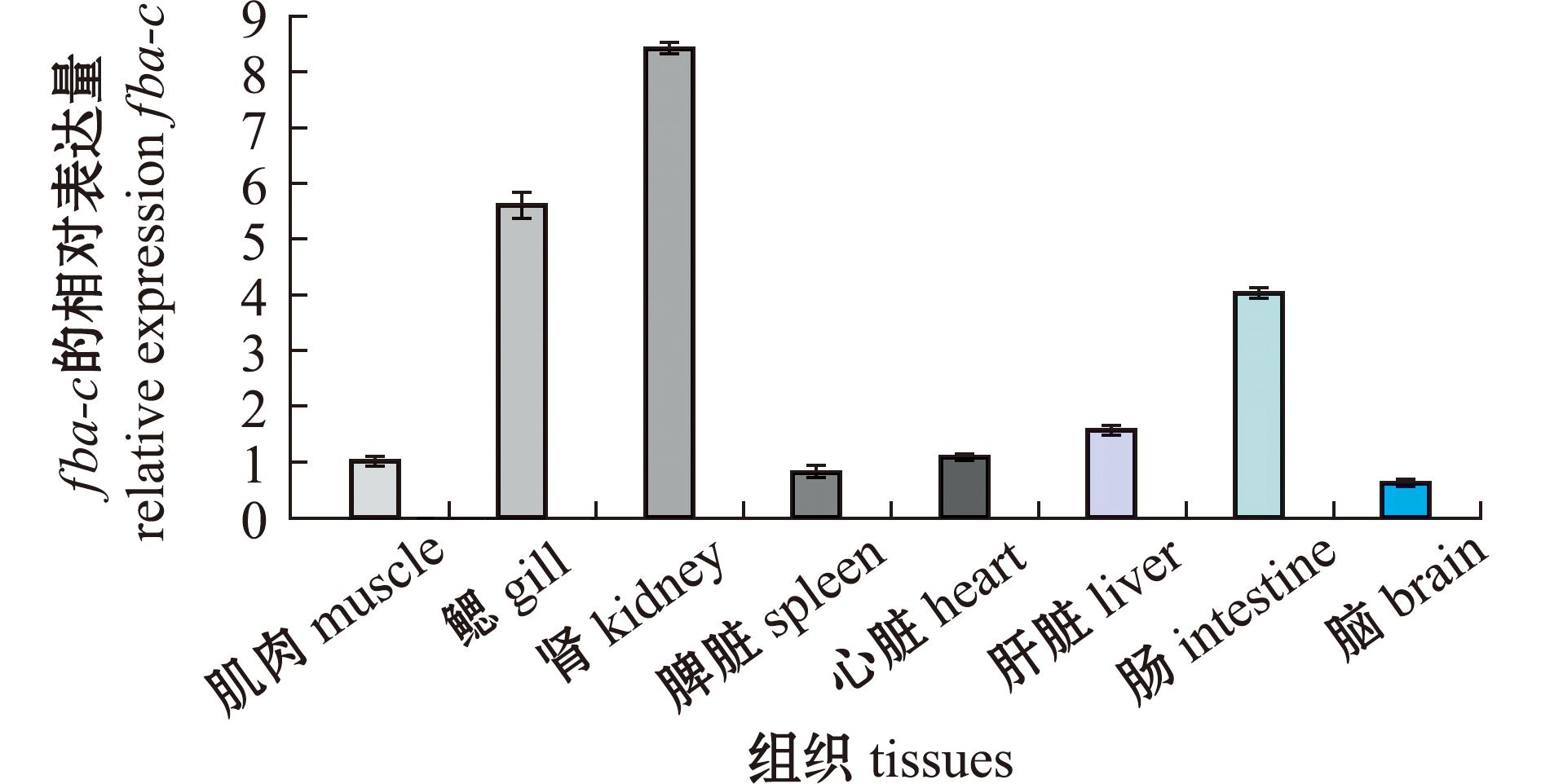
图7 青海湖裸鲤fba-c在淡水中的组织表达
Fig.7 Tissue expression of fba-c in freshwater of Gymnocypris przewalskii
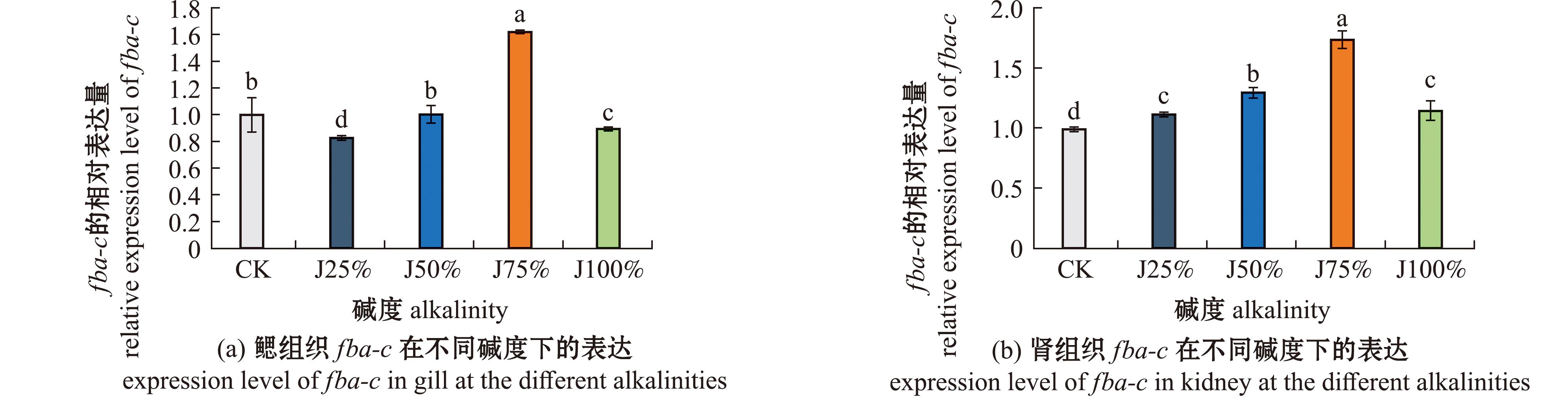
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences.
图8 青海湖裸鲤fba-c在不同碱浓度中的表达
Fig.8 Tissue expression of fba-c in Gymnocypris przewalskii at the different alkalinities concentrations
3 讨论
3.1 糖原、葡萄糖及丙酮酸对青海湖裸鲤碱胁迫的响应
糖原是糖类在体内的储存形式,主要以颗粒形式存在于细胞质中,其主要生理功能是氧化供能,也参与合成脂肪、氨基酸以及其他生理活性物质[16]。在本研究中,随碱度的上升,糖原含量呈先增加再降低的变化趋势。肝糖原在J25%组和J50%组含量较高,说明青海湖裸鲤可以轻松适应J25%~J50%的碱度范围,并不需要过多能量用于平衡此时的碱度环境,适宜的碱度对青海湖裸鲤生长生存并无影响,这也与青海湖裸鲤长期生存于青海湖中有关。淡水和碱度≥75%的环境中糖原含量相对较少,由于青海湖裸鲤可自由穿梭于青海湖及周边淡水河流[17],推测淡水中鱼体无需较多能量以适应环境,因而此时糖代谢过程不活跃。但水体碱度过高(≥75%)可对其造成胁迫,推测糖原大量进入糖酵解,能供增加以适应环境。这与徐志鑫[18]的研究相似,即当鱼体处于胁迫状态,肌肉和肝脏中的糖原将会积极地参与机体的能量消耗。本研究中,各处理组中肝糖原含量均明显高于肌糖原含量,说明肝脏在能量供应及机体平衡环境压力时具有重要作用。
糖、蛋白质和脂肪是鱼类能量的根本来源,其中,葡萄糖是机体组织所必需的燃料,葡萄糖氧化分解是重要供能途径[19]。本研究中,青海湖裸鲤鳃、肾和肝中GLU含量随碱度的增加呈先增加再降低的变化趋势,与糖原随碱度的变化相一致,说明适宜的碱度有利于GLU和糖原的合成,可促进生长。淡水中GLU含量较低,这与糖原含量相对应,表明此时糖原的合成与分解过程并不活跃,从而反映了淡水中鱼体无生存压力。鳃、肾是鱼体重要的渗透器官[20],碱度过高(≥75%)导致鱼体渗透压力增大,需要大量能量平衡渗透压力,鳃、肾等组织GLU进入糖酵解,含量减少。青海湖裸鲤肌肉中GLU呈逐渐降低的趋势,推测随着碱度的增加肌中GLU消耗增加或是糖代谢过程被抑制,所以逐渐减少。试验发现,在J25%~J50%环境下,青海湖裸鲤糖原和GLU含量普遍较高,推测该环境有利于青海湖裸鲤糖类的吸收与合成,促进生长发育。
PA是糖酵解的产物,它连接了细胞中的氧化和分解代谢,在细胞代谢网络中占有重要地位[21]。本试验中,青海湖裸鲤鳃中PA含量在CK组与J100%组较低。推测淡水中糖代谢过程不活跃,即鱼体无需过多的能量支持;推测J100%组中糖代谢过程活跃,即此时产生的PA已进入三羧酸循环,从而产生ATP,大量耗能。肾、肝和肌中PA含量均表现为CK组和J100%组较高。相较于J25%~J50%的环境,淡水环境下积累了大量PA,也说明淡水中GLU和糖原的合成较少,生长较缓慢。而J100%环境中PA合成较多,则很可能是环境压力增大,导致糖酵解过程活跃,能供需求增大。
3.2 糖代谢酶对青海湖裸鲤碱胁迫的响应
糖代谢酶是糖代谢途径中的重要基础物质,在鱼体糖代谢过程中起重要作用,HK和PK都是糖酵解反应中重要的限速酶[22]。本试验中,鱼鳃中HK和PK活性随碱度升高而上升,表明碱度胁迫下鳃中葡萄糖分解加快,从而能量供应增加。肾和肝中HK和PK活性随碱度均呈现先升高再降低的趋势;肌肉中HK活性随碱度先升高再降低,PK则呈降低趋势。肌肉中PK变化趋势与鳃、肾和肝呈相反趋势,说明这些组织中糖酵解被碱度激活,而肌肉中糖酵解被碱度抑制。该研究结果证实了鳃、肾、肝和肌肉均能通过糖酵解响应外界环境变化,鳃中糖酵解最明显[23]。此外,本研究中发现,青海湖裸鲤鳃中HK活性变化远大于其他组织,说明鳃组织响应碱度变化较其他组织更为明显[7]。
PEPCK是糖异生途径的关键限速酶,能催化草酰乙酸生成磷酸烯醇式丙酮酸,在维持动物血糖水平的稳定中起关键作用[24]。本研究发现,随碱度的升高,青海湖裸鲤鳃和肝中PEPCK活性明显上升,肾中PEPCK活性在J25%组和J75%组被明显促进,表明了鳃、肾、肝中糖异生可被碱度促进。肌肉中PEPCK活性呈降低趋势,表明肌肉中糖异生可被碱度抑制。此外,本研究中还发现,青海湖裸鲤肝和鳃中的PEPCK活性要高于肾和肌肉。这可能是因为肝脏是鱼类代谢的主要器官,也是鱼类重要的营养储存场所[25],鳃则直接与环境接触,参与呼吸、渗透等过程,因此可能导致肝和鳃中PEPCK活性较其他组织高。本研究中,青海湖裸鲤鳃、肝中PEPCK均在J100%时有较高活性,结合HK和PK变化趋势,表明鱼体的糖异生和糖酵解过程在J100%的环境下较为活跃,这可能是因为鱼体急需糖酵解和糖异生通路中产生的中间物质进入其他生理过程,从而适应J100%的碱度环境。
磷酸戊糖途径是糖代谢的重要途径,是生物体内葡萄糖分解的一种机制[26]。G6PD是催化磷酸戊糖途径的首要关键酶,能够催化还原型辅酶Ⅱ(NADPH)的合成,与能量平衡、生长速率和细胞活力等密切相关[27]。本研究中发现,所有碱度均促进了青海湖裸鲤鳃、肾和肝中的G6PD活性。鳃中G6PD在J25%和J100%组活性最高,表明此时磷酸戊糖途径活跃,从而产生大量的NADPH,为细胞的各种合成反应提供还原力。肾和肝中G6PD活性被碱度普遍提升,这说明肾和肝能通过磷酸戊糖途径响应碱胁迫,碱度可激活鱼体肾和肝中的磷酸戊糖途径。G6PD活性上升将使得磷酸戊糖途径产生许多中间产物,从而为其他物质的合成提供基础原料,有助于鱼体适应碱度变化。其中,达到G6PD活性的最高点不同,可能是不同组织响应碱胁迫的速度不同。肌肉中G6PD活性整体被碱度抑制,但在J75%组有明显的升高。表明在碱度胁迫下,肌肉参与磷酸戊糖途径较其他组织弱,这也可能与肌肉中GLU减少相关,底物减少G6PD酶活性相应下降。总之,各组织G6PD活性随碱度的变化而变化,表明磷酸戊糖途径也参与了青海湖裸鲤耐碱过程;此外,磷酸戊糖途径氧化分解释放能量[28],也可以和糖酵解、糖异生及三羧酸循环相互补充、相互配合,增加鱼体的适应能力。
FBA是生物体新陈代谢过程中的一种关键酶,该反应既存在于糖酵解和糖异生途径中又存在于磷酸戊糖循环途径中[29]。本研究中,随碱度的升高,青海湖裸鲤鳃、肾、肝和肌肉中FBA活性均呈升高趋势,表明鱼体糖代谢过程中糖酵解、糖异生和磷酸戊糖途径被碱度激活。随着碱度的上升,糖代谢作用逐渐增强,J100%时最为明显。其中,肝和肌肉中FBA活性变化远大于鳃和肾。这可能是因为FBA并非糖酵解和糖异生过程中的关键酶,只需在鳃、肾组织中维持相对自身较高表达即可,关键还是HK、PK等关键酶通过糖代谢响应碱度变化。此外,肝脏和肌肉是糖原储存的主要器官[30],因而也可能使FBA表现出较高的活性。
3.3 热图糖代谢综合分析
本研究为青海湖裸鲤碱度胁迫下的糖代谢研究,试验所测8种物质涵盖了糖原合成分解、糖酵解、糖异生、三羧酸循环及磷酸戊糖途径等过程,对于鱼体糖代谢极为重要。研究结果表明,青海湖裸鲤鳃组织在J25%时磷酸戊糖途径活跃,PA含量大量增加,这可能是因为鱼体鳃组织直接接触碱度环境导致的。磷酸戊糖途径活跃可以产生大量糖代谢过程中的中间产物,从而为鱼体耐碱提供基础原料。鳃组织在J50%时糖异生过程最活跃,PA含量开始减少,此时鱼体鳃组织无需过多能量便可适应环境,有助于鱼体生长。J75%时鳃中糖酵解增强,可能此时的碱度已对鱼体鳃组织造成了压迫,糖酵解过程的增强为鳃组织提供了能量,从而适应碱度环境。J100%时鳃中糖酵解、糖异生和磷酸戊糖途径均较强,此时PA含量急剧减少说明三羧酸循环过程变得活跃;这里推测鳃通过糖酵解已无法提供充足的能量,大量PA进入三羧酸循环,葡萄糖彻底氧化分解,为鱼体供应大量能量以适应碱度环境。碱度上升过程中,鳃中糖酵解逐步增强,表明能量供应在鳃组织应对碱度胁迫时极为重要,此外充足的能量也可能在一定程度上减少鳃组织器质性损伤[31]。肾组织在J25%时糖酵解和糖异生途径活跃,在J50%时糖酵解途径活跃,在J25%和J50%组GLU和PA含量也相对较高。说明在J25%~J50%环境下,糖酵解和糖异生动态过程被提高,产生GLU,有助于鱼体生长发育。在J75%环境下糖异生和磷酸戊糖途径可为鱼体适应碱度产生中间物质,同时也可产生NADPH为肾组织代谢提供还原力。在J100%时糖酵解和磷酸戊糖途径活跃,肾中糖酵解的供能可增强鱼体渗透能力,大量能量用于平衡环境压力,不利于鱼体生长生存。随碱度的升高,肝组织中糖代谢过程逐渐增强,在J25%和J50%环境下,GLU和糖原含量较高,PA含量较少,说明在该环境下肝脏糖异生占主导,有助于肝脏合成能量物质,进而促进生长发育。在J75%和J100%的环境下,GLU和糖原含量较少,PA含量逐渐增多,说明碱度超过J75%后,鱼体肝脏糖酵解和磷酸戊糖途径糖占主导,释放大量能量维持鱼体基本生命活动,此外,磷酸戊糖途径产生的NADPH也可提升鱼体免疫和解毒能力[32]。随碱度的升高,肌肉组织中糖代谢过程整体呈减弱趋势。在淡水中糖酵解、糖异生最强,在J50%时糖酵解活跃,在J75%时磷酸戊糖途径活跃,在J100%时糖代谢过程最弱。肌肉中糖代谢过程明显不同于鳃、肾和肝,可能是在淡水环境中鱼体运动增加,肌肉供能较强,从而导致糖代谢过程较强;而在J100%的环境运动较弱,肌肉糖代谢过程减弱,推测鱼体受胁迫压力巨大,大量能量用于平衡环境压力,而无能量用于自身运动。这与本研究中胁迫试验时所观察到的现象相吻合,当碱度超过J75%时,青海湖裸鲤的运动能力大为减弱,并出现死亡现象,这表明鱼体此时的生长生存遭受巨大威胁。此外,幼鱼摄食速度有明显减缓,但摄食量无明显变化,因此对本试验中所测鱼体糖原及葡萄糖变化无明显影响(图9)。

图9 糖代谢网络简图
Fig.9 Sketch diagram of the glucose metabolism network
3.4 基因fba-c对青海湖裸鲤碱胁迫的响应
FBA是普遍存在于生物体内的一种代谢酶,对糖酵解和糖异生至关重要[29]。而醛缩酶C主要作为糖酵解关键酶[33],当环境对鱼体造成压力时,其可以通过控制糖酵解过程从而控制鱼体能量供应,使鱼体平衡环境压力,适应各种环境。本研究中,fba-c在青海湖裸鲤鳃、肾、肝、肠、肌、脑、脾脏和心脏中均有表达,表达具有普遍性。但fba-c在不同组织中的表达量不同,在肾中表达量最高,这与王志刚等[34]在翘嘴红鲌中的研究结果相一致。其次,在鳃和肠中也有较高表达,脾脏和脑中表达较低。随碱度的增加,鳃和肾中fba-c均呈现先上升再降低,整体呈促进趋势。这说明碱胁迫提高了fba-c表达,从而促进鱼体糖代谢,进而适应碱度环境。这里肾中fba-c的表达量与FBA活性变化关系大致相似,说明碱度上升过程中糖代谢过程变得活跃。然而,鳃中fba-c的表达量与FBA活性变化趋势略有差异,但变化趋势类似。这可能是因为鱼体鳃组织直接接触外界碱环境,导致鳃中FBA酶活性变化先于基因fba-c的表达,从而出现不同步的现象。
4 结论
1)碱度能促进青海湖裸鲤的鳃、肾和肝中糖代谢,在碱度为J25%~J50%的环境下,鱼体糖代谢有助于糖原的合成,从而促进生长发育;当碱度超过J75%后,糖代谢供能协助鱼体应对碱度胁迫,糖储存减少,不利于生长生存。
2)肌肉中糖代谢随碱度的增加呈减弱趋势,说明鱼可能通过减少自身运动进而将能量用于应对碱度胁迫。
[1] 梁健,陈雪妍,卫唯,等.青海湖裸鲤TOB1和TOB2基因的克隆与表达分析[J].西北农林科技大学学报(自然科学版),2020,48(5):31-41.LIANG J,CHEN X Y,WEI W,et al.Cloning and expression analysis of TOB1 and TOB2 genes in naked carp (Gymnocypris przewalskii) in Qinghai Lake[J].Journal of Northwest A &F University (Natural Science Edition),2020,48(5):31-41.(in Chinese)
[2] WOOD C M,DU J Z,ROGERS J,et al.Przewalski’s naked carp (Gymnocypris przewalskii):an endangered species taking a metabolic holiday in Lake Qinghai,China[J].Physiological and Biochemical Zoology:PBZ,2007,80(1):59-77.
[3] ALFONSO S,GESTO M,SADOUL B.Temperature increase and its effects on fish stress physiology in the context of global warming[J].Journal of Fish Biology,2021,98(6):1496-1508.
[4] 周凯.高温胁迫下虾夷扇贝GSK-3β调节糖代谢和细胞凋亡的功能研究[D].大连:大连海洋大学,2022.ZHOU K.Study on the function of Gsk-3β in regulating glucose metabolism and apoptosis under high temperature stress in Yesso scallop(Patinopecten yessoensis)[D].Dalian:Dalian Ocean University,2022.(in Chinese)
[5] 杨艳羽.抗生素氟苯尼考对斑马鱼糖代谢的干扰及机制研究[D].青岛:青岛理工大学,2023.YANG Y Y.Interference of antibiotic florfenicol on glucose metabolism of Zebrafish and the underlying mechanism[D].Qingdao:Qingdao University of Technology,2023.(in Chinese)
[6] 曾会玲.水体锌暴露对斜带石斑鱼胚胎糖代谢的影响[D].海口:海南大学,2020.ZENG H L.Waterborne Zinc (67Zn) exposure influencing embryos glucose metabolism in grouper (Epinephelus coioides)[D].Haikou:Hainan University,2020.(in Chinese)
[7] 邢晓丹.大弹涂鱼适应盐度胁迫的糖代谢模式及葡萄糖和二甲双胍的调控作用研究[D].舟山:浙江海洋大学,2018.XING X D.Study on the glucose metabolism of Boleophthalmus pectinirosris adapted to salinity stress and regulation by glucose and metformin[D].Zhoushan:Zhejiang Ocean University,2018.(in Chinese)
[8] 王晓丹.凡纳滨对虾适应低盐度胁迫的糖营养和糖代谢研究[D].上海:华东师范大学,2017.WANG X D.Carbohydrate metabolism and regulation in Litopenaeus vannamei at low salinity[D].Shanghai:East China Normal University,2017.(in Chinese)
[9] 衣晓飞,来琦芳,史建全,等.高碱环境下青海湖裸鲤氮废物排泄及相关基因的表达规律[J].中国水产科学,2017,24(4):681-689.YI X F,LAI Q F,SHI J Q,et al.Nitrogenous waste excretion and gene expression of nitrogen transporter in Gymnocypris przewalskii in high alkaline environment[J].Journal of Fishery Sciences of China,2017,24(4):681-689.(in Chinese)
[10] WEI F L,LIANG J,TIAN W G,et al.Transcriptomic and proteomic analyses provide insights into the adaptive responses to the combined impact of salinity and alkalinity in Gymnocypris przewalskii[J].Bioresources and Bioprocessing,2022,9(1):104.
[11] 许保可,阿琳林,张海琛,等.青海湖裸鲤TNNI1和TNNI2基因克隆及其响应盐碱胁迫的表达研究[J].西北农林科技大学学报(自然科学版),2023,51(10):1-10.XU B K,A L L,ZHANG H C,et al.Cloning of TNNI1 and TNNI2 genes of Gymnocypris przewalskii and expression analysis in response to salinity-alkali stress[J].Journal of Northwest A &F University (Natural Science Edition),2023,51(10):1-10.(in Chinese)
[12] LINLIN A,ZHANG Y J,XU B K,et al.Comprehensive analyses of annexins in naked carp (Gymnocypris przewalskii) unveil their roles in saline-alkaline stress[J].Aquaculture,2024,579:740175.
[13] 张海琛,马清花,许保可,等.青海湖裸鲤盐碱耐受过程中的渗透、免疫、代谢相关基因筛选和分析[J].水产学报,2023,47(12):19-38.ZHANG H C,MA Q H,XU B K,et al.Screening and analysis of the osmotic,immune,metabolic related genes of Gymnocypris przewalskii in saline-alkali tolerance[J].Journal of Fisheries of China,2023,47(12):19-38.(in Chinese)
[14] 阿琳林,张海琛,许保可,等.碱度胁迫对青海湖裸鲤血清生理生化指标的影响[J].南方农业学报,2023,54(7):2164-2174.A L L,ZHANG H C,XU B K,et al.Effects of alkalinity stress on serum physiological indexes of Gymnocypris przewalskii[J].Journal of Southern Agriculture,2023,54(7):2164-2174.(in Chinese)
[15] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J].Methods,2001,25(4):402-408.
[16] 杨丽萍,郑文佳,秦超彬,等.饲料糖脂比对吉富罗非鱼生长、血液指标和肝脏糖代谢关键酶活性及基因表达的影响[J].水产学报,2016,40(9):1376-1386.YANG L P,ZHENG W J,QIN C B,et al.Effects of dietary carbohydrate-to-lipid ratios on growth,blood biochemical indices,key enzymes activity and gene expression of hepatic glucose metabolism of juvenile GIFT Oreochromis niloticus[J].Journal of Fisheries of China,2016,40(9):1376-1386.(in Chinese)
[17] 汪洋,方弟安,匡箴,等.青海湖裸鲤仔稚鱼耳石结构特征与早期生长相关性分析[J].大连海洋大学学报,2024,39(1):20-28.WANG Y,FANG D A,KUANG Z,et al.Correlation between otolith structure and early growth of Gymnocypris przewalskii larvae and juveniles[J].Journal of Dalian Ocean University,2024,39(1):20-28.(in Chinese)
[18] 徐志鑫.盐度胁迫下尼罗罗非鱼的能量代谢及其胆固醇营养的研究[D].上海:华东师范大学,2017.XU Z X.Energy metabolism and cholesterol nutrition of Nile tilapia Oreochromis niloticus under salinity stress[D].Shanghai:East China Normal University,2017.(in Chinese)
[19] YANG M X,DENG K Y,PAN M Z,et al.Glucose and lipid metabolic adaptations during postprandial starvation of Japanese flounder Paralichthys olivaceus previously fed different levels of dietary carbohydrates[J].Aquaculture,2019,501:416-429.
[20] 仲勇.盐度影响金钱鱼生长及渗透相关基因的表达[D].上海:上海海洋大学,2019.ZHONG Y.Effects of salinity on growth and osmotic gene expression in spotted scat(Scatophagus argus)[D].Shanghai:Shanghai Ocean University,2019.(in Chinese)
[21] 沈建霖.拟南芥丙酮酸转运体AtMPC1介导植物干旱胁迫响应机制研究[D].济南:山东大学,2018.SHEN J L.The mechanism investigation of arabidopsis mitochondrial pyruvate carrier 1 in plant drought response[D].Jinan:Shandong University,2018.(in Chinese)
[22] 肖威,单洪伟,马甡,等.亚硝态氮慢性胁迫对凡纳滨对虾体成分和糖代谢的影响[J].渔业科学进展,2020,41(6):74-81.XIAO W,SHAN H W,MA S,et al.Effects of chronic nitrite stress on body composition and glucose metabolism of Litopenaeus vannamei[J].Progress in Fishery Sciences,2020,41(6):74-81.(in Chinese)
[23] PFEIFFER-GUGLIELMI B,FLECKENSTEIN B,JUNG G,et al.Immunocytochemical localization of glycogen phosphorylase isozymes in rat nervous tissues by using isozyme-specific antibodies[J].Journal of Neurochemistry,2003,85(1):73-81.
[24] 俞菊华,戈贤平,唐永凯,等.碳水化合物、脂肪对翘嘴红鲌PEPCK基因表达的影响[J].水产学报,2007,31(3):369-373.YU J H,GE X P,TANG Y K,et al.Effects of carbohydrate,lipid in diets on the PEPCK gene expression of Eryghroculter ilishaeformis[J].Journal of Fisheries of China,2007,31(3):369-373.(in Chinese)
[25] 刘襄河,叶超霞,沈碧端,等.饲料中糖/脂肪比对暗纹东方 幼鱼生长、血液指标、肝代谢酶活性及PEPCK基因表达的影响[J].水产学报,2014,38(8):1149-1158.LIU X H,YE C X,SHEN B D,et al.Effect of dietary carbohydrate-to-lipid ratio on growth,blood biochemical indices,hepatic metabolic enzymes and PEPCK gene expression of juvenile obscure puffer(Takifugu obscurus)[J].Journal of Fisheries of China,2014,38(8):1149-1158.(in Chinese)
幼鱼生长、血液指标、肝代谢酶活性及PEPCK基因表达的影响[J].水产学报,2014,38(8):1149-1158.LIU X H,YE C X,SHEN B D,et al.Effect of dietary carbohydrate-to-lipid ratio on growth,blood biochemical indices,hepatic metabolic enzymes and PEPCK gene expression of juvenile obscure puffer(Takifugu obscurus)[J].Journal of Fisheries of China,2014,38(8):1149-1158.(in Chinese)
[26] 张文静,丑天胜,刘芳,等.金针菇戊糖磷酸途径的关键基因表达分析[J].基因组学与应用生物学,2019,38(12):5542-5549.ZHANG W J,CHOU T S,LIU F,et al.Expression analysis of key genes in pentose phosphate pathway of Flammulina velutipes[J].Genomics and Applied Biology,2019,38(12):5542-5549.(in Chinese)
[27] HU W,ZHI L,ZHUO M Q,et al.Purification and characterization of glucose 6-phosphate dehydrogenase (G6PD) from grass carp (Ctenopharyngodon idella) and inhibition effects of several metal ions on G6PD activity in vitro[J].Fish Physiology and Biochemistry,2013,39(3):637-647.
[28] 焦雅琪.邻苯二甲酸单丁酯对斑马鱼(Danio rerio)的毒性效应机制[D].哈尔滨:东北农业大学,2021.JIAO Y Q.Toxic effect mechanism of monobutyl phthalate on Zebrafish(Danio rerio)[D].Harbin:Northeast Agricultural University,2021.(in Chinese)
[29] 肖舒文,胡永红.果糖-1,6-二磷酸醛缩酶的研究进展[J].河北师范大学学报(自然科学版),2022,46(3):297-303.XIAO S W,HU Y H.Research progress of fructose-1,6-bisphosphate aldolase[J].Journal of Hebei Normal University (Natural Science Edition),2022,46(3):297-303.(in Chinese)
[30] LIAO X L,CHENG L,XU P,et al.Transcriptome analysis of crucian carp (Carassius auratus),an important aquaculture and hypoxia-tolerant species[J].PLoS One,2013,8(4):e62308.
[31] 周伟江,常玉梅,梁利群,等.氯化钠盐度和碳酸氢钠碱度对达里湖鲫毒性影响的初步研究[J].大连海洋大学学报,2013,28(4):340-346.ZHOU W J,CHANG Y M,LIANG L Q,et al.Toxic effects of salinity (NaCl) and alkalinity (NaHCO3)on crucian carp Carassius auratus Linnaeus in Dali Lake[J].Journal of Dalian Ocean University,2013,28(4):340-346.(in Chinese)
[32] MENG S L,CHEN J Z,HU G D,et al.Effects of chronic exposure of methomyl on the antioxidant system in liver of Nile tilapia (Oreochromis niloticus)[J].Ecotoxicology and Environmental Safety,2014,101:1-6.
[33] LEBHERZ H G,RUTTER W J.Distribution of fructose diphosphate aldolase variants in biological systems[J].Biochemistry,1969,8(1):109-121.
[34] 王志刚,刘士力,李贤露,等.翘嘴红鲌(Erythroculter ilishaeformis)果糖-1,6-二磷酸醛缩酶(ALDO-C)基因定位、克隆及表达分析[J].海洋与湖沼,2019,50(5):1138-1145.WANG Z G,LIU S L,LI X L,et al.Location,cloning and expression analysis of aldo-c gene in Erythroculter ilishaeformis[J].Oceanologia et Limnologia Sinica,2019,50(5):1138-1145.(in Chinese)