虾夷扇贝(Patinopecten yessoensis)隶属于软体动物门(Mollusca)瓣鳃纲(Lamellibranchia)珍珠贝目 (Pteriodia)扇贝科 (Pectinidae),是一种大型冷水型双壳扇贝,广泛分布于日本北海道和本州北部,以及俄罗斯远东和朝鲜海域[1]。1982年由辽宁省水产研究所从日本引进,由于虾夷扇贝营养价值高,个体大,具有较高的经济价值,现已成为中国北方海水增养殖的重要水产经济贝类[2]。近年来,养殖虾夷扇贝因病毒、细菌和寄生虫等病原生物的感染而大量死亡,造成严重经济损失[3-4]。其中,一些多毛类蠕虫[如才女虫(Polydora)]寄生在虾夷扇贝的贝壳中,通过分泌酸性物质与刚毛摩擦在贝壳上穿凿孔洞,使贝壳变得脆弱易碎、充满泥垢,影响扇贝的呼吸、摄食和生长发育;严重时还会侵染扇贝软体部,造成器官炎症,组织脓肿,进而引发各种细菌性疾病,危害扇贝的生存[4-5]。虽然才女虫侵染直接造成的高死亡率并不常见,但是携带才女虫的贝类更易受到二次应激的影响,如捕食、疾病和环境应激等[6]。目前,才女虫病已成为虾夷扇贝养殖中最严重的病害之一。据报道,大连獐子岛海域有90%的虾夷扇贝遭受不同程度才女虫的侵染,严重影响了虾夷扇贝的质量和产量,降低了其市场价值,给虾夷扇贝养殖业造成较大的损失[7]。由于才女虫强盛的繁殖特性和扇贝开放的生长环境,至今仍未获得防治才女虫病的有效方法。因此,开展虾夷扇贝抗才女虫病分子机制研究,对虾夷扇贝才女虫病害防治及抗病良种选育具有重要意义。
组织蛋白酶B(Cathepsin B,CatB),是木瓜蛋白酶家族的一种溶酶体半胱氨酸蛋白酶,属于C1肽酶家族,具有内肽酶和二肽基羧基肽酶活性和重要的免疫功能[8-9]。CatB由一种非活性的前体酶合成,在溶酶体中由6-磷酸甘露糖受体识别后,在酸性条件下被活化[10]。在脊椎动物中,CatB是研究最为深入的细胞内酸性半胱氨酸蛋白[11],大量研究表明,其在人类癌症、肿瘤、心血管疾病、胎盘发育和寄生虫感染等条件下差异表达[12-16],诊疗中CatB还作为诊断标志物和治疗靶点使用。CatB参与广泛的生理过程,包括抗原的加工处理、能量代谢、细胞内蛋白质的降解及免疫应答等[17-18]。在海洋生物中,CatB被认为与生物的营养消化[19-20]、生长发育[21-22]和免疫[17,20,23]等过程有关。在贝类中,CatB被证明参与贝类的先天免疫过程[24],但在扇贝抵御才女虫侵染中的功能研究还未见报道。本研究中前期对健康及感染才女虫虾夷扇贝的蛋白质组学分析发现,CatB在患病扇贝外套膜组织中显著上调表达,推测其在虾夷扇贝先天免疫应答中发挥重要作用。为进一步探索CatB在虾夷扇贝应答才女虫侵染中的分子功能,本研究中进行了虾夷扇贝CatB基因的基因组鉴定,解析了虾夷扇贝CatB基因的基因结构及序列特征,阐释了其系统进化地位,解析了虾夷扇贝CatB基因的组织表达模式及其在感染才女虫个体中的酶活性和基因表达变化特征,以期为虾夷扇贝应答才女虫的分子机制研究提供更多依据。
1 材料与方法
1.1 材料
试验所需扇贝样品采自辽宁大连獐子岛海域,收集2龄健康和感染才女虫虾夷扇贝(图1)。两组虾夷扇贝取回后,在实验室10 ℃过滤海水条件下暂养一周,并向海水中不断充氧,每天投喂两次小球藻(Chlorella sp.),并更换一次海水。之后解剖获取健康及患病虾夷扇贝的左侧边缘膜、左侧中央膜、右侧边缘膜、右侧中央膜、鳃丝、肝胰腺、肾、血淋巴细胞、性腺和闭壳肌10个组织,立即在液氮中冷冻,并储存在-80 ℃的冰箱中用于后续试验。
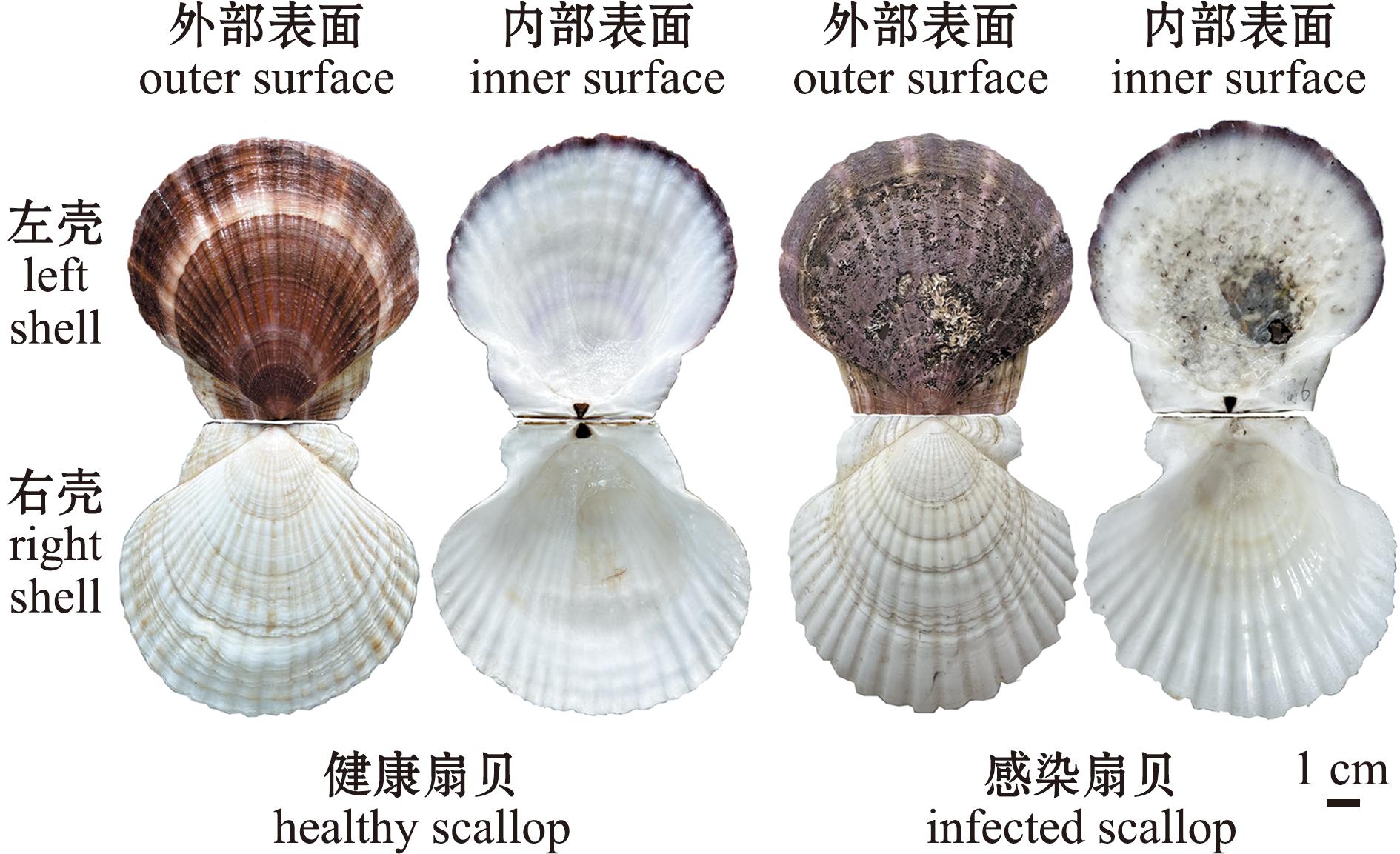
图1 健康和感染才女虫虾夷扇贝的贝壳
Fig.1 Shells of healthy and Polydora-infected scallops
1.2 方法
1.2.1 虾夷扇贝CatB基因的生物信息学分析 从NCBI(http://www.ncbi.nlm.nih.gov)、MolluscDB(http://mgbase.qnlm.ac/home)等数据库中分别下载脊椎动物和无脊椎动物不同物种的CatB蛋白序列,包括智人(Homo sapiens,NP_001371655.1)、小家鼠(Mus musculus,AAA37375.1)、非洲爪蟾(Xenopus laevis,NP_001079570.1)、高山蛙(Nanorana parkeri,XP_018425124.1)、斑马鱼(Danio rerio,AAQ97764.1)、点带石斑鱼(Epinephelus coioides,AHF27212.1)、南美白对虾(Penaeus vanname,ADI80349.1)、日本沼虾(Macrobrachium nipponense,AEC22812.1)、合浦珠母贝(Pinctada fucata,ADX32985.1)、海湾扇贝(Argopecten irradians,ANG56311.1)、欧洲大扇贝(Pecten maximus,XP_033726865.1)、虾夷扇贝(P.yessoensis,XP_021377571.1)、中国真蛸(Octopus sinensis,XP_029635157.1)、双班蛸(Octopus bimaculoides,XP_014776577.1)、美洲牡蛎(Crassostrea virginica,XP_022304323.1)、近江牡蛎(Crassostrea ariakensis,AEJ08755.1)、软壳蛤(Mya arenaria,XP_052763609.1)、文蛤(Meretrix meretrix,ACB38229.1)、皱纹盘鲍(Haliotis discus hannai,XP_021377571.1)和红鲍(Haliotis rufescens,XP_046350891.1)等。采用ORF finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)在线软件确定 CatB基因的开放阅读框,并预测其氨基酸序列。利用NCBI Conserved Domain Database(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线软件预测CatB蛋白的保守结构域。通过ExPasy(http://web.expasy.org/compute_pi/)预测CatB蛋白的分子量和等电点。采用Geneious 4.8.4软件预测CatB蛋白质的二级结构,并用在线软件Phyre2(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi?id=index/)推测其三级结构。利用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)在线软件预测CatB蛋白的信号肽序列,并用在线软件DeepTMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构。利用DNAStar软件进行不同物种CatB蛋白序列的多序列比对,利用MEGA 11软件构建系统进化树。
1.2.2 CatB酶活性测定 选用Cathepsin B Activity Assay试剂盒(Fluorometric)(Abcam)测定健康及患病虾夷扇贝左外套膜CatB酶活性。将10 mg贝新鲜组织(冰上解冻)置于100 μL裂解缓冲液中进行匀浆,4 ℃下高速离心5 min,收集上清。将50 μL上清液样品、50 μL反应液和2 μL荧光底物依次加入到酶标板中,37 ℃下避光放置2 h。CatB裂解缓冲液作为空白对照。每个反应设置3个重复,健康组和患病组各选择3个个体作为生物学重复。使用多功能酶标仪(柏楉)在激发波长400 nm与发射波长505 nm下测定荧光强度,计算各样品酶活性,比较健康和患病扇贝外套膜酶活性变化情况。
1.2.3 RNA的提取及实时荧光定量PCR分析 采用海洋动物RNA提取试剂盒(TIANGEN)提取健康与患病虾夷扇贝左侧边缘膜、左侧中央膜、右侧边缘膜、右侧中央膜、肾、肝胰腺、血淋巴细胞、鳃丝、性腺和闭壳肌等10个组织的RNA,利用琼脂糖凝胶电泳检测RNA的完整性,利用NV3000 型显微分光光度计(Vastech)测定RNA的纯度和浓度。将所得的RNA使用PrimeScript RT reagent试剂盒反转录成cDNA,将产物均稀释至 200 ng/μL。采用FastStart Essential DNA Green Master试剂盒(Roche)和罗氏Light Cycler 96系统进行荧光定量PCR反应。20 μL反应体系包括:上、下游引物(10 μmol/L)各0.8 μL,FastStart Essential DNA Green Master 10 μL,ddH2O 6.4 μL,cDNA模板2 μL。反应程序为95 ℃下预变性10 min;95 ℃下变性10 s,60 ℃下退火30 s,共进行40个循环;95 ℃下变性10 s,65 ℃下退火1 min;最后在97 ℃下再延伸1 s,37 ℃下退火30 s。采用Primer Premier 5.0软件设计CatB基因的特异性引物,β-actin基因作为内参基因,并用Blastn将引物序列与转录组和基因组进行比对,以确定引物的特异性;对扩增熔解曲线进行分析,以确定所用引物仅能扩增出单一产物。最后通过构建模板系列稀释梯度的标准曲线,计算引物的扩增效率并对其进行优化,使扩增效率接近100%。引物序列见表1。
表1 试验所有引物序列
Tab.1 Primer sequences used in the present study
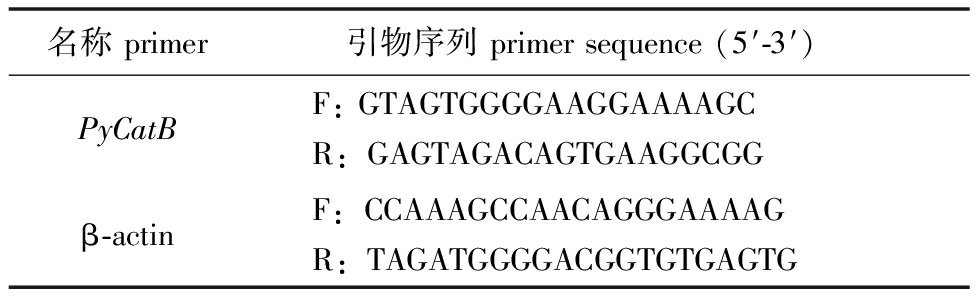
名称primer引物序列primersequence(5′-3′) PyCatBF:GTAGTGGGGAAGGAAAAGCR:GAGTAGACAGTGAAGGCGGβ-actinF:CCAAAGCCAACAGGGAAAAGR:TAGATGGGGACGGTGTGAGTG
1.3 数据处理
采用 2-ΔΔCt法[25]分别计算健康和患病虾夷扇贝各个组织中 CatB基因的相对表达量。并采用 SPSS 19.0软件对所计算出的各个组织的CatB基因相对表达量进行独立样本t检验,分析健康和患病虾夷扇贝不同组织中CatB基因相对表达量之间是否存在显著性差异,显著性水平设为0.05。
2 结果与分析
2.1 PyCatB基因的基因结构及序列特征
经过同源比对,在虾夷扇贝基因组鉴定获得CatB基因(Accession number:LOC110465802),并依据该基因在其他物种中的命名规则,将其命名为PyCatB(P.yessoensis CatB)。PyCatB基因序列全长为9 267 bp,包含9个外显子,8个内含子,cDNA序列长为1 219 bp,5′UTR长为103 bp,3′UTR长为99 bp,CDS长度为1 017 bp,共编码338个氨基酸。PyCatB基因结构如图2所示。
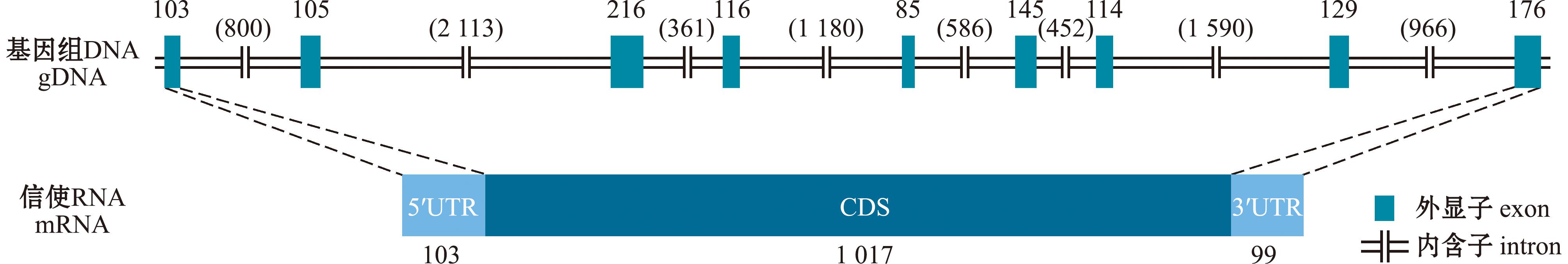
图2 PyCatB的基因结构(bp)
Fig.2 Gene structures of PyCatB (bp)
预测PyCatB蛋白质的相对分子质量为37 200,理论等电点PI为6.37。CatB蛋白质二级结构预测显示,其含有19个α-螺旋(helix)、23个β-折叠(strand)、24个无规则卷曲(coil)和27个转角(turns)(图3(a))。图3(b)为PyCatB的三级结构,功能域预测显示,PyCatB含有前肽Propeptide C1结构域(31~72 aa) 与肽酶peptidase C1A cathepsin B结构域(89~334 aa);通过SingalP预测在N端含有一个序列为MKILAVLCVLWASWA的信号肽,其长度为16 aa,保守功能域示意图如图3(c)所示。PyCatB含有3个活性残基—催化三联体Cys116、His284、Asn304和 Gln110氧阴离子孔;含有一个保守的GCNGG基序;含有 C194~C205的固定残基片段形成的特征性闭塞环,长度为12 aa,并在其中含有2个连续的组氨酸H196和H197(图4)。对其进行跨膜结构预测结果显示,PyCatB无跨膜结构。不同物种 CatB蛋白质序列对的多重比对结果表明,PyCatB与其他物种在结构功能域的序列最为保守,在基序和活性残基中的序列也相对保守(图4)。
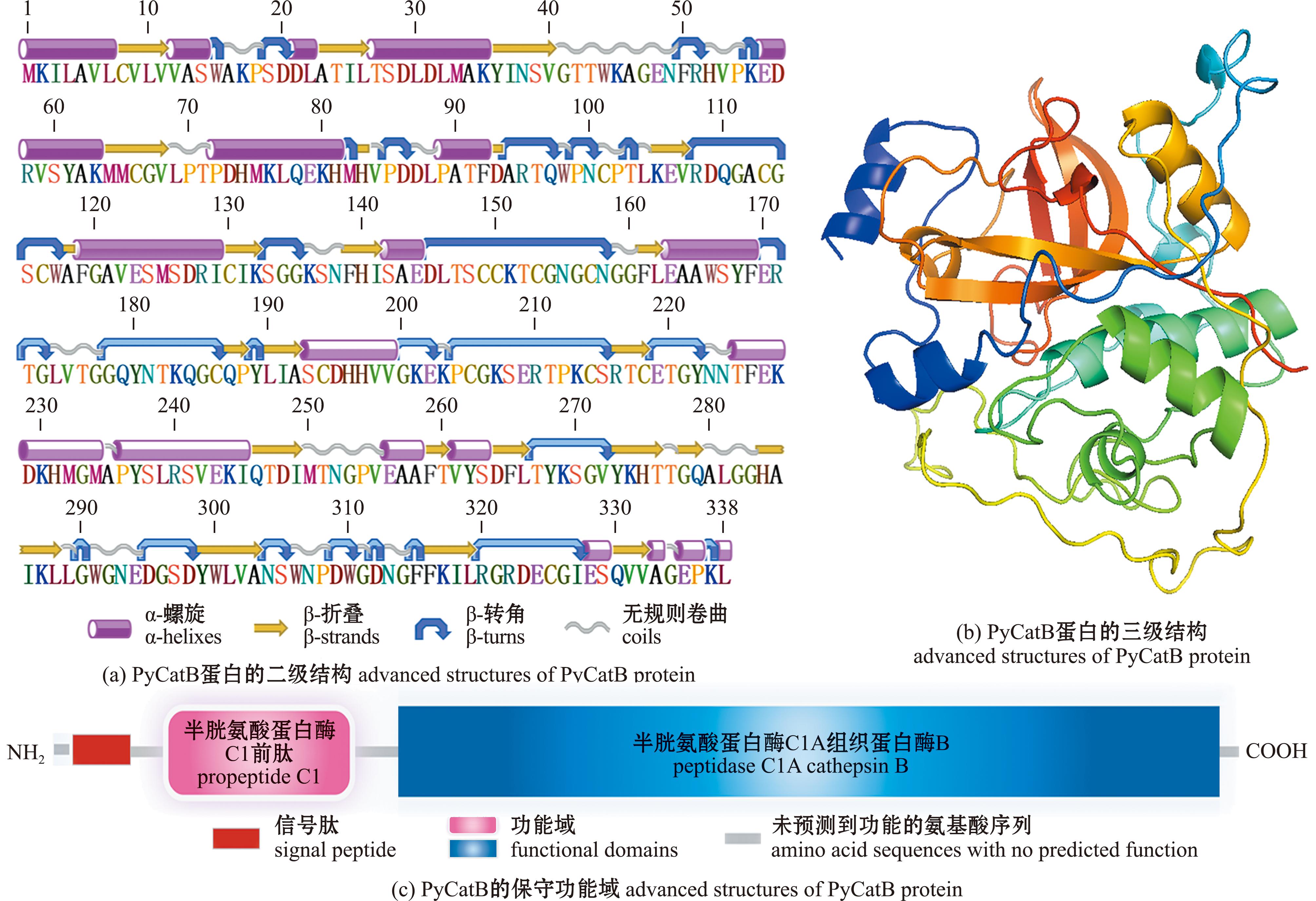
图3 PyCatB蛋白的高级结构
Fig.3 Advanced structures of PyCatB protein

黑色圆形代表催化三联体Cys116、His284、Asn304,黑色方框代表含氧阴离子Gln110,字母代表基序,红色虚线代表闭塞环。
The black circles represent the catalytic triplet Cys116,His284,Asn304,the black box represents the oxygen-containing anion Gln110,the letters represent the motif,and the red dashed lines represent occluding loop.
图4 不同物种CatB蛋白序列的多重比对
Fig.4 Multiple alignment of CatB protein sequences among different species
2.2 PyCatB同源性与系统进化分析
不同物种 CatB 蛋白质序列的两两比对表明,PyCatB与各物种的氨基酸序列同源性较高,序列一致性为50.2%~94.7%;其中与欧洲大扇贝(P.maximus)的序列一致性最高(94.7%),其次是与海湾扇贝(A.irradians)(90.8%)(图5)。
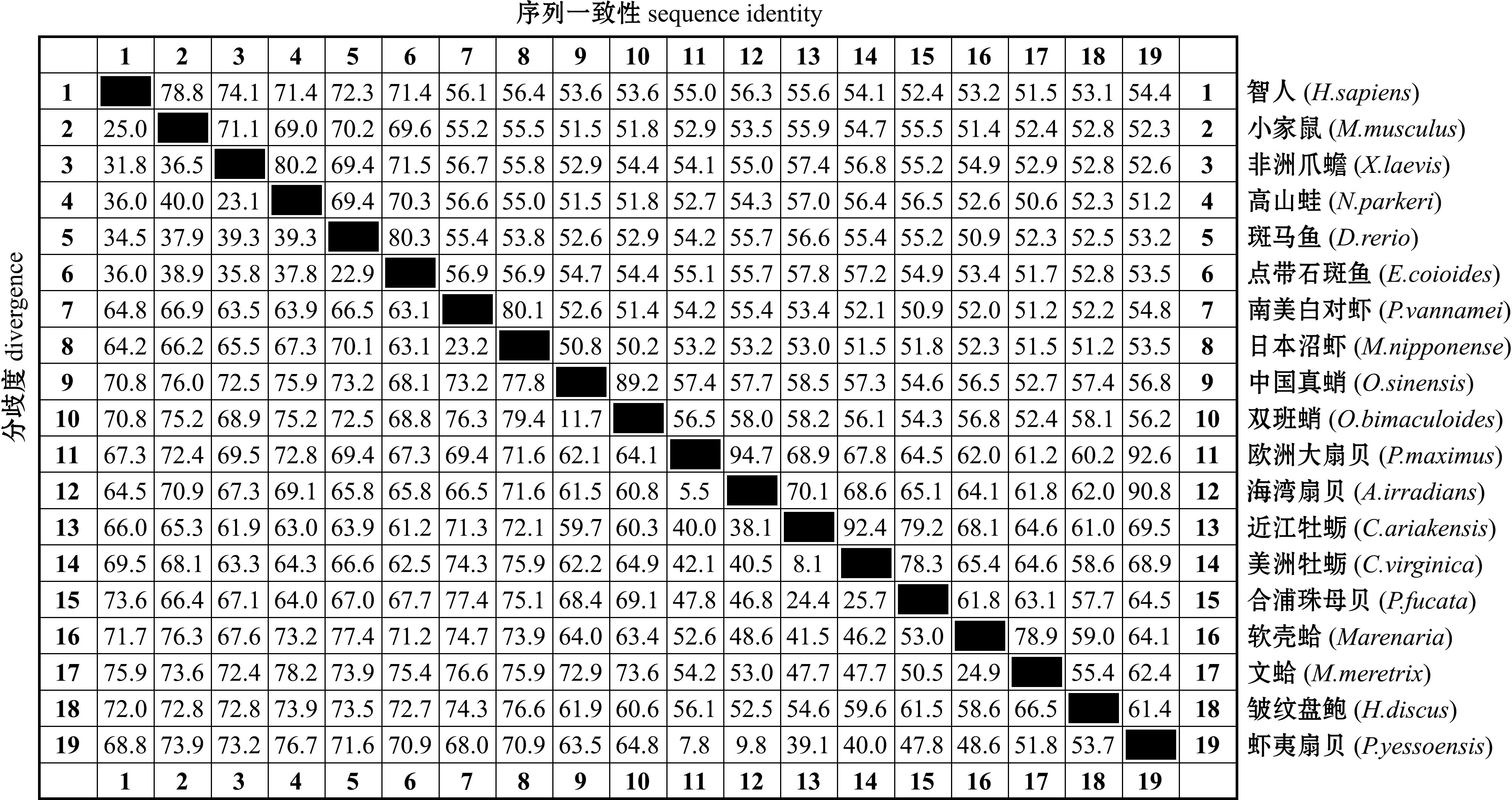
图5 不同物种CatB蛋白序列的两两比对
Fig.5 Pairwise comparison of CatB protein sequences between different species
使用邻接法构建CatB的系统发育树,以确认PyCatB的系统进化地位。从图6可见,系统进化树主要分为两大枝:一大枝为软体动物的CatB,主要包括双壳类、腹足类和头足类;其中,近江牡蛎(C.ariakensis)、美洲牡蛎(C.virginica)、文蛤(M.meretrix)、软壳蛤(M.arenaria)、合浦珠母贝(P.fucata)、海湾扇贝(A.irradians)、巨型海扇(P.maximus)与虾夷扇贝(P.yessoensis)等双壳类先聚成一支,后与腹足纲的皱纹盘鲍(H.discus hannai)聚在一起,再与头足类的中国真蛸(O.sinensis)与双班蛸(O.bimaculoides)聚在一起;另一大枝由脊椎动物、甲壳类聚集而成。其中,虾夷扇贝与海湾扇贝和欧洲大扇贝首先聚在一起,具有较近的亲缘关系。整体上,各物种CatB间的进化关系与各物种的生物进化地位相一致。
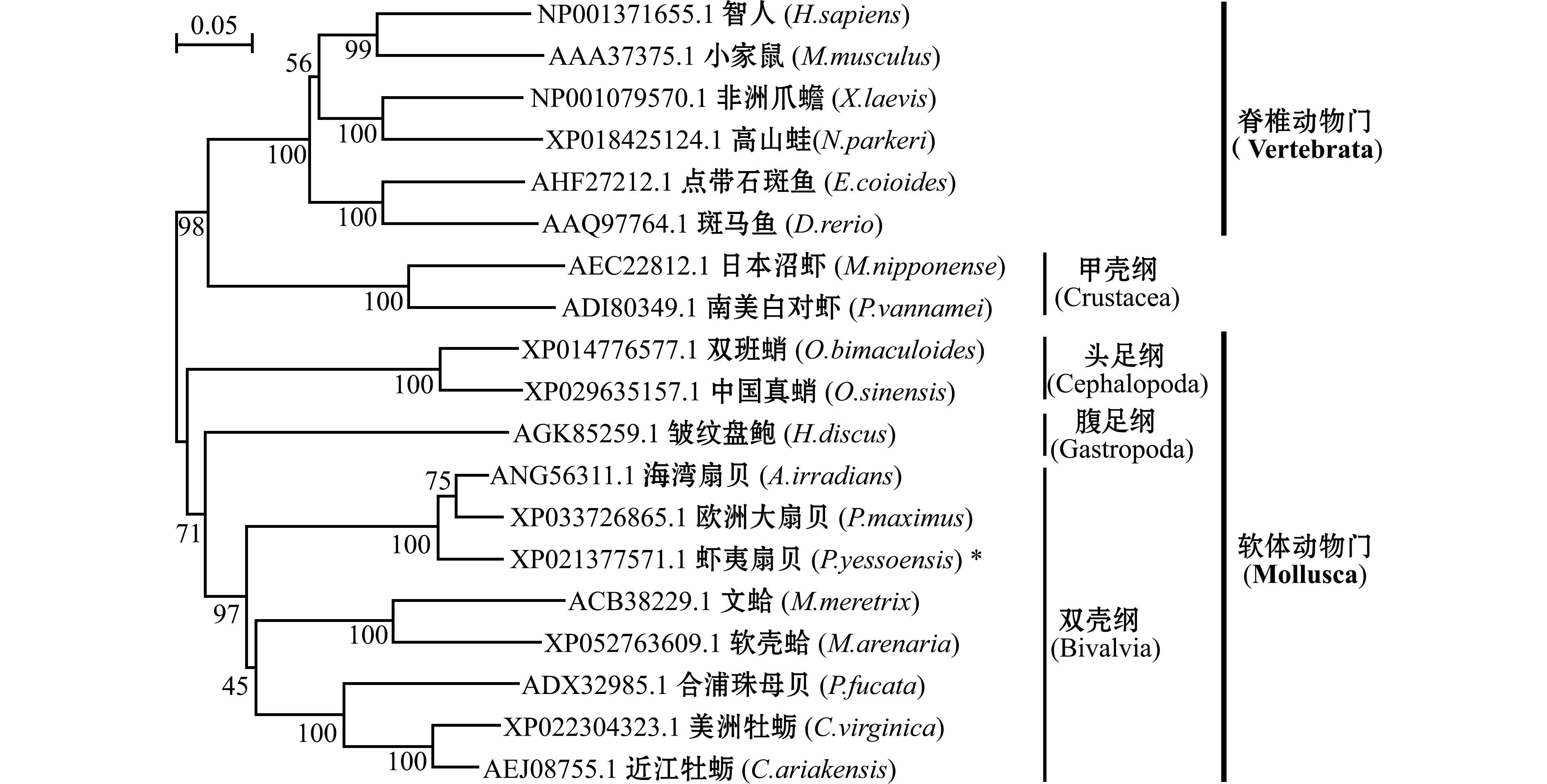
*代表PyCatB。*stands for PyCatB.
图6 不同物种CatB蛋白的系统进化分析
Fig.6 Phylogenetic analysis of CatB proteins in different species
2.3 健康与患病虾夷扇贝中PyCatB的酶活性变化
对健康与感染才女虫虾夷扇贝的左外套膜组织进行CatB的酶活性检测。从图7可见,与健康虾夷扇贝相比,患病虾夷扇贝外套膜组织中的CatB酶活性显著升高(P<0.05),约为健康扇贝中PyCatB酶活性的2倍。
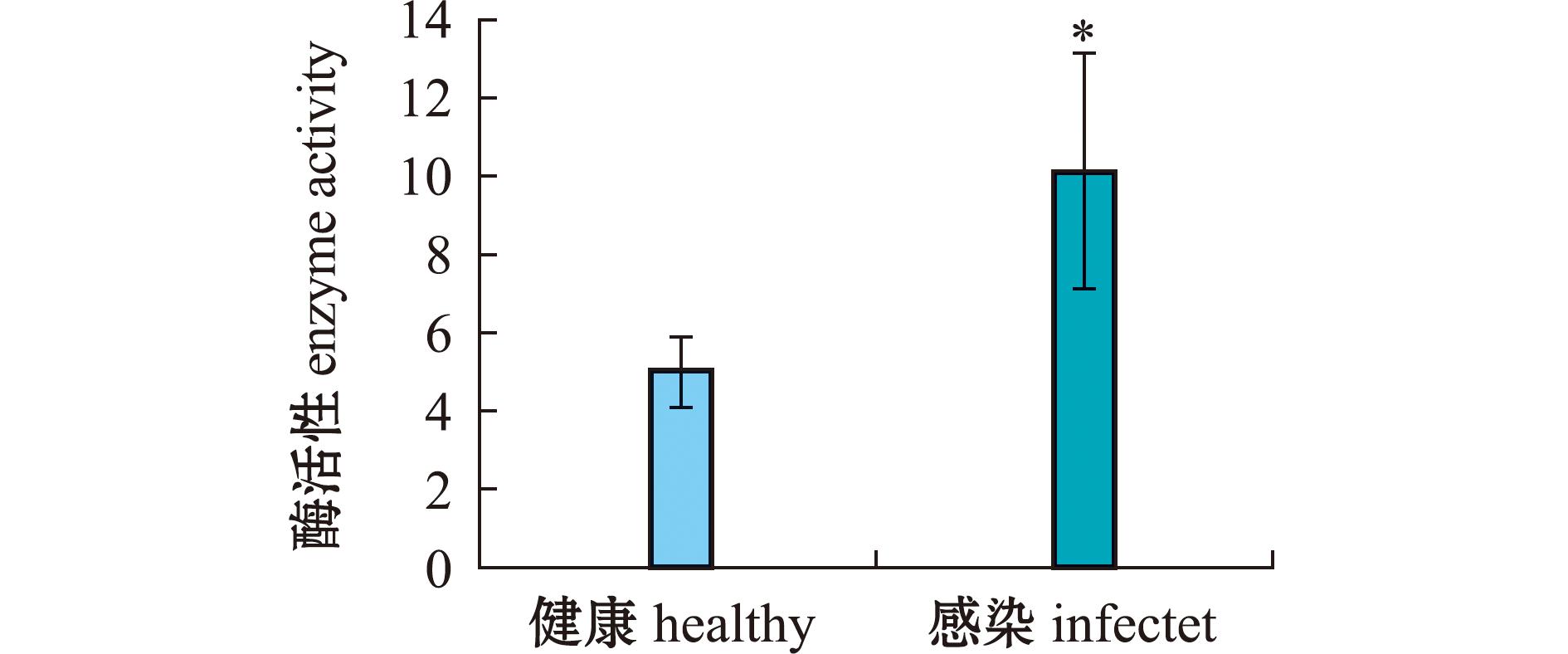
*代表两组之间差异显著(P<0.05)。
* represents significant difference between two groups (P<0.05).
图7 CatB在健康与患病扇贝中的酶活性
Fig.7 Enzyme activity of CatB gene in healthy and infected Patinopecten yessoensis
2.4 PyCatB在虾夷扇贝不同组织中的表达分析
利用qRT-PCR技术检测PyCatB在虾夷扇贝左边缘膜、左中央膜、右边缘膜、右中央膜、鳃、性腺、肝脏、肾脏、血淋巴细胞和闭壳肌等组织中mRNA的表达水平。从图8可见,PyCatB基因在成体各个组织均有不同水平的表达。血细胞中PyCatB基因的表达水平最高,显著高于其他组织(P<0.05)(约为闭壳肌中PyCatB基因表达水平的3 200倍);其次是肾脏(约为闭壳肌的250倍)、左侧中央膜(约125倍)和右侧边缘膜(约120倍);随后是右侧中央膜(约45倍)、左侧边缘膜(约30倍)、肝胰腺(约25倍)和鳃丝(约20倍);PyCatB基因在性腺和闭壳肌中的表达水平较低,在闭壳肌几乎无表达。
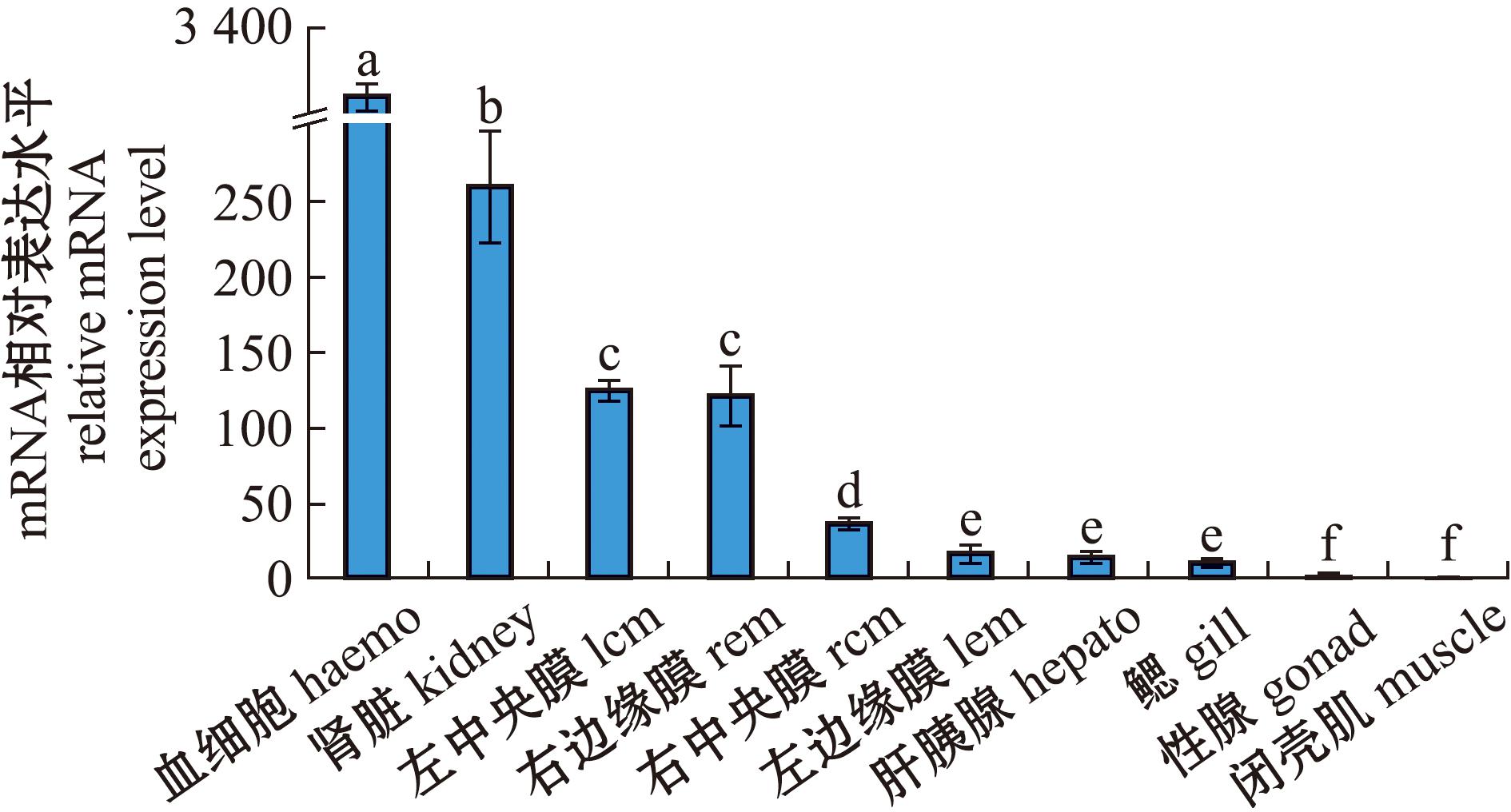
柱形图表示平均值±标准误差(n=3);不同的字母表示有显著性差异(P<0.05)。
The bar represents the mean±standard error (n=3);Different letters indicate significant differences (P<0.05).
图8 PyCatB在虾夷扇贝不同组织中的表达
Fig.8 Expression of PyCatB in different tissues of Patinopecten yessoensis
2.5 感染才女虫虾夷扇贝PyCatB的表达变化分析
试验进一步利用qRT-PCR技术检测了健康与患病虾夷扇贝外套膜不同区域(左边缘膜、左中央膜、右边缘膜、右中央膜)及血淋巴细胞中CatB的表达水平变化情况。从图9可见:在外套膜不同区域组织中,患病个体的PyCatB mRNA表达水平均明显高于健康个体(P<0.05);且在左边缘膜、左中央膜和右中央膜中的表达变化均极显著(P<0.01)。而在血淋巴细胞中,被感染个体的PyCatB表达量略高于健康个体,但无显著性差异(P>0.05)。
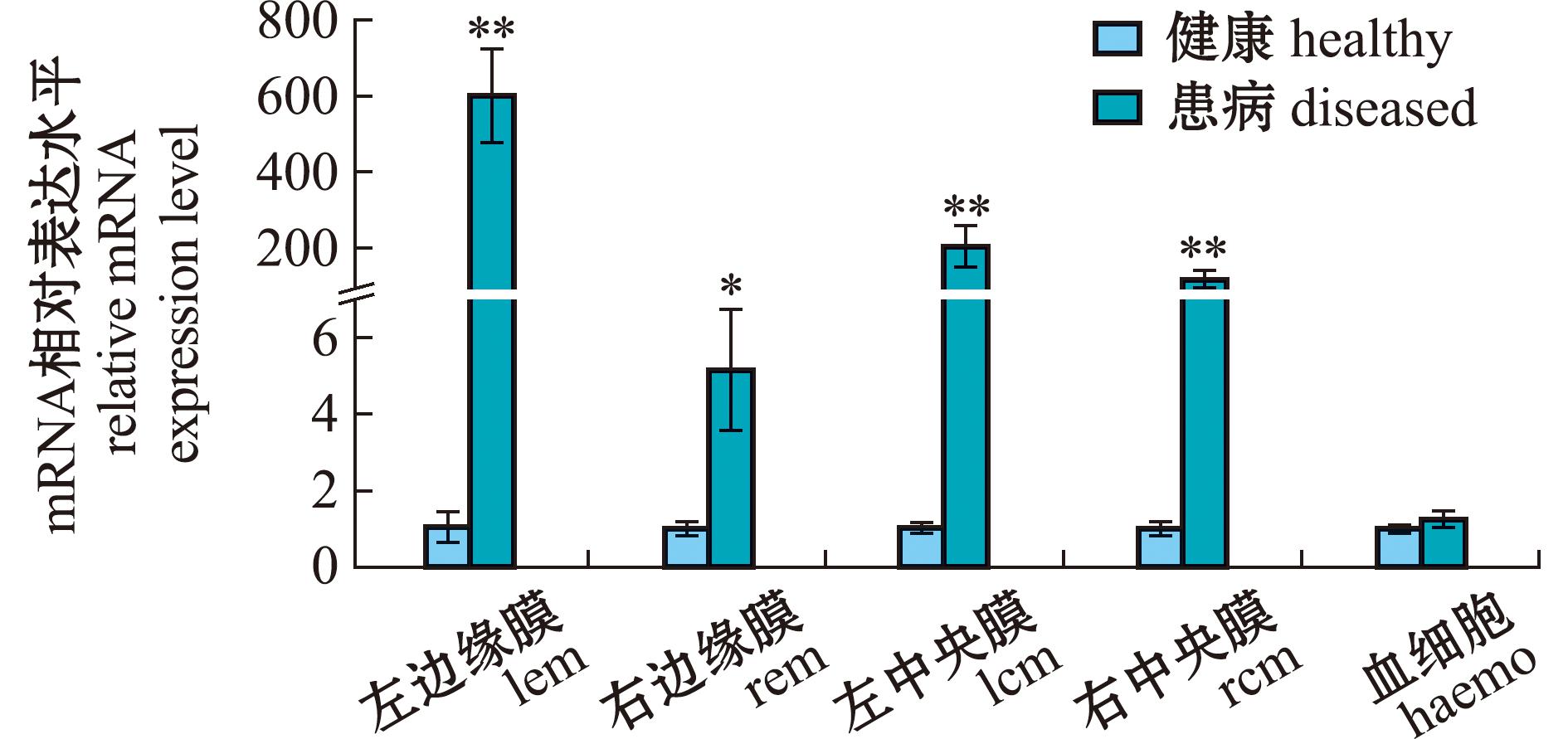
*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01)。
*means significant difference compared with the control (P<0.05);**means very significant difference compared with the control(P<0.01).
图9 PyCatB在健康与患病虾夷扇贝不同组织中的表达
Fig.9 Expression of PyCatB in different tissues of healthy and infected Patinopecten yessoensis
3 讨论
虾夷扇贝是中国北方重要的水产经济贝类。然而,近年来养殖中受到才女虫不同程度侵染,造成了严重的经济损失[26]。由于缺乏适应性免疫,贝类只能依赖先天免疫机制来对抗病原体[27]。CatB是一种重要的先天免疫分子,在宿主抵抗病原体感染和清除病原体中扮演重要的角色,其在脊椎动物中研究比较深入[28]。虽然在水产动物中也有一定报道[11],但CatB在虾夷扇贝抵御才女虫侵染中的功能还不明确,限制了对贝类先天免疫机制的深入理解。
3.1 虾夷扇贝PyCatB基因的序列及进化特征
本研究中对PyCatB的序列特征分析发现,与典型的CatB一样,PyCatB含有N端信号肽,前肽 (Propeptide C1)和半胱氨酸蛋白酶肽酶结构域(Peptidase C1)3个保守功能域,证明了本研究鉴定获得的CatB的可靠性。并在上述区域中找到了CatB所特有的真核生物半胱氨酸蛋白酶氨基酸即催化三联体结构,即Cys116、His284和Asn304,它们是保守活性位点,对催化位点和活化酶三维结构的形成和稳定起着关键作用[8]。PyCatB还含有氧阴离子孔Gln110和CGNGG基序,这些结构在进化中都是保守的,对CatB的催化活性起着至关重要的作用[29]。此外,在PyCatB中还存在一个特定的闭塞环结构,这是CatB区别于其他半胱氨酸蛋白酶的一个重要的标签区域[30],其功能是对于形成三级结构后的酶活性切口位点起限制性作用,可以阻断部分活性位点[9]。多序列比对及系统进化分析表明,CatB序列具有较高的保守性,尤其在功能域和活性位点区域,且CatB在各物种中的进化关系与物种的进化地位基本一致。
3.2 PyCatB基因在感染才女虫虾夷扇贝中的表达变化规律
CatB在哺乳动物中,不仅参与溶酶体蛋白的周转和细胞外基质成分的降解,还与许多病理状态有关,如炎症反应、癌症和阿尔茨海默病等[23,28,31-32];在海洋生物中的研究表明,病毒、细菌和脂多糖类(LPS)等可诱导CatB mRNA的表达[28]。如在日本鳗(Anguilla japonica)表皮中的CatB与CatL负责非特异性防御中致病细菌的裂解[20];对牙鲆(Paralichthys olivaceus)注射牙鲆棒状病毒(SMRV)后,脾脏、后肾和肠中的CatB表达显著增加[23];在中国明对虾(Fenneropenaeus chinensis)白斑综合征病毒(WSSV)的免疫反应中,发现CatB在肝胰腺中的表达量显著变化,48 h前上升后逐渐下降[33]。在贝类中,皱纹盘鲍(Haliotis discus hannai)在弧菌(Vibrio anguillarum)感染后,血细胞和消化腺中CatB的表达均上调[31];褶纹冠蚌(Cristaria plicata)在受嗜水气单胞菌( Aeromonas hydrophila )刺激后,CatB在血细胞和肝胰腺中增加[28]。以上研究表明了CatB在海洋生物免疫应答中的重要功能,但其在虾夷扇贝应答才女虫侵染中的功能尚不清晰。
本研究中利用qRT-PCR技术分析了虾夷扇贝CatB的组织表达模式及在感染才女虫个体中的表达变化规律。研究发现,除闭壳肌外,CatB在虾夷扇贝的各个组织中均存在表达,表明其在虾夷扇贝中广泛的生理作用。血细胞是贝类重要的免疫组织,尽管本研究中CatB在健康扇贝血细胞中的表达量最高,但患病后血细胞中CatB的表达水平并未显著升高,而CatB在外套膜边缘膜和中央膜中的表达水平均显著升高。此外,CatB酶活性在患病扇贝外套膜中也显著升高。才女虫主要寄生在扇贝贝壳中,因此作为贝壳形成的主要器官,外套膜在虾夷扇贝抵御才女虫中发挥关键作用。外套膜上皮细胞中分布着丰富的黏液细胞,可分泌多种免疫效应分子,如溶酶体酶、蛋白酶、蛋白酶抑制剂和凝集素等,以抵抗病原体入侵[27,34-36]。此外,上皮细胞还具有吞噬活性,能有效清除病原体[27]。越来越多的证据表明,除分泌产生贝壳的物质,外套膜在贝类免疫防御中发挥一定作用。如患褐环病(BRD)菲律宾蛤仔(Ruditapes philippinarum)外套膜中多个免疫相关基因上调表达[37];而在经鳗弧菌(Vibrio anguillarum)感染的缢蛏(Sinonovacula constricta)中,外套膜中CatB的表达也显著升高[38],与本研究结果一致。因此,患病虾夷扇贝外套膜中显著升高的CatB基因表达水平和酶活性,表明CatB主要通过外套膜组织参与虾夷扇贝应答才女虫的侵染。此外,本研究前期的蛋白质组学研究表明,CatB蛋白水平在患病虾夷扇贝外套膜中显著升高,且富集于吞噬作用相关分子通路,包括“吞噬体”(ko04145)、“溶酶体”(ko04442),以及“抗原处理和呈递”(ko04612)[24]。因此,推测虾夷扇贝中CatB很可能通过吞噬作用参与了病原体的降解清除[24]。
4 结论
1)PyCatB基因全长为9 267 bp,包含9个外显子,8个内含子,共编码338个氨基酸。PyCatB含有N端信号肽、前肽Propeptide C1和肽酶peptidase C1A cathepsin B 3个保守功能域;还具有Cys116、His284、Asn304催化三联体结构、Gln110氧阴离子孔、GCNGG基序和C194-C205固定残基片段形成的特征性闭塞环,这些结构对PyCatB的催化活性起着重要作用。
2)CatB序列具有较高的保守性,尤其在功能域和活性位点区域;CatB在各物种中的进化关系与物种的进化地位基本一致。
3)感染虾夷扇贝外套膜组织的CatB酶活性显著高于健康扇贝,推测其在虾夷扇贝应答才女虫侵染中发挥重要作用。
4)除闭壳肌外,PyCatB在健康虾夷扇贝成体各组织中均有不同水平的表达,表明PyCatB基因参与广泛的生理过程。PyCatB在患病虾夷扇贝外套膜不同区域的表达量均显著高于健康扇贝,但在血淋巴细胞中不显著,推测PyCatB主要通过外套膜组织参与在虾夷扇贝的免疫应答过程进而抵御才女虫的侵染。
[1] KOSAKA Y.Scallops:biology,ecology,aquaculture,and fisheries[M].3rd.Amsterdam:Elsevier,2016:891-925.
[2] WANG Q C.Introduction of Japanese scallop and prospect of culture it in northern China[J].Fisheries Science,1984,3(4):24-27.
[3] GETCHELL R G,SMOLOWITZ R M,MCGLADDERY S E,et al.Diseases and parasites of scallops[M]//Developments in Aquaculture and Fisheries Science.Amsterdam:Elsevier,2016:425-467.
[4] 叶灵通,唐彬,姜敬哲,等.才女虫属复合体的研究进展[J].南方水产科学,2014,10(06):93-100.YE L T,TANG B,JIANG J Z,et al.Research progress of polydora complex[J].South China Fisheries Science,2014,10(6):93-100.(in Chinese)
[5] 郝寿康,史令,舒予,等.石灰虫、苔藓虫和才女虫对不同群体虾夷扇贝的寄生选择研究[J].科学养鱼,2019(10):60-61.HAO S K,SHI L,SHU Y,et al.A study on the parasitic selection of Calcarina,Bryozoa and Polydora on different populations of Patinopecten yessoensis[J].Scientific Fish Farming,2019(10):60-61.(in Chinese)
[6] WALKER L M.Polydora and Dipolydora (Polychaeta Spionidae) of estuaries and bays of subtropical eastern Australia:a review and morphometric investigation of their taxonomy and distribution[D].Lismore,NSW:Southern Cross University,2009.
[7] 高燕.才女虫生物学特征及其寄生行为的基础研究[D].青岛:中国科学院研究生院(海洋研究所),2013.GAO Y.Study on the biological characters and the parasitic behavior of Polydora[D].Qingdao:Graduate School of Chinese Academy of Sciences (Institute of Oceanology),2013.(in Chinese)
[8] BERQUIN I M,CAO L Q,FONG D,et al.Identification of two new exons and multiple transcription start points in the 5’-untranslated region of the human cathepsin-B-encoding gene[J].Gene,1995,159(2):143-149.
[9] MCGRATH M E.The lysosomal cysteine proteases[J].Annual Review of Biophysics and Biomolecular Structure,1999,28:181-204.
[10] CATHERS B E,BARRETT C,PALMER J T,et al.pH Dependence of inhibitors targeting the occluding loop of cathepsin B[J].Bioorganic Chemistry,2002,30(4):264-275.
[11] 黄媛,王艺磊,冯建军,等.组织蛋白酶B在水生动物中的研究进展[J].生命科学,2016,28(11):1384-1390.HUANG Y,WANG Y L,FENG J J,et al.Research progress of cathepsin B in aquatic animals[J].Chinese Bulletin of Life Sciences,2016,28(11):1384-1390.(in Chinese)
[12] ![]() A,PANIN A N,et al.Cathepsin B:a sellsword of cancer progression[J].Cancer Letters,2019,449:207-214.
A,PANIN A N,et al.Cathepsin B:a sellsword of cancer progression[J].Cancer Letters,2019,449:207-214.
[13] YAMAGUCHI N,TOMARU U,KIUCHI T,et al.Expression of cathepsins B,D and K in thymic epithelial tumours[J].Journal of Clinical Pathology,2021,74(2):84-90.
[14] MARETI A,KRITSIOTI C,GEORGIOPOULOS G,et al.Cathepsin B expression is associated with arterial stiffening and atherosclerotic vascular disease[J].European Journal of Preventive Cardiology,2020,27(19):2288-2291.
[15] KIM H Y,BAEK H S.Circulating cathepsin B and D in pregnancy[J].Journal of Obstetrics and Gynaecology,2019,39(1):17-21.
[16] SMOOKER P M,JAYARAJ R,PIKE R N,et al.Cathepsin B proteases of flukes:the key to facilitating parasite control?[J].Trends in Parasitology,2010,26(10):506-514.
[17] HONEY K,RUDENSKY A Y.Lysosomal cysteine proteases regulate antigen presentation[J].Nature Reviews Immunology,2003,3(6):472-482.
[18] CONUS S,SIMON H U.Cathepsins and their involvement in immune responses[J].Swiss Medical Weekly,2010,140:w13042.
[19] YAO X L,ZHANG J Q,SUN J S,et al.Recombinant expression,characterization and expressional analysis of clam Meretrix meretrix cathepsin B,an enzyme involved in nutrient digestion[J].Molecular Biology Reports,2011,38(3):1861-1868.
[20] ARANISHI F.Lysis of pathogenic bacteria by epidermal cathepsins L and B in the Japanese eel[J].Fish Physiology and Biochemistry,1999,20(1):37-41.
[21] LYSENKO L A,KANTSEROVA N P,KAIVARAINEN E I,et al.Skeletal muscle protease activities in the early growth and development of wild Atlantic salmon (Salmo salar L.)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2017,211:22-28.
[22] CHEN J H,ZHANG L,YANG N,et al.Characterization of the immune roles of cathepsin L in turbot (Scophthalmus maximus L.) mucosal immunity[J].Fish &Shellfish Immunology,2020,97:322-335.
[23] ZHANG F T,ZHANG Y B,CHEN Y D,et al.Expressional induction of Paralichthys olivaceus cathepsin B gene in response to virus,poly I:C and lipopolysaccharide[J].Fish &Shellfish Immunology,2008,25(5):542-549.
[24] SUN H Y,MAO J X,WANG Y Y,et al.Quantitative proteomic analysis reveals the molecular mechanism of the Yesso scallop (Patinopecten yessoensis) in response to Polydora infection[J].Computational and Structural Biotechnology Journal,2022,20:5966-5977.
[25] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T)) Method[J].Methods,2001,25(4):402-408.
[26] ZHANG W J,MAO J X,YUAN C Z,et al.Histological changes in the mantle tissue of the yesso scallop Patinopecten yessoensis shell infested by Polydora[J].Journal of Shellfish Research,2020,39(1):87.
[27] ALLAM B,ESPINOSA E P.Mucosal immunity in mollusks[M]//Mucosal Health in Aquaculture.Amsterdam:Elsevier,2015:325-370.
[28] YI P,HU X,HU B,et al.Identification and expression of cathepsin B from the freshwater mussel Cristaria plicata[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2018,225:21-28.
[29] 崔孟暄.松江鲈(Trachidermus fasciatus)组织蛋白酶B和L的基因克隆、蛋白表达与表达模式分析[D].济南:山东大学,2012.CUI M X.Gene cloning,protein expression and expression analysis of Cathepsin B and L in roughskin Sculpin (Trachidermus fasciatus)[D].Jinan:Shandong University,2012.(in Chinese)
[30] KARRER K M,PEIFFER S L,DITOMAS M E.Two distinct gene subfamilies within the family of cysteine protease genes[J].Proceedings of the National Academy of Sciences of the United States of America,1993,90(7):3063-3067.
[31] QIU R,LIU X,HU Y H,et al.Expression characterization and activity analysis of a cathepsin B from Pacific abalone Haliotis discus Hannai[J].Fish &Shellfish Immunology,2013,34(5):1376-1382.
[32] TURK B,TURK D,SALVESEN G S.Regulating cysteine protease activity:essential role of protease inhibitors as guardians and regulators[J].Current Pharmaceutical Design,2002,8(18):1623-1637.
[33] LI X P,MENG X H,KONG J,et al.Molecular cloning and characterization of a cathepsin B gene from the Chinese shrimp Fenneropenaeus chinensis[J].Fish &Shellfish Immunology,2013,35(5):1604-1612.
[34] XIONG X W,CAO Y F,LI Z X,et al.Transcriptome analysis reveals the transition and crosslinking of immune response and biomineralization in shell damage repair in pearl oyster[J].Aquaculture Reports,2021,21:100851.
[35] CHECA A.A new model for periostracum and shell formation in Unionidae (Bivalvia,Mollusca)[J].Tissue and Cell,2000,32(5):405-416.
[36] HUANG J L,LI L,JIANG T F,et al.Mantle tissue in the pearl oyster Pinctada fucata secretes immune components via vesicle transportation[J].Fish &Shellfish Immunology,2022,121:116-123.
[37] ALLAM B,PALES ESPINOSA E,TANGUY A,et al.Transcriptional changes in Manila clam (Ruditapes philippinarum) in response to Brown Ring Disease[J].Fish &Shellfish Immunology,2014,41(1):2-11.
[38] NIU D H,JIN K,WANG L,et al.Identification of cathepsin B in the razor clam Sinonovacula constricta and its role in innate immune responses[J].Developmental &Comparative Immunology,2013,41(1):94-99.