蛤蜊岗是辽东湾北部辽河与双台子河入海口之间的一片沙洲,面积约10 000 hm2,平均海拔-2 m[1]。其水质特点为浑浊度大,透明度低,水体富营养化严重,80%的滩面平均每天干露3 h左右,滩面平坦,表面水流湍急,冬季有较长的结冰期。蛤蜊岗盛产四角蛤蜊(Mactra veneriformis)、光滑河蓝蛤(Potamocorbula laevis)和大竹蛏(Solen grandis)等多种经济贝类。四角蛤蜊又称白蚬子,属于瓣鳃纲帘蛤目蛤蜊科,为滩涂埋栖贝类,主要生活在潮间带的中、低潮区及浅海的泥砂滩,在韩国、日本及中国辽宁、广东和山东等沿海滩涂地区均有分布[1-4]。四角蛤蜊资源量丰富,在辽东湾蛤蜊岗,其生物量达178.51 g/m3,占当地优势贝类总生物量的71%[1]。四角蛤蜊生长速度快、繁殖周期短、肉质鲜美、营养丰富,且富含多种糖原和蛋白质,具有较高的经济价值[5]。目前,四角蛤蜊性腺发育周期与人工繁育[6-7]、形态性状[3,8]、对环境因子的响应[9-10]、生态毒理[11-13]、营养成分[5,14],以及基因组、转录组和代谢组等研究[15-16]已有较多报道。近年来,由于受气候变化、生境破坏等因素影响,包括四角蛤蜊在内的一些滩涂贝类在自然海区的资源量波动较大[1,17],有关优势贝类种群迁移特征的相关研究越来越受到重视。
人工标记是研究贝类种群数量生态学的常规方法,一般可以通过标记增殖放流前后的外部性状、重捕位点、数量及时间等变化,记录反映生物的生长和种群变化规律。原位标记是在传统标记技术基础上,避免了运输过程,直接在贝类的自然栖息地进行标记,能够有效减少对贝类可能造成的胁迫。众所周知,化学荧光标记以高效率、高成功率和高保留率等特点,在贝类中有着广泛应用[18-20],其原理主要是通过荧光素与生物组织络合,在上面形成一定波长光源下可见的荧光标记,适宜的荧光素浓度和浸染时间是有效化学标记的关键。浓度过高或时间过长会导致贝类生长受限甚至死亡,需要确定合适的染剂和标记条件以减少对贝类的刺激。
钙黄绿素(Calcein)是一种激发光波长在495 nm处,发射光波长在515 nm处的钙离子荧光指示剂,细胞毒性低[21],已被用于贝类[19]、鱼类[22]和棘皮类[23]等多种水生生物的标记研究。外源物质造成的影响体现在生物体的生理活动和生化指标上,如抗氧化酶活性通常可反映机体受到的损伤程度[24]。脂肪酸参与生物体能量供应、生物膜形成乃至信号分子等多种生理生化途径[25],对污染物及环境变化非常敏感,是生态系统健康的良好生物指标和应激生物指标,已成为海洋贝类响应外界胁迫的指标[26]。分析标记后贝类的抗氧化能力和脂肪酸变化可准确评估标记对贝类的影响。
本文中以贝类抗氧化能力和脂肪酸标志物作为指示指标,研究了钙黄绿素浸泡标记四角蛤蜊的可行性及标记的最佳浓度和浸泡时间,以期为四角蛤蜊原生优质资源的养护利用提供方法学参考。
1 材料与方法
1.1 材料
试验用四角蛤蜊采自辽东湾,经冷链运输回实验室,PVC水槽暂养10 d,每日定时换水50%,水温为6.82 ℃±0.92 ℃,按贝类软体部质量的1%混合投喂盐藻(Dunaliella salina)、小球藻(Chlorella vulgaris)和螺旋藻(Spirulina sp.)藻粉。
试验用钙黄绿素(Calcein,C30H26N2O13,分子量622.53)为分析纯(北京Solarbio科技有限公司,货号C7600)。试验前使用去离子水配制1 g/L钙黄绿素储备液,配制过程中加入少量NaHCO3调节pH以增加溶解性,配制好的储备液避光保存,使用时将储备液加入10 L海水,配制为相应浓度的钙黄绿素溶液。整体试验设计如图1所示。
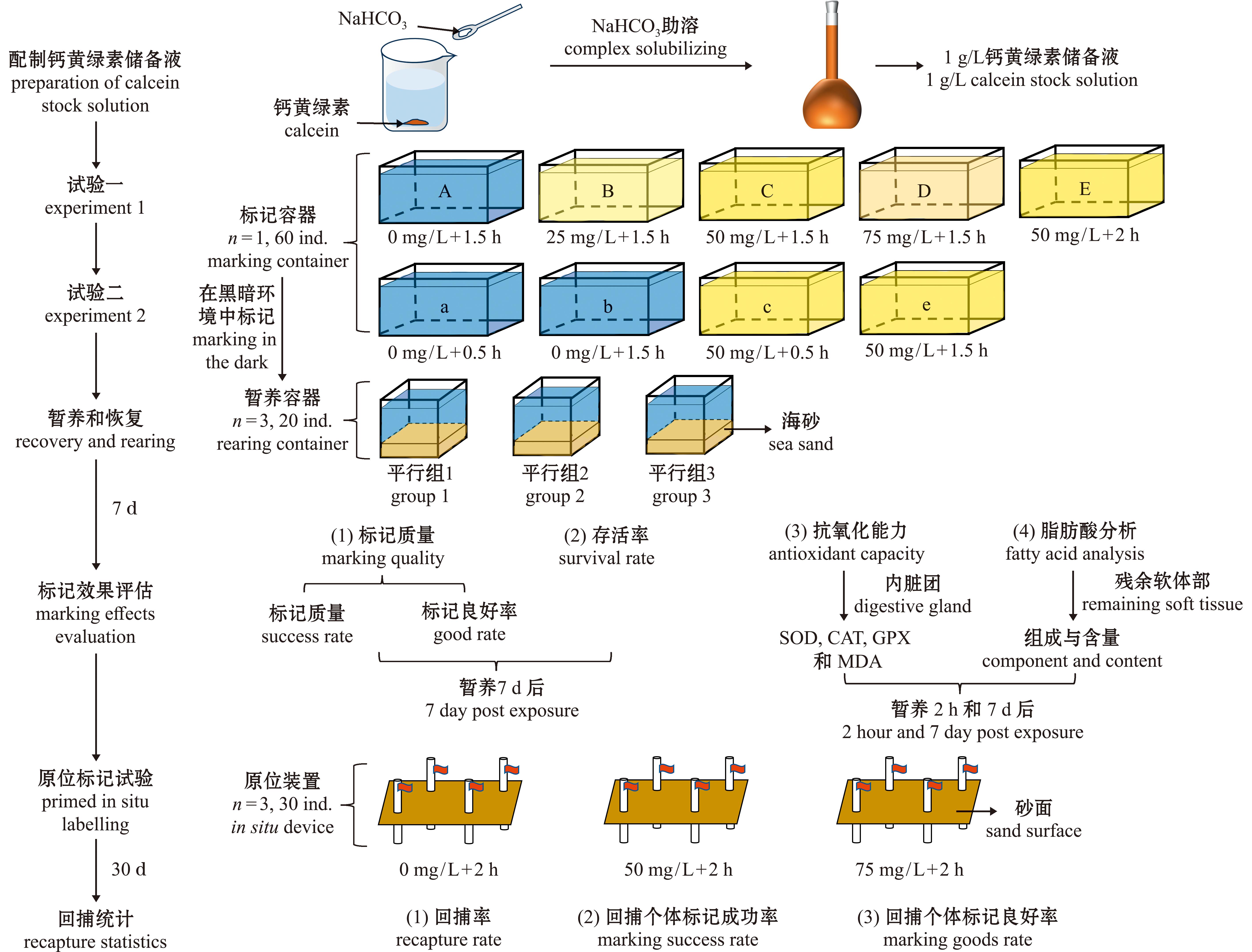
SOD—超氧化物歧化酶;CAT—过氧化氢酶;GSH-PX—谷胱甘肽过氧化物酶;MDA—丙二醛。
SOD—superoxide dismutase;CAT—catalase;GSH-PX-Glutathione peroxidase;MDA-malondialdehyde.
图1 四角蛤蜊钙黄绿素原位标记试验设计
Fig.1 Mactra veneriformis Calcein in situ marking experiment design
1.2 方法
1.2.1 试验一:标记浓度 根据预试验结果,试验设置1个对照组和4个处理组,分别为A组(对照,0 mg/L,1.5 h)、B组(20 mg/L,1.5 h)和C组(50 mg/L,1.5 h)、D组(75 mg/L,1.5 h)及E组(50 mg/L,2 h),每组设置3个平行,每个平行水槽放置20枚四角蛤蜊,壳长为(36.54±1.83) mm。浸染标记期间充气不投饵,各处理组内不区分平行,统一浸染。标记容器为不透光的泡沫保温箱,水温为7.68 ℃±0.37 ℃,溶氧为(8.83±0.17)mg/L,盐度为33.04±0.07,标记密度为6 ind./L。浸染结束后,使用新鲜海水将贝壳表面残留的钙黄绿素缓流冲洗干净,随机均分至3个铺有约5 cm厚270~550 μL商品海砂的0.16 m3透明玻璃水箱中观察7 d,每个水箱为一个平行组。观察期间记录并挑出死亡个体,每日定时换水70%,按盐藻∶小球藻=1∶1的比例混合投喂藻粉,投饵量为贝类软体部质量的1%。试验用水为曝气24 h后的海水,水温为7.51 ℃±1.00 ℃,溶氧为(8.82±0.37)mg/L,盐度为33.32±0.07,pH为7.96±0.01。保留试验一中剩余四角蛤蜊进行为期一个月的室内养殖试验,养殖期间未区分平行组,养殖期间管理方法与上述一致,水温为5.79 ℃±1.52 ℃,溶氧为(9.00±0.45)mg/L,盐度为33.82±0.38。
1.2.2 试验二:标记时间 基于试验一标记浓度的结果,选择50 mg/L钙黄绿素开展试验二,共设置2个试验组和2个对照组,分别为a组(对照,0 mg/L,0.5 h)、b组(50 mg/L,1.5 h)、c组(50 mg/L,0.5 h)和d组(50 mg/L,1.5 h),每组设3个平行,每个平行水槽放20枚四角蛤蜊,壳长为(35.44±1.55)mm。标记方法及标记后暂养方法同试验一。标记期间的水温为(4.76±0.09)℃,溶氧为(9.60±0.03)mg/L,盐度为33.50±0.19,密度为6 ind./L。暂养观察期的水温为(4.56±0.65)℃,溶氧为(9.57±1.00)mg/L,盐度33.45±0.10,pH为7.96±0.00。
1.2.3 试验三:原位标记 原位标记试验的地点为辽东湾蛤蜊岗,结合当地潮汐时间和多变的自然条件,原位标记条件在室内试验结果的基础上增设了钙黄绿素浓度和浸染时间处理。试验设计两组试验组(50、75 mg/L分别浸染2 h),每个试验组设置3个平行点位与1个对照点位(0 mg/L浸染2 h),每个点位30枚四角蛤蜊。四角蛤蜊采集自蛤蜊岗当地,壳长为(36.86±1.67)mm。标记过程在装有20 L海水的密闭避光容器中进行,防止外界环境导致钙黄绿素遇光淬灭或浓度变化。
在蛤蜊岗滩涂选取7个相距约50 m的点位(40°42′7.76″N,121°53′33.07″E;40° 42′7.18″ N,121° 53′32.76″ E;40° 42′8.38″ N,121° 53′33.01″ E;40° 42′8.49″ N,121° 53′32.37″ E;40° 42′7.84″ N,121° 53′32.13″ E;40° 42′8.53″ N,121° 53′31.17″ E;40° 46′23″ N,121° 58′55″ E)。在退潮期间,安装原位装置(图2),并将标记后的四角蛤蜊转移至原位装置中。一个月后进行回捕,筛取点位中的四角蛤蜊,统计回捕率、标记率及标记质量。
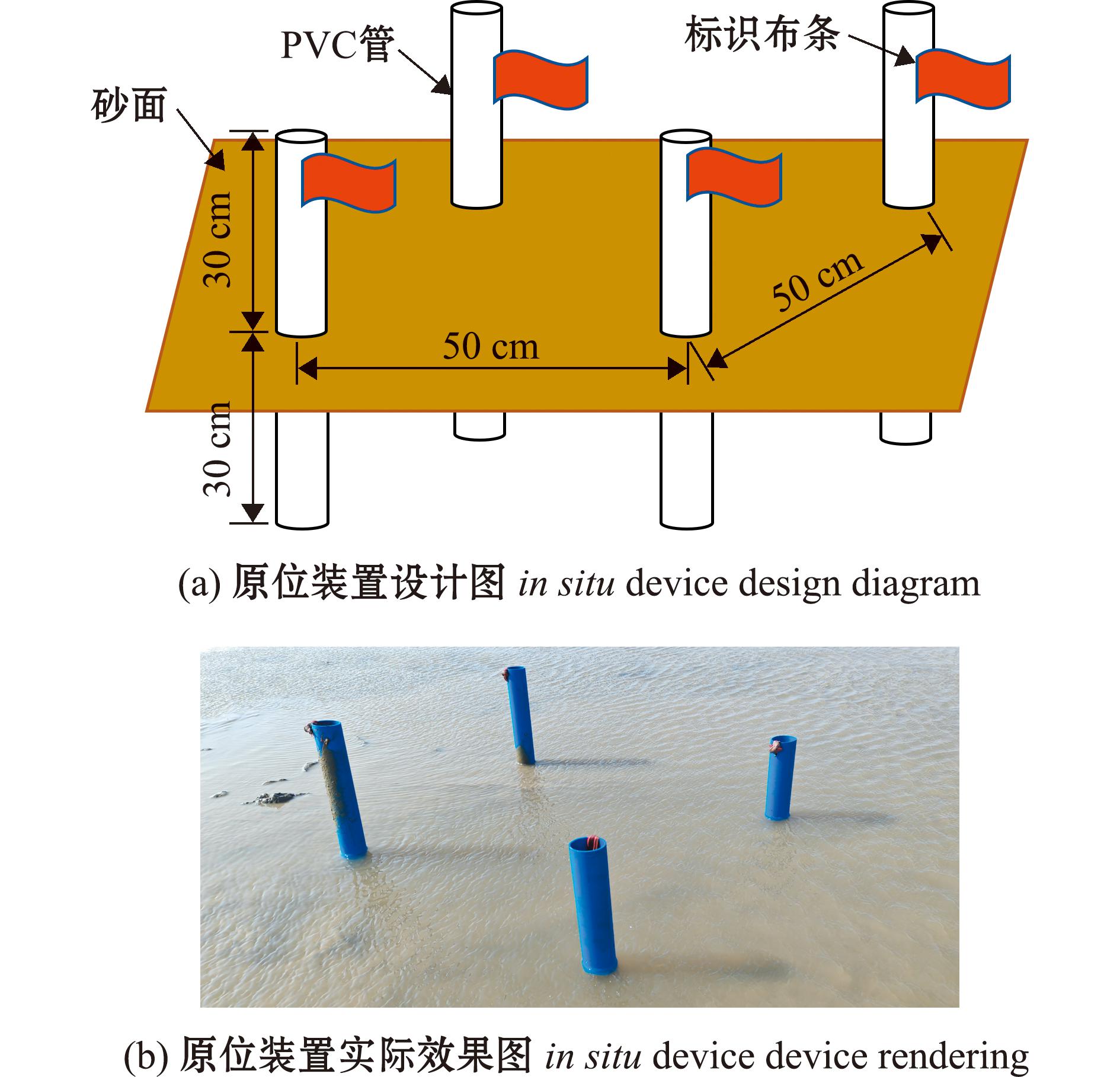
图2 钙黄绿素原位标记试验模式和装置图
Fig.2 Calcein in situ marking experimental model and device
1.2.4 酶活测定 分别在标记后2 h和7 d取样,每组随机采取3枚四角蛤蜊,于冰上剖取消化腺和软体部,样品-80 ℃保存。消化腺按1∶9(质量∶体积)加入4 ℃预冷的0.9%生理盐水,冰水浴条件下,机械匀浆,制备成10%的匀浆液,以2 500~3 000 r/min离心10 min,取上清液进行测定。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、丙二醛(MDA)和总蛋白(TP)试剂盒均购自南京建成生物有限公司,按试剂盒说明书进行测定。
1.2.5 脂肪酸分析 脂肪酸分析参考改进后的一步酸催化酯化法测定[27]。四角蛤蜊软体部(除消化腺)样品经冻干、研磨、过筛(75 μL)后,量取50 mg样品粉末加至10 mL圆底烧瓶中,加入5 mL 2%硫酸-甲醇(v/v)。经超声处理后,于70 ℃油浴下反应40 min,待冷却回流后,加入2 mL正己烷和0.75 mL离子水,充分混合后,将上层含有脂肪酸甲酯的正己烷转至2 mL色谱瓶中,进行气相色谱分析。以十九烷酸甘油三酯为内标,进样量为1 μL,检测器为氢火焰离子化检测器(FID),载气为高纯氮气,前进样口和前检测器温度均为270 ℃,分流比为50∶1,色谱柱为DB23。升温程序设置初始值为130 ℃,并以10 ℃/min的升温速率升至170 ℃,再以2.5 ℃/min的升温速率升至210 ℃,保持3 min,运行时间为23 min。每种脂肪酸相对含量与绝对含量的计算公式为
Pi=Ai/∑Ai×100%,
(1)
Mi=(Ai/As×Ms)/Ma。
(2)
式中:Pi为每种脂肪酸的相对质量,即每种脂肪酸的质量占总脂肪酸质量的百分比;Mi为每种脂肪酸的绝对含量,即每克样品粉末所含各种脂肪酸的毫克数;Ai为每种脂肪酸的峰面积;∑Ai为所有脂肪酸的峰面积之和;As为内标十九烷酸甲酯的峰面积;Ms为内标十九烷酸甲酯的加入量(mg);Ma为样品粉末含量(mg)。
1.2.6 标记效果评价 使用荧光手电筒(Luyor-3280LB,480~490 nm)在黑暗环境下检测贝壳上的荧光标记。按0~5级对荧光标记质量进行评价[28](表1),标记质量在2级以上的被视为良好,分别统计各试验组中的标记成功率和2级以上的良好率。
表1 荧光标记质量评价标准
Tab.1 Evaluation criteria for fluorescent marking grade

等级grade评价标准criteria0级荧光手电照射下标记不可见1级荧光手电照射下标记模糊2级荧光手电照射下标记清晰3级荧光手电照射下标记明亮4级透射光下标记可见5级透射光下标记清晰
1.3 数据分析
试验数据采用SPSS 26.0软件进行统计学分析,存活率、抗氧化酶活和脂肪酸等指标以平均值±标准差(mean±S.D.,n=3)表示。采用单因素方差分析、Tukey’s和HSD进行显著性检验,显著性水平设为0.05。
2 结果与分析
2.1 四角蛤蜊的存活率
试验一与试验二各试验组在标记后7 d存活率与对照组均无显著性差异(P>0.05),试验标记条件对四角蛤蜊短期存活无明显负面影响。试验一存活率为90%~100%,试验二存活率为90%~100%。试验一四角蛤蜊养殖1个月后,A~E组的存活率分别为81.93%、85.54%、85.37%、83.95%、86.74%,各组较为接近(图3)。
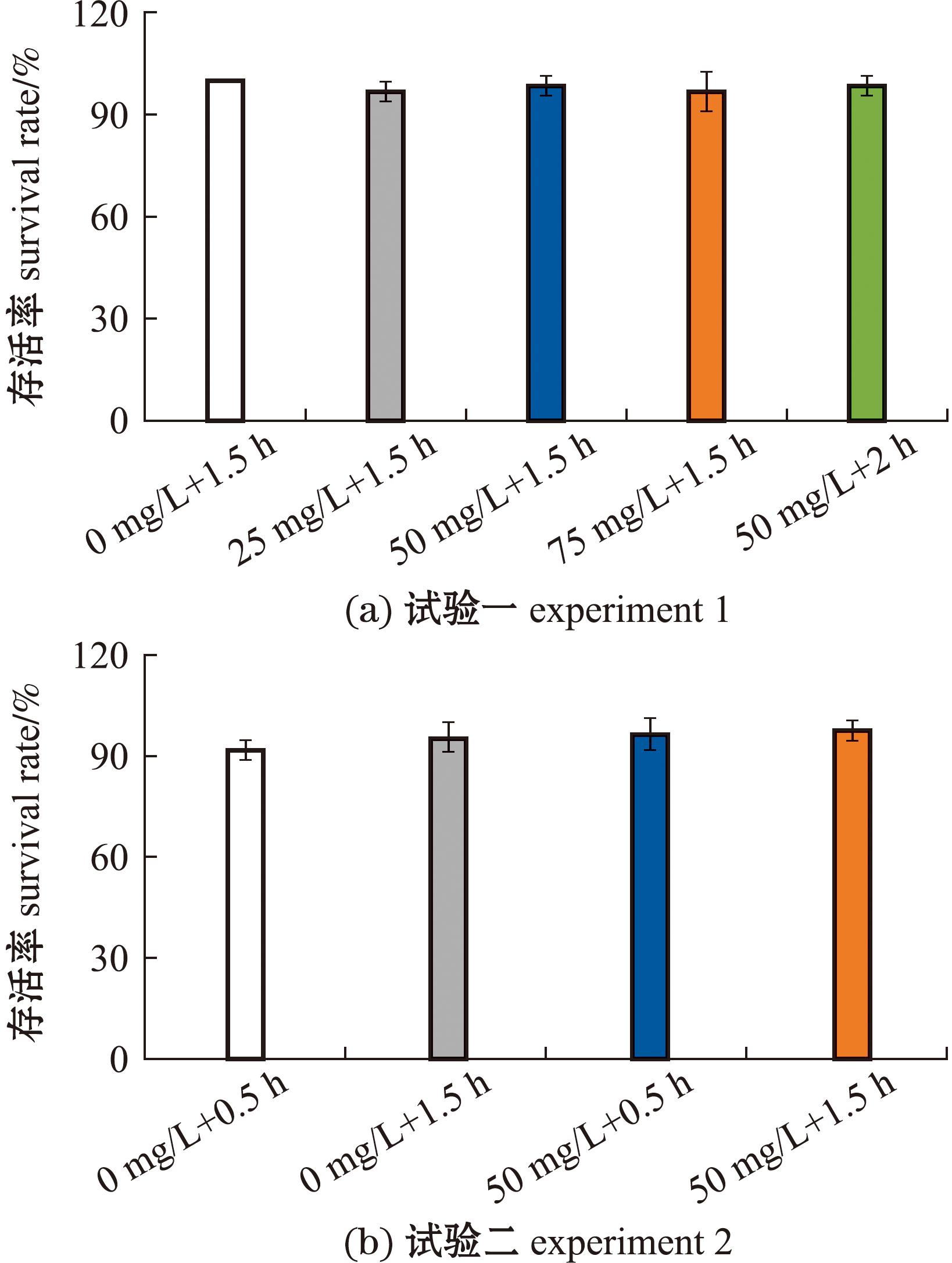
图3 标记试验期间四角蛤蜊存活率统计
Fig.3 Statistics of survival rate of Mactra veneriformis during the marking experiment period
2.2 标记条件对四角蛤蜊抗氧化能力的影响
从图4可见,试验一各组贝类在标记后2 h和7 d的SOD、CAT、GSH-PX酶活性及MDA含量与对照组均无显著性差异(P>0.05);从图5可见,试验二设置的不同标记时间对四角蛤蜊抗氧化能力也无显著性影响(P>0.05)。
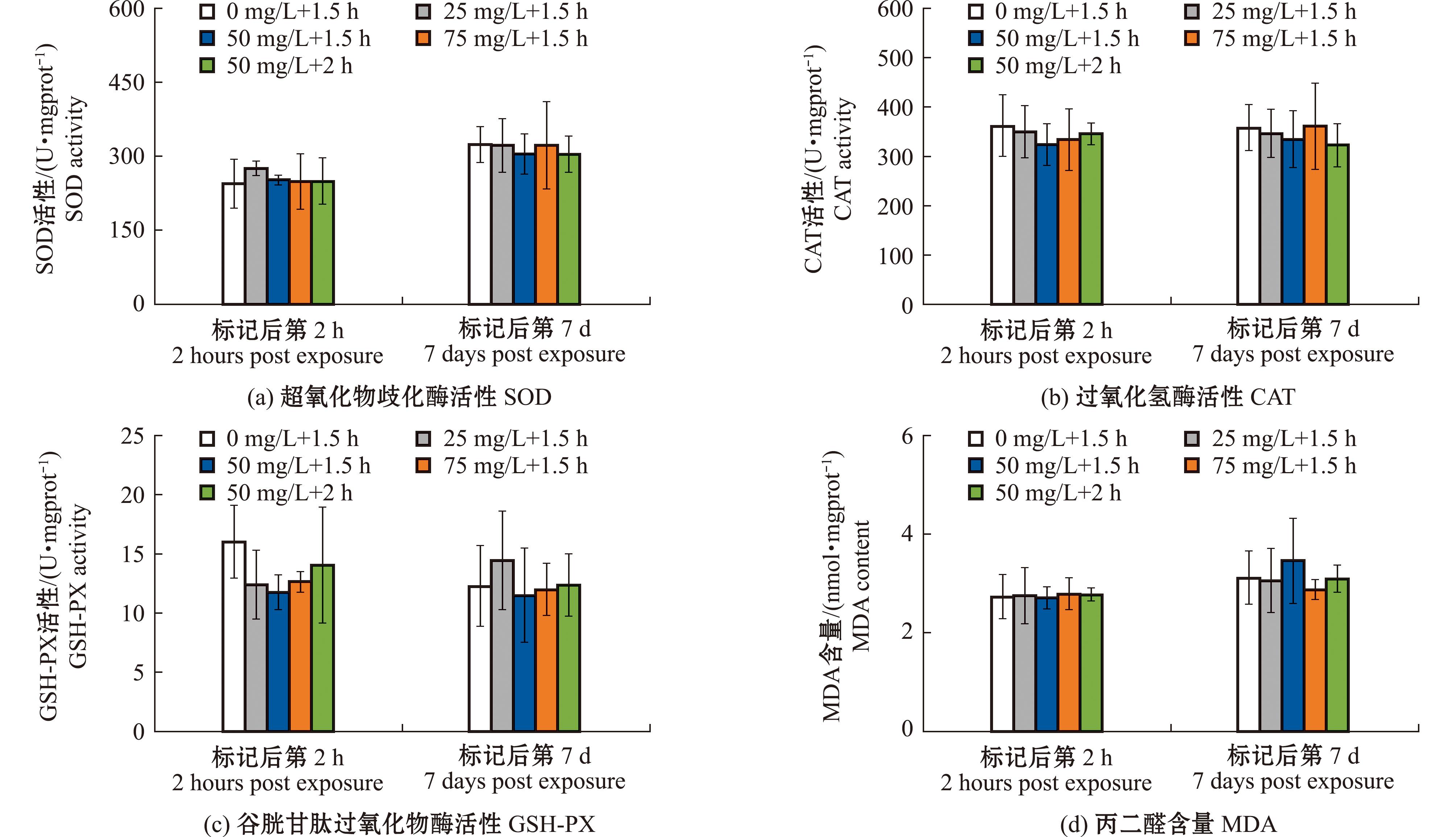
图4 钙黄绿素标记浓度对四角蛤蜊抗氧化酶活性的影响
Fig.4 Effects on the antioxidant activity of Mactra veneriformis in Calcein in situ marking concentration experiment
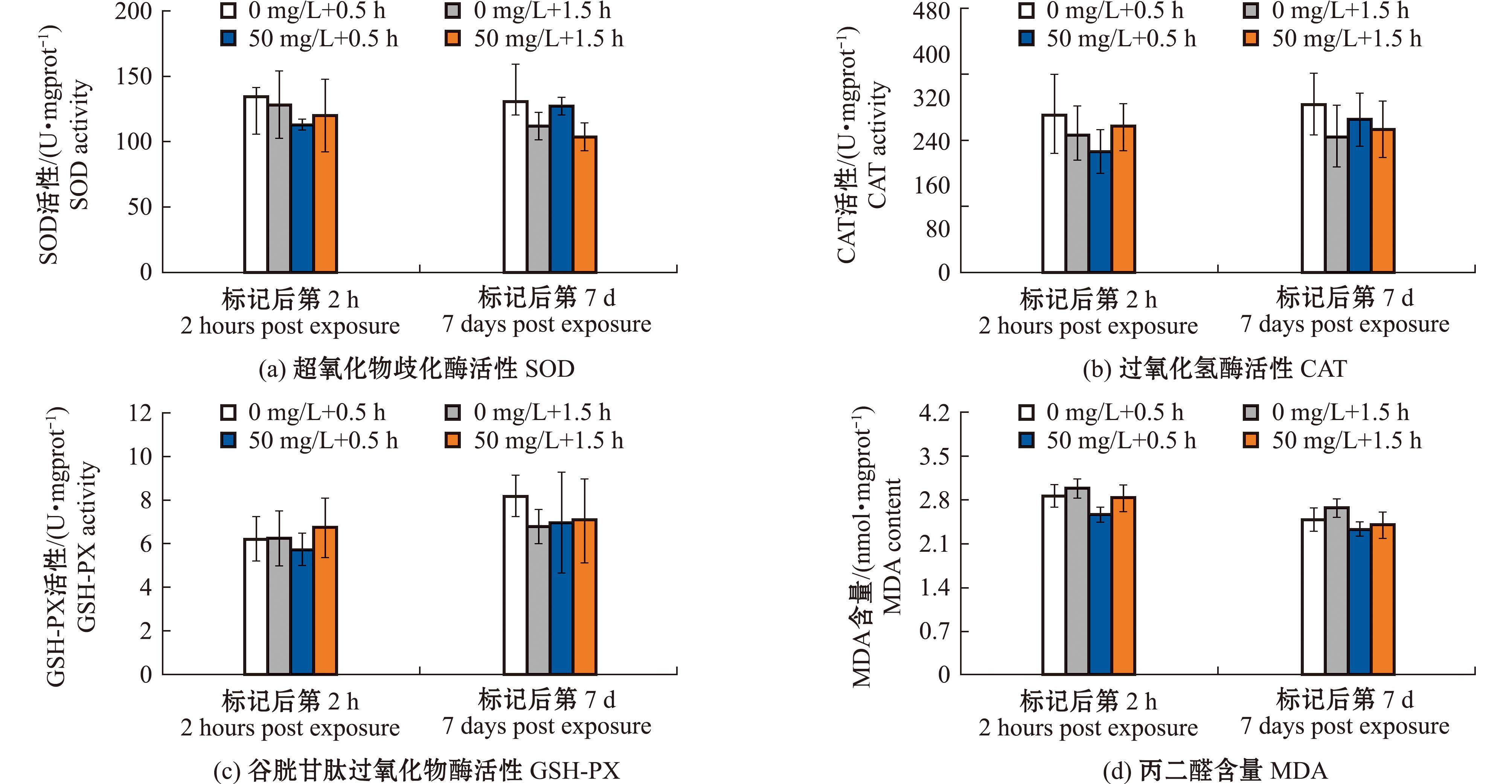
图5 钙黄绿素标记时间对四角蛤蜊抗氧化酶活性的影响
Fig.5 Effects on the antioxidant activity of Mactra veneriformis during the marking experiment
2.3 标记条件对四角蛤蜊脂肪酸组成的影响
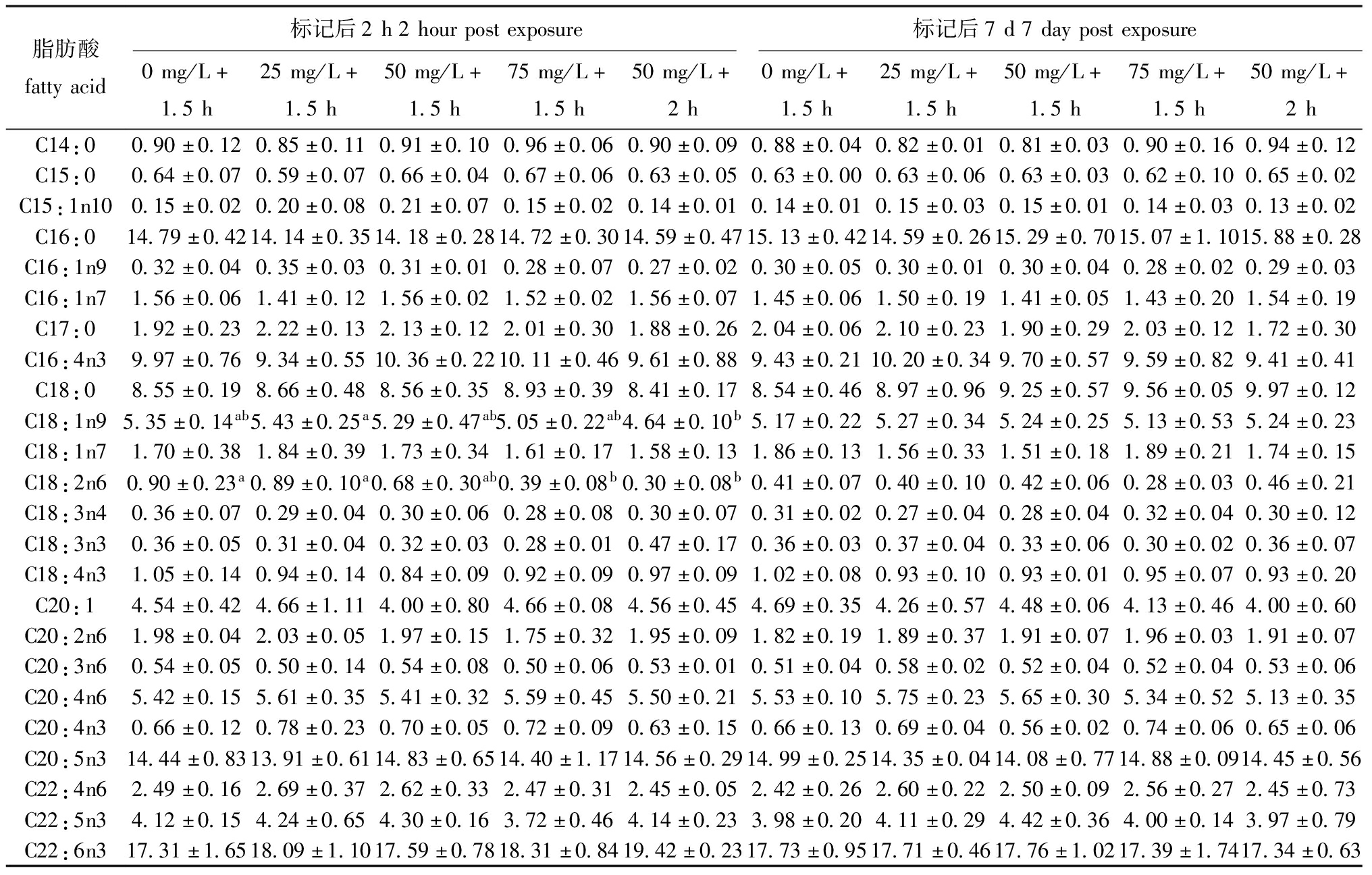
从表2和表3可见,四角蛤蜊中共检出24种脂肪酸,其中包括5种饱和脂肪酸、6种单不饱和脂肪酸及13种多不饱和脂肪酸,其中,主要脂肪酸4种,分别为C16:0、C16:4n3、C20:5n3(EPA)和C22:6n3(DHA),次要脂肪酸3种,分别为C18:0、C18:1n9及C20:4n3。
表2 钙黄绿素标记浓度对四角蛤蜊脂肪酸相对丰度影响
Tab.2 Effects on fatty acid profiles of Mactra veneriformis in Calcein marking concentration experiment %
脂肪酸fattyacid标记后2h2hourpostexposure标记后7d7daypostexposure0mg/L+1.5h25mg/L+1.5h50mg/L+1.5h75mg/L+1.5h50mg/L+2h0mg/L+1.5h25mg/L+1.5h50mg/L+1.5h75mg/L+1.5h50mg/L+2hC14:00.90±0.120.85±0.110.91±0.100.96±0.060.90±0.090.88±0.040.82±0.010.81±0.030.90±0.160.94±0.12C15:00.64±0.070.59±0.070.66±0.040.67±0.060.63±0.050.63±0.000.63±0.060.63±0.030.62±0.100.65±0.02C15:1n100.15±0.020.20±0.080.21±0.070.15±0.020.14±0.010.14±0.010.15±0.030.15±0.010.14±0.030.13±0.02C16:014.79±0.4214.14±0.3514.18±0.2814.72±0.3014.59±0.4715.13±0.4214.59±0.2615.29±0.7015.07±1.1015.88±0.28C16:1n90.32±0.040.35±0.030.31±0.010.28±0.070.27±0.020.30±0.050.30±0.010.30±0.040.28±0.020.29±0.03C16:1n71.56±0.061.41±0.121.56±0.021.52±0.021.56±0.071.45±0.061.50±0.191.41±0.051.43±0.201.54±0.19C17:01.92±0.232.22±0.132.13±0.122.01±0.301.88±0.262.04±0.062.10±0.231.90±0.292.03±0.121.72±0.30C16:4n39.97±0.769.34±0.5510.36±0.2210.11±0.469.61±0.889.43±0.2110.20±0.349.70±0.579.59±0.829.41±0.41C18:08.55±0.198.66±0.488.56±0.358.93±0.398.41±0.178.54±0.468.97±0.969.25±0.579.56±0.059.97±0.12C18:1n95.35±0.14ab5.43±0.25a5.29±0.47ab5.05±0.22ab4.64±0.10b5.17±0.225.27±0.345.24±0.255.13±0.535.24±0.23C18:1n71.70±0.381.84±0.391.73±0.341.61±0.171.58±0.131.86±0.131.56±0.331.51±0.181.89±0.211.74±0.15C18:2n60.90±0.23a0.89±0.10a0.68±0.30ab0.39±0.08b0.30±0.08b0.41±0.070.40±0.100.42±0.060.28±0.030.46±0.21C18:3n40.36±0.070.29±0.040.30±0.060.28±0.080.30±0.070.31±0.020.27±0.040.28±0.040.32±0.040.30±0.12C18:3n30.36±0.050.31±0.040.32±0.030.28±0.010.47±0.170.36±0.030.37±0.040.33±0.060.30±0.020.36±0.07C18:4n31.05±0.140.94±0.140.84±0.090.92±0.090.97±0.091.02±0.080.93±0.100.93±0.010.95±0.070.93±0.20C20:14.54±0.424.66±1.114.00±0.804.66±0.084.56±0.454.69±0.354.26±0.574.48±0.064.13±0.464.00±0.60C20:2n61.98±0.042.03±0.051.97±0.151.75±0.321.95±0.091.82±0.191.89±0.371.91±0.071.96±0.031.91±0.07C20:3n60.54±0.050.50±0.140.54±0.080.50±0.060.53±0.010.51±0.040.58±0.020.52±0.040.52±0.040.53±0.06C20:4n65.42±0.155.61±0.355.41±0.325.59±0.455.50±0.215.53±0.105.75±0.235.65±0.305.34±0.525.13±0.35C20:4n30.66±0.120.78±0.230.70±0.050.72±0.090.63±0.150.66±0.130.69±0.040.56±0.020.74±0.060.65±0.06C20:5n314.44±0.8313.91±0.6114.83±0.6514.40±1.1714.56±0.2914.99±0.2514.35±0.0414.08±0.7714.88±0.0914.45±0.56C22:4n62.49±0.162.69±0.372.62±0.332.47±0.312.45±0.052.42±0.262.60±0.222.50±0.092.56±0.272.45±0.73C22:5n34.12±0.154.24±0.654.30±0.163.72±0.464.14±0.233.98±0.204.11±0.294.42±0.364.00±0.143.97±0.79C22:6n317.31±1.6518.09±1.1017.59±0.7818.31±0.8419.42±0.2317.73±0.9517.71±0.4617.76±1.0217.39±1.7417.34±0.63
注:标记2 h或7 d后的同一行上标记的不同字母表示差异有统计学意义。数值均为mean±S.D.(n=3),下同。
Note:The distinct letters labeled for the same line after 2 h or 7 d of labeling indicated the statistically significant difference by Tukey’s honestly significant difference (HSD) test.The values were mean±S.D.(n=3),et sequentia.
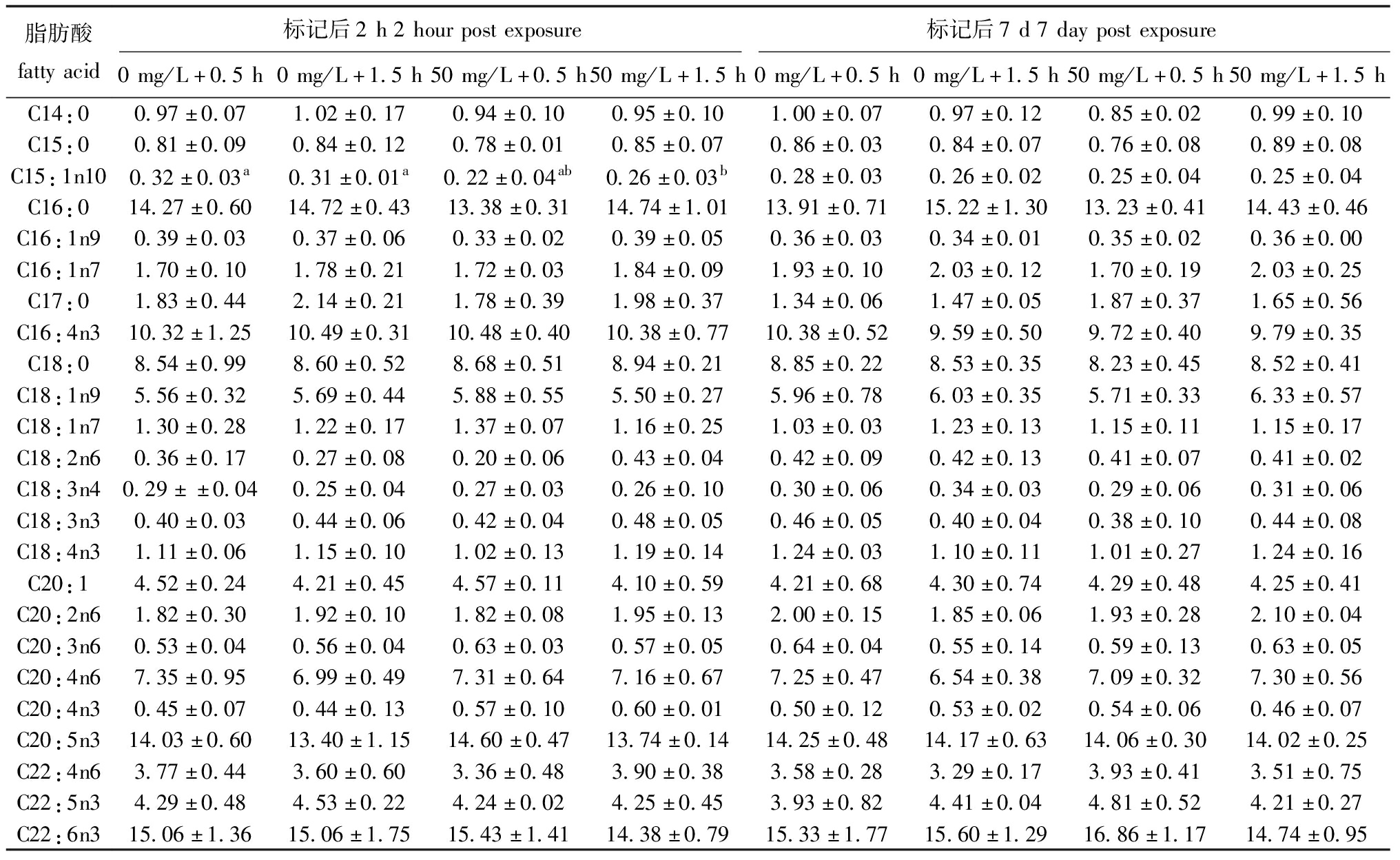
表3 钙黄绿素标记时间对四角蛤蜊脂肪酸相对丰度影响
Tab.3 Effects on fatty acid profiles of Mactra veneriformis during the Calcein marking experiment %
脂肪酸fattyacid标记后2h2hourpostexposure标记后7d7daypostexposure0mg/L+0.5h0mg/L+1.5h50mg/L+0.5h50mg/L+1.5h0mg/L+0.5h0mg/L+1.5h50mg/L+0.5h50mg/L+1.5hC14:00.97±0.071.02±0.170.94±0.100.95±0.101.00±0.070.97±0.120.85±0.020.99±0.10C15:00.81±0.090.84±0.120.78±0.010.85±0.070.86±0.030.84±0.070.76±0.080.89±0.08C15:1n100.32±0.03a0.31±0.01a0.22±0.04ab0.26±0.03b0.28±0.030.26±0.020.25±0.040.25±0.04C16:014.27±0.6014.72±0.4313.38±0.3114.74±1.0113.91±0.7115.22±1.3013.23±0.4114.43±0.46C16:1n90.39±0.030.37±0.060.33±0.020.39±0.050.36±0.030.34±0.010.35±0.020.36±0.00C16:1n71.70±0.101.78±0.211.72±0.031.84±0.091.93±0.102.03±0.121.70±0.192.03±0.25C17:01.83±0.442.14±0.211.78±0.391.98±0.371.34±0.061.47±0.051.87±0.371.65±0.56C16:4n310.32±1.2510.49±0.3110.48±0.4010.38±0.7710.38±0.529.59±0.509.72±0.409.79±0.35C18:08.54±0.998.60±0.528.68±0.518.94±0.218.85±0.228.53±0.358.23±0.458.52±0.41C18:1n95.56±0.325.69±0.445.88±0.555.50±0.275.96±0.786.03±0.355.71±0.336.33±0.57C18:1n71.30±0.281.22±0.171.37±0.071.16±0.251.03±0.031.23±0.131.15±0.111.15±0.17C18:2n60.36±0.170.27±0.080.20±0.060.43±0.040.42±0.090.42±0.130.41±0.070.41±0.02C18:3n40.29±±0.040.25±0.040.27±0.030.26±0.100.30±0.060.34±0.030.29±0.060.31±0.06C18:3n30.40±0.030.44±0.060.42±0.040.48±0.050.46±0.050.40±0.040.38±0.100.44±0.08C18:4n31.11±0.061.15±0.101.02±0.131.19±0.141.24±0.031.10±0.111.01±0.271.24±0.16C20:14.52±0.244.21±0.454.57±0.114.10±0.594.21±0.684.30±0.744.29±0.484.25±0.41C20:2n61.82±0.301.92±0.101.82±0.081.95±0.132.00±0.151.85±0.061.93±0.282.10±0.04C20:3n60.53±0.040.56±0.040.63±0.030.57±0.050.64±0.040.55±0.140.59±0.130.63±0.05C20:4n67.35±0.956.99±0.497.31±0.647.16±0.677.25±0.476.54±0.387.09±0.327.30±0.56C20:4n30.45±0.070.44±0.130.57±0.100.60±0.010.50±0.120.53±0.020.54±0.060.46±0.07C20:5n314.03±0.6013.40±1.1514.60±0.4713.74±0.1414.25±0.4814.17±0.6314.06±0.3014.02±0.25C22:4n63.77±0.443.60±0.603.36±0.483.90±0.383.58±0.283.29±0.173.93±0.413.51±0.75C22:5n34.29±0.484.53±0.224.24±0.024.25±0.453.93±0.824.41±0.044.81±0.524.21±0.27C22:6n315.06±1.3615.06±1.7515.43±1.4114.38±0.7915.33±1.7715.60±1.2916.86±1.1714.74±0.95
脂肪酸组成上,多不饱和脂肪酸(PUFA)>饱和脂肪酸(SFA)>单不饱和脂肪酸(MUFA),ω3脂肪酸的占比远大于ω6脂肪酸(图6)。在试验一标记后的第2 h,E组次要脂肪酸C18:1n9显著低于B组(P<0.05),D、E组C18:2n6显著低于A、B组(P<0.05),但在标记后第7 d,上述脂肪酸恢复至正常水平。在试验二中,d组C15:1n10在标记后的第2 h显著低于a、b组,在7 d后同样恢复至正常水平(表2和表3)。试验一和试验二各组在脂肪酸总含量上均无显著性差异(P<0.05)(图7)。
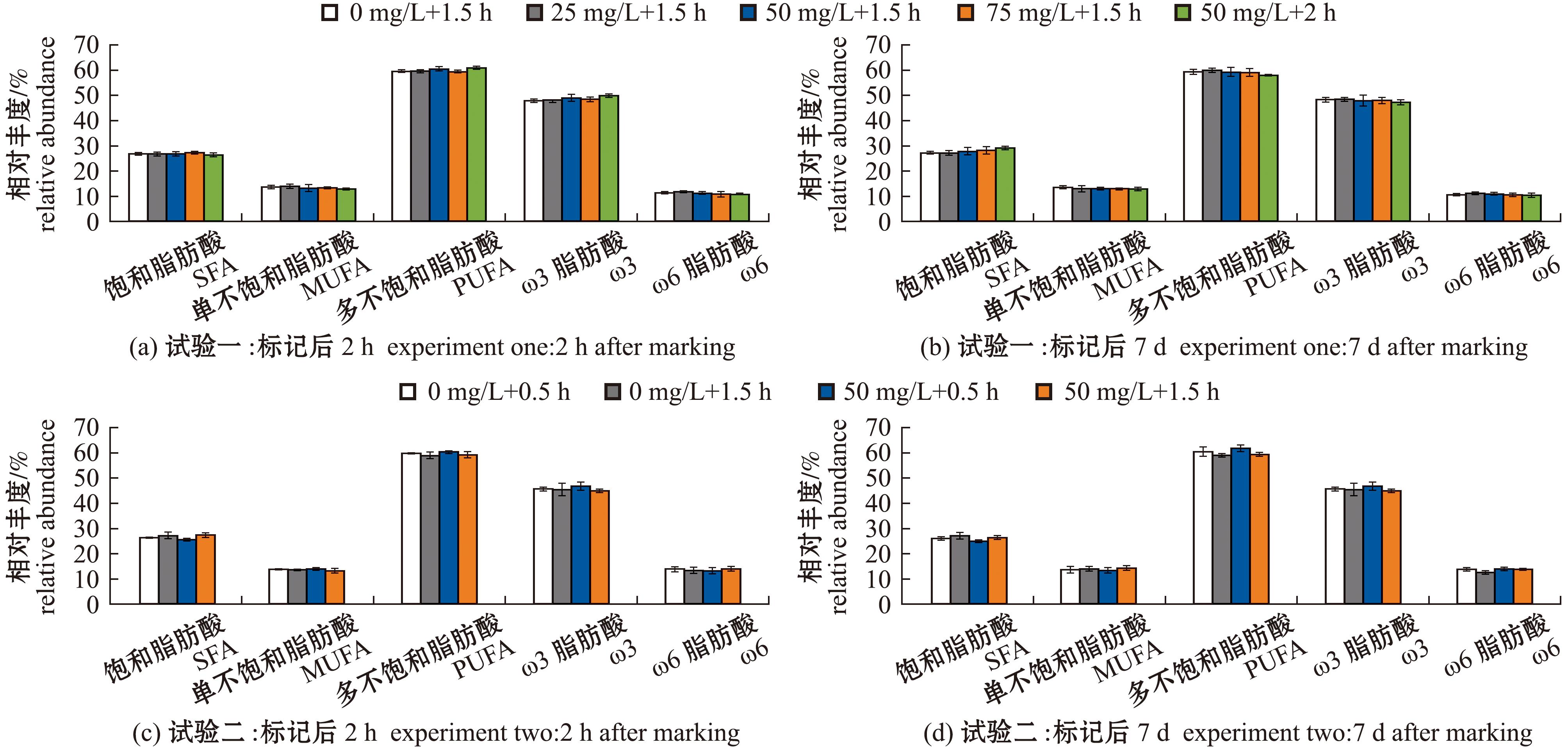
SFA、MUFA和PUFA分别代表饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸;ω3包括C16:4n3、C18:3n3、C18:4n3、C20:4n3、C20:5n3、C22:5n3和C22:6n3;ω6包括C18:2n6、C20:2n6、C20:3n6、C20:4n6和C22:4n6。
SFA,MUFA,PUFA indicated saturated,monounsaturated,and polyunsaturated fatty acids,respectively;ω3 referred to C16:4n3,C18:3n3,C18:4n3,C20:4n3,C20:5n3,C22:5n3 and C22:6n3;ω6 referred to C18:2n6,C20:2n6,C20:3n6,C20:4n6 and C22:4n6.
图6 不同饱和程度脂肪酸在四角蛤蜊中的相对丰度
Fig.6 Relative abundances of fatty acids with different saturation degrees in Mactra veneriformis
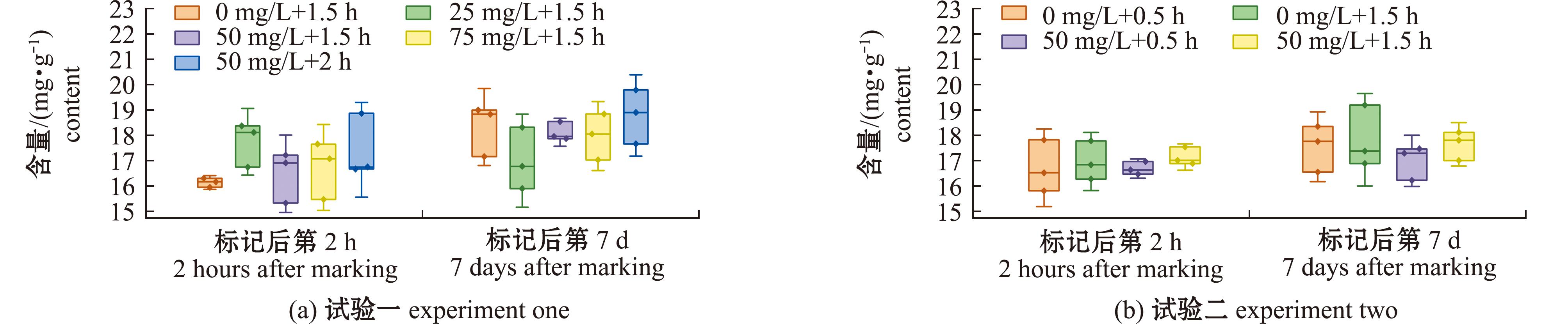
图7 四角蛤蜊总脂肪酸含量
Fig.7 Total fatty acid content of Mactra veneriformis
2.4 钙黄绿素标记效果评价
钙黄绿素能够有效标记四角蛤蜊,在480~490 nm蓝光照射下,成功标记的贝类壳面均匀散发黄绿色荧光,四角蛤蜊中的荧光强度最高可达3级(图8)。从表4可见,试验一中各试验组标记成功率均为100%,除B组良好率显著低于其他组外(P<0.05),其余各组良好率均为100%。试验二中,四角蛤蜊50 mg/L钙黄绿素浸泡0.5 h与浸泡1.5 h的标记质量无显著性差异(P>0.05)。
表4 四角蛤蜊标记质量评价
Tab.4 Quality evaluation of Mactra veneriformis marking %
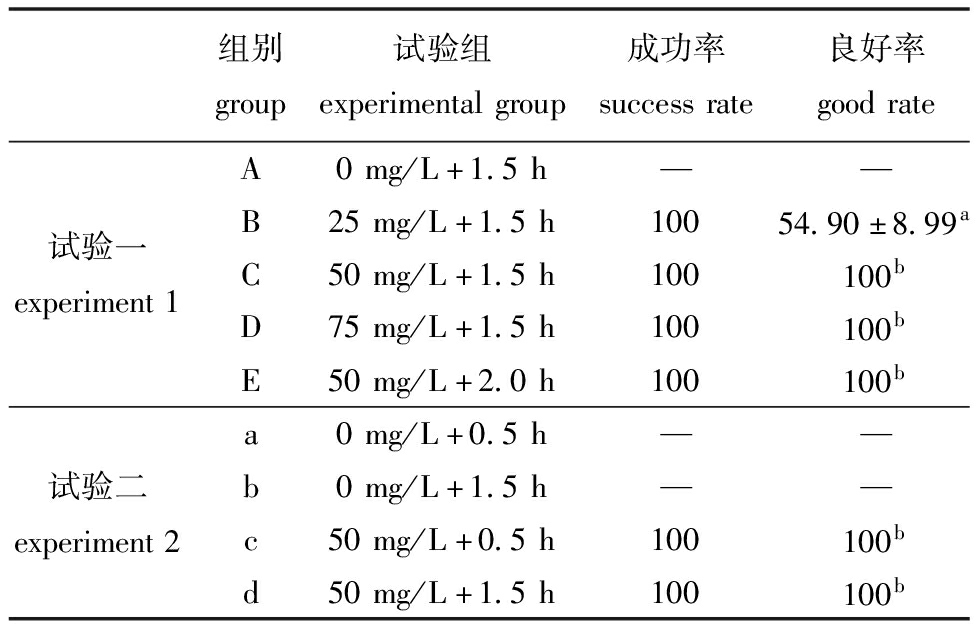
组别group试验组experimentalgroup成功率successrate良好率goodrateA0mg/L+1.5h——B25mg/L+1.5h10054.90±8.99a试验一experiment1C50mg/L+1.5h100100bD75mg/L+1.5h100100bE50mg/L+2.0h100100ba0mg/L+0.5h——试验二experiment2b0mg/L+1.5h——c50mg/L+0.5h100100bd50mg/L+1.5h100100b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05);单因素方差分析,下同。
Note:The means with different letters within the same line are significantly different in the groups at the 0.05 probability level;one-way ANOVA,et sequentia.

图8 钙黄绿素标记四角蛤蜊
Fig.8 Fluorescent labeling of calcein on Mactra veneriformis
2.5 原位标记效果评价
从表5可见,原位标记回捕率为10%~13.33%,各组无显著性差异(P>0.05),其中,75 mg/L组四角蛤蜊的标记成功率和良好率显著高于50 mg/L组(P<0.05)。
表5 原位标记效果评价
Tab.5 Evaluation of in situ marking result %
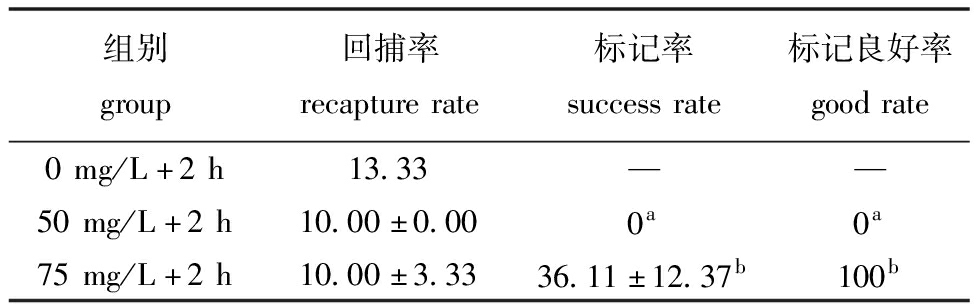
组别group回捕率recapturerate标记率successrate标记良好率goodrate0mg/L+2h13.33——50mg/L+2h10.00±0.000a0a75mg/L+2h10.00±3.3336.11±12.37b100b
3 讨论
3.1 钙黄绿素对四角蛤蜊标记的安全性评估
死亡率是各类标记对生物最直观的负面影响,可以直接校验标记方案的可行性。当化学荧光素浓度过高或标记时长超过生物耐受限度时,标记贝类的生理生化过程受到影响,进而生长受限甚至死亡。在本研究过程中,两批次试验各组贝类在标记后7 d的死亡率与对照组均无明显差异。这与利用钙黄绿素标记菲律宾蛤仔(Ruditapes philippinarum)[20]、魁蚶(Anadara broughtonii)[29]和新西兰绿唇贻贝(Perna canaliculus)[30]的研究结果一致。还有研究报道,浸染钙黄绿素对海湾扇贝(Argopecten irradians)[31]、油黑壳菜蛤(Mytilus trossulus)[31]及美洲牡蛎(Crassostrea virginica)的生长具有促进作用[32-33]。由此可见,钙黄绿素是一种相对安全的荧光标记素,在适宜的浓度和标记方式下,不会影响贝类的存活与生长。
当贝类受到胁迫时,机体内会产生大量活性氧自由基(ROS),生成过多会引起组织脂质过氧化。包括SOD、CAT、GSH-PX等在内的抗氧化酶活性能够有效反映外源物质对有机体的影响情况[34],丙二醛(MDA)含量可间接反映贝类受到氧化应激产生的组织细胞的损伤程度[35-36]。本试验所用钙黄绿素对四角蛤蜊的生理影响轻微,贝类软体部组织SOD、CAT、GSH-PX活性和MDA含量在标记前后无显著性变化。脂肪酸能够检测、记录和评估环境胁迫对生物的影响[37]。如高盐胁迫会引起缢蛏中EPA和DHA相对丰度增加[38],美洲牡蛎的EPA和DHA及C20:4n6含量会随温度波动而变化[39]。本研究中,两批次试验各组贝类脂肪酸总量无显著性变化,钙黄绿素仅在标记初期(2 h)导致少数几种脂肪酸发生变化,与对照组差异明显的C18:2n6与C15:1n10的相对丰度均小于1%,其余发生变化的脂肪酸种类亦不相同。因此,四角蛤蜊脂肪酸组成与含量受到荧光标记的影响极小。综上表明,试验设定的钙黄绿素标记条件对四角蛤蜊的生理状况无明显的负面影响,可作为进一步原位标记方案研发的潜在选择。
3.2 标记贝类的荧光特征
钙黄绿素浸染标记的四角蛤蜊在480~490 nm激发波长下,贝壳整体散布黄绿素荧光。与四角蛤蜊荧光特点类似的贝类包括满月蛤(Loripes lacteus)[40]、魁蚶[29]、美丽蚌(Lampsilis cardium)[41]等,而在光滑河蓝蛤(Potamocorbula laevis)、菲律宾蛤仔[20]和美洲牡蛎幼虫[32]中,荧光标记则集中在贝壳生长边缘部位。也有研究指出,钙黄绿素注射标记马萨特兰珠贝(Pinctada mazatlanica),会使其整个壳面散发荧光,而采用浸染的方法则是在生长边缘形成清晰的荧光条带[42]。茜素红浸染标记魁蚶会使其整个表面散布橘红色荧光[29],而标记黑唇鲍(Haliotis rubra)会在其生长边缘形成荧光条带[43]。在使用土霉素浸染标记贝类时也发现了上述现象[41,43]。由此推测,这类现象受到荧光染剂种类的影响较小,可能与荧光素结合位置、贝类生长速度、不同贝类的生物矿化特征,以及同种贝类不同生长发育阶段的贝类矿化特征有关,相关特征的背后规律和机制解析有助于针对不同贝类和试验目的快速选择适宜的标记方法。
3.3 钙黄绿素对四角蛤蜊的最佳标记条件
通过批次试验发现,钙黄绿素浓度是影响标四角蛤蜊标记效果的主要因素,浸泡时间是次要因素。当钙黄绿素浓度达50 mg/L及以上时,可在短时间内大规模、高质量标记四角蛤蜊。在此基础上延长浸泡时间可进一步提高标记质量,如试验二中,50 mg/L钙黄绿素浸泡0.5 h和1.5 h的标记成功率和标记良好率(标记质量2级以上视为良好)均为100%,但在浸泡0.5 h的四角蛤蜊中,标记质量在3级以上的比例仅有3.75%,显著低于浸泡1.5 h的18.75%。总体而言,本研究中四角蛤蜊的标记质量随钙黄绿素浓度增加和浸染时间延长而提高,在钙黄绿素50 mg/L浸染1.5~2 h时标记质量最佳。这一结论与钙黄绿素浸染魁蚶(钙黄绿素300 mg/L浸染24 h)[29]、新西兰绿唇贻贝(钙黄绿素200 mg/L浸染24 h)[30]及黑唇鲍(钙黄绿素100 mg/L浸染48 h)[44]的发现相一致。也有研究指出,当钙黄绿素的浓度达到一定程度时,继续增加浓度或延长浸染时间,贝类荧光标记质量未获得显著提升,如Moran等[31]使用钙黄绿素标记海湾扇贝面盘幼虫时发现,钙黄绿素浓度10 mg/L浸染72 h与5 mg/L浸染48 h的标记效果无显著性差异,这可能与贝类结合荧光素的能力有关。因此,在进行放流标记之前,建议根据滩涂潮汐周期优化室内模拟试验结果以确定最佳标记条件。
3.4 原位标记效果的潜在影响因素
原位标记除能减少因运输造成的胁迫外,还能够最大程度上展现贝类标记在自然生境下的保留情况,得到的试验数据更加准确且符合实际情况。在辽东湾蛤蜊岗原位标记试验中,50 mg/L钙黄绿素标记组1个月后回捕个体中的标记率为0%,可能是该组的3个原位装置处于湍急区域,潮流带走标记贝类的同时,将周围生境中未经过标记的贝类带入原位装置中。75 mg/L组的回捕数据能够为上述阐释提供依据,两个浓度组的回捕率接近,但75 mg/L组所有带有荧光标记的四角蛤蜊,其标记质量均在2级及以上,未发现处于1级的过渡状态,推测该组四角蛤蜊可能受到潮汐影响而发生转滩现象。因此,在原位试验中应注重结合自然环境条件,减少操作误差,提高精确度。
4 结论
1)试验所用钙黄绿素标记条件均能够在四角蛤蜊壳面形成清晰的荧光标记,且不会对其存活和正常生理生化活动造成明显负面影响。
2)钙黄绿素浓度在50 mg/L以上时,能够以较高的质量在短时间内大规模标记四角蛤蜊。
3)综合考虑标记效果和滩涂潮汐时间等自然因素,推荐使用75 mg/L钙黄绿素浸泡标记2 h作为滩涂原位标记方案研发的适宜条件。
[1] 王金叶,张安国,李晓东,等.蛤蜊岗滩涂贝类分布及其与环境因子的关系[J].海洋科学,2016,40(4):32-39.WANG J Y,ZHANG A G,LI X D,et al.Spatial distribution of buried molluscs and their relationship with sediment factors in Geligang[J].Marine Sciences,2016,40(4):32-39.(in Chinese)
[2] 刘强,张士华,刘艳芬,等.黄河三角洲潮间带四角蛤蜊资源调查分析[J].海洋渔业,2018,40(2):163-170.LIU Q,ZHANG S H,LIU Y F,et al.Survey and analysis of Mactra venerformis resources in intertidal zone of the Yellow River Delta[J].Marine Fisheries,2018,40(2):163-170.(in Chinese)
[3] 李昂,冯加岭,李加琦,等.蛤蜊岗不同贝龄四角蛤蜊数量性状的通径分析[J].渔业科学进展,2024,45(1):185-193.LI A,FENG J L,LI J Q,et al.Path analysis of quantitative characters for Mactra veneriformis with different ages in geligang[J].Progress in Fishery Sciences,2024,45(1):185-193.(in Chinese)
[4] 林基亮,王春德,吕倩,等.青岛地区四角蛤蜊(Mactra veneriformis)2个自然群体遗传多样性RAPD分析[J].青岛农业大学学报(自然科学版),2020,37(4):289-293,303.LIN J L,WANG C D,LÜ Q,et al.Genetic diversity RAPD analysis of two natural population of Mactra veneriformis in Qingdao Area[J].Journal of Qingdao Agricultural University (Natural Science Edition),2020,37(4):289-293,303.(in Chinese)
[5] KE Q Z,LI Q.Annual dynamics of glycogen,lipids,and proteins during the reproductive cycle of the surf clam Mactra veneriformis from the north coast of Shandong Peninsular,China[J].Invertebrate Reproduction &Development,2013,57(1):49-60.
[6] 刘项峰,谢玺,陈微,等.辽河口四角蛤蜊繁殖周期研究[J].水产科学,2021,40(6):883-888.LIU X F,XIE X,CHEN W,et al.Reproduction of surf clam Mactra veneriformis inhabiting the Liaohe Estuary[J].Fisheries Science,2021,40(6):883-888.(in Chinese)
[7] 闫喜武,张跃环,左江鹏,等.北方沿海四角蛤蜊人工育苗技术的初步研究[J].大连水产学院学报,2008,23(5):348-352.YAN X W,ZHANG Y H,ZUO J P,et al.Artificial breeding technique of clam Mactra veneriformis in Northern coast in China[J].Journal of Dalian Fisheries College,2008,23(5):348-352.(in Chinese)
[8] 闫喜武,王琰,郭文学,等.四角蛤蜊形态性状对重量性状的影响效果分析[J].水产学报,2011,35(10):1513-1518.YAN X W,WANG Y,GUO W X,et al.Effects of shell morphological traits on the weight traits of clam Mactra veneriformis Reeve along northern coast in China[J].Journal of Fisheries of China,2011,35(10):1513-1518.(in Chinese)
[9] 滕炜鸣,高士林,刘谞,等.盐度对辽东湾四角蛤蜊和光滑河蓝蛤摄食率和滤水率的影响[J].水产科学,2018,37(5):622-627.TENG W M,GAO S L,LIU X,et al.Effects of salinity on filtration and ingestion rates of surf clam Mactra veneri formis and clam Potamocorbula laevis in Liaodong Bay[J].Fisheries Science,2018,37(5):622-627.(in Chinese)
[10] YU J H,SONG J H,CHOI M C,et al.Effects of water temperature change on immune function in surf clams,Mactra veneriformis (Bivalvia:Mactridae)[J].Journal of Invertebrate Pathology,2009,102(1):30-35.
[11] 彭中校,刘鸽,黄会,等.西草净对四角蛤蜊的毒性效应[J].生态毒理学报,2023,18(3):478-490.PENG Z X,LIU G,HUANG H,et al.Toxic effect of simetryn on Mactra veneriformis[J].Asian Journal of Ecotoxicology,2023,18(3):478-490.(in Chinese)
[12] 于帅.四角蛤蜊全基因组测序及低氧胁迫响应的研究[D].天津:天津农学院,2023.YU S.Study on whole genome sequencing and hypoxic stress response of Mactra veneriformis[D].Tianjin:Tianjin Agricultural University,2023 (in Chinese).
[13] ZHU N,YANG Y Y,XU H,et al.Bioaccumulation of decabromodiphenyl ether affects the antioxidant system in the clam Mactra veneriformis[J].Environmental Toxicology and Pharmacology,2019,68:19-26.
[14] WANG L C,ZHANG K,DI L Q,et al.Isolation and structural elucidation of novel homogenous polysaccharide from Mactra veneriformis[J].Carbohydrate Polymers,2011,86(2):982-987.
[15] SUN Y X,LIU X F,XIE X,et al.A high-quality chromosome-level genome assembly of the bivalve mollusk Mactra veneriformis[J].G3,2022,12(11):jkac229.
[16] ZHAO X R,WANG Q,LI X F,et al.Norgestrel causes digestive gland injury in the clam Mactra veneriformis:an integrated histological,transcriptomics,and metabolomics study[J].Science of the Total Environment,2023,871:162110.
[17] 翟伟康,刘文利,范诗玥.沿海滩涂资源管理面临的问题及对策[J].中国土地,2022(5):49-50.ZHAI W K,LIU W L,FAN S Y.Problems and countermeasures of coastal tidal flat resources management[J].China Land,2022(5):49-50.(in Chinese)
[18] GANCEL H N,CARMICHAEL R H,PARK K,et al.Field mark-recapture of calcein-stained larval oysters (Crassostrea virginica) in a freshwater-dominated estuary[J].Estuaries and Coasts,2019,42(6):1558-1569.
[19] SUGIURA D,KIKUYA N.Validation of the age estimation method using the shell section of the Manila clam Ruditapes philippinarum in Mutsu Bay,northern Japan[J].Aquaculture Science,2018,65(3):193-202.
[20] MAH K,BELLAMY E,D’AMICO F,et al.In situ fast marking study of Manila clams (Ruditapes philippinarum)[J].International Journal of Fisheries and Aquatic Studies,2021,9(1):47-51.
K,BELLAMY E,D’AMICO F,et al.In situ fast marking study of Manila clams (Ruditapes philippinarum)[J].International Journal of Fisheries and Aquatic Studies,2021,9(1):47-51.
[21] 夏雁青,李卫宾.钙黄绿素荧光性质的研究[J].广东化工,2015,42(7):29-30.XIA Y Q,LI W B.Study of calcein fluorescence properties[J].Guangdong Chemical Industry,2015,42(7):29-30.(in Chinese)
[22] 陈灵涵.钙黄绿素注射鲢幼鱼和拌饲投喂中华倒刺鲃幼鱼的毒性效应及其浸染标记效果的研究[D].重庆:西南大学,2021.CHEN L H.Study on toxic effects of calcein injection into juvenile silver carp and mixed feeding to juvenile Spinibarbus sinensis and its staining effect[D].Chongqing:Southwest University,2021.(in Chinese)
[23] 赵鹏,杨红生,王晓宇,等.钙黄绿素标记刺参的效果及其对刺参抗氧化酶活力的影响[J].水产学报,2011,35(3):372-378.ZHAO P,YANG H S,WANG X Y,et al.Marking sea cucumber Apostichopus japonicus with calcein and its effects on antioxidant system[J].Journal of Fisheries of China,2011,35(3):372-378.(in Chinese)
[24] DUAN Y F,ZHANG J S,DONG H B,et al.Effect of desiccation and resubmersion on the oxidative stress response of the kuruma shrimp Marsupenaeus japonicus[J].Fish &Shellfish Immunology,2016,49:91-99.
[25] LEE M C,PARK J C,LEE J S.Effects of environmental stressors on lipid metabolism in aquatic invertebrates[J].Aquatic Toxicology,2018,200:83-92.
[26] GONÇALVES A M M,MESQUITA A F,VERDELHOS T,et al.Fatty acids’ profiles as indicators of stress induced by of a common herbicide on two marine bivalves species:Cerastoderma edule (Linnaeus,1758) and Scrobicularia plana (da Costa,1778)[J].Ecological Indicators,2016,63:209-218.
[27] LIU J,LIU Y N,WANG H T,et al.Direct transesterification of fresh microalgal cells[J].Bioresource Technology,2015,176:284-287.
[28] LV H J,ZHANG X M,XI D,et al.Use of calcein and alizarin red S for immersion marking of black rockfish Sebastes schlegelii juveniles[J].Chinese Journal of Oceanology and Limnology,2014,32(1):88-98.
[29] ZHOU S S,ZHANG X M,LI W T,et al.Experimental evaluation of fluorescent (alizarin red S and calcein) and clip-tag markers for stock assessment of ark shell,Anadara broughtonii[J].Chinese Journal of Oceanology and Limnology,2017,35(2):265-274.
[30] FITZPATRICK M P,JEFFS A G,DUNPHY B J.Efficacy of calcein as a chemical marker of green-lipped mussel (Perna canaliculus) larvae and its potential use for tracking larval dispersal[J].Aquaculture Research,2013,44(3):345-353.
[31] MORAN A L,MARKO P B.A simple technique for physical marking of larvae of marine bivalves[J].Journal of Shellfish Research,2005,24(2):567-571.
[32] SPIRES J E,DUNGAN C F,NORTH E W.Marking the shells of pediveliger eastern oysters Crassostrea virginica,with a calcein fluorochrome dye[J].Journal of Shellfish Research,2022,40(3):479-487.
[33] SPIRES J E,NORTH E W.Marking the shells of juvenile and adult eastern oysters,Crassostrea virginica,with the fluorochrome dye calcein and measuring growth and mortality after marking[J].Journal of Molluscan Studies,2022,88(1):eyac004.
[34] SCHIEBER M,CHANDEL N S.ROS function in redox signaling and oxidative stress[J].Current Biology,2014,24(10):R453-R462.
[35] ZHANG Q P,WU X H,ZHENG J H,et al.Progress of researches on methods for determination of malondialdehyde in biological samples[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2016,52(8):979-985.
[36] 许莉佳.荧光标记斑马鱼稚鱼耳石的效果及其对抗氧化酶活力的影响[D].重庆:西南大学,2012.XU L J.Effect of fluorescent labeling on otolith of zebrafish larvae and its effect on anti-oxidase activity[D].Chongqing:Southwest University,2012.(in Chinese)
[37] FILIMONOVA V,GONÇALVES F,MARQUES J C,et al.Fatty acid profiling as bioindicator of chemical stress in marine organisms:a review[J].Ecological Indicators,2016,67:657-672.
[38] 冉照收,芦文奇,徐继林,等.盐度对缢蛏稚贝脂肪酸和甾醇组成的影响[J].中国食品学报,2017,17(9):48-57.RAN Z S,LU W Q,XU J L,et al.Salinity effect on fatty acid and sterol compositions of juvenile Sinonovacula constricta[J].Journal of Chinese Institute of Food Science and Technology,2017,17(9):48-57.(in Chinese)
[39] PERNET F,GAUTHIER-CLERC S,MAYRAND  .Change in lipid composition in eastern oyster (Crassostrea virginica Gmelin) exposed to constant or fluctuating temperature regimes[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2007,147(3):557-565.
.Change in lipid composition in eastern oyster (Crassostrea virginica Gmelin) exposed to constant or fluctuating temperature regimes[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2007,147(3):557-565.
[40] VAN DER GEEST M,VAN GILS J A,VAN DER MEER J,et al.Suitability of calcein as an in situ growth marker in burrowing bivalves[J].Journal of Experimental Marine Biology and Ecology,2011,399(1):1-7.
[41] EADS C B,LAYZER J B.How to pick your mussels out of a crowd:using fluorescence to mark juvenile freshwater mussels[J].Journal of the North American Benthological Society,2002,21(3):476-486.
[42] LORIA P L,HUATO-SOBERANIS L.Efficacy of calcein and Coomassie Blue dyeing of shell growing-edges and micro growth-bands:ageing juvenile of Pinctada mazatlanica (Pterioida:Pteriidae)[J].Revista De Biologia Tropical,2014,62(3):957-968.
[43] DAY R W,WILLIAMS M C,HAWKES G P.A comparison of fluorochromes for marking abalone shells[J].Marine and Freshwater Research,1995,46(3):599.
[44] CHICK R C.Batch-tagging blacklip abalone (Haliotis rubra) for identification of hatchery-reared individuals on natural coastal reefs in new South Wales,Australia[J].Journal of Shellfish Research,2010,29(1):209-215.