近年来,中国虾类养殖业发展迅速,养殖规模不断扩大的同时也面临着诸多挑战。其中,病害问题较为突出,并成为限制养殖业发展的主要瓶颈之一。目前,虾类中的病害大多数是由感染性疾病(infectious diseases)引发,短时间内可造成大规模死亡,给养殖业带来巨大的经济损失[1]。抗生素类药物的使用是目前解决感染性疾病最直接有效的方法,但是,过量使用抗生素不仅会导致病原微生物产生抗药性[2],药物的积累和残留还会引起环境污染和食品安全问题。因此,有必要对虾类潜在免疫基因开展功能和免疫机制研究,为病害防控提供理论依据和作用靶点,促进虾类养殖业的健康、可持续发展。
双氧化酶(dual oxidase,Duox)是烟酰胺腺嘌呤二核苷酸(NADPH)氧化酶(NOX)家族的成员之一,在机体活性氧(reactive oxygen species,ROS)产生、生物钟调节、免疫应答等多种生命活动中均发挥重要功能,广泛存在真核生物体内[3]。在生物体受到病原菌刺激时,Duox通过质膜传输电子,催化分子氧的还原,产生超氧化物和下游活性氧,有效地杀伤或抑制病原微生物的侵染[4-5]。Duox诱导产生的ROS参与调控细胞内多种生理过程,包括免疫防御、细胞增殖分化、生长发育、伤口修复和激素合成等[6-7]。目前,在家蚕(Bombyx mori)、黑腹果蝇(Drosophila melanogaster)、飞灰虱(Laodelphghax striatellus)等节肢动物中的研究发现,Duox-ROS免疫过程对于维持肠道内环境稳态至关重要。马振刚等[8]研究发现,家蚕微孢子虫感染家蚕幼虫时,Duox蛋白表达及ROS含量显著上升,说明Duox-ROS系统参与宿主对微孢子虫感染的免疫应答。同样地,副溶血弧菌和脂多糖(LPS)分别刺激拟穴青蟹(Scylla paramamosain)时,Duox基因表达量在6 h时显著上升,敲降Duox基因后,血淋巴中细菌数量增加,清除细菌能力下降,证实Duox基因在维持拟穴青蟹血淋巴细菌稳态中发挥重要作用[9]。
脊尾白虾(Exopalaemon carinicauda)是中国特有的经济虾类,因其生长速度快、繁殖周期短、环境适应性强等优点,迅速成为池塘单养或混养的优选品种[10]。随着养殖规模不断扩大,养殖环境恶化、高密度养殖和滥用抗生素等问题日益凸显,导致脊尾白虾对致病菌的抵抗力下降,病害频发不仅影响了虾类的健康生长,还严重影响了养殖户的经济效益。基于此,深入挖掘虾类潜在免疫基因的内在作用机制,对于虾类病害的预防和控制具有重要意义。目前,尽管在其他节肢动物中对于Duox的免疫功能研究较为深入,但在甲壳动物领域的研究仍然相对欠缺。本研究中以脊尾白虾为研究对象,基于实验室现有的转录组数据库,克隆获得脊尾白虾Duox基因的cDNA序列,并进行生物信息学分析。研究中还利用实时荧光定量PCR(qRT-PCR)和RNAi等技术,分析Duox基因在脊尾白虾不同组织及副溶血弧菌刺激后的表达情况。此外,本研究中还研究了敲降Duox基因后感染副溶血弧菌脊尾白虾存活率的变化,研究结果将为进一步探究Duox基因在脊尾白虾免疫功能中的作用提供科学参考。
1 材料与方法
1.1 材料
试验虾来自江苏连云港水产养殖公司,体长为(4.60±0.61) cm,体质量为(1.39±0.39) g。试验开始前,在实验室暂养7 d,暂养期间每天更换1/3体积的海水,持续充氧,每日8:00、20:00各投喂一次商业饲料,投喂量为虾体质量的3%。盐度控制在23~25,温度为20 ℃±2 ℃,pH值为7.8~8.2,氨氮质量浓度控制在0.05 mg/L以下。
挑选大小均一脊尾白虾,用50 μL微量注射器在围心腔小心抽取血淋巴组织,之后迅速解剖获取其肝胰腺、胃、肌肉、鳃、肠、心脏组织并将其放入提前加好的Trizol试剂中(全程置于冰上),组织匀浆后迅速置于-80 ℃冰箱中,以备后续使用。
1.2 方法
1.2.1 总RNA提取和cDNA的合成 采用RNA提取试剂盒(Total RNA Extractor,上海生工)提取虾心脏、肝胰腺、鳃、血淋巴、肌肉和胃组织样本的总RNA,利用Nanodrop 2000和琼脂糖凝胶电泳检测RNA浓度和质量。在确定RNA完整性的前提下,利用反转录试剂盒(HiScript® Ⅲ 1st Strand cDNA Synthesis Kit (+gDNA wiper),Vazyme)进行反转录获得cDNA。
1.2.2 Duox基因克隆 基于实验室脊尾白虾转录组数据库数据,采用Primer Premier 5.0软件设计Duox基因引物,为Duox-F1和Duox-R1,由上海生工生物工程有限公司合成(表1)。以cDNA为模板进行PCR扩增。整个扩增分为预变性、变性、退火和延伸4个过程,设置程序:94 ℃下预变性2 min,98 ℃下变性10 s,53.5 ℃下退火30 s,68 ℃下延伸2 min,共进行35个循环。琼脂糖凝胶电泳检测后切下目的条带,将回收纯化后的PCR产物与pCE3 Blunt Vector载体连接后转入到DH5α感受态细胞中,在含氨苄的固体培养基上培养,挑取阳性克隆单菌落进行菌液PCR验证后,送上海生工生物工程(上海)有限公司进行测序。
表1 试验引物序列
Tab.1 Experimental primer sequences
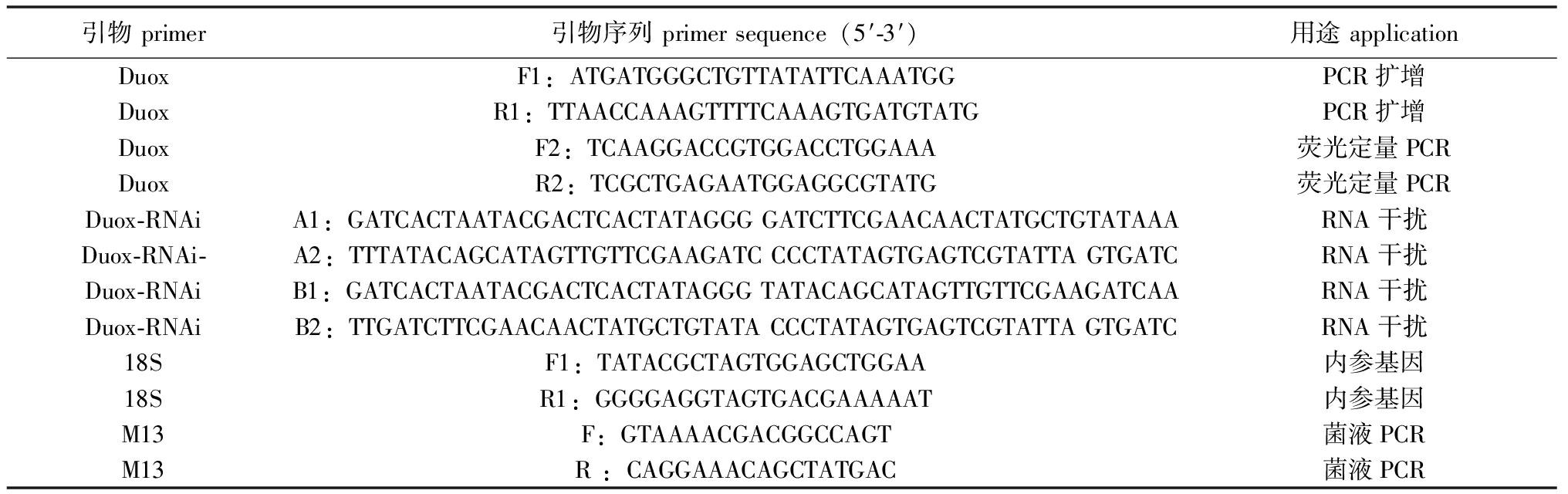
引物primer引物序列primersequence(5′-3′)用途applicationDuoxF1:ATGATGGGCTGTTATATTCAAATGGPCR扩增DuoxR1:TTAACCAAAGTTTTCAAAGTGATGTATGPCR扩增DuoxF2:TCAAGGACCGTGGACCTGGAAA荧光定量PCRDuoxR2:TCGCTGAGAATGGAGGCGTATG荧光定量PCRDuox-RNAiA1:GATCACTAATACGACTCACTATAGGGGATCTTCGAACAACTATGCTGTATAAARNA干扰Duox-RNAi-A2:TTTATACAGCATAGTTGTTCGAAGATCCCCTATAGTGAGTCGTATTAGTGATCRNA干扰Duox-RNAiB1:GATCACTAATACGACTCACTATAGGGTATACAGCATAGTTGTTCGAAGATCAARNA干扰Duox-RNAiB2:TTGATCTTCGAACAACTATGCTGTATACCCTATAGTGAGTCGTATTAGTGATCRNA干扰18SF1:TATACGCTAGTGGAGCTGGAA内参基因18SR1:GGGGAGGTAGTGACGAAAAAT内参基因M13F:GTAAAACGACGGCCAGT菌液PCRM13R:CAGGAAACAGCTATGAC菌液PCR
1.2.3 生物信息学分析 通过DNAMan软件分析基因及其编码的氨基酸序列,利用Expasy网站(https://www.expasy.org/)预测蛋白质的理化性质。使用prosite网站(https://prosite.expasy.org/)预测蛋白质结构域,利用TMHMM2.0网站(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)预测跨膜结构域,信号肽预测通过SignalP-4.1网址(https://services.healthtech.dtu.dk/services/SignalP-4.1/)完成,通过SOPMA网址(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)分析Duox的二级结构。利用Clustal W网站(https://www.genome.jp/tools-bin/clustalw)和MEGA 7.0软件,进行氨基酸多重序列比对和邻接法构建系统发育树。
1.2.4 Duox基因在组织中的表达情况 设计实时荧光定量PCR引物,18s为内参基因(表1),以脊尾白虾各组织的cDNA为模板,按照实时荧光定量试剂说明书(PerfectStart® Green qPCR SuperMix,TRAN)进行实时荧光定量PCR,(所用仪器:LightCycler 96,瑞士)。qRT-PCR体系为cDNA模板4 μL,Duox-F/R引物0.4 μL,2×PerfectStart® Green qPCR SuperMix 10 μL,Nuclease-free Water 5.2 μL,总计20 μL。设置程序:94 ℃下预变性30 s,94 ℃下变性5 s,60 ℃下退火30 s(两步法),共进行45个循环。熔解曲线程序为95 ℃下变性10 s,65 ℃下退火1 min,97 ℃下延伸1 s。采用2-ΔΔCt方法处理分析试验数据。
1.2.5 副溶血弧菌刺激后Duox基因的表达分析 将180只脊尾白虾分为两组,试验组为副溶血弧菌刺激的虾,对照组为正常饲养的虾。在试验开始前,对副溶血弧菌进行活化处理,挑取瓷珠菌种保存管中吸附有副溶血弧菌的小瓷珠,置入含有3% Nacl的LB液体培养基中37 ℃下震荡培养使其活化。吸取200 μL活化后的菌液至50 mL的培养基中进行扩培,扩培后通过离心的方式去除培养基,保留菌体沉淀。采用无菌生理盐水对菌体进行冲洗和重悬,再次离心,重复操作至获得澄清溶液,稀释菌液至3×108 CFU/mL[11],现配现用。以10 μL/只的剂量,通过第二腹节肌肉注射到试验组虾的体内,对照组注射相同剂量的生理盐水。在0、3、6、12、24、48、72 h时随机挑选9只脊尾白虾,剖其鳃组织进行总RNA提取和cDNA合成,利用实时荧光定量PCR技术,分析副溶血弧菌刺激后Duox基因的表达情况。
1.2.6 siRNA干扰效率验证 利用网站Thermo Fisher(https://rnaidesigner.thermofisher.com/rnaiexpress/)设计Duox基因的干扰引物(表1)(注:设计RNAi引物要避开实时荧光定量PCR引物的设计位点)。按照RNA干扰试剂盒(T7 RNAi Transcription Kit,Vazyme)说明书合成干扰试剂siRNA,现用现配。挑选180只大小均一、活力较好的脊尾白虾分为对照组和干扰组,每组放置90只虾,其中干扰组使用微量注射器按照5 μg/g的剂量[12],进行围心腔注射;对照组注射相同剂量的生理盐水。在注射后0、12、24、48、72 h时取脊尾白虾的鳃组织,提取总RNA,反转录为cDNA后进行实时荧光定量PCR,根据对照组和干扰组Duox基因的相对表达量计算siRNA的干扰效率(同一时间点对照组Doux基因相对表达量-干扰组Doux基因相对表达量)/对照组Doux基因相对表达量×100%)。
1.2.7 敲降Duox后副溶血弧菌刺激对脊尾白虾存活率的分析 试验挑选180只脊尾白虾,平均分为3组。第1组注射生理盐水1 h后,注射3×108 CFU/mL副溶血弧菌10 μL。第2组注射5 μg/g siRNA试剂1 h后,注射3×108 CFU/mL副溶血弧菌10 μL。第3组注射5 μg/g siRNA试剂1 h后,注射同剂量生理盐水。鉴于siRNA介导的RNA干扰作用通常是短效的,为了维持基因沉默效果,在试验过程中隔72 h后对第2组和第3组进行一次siRNA试剂的补充注射,第1组注射相同剂量生理盐水。在整个试验周期内,详细记录各组0、12、24、48、60、72、84、96、108、120 h时虾的存活情况,以分析siRNA试剂敲降Duox基因后副溶血弧菌刺激对脊尾白虾存活率的影响。
1.3 数据处理
所有试验均设置3个生物学重复。试验数据均以平均值±标准差(mean±S.D.)表示,利用SPSS 23.0软件进行单因素方差分析和独立样本T检验,采用Tukey’s法进行多重比较,显著性水平设为0.05,使用Excel软件绘图。
2 结果与分析
2.1 生物信息学分析
2.1.1 一级结构和理化性质分析 Duox基因编码区的长度为4 518 bp,共编码1 505个氨基酸,预测的蛋白相对分子量为174 410,理论等电点为6.73。ProtParam分析结果显示,组成Duox氨基酸残基中,亮氨酸(Leu) 9.0%占比最高,色氨酸(Trp) 1.5%占比最低(表2),Duox蛋白包括总负电荷残基数186,总正电荷残基数179,其分子式为C7855H12092N2118O2224S82,其不稳定指数为44.42,属于不稳定蛋白质。该蛋白总平均亲水系数是-0.310,脂肪系数为81.61,是一种亲水性蛋白。保守结构域分析显示,Duox蛋白具有双氧化物酶典型的结构特征(图1)。

单下划线表示信号肽序列,方框表示跨膜结构域,用灰色背景标出过氧化物酶结构域,双下划线表示EF结构域,短虚线标注为铁还原酶结构域,波浪线表示黄素腺嘌呤二核苷酸结构域,中虚线表示烟酰胺腺嘌呤二核苷酸结构域,*表示终止密码子。
Single underlining indicates the signal peptide sequence,boxes indicate transmembrane structural domains,the peroxidase domain is marked with the gray background,double underlining indicate EF binding domains,short dashed line is marked with the iron reductase binding domain,wavy line indicates the flavin adenine dinucleotide binding domain,medium dashed line indicates nicotinamide adenine dinucleotide,and asterisk indicates a stop codon.
图1 脊尾白虾Duox基因序列分析
Fig.1 Sequence analysis of Duox gene in Exopalaemon carinicauda
表2 Duox的氨基酸组成
Tab.2 Amino acid composition of Duox
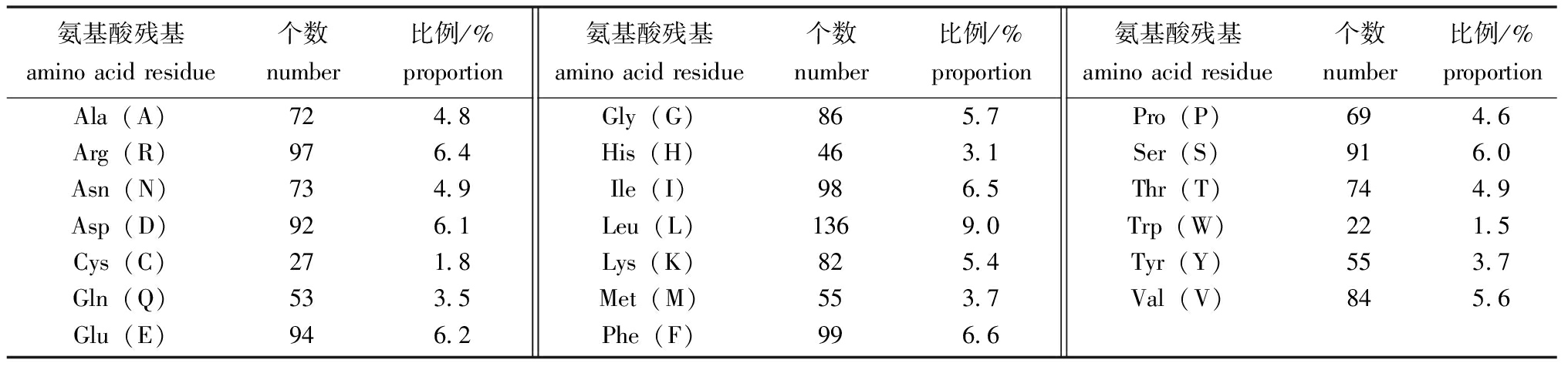
氨基酸残基aminoacidresidue个数number比例/%proportionAla(A)724.8Arg(R)976.4Asn(N)734.9Asp(D)926.1Cys(C)271.8Gln(Q)533.5Glu(E)946.2氨基酸残基aminoacidresidue个数number比例/%proportionGly(G)865.7His(H)463.1Ile(I)986.5Leu(L)1369.0Lys(K)825.4Met(M)553.7Phe(F)996.6氨基酸残基aminoacidresidue个数number比例/%proportionPro(P)694.6Ser(S)916.0Thr(T)744.9Trp(W)221.5Tyr(Y)553.7Val(V)845.6
2.1.2 二级结构分析 通过SOPMA网站预测分析脊尾白虾Duox蛋白质的二级结构,分析结果显示,二级结构中α螺旋(Alpha helix)所占比例40.80%、β转角(Beta turn)所占比例4.98%、无规卷曲(random coil)所占比例37.74%,以及延伸链(extended strand)所占比例16.48%。结果表明,α螺旋是Duox蛋白质二级结构中的主要构成元件,其次为无规卷曲(图2)。
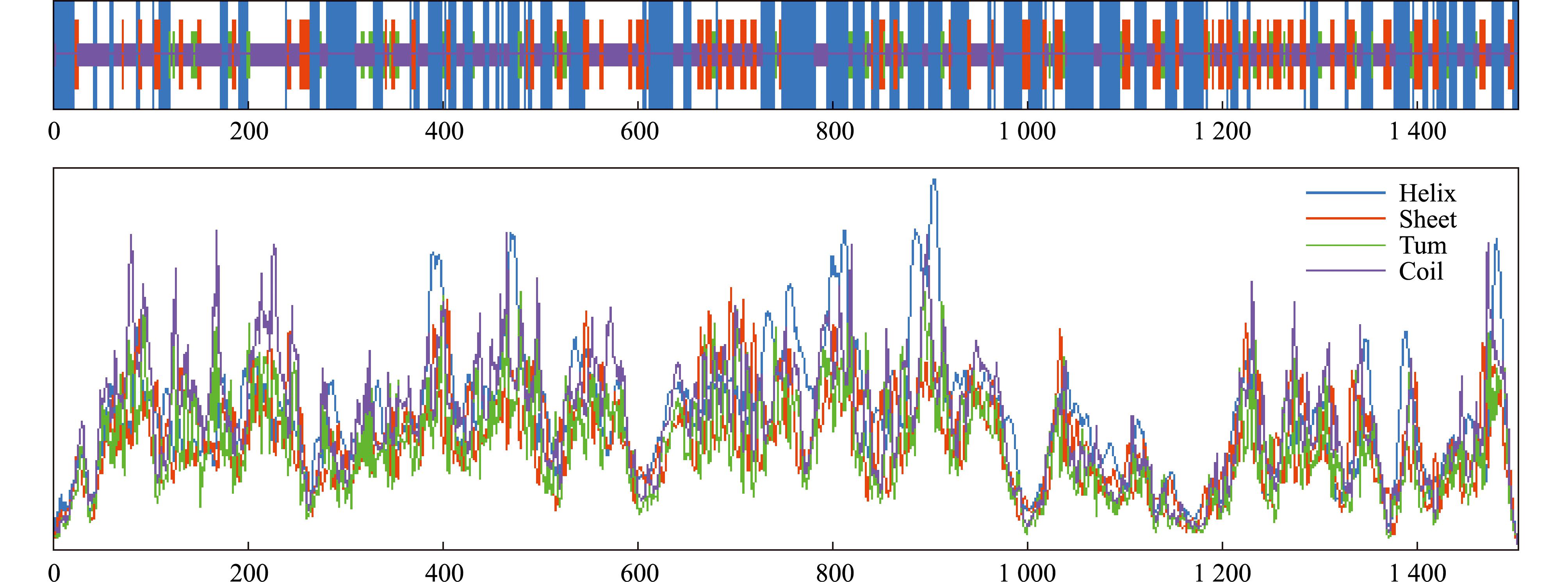
图2 SOPMA预测Duox二级结构
Fig.2 Prediction of Duox secondary structure by SOPMA
2.1.3 氨基酸序列多重比对及进化树分析 利用NCBI网站中的BLAST工具,选出与脊尾白虾Duox同源性高的其他物种的氨基酸序列,利用Clustal W和DNAMan进行多重序列比对(图3),与脊尾白虾Duox氨基酸序列一致性最高的是日本沼虾(Macrobrachium nipponense),为95.14%,与克氏原螯虾(Procambarus clarkii)、日本对虾(Penaeus japonicus)、南美白对虾(Penaeus vannamei)、斑节对虾(Penaeus monodon)、美洲螯龙虾(Homarus americanus)、中华绒螯蟹(Eriocheir sinensis)和三疣梭子蟹(Portunus trituberculatus)氨基酸序列一致性分别为85.24%、85.80%、86.31%、85.86%、85.39%、85.01%和84.21%。采用MEGA 7.0软件及邻接法(Neighbor-joining)构建系统发育树,从图4可见,脊尾白虾与日本沼虾聚为一小支,与其他虾蟹聚为甲壳动物的一大支,亲缘关系较近。

图3 脊尾白虾与其他物种Duox氨基酸序列比对
Fig.3 Comparison of Duox amino acid sequence between Exopalaemon carinicauda and other species
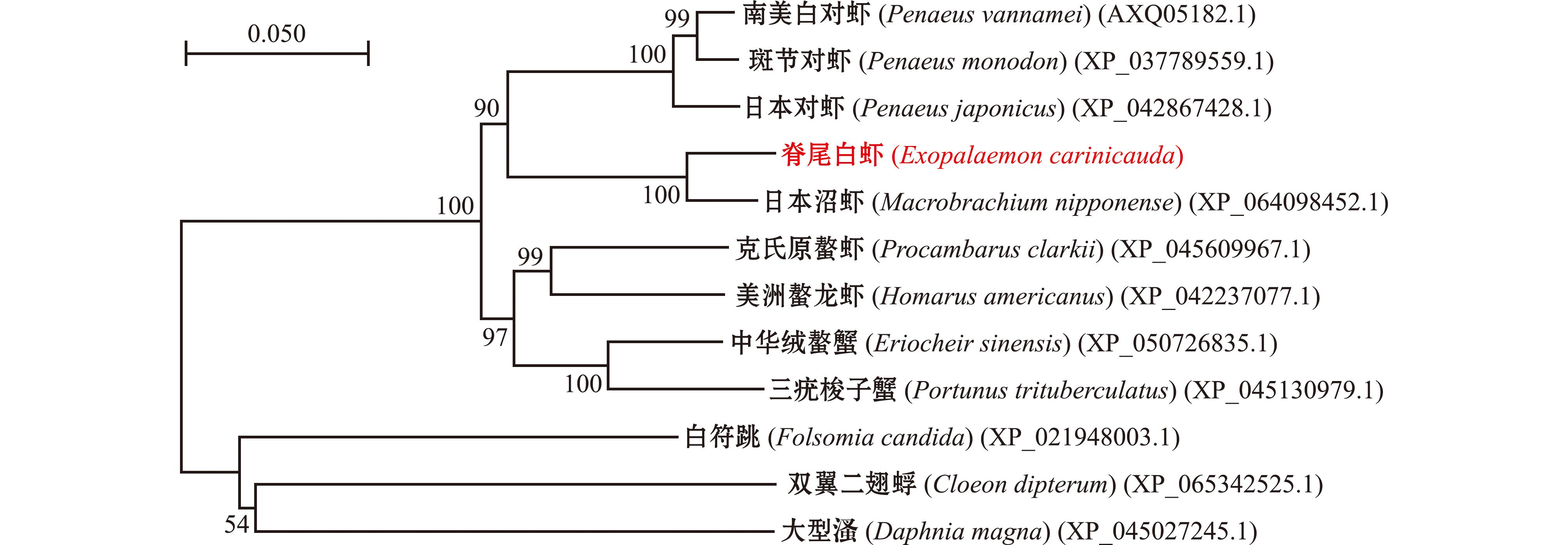
图4 脊尾白虾Duox系统进化树
Fig.4 Phylogenetic tree of Duox in Exopalaemon carinicauda
2.2 Duox基因在组织中的表达分析
实时荧光定量PCR分析Duox基因在不同组织中的表达情况,18s为内参基因。从图5可见,Duox基因在鳃、胃、心、肝胰腺、肌肉和血淋巴中均存在表达,其中,在鳃组织中表达量最高,且显著高于其他组织(P<0.05),在心组织中表达量最低(P<0.05)。
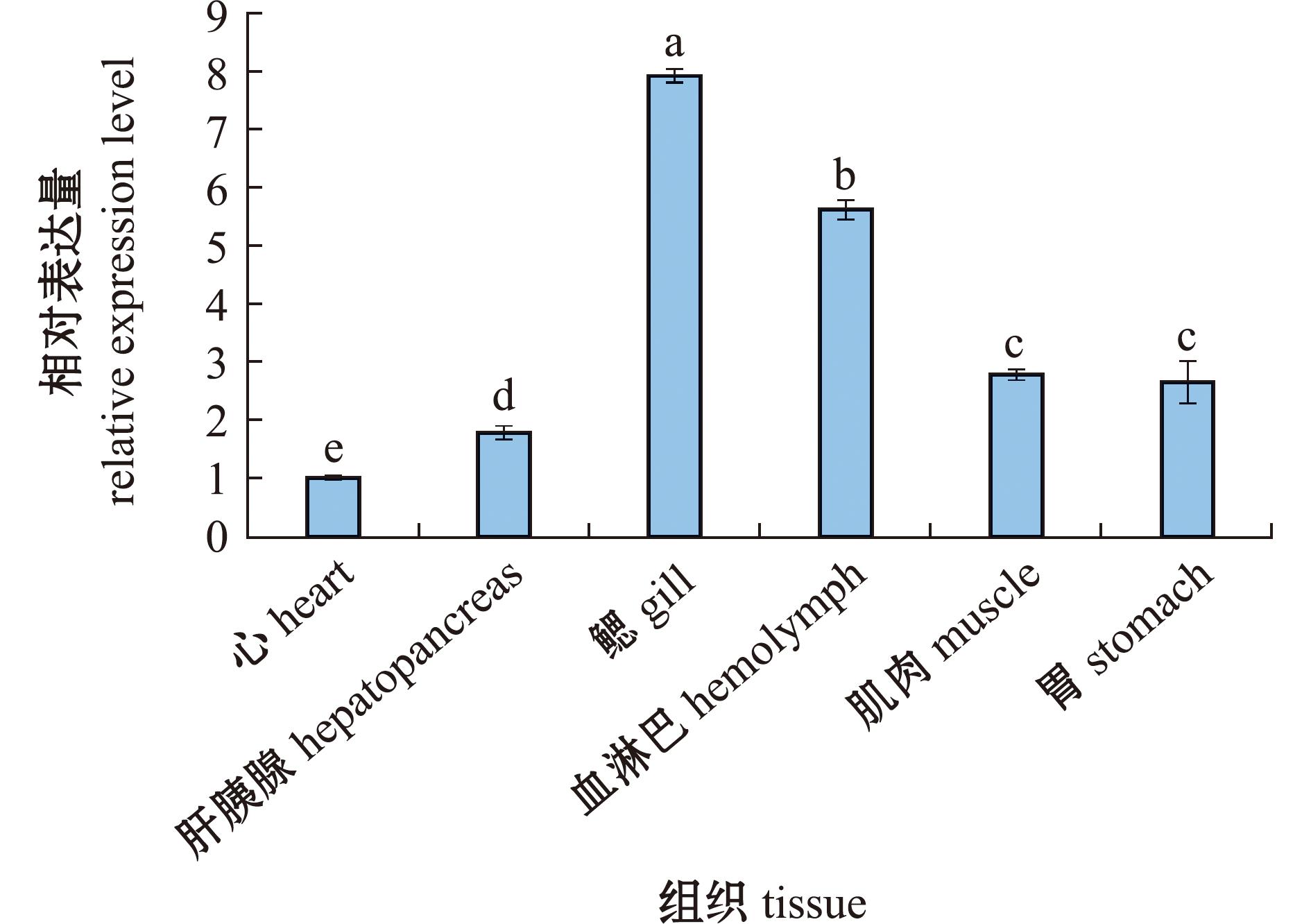
标有不同字母表示组间有显著性差异(P<0.05),标有相同字母者表示无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图5 Duox基因在不同组织中的表达
Fig.5 Expression level of Duox gene in different tissues
2.3 副溶血弧菌刺激后Duox基因的表达分析
为探究致病菌刺激脊尾白虾时Duox基因的响应情况,本研究中用副溶血弧菌刺激脊尾白虾,在0、3、6、12、24、48、72 h时收集鳃组织,以分析其在鳃组织中的表达情况。从图6可见,当副溶血弧菌刺激后,Duox的表达呈时间依赖性变化(P<0.05)。与对照组相比,Duox基因的相对表达量在副溶血弧菌刺激后显著上升,且在刺激后3 h时达到峰值,72 h时下降至对照组水平(P<0.05)。
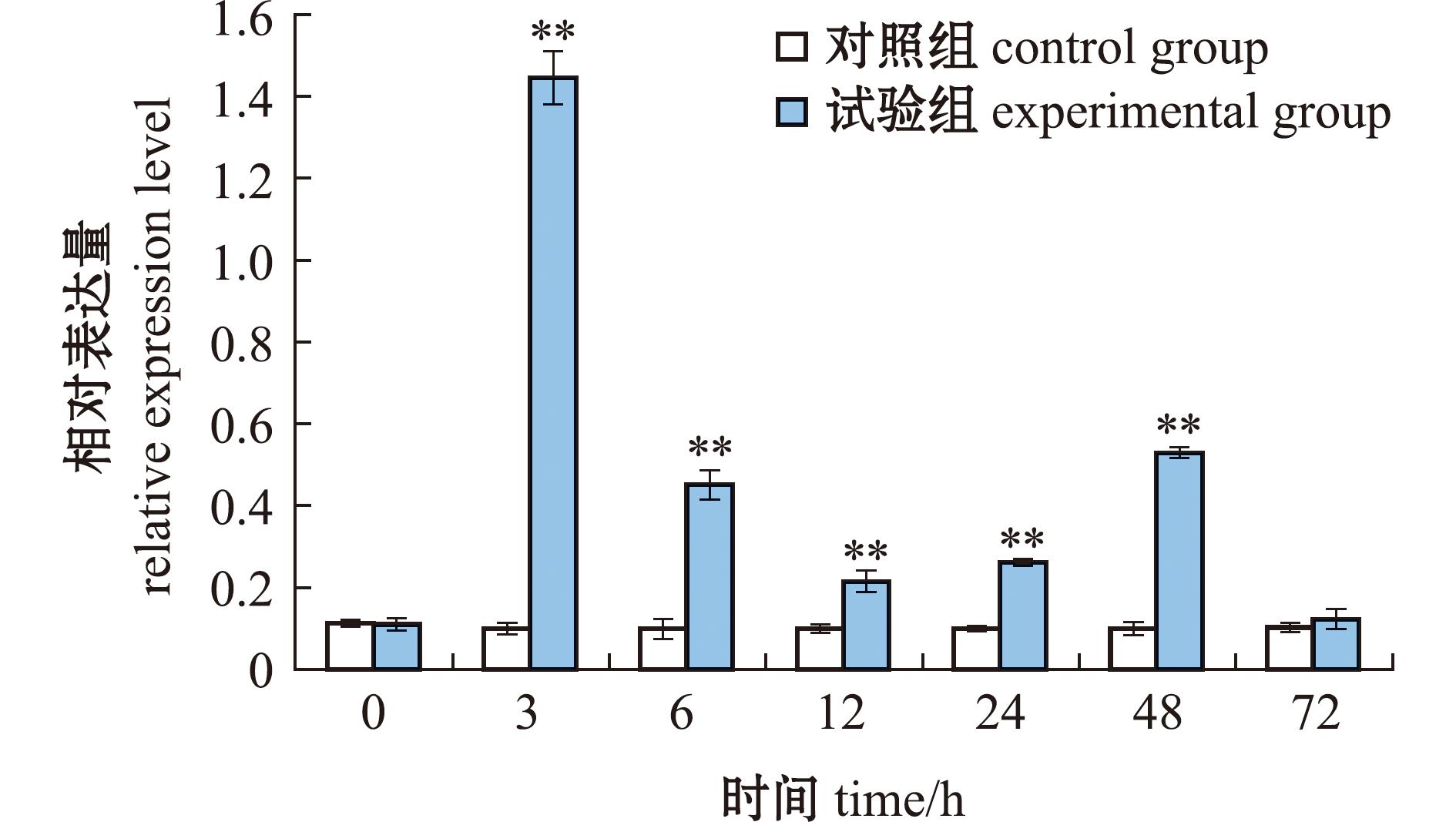
*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01),下同。
*means significant difference compared with control (P<0.05);**means very significant difference compared with control(P<0.01),et sequentia.
图6 副溶血弧菌刺激对鳃组织中Duox的表达
Fig.6 Expression level of Duox in gill tissue after Vibrio parahemolyticus challenges
2.4 siRNA干扰效率验证
为验证siRNA的干扰效率,注射siRNA试剂后,分别在0、12、24、48、72 h时收集鳃组织样本,采用qRT-PCR方法分析干扰组和对照组中脊尾白虾Duox基因的表达情况。从图7可见,注射siRNA试剂后,干扰组Duox基因表达量显著低于对照组,且在24~48 h时表达量下降最为显著,在24 h时干扰效率为85.30%,这一结果证明了siRNA试剂能够有效降低Duox基因的表达,从而验证了siRNA干扰的有效性。
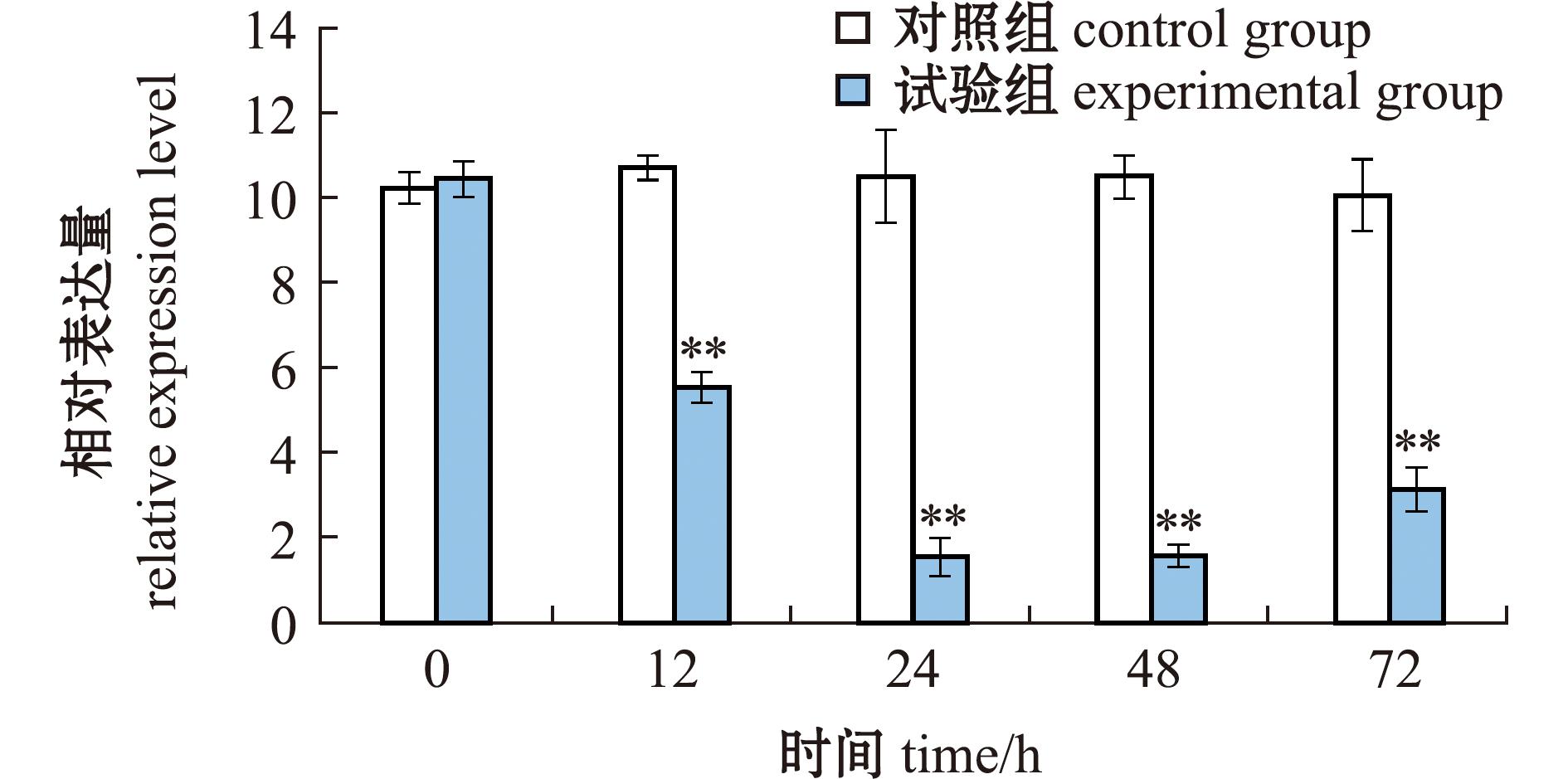
图7 RNA干扰后脊尾白虾鳃中Duox的表达
Fig.7 Expression level of Duox in gill of Exopalaemon carinicauda after RNA interference
2.5 敲降Duox基因后副溶血弧菌刺激对脊尾白虾存活率分析
从图8可见,与注射生理盐水+副溶血弧菌组和注射siRNA试剂+生理盐水组相比,注射siRNA试剂+副溶血弧菌组的脊尾白虾存活率显著下降,刺激120 h时,脊尾白虾的存活率约为2.5%。这一结果进一步证明,敲降Duox基因会显著增加脊尾白虾在感染副溶血弧菌后的死亡率。
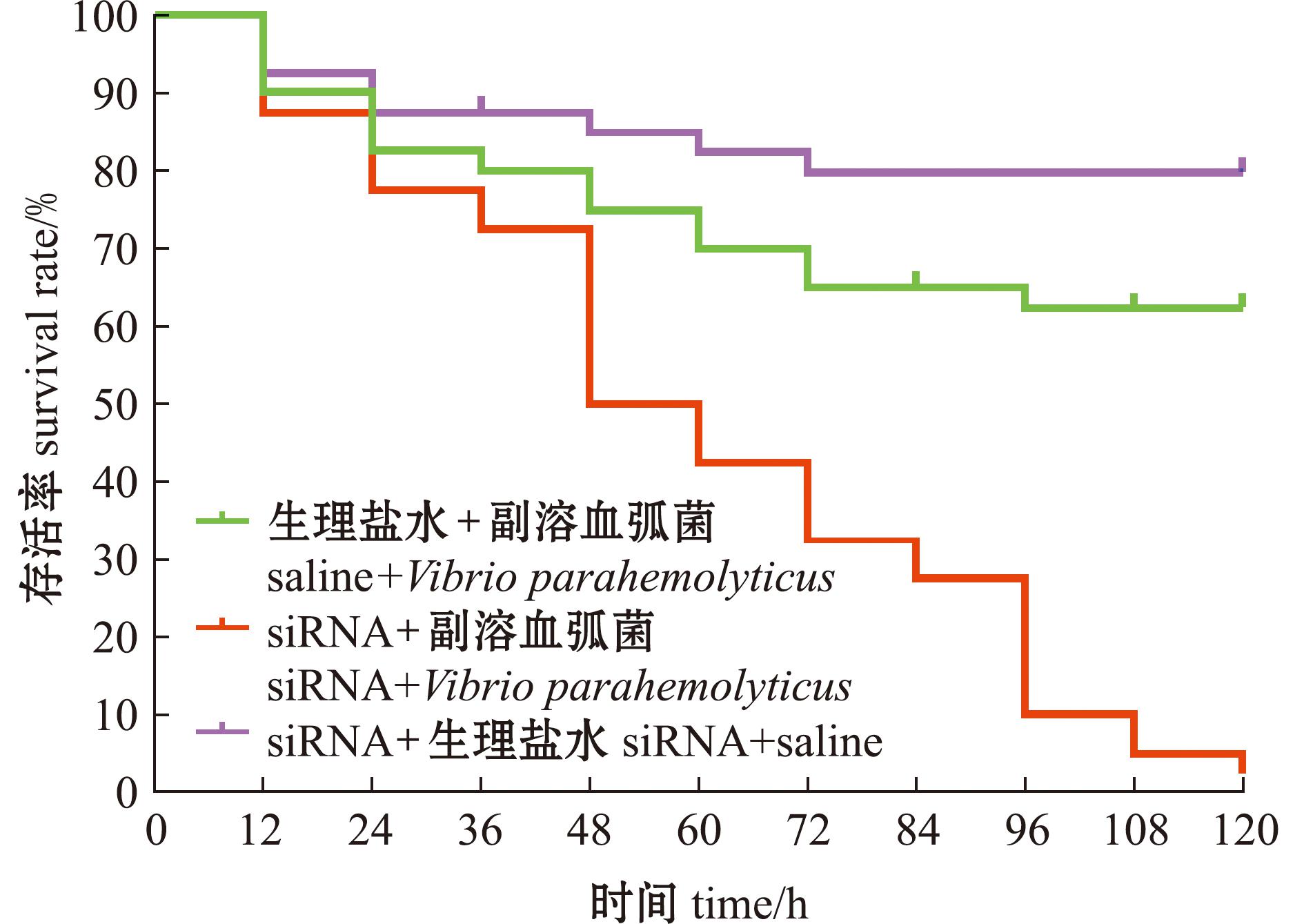
图8 Duox基因敲降后感染副溶血弧菌脊尾白虾的存活率
Fig.8 Survival rate of Exopalaemon carinicauda challenged with Vibrio parahemolyticus after Duox gene knocked down
3 讨论
3.1 脊尾白虾Duox结构特征
Duox是烟酰胺腺嘌呤二核苷酸氧化酶家族中的重要成员,最初在人类的甲状腺中被发现,可分为Duox1、Duox2两种亚型[13]。Duox在N端有6个保守的跨膜结构域,在C端有FAD和NADPH保守的结合位点,与家族内其他成员(NOX1-5)相比,Duox具有独特的过氧化物酶结构域。此外,Duox还具有与Ca2+结合的EF结构域[14]。本研究中成功克隆了Duox基因的cDNA序列,编码区序列长度为4 518 bp,编码1 505个氨基酸。通过序列比对分析可知,脊尾白虾Duox与日本沼虾的氨基酸序列一致性最高。系统发育树分析结果也表明,Duox在不同物种间具有较强的保守性。此外,保守结构域分析显示,脊尾白虾与人类、蛾和家蚕等物种Duox结构域相似,包括跨膜结构域、过氧化物酶结构域、EF结构域、铁还原酶结构域、黄素腺嘌呤二核苷酸结构域和烟酰胺腺嘌呤二核苷酸结构域,推测具有相似的生物学功能。Duox在细胞信号转导、细胞分化,细胞免疫、生长发育和黏膜免疫等多个生物学过程中发挥着至关重要的作用[15-16],其中,EF结构域可以参与Ca2+的信号传导,在人类中研究发现,Ca2+浓度变化可以调节细胞内Duox的活性,其中,高钙状态促进了各结构域相互作用,从而进行氧化还原反应,而在低钙状态下,电子转移效率会下降[17],这种调节机制对维持细胞内环境平衡至关重要。研究发现,在节肢动物中,当感染病原菌后,中肠上皮细胞通过提高Ca2+浓度来激活Duox的活性,进而增加ROS的含量来保护肠道上皮组织[18],推测脊尾白虾中Duox的功能可能与人类和节肢动物作用机制相似。
3.2 脊尾白虾Duox基因表达模式分析
由于缺乏特殊的保护机制,在复杂的水环境中,水生动物的鳃很容易受到环境中病原微生物、病毒和寄生虫的侵袭。鳃不仅可以进行气体交换、离子运输,还能参与机体的免疫调节,也是受到环境胁迫时评估风险的重要模型[19]。鳃是与外界环境直接接触的器官,可以通过分泌黏液和免疫相关酶来保护机体免受伤害。本研究中,Duox基因在脊尾白虾各个组织中均有表达,尤其在鳃组织表达量最高,用副溶血弧菌刺激后,Duox基因表达量在3 h显著上升并达到峰值,这一研究结果暗示Duox基因可能参与了机体响应副溶血弧菌刺激的免疫调控。在日本囊对虾鳃组织中注射白斑综合征病毒(WSSV)后,Duox基因表达量同样出现了显著上调[20],推测Duox基因在虾类中参与免疫调控是普遍存在的。此外,Duox基因在中华绒螯蟹的肝胰腺、鳃、胃和肠组织中也广泛表达,在鳃组织中表达量最高,亚硝酸盐胁迫可以诱导Duox基因的表达,正向调控ROS,进一步激活免疫调控信号通路来增强机体对病原菌的抵抗能力[21]。类似现象在其他物种中也有发现,在果蝇中,胡萝卜软腐果胶杆菌(Ecc15)感染16 h,Duox诱导肠道干细胞增殖,参与上皮细胞更新的早期阶段[22]。在慢性Th2炎症性气道疾病中,敲降Duox1基因,显著抑制了IL-13诱导的超氧化物水平的上升,揭示Duox1可能与疾病的发病机制有关[23]。这些试验结果表明,Duox基因在不同物种中都与免疫调控密切相关,为进一步研究其在免疫防御中的分子机制提供了重要参考,并为理解水生动物如何通过鳃组织应对环境刺激提供了新的视角。
3.3 脊尾白虾Duox基因免疫功能研究
为进一步研究Duox基因在脊尾白虾先天免疫中的作用,本试验中先敲降脊尾白虾中Duox基因,进行干扰效率验证后,再进行后续试验。成功敲降Duox基因后,用副溶血弧菌进行感染,与对照组相比,敲降Duox基因的脊尾白虾存活率显著降低。这一结果表明,Duox基因在脊尾白虾的抗菌免疫调控中发挥重要作用,有助于抵抗致病菌的入侵。类似地,在甜菜夜蛾5龄幼虫中,通过注射dsRNA试剂抑制Duox基因,发现肠道中的ROS水平显著降低,用黏质沙雷氏菌攻毒后,与对照组相比,干扰组的4龄幼虫死亡率显著升高[24],进一步证实了Duox基因在节肢动物免疫反应的重要性。敲降按蚊Duox基因后,中肠内细菌大量增殖,ROS浓度下降,显著降低了按蚊的存活率[25],表明Duox基因在维持肠道微生物群稳态中扮演了重要角色。研究发现,敲降Duox基因后,暴露于汽车尾气(VE)下的果蝇肠道屏障功能受损,引起肠道菌群失调,进而导致寿命缩短,死亡率显著升高,这表明Duox基因参与果蝇抗菌的免疫反应,对维系其生存至关重要[26]。在对日本囊对虾的研究中,敲降Duox基因后,经口感染弧菌,观察到肠道中弧菌的数量、对虾的死亡率显著高于对照组[27],说明在致病菌刺激时,Duox基因参与了对虾的肠道免疫调控。本研究中也获得相似的结果,进一步证明Duox基因在不同物种免疫防御过程中的功能保守。
4 结论
1)本研究成功克隆了脊尾白虾Duox基因的cDNA序列,该基因具有Duox典型的结构特征,且在甲壳动物中显示出高度的进化保守性。
2)Duox基因在不同组织中均有表达,且在鳃组织中表达量较高。用副溶血弧菌刺激时,Duox基因的表达水平显著上升,敲降Duox基因的脊尾白虾在感染副溶血弧菌后的存活率显著下降。
3)本研究中初步探究了Duox基因在脊尾白虾免疫应答过程中的调控机制,为进一步研究虾类的先天免疫机制提供了科学依据。
[1] SEETHALAKSHMI P S,RAJEEV R,KIRAN G S,et al.Shrimp disease management for sustainable aquaculture:innovations from nanotechnology and biotechnology[J].Aquaculture International,2021,29(4):1591-1620.
[2] 邓益琴.水产动物弧菌病及其生物防治研究进展[J].大连海洋大学学报,2023,38(4):553-563.DENG Y Q.Progress in research on vibriosis and biological control in animals in aquaculture:a review[J].Journal of Dalian Ocean University,2023,38(4):553-563.(in Chinese)
[3] LI Q Q,ZHANG M D,QIN S Y,et al.Dual oxidase 2 (duox 2) participates in the intestinal antibacterial innate immune responses of Procambarus clarkii by regulating ROS levels[J].Developmental &Comparative Immunology,2024,153:105116.
[4] BEDARD K,KRAUSE K H.The NOX family of ROS-generating NADPH oxidases:physiology and pathophysiology[J].Physiological Reviews,2007,87(1):245-313.
[5] DE DEKEN X,CORVILAIN B,DUMONT J E,et al.Roles of DUOX-mediated hydrogen peroxide in metabolism,host defense,and signaling[J].Antioxidants &Redox Signaling,2014,20(17):2776-2793.
[6] SARR D,T TH E,GINGERICH A,et al.Antimicrobial actions of dual oxidases and lactoperoxidase[J].Journal of Microbiology,2018,56(6):373-386.
TH E,GINGERICH A,et al.Antimicrobial actions of dual oxidases and lactoperoxidase[J].Journal of Microbiology,2018,56(6):373-386.
[7] BAE Y S,CHOI M K,LEE W J.Dual oxidase in mucosal immunity and host-microbe homeostasis[J].Trends in Immunology,2010,31(7):278-287.
[8] 马振刚,汪燕,李春峰,等.家蚕双重氧化酶BmDUOX的序列特征、表达模式及病原诱导表达[J].昆虫学报,2017,60(11):1255-1265.MA Z G,WANG Y,LI C F,et al.Sequence characteristics,expression pattern and pathogen-induced expression of BmDUOX from the silkworm,Bombyx mori (Lepidoptera:Bombycidae)[J].Acta Entomologica Sinica,2017,60(11):1255-1265.(in Chinese)
[9] SUN Z Q,HAO S F,GONG Y,et al.Dual oxidases participate in the regulation of hemolymph microbiota homeostasis in mud crab Scylla paramamosain[J].Developmental &Comparative Immunology,2018,89:111-121.
[10] 武世公.脊尾白虾生物学特性及池塘养殖技术[J].黑龙江水产,2024,43(1):111-112.WU S G.Biological characteristics and pond culture technology of Exopalaemon carinicauda[J].Northern Chinese Fisheries,2024,43(1):111-112.(in Chinese)
[11] XU K,WANG W L,LIU D,et al.Characterization of a crustin-like peptide involved in shrimp immune response to bacteria and Enterocytozoon hepatopenaei (EHP) infection in Palaemon carinicauda[J].Fish &Shellfish Immunology,2023,139:108871.
[12] MA H K,GAO H,XU W Y,et al.Cloning and functional study of fatty acid-binding protein-like gene of the ridgetail white prawn,Exopalaemon carinicauda[J].Aquaculture International,2020,28(4):1517-1530.
[13] HOSTE C,DUMONT J E,MIOT F,et al.The type of DUOX-dependent ROS production is dictated by defined sequences in DUOXA[J].Experimental Cell Research,2012,318(18):2353-2364.
[14] TAYLOR J P,TSE H M.The role of NADPH oxidases in infectious and inflammatory diseases[J].Redox Biology,2021,48:102159.
[15] YANG H T,HUANG Y H,YANG G W.Mini review:immunologic functions of dual oxidases in mucosal systems of vertebrates[J].Brazilian Journal of Biology,2020,80(4):948-956.
[16] MEZIANI L,GERB DE THOR
DE THOR M,HAMON P,et al.Dual oxidase 1 limits the IFNγ-associated antitumor effect of macrophages[J].Journal for Immunotherapy of Cancer,2020,8(1):e000622.
M,HAMON P,et al.Dual oxidase 1 limits the IFNγ-associated antitumor effect of macrophages[J].Journal for Immunotherapy of Cancer,2020,8(1):e000622.
[17] WU J X,LIU R,SONG K C,et al.Structures of human dual oxidase 1 complex in low-calcium and high-calcium states[J].Nature Communications,2021,12(1):155.
[18] ROY M C,AHMED S,KIM Y.Dorsal switch protein 1 as a damage signal in insect gut immunity to activate dual oxidase via an eicosanoid,PGE2[J].Frontiers in Immunology,2022,13:994626.
[19] WANG D L,ZUO D,WANG L M,et al.Effects of white spot syndrome virus infection on immuno-enzyme activities and ultrastructure in gills of Cherax quadricarinatus[J].Fish &Shellfish Immunology,2012,32(5):645-650.
[20] INADA M,KIHARA K,KONO T,et al.Deciphering of the Dual oxidase (Nox family) gene from kuruma shrimp,Marsupenaeus japonicus:full-length cDNA cloning and characterization[J].Fish &Shellfish Immunology,2013,34(2):471-485.
[21] JIA R,DAI XL,LI Y F,et al.Duox mediated ROS production inhibited WSSV replication in Eriocheir sinensis under short-term nitrite stress[J].Aquatic Toxicology,2023,260:106575.
[22] LIU Z G,ZHANG H Y,LEMAITRE B,et al.Duox activation in Drosophila Malpighian tubules stimulates intestinal epithelial renewal through a countercurrent flow[J].Cell Reports,2024,43(4):114109.
[23] DICKINSON J D,SWEETER J M,WARREN K J,et al.Autophagy regulates DUOX1 localization and superoxide production in airway epithelial cells during chronic IL-13 stimulation[J].Redox Biology,2018,14:272-284.
[24] SAJJADIAN S M,KIM Y.PGE2 upregulates gene expression of dual oxidase in a lepidopteran insect midgut via cAMP signalling pathway[J].Open Biology,2020,10(10):200197.
[25] WEI G,LAI YL,WANG G D,et al.Insect pathogenic fungus interacts with the gut microbiota to accelerate mosquito mortality[J].Proceedings of the National Academy of Sciences of the United States of America,2017,114(23):5994-5999.
[26] LI Y J,PAN L,LI P C,et al.Microbiota aggravates the pathogenesis of Drosophila acutely exposed to vehicle exhaust[J].Heliyon,2022,8(9):e10382.
[27] YANG H T,YANG M C,SUN J J,et al.Dual oxidases participate in the regulation of intestinal microbiotic homeostasis in the kuruma shrimp Marsupenaeus japonicus[J].Developmental &Comparative Immunology,2016,59:153-163.