牛磺酸(化学名为“2-氨基乙磺酸”)是动物体内含量最丰富的游离氨基酸,广泛存在于各个组织和器官中,在抗氧化、抗衰老、调节机体免疫反应、维持渗透压平衡和促进神经元发育等方面发挥着重要作用[1-5]。机体牛磺酸稳态的调控主要包括牛磺酸的吸收、合成和排泄等过程,涉及牛磺酸转运蛋白、牛磺酸合成酶(如半胱氨酸双加氧酶、半胱氨酸亚磺酸脱羧酶)等分子的共同参与和调节[6]。
牛磺酸转运蛋白(taurine transporter,TauT)属于溶质载体家族6(solute carriers 6,SLC6)[7],是一种位于细胞膜上的跨膜蛋白,介导牛磺酸在细胞内外之间的转运,对于维持细胞的牛磺酸稳态及其生理功能至关重要[8]。当细胞内牛磺酸浓度降低时,TauT表达量升高,促进牛磺酸从细胞外向细胞内的转运;反之,当细胞内牛磺酸浓度升高时,TauT表达量降低,抑制细胞对外界牛磺酸的摄取[9]。目前,有关TauT生理功能的研究已在不同物种中相继开展,如在人类(Homo sapiens)3号染色体上鉴定到1个TauT基因[10],发现其能够调节牛磺酸的转运,进而在保护视神经、肝脏和肾脏等器官方面发挥重要作用[11-13];在小鼠(Mus musculus)中鉴定到1个TauT基因,敲除MmTauT基因的第一外显子可导致视网膜、肝脏和肾脏中的牛磺酸含量显著降低,从而引发视网膜退化、肝脏纤维化、肾功能衰退和衰老加速等症状[14-17];在大西洋鲑(Salmo salar)中克隆1个TauT基因,其mRNA表达量在高渗条件下显著升高,可能在调节鱼体渗透压平衡过程中起着关键作用[18]。张志超等[19]在菲律宾蛤仔(Ruditapes philippinarum)基因组中鉴定到6个RpTauT基因,在低盐胁迫下呈现不同的表达模式,可能与贝类抗逆性有关。
长牡蛎(Crassostrea gigas)是世界上养殖产量最高的经济贝类,富含多种氨基酸和微量元素,其中牛磺酸含量尤为丰富,其含量可达组织干质量的3%~4%[20]。目前,有关长牡蛎牛磺酸转运蛋白的研究主要集中在渗透压调节方面。本研究中基于长牡蛎基因组数据,开展了CgTauT基因家族成员鉴定和结构特征分析,并探究了其组织分布模式和牛磺酸处理下的表达特征,以期为深入研究长牡蛎TauT基因在牛磺酸代谢中的作用提供有益参考。
1 材料与方法
1.1 材料
试验用长牡蛎购自辽宁省大连市金州养殖场,壳高为(13.0±0.5)cm,湿质量为(155.0±5.0)g。试验前置于温度22 ℃、盐度30的海水中暂养1周。暂养期间连续充气,每天全量换水1次,早、中、晚各投喂螺旋藻粉一次。
1.2 方法
1.2.1 牛磺酸含量检测 随机选取9只长牡蛎,解剖取其外套膜、鳃、闭壳肌、性腺和肝胰腺组织,冷冻干燥后在液氮中研磨成粉状,装入1.5 mL离心管中备用。每3只牡蛎的组织混合为1个样品,每组设置3个重复。
取50 mg组织干粉置于5 mL离心管中,加入2.5 mL超纯水,混合后在冰水浴中使用超声波破碎仪(SM-1000D,舜玛,中国)进行破碎,于4 ℃,12 000 g条件下离心10 min,收集上清液用于牛磺酸含量检测。牛磺酸含量使用牛磺酸检测试剂盒(ab241040,Abcam,英国)进行测定。每个样品设置3次重复。
1.2.2 CgTauT基因鉴定和进化分析 从NCBI下载长牡蛎基因组数据库(GCA_000297895.1)(http://www.ncbi.nlm.nih.gov),从Pfam数据库下载TauT特征结构域SNF(http://pfam.xfam.org)的隐马尔可夫模型(PF00209),利用HMMER 3.0检索长牡蛎基因组数据库中的蛋白序列;同时下载人、小鼠、斑马鱼(Danio rerio)、马氏珠母贝(Pinctada martensii)和虾夷扇贝(Mizuhopecten yessoensis)等物种的TauT蛋白序列,通过BLASTP(http://www.ncbi.nlm.nih.gov/blast)检索长牡蛎蛋白数据库(e<2-10)。对上述两种方法获得的序列去除冗余,获得候选序列。使用NCBI在线保守区分析工具CDD和SMART (http://smart.embl-heidelberg.de)在线工具进行结构域分析[21],最终确定TauT基因家族成员。使用在线软件TMHMM(https://services.healthtech.dtu.dk/services/TMHMM-2.0)进行蛋白跨膜结构预测,使用Expasy(https://www.expasy.org)进行TauT蛋白的疏水性和等电点预测[22],使用MEME(https://meme-suite.org/meme)在线工具分析蛋白的保守基序(基序最大数目为10),使用Tbtools对基因结构和染色体定位进行可视化[23]。使用SWISS-MODEL(https://swissmodel.expasy.org)在蛋白质数据库PDB中筛选与人、斑马鱼和长牡蛎TauT序列相似度最高的三维结构模板,据此构建HsTauT、DrTauT和CgTauT的三维结构模型[24],利用PyMol计算模型之间的均方根偏差(root mean square deviation,RMSD)以评估蛋白模型的相似性。采用MEGA 11.0软件构建基于邻接法(Neighbor-Joining,NJ)的TauT系统进化树,选取秀丽隐杆线虫(Caenorhabditis elegans)中的TauT同源基因SNF-5作为外群,校验参数bootstrap值设置为1 000[25]。
1.2.3 CgTauT基因组织表达量分析 随机选取9只长牡蛎,解剖取其外套膜、鳃、闭壳肌、性腺和肝胰腺组织,每个样本加入500 μL TRIzol,液氮速冻后于-80 ℃超低温冰箱中保存。每3只牡蛎的组织混合为1个样品,每组设置3个重复。
1.2.4 牛磺酸处理下CgTauT基因表达量分析 随机选取72只长牡蛎,置于浓度为4 mmol/L牛磺酸的海水中进行浸泡处理,分别于0、3、6、12、24、48、72、96 h取样,每个时间点选取9只个体,解剖取其外套膜,加入500 μL TRIzol,液氮速冻后于-80 ℃超低温冰箱中保存。每3只牡蛎的外套膜组织混合为1个样品,每组设3个重复。
1.2.5 RNA提取和反转录 采用TRIzol Reagent法从长牡蛎组织中提取总RNA。采用15%琼脂糖凝胶电泳检测RNA的完整性,采用NanoDrop 2000(Thermo Fisher Scientific)检测RNA的纯度及浓度。采用TransScript® RT/RI Enzyme Mix(TransGen Biotech)反转录试剂盒合成 cDNA,用于后续分析。
1.2.6 实时荧光定量 PCR(qRT-PCR)分析 采用Primer Premier 5.0设计qRT-PCR引物(表1)。采用Quant Studio 6 实时荧光定量 PCR仪(Thermo Fisher Scientific)检测CgTauT的mRNA表达量。qRT-PCR反应程序:95 ℃下预变性10 min,95 ℃下变性10 s,60 ℃下退火45 s,共进行40个循环。以延伸因子1-α基因(CgEF,LOC105338957)作为内参,采用2-ΔΔCt方法计算基因的表达量[26]。
表1 试验所用引物序列
Tab.1 Sequences of primers used in experment
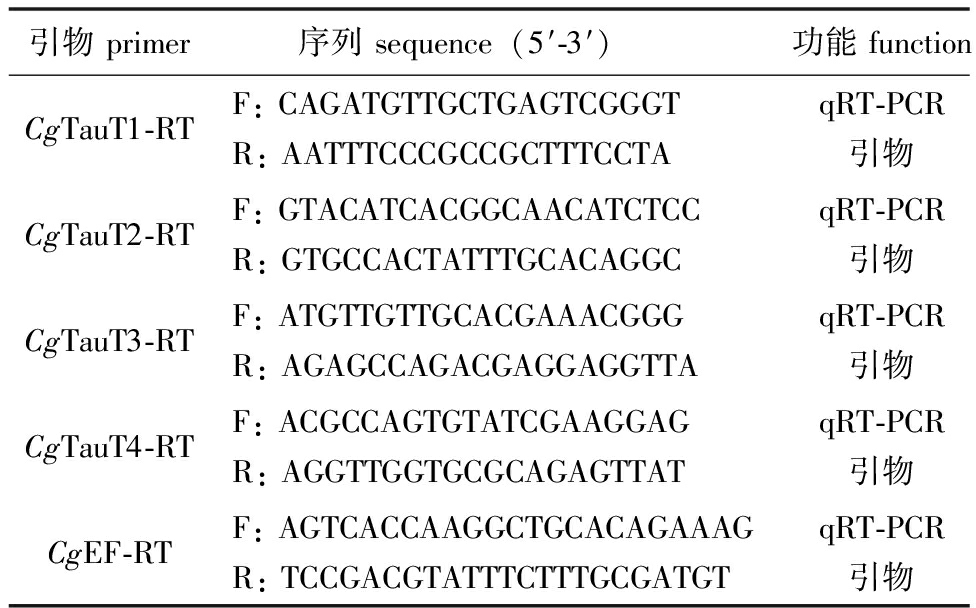
引物primer 序列sequence(5′-3′)功能functionCgTauT1-RTF:CAGATGTTGCTGAGTCGGGTR:AATTTCCCGCCGCTTTCCTAqRT-PCR引物CgTauT2-RTF:GTACATCACGGCAACATCTCCR:GTGCCACTATTTGCACAGGCqRT-PCR引物CgTauT3-RTF:ATGTTGTTGCACGAAACGGGR:AGAGCCAGACGAGGAGGTTAqRT-PCR引物CgTauT4-RTF:ACGCCAGTGTATCGAAGGAGR:AGGTTGGTGCGCAGAGTTATqRT-PCR引物CgEF-RTF:AGTCACCAAGGCTGCACAGAAAGR:TCCGACGTATTTCTTTGCGATGTqRT-PCR引物
1.3 数据处理
试验结果以平均值±标准误(mean±S.E.)表示,采用SPSS 20软件进行单因素方差分析,采用最小显著差异(LSD)法进行多重比较,采用皮尔森系数进行相关性分析,显著性水平设为0.05。
2 结果与分析
2.1 长牡蛎各组织中的牛磺酸含量
从图1可见,长牡蛎各组织中牛磺酸含量具有显著性差异(P<0.01),其中肝胰腺牛磺酸含量最高,为(33.03±0.65)mg/g;其次为外套膜,牛磺酸含量为(25.91±0.76)mg/g;性腺牛磺酸含量最低,为(17.68±0.68)mg/g(图1)。
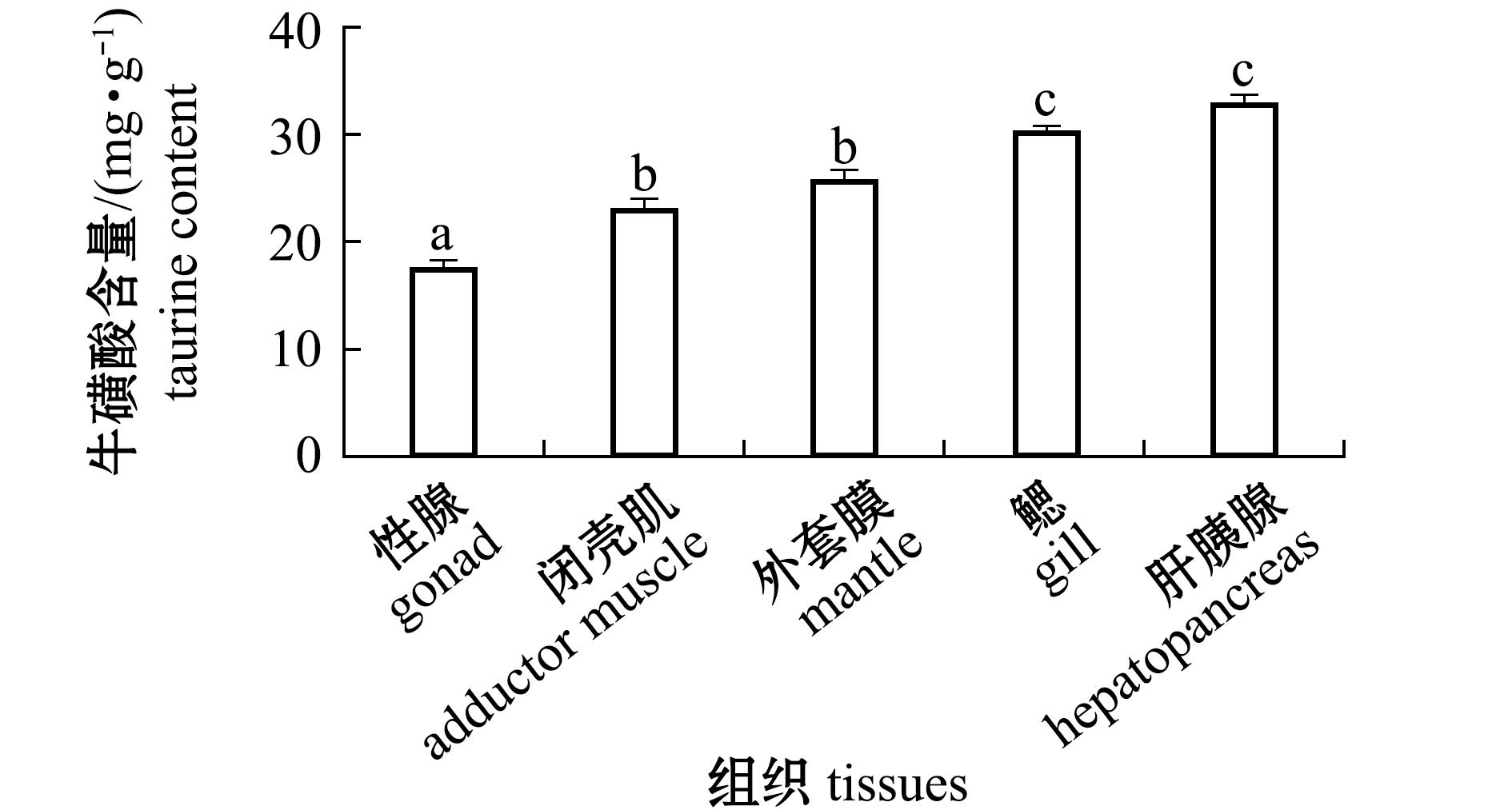
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significantly different,et sequentia.
图1 长牡蛎各组织中的牛磺酸含量
Fig.1 Taurine content in various tissues of Crassostrea gigas
2.2 CgTauT基因鉴定与序列分析
从长牡蛎基因组中共鉴定到4个CgTauT基因,分别命名为CgTauT1、CgTauT2、CgTauT3和CgTauT4(表2),其中CgTauT1和CgTauT2位于第7号染色体,CgTauT3和CgTauT4位于第6号染色体(图2)。4个CgTauT基因的外显子数量为13~15个,内含子数量为12~15个,可编码626~671个氨基酸,蛋白分子量为70 250~75 030,等电点为5.24~8.37。长牡蛎中的4个CgTauT均含有1个SNF结构域,该结构域中含有12个跨膜结构域。基序(motif)预测显示,CgTauT均含有10个相同的motif(图3)。蛋白模型相似性评估结果显示,4个CgTauT与HsTauT的RMSD值为0.617~0.809 Å,与DrTauT的RMSD值为0.588~0.849 Å(图4),表明4个CgTauT在蛋白空间结构上与人和斑马鱼的TauT具有较高的相似性。
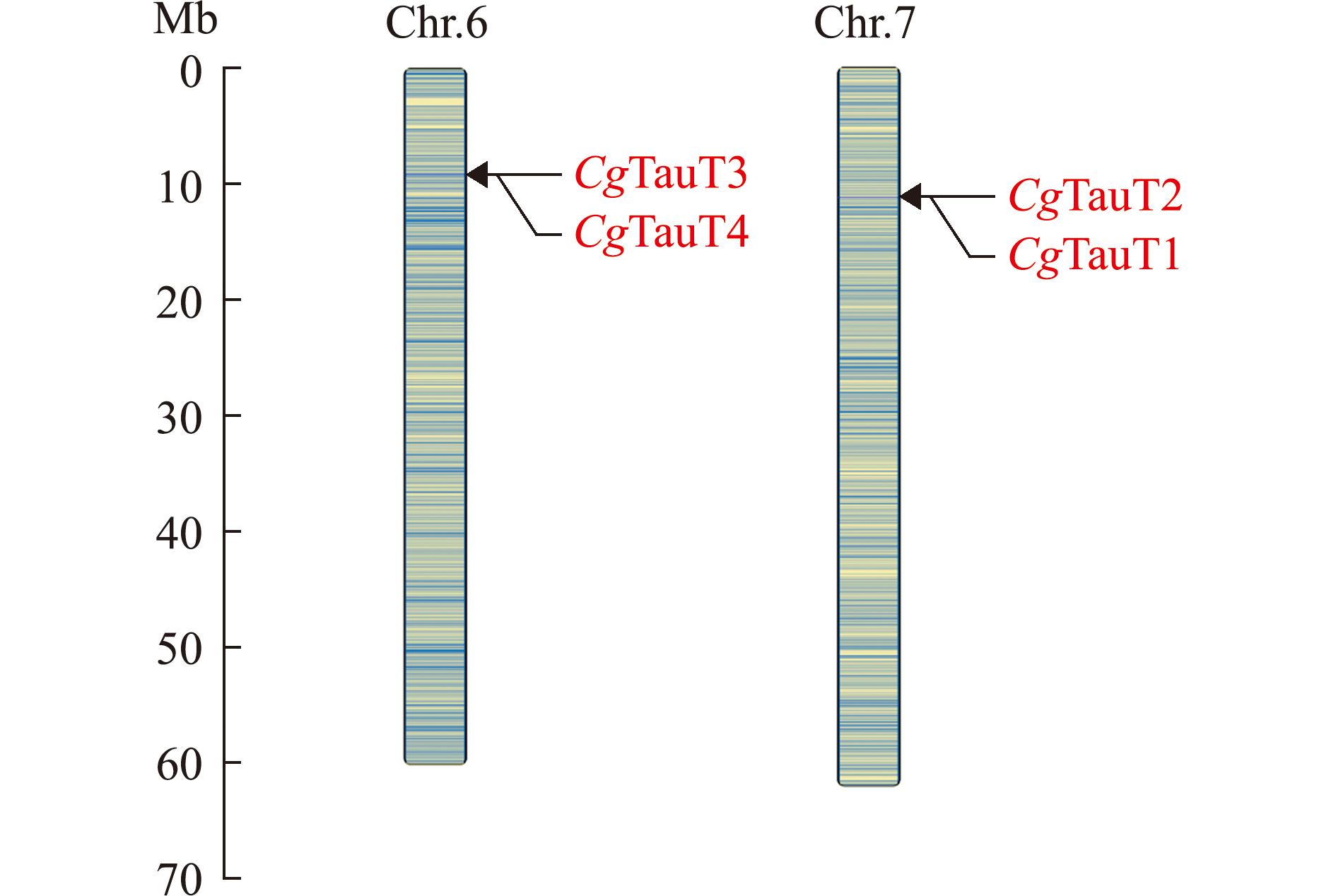
图2 CgTauT基因在长牡蛎染色体上的定位
Fig.2 Chromosomal localizations of CgTauT genes
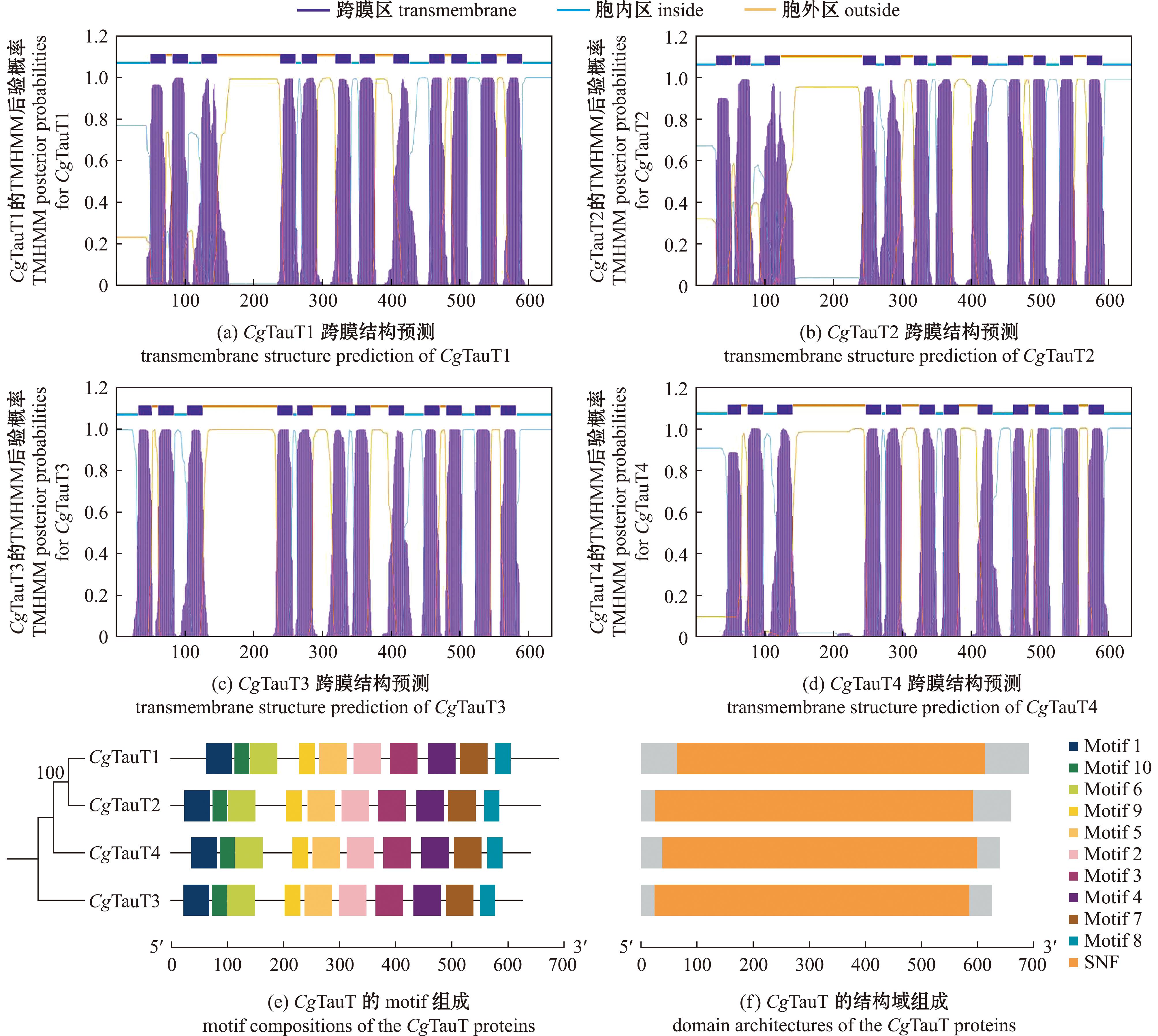
图3 CgTauT结构域和motif分析
Fig.3 Domain architectures and motif compositions of the CgTauT proteins
表2 长牡蛎TauT基因信息汇总
Tab.2 Summary of TauT genes in Crassostrea gigas genome
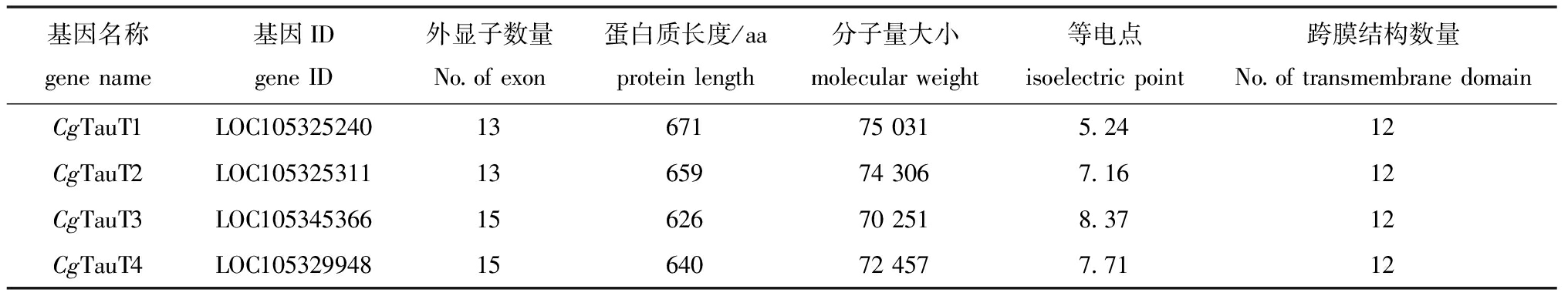
基因名称genename基因IDgeneID外显子数量No.ofexon蛋白质长度/aaproteinlength分子量大小molecularweight等电点isoelectricpoint跨膜结构数量No.oftransmembranedomainCgTauT1LOC10532524013671750315.2412CgTauT2LOC10532531113659743067.1612CgTauT3LOC10534536615626702518.3712CgTauT4LOC10532994815640724577.7112
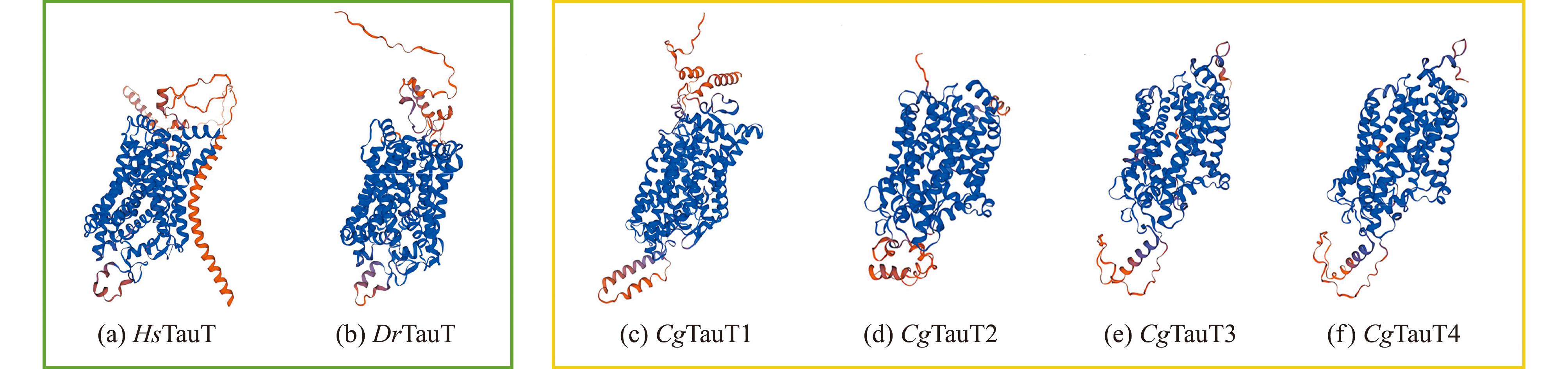
图4 HsTauT、DrTauT和CgTauT蛋白三维结构模型
Fig.4 Three-dimensional structural models of HsTauT,DrTauT and CgTauT proteins
2.3 CgTauT系统进化分析
选取包括人在内的19个物种的35个TauT蛋白构建NJ系统进化树(图5)。结果显示,脊椎动物和无脊椎动物的TauT分为两个分支,CgTauT1和CgTauT2与马氏珠母贝PmTauT聚为一支,CgTauT3和CgTauT4与虾夷扇贝MyTauT聚为一支,然后与其他无脊椎动物的同源分子聚为一簇。
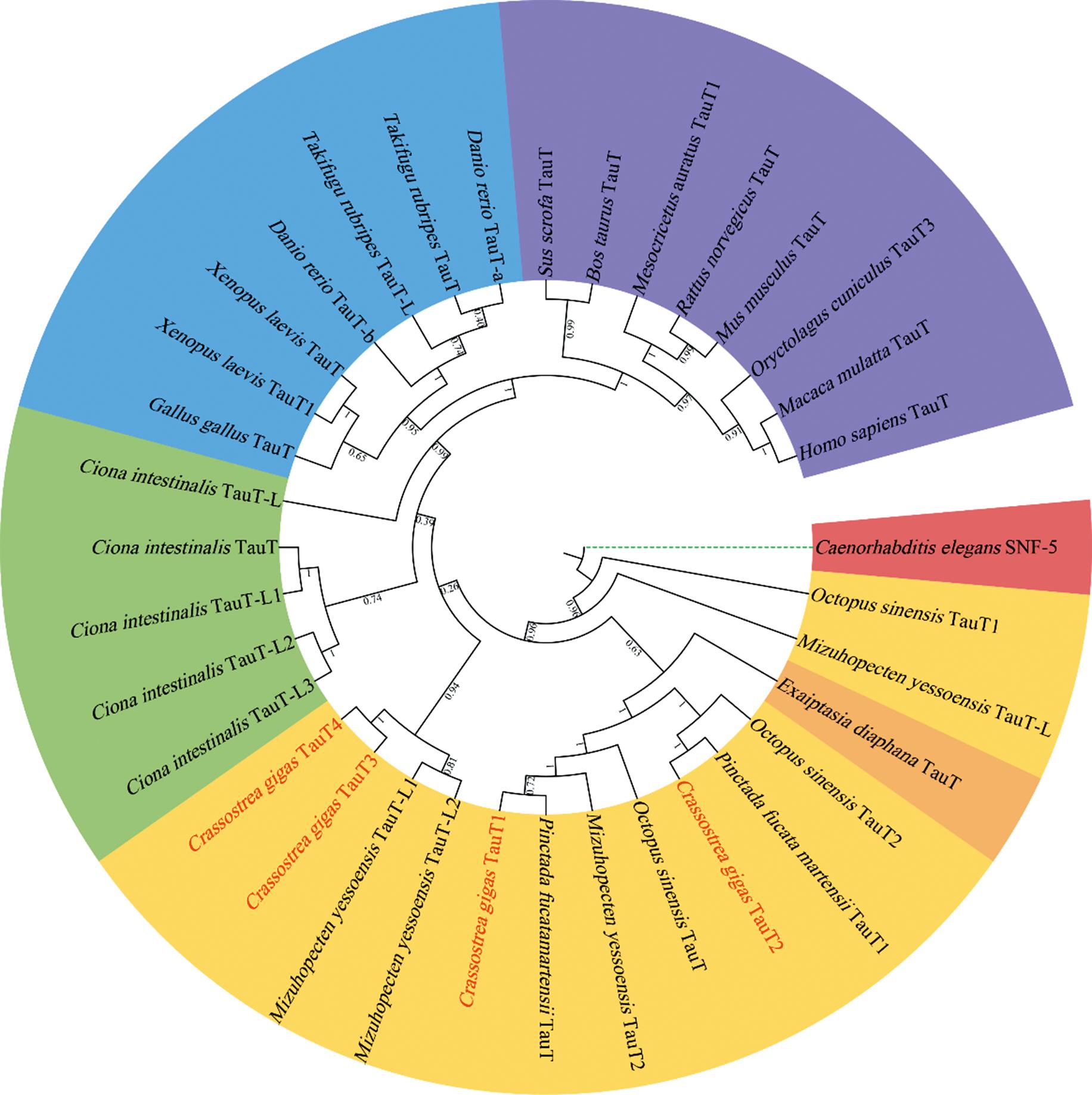
图5 长牡蛎与其他物种TauT的系统进化分析
Fig.5 Phylogenetic analysis of TauT in Crassostrea gigas and other species
2.4 CgTauT基因的组织表达模式
qRT-PCR结果显示,4个CgTauT基因在所检测的长牡蛎组织中均有表达,且呈现不同的表达模式(图6)。CgTauT1在闭壳肌中的表达量最高,在鳃中的表达量最低,闭壳肌中的表达量为鳃中表达量的94.13倍;CgTauT2、CgTauT3和CgTauT4在外套膜中的表达量高于其他组织,CgTauT2在肝胰腺中的表达量最低,CgTauT3在闭壳肌中的表达量最低,CgTauT4在鳃中的表达量最低。
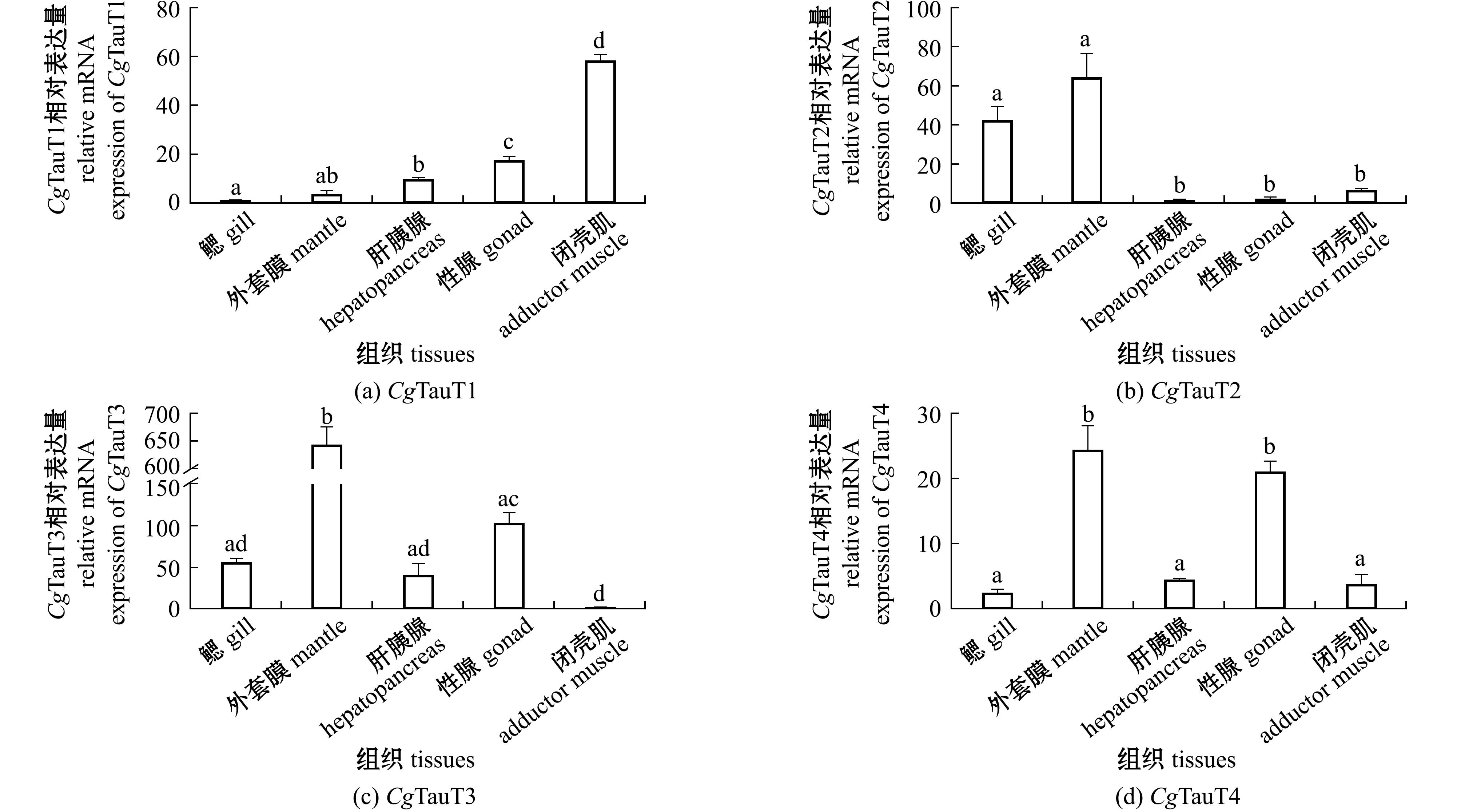
图6 CgTauT基因在长牡蛎各组织中的表达量
Fig.6 Expression levels of CgTauT genes in different tissues of Crassostrea gigas
2.5 牛磺酸处理下外套膜中CgTauT基因的表达模式
牛磺酸浸泡处理下,长牡蛎外套膜中4个CgTauT基因呈现不同的时序表达模式(图7)。CgTauT1的表达量在牛磺酸浸泡处理24 h时急剧升高,48 h降至最低,72 h再次升高至最大值;CgTauT2在处理72 h的表达量最高,96 h降至初始水平;CgTauT3表达量随处理时间延长呈现逐渐升高趋势,96 h时达到峰值,为0 h时的4.22倍(P<0.01);CgTauT4表达量随处理时间延长呈现先升高后降低的趋势,12 h时表达量最高,96 h时表达量最低。
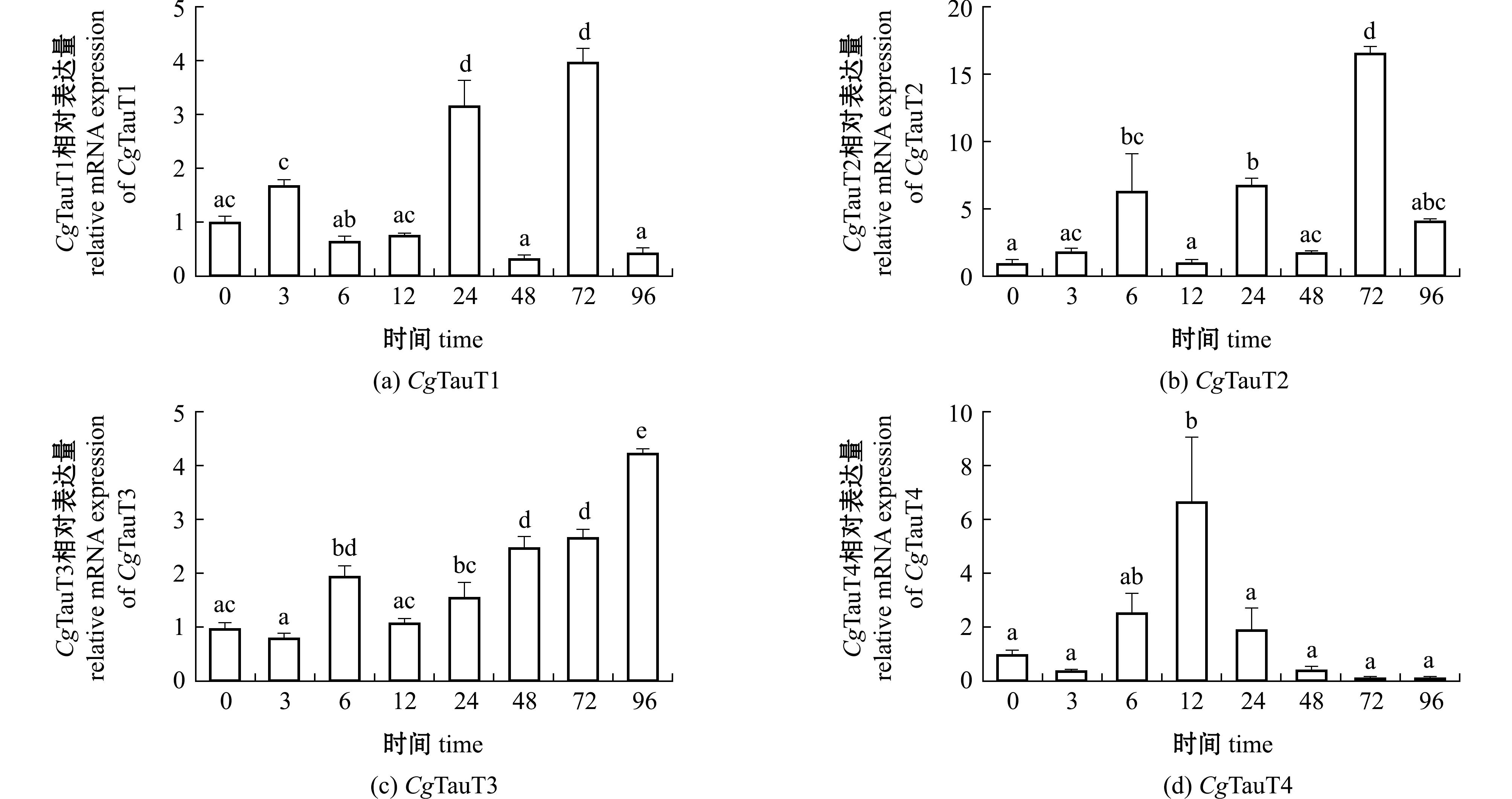
图7 CgTauT基因在牛磺酸处理下的时序表达
Fig.7 Temporal expression of CgTauT genes after taurine treatment
3 讨论
3.1 CgTauT基因家族鉴定及进化分析
TauT是动物体内重要的牛磺酸转运蛋白,不同物种中TauT家族成员的数量不等。本研究中从长牡蛎基因组中鉴定到4个CgTauT基因,其数量与菲律宾蛤仔的RpTauT基因数(6个)相近,多于人(1个)和小鼠(1个)等脊椎动物中的TauT基因数,这可能构成了贝类体内牛磺酸含量高于上述物种的分子基础。染色体定位结果显示,CgTauT1和CgTauT2、CgTauT3和CgTauT4分别位于同一条染色体上,且遗传距离较近,推测CgTauT基因在进化过程中发生了基因复制,从而赋予长牡蛎更强的牛磺酸代谢调控能力,帮助其更好地适应复杂多变的潮间带环境[27]。4个CgTauT基因均包含一个SNF结构域和相同的motif,表明这些基因的结构和功能较为相似。在海水养殖贝类中,长牡蛎和马氏珠母贝的牛磺酸含量通常高于其他贝类[28]。进化分析显示,CgTauT首先与虾夷扇贝和马氏珠母贝的TauT聚为一支,表明其在牛磺酸代谢过程中发挥重要作用。
3.2 CgTauT的组织分布模式
研究表明,贝类中的TauT在维持细胞渗透压平衡、帮助机体快速适应盐度变化等方面发挥着重要作用[29]。高渗条件下文蛤(Meretrix lusoria)外套膜中的TauT mRNA表达量显著升高,增加了细胞对牛磺酸的摄取能力,从而帮助机体有效应对高盐度胁迫[30]。低渗条件下文蛤外套膜中的TauT mRNA表达量显著降低[31],而紫贻贝(Mytilus edulis)外套膜中的TauT表达量在低渗条件下显著升高[32],这可能与不同贝类对渗透压胁迫的响应及适应机制不同有关。TauT在贝类不同组织中均有表达,其中在与外界环境直接接触的外套膜、鳃和水管等组织中的表达量较高[19]。当外界盐度发生改变时,外套膜能迅速感知渗透压和离子浓度的变化,并及时做出应激反应[33]。与已有研究结果类似,CgTauT2、CgTauT3和CgTauT4在长牡蛎外套膜中的表达量均显著高于其他组织,推测3个基因通过调控外套膜对牛磺酸的吸收能力,帮助牡蛎应对局部渗透压胁迫,从而提高其对盐度变化的适应能力。与上述3个基因不同,CgTauT1在长牡蛎闭壳肌中的表达量最高。闭壳肌是控制贝壳开合的肌肉,对能量需求较大,而牛磺酸具有促进脂质分解和提高能量利用率的功能,推测CgTauT1通过促进肌细胞对牛磺酸的吸收,来满足闭壳肌的能量需求,同时较高的牛磺酸可减少自由基的生成,有助于缓解肌肉疲劳和损伤[34]。皮尔森相关性分析表明,长牡蛎组织中的牛磺酸含量与CgTauT基因表达量之间无显著相关性,推测4个CgTauT基因可能通过相互作用共同调控组织中的牛磺酸含量;此外,牛磺酸含量还受各组织合成牛磺酸能力的影响,使得牛磺酸含量与CgTauT表达量之间的关系变得更加复杂。
3.3 CgTauT对牛磺酸的响应特征
外界牛磺酸浓度是影响水产动物TauT表达量的重要因素。随着饲料中牛磺酸含量的升高,金鱼(Carassius auratus)肠道中的TauT mRNA表达量先升高后降低[35],而大菱鲆(Scophthalmus maximus L.)幼鱼肝脏、脑和眼中的TauT mRNA表达量却呈现逐渐降低的趋势[36]。斜带石斑鱼(Epinephelus coioides)中的研究表明,饲料中添加牛磺酸能够诱导组织中TauT的表达,然而,随着投喂时间的延长,各组织中TauT mRNA表达量逐渐降低,这可能与组织内牛磺酸浓度升高从而抑制TauT的表达有关[37]。本研究中发现,4个CgTauT基因在牛磺酸处理前期均呈现上升趋势,表明牛磺酸供应充足时牡蛎会增强对牛磺酸的摄取以满足自身生理需求。CgTauT1的mRNA表达量在牛磺酸处理3 h时率先升高,此时其余CgTauT表达量尚无显著变化,表明CgTauT1对外界牛磺酸浓度变化最为敏感,可能在牡蛎快速应对环境变化的过程中发挥重要作用。值得注意的是,CgTauT3呈现出与CgTauT1、CgTauT2和CgTauT4不同的时序表达模式,其mRNA表达量随牛磺酸处理时间的延长逐渐升高。该结果与人、大鼠、斜带石斑鱼等物种中的研究结果不同[13,37-38],表明牡蛎体内可能存在一套独特的牛磺酸转运调控机制,使其在高牛磺酸浓度下具备持续吸收牛磺酸的能力。
4 结论
1)从长牡蛎基因组中鉴定到4个CgTauT基因,其均包含1个SNF结构域和12个疏水跨膜结构,CgTauT与其他双壳贝类同源基因的亲缘关系较近。
2)4个CgTauT基因在长牡蛎各组织中呈组成型表达,其中CgTauT1在闭壳肌中的表达量最高,CgTauT2、CgTauT3和CgTauT4在外套膜中的表达量最高,推测4个CgTauT基因在不同组织中发挥不同生理功能。
3)牛磺酸浸泡处理下4个CgTauT基因呈现不同的时序表达模式。CgTauT1对外界牛磺酸浓度变化最为敏感,其mRNA表达量在牛磺酸处理早期(3 h)率先升高;CgTauT3的mRNA表达量随牛磺酸处理时间延长逐渐升高,推测其存在特殊的表达调控机制,使牡蛎在牛磺酸供应充足时具备持续的吸收能力。
[1] SCHAFFER S W,AZUMA J,MOZAFFARI M.Role of antioxidant activity of taurine in diabetes[J].Canadian Journal of Physiology and Pharmacology,2009,87(2):91-99.
[2] ITO T,MIYAZAKI N,SCHAFFER S,et al.Potential anti-aging role of taurine via proper protein folding:a study from taurine transporter knockout mouse[J].Advances in Experimental Medicine and Biology,2015,803:481-487.
[3] SCHULLER-LEVIS G B,PARK E.Taurine and its chloramine:modulators of immunity[J].Neurochemical Research,2004,29(1):117-126.
[4] PASANTES-MORALES H,QUESADA O,MORAN J.Taurine:an osmolyte in mammalian tissues[M]//SCHAFFER S,LOMBARDINI J B,HUXTABLE R J.Taurine 3.Boston,M A:Springer,1998:209-217.
[5] HUSSY N,DELEUZE C,DESARM NIEN M G,et al.Osmotic regulation of neuronal activity:a new role for taurine and glial cells in a hypothalamic neuroendocrine structure[J].Progress in Neurobiology,2000,62(2):113-134.
NIEN M G,et al.Osmotic regulation of neuronal activity:a new role for taurine and glial cells in a hypothalamic neuroendocrine structure[J].Progress in Neurobiology,2000,62(2):113-134.
[6] TAPPAZ M L.Taurine biosynthetic enzymes and taurine transporter:molecular identification and regulations[J].Neurochemical Research,2004,29(1):83-96.
[7] BRÖER S,GETHER U.The solute carrier 6 family of transporters[J].British Journal of Pharmacology,2012,167(2):256-278.
[8] LAMBERT I H,KRISTENSEN D M,HOLM J B,et al.Physiological role of taurine:from organism to organelle[J].Acta Physiologica,2015,213(1):191-212.
[9] BALIOU S,KYRIAKOPOULOS A M,GOULIELMAKI M,et al.Significance of taurine transporter (TauT)in homeostasis and its layers of regulation (Review)[J].Molecular Medicine Reports,2020,22(3):2163-2173.
[10] PATEL A,ROCHELLE J M,JONES J M,et al.Mapping of the taurine transporter gene to mouse chromosome 6 and to the short arm of human chromosome 3[J].Genomics,1995,25(1):314-317.
[11] PREISING M N,GÖRG B,FRIEDBURG C,et al.Biallelic mutation of human SLC6A6 encoding the taurine transporter TAUT is linked to early retinal degeneration[J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology,2019,33(10):11507-11527.
[12] HAN X B,CHESNEY R W.Knockdown of TauT expression impairs human embryonic kidney 293 cell development[C]//EL IDRISSI A,L’AMOREAUX W.Taurine 8.New York:Springer,2013:307-320.
[13] SATSU H,TERASAWA E,HOSOKAWA Y,et al.Functional characterization and regulation of the taurine transporter and cysteine dioxygenase in human hepatoblastoma HepG2 cells[J].The Biochemical Journal,2003,375(Pt 2):441-447.
[14] LOMBARDINI J B.Taurine:retinal function[J].Brain Research Reviews,1991,16(2):151-169.
[15] WARSKULAT U,HELLER-STILB B,OERMANN E,et al.Phenotype of the taurine transporter knockout mouse[J].Methods in Enzymology,2007,428:439-458.
[16] HAN X,BUDREAU A M,CHESNEY R W.The taurine transporter gene and its role in renal development[J].Amino Acids,2000,19(3/4):499-507.
[17] SINGH P,GOLLAPALLI K,MANGIOLA S,et al.Taurine deficiency as a driver of aging[J].Science,2023,380(6649):eabn9257.
[18] ZARATE J M,BRADLEY T M.Molecular cloning and characterization of the taurine transporter of Atlantic salmon[J].Aquaculture,2007,273(2/3):209-217.
[19] 张志超,王珺,霍忠明,等.菲律宾蛤仔牛磺酸转运体蛋白基因鉴定、表达及低盐胁迫响应[J].江苏农业科学,2023,51(18):45-53.ZHANG Z C,WANG J,HUO Z M,et,al.ANG identification,expression and response to low-salt stress of taurine transporter genes in Manalia clam(Ruditapes philippinarum)[J].Jiangsu Agricultural Sciences,2023,51(18):45-53.(in Chinese)
[20] QIAO X,KONG N,SUN S Q,et al.Polymorphisms in the cysteine dioxygenase gene and their association with taurine content in the Pacific oyster Crassostrea gigas[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2024,273:110981.
[21] 马得友,于莲莲,林威港,等.刺参Wnt9基因克隆、组织分布及在胚胎发育中的表达分析[J].大连海洋大学学报,2022,37(3):394-402.MA D Y,YU L L,LIN W G,et,al.cDNA cloning and expression distribution of Wnt9 gene in adult tissues and embryonic development in sea cucumber Apostichopus japonicas[J].Journal of Dalian Ocean University,2022,37(3):394-402.(in Chinese)
[22] WALKER J M.The proteomics protocols handbook[M].Totowa,New Jersey:Humana Press,2005
[23] CHEN C J,CHEN H,ZHANG Y,et al.TBtools:an integrative toolkit developed for interactive analyses of big biological data[J].Molecular Plant,2020,13(8):1194-1202.
[24] KIEFER F,ARNOLD K,KÜNZLI M,et al.The SWISS-MODEL repository and associated resources[J].Nucleic Acids Research,2009,37(Database issue):D387-D392.
[25] KUMAR S,TAMURA K,NEI M.MEGA:Molecular evolutionary genetics analysis software for microcomputers[J].Computer Applications in the Biosciences:CABIOS,1994,10(2):189-191.
[26] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[27] MAGADUM S,BANERJEE U,MURUGAN P,et al.Gene duplication as a major force in evolution[J].Journal of Genetics,2013,92(1):155-161.
[28] 谭乐义,章超桦,薛长湖,等.牛磺酸的生物活性及其在海洋生物中的分布[J].湛江海洋大学学报,2000,(3):75-79.TAN L Y,ZHANG C H,XUE C H,et,al.Biological activity of taurine and its distribution in marine organisms[J].Journal of Zhanjiang Ocean University,2000,(3):75-79.(in Chinese)
[29] 牛东红,王宏蕾,李家乐.海洋贝类对盐度胁迫适应机制的研究进展[J].水产学报,2024,48(4):32-44.NIU D H,WANG H L,LI J L,et,al.Research progress on adaptation mechanism of marine shellfish to salinity stress[J].Journal of Fisheries of China,2024,48(4):32-44.(in Chinese)
[30] LIN C H,YEH P L,LEE T H.Ionic and amino acid regulation in hard clam (Meretrix lusoria)in response to salinity challenges[J].Frontiers in Physiology,2016,7:368.
[31] LIN C H,YEH P L,LEE T H.Time-course changes in the regulation of ions and amino acids in the hard clam Meretrix lusoria upon lower salinity challenge[J].Journal of Experimental Zoology Part A,Ecological and Integrative Physiology,2021,335(7):602-613.
[32] TOYOHARA H,YOSHIDA M,HOSOI M,et al.Expression of taurine transporter in response to hypo-osmotic stress in the mantle of Mediterranean blue mussel[J].Fisheries Science,2005,71(2):356-360.
[33] 丁鉴锋,王锐,闫喜武,等.菲律宾蛤仔3种壳色群体低盐耐受能力的比较研究[J].大连海洋大学学报,2013,28(3):264-268.DING J F,WANG R,YAN X W,et al.Comparative tolerance to low salinity stress in Manila clam Ruditapes philippinarum with three shell colors[J].Journal of Dalian Ocean University,2013,28(3):264-268.(in Chinese)
[34] DE CARVALHO F G,GALAN B S M,SANTOS P C,et al.Taurine:a potential ergogenic aid for preventing muscle damage and protein catabolism and decreasing oxidative stress produced by endurance exercise[J].Frontiers in Physiology,2017,8:710.
[35] XIONG D,JIANG G M,HE Z M,et al.Molecular characterization and taurine regulation of taurine transporter in goldfish[J].North American Journal of Aquaculture,2020,82(2):143-152.
[36] 柳茜,梁萌青,郑珂珂,等.牛磺酸及相关氨基酸对大菱鲆幼鱼生长性能及TauT mRNA表达的影响[J].水生生物学报,2017,41(1):165-173.LIU Q,LIANG M Q,ZHENG K K,et al.Effects of dietary taurine and related amino acids on growth performance and taurine transporter (TauT)mrna expression of juvenile turbot (Scophthal musmaximus L.)[J].Acta Hydrobiologica Sinica,2017,41(1):165-173.(in Chinese)
[37] 李家旭.饲料牛磺酸对斜带石斑鱼TauT基因表达的影响[D].厦门:集美大学,2016.LI J X.Effect of Taurine on TauT gene expression in Epinephelus coioides[D].Xiamen:Jimei University,2016.(in Chinese)
[38] BITOUN M,TAPPAZ M.Taurine down-regulates basal and osmolarity-induced gene expression of its transporter,but not the gene expression of its biosynthetic enzymes,in astrocyte primary cultures[J].Journal of Neurochemistry,2000,75(3):919-924.