不同气候模态下东太平洋赤道海域茎柔鱼的食性比较
朱婷1,贡艺1,2,3,4,李云凯1,2,3,4*,高小迪5,张嘉旭1
(1.上海海洋大学 海洋生物资源与管理学院,上海 201306;2.大洋渔业资源可持续开发教育部重点实验室,上海 201306;3.国家远洋渔业工程技术研究中心,上海 201306;4.农业农村部大洋渔业开发重点实验室,上海 201306;5.中国水产科学研究院东海水产研究所,上海 200090)
摘要:为了解气候异常变化对茎柔鱼(Dosidicus gigas)摄食行为的潜在影响,采用基于形态学和DNA条形码技术的胃含物分析对东太平洋赤道海域不同气候模态(2017年的正常气候时期和2020年的La Ni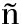 a事件发生时期)下的茎柔鱼饵料组成进行比较分析。结果表明:两种模态下,荧串光鱼(Vinciguerria lucetia)、朗明灯鱼(Diogenichthys laternatus)、翼足目(Pteropoda)和头足类是茎柔鱼的优势饵料生物,茎柔鱼在正常气候时期,还摄食褶胸鱼(Sternoptyx diaphana)和镜蛤属(Dosinia sp.),而在La Ni
a事件发生时期)下的茎柔鱼饵料组成进行比较分析。结果表明:两种模态下,荧串光鱼(Vinciguerria lucetia)、朗明灯鱼(Diogenichthys laternatus)、翼足目(Pteropoda)和头足类是茎柔鱼的优势饵料生物,茎柔鱼在正常气候时期,还摄食褶胸鱼(Sternoptyx diaphana)和镜蛤属(Dosinia sp.),而在La Ni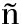 a发生时期则会摄食墨西哥尾灯鱼(Triphoturus mexicanus)和尖菱蝶螺(Clio pyramidata);Amundsen图示法发现,茎柔鱼会摄食一些稀有饵料,属于高表型内贡献类型,是广食性鱼类;Shannon多样性指数分析显示,正常时期茎柔鱼的饵料组成多样性显著高于La Ni
a发生时期则会摄食墨西哥尾灯鱼(Triphoturus mexicanus)和尖菱蝶螺(Clio pyramidata);Amundsen图示法发现,茎柔鱼会摄食一些稀有饵料,属于高表型内贡献类型,是广食性鱼类;Shannon多样性指数分析显示,正常时期茎柔鱼的饵料组成多样性显著高于La Ni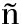 a发生时期;NMDS分析显示,两个时期茎柔鱼存在一定食性分化,而La Ni
a发生时期;NMDS分析显示,两个时期茎柔鱼存在一定食性分化,而La Ni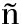 a发生时期茎柔鱼个体间食性差异更大;GII弦图及SIMPER相似性分析显示,不同气候模态下茎柔鱼的饵料差异主要体现在褶胸鱼和镜蛤属。研究表明,La Ni
a发生时期茎柔鱼个体间食性差异更大;GII弦图及SIMPER相似性分析显示,不同气候模态下茎柔鱼的饵料差异主要体现在褶胸鱼和镜蛤属。研究表明,La Ni a事件对茎柔鱼的摄食产生了显著影响。
a事件对茎柔鱼的摄食产生了显著影响。
关键词:茎柔鱼;胃含物分析;DNA条形码;气候变化
DOI:10.16535/j.cnki.dlhyxb.2023-183
文章编号:2095-1388(2024)02-0308-10
中图分类号:S 917.4
文献标志码:A
收稿日期:2023-08-10
基金项目:国家自然科学基金(31900333,42276092)
作者简介:朱婷(1997—),女,硕士研究生。E-mail:zhuting0430@qq.com
通信作者:李云凯(1981—),男,博士,教授。E-mail:ykli@shou.edu.cn
茎柔鱼(Dosidicus gigas)在东太平洋分布广泛,是世界最主要的头足类资源之一,也是中国鱿钓渔业的重要捕捞对象[1]。茎柔鱼作为一种典型的掠食性动物,在海洋生态系统中起到“承上启下”的关键性作用,其既是大型捕食者的重要捕食对象,同时自身又捕食甲壳类、鱼类和头足类等[2]。茎柔鱼通过摄食影响自身能量积累并对其生长发育产生重要影响[3],全面了解茎柔鱼摄食习性是研究茎柔鱼在海洋生态系统中功能的关键。
胃含物鉴定是开展捕食者食性分析、构建食物网的重要环节。传统胃含物鉴定法主要是对胃中饵料生物的耳石、角质颚等进行肉眼或显微观察,但其工作量较大且较难分辨消化程度高的饵料生物,而DNA条形码技术可有效解决该问题,通过测定胃中饵料生物未消化完的组织样品,可以实现对未知饵料生物的鉴定和分类[4]。因此,结合传统胃含物鉴定法和DNA条形码技术能尽可能多地解析胃含物中饵料生物的信息。目前,已有使用该技术对不同生长阶段或部分海域茎柔鱼胃含物相关研究的报道[5-7]。
在全球气候变化背景下,受极端气候事件和海洋环境变动的影响,茎柔鱼种群数量及饵料生物分布的剧烈变动引发的管理和生态问题备受关注。通过对比不同气候时期茎柔鱼食性的潜在差异,有助于了解其对极端气候事件的响应与适应机制[1]。本研究中,以东太平洋赤道海域茎柔鱼为研究对象,采用传统胃含物鉴定法和DNA条形码技术,对正常气候时期及拉尼娜(La Ni a)事件发生时期茎柔鱼的饵料生物组成进行了比较,以期为深入了解气候变化对茎柔鱼食性的潜在影响提供科学依据。
a)事件发生时期茎柔鱼的饵料生物组成进行了比较,以期为深入了解气候变化对茎柔鱼食性的潜在影响提供科学依据。
1 材料与方法
1.1 材料
茎柔鱼样品分别于2017年7—8月、2020年8—9月由中国远洋鱿钓船在东太平洋赤道海域采集(表1,图1),于-20 ℃下保存备用。
表1 茎柔鱼样品基本信息
Tab.1 Basic information on Dosidicus gigas samples

采样日期sampling date气候时期climatic period样本量/ind.sample number采样海域sampling area平均胴长/mmmantle length平均体质量/gbody weight2017-06—2017-07正常 normal9884°37'~93°52'W,2°50'~9°20'S259±33561±2552020-07—2020-08拉尼娜La Niña7787°30'~94°11'W,4°25'~6°16'S268±47535±252
1.2 方法
1.2.1 基础生物学数据的测定 将保存的175尾茎柔鱼样品在实验室解冻后,测量其胴长和体质量。解剖取其胃,放入自封袋,于-80 ℃超低温冰箱中保存。
根据美国NOAA气象预测中心发布的海洋尼诺指数(Oceanic Ni o Index,ONI),2017年6—7月是正常气候时期,2020年7—8月是La Ni
o Index,ONI),2017年6—7月是正常气候时期,2020年7—8月是La Ni a事件发生时期(以下简称为“La Ni
a事件发生时期(以下简称为“La Ni a时期”)。
a时期”)。
1.2.2 胃含物分析 将茎柔鱼胃解冻后,用吸水纸吸附干胃表面水分,用剪刀剪开胃黏膜,在体视显微镜(Olympus ZX7)下进行胃含物观察、鉴定、拍照、计数和称重。根据鱼类未消化的耳石、头足类的角质颚与齿环及甲壳类的外骨骼进行鉴定,并对饵料生物尽可能鉴定到最低分类单元。在对饵料生物计数时,鱼类耳石计左侧或右侧的最大数量;头足类角质颚计上侧或下侧角质颚的最大数量;甲壳类计形态较为完整的个体数量。尽可能将饵料生物计以最大数量,从而保证较准确地估算茎柔鱼所摄食饵料生物的个体数量。
1.2.3 DNA条形码鉴定 在无菌条件下,选取糜烂程度较小的组织块,使用体积分数为75%的乙醇、超纯水和PBS溶液反复冲洗后,确保组织表面无杂质及胃液,取100 mg组织置入灭菌离心管中,采用东盛海洋动物组织基因组DNA提取试剂盒提取组织基因组DNA。采用Nano Drop 2000超微量分光光度计测量DNA浓度。
使用无脊椎动物通用引物Lco1490和Hco2198对靶向线粒体基因细胞色素C氧化酶亚基Ⅰ (cytochrome c oxidase subunit Ⅰ,COⅠ)片段的基因组DNA进行PCR扩增。对无法扩增的样品,则采用Leray等[8]改进的新型引物mlCOIintF和jgHCO2198对COⅠ片段进行扩增,试验证明,该引物的扩增成功率较好,检出率可达91%,从而提高了鉴定效率。引物由生工生物工程(上海)股份有限公司合成。
PCR扩增体系(25 μL) 包括:TaKaRa 2× Ex Taq 12.5 μL酶,上、下游引物各0.5 μL,DNA模板5 μL,ddH2O 6.5 μL。引物及反应条件如表2所示。用10 g/L琼脂糖凝胶进行电泳,将条带明显的样品,送至生工生物工程(上海)股份有限公司进行DNA单向测序。将测序结果与NCBI(national center for biotechnology information)网站上的序列进行比对。其中,对于鱼类和头足类的目标序列,将最高匹配相似度超过99%的饵料生物确定到种,相似度低于99%、高于90%的确定到属;对于甲壳类的目标序列,将相似度超过90%的饵料生物确定到种,相似度低于90%、高于80%的确定到属[9]。最后将比对成功的鉴定结果与相应茎柔鱼样本进行对照,而形态学鉴定不出的胃含物标为未知鱼类耳石或未知头足类角质颚,从而使鉴定的结果更准确。
表2 PCR扩增引物及反应条件
Tab.2 PCR amplification primers and reaction conditions

引物 primer引物序列 sequence (5'-3')反应条件 reaction condition参考文献 referenceLco1490GGTCAAATCATAAAGATTTGGHco2198TAAACTTCAGGGTGACCAAAAAAATCAmlCOIintFGGWACWGGWTGAACWGTWTAYCCYCCjgHCO2198TAIACYTCIGGRTGICCRAARAAYCA96 ℃下预变性6 min;94 ℃下变性20 s,55 ℃下退火30 s,72 ℃下延伸40 s,共进行30个循环;最后在72 ℃下再延伸20 min,4 ℃下保存95 ℃下预变性5 min;95 ℃下变性10 s,62 ℃下退火30 s,72 ℃下延伸1 min,退火温度以1 ℃降序进行16次变性、退火、延伸循环,至退火温度为46 ℃时,重复25次循环;最后在72 ℃下再延伸10 min,4 ℃下保存Leray等[8]
1.2.4 物种累积曲线 采用R软件Vegan包通过绘制物种累积曲线(species accumulation curves)评估样本量是否充足,以进行后续不同气候时期茎柔鱼食性分析。首先对曲线进行Logistic曲线拟合,拟合度R2趋近于1,则认为曲线趋近渐近线[10]。此时可认为,随着样本量的增加物种丰富度减小,被摄食的新饵料生物种类较少。
1.2.5 重要性指数的计算 计算饵料生物数量的百分比(N,%)、出现频率(F,%)和Shannon-Wiener多样性指数(H′)[11],计算公式为
(1)
(2)
H′=-∑Pi×lnPi。
(3)
式中:Pi为第i种饵料生物的个体数在食物组成中的百分比。
参考Field等[12]的方法,计算基于N和F的几何重要性指数(the geometric index of importance,GII),以评估各种饵料生物的重要性,计算公式为
(4)
式中,IGIIj为几何重要性指数。
1.2.6 不同气候时期食性差异分析 采用Amundsen图示法分别以出现频率和数量百分比为横、纵坐标作图,描述茎柔鱼的摄食策略、饵料重要性及茎柔鱼个体间的摄食差异。
采用R软件(version 1.4.1717)的Vegan包绘制基于Bray-Curtis相似性矩阵的非度量多维尺度排序图(NMDS),分析不同气候时期茎柔鱼个体间的食性差异。
采用Origin软件绘制茎柔鱼胃含物饵料生物GII的弦图(circos),用于对比两个时期饵料生物的组成及GII数值大小关系。各圆弧间连线为弦,不同弦的颜色表示不同的气候时期,弦的宽度取决于饵料生物GII的大小,绘制时较大弦的宽度在上。不同颜色圆弧代表不同的饵料生物,值越大对应圆弧越长。使用Past 4.0软件,采用相似性百分比(SIMPER)法分析引起不同气候时期茎柔鱼饵料组成出现差异的主要饵料生物。
2 结果与分析
2.1 样本的有效性
在东太平洋赤道海域175尾茎柔鱼样品中,正常气候时期和La Ni a时期的胴长大小(ANONA,F=2.29 ,P=0.13)和体质量大小(F=0.42,P=0.52)均无显著性差异。分析两个气候时期茎柔鱼胃含物中饵料生物的物种累积曲线(图2),正常气候时期得到的曲线经Logistic曲线拟合,拟合度为R2=0.998(P<0.01),La Ni
a时期的胴长大小(ANONA,F=2.29 ,P=0.13)和体质量大小(F=0.42,P=0.52)均无显著性差异。分析两个气候时期茎柔鱼胃含物中饵料生物的物种累积曲线(图2),正常气候时期得到的曲线经Logistic曲线拟合,拟合度为R2=0.998(P<0.01),La Ni a时期的拟合度为R2=0.999(P<0.01),两个时期的拟合度均趋近于1,曲线为趋近线,当曲线呈平台期时,说明随着样本量增加将难以再出现新的物种,此时所检测的样本量充分[13]。表明本研究中两个气候时期茎柔鱼胃含物样品数量充分,可开展进一步分析。
a时期的拟合度为R2=0.999(P<0.01),两个时期的拟合度均趋近于1,曲线为趋近线,当曲线呈平台期时,说明随着样本量增加将难以再出现新的物种,此时所检测的样本量充分[13]。表明本研究中两个气候时期茎柔鱼胃含物样品数量充分,可开展进一步分析。
2.2 不同气候时期茎柔鱼的食物组成
茎柔鱼胃含物中共鉴定出90种饵料生物(表3),不同气候时期茎柔鱼共同摄食的饵料生物有25种,La Ni a时期胃含物中饵料生物的种类比正常气候时期少,主要表现为鱼类和头足类种类的变化。其中,正常气候时期共鉴定出66种饵料生物,包括鱼类37种,主要有荧串光鱼(Vinciguerria lucetia)、朗明灯鱼(Diogenichthys laternatus)、褶胸鱼(Sternoptyx diaphana)和墨西哥尾灯鱼(Triphoturus mexicanus)等;头足类9种,主要有未知头足类T1、茎柔鱼 (D.gigas)、图氏小钩腕乌贼(Abraliopsis tui)和近缘小钩腕乌贼(A.affinis)等;甲壳类16种,主要有大眼水蚤科(Corycaeidae)、镜蛤属(Dosinia sp.)和
a时期胃含物中饵料生物的种类比正常气候时期少,主要表现为鱼类和头足类种类的变化。其中,正常气候时期共鉴定出66种饵料生物,包括鱼类37种,主要有荧串光鱼(Vinciguerria lucetia)、朗明灯鱼(Diogenichthys laternatus)、褶胸鱼(Sternoptyx diaphana)和墨西哥尾灯鱼(Triphoturus mexicanus)等;头足类9种,主要有未知头足类T1、茎柔鱼 (D.gigas)、图氏小钩腕乌贼(Abraliopsis tui)和近缘小钩腕乌贼(A.affinis)等;甲壳类16种,主要有大眼水蚤科(Corycaeidae)、镜蛤属(Dosinia sp.)和 亚目(Hyperiidea)等。La Ni
亚目(Hyperiidea)等。La Ni a时期共检出49种饵料生物,包括鱼类25种,主要有荧串光鱼、朗明灯鱼、墨西哥尾灯鱼和麦氏犀鳕(Bregmaceros mcclellandi)等;头足类4种,主要有茎柔鱼等;甲壳类16种,主要有大眼水蚤和
a时期共检出49种饵料生物,包括鱼类25种,主要有荧串光鱼、朗明灯鱼、墨西哥尾灯鱼和麦氏犀鳕(Bregmaceros mcclellandi)等;头足类4种,主要有茎柔鱼等;甲壳类16种,主要有大眼水蚤和 亚目等。
亚目等。
表3 不同气候时期茎柔鱼胃含物组成(按出现频率排序)
Tab.3 Stomach contents composition of Dosidicus gigas in different climatic periods(sorted by occurrence frequency)
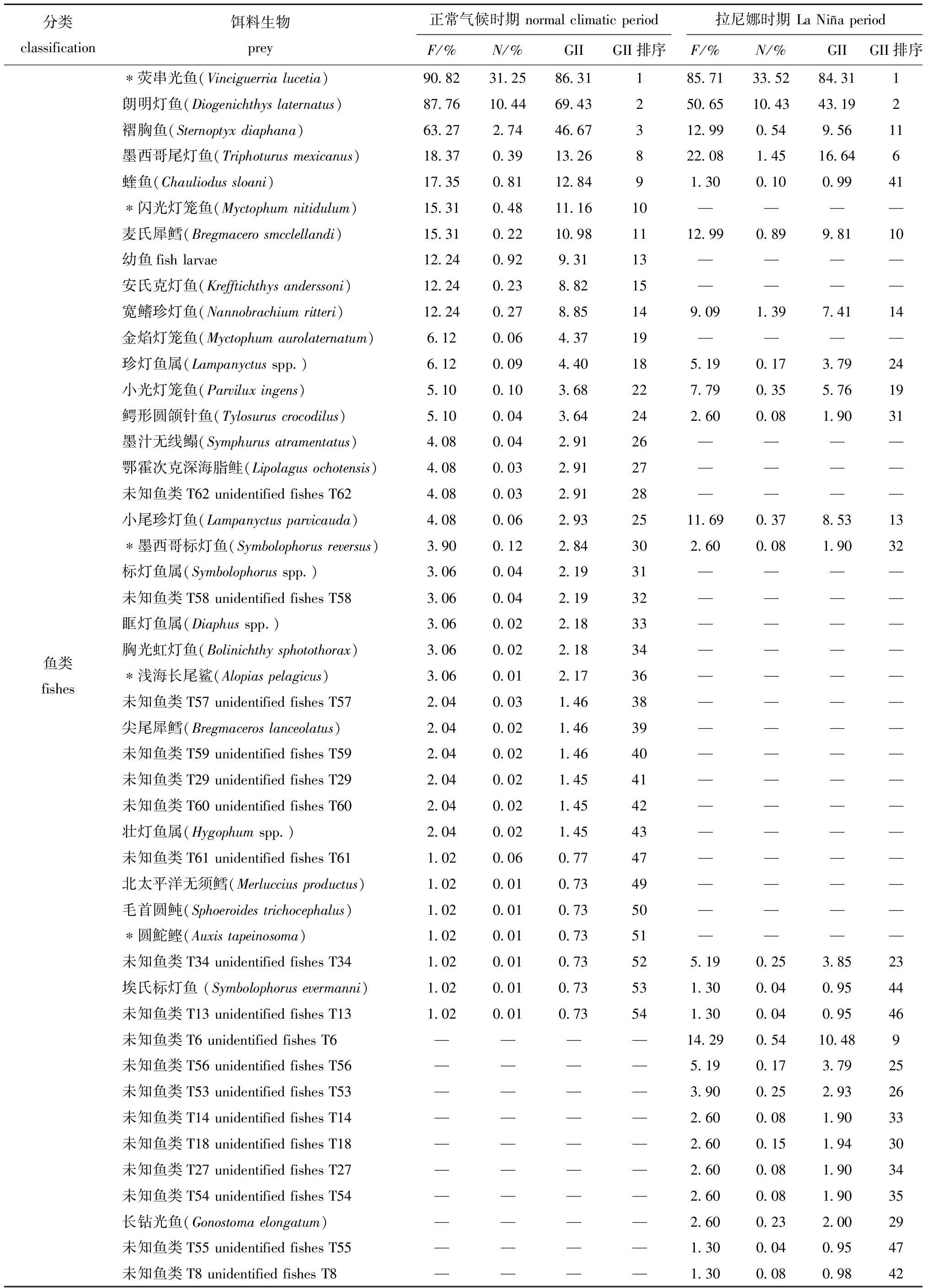
分类classification饵料生物prey正常气候时期 normal climatic period拉尼娜时期 La Niña periodF/%N/%GIIGII排序F/%N/%GIIGII排序*荧串光鱼(Vinciguerria lucetia)90.8231.2586.31185.7133.5284.311朗明灯鱼(Diogenichthys laternatus)87.7610.4469.43250.6510.4343.192褶胸鱼(Sternoptyx diaphana)63.272.7446.67312.990.549.5611墨西哥尾灯鱼(Triphoturus mexicanus)18.370.3913.26822.081.4516.646蝰鱼(Chauliodus sloani)17.350.8112.8491.300.100.9941*闪光灯笼鱼(Myctophum nitidulum)15.310.4811.1610————麦氏犀鳕(Bregmacero smcclellandi)15.310.2210.981112.990.899.8110幼鱼fish larvae12.240.929.3113————安氏克灯鱼(Krefftichthys anderssoni)12.240.238.8215————宽鳍珍灯鱼(Nannobrachium ritteri)12.240.278.85149.091.397.4114金焰灯笼鱼(Myctophum aurolaternatum)6.120.064.3719————珍灯鱼属(Lampanyctus spp.)6.120.094.40185.190.173.7924小光灯笼鱼(Parvilux ingens)5.100.103.68227.790.355.7619鳄形圆颌针鱼(Tylosurus crocodilus)5.100.043.64242.600.081.9031墨汁无线鳎(Symphurus atramentatus)4.080.042.9126————鄂霍次克深海脂鲑(Lipolagus ochotensis)4.080.032.9127————未知鱼类T62 unidentified fishes T624.080.032.9128————小尾珍灯鱼(Lampanyctus parvicauda)4.080.062.932511.690.378.5313*墨西哥标灯鱼(Symbolophorus reversus)3.900.122.84302.600.081.9032标灯鱼属(Symbolophorus spp.)3.060.042.1931————未知鱼类T58 unidentified fishes T583.060.042.1932————眶灯鱼属(Diaphus spp.)3.060.022.1833————胸光虹灯鱼(Bolinichthy sphotothorax)3.060.022.1834————鱼类fishes*浅海长尾鲨(Alopias pelagicus)3.060.012.1736————未知鱼类T57 unidentified fishes T572.040.031.4638————尖尾犀鳕(Bregmaceros lanceolatus)2.040.021.4639————未知鱼类T59 unidentified fishes T592.040.021.4640————未知鱼类T29 unidentified fishes T292.040.021.4541————未知鱼类T60 unidentified fishes T602.040.021.4542————壮灯鱼属(Hygophum spp.)2.040.021.4543————未知鱼类T61 unidentified fishes T611.020.060.7747————北太平洋无须鳕(Merluccius productus)1.020.010.7349————毛首圆鲀(Sphoeroides trichocephalus)1.020.010.7350————*圆鮀鲣(Auxis tapeinosoma)1.020.010.7351————未知鱼类T34 unidentified fishes T341.020.010.73525.190.253.8523埃氏标灯鱼 (Symbolophorus evermanni)1.020.010.73531.300.040.9544未知鱼类T13 unidentified fishes T131.020.010.73541.300.040.9546未知鱼类T6 unidentified fishes T6————14.290.5410.489未知鱼类T56 unidentified fishes T56————5.190.173.7925未知鱼类T53 unidentified fishes T53————3.900.252.9326未知鱼类T14 unidentified fishes T14————2.600.081.9033未知鱼类T18 unidentified fishes T18————2.600.151.9430未知鱼类T27 unidentified fishes T27————2.600.081.9034未知鱼类T54 unidentified fishes T54————2.600.081.9035长钻光鱼(Gonostoma elongatum)————2.600.232.0029未知鱼类T55 unidentified fishes T55————1.300.040.9547未知鱼类T8 unidentified fishes T8————1.300.080.9842
表3(续) 不同气候时期茎柔鱼胃含物组成(按出现频率排序)
Tab.3(Cont.) Stomach contents composition of Dosidicus gigas in different climatic periods(sorted by occurrence frequency)
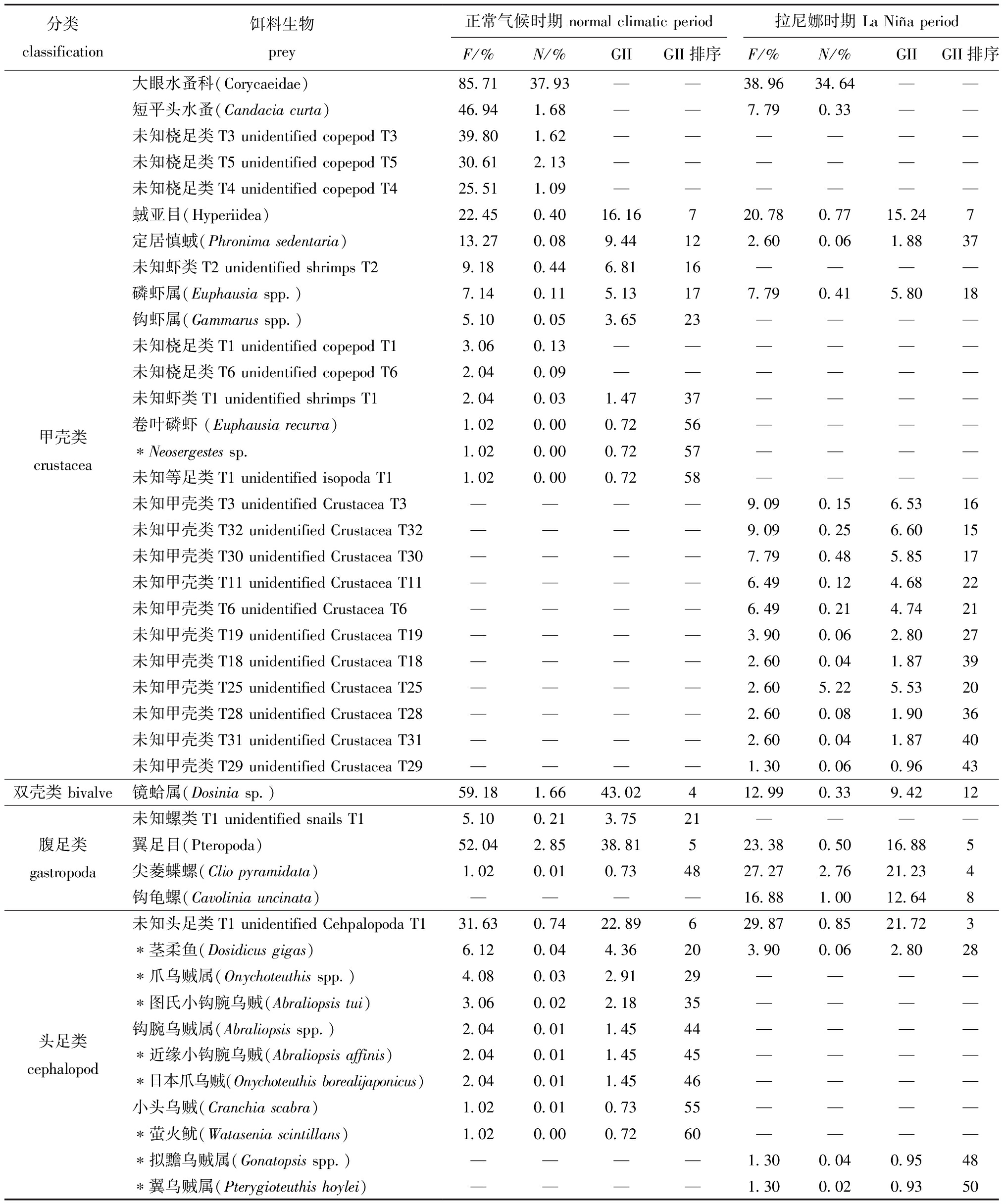
分类classification饵料生物prey正常气候时期 normal climatic period拉尼娜时期 La Niña periodF/%N/%GIIGII排序F/%N/%GIIGII排序大眼水蚤科(Corycaeidae)85.7137.93——38.9634.64——短平头水蚤(Candacia curta)46.941.68——7.790.33——未知桡足类T3 unidentified copepod T339.801.62——————未知桡足类T5 unidentified copepod T530.612.13——————未知桡足类T4 unidentified copepod T425.511.09——————亚目(Hyperiidea)22.450.4016.16720.780.7715.247定居慎(Phronima sedentaria)13.270.089.44122.600.061.8837未知虾类T2 unidentified shrimps T29.180.446.8116————磷虾属(Euphausia spp.)7.140.115.13177.790.415.8018钩虾属(Gammarus spp.)5.100.053.6523————未知桡足类T1 unidentified copepod T13.060.13——————未知桡足类T6 unidentified copepod T62.040.09——————未知虾类T1 unidentified shrimps T12.040.031.4737————卷叶磷虾 (Euphausia recurva)1.020.000.7256————甲壳类crustacea*Neosergestes sp.1.020.000.7257————未知等足类T1 unidentified isopoda T11.020.000.7258————未知甲壳类T3 unidentified Crustacea T3————9.090.156.5316未知甲壳类T32 unidentified Crustacea T32————9.090.256.6015未知甲壳类T30 unidentified Crustacea T30————7.790.485.8517未知甲壳类T11 unidentified Crustacea T11————6.490.124.6822未知甲壳类T6 unidentified Crustacea T6————6.490.214.7421未知甲壳类T19 unidentified Crustacea T19————3.900.062.8027未知甲壳类T18 unidentified Crustacea T18————2.600.041.8739未知甲壳类T25 unidentified Crustacea T25————2.605.225.5320未知甲壳类T28 unidentified Crustacea T28————2.600.081.9036未知甲壳类T31 unidentified Crustacea T31————2.600.041.8740未知甲壳类T29 unidentified Crustacea T29————1.300.060.9643双壳类 bivalve镜蛤属(Dosinia sp.)59.181.6643.02412.990.339.4212未知螺类T1 unidentified snails T15.100.213.7521————腹足类gastropoda翼足目(Pteropoda)52.042.8538.81523.380.5016.885尖菱蝶螺(Clio pyramidata)1.020.010.734827.272.7621.234钩龟螺(Cavolinia uncinata)————16.881.0012.648未知头足类T1 unidentified Cehpalopoda T131.630.7422.89629.870.8521.723*茎柔鱼(Dosidicus gigas)6.120.044.36203.900.062.8028*爪乌贼属(Onychoteuthis spp.)4.080.032.9129————*图氏小钩腕乌贼(Abraliopsis tui)3.060.022.1835————钩腕乌贼属(Abraliopsis spp.)2.040.011.4544————头足类cephalopod*近缘小钩腕乌贼(Abraliopsis affinis)2.040.011.4545————*日本爪乌贼(Onychoteuthis borealijaponi-cus)2.040.011.4546————小头乌贼(Cranchia scabra)1.020.010.7355————*萤火鱿(Watasenia scintillans)1.020.000.7260————*拟黵乌贼属(Gonatopsis spp.)————1.300.040.9548*翼乌贼属(Pterygioteuthis hoylei)————1.300.020.9350
注:*表示DNA条形码鉴定物种。
Note:* indicates identification results by DNA barcoding.
由于茎柔鱼消化速度快,在胃中观察到大部分食物以肉糜、鱼鳞片、鱼骨和眼球等混合物的形式存在,难以准确计量各饵料生物,因此,使用传统方法估算质量难以准确定量分析。本研究中参考Field等[12]的方法,使用几何重要性指数来估算饵料生物的重要性。结果显示:正常气候时期,茎柔鱼饵料生物GII数值从大到小依次为荧串光鱼(GII=86.31)、朗明灯鱼(GII=69.43)、褶胸鱼(GII=46.67)、镜蛤属(GII=43.02)、翼足目(GII=38.81)、未知头足类T1(GII=22.89);La Ni a时期,GII数值从大到小排序为荧串光鱼(GII=84.31)、朗明灯鱼(GII=43.19)、未知头足类T1(GII=21.72)、尖菱蝶螺(GII=21.33)、翼足目(GII=16.88)(表3)。
a时期,GII数值从大到小排序为荧串光鱼(GII=84.31)、朗明灯鱼(GII=43.19)、未知头足类T1(GII=21.72)、尖菱蝶螺(GII=21.33)、翼足目(GII=16.88)(表3)。
从出现频率来看,正常气候时期和La Ni a时期茎柔鱼的饵料生物出现频率最高的鱼类均是荧串光鱼(分别为90.82%和85.71%),甲壳类最高的均是大眼水蚤(分别为85.71%和38.96%),头足类最高的均是未知头足类T1(分别为31.63%和29.87%)。此外,两时期均出现了一定频率的自食现象,正常气候时期饵料生物茎柔鱼的出现频率为6.12%,La Ni
a时期茎柔鱼的饵料生物出现频率最高的鱼类均是荧串光鱼(分别为90.82%和85.71%),甲壳类最高的均是大眼水蚤(分别为85.71%和38.96%),头足类最高的均是未知头足类T1(分别为31.63%和29.87%)。此外,两时期均出现了一定频率的自食现象,正常气候时期饵料生物茎柔鱼的出现频率为6.12%,La Ni a时期为3.90%。从数量百分比来看,正常气候时期和La Ni
a时期为3.90%。从数量百分比来看,正常气候时期和La Ni a时期茎柔鱼的饵料生物数量百分比最高的鱼类均是荧串光鱼(分别为31.25%和33.52%),甲壳类最高的均是大眼水蚤(分别为37.93%和34.64%),头足类最高的均是未知头足类T1(分别为0.74%和0.85%)(表3)。
a时期茎柔鱼的饵料生物数量百分比最高的鱼类均是荧串光鱼(分别为31.25%和33.52%),甲壳类最高的均是大眼水蚤(分别为37.93%和34.64%),头足类最高的均是未知头足类T1(分别为0.74%和0.85%)(表3)。
175尾茎柔鱼胃含物样品基于COⅠ引物扩增共获得14条有效序列(表4),NCBI比对结果分属于鱼类、头足类和虾类等,其中,鱼类5种、头足类8种和虾类1种,包括墨西哥标灯鱼(Symbolophorus reversus)、拟黵乌贼属(Gonatopsis spp.)、Pterygioteuthis hoylei、茎柔鱼、闪光灯笼鱼(Myctophum nitidulum)、荧串光鱼、萤火鱿(Watasenia scintillans)、图式小钩腕乌贼、近缘小钩腕乌贼、爪乌贼属(Onychoteuthis spp.)和日本爪乌贼(O.borealijaponicus)等。此外,还鉴定出浅海长尾鲨(Alopias pelagicus)、圆鮀鲣(Auxis tapeinosoma)这两种营养级较高的饵料生物。
表4 茎柔鱼胃含物DNA条形码鉴定结果
Tab.4 Identification results of stomach contents of Dosidicus gigas by DNA barcoding
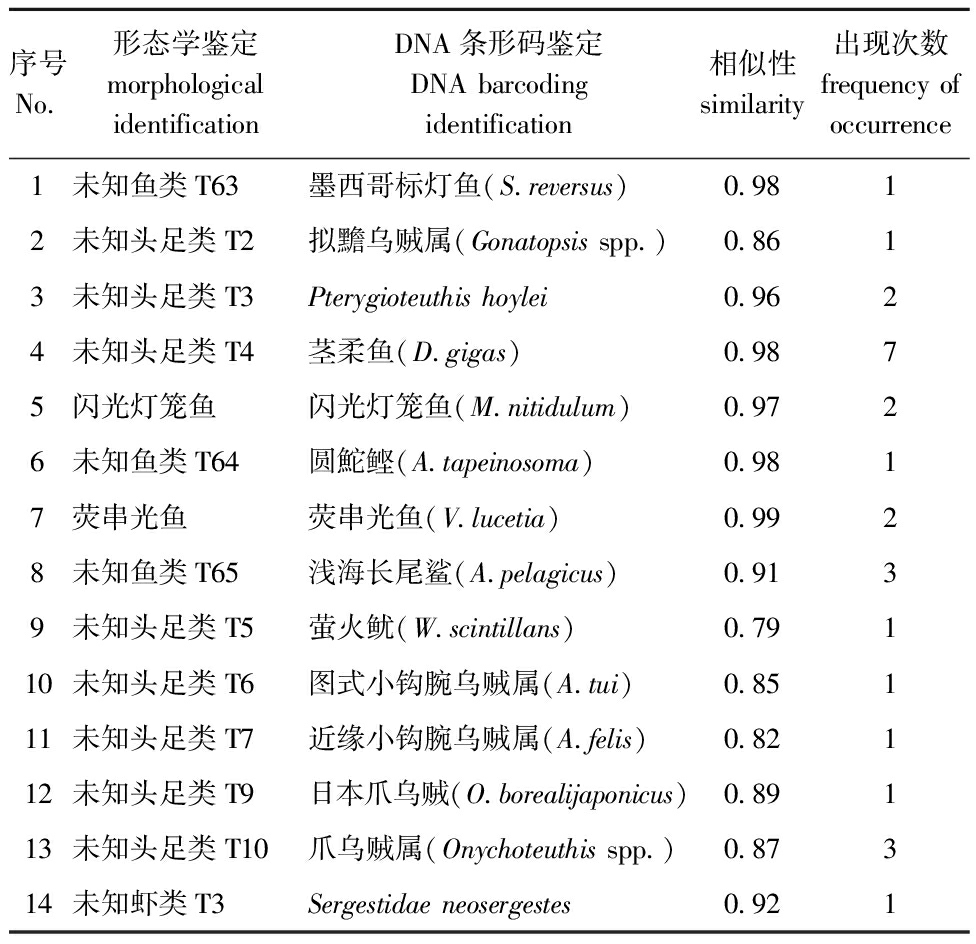
序号No.形态学鉴定morphological identificationDNA条形码鉴定DNA barcoding identification相似性similarity出现次数frequency of occurrence1未知鱼类T63墨西哥标灯鱼(S.reversus)0.9812未知头足类T2拟黵乌贼属(Gonatopsis spp.)0.8613未知头足类T3Pterygioteuthis hoylei0.9624未知头足类T4茎柔鱼(D.gigas)0.9875闪光灯笼鱼闪光灯笼鱼(M.nitidulum)0.9726未知鱼类T64圆鮀鲣(A.tapeinosoma)0.9817荧串光鱼荧串光鱼(V.lucetia)0.9928未知鱼类T65浅海长尾鲨(A.pelagicus)0.9139未知头足类T5萤火鱿(W.scintillans)0.79110未知头足类T6图式小钩腕乌贼属(A.tui)0.85111未知头足类T7近缘小钩腕乌贼属(A.felis)0.82112未知头足类T9日本爪乌贼(O.borealijaponicus)0.89113未知头足类T10爪乌贼属(Onychoteuthis spp.)0.87314未知虾类T3Sergestidae neosergestes0.921
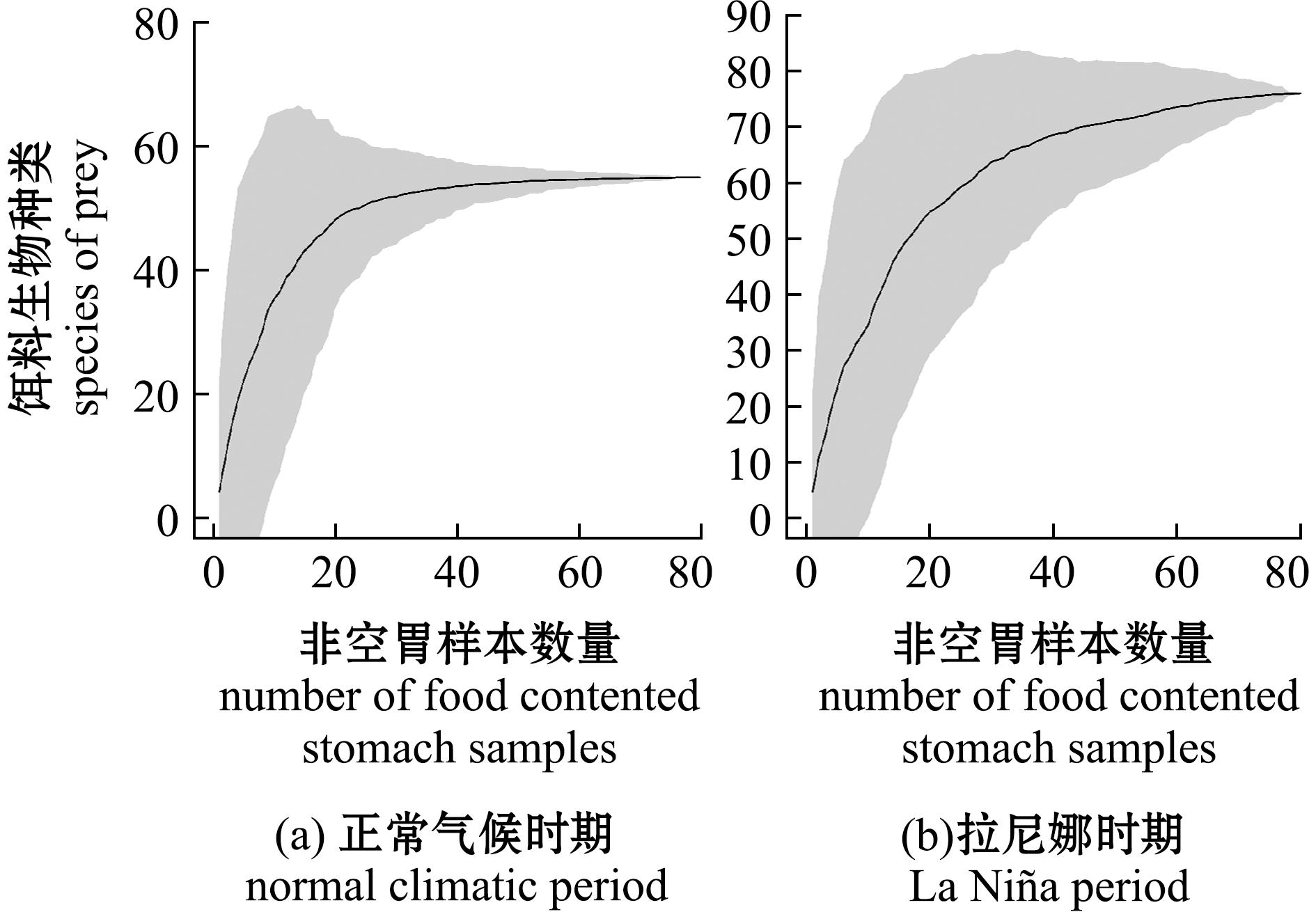
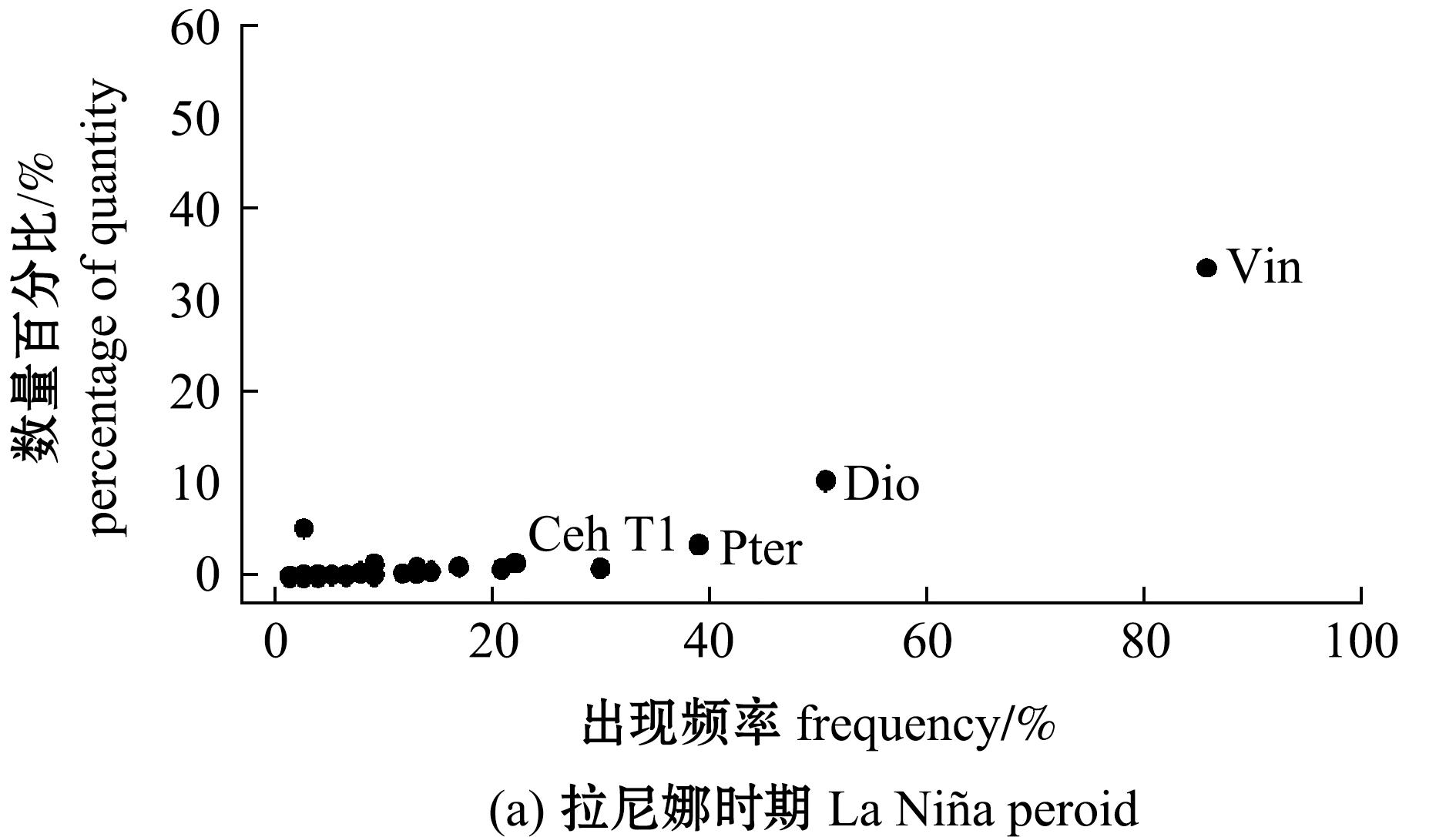
2.3 不同气候时期茎柔鱼摄食策略
根据Amundsen图示法(图3),正常气候时期茎柔鱼主要饵料是荧串光鱼、朗明灯鱼,较重要饵料是褶胸鱼、镜蛤属和翼足目;而La Ni a时期主要饵料是荧串光鱼和朗明灯鱼,较重要饵料是翼足目和头足类。相较正常气候时期,La Ni
a时期主要饵料是荧串光鱼和朗明灯鱼,较重要饵料是翼足目和头足类。相较正常气候时期,La Ni a时期的朗明灯鱼出现频率从87.76%下降到50.65%,而其他饵料生物多分布在Amundsen图的左下部分,出现频率和丰度均较低,出现频率大多低于20%,属稀有饵料[14]。此外,Amundsen图还显示,茎柔鱼为高表型内贡献(即高WPC类型)物种,种群内部食物组成差异较小,食物重叠程度较高[15]。
a时期的朗明灯鱼出现频率从87.76%下降到50.65%,而其他饵料生物多分布在Amundsen图的左下部分,出现频率和丰度均较低,出现频率大多低于20%,属稀有饵料[14]。此外,Amundsen图还显示,茎柔鱼为高表型内贡献(即高WPC类型)物种,种群内部食物组成差异较小,食物重叠程度较高[15]。
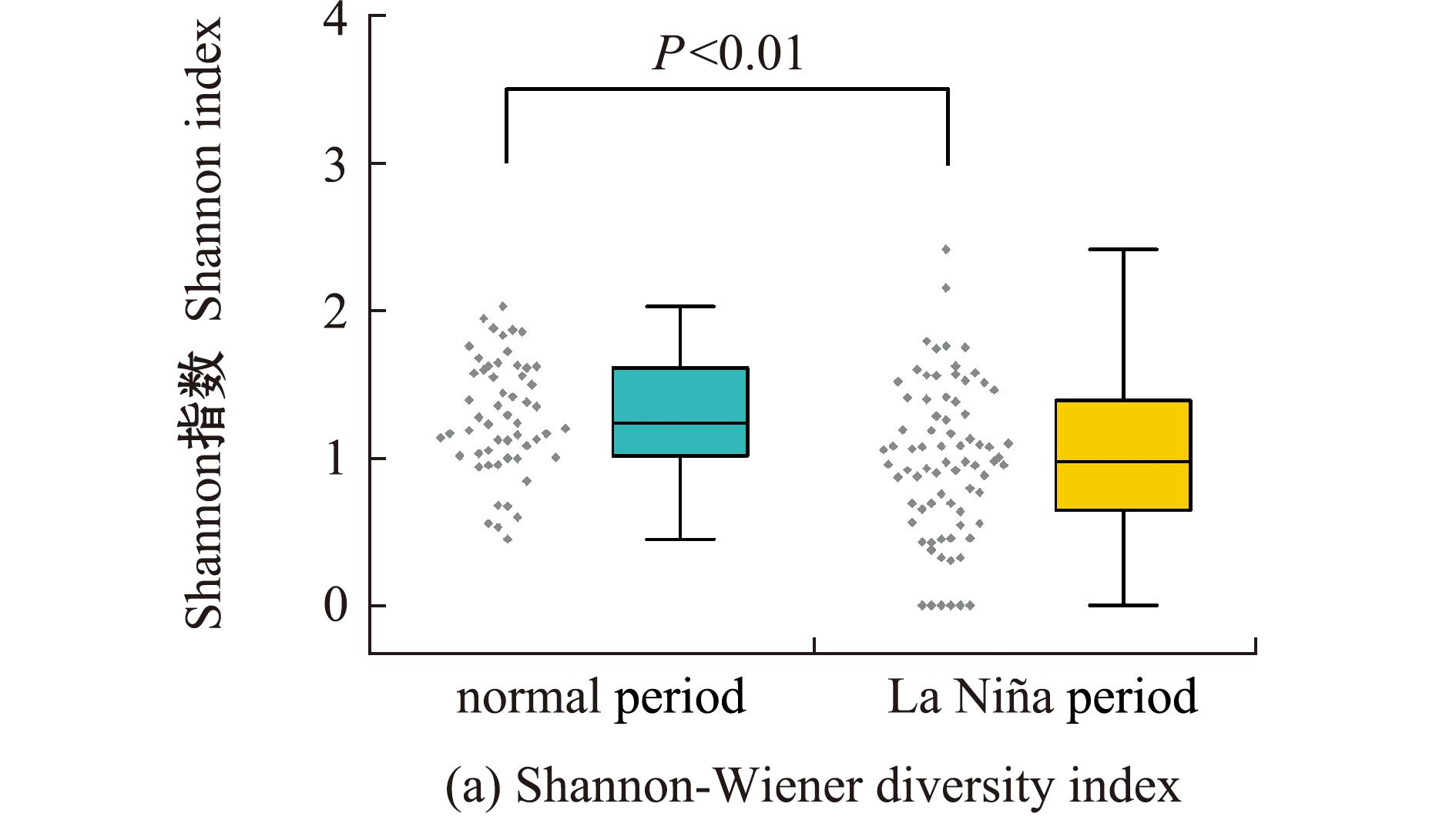
2.4 不同气候时期饵料生物的多样性
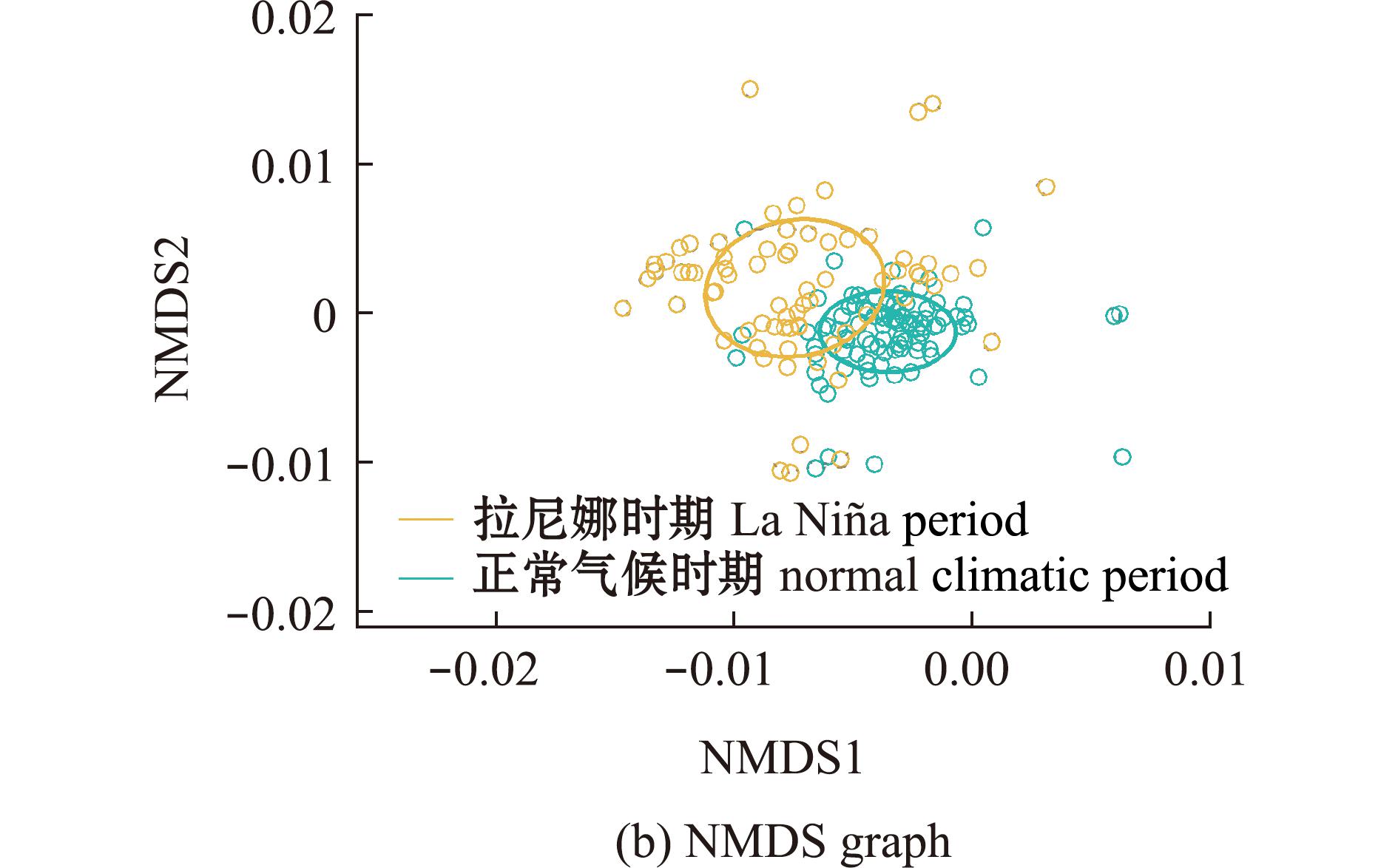
茎柔鱼食物组成Shannon多样性指数分析显示,相较正常气候时期,La Ni a时期茎柔鱼的饵料组成多样性水平较低(P<0.05,图4(a))。NMDS分析显示:茎柔鱼正常气候时期和La Ni
a时期茎柔鱼的饵料组成多样性水平较低(P<0.05,图4(a))。NMDS分析显示:茎柔鱼正常气候时期和La Ni a时期仅部分重叠,表示两个时期的饵料生物组成存在一定差异;正常气候时期饵料生物分布比较紧凑,茎柔鱼个体间食性差异较小,而La Ni
a时期仅部分重叠,表示两个时期的饵料生物组成存在一定差异;正常气候时期饵料生物分布比较紧凑,茎柔鱼个体间食性差异较小,而La Ni a时期则相对分散,该时期的面积显著大于正常气候时期,表明个体间摄食组成存在较大差异(图4(b))。
a时期则相对分散,该时期的面积显著大于正常气候时期,表明个体间摄食组成存在较大差异(图4(b))。
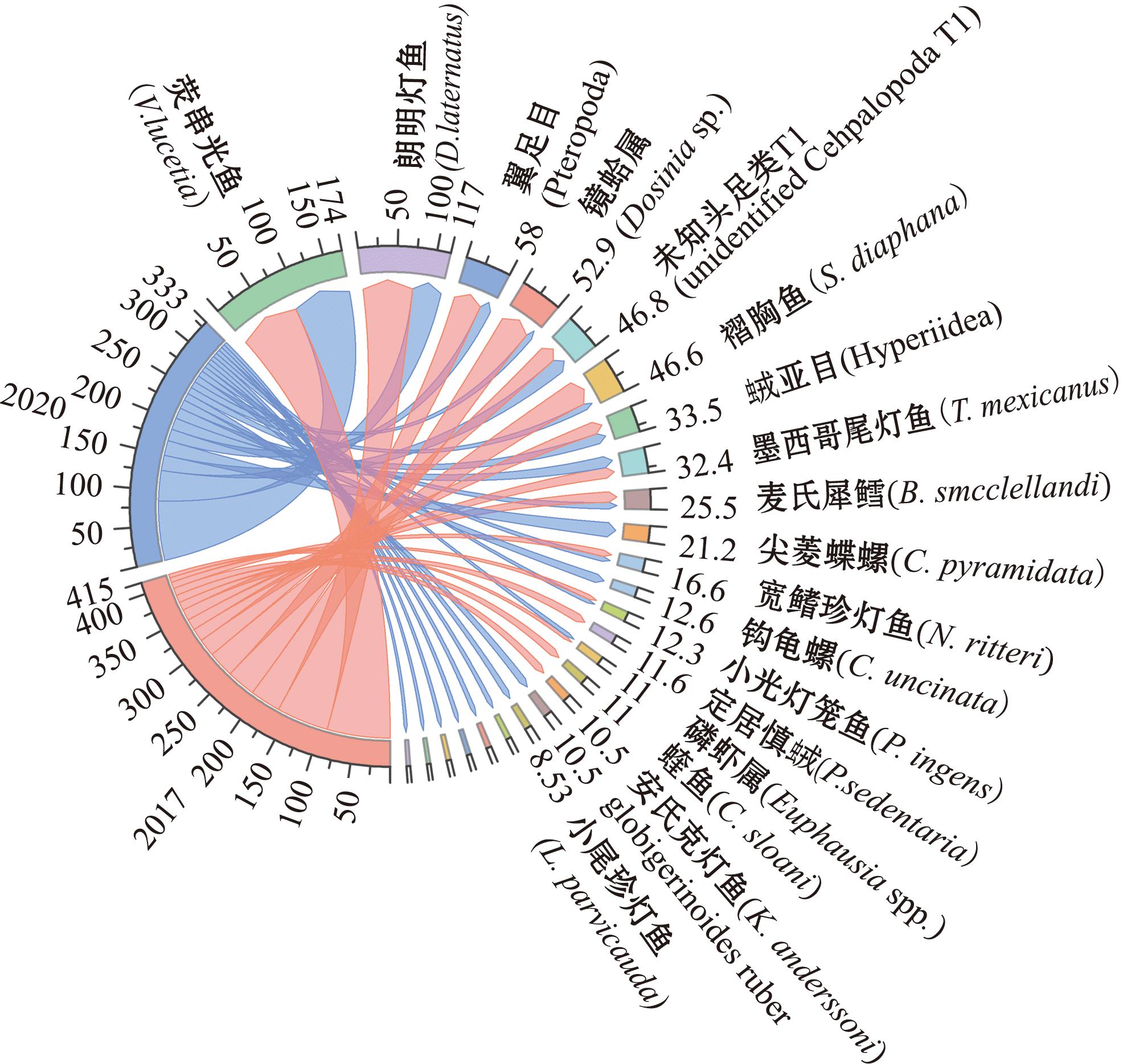
2.5 不同气候时期饵料生物的差异
胃含物GII弦图显示,与正常气候时期相比,La Ni a时期朗明灯鱼、翼足目、褶胸鱼和镜蛤属的GII数值减少,尖菱蝶螺(Clio pyramidata)、钩龟螺(Cavolinia uncinata)、未知鱼类T6和小尾珍灯鱼(Lampanyctus parvicauda)GII数值显著增加,定居慎
a时期朗明灯鱼、翼足目、褶胸鱼和镜蛤属的GII数值减少,尖菱蝶螺(Clio pyramidata)、钩龟螺(Cavolinia uncinata)、未知鱼类T6和小尾珍灯鱼(Lampanyctus parvicauda)GII数值显著增加,定居慎 (Phronima sedentaria)、安氏克灯鱼(Krefftichthys anderssoni)和虾类GII数值为0(图5)。SIMPER相似性分析显示,两个气候时期茎柔鱼饵料组成差异贡献度较高的是镜蛤属(7.65%)、翼足目(7.12%)、褶胸鱼(6.77%),其他饵料生物贡献度从高到低依次为朗明灯鱼(6.47%)、未知头足类T1(5.85%)、
(Phronima sedentaria)、安氏克灯鱼(Krefftichthys anderssoni)和虾类GII数值为0(图5)。SIMPER相似性分析显示,两个气候时期茎柔鱼饵料组成差异贡献度较高的是镜蛤属(7.65%)、翼足目(7.12%)、褶胸鱼(6.77%),其他饵料生物贡献度从高到低依次为朗明灯鱼(6.47%)、未知头足类T1(5.85%)、 亚目(4.80%)、墨西哥尾灯鱼(4.62%)、麦氏犀鳕(3.95%)、尖菱蝶螺(3.72%)、宽鳍珍灯鱼(Nannobrachium ritteri)(2.65%)、荧串光鱼(2.53%)、定居慎戎(2.43%)和钩龟螺(2.31%)。
亚目(4.80%)、墨西哥尾灯鱼(4.62%)、麦氏犀鳕(3.95%)、尖菱蝶螺(3.72%)、宽鳍珍灯鱼(Nannobrachium ritteri)(2.65%)、荧串光鱼(2.53%)、定居慎戎(2.43%)和钩龟螺(2.31%)。
3 讨论
3.1 东太平洋赤道海域茎柔鱼的胃含物组成
头足类是海洋食物网中的关键组成部分,且大多是活跃的捕食者[16]。在适宜的环境条件下,头足类会倾向于选择在饵料生物丰度高、可获得性强的海域摄食[17]。头足类与其饵料生物间营养关系的相关研究是构建海洋食物网、理解海洋生态系统和营养动力学研究的基础。本研究中发现,东太平洋赤道海域茎柔鱼在正常气候时期和La Ni a时期以鱼类、头足类和甲壳类为主要饵料,其中,共同优势饵料有荧串光鱼、朗明灯鱼、翼足目和头足类,正常气候时期特有的优势饵料包括褶胸鱼、镜蛤属,而La Ni
a时期以鱼类、头足类和甲壳类为主要饵料,其中,共同优势饵料有荧串光鱼、朗明灯鱼、翼足目和头足类,正常气候时期特有的优势饵料包括褶胸鱼、镜蛤属,而La Ni a时期则包括墨西哥尾灯鱼和尖菱蝶螺,本研究中茎柔鱼胃含物鉴定结果与加利福尼亚湾[5,12,17-19]、秘鲁外海[6,20]及东太平洋赤道海域[11]的茎柔鱼胃含物研究结果相似,但与智利外海的研究结果存在差异。Marco等[21]和Bruno等[22]研究发现,智利外海茎柔鱼的饵料生物主要为智利无须鳕(Merluccius gayi)、秘鲁鳀(Engraulis ringens)、贝氏智利鲱(Stragonema bentincki)和磷虾目(Euphausiacea)。造成饵料生物组成差异的原因可能是饵料生物在不同地区的分布差异,而茎柔鱼多扮演“机会主义”捕食者角色,区域间饵料生物分布的差异导致茎柔鱼食性的差异。此外,本研究中还显示,茎柔鱼多以中上层鱼类和无脊椎动物为食,此类生物含有较高含量的多不饱和脂肪酸,属于高能量生物,因此,为追求更高的净能量收益,茎柔鱼可能选择了这一摄食策略[21]。有研究发现,饵料生物的生活史特征也会影响茎柔鱼的生活习性[20],如荧串光鱼生活史中存在显著的垂直迁移行为,主要表现为夜间随浮游动物的迁徙上升到表层觅食,白天则下降到中层以躲避捕食者并消化食物,而茎柔鱼与荧串光鱼有着相似的垂直移动模式[20,23],这也决定了荧串光鱼在茎柔鱼食物组成中占据主要地位。
a时期则包括墨西哥尾灯鱼和尖菱蝶螺,本研究中茎柔鱼胃含物鉴定结果与加利福尼亚湾[5,12,17-19]、秘鲁外海[6,20]及东太平洋赤道海域[11]的茎柔鱼胃含物研究结果相似,但与智利外海的研究结果存在差异。Marco等[21]和Bruno等[22]研究发现,智利外海茎柔鱼的饵料生物主要为智利无须鳕(Merluccius gayi)、秘鲁鳀(Engraulis ringens)、贝氏智利鲱(Stragonema bentincki)和磷虾目(Euphausiacea)。造成饵料生物组成差异的原因可能是饵料生物在不同地区的分布差异,而茎柔鱼多扮演“机会主义”捕食者角色,区域间饵料生物分布的差异导致茎柔鱼食性的差异。此外,本研究中还显示,茎柔鱼多以中上层鱼类和无脊椎动物为食,此类生物含有较高含量的多不饱和脂肪酸,属于高能量生物,因此,为追求更高的净能量收益,茎柔鱼可能选择了这一摄食策略[21]。有研究发现,饵料生物的生活史特征也会影响茎柔鱼的生活习性[20],如荧串光鱼生活史中存在显著的垂直迁移行为,主要表现为夜间随浮游动物的迁徙上升到表层觅食,白天则下降到中层以躲避捕食者并消化食物,而茎柔鱼与荧串光鱼有着相似的垂直移动模式[20,23],这也决定了荧串光鱼在茎柔鱼食物组成中占据主要地位。
茎柔鱼是具有高度洄游能力的短周期头足类,由于其快速生长和高速代谢需求,导致种群在饵料生物匮乏或者群体数量过多的情况下出现一种限制策略——自食现象[9]。本研究中发现,正常时期和La Ni a时期的茎柔鱼均存在一定程度的同类相食现象。在太平洋的其他海域如智利(F=25%[21],F=28.6%[7])、东太平洋赤道海域(F=17.81%[11])、秘鲁(F=13.2%[6],F=10.77%[20])和加利福尼亚湾(F=26%[19])等的茎柔鱼食性研究中均验证了这种现象,其中以Ibarra-García等[24]的研究中出现自食现象的频率最高(F=43%),但Rosas-Luis等[20]则认为,茎柔鱼的自食现象频率可能存在一定误差,因为茎柔鱼可能会啃食同时被捕捞进网的附近其他渔获物,从而导致对自食现象的错误估计,因此,未来还需对茎柔鱼自食规律进一步探究。
a时期的茎柔鱼均存在一定程度的同类相食现象。在太平洋的其他海域如智利(F=25%[21],F=28.6%[7])、东太平洋赤道海域(F=17.81%[11])、秘鲁(F=13.2%[6],F=10.77%[20])和加利福尼亚湾(F=26%[19])等的茎柔鱼食性研究中均验证了这种现象,其中以Ibarra-García等[24]的研究中出现自食现象的频率最高(F=43%),但Rosas-Luis等[20]则认为,茎柔鱼的自食现象频率可能存在一定误差,因为茎柔鱼可能会啃食同时被捕捞进网的附近其他渔获物,从而导致对自食现象的错误估计,因此,未来还需对茎柔鱼自食规律进一步探究。
3.2 饵料生物的DNA条形码鉴定
DNA条形码技术作为物种鉴定的补充方法,可有效鉴定出消化程度较高的饵料种类,极大地提高了物种的鉴定水平[25-26]。由于本研究中茎柔鱼胃组织内几乎不存在完整的鱼类及头足类,同时在部分茎柔鱼胃中存在充满整个胃但无角质颚的头足类组织,因此,本研究中采用传统DNA条形码无脊椎动物通用引物Lco1490/Hco2198与Leray等[8]改进的引物mlCOIintF/jgHCO2198相结合的方式,对东太平洋赤道海域茎柔鱼胃含物进行DNA条形码鉴定,并成功鉴定出8种头足类,包括拟黵乌贼属、翼乌贼属(P.hoylei)、茎柔鱼、萤火鱿、图式小钩腕乌贼和近缘小钩腕乌贼等。席晓晴等[25]研究发现,DNA鉴定的优点:一是可以对胃含物中被消化后较小的组织进行物种鉴定;二是对饵料生物不同生长发育阶段、不同性别、不同年龄进行鉴定;三是对表型相似的鱼类或头足类可以进行更加准确的鉴定;四是在依托GenBank数据库的基础上,使鉴定更加准确快速。本研究中证明,分子技术可有效提高饵料生物的物种鉴定水平,但DNA条形码技术目前只能满足定性鉴定的条件,不能达到定量测定的目的,因此,DNA条形码技术目前仍不能代替传统的分类方法,需要结合形态学鉴定的定量分析才能更加准确地进行食性分析[26]。此外,在样品有限的情况下,两种方法结合可以获得更加详细的食性信息。
3.3 气候变化对茎柔鱼食性的影响
La Ni a时期和正常气候时期茎柔鱼的摄食差异可能是由气候异常变化引发的海洋温度变化所驱动的。当La Ni
a时期和正常气候时期茎柔鱼的摄食差异可能是由气候异常变化引发的海洋温度变化所驱动的。当La Ni a事件发生时,东太平洋赤道海域上升流势力强盛,海表面温度降低,表面营养盐丰富,从而导致浮游植物大量繁殖,初级生产力升高[27],并影响饵料生物的栖息地分布和垂直移动习性,最终导致茎柔鱼饵料的可获得性发生改变。本研究表明,La Ni
a事件发生时,东太平洋赤道海域上升流势力强盛,海表面温度降低,表面营养盐丰富,从而导致浮游植物大量繁殖,初级生产力升高[27],并影响饵料生物的栖息地分布和垂直移动习性,最终导致茎柔鱼饵料的可获得性发生改变。本研究表明,La Ni a时期的朗明灯鱼、定居慎
a时期的朗明灯鱼、定居慎 亚目、镜蛤属、翼足目、褶胸鱼、蝰鱼的出现频率明显比正常气候时期低,其中,朗明灯鱼的出现频率变化最为显著,由87.76%下降到50.65%,而小尾珍灯鱼、墨西哥尾灯鱼的出现频率却显著升高。Sanchez-Velasco等[28]研究发现,在La Ni
亚目、镜蛤属、翼足目、褶胸鱼、蝰鱼的出现频率明显比正常气候时期低,其中,朗明灯鱼的出现频率变化最为显著,由87.76%下降到50.65%,而小尾珍灯鱼、墨西哥尾灯鱼的出现频率却显著升高。Sanchez-Velasco等[28]研究发现,在La Ni a时期前,朗明灯鱼主要分布在海表混合层,而在La Ni
a时期前,朗明灯鱼主要分布在海表混合层,而在La Ni a时期,朗明灯鱼栖息地显著向低溶解氧浓度、低温度的温跃层和浅缺氧层移动,这解释了本研究中La Ni
a时期,朗明灯鱼栖息地显著向低溶解氧浓度、低温度的温跃层和浅缺氧层移动,这解释了本研究中La Ni a时期朗明灯鱼频率显著下降的原因。此外,Shannon多样性指数表明,La Ni
a时期朗明灯鱼频率显著下降的原因。此外,Shannon多样性指数表明,La Ni a时期茎柔鱼的饵料组成多样性水平比正常气候时期水平低。在热带东太平洋区域,季节性的环境变化(如微量元素、营养盐和温度等)微弱,气候变化是导致该海域环境要素年际变化的重要原因[17],说明不同时期饵料组成的差异可能主要是气候异常变化所导致的环境差异造成的。
a时期茎柔鱼的饵料组成多样性水平比正常气候时期水平低。在热带东太平洋区域,季节性的环境变化(如微量元素、营养盐和温度等)微弱,气候变化是导致该海域环境要素年际变化的重要原因[17],说明不同时期饵料组成的差异可能主要是气候异常变化所导致的环境差异造成的。
4 结论
1)La Ni a时期和正常气候时期茎柔鱼均主要以中上层小型鱼类、头足类及甲壳类为食,但饵料种类和数量具有显著性差异。
a时期和正常气候时期茎柔鱼均主要以中上层小型鱼类、头足类及甲壳类为食,但饵料种类和数量具有显著性差异。
2)La Ni a时期茎柔鱼饵料多样性显著低于正常气候时期,而NMDS结果发现,两时期茎柔鱼食性存在一定差异,相较正常气候时期来说,La Ni
a时期茎柔鱼饵料多样性显著低于正常气候时期,而NMDS结果发现,两时期茎柔鱼食性存在一定差异,相较正常气候时期来说,La Ni a时期茎柔鱼个体间食性差异较大,说明La Ni
a时期茎柔鱼个体间食性差异较大,说明La Ni a事件会对茎柔鱼的摄食产生显著影响。
a事件会对茎柔鱼的摄食产生显著影响。
参考文献:
[1] 汪惠琼,陈洁南,李云凯,等.厄尔尼诺对柔鱼亚科近缘种茎柔鱼与鸢乌贼营养生态位的影响[J].海洋渔业,2020,42(5):524-532. WANG H Q,CHEN J N,LI Y K,et al.Impact of El Niňo event on trophic niches of closely related Ommastrephinae species,Dosidicus gigas and Sthenoteuthis oualaniensis[J].Marine Fisheries,2020,42(5):524-532.(in Chinese)
[2] 王尧耕,陈新军.世界大洋性经济柔鱼类资源及其渔业[M].北京:海洋出版社,2005:60-66. WANG Y G,CHEN X J.World oceanic economic soft fish resources and their fisheries[M].Beijing:Ocean Press,2005:60-66.(in Chinese)
[3] NIGMATULLIN C M,NESIS K N,ARKHIPKIN A I.A review of the biology of the jumbo squid Dosidicus gigas (Cephalopoda:Ommastrephidae)[J].Fisheries Research,2001,54(1):9-19.
[4] 宋立民,于清海,袁立来,等.回捕牙鲆生长和摄食状况调查研究[J].天津农业科学,2019,25(5):33-38. SONG L M,YU Q H,YUAN L L,et al.Growth and feeding status of the captured population of Paralichthys olivaceus[J].Tianjin Agricultural Sciences,2019,25(5):33-38.(in Chinese)
[5] MARKAIDA U.Food and feeding of jumbo squid Dosidicus gigas in the Gulf of California and adjacent waters after the 1997-98 El Niňo event[J].Fisheries Research,2006,79(1/2):16-27.
[6] ALEGRE A,MÉNARD F,TAFUR R,et al.Comprehensive model of jumbo squid Dosidicus gigas trophic ecology in the Northern Humboldt Current System[J].PLoS One,2014,9(1):e85919.
[7] PARDO-GANDARILLAS M C,LOHRMANN K B,GEORGE-NASCIMENTO M,et al.Diet and parasites of the jumbo squid Dosidicus gigas in the Humboldt Current System[J].Molluscan Research,2014,34(1):10-19.
[8] LERAY M,YANG J Y,MEYER C P,et al.A new versatile primer set targeting a short fragment of the mitochondrial COI region for metabarcoding metazoan diversity:application for characterizing coral reef fish gut contents[J].Frontiers in Zoology,2013,10:34.
[9] 刘梦娜,徐磊,王雪辉,等.基于DNA条形码研究中国枪乌贼和鸢乌贼的食物种类组成[J].热带海洋学报,2020,39(4):61-69. LIU M N,XU L,WANG X H,et al.Study on food contents of Uroteuthis chinensis and Sthenoteuthis oualaniensis based on COI sequence[J].Journal of Tropical Oceanography,2020,39(4):61-69.(in Chinese)
[10] 洪巧巧,庄平,杨刚,等.长江口中国花鲈食性分析[J].生态学报,2012,32(13):4181-4190. HONG Q Q,ZHUANG P,YANG G,et al.Feeding habits of Lateolabrax maculatus in Yangtze River Estuary[J].Acta Ecologica Sinica,2012,32(13):4181-4190.(in Chinese)
[11] 李云凯,冯丹,高小迪,等.东太平洋赤道海域鸢乌贼(Sthenoteuthis oualaniensis)和茎柔鱼(Dosidicus gigas)的食性比较研究[J].海洋与湖沼,2021,52(5):1303-1314. LI Y K,FENG D,GAO X D,et al.Comparative study on the feeding habits of Sthenoteuthis oualaniensis and Dosidicus gigas in the eastern equatorial Pacific Ocean[J].Oceanologia et Limnologia Sinica,2021,52(5):1303-1314.(in Chinese)
[12] FIELD J C,ELLIGER C,BALTZ K,et al.Foraging ecology and movement patterns of jumbo squid (Dosidicus gigas) in the California Current System[J].Deep Sea Research Part II:Topical Studies in Oceanography,2013,95:37-51.
[13] 邓红.高通量测序和qRT-PCR研究何首乌肝损伤大鼠肠道菌群的变化[D].广州:广东药科大学,2017. DENG H.Study on gut microbiota changes in polygonum multiflorum thunb induced liver injury rats by high-throughput sequencing and real-time quantitative PCR[D].Guangzhou:Guangdong Pharmaceutical University,2017.(in Chinese)
[14] 张元,童春富.长江口盐沼湿地无齿螳臂相手蟹(Chiromantes dehaani)胃含物特征与取食偏好[J].生态学杂志,2018,37(7):2059-2066. ZHANG Y,TONG C F.Stomach content characteristics and feeding preference of Chiromantes dehaani in the salt marsh of Yangtze Estuary[J].Chinese Journal of Ecology,2018,37(7):2059-2066.(in Chinese)
[15] 薛莹,金显仕.鱼类食性和食物网研究评述[J].海洋水产研究,2003,24(2):76-87. XUE Y,JIN X S.Review of the study on feeding habits of fishes and food webs[J].Marine Fisheries Research,2003,24(2):76-87.(in Chinese)
[16] IB
 EZ C M,RIERA R,LEITE T,et al.Stomach content analysis in cephalopods:past research,current challenges,and future directions[J].Reviews in Fish Biology and Fisheries,2021,31(3):505-522.
EZ C M,RIERA R,LEITE T,et al.Stomach content analysis in cephalopods:past research,current challenges,and future directions[J].Reviews in Fish Biology and Fisheries,2021,31(3):505-522.
[17] PORTNER E J,MARKAIDA U,ROBINSON C J,et al.Trophic ecology of humboldt squid,Dosidicus gigas,in conjunction with body size and climatic variability in the Gulf of California,Mexico[J].Limnology and Oceanography,2020,65(4):732-748.
[18] MARKAIDA U,GILLY W F,SALINAS-ZAVALA C A,et al.Food and feeding of jumbo squid Dosidicus gigas in the central Gulf of California during 2005-2007[J].California Cooperative Oceanic Fisheries Investigations Reports,2008,49(1):90-103.
[19] MARKAIDA U,SOSA-NISHIZAKI O.Food and feeding habits of jumbo squid Dosidicus gigas (Cephalopoda:Ommastrephidae) from the Gulf of California,Mexico[J].Journal of the Marine Biological Association of the United Kingdom,2003,83(3):507-522.
[20] ROSAS-LUIS R,TAFUR-JIMENEZ R,ALEGRE-NORZA A R,et al.Trophic relationships between the jumbo squid (Dosidicus gigas) and the lightfish (Vinciguerria lucetia) in the Humboldt Current System off Peru[J].Scientia Marina,2011,75:549-557.
[21] MARCO Q M,GUZM N-RIVAS FABI
N-RIVAS FABI N A,IB
N A,IB
 EZ CHRISTIAN M,et al.Trophodynamics of the jumbo squid Dosidicus gigas during winter in the Southeast Pacific Ocean off the Coast of Chile:diet analyses and fatty acid profile[J].Fisheries Research,2022,245:106154.
EZ CHRISTIAN M,et al.Trophodynamics of the jumbo squid Dosidicus gigas during winter in the Southeast Pacific Ocean off the Coast of Chile:diet analyses and fatty acid profile[J].Fisheries Research,2022,245:106154.
[22] BRUNO C,CORNEJO C F,RIERA R,et al.What is on the menu?Feeding,consumption and cannibalism in exploited stocks of the jumbo squid Dosidicus gigas in south-central Chile[J].Fisheries Research,2021,233:105722.
[23] CONTRERAS T,OLIVAR M P,HULLEY P A,et al.Feeding ecology of early life stages of mesopelagic fishes in the equatorial and tropical Atlantic[J].ICES Journal of Marine Science,2019,76(3):673-689.
[24] IBARRA-GARC A L E,CAMARILLO-COOP S,SALINAS-ZAVALA C.Cannibalism assessment of jumbo squid Dosidicus gigas from the Gulf of California[J].Hydrobiologica,2014,24:51-56.
A L E,CAMARILLO-COOP S,SALINAS-ZAVALA C.Cannibalism assessment of jumbo squid Dosidicus gigas from the Gulf of California[J].Hydrobiologica,2014,24:51-56.
[25] 席晓晴,鲍宝龙,章守宇.DNA条形码在鱼类胃含物种类鉴定中的应用[J].上海海洋大学学报,2015,24(2):203-210. XI X Q,BAO B L,ZHANG S Y.Application of DNA barcoding in species analysis of fish stomach content[J].Journal of Shanghai Ocean University,2015,24(2):203-210.(in Chinese)
[26] 席晓晴,鲍宝龙,章守宇.DNA条形码在马鞍列岛海域皮氏叫姑鱼胃含物鉴定中的应用[J].水产学报,2017,41(10):1533-1541. XI X Q,BAO B L,ZHANG S Y.Application of DNA barcoding in analyzing food composition of Belanger’s croaker(Johnius belangerii) in Ma’an Archipelago[J].Journal of Fisheries of China,2017,41(10):1533-1541.(in Chinese)
[27] 陈新军.渔业资源与渔场学[M].北京:海洋出版社,2004:383-389. CHEN X J.Fishery resources and fishery science[M].Beijing:Ocean Press,2004:383-389.(in Chinese)
[28] SANCHEZ-VELASCO L,BEIER E,GODINEZ V M,et al.Hydrographic and fish larvae distribution during the “Godzilla El Nião 2015-2016” in the northern end of the shallow oxygen minimum zone of the Eastern Tropical Pacific Ocean[J].Journal of Geophysical Research Oceans,2017,122(3):2156-2170.
Comparison of feeding habits of jumbo flying squid (Dosidicus gigas) under different climate conditions in the eastern equatorial Pacific Ocean
ZHU Ting1,GONG Yi1,2,3,4,LI Yunkai1,2,3,4*,GAO Xiaodi5,ZHANG Jiaxu1
(1.College of Marine Living Resources and Management,Shanghai Ocean University,Shanghai 201306,China;2.Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources,Ministry of Education,Shanghai 201306,China;3.National Engineering Research Center for Oceanic Fisheries,Shanghai 201306,China;4.Key Laboratory of Oceanic Fisheries Exploration,Ministry of Agriculture and Rural Affairs,Shanghai 201306,China;5.East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Shanghai 200090,China)
Abstract: In order to comprehend the potential effects of abnormal climate changes on feeding behavior of jumbo flying squid, Dosidicus gigas, items and amounts of stomach content were determined in jumbo flying squid D.gigas collected in June and July of 2017 Normal period and July and August of 2020 La Ni a period in the eastern equatorial Pacific Ocean by morphological methods and DNA barcoding technology. The results showed that Vinciguerria lucetia, Diogenichthys laternatus, Pteropods and Cephalopods were the main dominant preys of jumbo flying squid in the two climate modes. During the normal climatic period, Sternoptyx diaphana and Dosinia spp. were also consumed by jumbo flying squid, while during the La Ni
a period in the eastern equatorial Pacific Ocean by morphological methods and DNA barcoding technology. The results showed that Vinciguerria lucetia, Diogenichthys laternatus, Pteropods and Cephalopods were the main dominant preys of jumbo flying squid in the two climate modes. During the normal climatic period, Sternoptyx diaphana and Dosinia spp. were also consumed by jumbo flying squid, while during the La Ni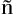 a period, Triphoturus mexicanus and Clio pyramidata were included. The Amundsen’s Diagram revealed that the jumbo flying squid has extensive feeding, exhibiting a high within-phenotype component (WPC) type. The Shannon diversity index indicated a higher diversity level in the diet composition of jumbo flying squid during Normal period compared to the La Ni
a period, Triphoturus mexicanus and Clio pyramidata were included. The Amundsen’s Diagram revealed that the jumbo flying squid has extensive feeding, exhibiting a high within-phenotype component (WPC) type. The Shannon diversity index indicated a higher diversity level in the diet composition of jumbo flying squid during Normal period compared to the La Ni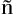 a period. Non-Metric Multidimensional Scale (NMDS) analysis indicated the significant differences in the feeding habits of jumbo flying squid between the two periods and the preys in La Ni
a period. Non-Metric Multidimensional Scale (NMDS) analysis indicated the significant differences in the feeding habits of jumbo flying squid between the two periods and the preys in La Ni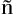 a period were more generalized. The GII chord diagram and SIMPER similarity results highlighted the S.diaphana and Dosinia spp. as the main contributors to the feeding differences under different climate modes. The significance of constructing a detailed food web was emphasized in the eastern equatorial Pacific Ocean and significance of investigating its energy flow pathway. The findings highlighted that La Ni
a period were more generalized. The GII chord diagram and SIMPER similarity results highlighted the S.diaphana and Dosinia spp. as the main contributors to the feeding differences under different climate modes. The significance of constructing a detailed food web was emphasized in the eastern equatorial Pacific Ocean and significance of investigating its energy flow pathway. The findings highlighted that La Ni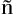 a event can significantly impact the feeding behavior of feeding habits of jumbo flying squid under different climate change.
a event can significantly impact the feeding behavior of feeding habits of jumbo flying squid under different climate change.
Key words: Dosidicus gigas; stomach content analysis; DNA barcoding; climate variability
 a事件发生时期)下的茎柔鱼饵料组成进行比较分析。结果表明:两种模态下,荧串光鱼(Vinciguerria lucetia)、朗明灯鱼(Diogenichthys laternatus)、翼足目(Pteropoda)和头足类是茎柔鱼的优势饵料生物,茎柔鱼在正常气候时期,还摄食褶胸鱼(Sternoptyx diaphana)和镜蛤属(Dosinia sp.),而在La Ni
a事件发生时期)下的茎柔鱼饵料组成进行比较分析。结果表明:两种模态下,荧串光鱼(Vinciguerria lucetia)、朗明灯鱼(Diogenichthys laternatus)、翼足目(Pteropoda)和头足类是茎柔鱼的优势饵料生物,茎柔鱼在正常气候时期,还摄食褶胸鱼(Sternoptyx diaphana)和镜蛤属(Dosinia sp.),而在La Ni a发生时期则会摄食墨西哥尾灯鱼(Triphoturus mexicanus)和尖菱蝶螺(Clio pyramidata);Amundsen图示法发现,茎柔鱼会摄食一些稀有饵料,属于高表型内贡献类型,是广食性鱼类;Shannon多样性指数分析显示,正常时期茎柔鱼的饵料组成多样性显著高于La Ni
a发生时期则会摄食墨西哥尾灯鱼(Triphoturus mexicanus)和尖菱蝶螺(Clio pyramidata);Amundsen图示法发现,茎柔鱼会摄食一些稀有饵料,属于高表型内贡献类型,是广食性鱼类;Shannon多样性指数分析显示,正常时期茎柔鱼的饵料组成多样性显著高于La Ni a发生时期;NMDS分析显示,两个时期茎柔鱼存在一定食性分化,而La Ni
a发生时期;NMDS分析显示,两个时期茎柔鱼存在一定食性分化,而La Ni a发生时期茎柔鱼个体间食性差异更大;GII弦图及SIMPER相似性分析显示,不同气候模态下茎柔鱼的饵料差异主要体现在褶胸鱼和镜蛤属。研究表明,La Ni
a发生时期茎柔鱼个体间食性差异更大;GII弦图及SIMPER相似性分析显示,不同气候模态下茎柔鱼的饵料差异主要体现在褶胸鱼和镜蛤属。研究表明,La Ni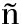 a事件对茎柔鱼的摄食产生了显著影响。
a事件对茎柔鱼的摄食产生了显著影响。 a)事件发生时期茎柔鱼的饵料生物组成进行了比较,以期为深入了解气候变化对茎柔鱼食性的潜在影响提供科学依据。
a)事件发生时期茎柔鱼的饵料生物组成进行了比较,以期为深入了解气候变化对茎柔鱼食性的潜在影响提供科学依据。





 EZ C M,RIERA R,LEITE T,et al.Stomach content analysis in cephalopods:past research,current challenges,and future directions[J].Reviews in Fish Biology and Fisheries,2021,31(3):505-522.
EZ C M,RIERA R,LEITE T,et al.Stomach content analysis in cephalopods:past research,current challenges,and future directions[J].Reviews in Fish Biology and Fisheries,2021,31(3):505-522. A L E,CAMARILLO-COOP S,SALINAS-ZAVALA C.Cannibalism assessment of jumbo squid
A L E,CAMARILLO-COOP S,SALINAS-ZAVALA C.Cannibalism assessment of jumbo squid  a period in the eastern equatorial Pacific Ocean by morphological methods and DNA barcoding technology. The results showed that
a period in the eastern equatorial Pacific Ocean by morphological methods and DNA barcoding technology. The results showed that