池塘养殖是中国水产养殖的主要生产方式之一。随着集约化养殖模式的深入推广,池塘养殖水体富营养化现象日趋严重,蓝藻水华频繁暴发,已成为制约淡水池塘养殖业健康发展的重要因素[1]。蓝藻水华在生长和消亡过程中释放的藻毒素会对养殖动物造成较严重和直接的危害,其中,以微囊藻毒素(MCs)危害最大[2]。自然水体中MCs质量浓度为1~80 μg/L[3],而某些养殖池塘可达2.5 mg/L[4]。因此,在生产过程中利用有效途径减少池塘养殖水体中MCs浓度,降低其危害已迫在眉睫。
自然环境中MCs降解主要依赖于微生物降解和光化学降解两种途径[5-6],其中,光化学降解包括直接光降解和间接光降解两种方式。MCs不仅可以在紫外光下发生直接光降解[7],还会在光敏剂作用下发生间接光降解[8-9]。溶解性有机质(DOM)是自然水体中普遍存在着的一类光敏性物质,主要由富里酸、腐殖酸、低分子量有机酸和碳水化合物等组成[10]。作为MCs间接光降解的重要参与者,DOM在自然水体MCs光降解中发挥着重要作用。在太阳光照射下DOM形成激发三重态(3DOM*),通过能量传递间接降解MCs[11],还可吸收太阳光产生多种活性氧(ROS),如单线态氧(1O2)、羟基自由基(·OH)、超氧阴离子![]() 和过氧化氢(H2O2),这些活性氧物质可以与MCs发生氧化反应,促进MCs的光降解[9]。
和过氧化氢(H2O2),这些活性氧物质可以与MCs发生氧化反应,促进MCs的光降解[9]。
自然水体中DOM的含量一般低于10 mg/L(以C计)[12]。除了陆源性DOM经风、降雨和地表径流进入外[13],自然水体中DOM主要来自浮游植物代谢和死亡后的残骸[14-15]。在养殖池塘中,养殖动物排泄物、残饵及施入的有机肥也是内源性DOM的重要来源[16]。池塘养殖水环境复杂,水体pH、光照条件等因素都会对水中MCs的降解产生一定影响。
MCs具有200种以上异构体,微囊藻毒素-LR(MC-LR)是淡水养殖池塘中最常见、急性毒性最强的异构体[17]。本研究中,选择DOM的主要光敏活性组分富里酸(FA)作为光敏剂,在模拟太阳光照射下,对比了不同浓度FA溶液中MC-LR的光降解规律和光降解产物,并探究了不同pH、光照度对FA光降解MC-LR的影响,以期为养殖池塘MCs污染控制提供科学参考。
试验试剂:MC-LR标样,美国苏望尼河富里酸标样(FA Standard Ⅱ),甲醇、三氟乙酸和乙腈为色谱纯,H2SO4、NaOH均为分析纯,试验用水为去离子水。
试验仪器:Agilent 1260型高效液相色谱仪(美国Agilent公司),Agilent 1290 Infinity Ⅱ-6545液质联用仪(美国Agilent公司),长弧氙灯(上海季光特种照明电器厂),磁力搅拌器(天津科诺仪器设备有限公司)。
1.2.1 MC-LR在不同浓度FA溶液中的光降解试验 光降解试验以500 W长弧氙灯模拟太阳光作为光源,固定氙灯于玻璃冷阱中央,以保证四周光源的均匀性。通过循环冷凝装置保持试验过程中温度恒定。分别向5个10 mL容量瓶中加入1 mL质量浓度为10 mg/L的MC-LR储备液,再分别加入0、0.25、0.50、0.75、1.00 mL 质量浓度为100 mg/L的FA储备液,加去离子水定容至10 mL,并用体积分数为1%的H2SO4和浓度为0.1 mol/L的 NaOH分别调节pH至7。反应体系中MC-LR终质量浓度为1 mg/L,FA终质量浓度分别为0、2.5、5.0、7.5、10.0 mg/L。
先将样品置于磁力搅拌器上在避光条件下进行暗反应,10 h后立即将样品置于500 W氙灯下进行光反应,光源打开的瞬间记为0 min。在整个暗反应和光反应期间磁力搅拌器均处于持续工作状态,分别在0、10、20、60、120、180 min时取样。采用高效液相色谱仪测定MC-LR浓度,采用液质联用仪检测MC-LR的光降解产物。
1.2.2 不同环境条件下MC-LR的光降解试验
1)不同pH下MC-LR在FA溶液中的光降解试验。反应体系中MC-LR终质量浓度为1 mg/L,FA终质量浓度为7.5 mg/L,调节反应体系pH,使pH分别为6、7、8、9。光反应及暗反应条件同“1.2.1节”,分别于0、10、20、60、120、180 min时取样并测定MC-LR含量。
2)不同光照度下MC-LR在FA溶液中的光降解试验。反应体系中MC-LR终质量浓度为1 mg/L,FA终质量浓度为7.5 mg/L,光照度分别设置为0、22.8、39.8、56.9 μmol/(s·m2)。光反应及暗反应条件同“1.2.1节”,分别于0、10、20、60、120、180 min时取样并测定MC-LR含量。
1.2.3 检测方法
液相色谱检测方法:SB-C18柱(4.6 mm×150 mm×5 μm),流动相为0.05%三氟乙酸+甲醇(二者体积比为40∶60),流速为0.8 mL/min,检测波长为238 nm,进样量为10 μL,柱温为40 ℃。
液质联用检测方法:色谱柱为SB-C18柱(4.6 mm×150 mm×5 μm),流动相A为水,流动相B为乙腈,流速为0.3 mL/min,进样量为2 μL,柱温为40 ℃;电离源为ESI,检测模式为正模式检测,分子量扫描范围为105~1 200。
1.2.4 反应动力学方程 MC-LR的光催化降解率方程为
v=(1-C/C0)×100%。
(1)
式中:v为MC-LR的降解率(%);C、C0分别为反应t时刻及初始时刻MC-LR的质量浓度(mg/L)。
对MC-LR的光降解过程进行动力学[18]拟合:
一级反应动力学方程为
-ln(C/C0)=k1t。
(2)
二级反应动力学方程为
1/C-1/C0=k2t。
(3)
式中:t为光反应时间(min);k1为一级反应动力学常数;k2为二级反应动力学常数。
FA在MC-LR的光降解过程中会产生光屏蔽作用,且其广泛分布在天然水体中,因此,在分析FA对MC-LR的光降解影响时应建立在扣除光屏蔽作用的基础上进行,根据MC-LR和FA的吸光度及光源条件计算,对表观速率常数进行光屏蔽校正[19-20]:
(4)
kFA=kobs(FA)-kobs(no-FA)×Sλ。
(5)
式中:kFA为扣除光屏蔽作用后的表观速率常数(min-1);Sλ为光屏蔽系数;ελ为MC-LR的摩尔吸光系数[L/(mol·cm)];αλ为FA的消光系数(cm-1);L为光程(cm);CMC-LR为MC-LR的浓度(mol/L);kobs(no-FA)为MC-LR在去离子水中的表观速率常数(min-1);kobs(FA)为MC-LR在FA存在条件下的表观速率常数(min-1)。
采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),显著性水平设为0.05。
2.1.1 降解率 从图1可见:去离子水中MC-LR在光照初期降解较快,光照10 min时MC-LR降解率可达23.42%,随后降解速度下降,光照180 min时MC-LR降解率为42.91%,表明MC-LR在去离子水中发生了直接光降解反应;在去离子水中添加FA后,前10 min各试验组间降解效果无显著性差异(P>0.05),随着降解时间的延长,60~180 min时各FA添加组MC-LR降解率均显著高于去离子水组(P<0.05),且在相同降解时间下,MC-LR降解率随着FA浓度的升高呈先升高后下降趋势,其中,7.5 mg/L FA对MC-LR的光降解作用最强,且在光照180 min时MC-LR降解率达到最高(52.65%)。
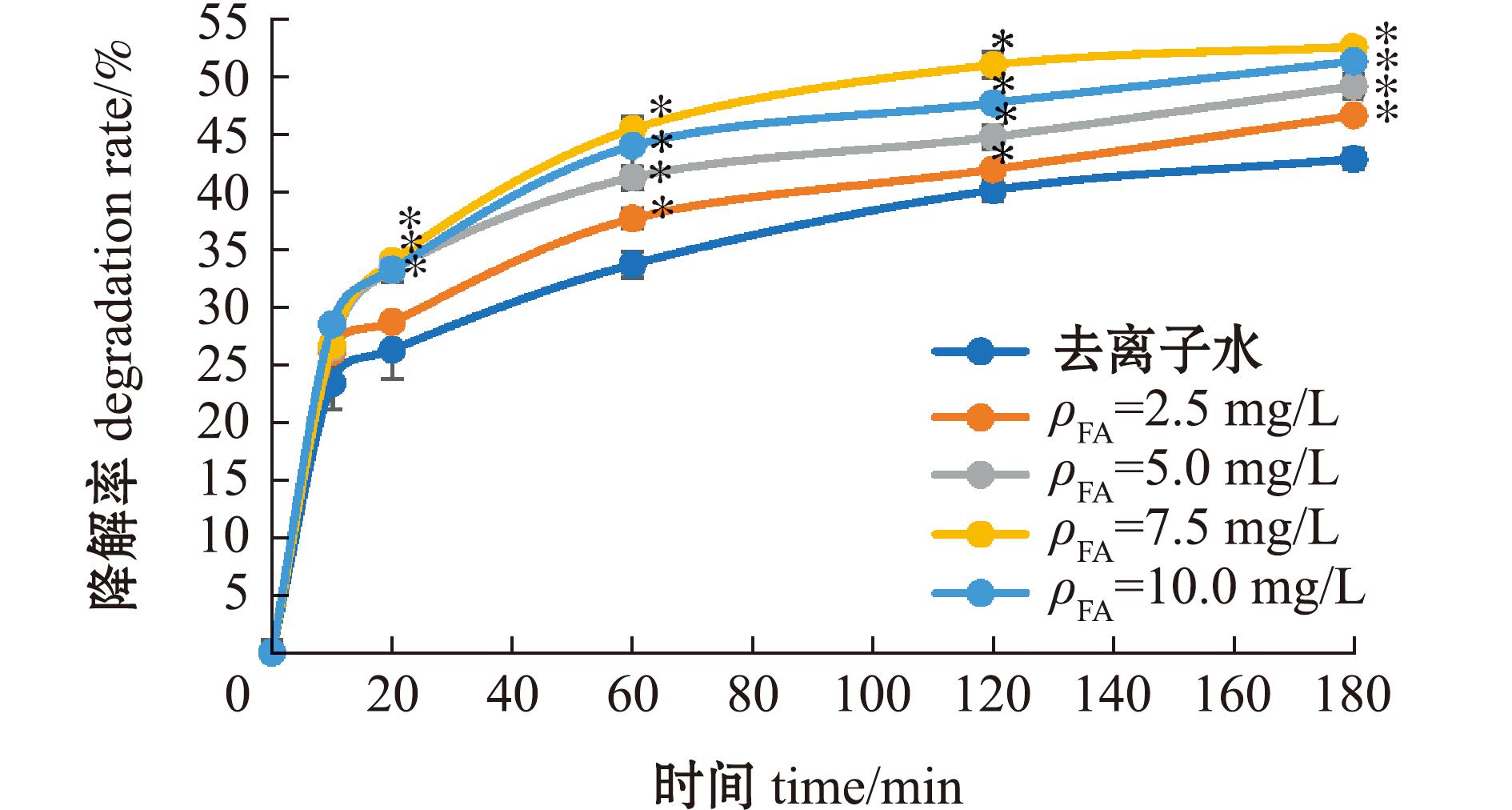
*表示相同时间点FA添加组与去离子水组间有显著性差异(P<0.05)。
*means significant difference between the FA addition group and the deionized water group at the same time point(P<0.05).
图1 MC-LR在不同浓度FA溶液中的降解率
Fig.1 Degradation rate of MC-LR in different concentrations of FA solutions
2.1.2 反应动力学方程 MC-LR的光降解动力学过程复杂,分别采用一级反应动力学和二级反应动力学方程进行拟合,结果见图2,相关光降解动力学参数见表1。MC-LR在去离子水中直接光降解的一级动力学拟合相关性R2=0.735 1,二级动力学拟合相关性R2=0.809 5,表明去离子水中MC-LR直接光降解更符合二级反应动力学方程;MC-LR在FA溶液中的光降解二级动力学拟合相关性R2值均高于一级动力学拟合相关性R2值,表明MC-LR在FA溶液中的光降解过程更符合二级反应动力学方程(表1)。
表1 MC-LR在不同浓度FA溶液中的光降解动力学方程及参数
Tab.1 Kinetic equations and parameters of photodegradation of MC-LR in different concentrations of FA solutions
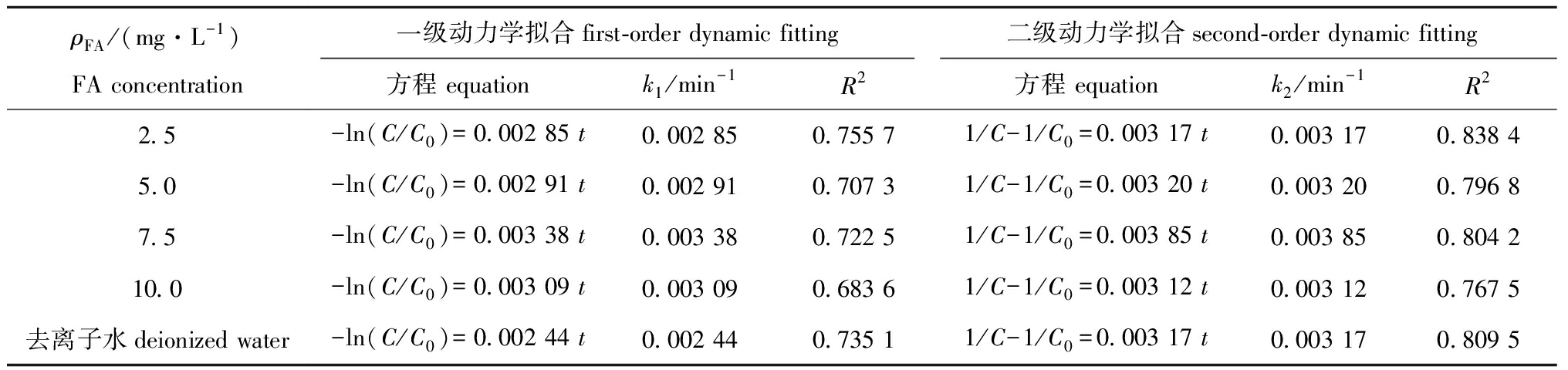
ρFA/(mg·L-1)FA concentration一级动力学拟合first-order dynamic fitting二级动力学拟合second-order dynamic fitting方程 equationk1/min-1R2方程 equationk2/min-1R22.5-ln(C/C0)=0.002 85 t0.002 850.755 71/C-1/C0=0.003 17 t0.003 170.838 45.0-ln(C/C0)=0.002 91 t0.002 910.707 31/C-1/C0=0.003 20 t0.003 200.796 87.5-ln(C/C0)=0.003 38 t0.003 380.722 51/C-1/C0=0.003 85 t0.003 850.804 210.0-ln(C/C0)=0.003 09 t0.003 090.683 61/C-1/C0=0.003 12 t0.003 120.767 5去离子水deionized water-ln(C/C0)=0.002 44 t0.002 440.735 11/C-1/C0=0.003 17 t0.003 170.809 5
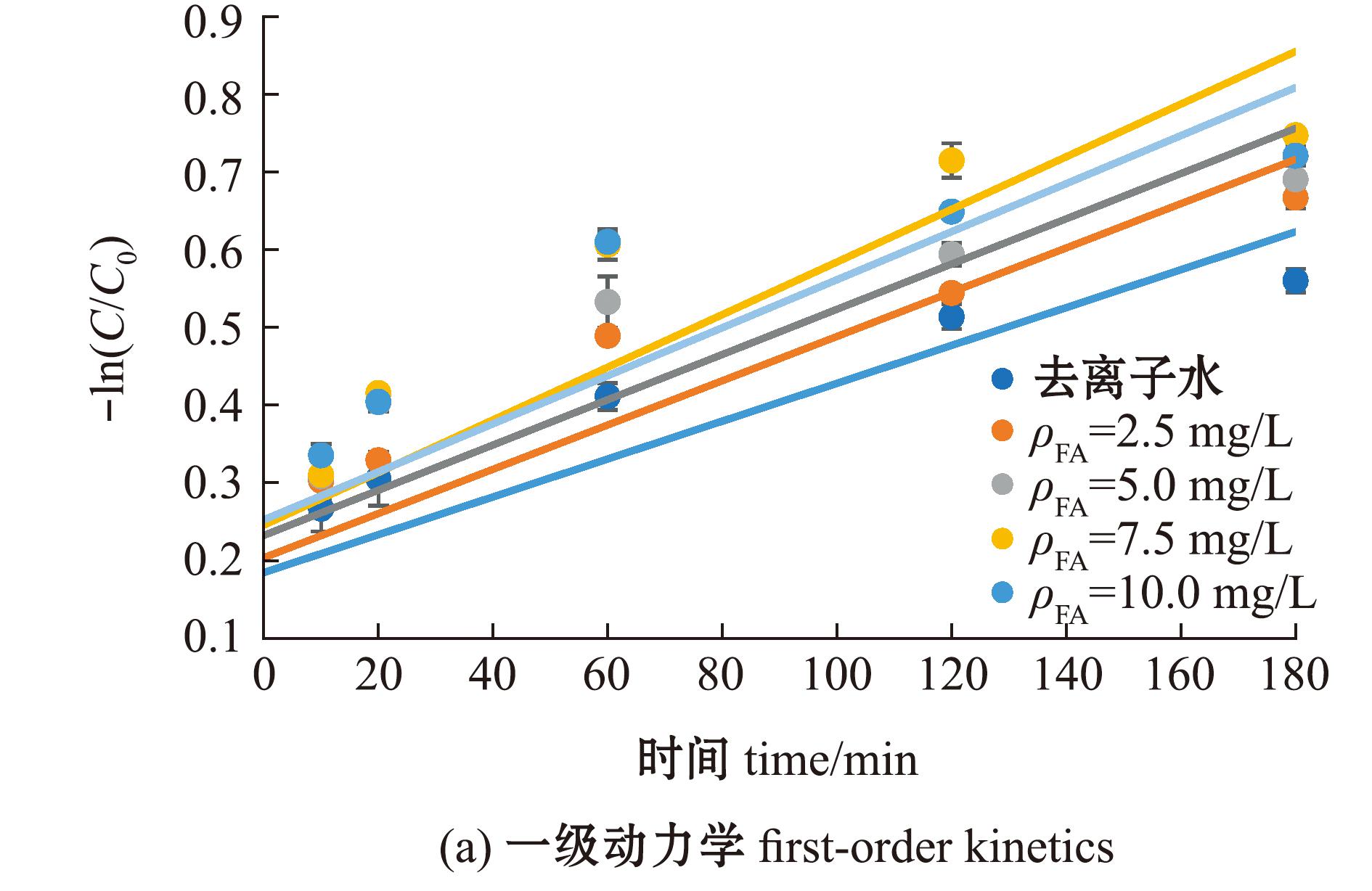
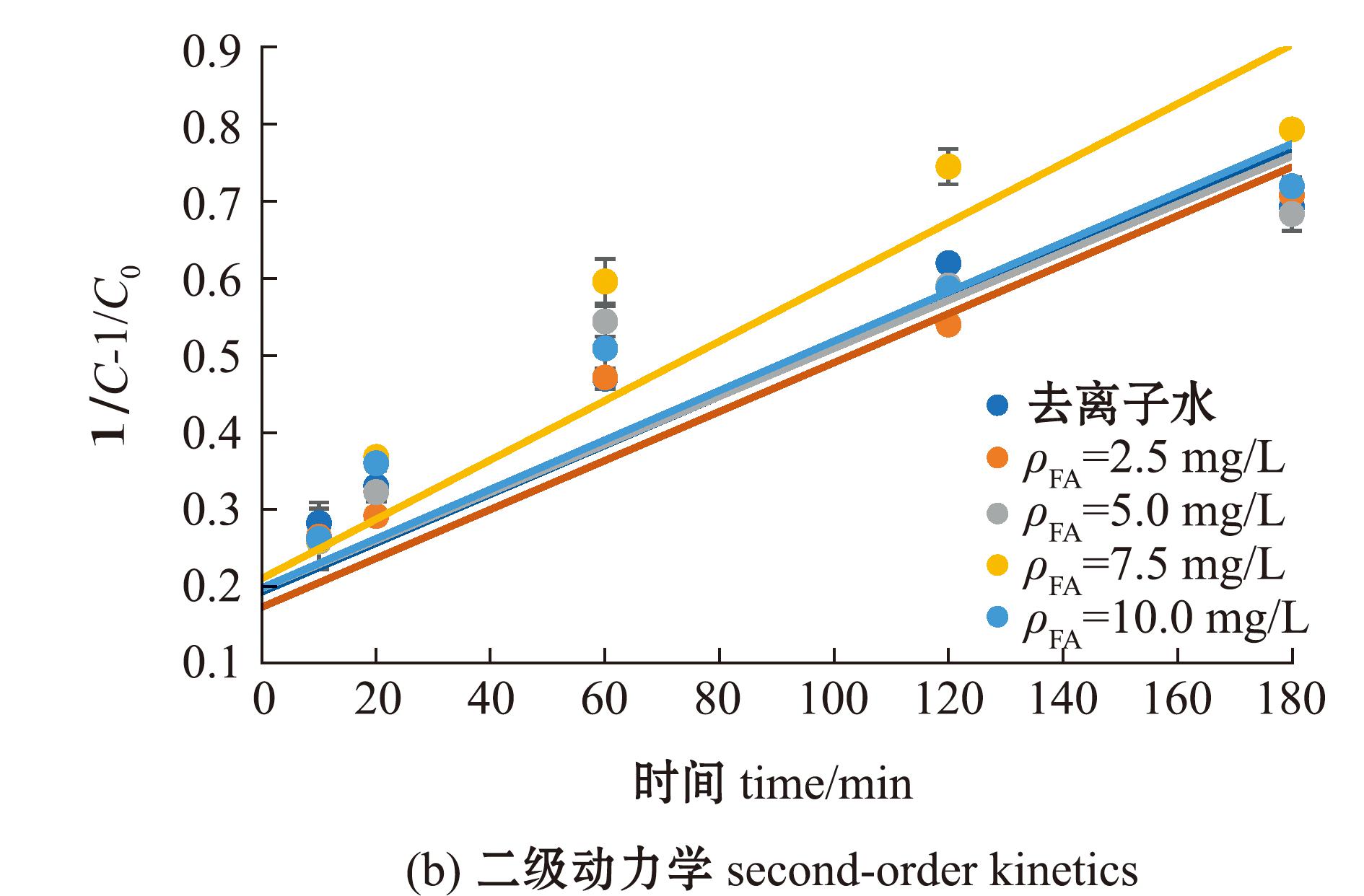
图2 MC-LR在不同浓度FA溶液中的光降解动力学拟合曲线
Fig.2 Fitting curve of photodegradation kinetics for MC-LR in different concentrations of FA solutions
2.1.3 光屏蔽校正 从表2可见:MC-LR在不同浓度FA溶液中的光屏蔽系数(Sλ)越小,光屏蔽作用越强,不同浓度FA的光屏蔽作用表现为10.0 mg/L>7.5 mg/L>5.0 mg/L>2.5 mg/L;通过光屏蔽校正后,MC-LR在不同浓度FA溶液中的表观速率常数(kFA)表现为7.5 mg/L>10.0 mg/L>5.0 mg/L>2.5 mg/L;不同浓度FA的kobs(no-FA)×Sλ均小于kobs(FA),说明通过光屏蔽校正后,不同浓度FA均能促进MC-LR的光降解,促进程度表现为7.5 mg/L>10.0 mg/L>5.0 mg/L>2.5 mg/L。
表2 MC-LR在不同浓度FA溶液中的表观速率常数与光屏蔽系数
Tab.2 Apparent rate constant and light shielding coefficient of MC-LR in different concentrations of FA solutions
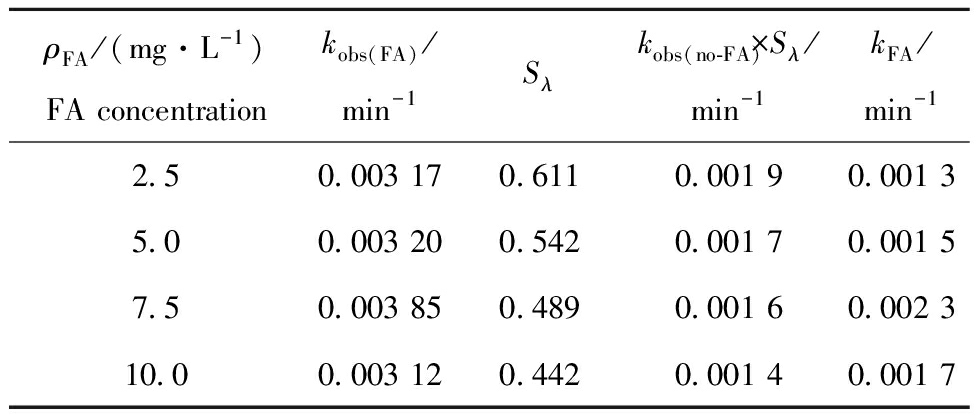
ρFA/(mg·L-1)FA concentrationkobs(FA)/min-1Sλkobs(no-FA)×Sλ/min-1kFA/min-12.50.003 170.6110.001 90.001 35.00.003 200.5420.001 70.001 57.50.003 850.4890.001 60.002 310.00.003 120.4420.001 40.001 7
在7.5 mg/L FA溶液中,MC-LR光降解产物的质荷比(m/z)分别为277.215 6、292.226 7、332.219 0、334.234 9、336.251 8,在去离子水中m/z分别为277.215 9、292.226 7、332.219 2、334.235 0、336.251 7,FA溶液中MC-LR的降解产物与去离子水中的基本相同。根据不同产物的准分子离子峰(M+H)+的m/z数据推断产物结构及可能的降解途径见图3,以上大部分产物中Adda基团的共轭碳双键均被破坏,FA溶液中MC-LR的光降解途径主要通过Adda基团的共轭双键断裂及酰胺键中C-N键的断裂实现。
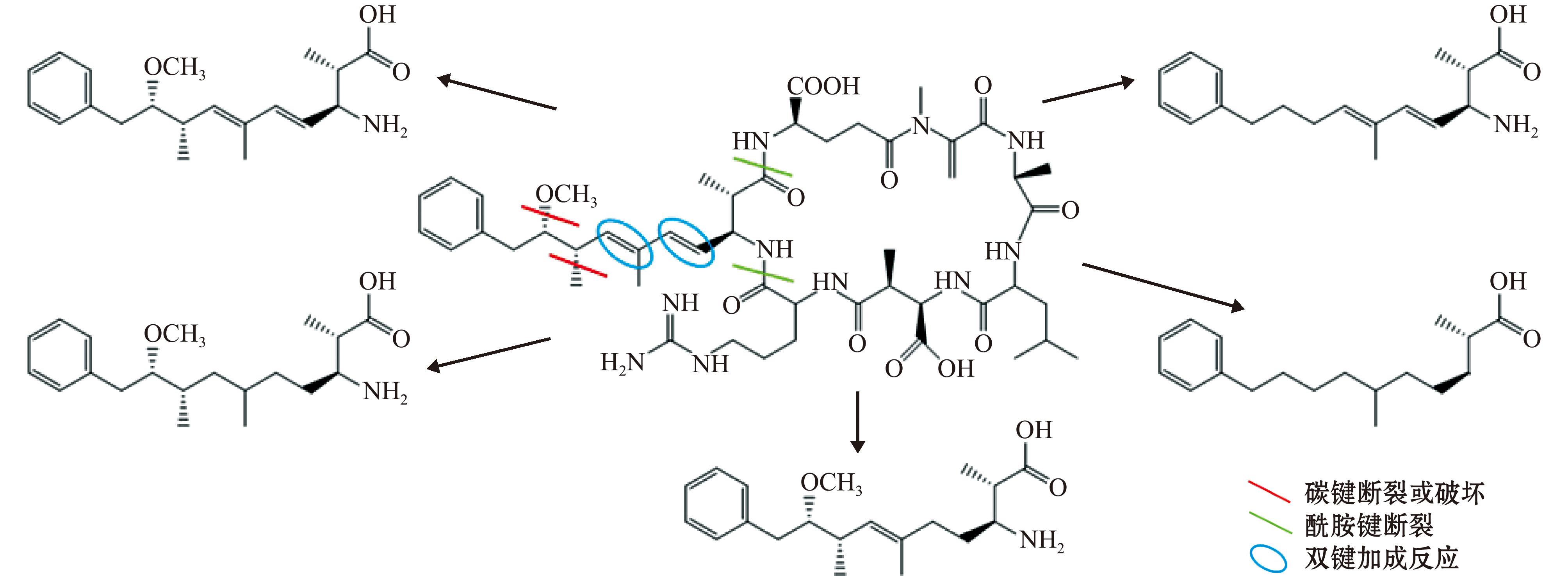
图3 MC-LR在去离子水和7.5 mg/L FA溶液中的光降解产物
Fig.3 Photolysis products of MC-LR in deionized water and 7.5 mg/L FA solution
不同pH的7.5 mg/L FA溶液均对MC-LR具有一定的光降解作用,pH为6时,FA对MC-LR的光降解作用最强(图4)。分别采用一级反应动力学和二级反应动力学方程拟合不同pH下FA对MC-LR的光降解过程(图5),二级动力学拟合相关性R2值均高于一级动力学R2值,表明不同pH下FA对MC-LR的光降解过程更符合二级反应动力学方程(表3)。
表3 不同pH下MC-LR在7.5 mg/L FA溶液中的光降解动力学方程及参数
Tab.3 Photodegradation kinetic equations and parameters of MC-LR in 7.5 mg/L FA solution at different pH values
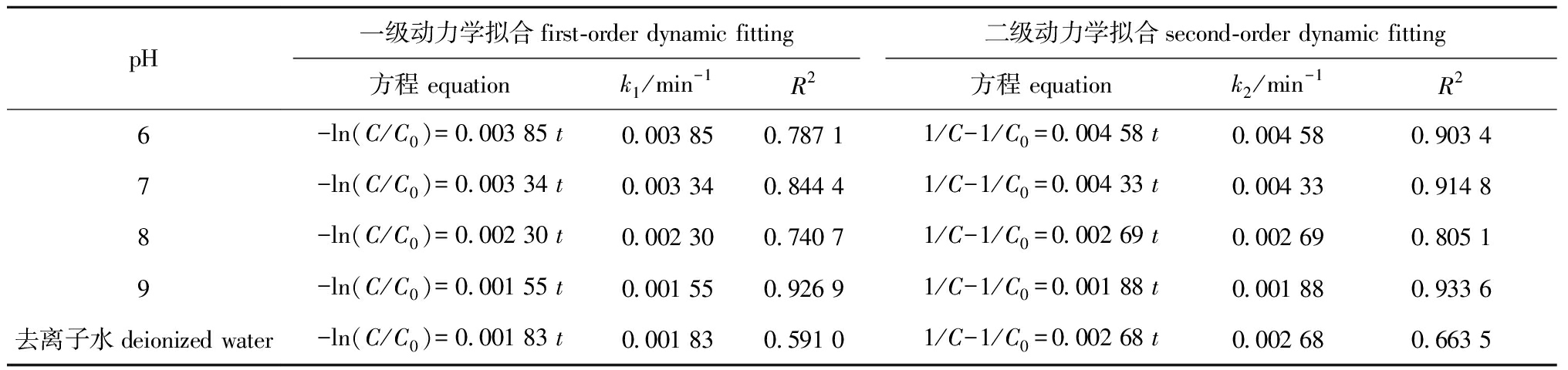
pH一级动力学拟合first-order dynamic fitting二级动力学拟合second-order dynamic fitting方程 equationk1/min-1R2方程 equationk2/min-1R26-ln(C/C0)=0.003 85 t0.003 850.787 11/C-1/C0=0.004 58 t0.004 580.903 47-ln(C/C0)=0.003 34 t0.003 340.844 41/C-1/C0=0.004 33 t0.004 330.914 88-ln(C/C0)=0.002 30 t0.002 300.740 71/C-1/C0=0.002 69 t0.002 690.805 19-ln(C/C0)=0.001 55 t0.001 550.926 91/C-1/C0=0.001 88 t0.001 880.933 6去离子水deionized water-ln(C/C0)=0.001 83 t0.001 830.591 01/C-1/C0=0.002 68 t0.002 680.663 5
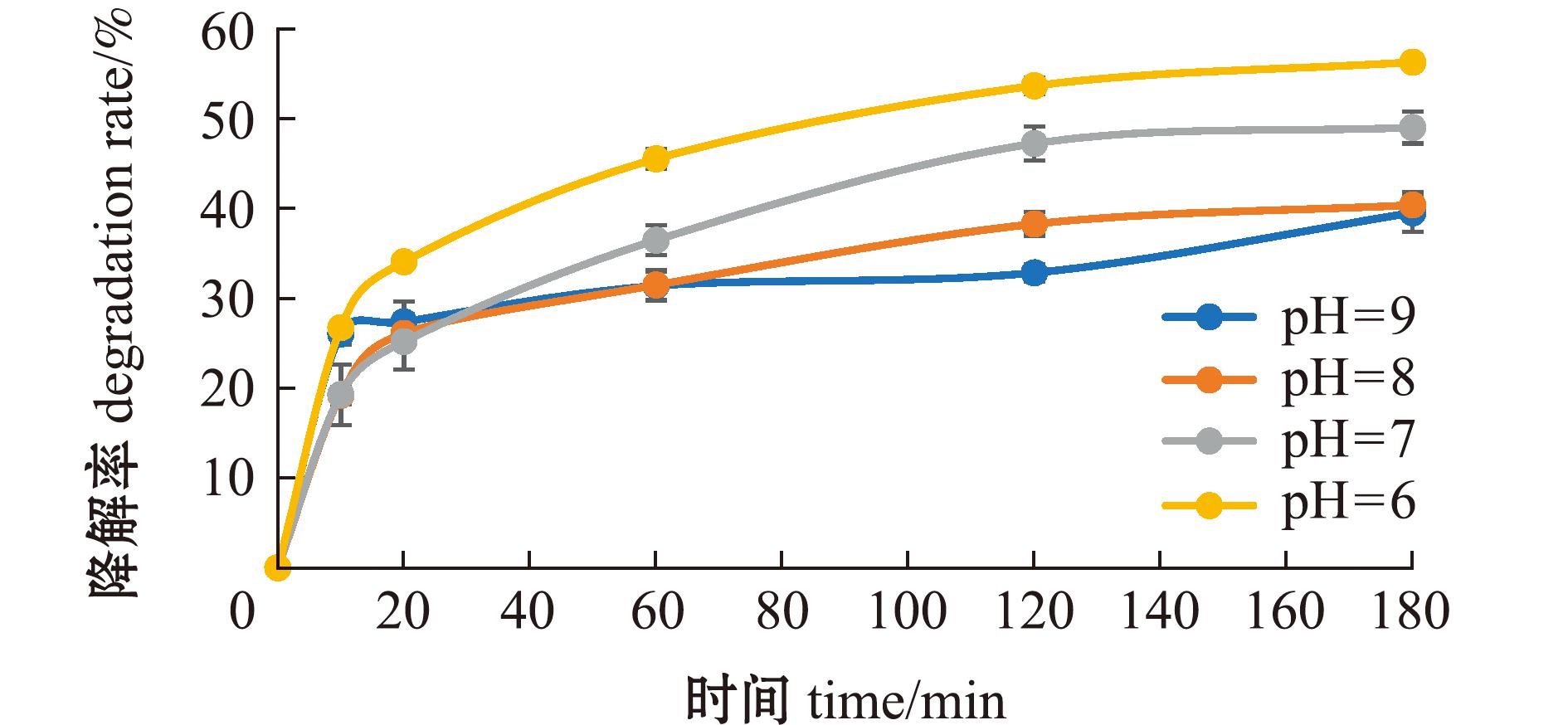
图4 不同pH下MC-LR在7.5 mg/L FA溶液中的降解率
Fig.4 Degradation rate of MC-LR in 7.5 mg/L FA solution at different pH values
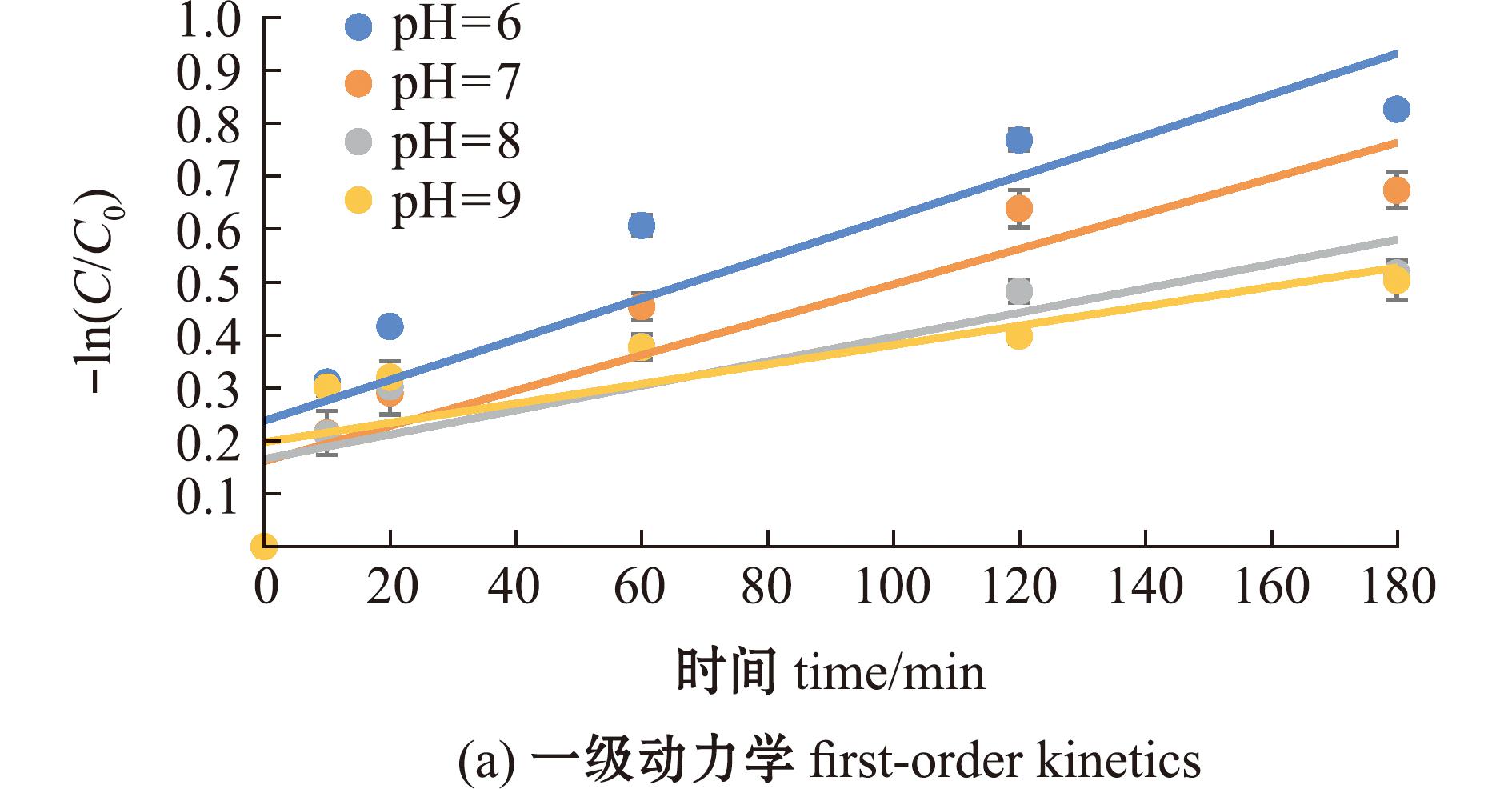
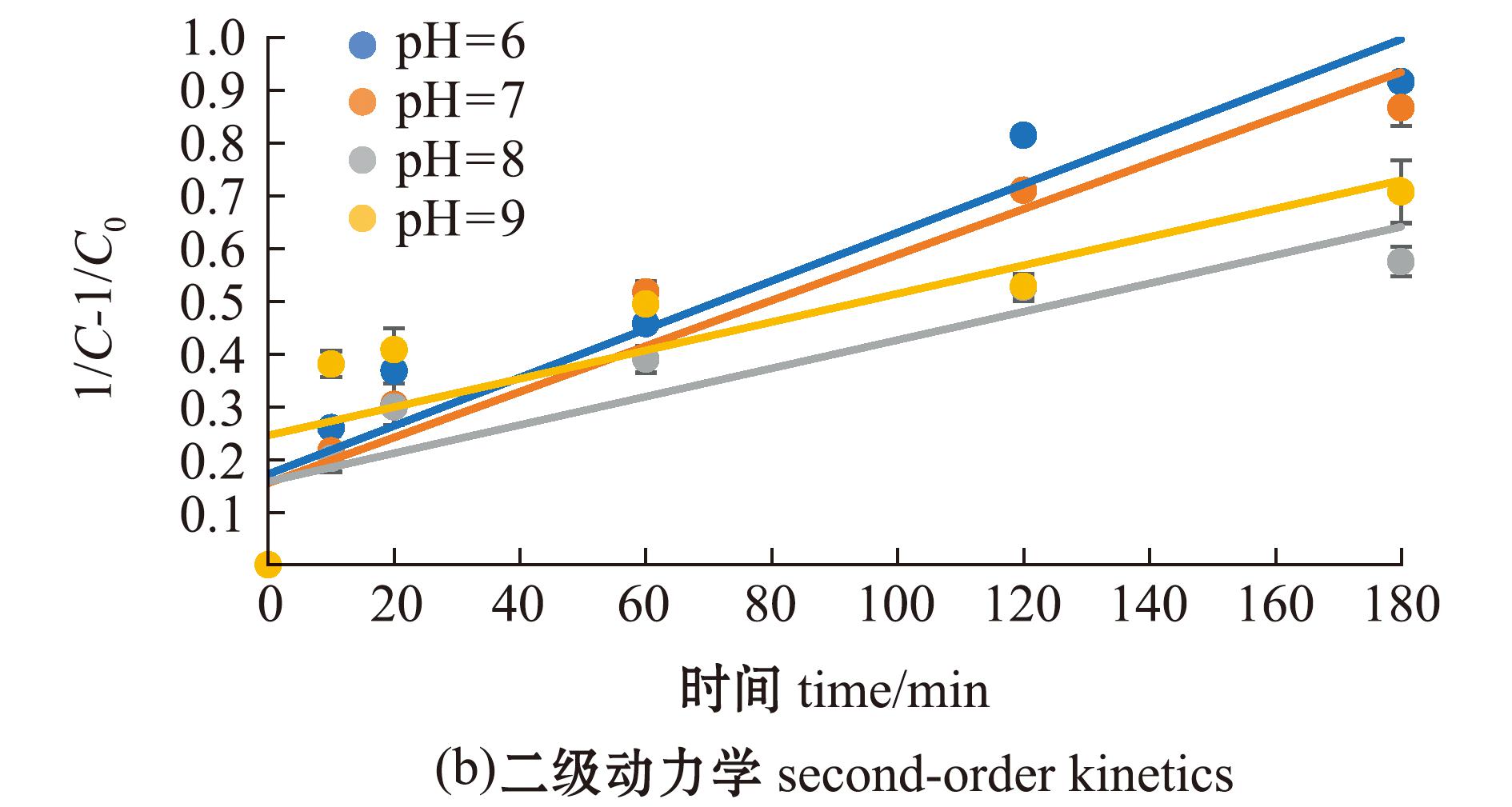
图5 不同pH下MC-LR在7.5 mg/L FA溶液中的光降解动力学方程拟合曲线
Fig.5 Fitting curve of photodegradation kinetic equation for MC-LR in 7.5 mg/L FA solution at different pH values
从图6可见:无光条件下,MC-LR不发生降解反应;有光条件下,7.5 mg/L的FA对MC-LR具有一定的光降解作用,3个光照度下的降解率表现为39.8 μmol/(s·m2)>56.9 μmol/(s·m2)>22.8 μmol/(s·m2)。分别采用一级反应动力学和二级反应动力学方程对不同光照度下MC-LR的光降解过程进行拟合(图7),其中,在56.9、39.8 μmol/(s·m2)光照度下,二级动力学拟合相关性R2值均高于一级动力学,表明在这2个光照条件下,MC-LR光降解过程更符合二级反应动力学方程(表4);而在22.8 μmol/(s·m2)光照度下,一级动力学拟合相关性R2值则高于二级动力学,表明在该光照条件下,MC-LR光降解过程更符合一级反应动力学方程。
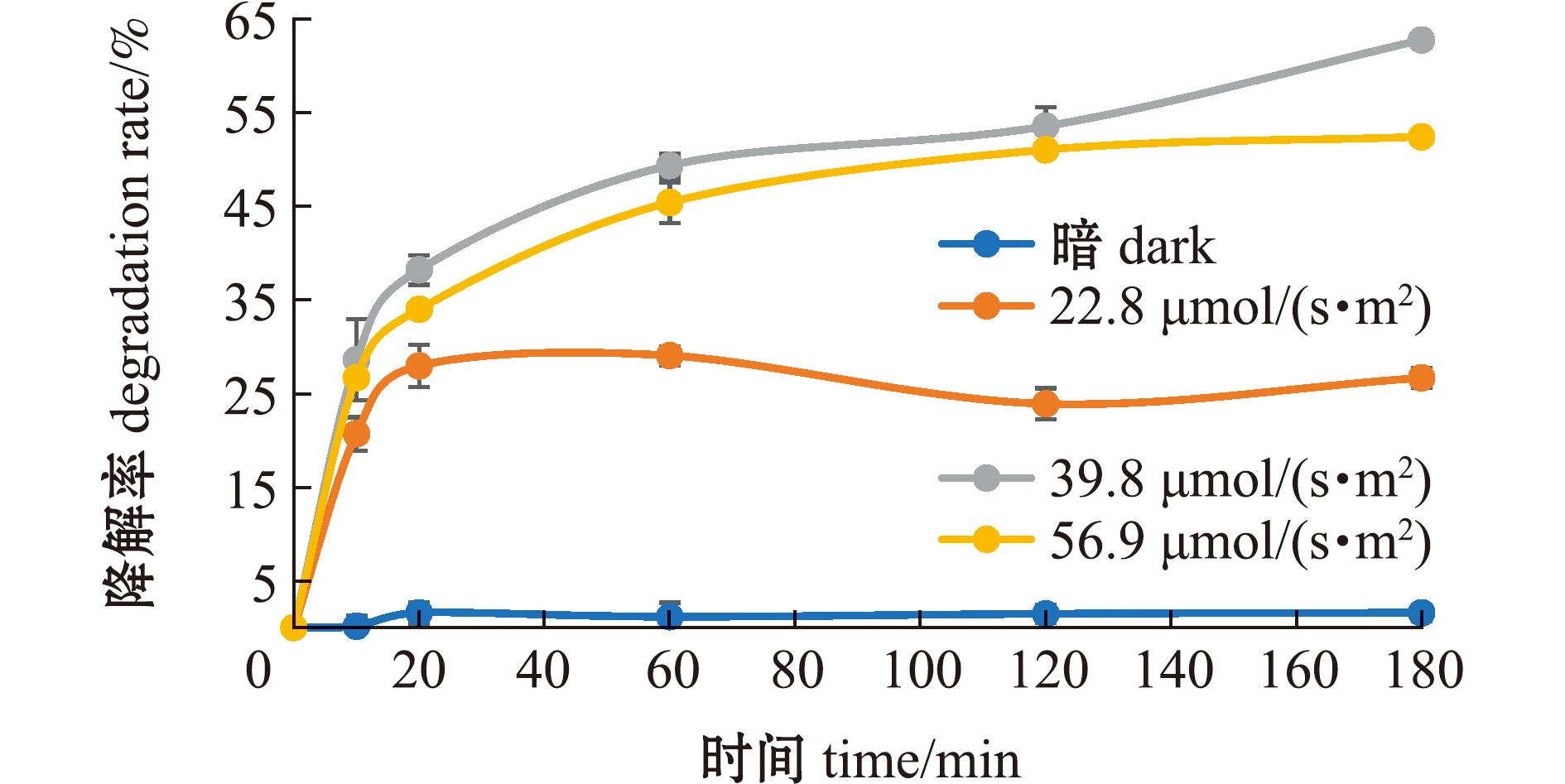
图6 不同光照度下MC-LR在7.5 mg/L FA溶液中的降解率
Fig.6 Degradation rate of MC-LR in 7.5 mg/L FA solution under different light intensities
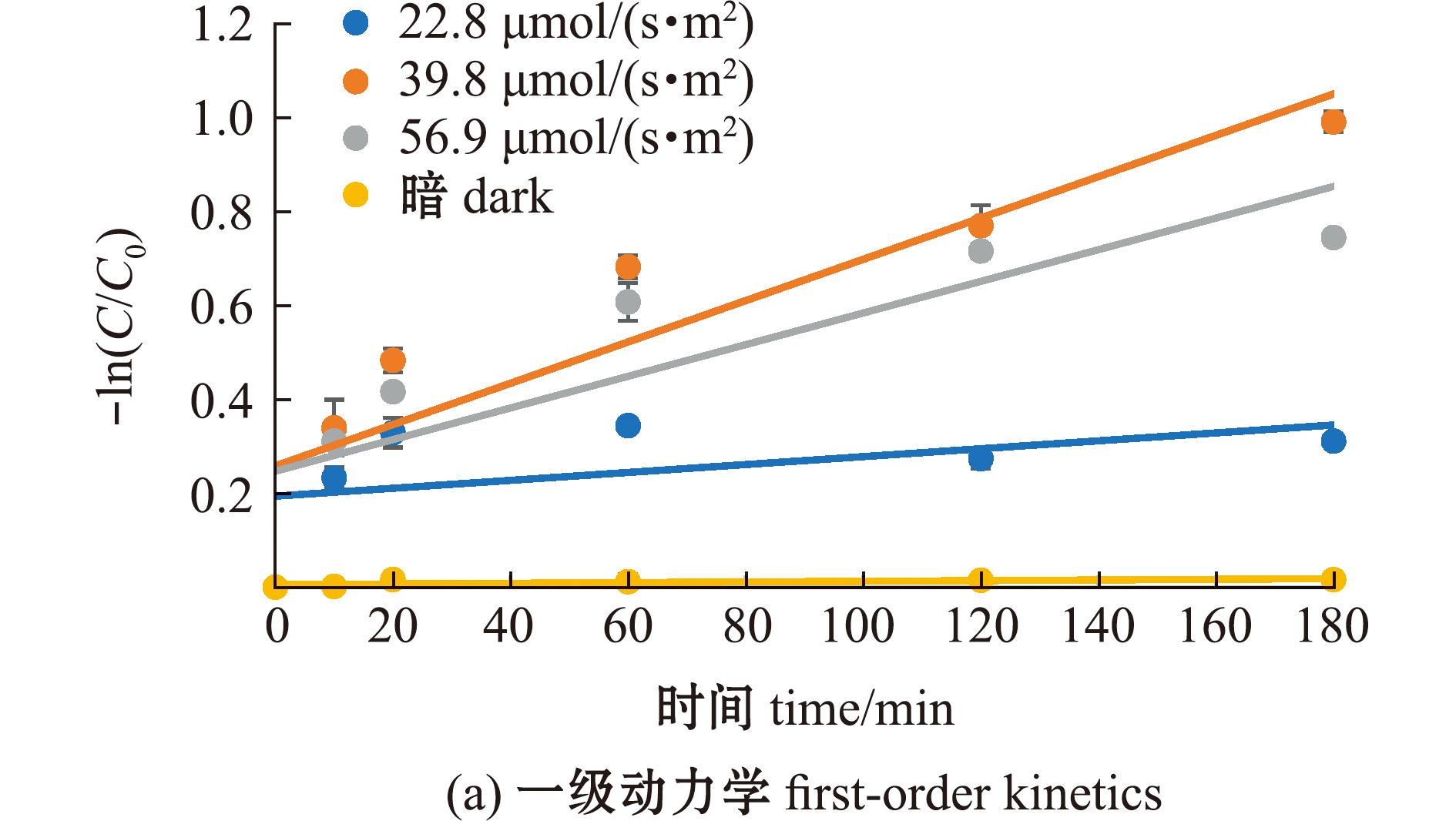
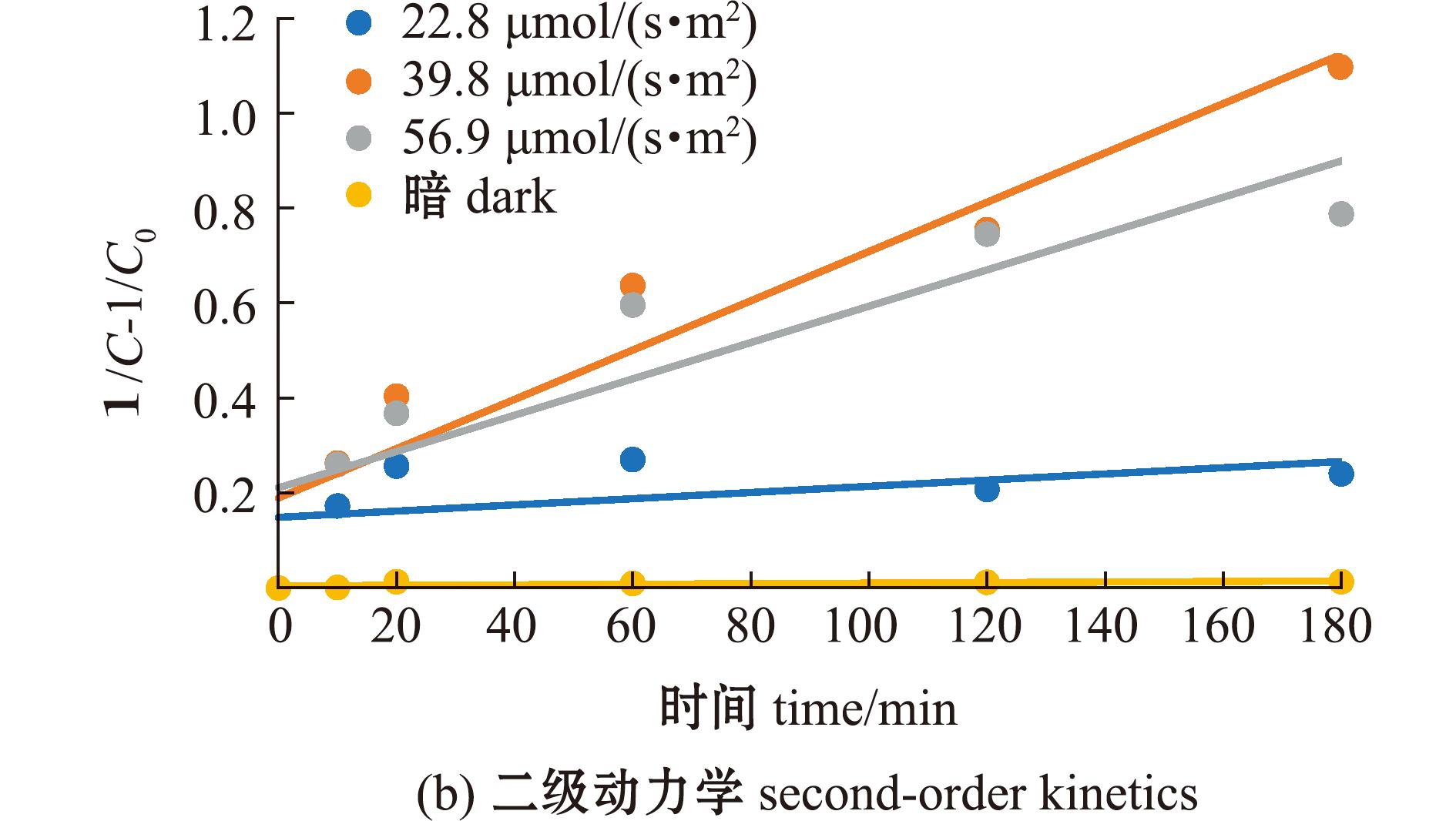
图7 不同光照度下MC-LR在7.5 mg/L FA溶液中的光降解动力学方程拟合曲线
Fig.7 Fitting curve of photodegradation kinetics equation of MC-LR in 7.5 mg/L FA solution under different light intensities
表4 不同光照度下MC-LR在7.5 mg/L FA溶液中的光降解动力学方程及参数
Tab.4 Kinetic equations and parameters of photodegradation of MC-LR in 7.5 mg/L FA solution under different light intensities
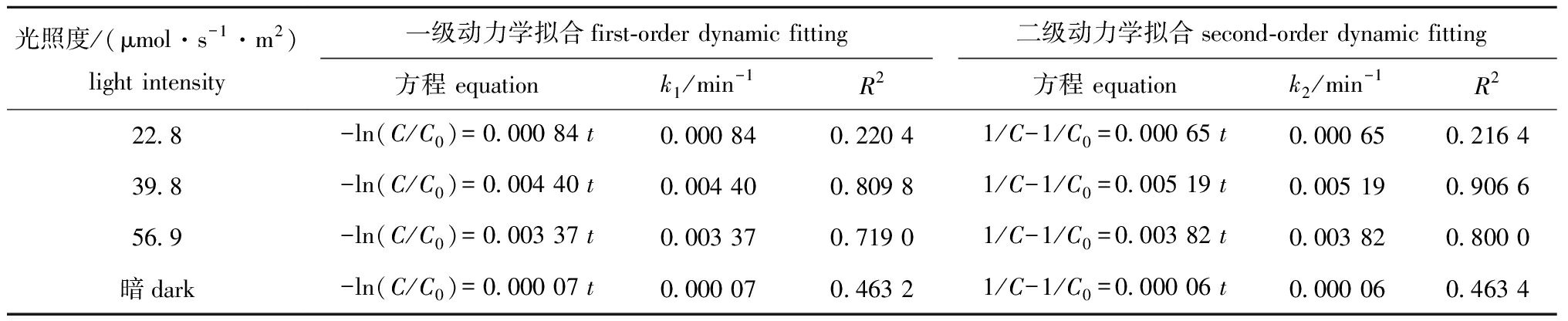
光照度/(μmol·s-1·m2)light intensity一级动力学拟合first-order dynamic fitting二级动力学拟合second-order dynamic fitting方程 equationk1/min-1R2方程 equationk2/min-1R222.8-ln(C/C0)=0.000 84 t0.000 840.220 41/C-1/C0=0.000 65 t0.000 650.216 439.8-ln(C/C0)=0.004 40 t 0.004 400.809 81/C-1/C0=0.005 19 t0.005 190.906 656.9-ln(C/C0)=0.003 37 t0.003 370.719 01/C-1/C0=0.003 82 t0.003 820.800 0暗dark-ln(C/C0)=0.000 07 t0.000 070.463 21/C-1/C0=0.000 06 t0.000 060.463 4
MC-LR在紫外光下可发生直接光降解,而照射到地面的太阳光包括可见光和少量紫外光。实验室条件下一般采用氙灯模拟太阳光。Yan等[21]利用氙灯模拟太阳光,在Milli-Q水中进行MC-LR光降解试验,光照14 h时未监测到MC-LR降解。张天芳[22]利用氙灯模拟太阳光,在去离子水中直接光降解MC-LR,10 h后MC-LR的去除率为59%。本研究中发现,利用氙灯模拟太阳光,去离子水中MC-LR亦发生了直接光降解反应,180 min时MC-LR的降解率达到42.91%,所选用的氙灯(500 W)波长为170~700 nm,其中包括紫外光、可见光和红外光。不同型号、厂家的氙灯在波长范围上存在一定差异,会影响其对MC-LR的光降解效果。前期研究发现,对目标污染物的光降解能力既与太阳光的光照度有关,还受光量子产率影响[23-24]。选用的氙灯光照度不同,光量子产率存在差异,也会影响MC-LR的直接光降解效果。
本研究中,在模拟太阳光下,不同浓度FA对MC-LR的光降解均有促进作用,且随着FA浓度升高,光降解作用呈现先升高后下降趋势。当FA浓度较低时,主要以光敏剂形式产生3DOM*和ROS等物质与MC-LR产生反应,进而促进间接光降解反应发生;随着FA浓度不断增大,促进作用越发明显。同时,因FA具有共轭发色团吸光而会产生光屏蔽效应,还会与ROS等相互淬灭[22]。随着FA浓度增加,其分子数变多、分子层变厚,使得MC-LR在单位面积上接收到的光能辐射变弱。此外,FA与MC-LR通过吸附或螯合作用,致使光能向FA转移,FA结构中包含的不饱和键也会与MC-LR进行竞争,致使光降解效率降低[25]。随着FA浓度增加,其通过光屏蔽、淬灭等对MC-LR光化学反应的抑制作用亦逐渐增强。因此,当FA浓度达到一定值时(7.5 mg/L)时,对MC-LR的降解效果最好。在养殖池塘中,可适当种植水生植物,使其与蓝藻竞争营养盐、阳光和氧气等,限制蓝藻生长,从根源上降低了水体中MC-LR含量升高的风险,同时水生植物的茎、叶腐败后可增加水体中FA的含量,有利于MC-LR的光降解[26-27]。
本研究中,在不同pH条件下,MC-LR降解率随着pH的升高呈下降趋势,MC-LR在酸性条件下的降解效果好于碱性条件下。在模拟太阳光照射下酸性溶液更易产生·OH,而·OH能够促进MC-LR的光降解。Yan等[21]发现,在酸性条件下,FA表面电荷被中和,从而促进FA分子的自卷曲和聚集,形成胶束状构象,增强了与疏水化合物MC-LR的结合。在碱性条件下,FA表面呈更多负电荷,同时MC-LR中的谷氨酸和甲基天冬氨酸基团去质子化。负电荷增加了MC-LR和FA之间的排斥力,从而降低了吸附效果。
光照度是影响MC-LR降解的重要环境条件因素之一。本研究中,在黑暗条件下,MC-LR的浓度基本保持不变;随着光照度的增大,单位溶液的能量密度增加,有利于产生更多的有效光子,其能量越大,所产生ROS浓度就越高,MC-LR的降解也就越快[28];但随着光照度的进一步增强,产生光降解产物分子的效率加快,这些中间产物分子与MC-LR母体分子之间对光能的吸收为竞争关系,大量中间产物累积,对光降解反应具有一定的抑制作用[29]。这种竞争作用与ROS所产生的促进作用相互制衡,当光照度为56.9 μmol/(s·m2)时,MC-LR吸收光能的效率降低,导致光降解速率减慢,因此,当光照度为39.8 μmol/(s·m2)时,MC-LR的光降解效果最好。
Adda中的共轭碳双键会引起蛋白磷酸酶1(PP1)和蛋白磷酸酶2A(PP2A)抑制,因此,该位点是MC-LR的毒性基团[30]。本研究中发现,去离子水与FA溶液中MC-LR的降解途径一致,均主要通过Adda基团的共轭碳双键断裂及酰胺键中C-N键断裂实现的,得到了破坏Adda键的产物。无论直接光降解还是间接光降解途径,均能使MC-LR失去毒性作用。不同分子量的FA对MC-LR在水中的光降解影响也得到相似结果[22]。Islam等[31]通过PP2A抑制试验发现,MC-LR经过高铁酸盐氧化处理后其毒性降低,其降解产物与本研究产物有所相似。
1)利用氙灯模拟太阳光,MC-LR在去离子水中发生直接光降解反应;FA对MC-LR的光降解有促进作用,且其光降解作用具有浓度依赖性,7.5 mg/L FA对MC-LR光降解作用最强;去离子水与FA溶液中MC-LR的光降解过程均符合二级反应动力学方程。
2)pH和光照度均会影响FA对MC-LR的光降解作用。在本研究条件下,pH为6、光照度为39.8 μmol/(s·m2)时,FA对MC-LR光降解的促进效果最好。
3)去离子水中与FA溶液中MC-LR的光降解产物相同,光降解途径一致,均能使MC-LR失去毒性作用。
[1] PAERL H W,TUCKER C S.Ecology of blue-green algae in aquaculture ponds[J].Journal of the World Aquaculture Society,1995,26(2):109-131.
[2] 毕相东.微囊藻毒素(MCs)对淡水池塘养殖业的危害及防控研究进展[J].大连海洋大学学报,2021,36(4):535-545. BI X D.Research progress on the harm and control of microcystins (MCs) in freshwater pond aquaculture:a review[J].Journal of Dalian Ocean University,2021,36(4):535-545.(in Chinese)
[3] XIE G Y,HU X J,DU Y X,et al.Light-driven breakdown of microcystin-LR in water:a critical review[J].Chemical Engineering Journal,2021,417:129244.
[4] BOUAÏCHA N,MILES C O,BEACH D G,et al.Structural diversity,characterization and toxicology of microcystins[J].Toxins,2019,11(12):714.
[5] G![]() GA
GA A I,MANKIEWICZ-BOCZEK J.The natural degradation of microcystins (Cyanobacterial hepatotoxins) in fresh water-the future of modern treatment systems and water quality improvement[J].Polish Journal of Environmental Studies,2012,21(5):1125-1139.
A I,MANKIEWICZ-BOCZEK J.The natural degradation of microcystins (Cyanobacterial hepatotoxins) in fresh water-the future of modern treatment systems and water quality improvement[J].Polish Journal of Environmental Studies,2012,21(5):1125-1139.
[6] SCHMIDTJ R,WILHELMS W,BOYERG L.The fate of microcystins in the environment and challenges for monitoring[J].Toxins,2014,6(12):3354-3387.
[7] TSUJI K,WATANUKI T,KONDO F,et al.Stability of microcystins from cyanobacteria:II.effect of UV light on decomposition and isomerization[J].Toxicon:Official Journal of the International Society on Toxinology,1995,33(12):1619-1631.
[8] FEITZ A J,WAITE T D,JONES G J,et al.Photocatalytic degradation of the blue green algal toxin microcystin-LR in a natural organic-aqueous matrix[J].Environmental Science &Technology,1999,33(2):243-249.
[9] SUN Q Y,ZHANG T F,WANG F F,et al.Ultraviolet photosensitized transformation mechanism of microcystin-LR by natural organic matter in raw water[J].Chemosphere,2018,209:96-103.
[10] SANKAR M S,DASH P,SINGH S,et al.Effect of photo-biodegradation and biodegradation on the biogeochemical cycling of dissolved organic matter across diverse surface water bodies[J].Journal of Environmental Sciences,2018,77:130-147.
[11] WANG H,ZHOU H X,MA J Z,et al.Triplet photochemistry of dissolved black carbon and its effects on the photochemical formation of reactive oxygen species[J].Environmental Science &Technology,2020,54(8):4903-4911.
[12] 张天芳,王晶晶,吴春山,等.水体中溶解性有机质对有机污染物降解机制的研究进展[J].海峡科学,2017(10):10-12. ZHANG T F,WANG J J,WU C S,et al.Research progress on degradation mechanism of organic pollutants by dissolved organic matter in water[J].Straits Science,2017(10):10-12.(in Chinese)
[13] 汪斌,谭建新,代静玉.腐殖酸对池塘底泥中铅、镉的离子形态分布及其活性的影响[J].土壤通报,2007,38(1):106-110. WANG B,TAN J X,DAI J Y.Effect of humic acid on ionic form distribution and activity of lead and cadmium in pond sediment[J].Chinese Journal of Soil Science,2007,38(1):106-110.(in Chinese)
[14] LIVANOU E,LAGARIA A,PSARRA S,et al.A DEB-based approach of modeling dissolved organic matter release by phytoplankton[J].Journal of Sea Research,2019,143:140-151.
[15] 李翔,李致春,汪旋,等.蓝藻衰亡过程中上覆水溶解性有机物变化特征[J].环境科学,2021,42(7):3281-3290. LI X,LI Z C,WANG X,et al.Characteristics of dissolved organic matter in overlying water during algal bloom decay[J].Environmental Science,2021,42(7):3281-3290.(in Chinese)
[16] 唐红日,刘超斌,唐新民.南美白对虾养殖池塘中有机物质的来源、危害及其降解[J].河北渔业,2007(10):2-3. TANG H R,LIU C B,TANG X M.Source,harm, and degradation of organic matter in Litopenaeus vannamei culture ponds[J].Hebei Fisheries.2007(10):2-3.(in Chinese)
[17] SPOOF L,CATHERINE A.Appendix 3:tables of microcystins and nodularins[M].New York:John Wiley &Sons,Ltd,2016:526-537.
[18] 王晶晶.溶解性有机质对水中微囊藻毒素-LR的光敏降解研究[D].福州:福建师范大学, 2017. WANG J J.Research on the photodegration of microcystin-LR in aqueous solution by dissolved organic matter[D].Fuzhou: Fujian Normal University,2017.(in Chinese)
[19] GUERARD J J,MILLER P L,TROUTS T D,et al.The role of fulvic acid composition in the photosensitized degradation of aquatic contaminants[J].Aquatic Sciences,2009,71(2):160-169.
[20] JACOBS L E,WEAVERS L K,CHIN Y P.Direct and indirect photolysis of polycyclic aromatic hydrocarbons in nitrate-rich surface waters[J].Environmental Toxicology and Chemistry,2008,27(8):1643-1648.
[21] YAN S W,ZHANG D,SONG W H.Mechanistic considerations of photosensitized transformation of microcystin-LR (cyanobacterial toxin) in aqueous environments[J].Environmental Pollution,2014,193:111-118.
[22] 张天芳.水中溶解性有机质(DOM)对微囊藻毒素-LR的光敏降解机制研究[D].福州:福建师范大学,2019. ZHANG T F.Mechanisms of photosensitive degradation of microcystin-LR by dissolved organic matter (DOM) in water[D].Fuzhou:Fujian Normal University,2019.(in Chinese)
[23] 梁辰.溶解性有机质对不同解离形态诺氟沙星光降解的影响[D].大连:大连理工大学,2014. LIANG C.Effect of dissolved organic matters on photolysis of norfloxacin with different dissociation species[D].Dalian:Dalian University of Technology,2014.(in Chinese)
[24] 安娜.水中溶解性有机质对四种典型抗抑郁药物光降解行为的影响[D].大连:大连理工大学,2012. AN N.Effects of aqueous dissolved organic matters on photodegradation of four typical antidepressant drugs[D].Dalian:Dalian University of Technology,2012.(in Chinese)
[25] 常晶.基于水中微囊藻毒素MC-LR去除的不同氧化方法降解机制研究[D].哈尔滨:哈尔滨工业大学,2015. CHANG J.Study on degradation mechanism of microcystin MC-LR in water by different oxidation methods[D].Harbin:Harbin Institute of Technology,2015.(in Chinese)
[26] 吴科君.植物浮床系统对三峡库区支流库湾富营养化水体的净化效果研究[D].重庆:西南大学,2020. WU K J.Study on purification effect of plant floating bed system on eutrophic water in tributary reservoir bay of three gorges reservoir[D].Chongqing:Southwest University,2020.(in Chinese)
[27] BAKKER E S,VAN DONK E,DECLERCK S A J,et al.Effect of macrophyte community composition and nutrient enrichment on plant biomass and algal blooms[J].Basic and Applied Ecology,2010,11(5):432-439.
[28] 陈伟,甘南琴,宋立荣.微囊藻毒素在单波长紫外光照射下的光降解动态研究[J].化学学报,2004,62(2):142-147,100. CHEN W,GAN N Q,SONG L R.Photodegradation dynamics of pure microcystin variants with illumination of fixed wavelength UV-lights[J].Acta Chimica Sinica,2004,62(2):142-147,100.(in Chinese)
[29] 郑晓东,于晓龙,逯洲,等.喹草酮在水环境中的光解特性[J].农药,2023,62(4):277-282. ZHENG X D,YU X L,LU Z,et al.The photolysis characteristics of quinotrione in water environment[J].Agrochemicals,2023,62(4):277-282.(in Chinese)
[30] AN J,CARMICHAEL W W.Use of a colorimetric protein phosphatase inhibition assay and enzyme linked immunosorbent assay for the study of microcystins and nodularins[J].Toxicon:Official Journal of the International Society on Toxinology,1994,32(12):1495-1507.
[31] ISLAM A,JEON D,RA J,et al.Transformation of microcystin-LR and olefinic compounds by ferrate(VI):oxidative cleavage of olefinic double bonds as the primary reaction pathway[J].Water Research,2018,141:268-278.