中间球海胆隶属于棘皮动物门(Echinodermata)海胆纲(Echinoidea)正形目(Camarodonta)球海胆科(Strongylocentrotidae)球海胆属(Strongylocentrotus),1989年由大连海洋大学从日本引入国内,因其性腺色泽好、味甜,深受消费者喜爱[1]。2020年中国海胆产量为7 952.53 t,2021年产量上升至13 600 t[2],增长率高达70%。随着养殖规模的不断扩大,各养殖区经常发生掉棘病、红斑病和黑嘴病等细菌性疾病[3],严重影响了海胆养殖业的健康发展。随着研究人员对海胆疾病病原研究的逐渐深入,对黑嘴病等疾病的发病规律及防治策略也有了新的认识[4-5],但限于自然海域养殖的特殊性,海胆养殖中仍然缺乏有效的疾病治疗方法,目前抑制疾病暴发最有效的方法仍是预防。
在水产养殖中,已经有多种途径可提高养殖物种的免疫力,以预防疾病和降低损失。例如在饲料中添加免疫增强剂[6-7]和中药提取物[8],在饲料或养殖水体中施加噬菌体[9]或益生菌[10-11],以及开展抗病育种[12]等。由于海胆属于啃食的摄食方式,在饲料中添加免疫增强剂、中药提取物等会因海胆摄食速度慢、饲料溶蚀严重而降低效果;又由于海胆的主要养殖方式为基于开放海域的筏式养殖或底播增殖,无法向养殖水体施加噬菌体、益生菌等制剂。因此,已广泛应用于水产动物中的大部分增强免疫方式在海胆养殖中难以实现。长期以来,人们认为无脊椎动物不存在获得性免疫,随着对无脊椎动物免疫研究的不断深入,研究人员发现,许多无脊椎动物在重复感染病原后,体内非特异性免疫指标显著高于首次感染[13],但由于无脊椎动物缺乏与脊椎动物相似的免疫元件,为了与脊椎动物的适应性免疫进行区分,将无脊椎动物的适应性免疫现象称为免疫致敏[14]。如![]() 等[15]发现,红棕象甲(Rhynchophorus ferrugineus)口服苏云金芽孢杆菌培养液(过滤除菌)后,能够显著提高苏云金芽孢杆菌攻毒后红棕象甲的存活率。虾蟹类能够通过改变唐氏综合征细胞黏附分子的可变剪切应对病原或灭活病原的重复刺激,提高机体的抗病能力并参与免疫致敏过程[16]。Zhang 等[17]、王伟林[18]发现,长牡蛎(Crassostrea gigas)在面对灿烂弧菌重复感染时,可以通过快速增殖淋巴细胞来特异性地增强对病原的抵抗能力。Burciaga等[19]使用大肠杆菌重复感染东非蜂(Apis mellifera)发现,免疫记忆组相较对照组获得了更高的存活率和溶菌活力。免疫致敏现象的发现,为开发无脊椎动物病害防控新方法提供了新的思路,即通过免疫致敏,可使动物体内产生类似于抗体作用的免疫能力,尤其是对于存在上述技术难点的海胆来说,免疫致敏的利用更为重要。然而,中间球海胆中是否存在免疫致敏现象尚不明确。
等[15]发现,红棕象甲(Rhynchophorus ferrugineus)口服苏云金芽孢杆菌培养液(过滤除菌)后,能够显著提高苏云金芽孢杆菌攻毒后红棕象甲的存活率。虾蟹类能够通过改变唐氏综合征细胞黏附分子的可变剪切应对病原或灭活病原的重复刺激,提高机体的抗病能力并参与免疫致敏过程[16]。Zhang 等[17]、王伟林[18]发现,长牡蛎(Crassostrea gigas)在面对灿烂弧菌重复感染时,可以通过快速增殖淋巴细胞来特异性地增强对病原的抵抗能力。Burciaga等[19]使用大肠杆菌重复感染东非蜂(Apis mellifera)发现,免疫记忆组相较对照组获得了更高的存活率和溶菌活力。免疫致敏现象的发现,为开发无脊椎动物病害防控新方法提供了新的思路,即通过免疫致敏,可使动物体内产生类似于抗体作用的免疫能力,尤其是对于存在上述技术难点的海胆来说,免疫致敏的利用更为重要。然而,中间球海胆中是否存在免疫致敏现象尚不明确。
本课题组前期对中间球海胆黑嘴病病原菌进行鉴定发现,该病原为棘皮动物弧菌(Vibrio echinoideorum)[4]。本试验中,使用棘皮动物弧菌对中间球海胆进行重复感染,对吞噬细胞吞噬作用等相关免疫指标及感染后的存活率进行了比较分析,探究了中间球海胆的免疫致敏现象,并探讨了利用该现象进行疾病防控的可行性,以期为海胆养殖的疾病防控提供理论和技术参考。
试验用中间球海胆取自大连海洋大学农业农村部北方海水增养殖重点实验室同批次人工繁育群体,挑选壳径为2~3 cm的健康个体作为试验材料。病原菌为本实验室分离纯化的棘皮动物弧菌[4]。
1.2.1 吞噬作用相关免疫指标免疫诱导试验 试验设计:本课题组前期研究表明[4-5],使用浓度为102 CFU/mL的棘皮动物弧菌在13 ℃水温下感染中间球海胆,即可使海胆患病。在后续研究中作者发现,棘皮动物弧菌对中间球海胆的感染效果受水温极显著影响(数据待发)。本次免疫诱导试验在20 ℃下进行,经预试验发现,浓度为103~104 CFU/mL的棘皮动物弧菌均不能使中间球海胆感染。因此,本试验使用103 CFU/mL低浓度棘皮动物弧菌进行首次免疫诱导,为保证样本数量,使用略高但不致死的104 CFU/mL菌浓度进行二次感染。具体试验过程为:将120只中间球海胆随机分配至8个40 L塑料水槽中,每个水槽中放置15只。试验分对照组和诱导致敏组,每组设4个平行。试验开始前将海胆在水槽中暂养3 d。首次感染时,诱导致敏组采用无菌注射器注射90 μL 103 CFU/mL的棘皮动物弧菌菌液+10 μL荧光微球(天津倍乐思,直径1 μm),对照组注射90 μL无菌海水+10 μL荧光微球。首次感染结束4 d后开始二次感染。二次感染时,诱导致敏组采用无菌注射器注射90 μL 104 CFU/mL的棘皮动物弧菌菌液+10 μL荧光微球,对照组注射90 μL无菌海水+10 μL荧光微球。分别在首次感染前(0 h)和首次感染后6、12、24、48、96 h,以及二次感染前(0 h)和二次感染后6、12、24、48、96 h进行吞噬作用相关免疫指标取样。
取样方法:从每个水槽随机取2只海胆,解剖后从每个个体等量吸取600 μL体腔液进行混合作为1个样本,每个时间点上免疫致敏组和对照组各获得4个体腔液样本。在每个体腔液样本中分别加入2.8 mL抗凝剂(20 mmol/L Tris-HCl+0.5 mol/L NaCl+70 mmol/L EDTA,pH 7.5),混匀振荡后分装入8个1.5 mL离心管中,每支离心管装入0.5 mL体腔液。随机取3管体腔液用于体腔细胞分类计数。本课题组前期研究[5]表明,中间球海胆感染棘皮动物弧菌后,体腔液上清液吞噬作用相关免疫指标变化不显著,因此,本试验中仅测定体腔细胞的免疫参数。将剩余5管体腔液于4 ℃下以3 000 r/min离心10 min,收集体腔细胞,于-80 ℃下保存,用于后续免疫参数的测定。
体腔细胞分类计数:使用血球计数板对体腔细胞进行分类计数,分类依据参考Deveci等[20]的体腔细胞分类方法,将每个样本3次计数获得的各细胞密度取平均值,乘以稀释倍数(3.3倍)后获得该样本各细胞的实际密度。
吞噬相关免疫参数检测:体腔细胞中酸性磷酸酶(ACP)活力、活性氧(ROS)含量、总抗氧化能力(T-AOC)等免疫参数均采用碧云天生物技术 (上海)有限公司相关试剂盒测定,所有检测步骤均按照试剂盒说明书操作。
体腔细胞吞噬能力检测:分别从各组随机取3只海胆,使用荧光显微镜对吞噬细胞总数、参与吞噬的细胞数及被吞噬的荧光微球数进行计数,并计算吞噬率和吞噬指数,即吞噬率=参与的吞噬细胞数/总吞噬细胞数×100%,
(1)
吞噬指数=吞噬荧光微球数/吞噬细胞总数。
(2)
1.2.2 致死试验 经预试验发现,在5 ℃水温下,103 CFU/mL的棘皮动物弧菌不能感染中间球海胆,而104 CFU/mL可以使其感染。因此,本次致死试验在5 ℃下进行。致死试验过程:将180只海胆平均放入6个40 L水槽中,分为阳性对照组、诱导致敏组,每个水槽放30只海胆。诱导阶段:致敏组使用无菌注射器刺破海胆围口膜,然后向水槽中加入棘皮动物弧菌,使其终浓度为103 CFU/mL,对海胆进行免疫诱导,阳性对照组只损伤海胆围口膜,不加菌液诱导;诱导24 h后换水一次,此后每两天换水一次。攻毒阶段:5 d后对海胆进行攻毒处理,均向诱导致敏组和阳性对照组水槽中加入棘皮动物弧菌,使其终浓度为104 CFU/mL,攻毒后24 h时记录海胆存活率。
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 26.0软件对中间球海胆存活率、各免疫参数进行单因素方差分析(one-way ANOVA),采用 LSD法进行组间多重比较,显著性水平设为0.05。
免疫诱导试验中,两次感染过程中,免疫致敏组和对照组均未出现患病和死亡。
从图1可见:在首次感染后,对照组细胞总密度在试验期间无显著性变化,而诱导致敏组则呈现先降低后升高的变化趋势,并在48 h时达到峰值[(232.56±21.04)×104 cells/mL];与对照组相比,诱导致敏组在6、12、24 h时显著降低(P<0.05),在48、96 h时显著升高(P<0.05)。在二次感染后,对照组细胞总密度总体上略呈降低趋势,而诱导致敏组呈波动变化,并在12、96 h时出现两次峰值,诱导致敏组细胞总密度在所有时间点均显著高于对照组(P<0.05)。两次感染比较显示:对照组二次感染后细胞总密度在大部分时间点均显著低于首次感染(P<0.05),而诱导致敏组则相反,除48 h外,在其他时间点均显著高于首次感染(P<0.05);诱导致敏组二次感染后细胞总密度在12 h时达到第一个峰值,达峰时间较首次感染提前了36 h,且峰值也显著提高(P<0.05)。
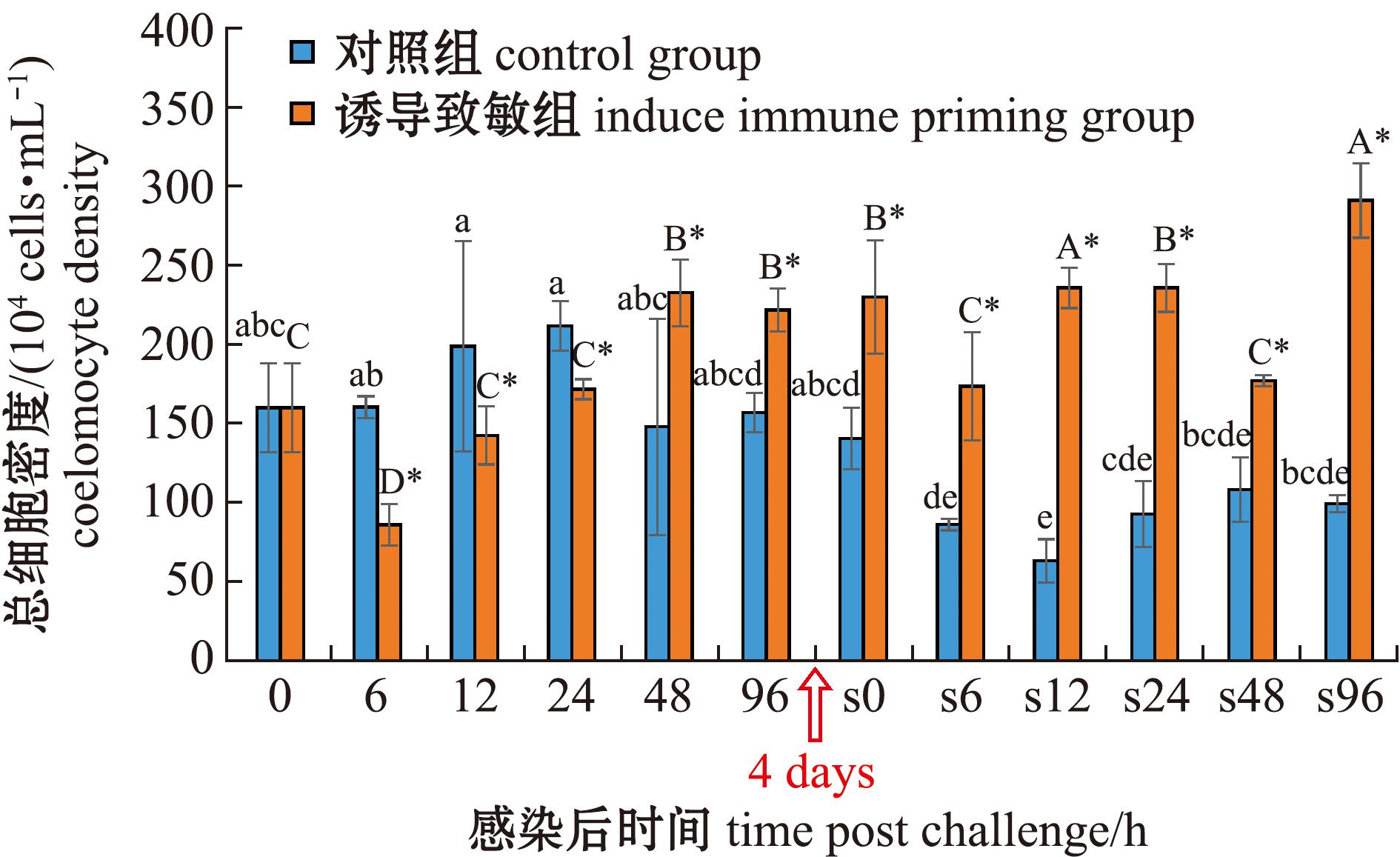
x轴中s表示二次感染。*表示同一时间点上,诱导致敏组与对照组间有显著性差异(P<0.05);标有不同小写字母者表示对照组各时间点间有显著性差异(P<0.05);标有不同大写字母表示诱导致敏组不同时间点间有显著性差异(P<0.05),下同。
The s in the abscissa denotes the secondary infection.* indicates significant difference between the induced immune priming group and the control group at the same time point(P<0.05). The means with different letters are significantly different among time points in control group(P<0.05). The means with different capital letters are significantly different among time points in induced immune priming group(P<0.05),et sequentia.
图1 两次棘皮动物弧菌感染后中间球海胆体腔细胞密度的变化
Fig.1 Changes in coelomocyte cell density in the sea urchin exposed to twice challenge with Vibrio echinoideorum
从图2可见:在首次感染后,对照组吞噬细胞密度在试验期间无显著性变化,而诱导致敏组则呈现先下降后上升的趋势,并在48 h时达到峰值[(106.94±15.84)×104 cells/mL];与对照组相比,诱导致敏组在6 h时显著降低(P<0.05),在48、96 h时显著升高(P<0.05)。在二次感染后,对照组吞噬细胞密度呈下降趋势,而诱导致敏组则呈波动变化,诱导致敏组吞噬细胞密度在所有时间点均显著高于对照组(P<0.05)。两次感染比较显示:对照组二次感染后吞噬细胞密度整体低于首次感染,而诱导致敏组则相反,除48 h外,在其他时间点均显著高于首次感染(P<0.05);诱导致敏组二次感染后吞噬细胞密度在12 h时达到第一个峰值[(135.33±7.10)×104 cells/mL],达峰时间较首次感染提前了36 h,且峰值也显著提高(P<0.05)。
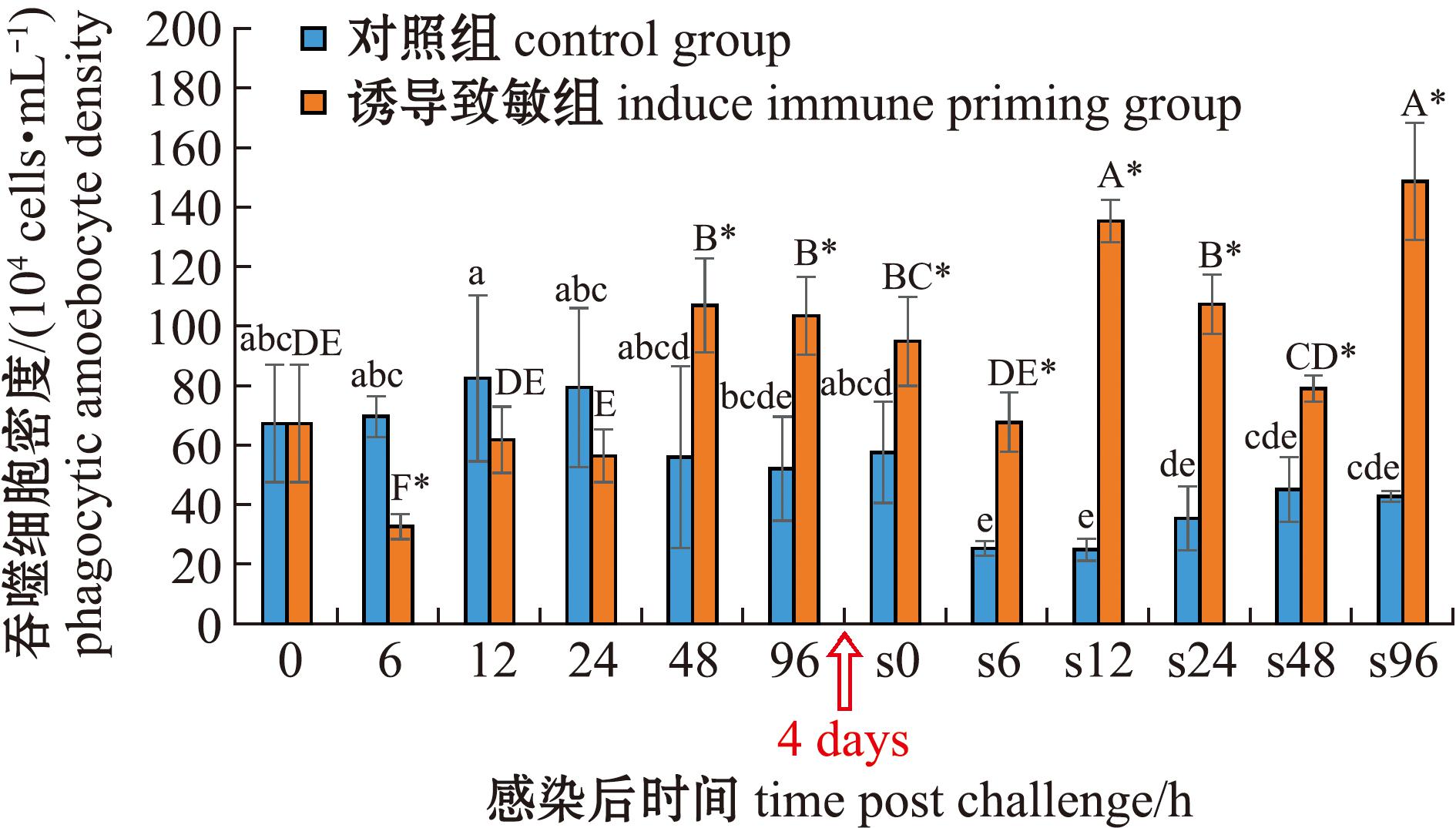
图2 两次棘皮动物弧菌感染后中间球海胆吞噬细胞密度的变化
Fig.2 Changes in phagocytic amoebocyte density in the sea urchin exposed to twice challenge with Vibrio echinoideorum
从图3可见:在首次感染后,对照组红色桑葚细胞密度呈现先升高后下降的趋势,在12 h时达到峰值 [(36.17±8.65)×104 cells/mL],而诱导致敏组红色桑葚细胞密度则呈现逐渐上升的趋势,并在96 h时达到峰值[(29.55±13.27)×104 cells/mL];诱导致敏组红色桑葚细胞密度在6 h时显著低于对照组(P<0.05)。在二次感染后,对照组与诱导致敏组红色桑葚细胞密度均呈下降趋势,对照组整体无显著性变化,而诱导致敏组红色桑葚细胞密度在12 h时达到峰值[(42.78±4.10)×104 cells/mL];除48 h外,诱导致敏组在其余各时间点均显著高于对照组(P<0.05)。两次感染比较显示:对照组二次感染后红色桑葚细胞密度除在12、96 h时显著低于首次感染外(P<0.05),在其余时间点与首次感染均无显著性差异性(P>0.05);诱导致敏组二次感染后在0~12 h时红色桑葚细胞密度均显著高于首次感染(P<0.05),达峰时间较首次感染提前了84 h,且峰值也显著提高(P<0.05)。
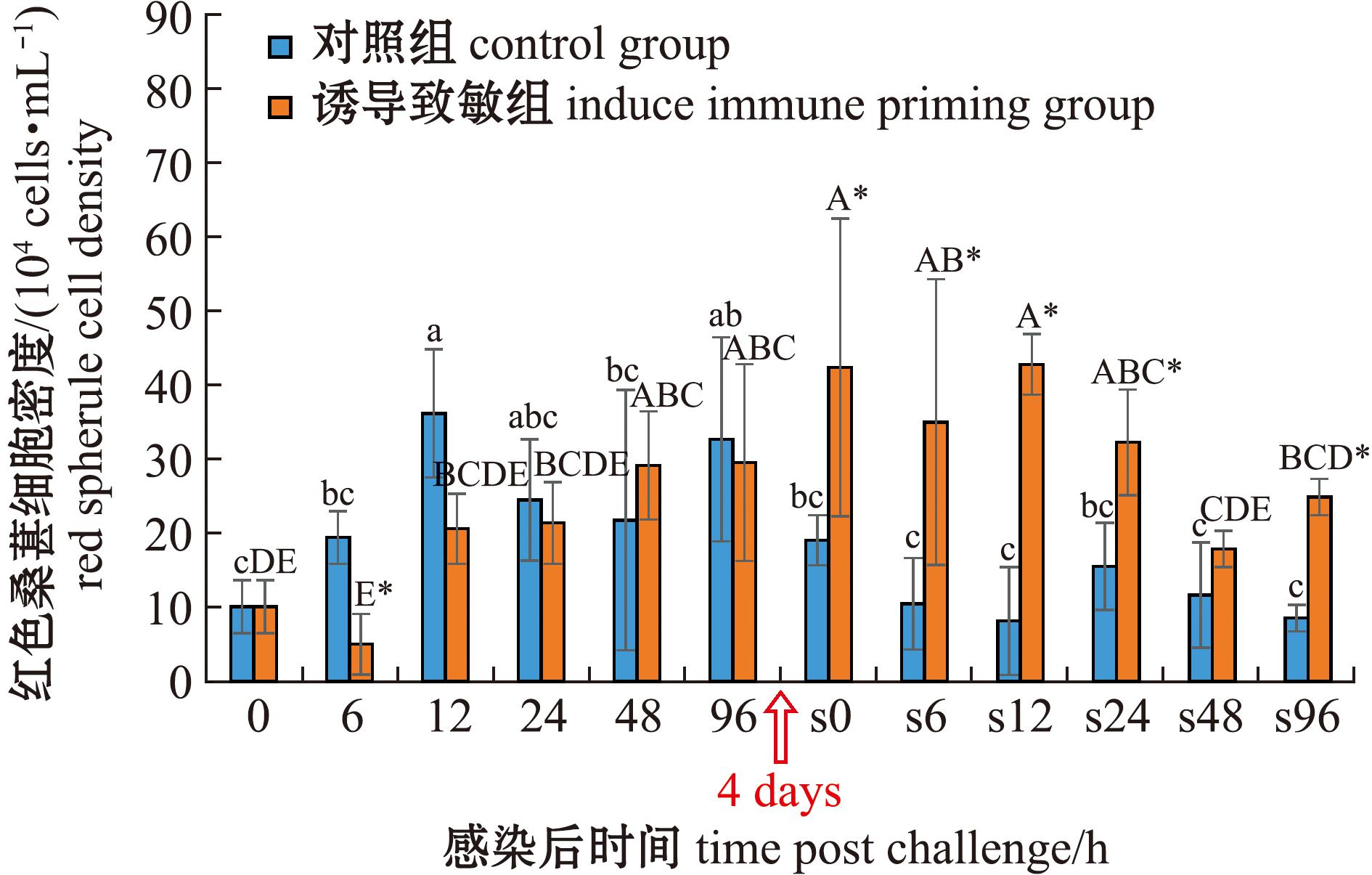
图3 两次棘皮动物弧菌感染后中间球海胆红色桑葚细胞密度的变化
Fig.3 Changes in red spherual cell density in the sea urchin exposed to twice challenge with Vibrio echinoideorum
由于荧光微球在体腔注射24 h后发生淬灭,所以只对两次感染后6、12 h的吞噬能力进行分析。从图4可见:在两次感染后,对照组与诱导致敏组吞噬细胞的吞噬率均无显著性变化;在首次感染后,诱导致敏组吞噬率与对照组无显著性差异(P>0.05);在二次感染后,诱导致敏组吞噬率在6 h时显著高于对照组(P<0.05)。两次感染比较显示,对照组二次感染后的吞噬率在所有时间点均显著低于首次感染(P<0.05),而诱导致敏组的吞噬率则略高于首次感染(P>0.05)。
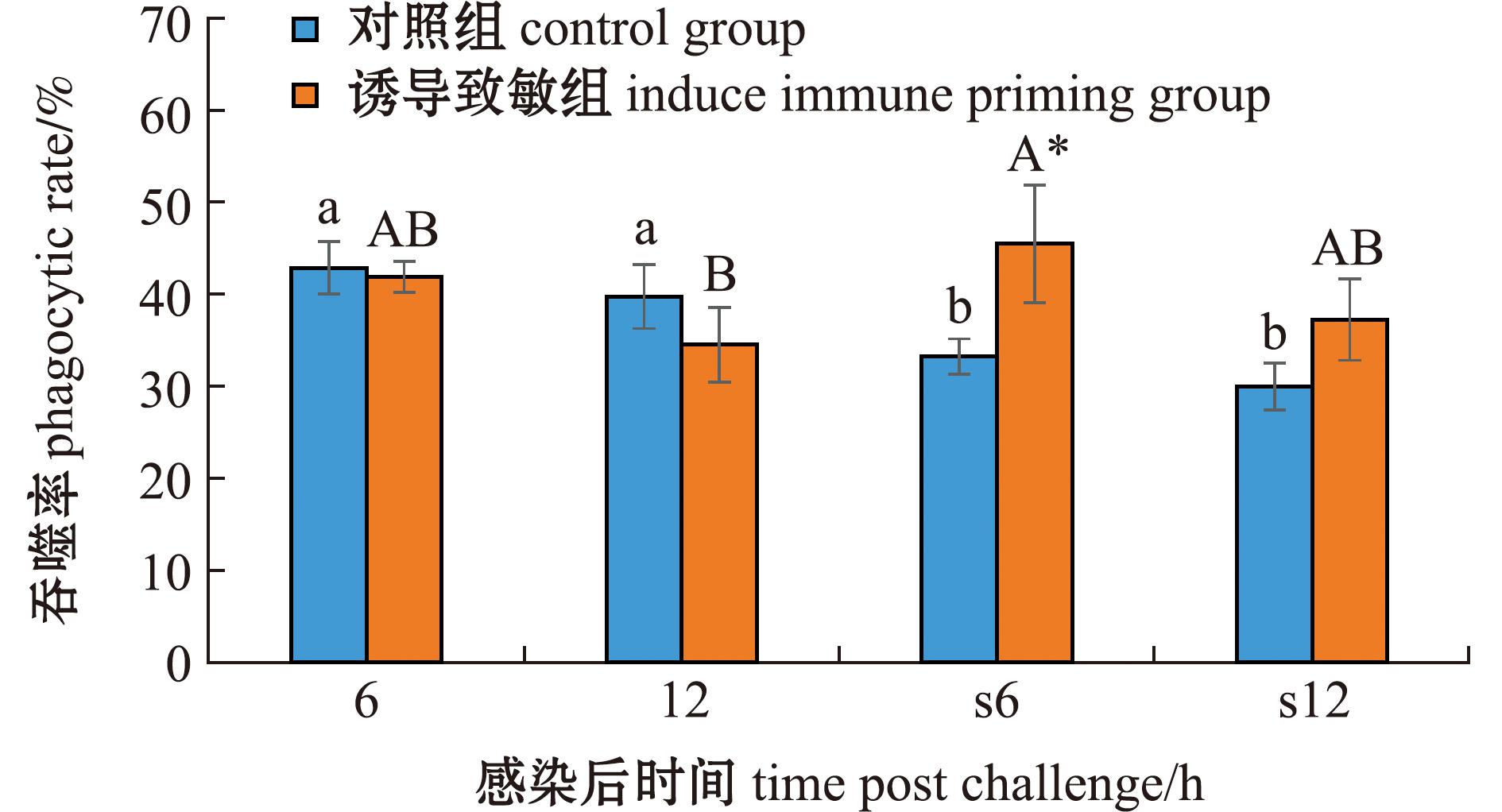
图4 两次棘皮动物弧菌感染后细胞吞噬率的变化
Fig.4 Changes in coelomocy phagocytosis in the sea urchin exposed to twice challenge with Vibrio echinoideorum
从图5可见:在首次感染后,对照组的吞噬指数随感染时间的延长显著降低,而诱导致敏组则无显著性变化,在6 h时,诱导致敏组显著低于对照组(P<0.05);在二次感染后,对照组的吞噬指数随感染时间的延长无显著性变化,而诱导致敏组则显著下降,在12 h时,诱导致敏组的吞噬指数显著低于对照组(P<0.05)。
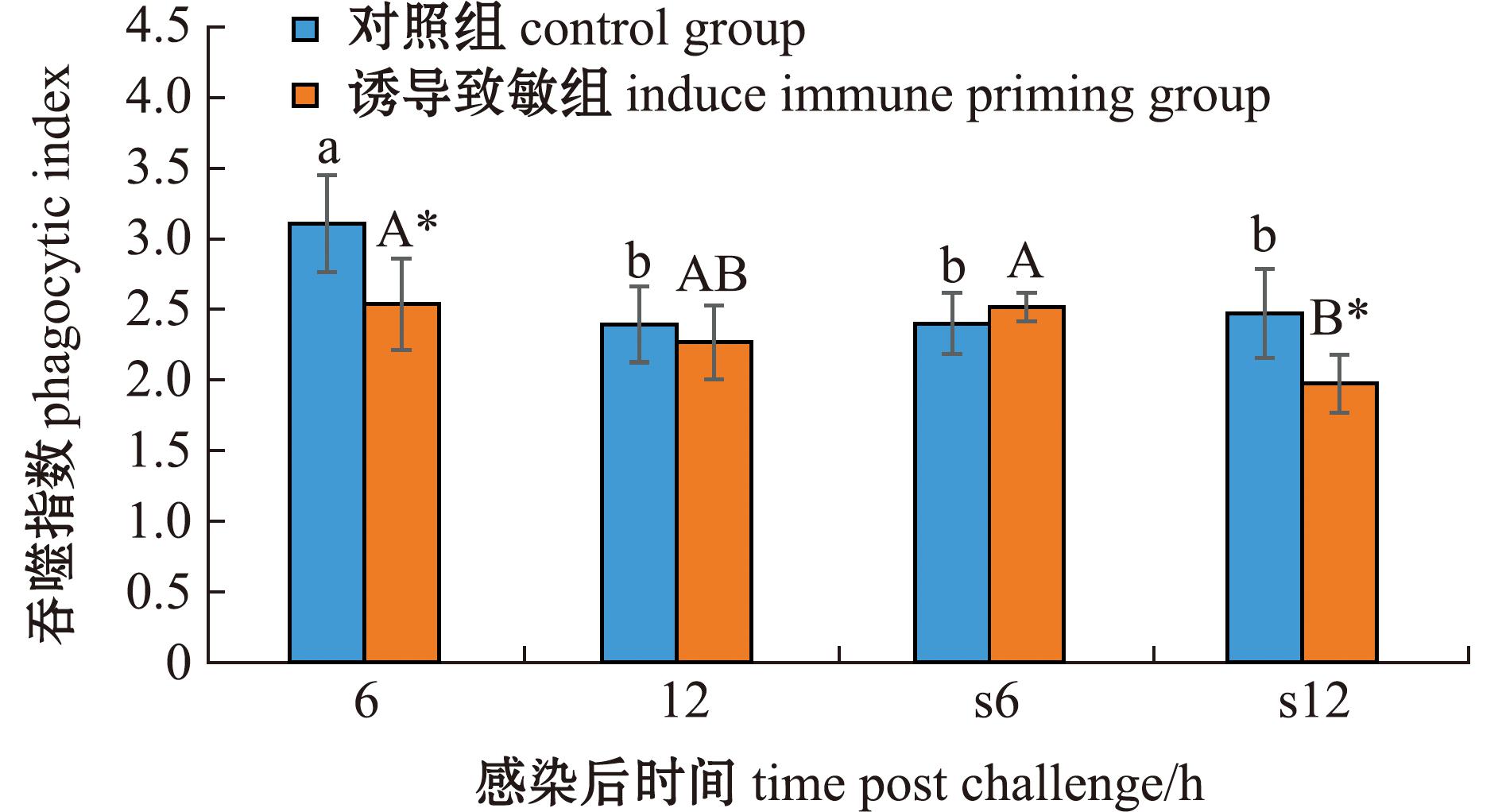
图5 两次棘皮动物弧菌感染后中间球海胆吞噬指数的变化
Fig.5 Changes in phagocytic index in the sea urchin exposed to twice challenge with Vibrio echinoideorum
从图6可见:在首次感染后,对照组体腔细胞ACP活力在试验期间无显著性变化,诱导致敏组ACP活力在48、96 h时显著高于对照组(P<0.05);在二次感染后,对照组ACP活力呈先降低后升高的趋势,至96 h时达到峰值,而诱导致敏组ACP活力则呈波动变化,分别在12、96 h出现两次峰值;诱导致敏组ACP活力在所有时间点均显著高于对照组(P<0.05)。两次感染比较显示:对照组二次感染后ACP活力整体与首次感染无显著性差异,而诱导致敏组在12、24、96 h时均显著高于首次感染(P<0.05);诱导致敏组二次感染后ACP活力在12 h时达到第一个峰值,达峰时间较首次感染提前了84 h,且峰值也显著提高(P<0.05)。
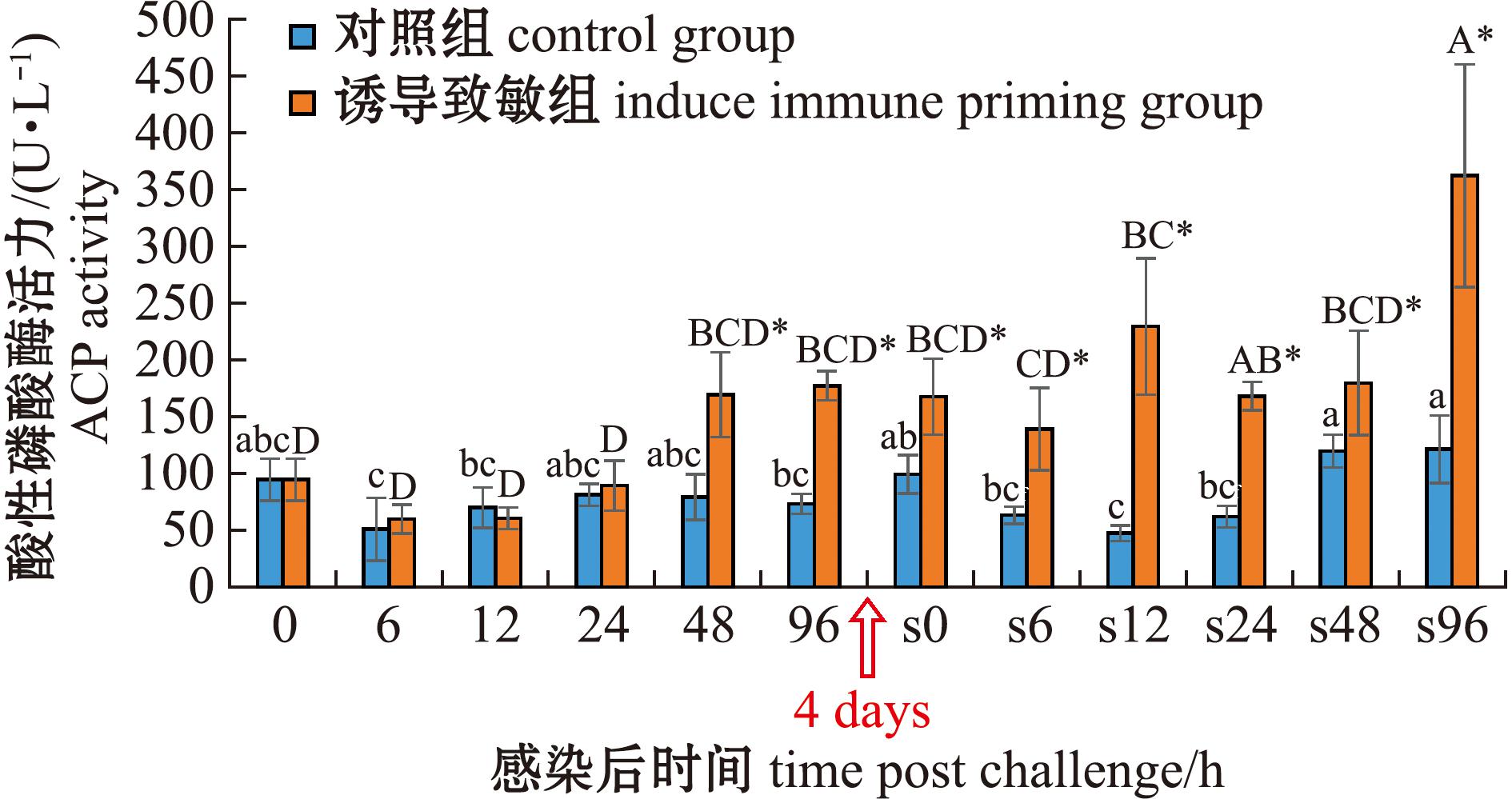
图6 两次棘皮动物弧菌感染后中间球海胆酸性磷酸酶活力的变化
Fig.6 Changes in acid phosphatase activity (ACP)in the sea urchin exposed to twice challenge with Vibrio echinoideorum
从图7可见:在首次感染后,对照组与诱导致敏组ROS水平均呈现先升高后降低的趋势,对照组与诱导致敏组变化幅度大致相同,在大多数时间点二者间均无显著性差异(P>0.05);在二次感染后,对照组ROS水平在各时间点变化不大,诱导致敏组则呈现先升高后降低的趋势,并在12 h时达到第一个峰值[(109.25±5.74)×105],诱导致敏组在所有时间点均显著高于对照组(P<0.05)。
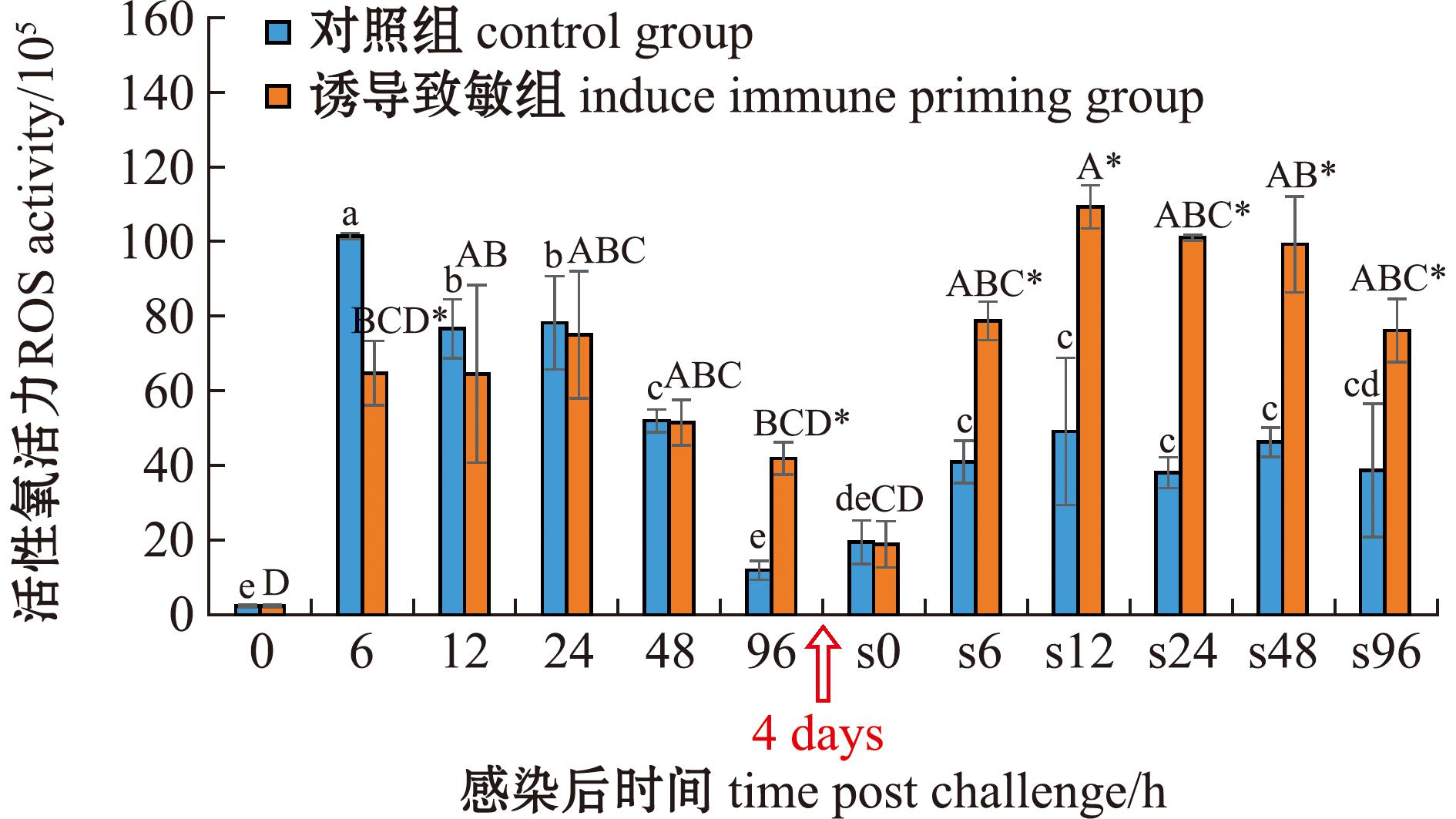
图7 两次棘皮动物弧菌感染后中间球海胆活性氧的变化
Fig.7 Changes in reactive oxygen species (ROS) in the sea urchin exposed to twice challenge with Vibrio echinoideorum
两次感染比较显示,二次感染后对照组ROS水平整体低于首次感染,而诱导致敏组则相反。
从图8可见:在首次感染后,对照组T-AOC活力呈现先上升后下降的趋势,在6 h时显著升高(P<0.05),而诱导致敏组则呈现先下降后上升的趋势,并在48 h时达到峰值(3.28 U/mg±0.24 U/mg);与对照组相比,诱导致敏组T-AOC在6 h时显著降低(P<0.05),在12、48、96 h时显著升高(P<0.05)。在二次感染后,对照组与诱导致敏组T-AOC活力变化均比较平稳,对照组在6、12 h时显著降低(P<0.05),而诱导致敏组在大部分时间点均无显著性差异;诱导致敏组在所有时间点均显著高于对照组(P<0.05)。
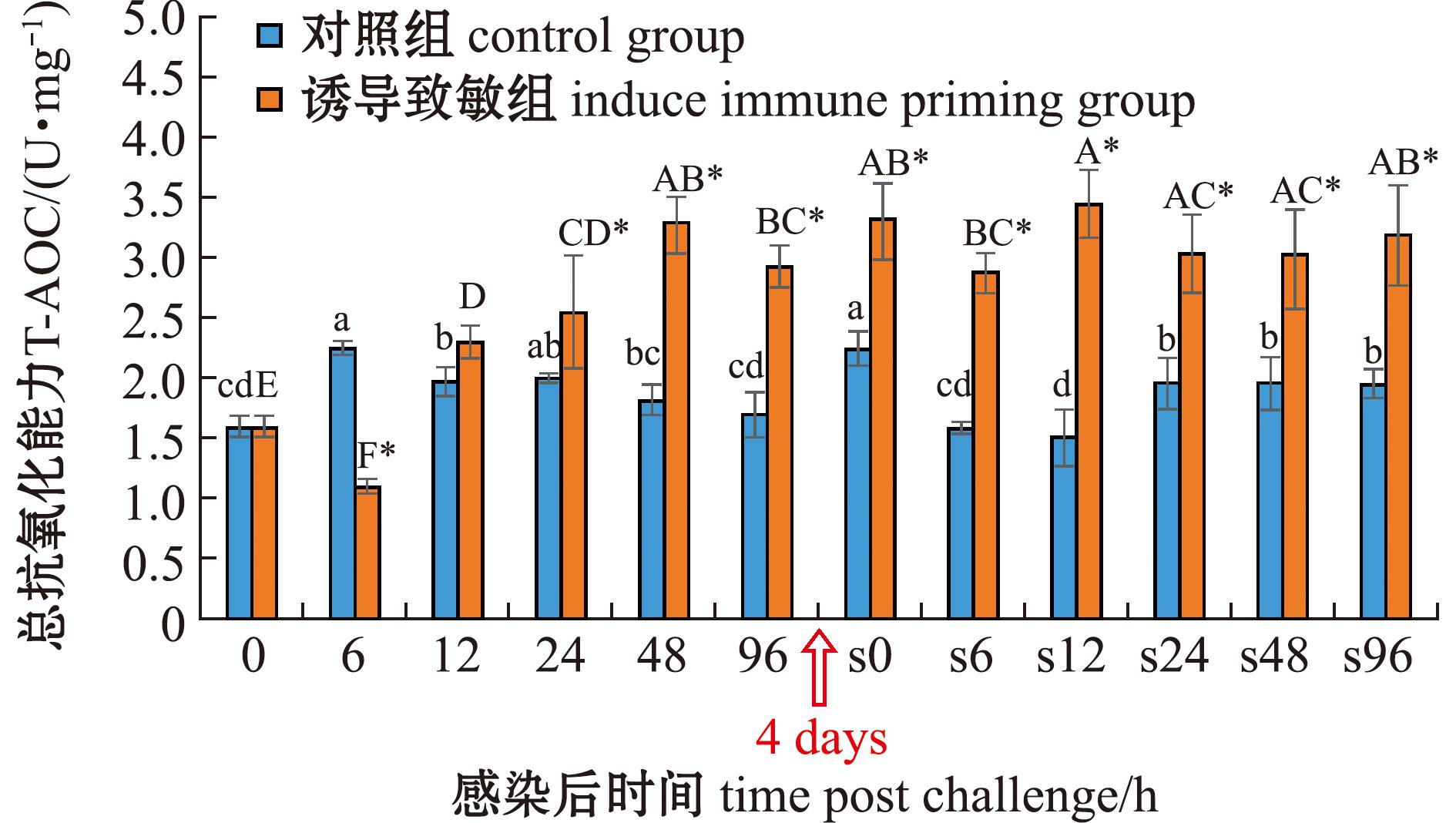
图8 两次棘皮动物弧菌感染后中间球海胆总抗氧化能力的变化
Fig.8 Changes in total antioxidant capacity (T-AOC)in the sea urchin exposed to twice challenge with Vibrio echinoideorum
致死试验中,首次感染时,阳性对照组、诱导致敏组均未出现死亡;二次感染时,阳性对照组、诱导致敏组攻毒后24 h时海胆存活率分别为(17.78%±10.71%)、(43.33%±10.00%),诱导致敏组的存活率较阳性对照组显著提高25.6%(P<0.05)。
海胆的体腔细胞是棘皮动物面对病原感染的第一道防线,是机体免疫屏障的重要组成部分,因此,在重复感染病原后,体腔细胞密度的变化可作为评价中间球海胆存在免疫致敏现象的重要标准。本研究发现,二次感染棘皮动物弧菌后,同时间点上,中间球海胆总体腔细胞密度、吞噬细胞密度及红色桑葚密度均较首次感染和对照组有明显升高,这说明首次感染诱导后的中间球海胆再次感染病原时,其体腔免疫细胞有更强的应对策略。变形吞噬细胞是行使免疫功能的主要细胞,可通过接触、捕获、吞噬外来粒子,将其降解后排出体外。红色桑葚细胞能够在海胆机体发生损伤后,通过阿米巴样运动移动到损伤部位附近并完成损伤修复[21],并可与吞噬细胞共同完成凝集反应[22],释放有抑菌能力的棘胞色素A[23]从而参与免疫应答过程。二次感染后,吞噬细胞密度和红色桑葚细胞密度的增加,说明机体较首次感染进一步增强了对病原的吞噬作用、杀菌作用和修复作用,即可能在免疫细胞层面上存在着免疫致敏现象。一般认为,免疫致敏存在两种诱导模式:第一种模式是致敏的抗原诱导了持久的防御,从而导致宿主体内相关免疫效应分子数量较长时间保持较高水平,这种情况可能会与第二次感染时的免疫反应相结合,导致机体更强的免疫反应;另一种模式是诱导过程启动的免疫反应随时间的推移而减弱,第二次感染时引发更强或更快的免疫反应,促进病原的快速清除[24]。本研究中,对首次感染进行了96 h的监测,之后又间隔4 d进行了二次感染,诱导致敏组二次感染0 h时,体腔细胞密度、吞噬细胞密度和红色桑葚细胞密度均显著高于首次感染0 h。海胆体腔细胞保持较长时间高数量的这种现象不同于中华绒螯蟹(Eriocheir sinensis)[25],但与第一种免疫致敏模式相符合,且在二次感染后,海胆体腔细胞密度出现更高水平的增长,仍符合第一种免疫致敏模式所描述的更强免疫反应,这与对黄粉虫(Tenebrio molitor) [26]、黑腹果蝇(Drosophila melanogaster)[27]等无脊椎动物的研究结果类似。由此可见,中间球海胆在细胞层面上的免疫致敏现象可能属于第一种免疫致敏模式,而中华绒螯蟹等无脊椎动物的免疫致敏现象则可能属于第二种免疫致敏模式。
吞噬作用在无脊椎动物的免疫应答中居于重要地位[28],能够有效清除入侵体内的微生物。吞噬作用的强弱可以通过吞噬细胞密度、吞噬率及吞噬指数的高低进行判断。本研究中,利用荧光微球来检测中间球海胆的吞噬率和吞噬指数,由于荧光微球会随时间延长而发生淬灭,故仅在感染后6、12 h进行了检测。相对于吞噬细胞数量的增幅(免疫致敏组vs对照组),吞噬率和吞噬指数的增幅较低,在二次感染12 h时吞噬指数甚至出现了显著下降。即便如此,仍可推测出二次感染后中间球海胆的吞噬作用得到了加强,即诱导致敏组较对照组在6 h时,吞噬细胞数提高了2.7倍,吞噬率提高了1.4倍;在12 h时,吞噬细胞数提高了5.4倍,吞噬率提高了1.2倍,尽管吞噬指数降低了20%,仍可推测出整个机体的吞噬作用有所提高。从吞噬作用整体角度考虑,本研究中对中间球海胆的重复感染仍然诱导了其机体的免疫致敏。Zhang等[17]在长牡蛎的免疫致敏研究中观察到相似的现象:吞噬细胞密度和吞噬率显著上升而吞噬指数未显著上升。而曹家旺[29]对中国对虾(Fennerpenaeus chinensis)免疫致敏的研究中则观察到三者均显著上升的结果。这可能是不同物种面对病原感染时其吞噬作用的应对策略有差异引起的。由此推测,中间球海胆在重复感染病原诱导免疫致敏过程中,机体吞噬作用的提升倾向于首先依靠提高吞噬细胞的密度,其次是提高吞噬率,最后是提高吞噬指数。
酸性磷酸酶在两次感染期间的变化与体腔细胞数量的变化有所不同,区别在于ACP在二次感染前0 h已与正常水平间无显著性差异,而相同点是二次感染后上升至更高的水平,这与Cong等[14]对栉孔扇贝免疫致敏现象的研究结果相似,该研究中栉孔扇贝(Chlamys farreri)的ACP在二次感染前恢复至正常水平,而二次感染后上升至更高的水平,这说明中间球海胆ACP的变化更接近于第二种免疫致敏模式。ACP是吞噬作用发生时一种重要溶酶体标志酶[30]。破损细胞或破损病原体及不溶性颗粒物质进入吞噬细胞后与初级溶酶体结合且被消化时,能够引起ACP的释放[31]。在刺参(Apostichopus japonicus)中,ACP能够消化细胞中由异物颗粒形成的吞噬体,也可直接对病原进行杀灭[32]。中间球海胆中ACP酶活的免疫致敏可能在二次感染后吞噬细胞内病原菌的清除过程中发挥重要作用。ROS在两次感染期间的变化与ACP相似,即ROS的变化仍属于第二种免疫致敏模式。王晶晶[25]在中华绒螯蟹免疫致敏诱导过程中同样发现,中华绒螯蟹ROS的变化符合第二种免疫致敏模式。ROS是伴随吞噬作用的呼吸爆发产生的活性物质,对病原的磷脂双分子膜、蛋白质乃至核酸均会产生严重的损伤[33],但同时也会对机体自身造成氧化损伤。ROS的免疫致敏现象有利于二次感染后吞噬细胞内病原菌的清除,在清除病原后恢复正常水平则有利于降低对自身的氧化损伤。为降低ROS对自身的氧化损伤,动物机体会提升自身的T-AOC。本研究中,免疫致敏组T-AOC在首次感染后96 h时未恢复正常水平,这可能是由于其变化较ROS有一定滞后性,在二次感染后,由于ROS的升高,T-AOC也相应地维持了较高水平。
综上,通过重复感染棘皮动物弧菌诱导的免疫致敏,不仅能通过快速动员免疫细胞发挥吞噬作用、产生吞噬相关酶来增强免疫保护能力,还能相应地提升机体的抗氧化能力以抵抗呼吸爆发时所带来的氧化损伤。同样诱导时产生的免疫组分一直存留在宿主体内直到发生第二次感染,持续存在的免疫反应增强了中间球海胆的抗病能力,而且一次感染后激活的免疫防御作用可能与二次感染后新的免疫反应相结合,导致更强的反应。
本试验表明,经过低浓度病原菌诱导后,中间球海胆再次感染高浓度病原时的存活率得到显著提高,这与Yao等[34]、曾新洋[35]分别在杂色鲍(Haliotis diversicolor)与拟穴青蟹(Scylla paramamosain)中得到的研究结果一致,这应该是得益于低浓度病原菌诱导的免疫致敏。通过上述对免疫指标的分析,可解释存活率显著提高的原因:首次低浓度的病原菌感染诱导中间球海胆产生了免疫致敏现象,其体腔内吞噬细胞、红色桑葚细胞等免疫细胞数量显著增加,同时ACP、T-AOC等免疫酶活力显著升高,吞噬作用显著加强。由于病原数量较少,海胆机体的免疫系统可将其顺利清除,且将大多数免疫因子长时间保持较高水平。在二次感染时,由于免疫致敏已经被诱导,海胆体腔内的免疫细胞在第一次感染的基础上进一步增加,免疫酶活性进一步增强,产生更强的吞噬作用和灭菌能力,即使病原数量较多,大部分的个体也可将病原菌清除,保持存活。
本研究中,从海胆体腔细胞吞噬作用的角度证实了免疫致敏现象的存在,同时又从病原感染后的存活率角度进行了验证。免疫致敏现象的发现为开发海胆病害防控新方法提供了新的思路:可在病害暴发季节前,利用低浓度的病原菌对中间球海胆进行免疫诱导,使其免疫力迅速提高,从而提高其在病害暴发季节的抗病能力,即类似于注射疫苗。此思路相对于目前水产动物中普遍使用的向饲料或水体中添加免疫增强剂、中药提取物和益生菌等方法针对性更强,但可行性仍需进一步探讨。后续研究应关注免疫致敏的维持时间,比注射低浓度病原菌更安全有效的免疫诱导方式,以及将免疫致敏现象应用于海胆养殖生产中的生产工艺等。
1)使用低浓度棘皮动物弧菌可诱导中间球海胆在二次感染时显著提升体腔免疫细胞密度和ACP、ROS、T-AOC等免疫相关酶活力,即产生免疫致敏。
2)使用棘皮动物弧菌诱导产生的免疫致敏能够显著提升中间球海胆的抗黑嘴病能力,感染后存活率显著提高。
3)中间球海胆存在免疫致敏现象,此现象为中间海胆养殖过程中的病害防控提供了新的策略。
[1] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004. CHANG Y Q,DING J,SONG J,et al.Biological research and culture of sea cucumber and sea urchin[M].Beijing:Ocean Press,2004.(in Chinese)
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2022 中国渔业统计年鉴[M].北京:中国农业出版社, 2022. Administration of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,Chinese Society of Fisheries.2022 China fishery statistical yearbook[M].Beijing:China Agriculture Press,2022.
[3] WANG Y N,FENG N S,LI Q A,et al.Isolation and characterization of bacteria associated with a syndrome disease of sea urchin Strongylocentrotus intermedius in North China[J].Aquaculture Research,2013,44(5):691-700.
[4] 刘岩松,张伟杰,王中,等.中间球海胆黑嘴病病原菌的分离与鉴定[J].大连海洋大学学报,2022,37(5):793-801. LIU Y S,ZHANG W J,WANG Z,et al.Isolation and identification of pathogenic bacteria associated with black-mouth disease in sea urchin Strongylocentrotus intermedius[J].Journal of Dalian Ocean University,2022,37(5):793-801.(in Chinese)
[5] 王中,张伟杰,刘雷,等.黑嘴病病原菌人工感染对中间球海胆吞噬作用相关免疫指标的影响[J].大连海洋大学学报,2021,36(2):241-247. WANG Z,ZHANG W J,LIU L,et al.Effects of artificial challenge of black mouth disease pathogen on phagocytosis related immune parameters in sea urchin Strongylocentrotus intermedius[J].Journal of Dalian Ocean University,2021,36(2):241-247.(in Chinese)
[6] 王仁宝,王一婷,张惠芬,等.口服特异性卵黄抗体对凡纳滨对虾抗WSSV感染的免疫保护效果[J].渔业科学进展,2022,43(4):226-233. WANG R B,WANG Y T,ZHANG H F,et al.Protective effects of oral specific egg yolk immunoglobulins(IgY)against white spot syndrome virus(WSSV) infection in Pacific white shrimp(Litopenaeus vannamei)[J].Progress in Fishery Sciences,2022,43(4):226-233.(in Chinese)
[7] 易建华,王辉,王钦,等.饲料中添加还原型谷胱甘肽对黄颡鱼幼鱼生长性能、血清生化、抗氧化和免疫指标的影响[J].中国饲料,2023(15):167-171. YI J H,WANG H,WANG Q,et al.Effects of dietary supplementation with reduced glutathione on growth performance,serum biochemical indices,antioxidant capacity and immunity of juvenile yellow catfish(Pelteobagurs fulvidraco)[J].China Feed,2023(15):167-171.(in Chinese)
[8] BAHI A,GUARDIOLA F A,MESSINA C,et al.Effects of dietary administration of fenugreek seeds,alone or in combination with probiotics,on growth performance parameters,humoral immune response and gene expression of gilthead seabream (Sparus aurata L.)[J].Fish &Shellfish Immunology,2017,60:50-58.
[9] ONARINDE B A,DIXON R A.Prospects for biocontrol of Vibrio parahaemolyticus contamination in blue mussels (Mytilus edulus)-a year-long study[J].Frontiers in Microbiology,2018,9:1043.
[10] 练小军,朱开玲,张庆起,等.饲料添加益生菌对多病原阳性的凡纳滨对虾生长与存活的影响[J].渔业科学进展,2020,41(2):121-130. LIAN X J,ZHU K L,ZHANG Q Q,et al.Effects of probiotics-supplemented diets on the growth and survival of Litopenaeus vannamei carrying multiple pathogens[J].Progress in Fishery Sciences,2020,41(2):121-130.(in Chinese)
[11] 储兰璐.EM菌对中华绒螯蟹非特异性免疫力和抗脂多糖毒性的研究[D].上海:上海海洋大学,2021. CHU L L.Study of effective microorganisms (EM) on non-specific immune responses and resistance against lipopolysaccharide of Eriocheir sinensis[D].Shanghai:Shanghai Ocean University,2021.(in Chinese)
[12] 江会杰,张伟杰,陈隆,等.中间球海胆抗病家系的筛选及其生长性能分析[J].大连海洋大学学报,2020,35(2):197-204. JIANG H J,ZHANG W J,CHEN L,et al.Selection of disease-resistant family and evaluation of growth performance in sea urchin Strongylocentrotus intermedius[J].Journal of Dalian Ocean University,2020,35(2):197-204.(in Chinese)
[13] 曾新洋,张子平,王艺磊.无脊椎动物免疫记忆研究进展[J].生命科学,2017,29(11):1174-1184. ZENG X Y,ZHANG Z P,WANG Y L.Progress in immunological memory of invertebrates[J].Chinese Bulletin of Life Sciences,2017,29(11):1174-1184.(in Chinese)
[14] CONG M,SONG L S,WANG L L,et al.The enhanced immune protection of Zhikong scallop Chlamys farreri on the secondary encounter with Listonella anguillarum[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,151(2):191-196.
[15]![]() B,FRITZLAR S,KURTZ J.Increased survival in the red flour beetle after oral priming with bacteria-conditioned media[J].Journal of Innate Immunity,2014,6(3):306-314.
B,FRITZLAR S,KURTZ J.Increased survival in the red flour beetle after oral priming with bacteria-conditioned media[J].Journal of Innate Immunity,2014,6(3):306-314.
[16] CHANG Y H,KUMAR R,NG T H,et al.What vaccination studies tell us about immunological memory within the innate immune system of cultured shrimp and crayfish[J].Developmental and Comparative Immunology,2018,80:53-66.
[17] ZHANG T,QIU L M,SUN Z B,et al.The specifically enhanced cellular immune responses in Pacific oyster (Crassostrea gigas) against secondary challenge with Vibrio splendidus[J].Developmental &Comparative Immunology,2014,45(1):141-150.
[18] 王伟林.长牡蛎免疫适应性(免疫致敏)机制的初步研究[D].青岛:中国科学院大学(中国科学院海洋研究所),2017. WANG W L.Preliminary study on the mechanism of immune adaptation (immune priming) in Pacific oyster Crassostrea gigas[D].Qingdao: University of Chinese Academy of Sciences(Institute of Oceanology,Chinese Academy of Sciences),2017.(in Chinese)
[19] BURCIAGA R A,RUIZ-GUZM N G,LANZ-MENDOZA H,et al.The honey bees immune memory[J].Developmental &Comparative Immunology,2023,138:104528.
N G,LANZ-MENDOZA H,et al.The honey bees immune memory[J].Developmental &Comparative Immunology,2023,138:104528.
[20] DEVECI R,![]() ENER
ENER ![]() S.Morphological and ultrastructural characterization of sea urchin immune cells[J].Journal of Morphology,2015,276(5):583-588.
S.Morphological and ultrastructural characterization of sea urchin immune cells[J].Journal of Morphology,2015,276(5):583-588.
[21] ALLEN R L,GEORGE A N,MIRANDA E,et al.Wound repair in sea urchin larvae involves pigment cells and blastocoelar cells[J].Developmental Biology,2022,491:56-65.
[22] 李霞,王斌,刘静,等.虾夷马粪海胆体腔细胞的类型及功能[J].中国水产科学,2003,10(5):381-385. LI X,WANG B,LIU J,et al.Type and function of coelomocyte in sea urchin Strongylocentrotus intermedius[J].Journal of Fishery Sciences of China,2003,10(5):381-385.(in Chinese)
[23] COATES C J,MCCULLOCH C,BETTS J,et al.Echinochrome A release by red spherule cells is an iron-withholding strategy of sea urchin innate immunity[J].Journal of Innate Immunity,2018,10(2):119-130.
[24]![]() B,PEUß R,FERRO K,et al.Immune priming in arthropods:an update focusing on the red flour beetle[J].Zoology,2016,119(4):254-261.
B,PEUß R,FERRO K,et al.Immune priming in arthropods:an update focusing on the red flour beetle[J].Zoology,2016,119(4):254-261.
[25] 王晶晶.中华绒螯蟹免疫致敏现象及相关分子机制的初步研究[D].青岛:中国科学院研究生院(海洋研究所),2013. WANG J J.Preliminary study on phenomenon and mechanism of immune priming in Eriocheir sinensis[D].Qingdao:University of Chinese Academy of Sciences(Institute of Oceanology,Chinese Academy of Sciences),2013.(in Chinese)
[26] HAINE E R,MORET Y,SIVA-JOTHY M T,et al.Antimicrobial defense and persistent infection in insects[J].Science,2008,322(5905):1257-1259.
[27] UTTENWEILER-JOSEPH S,MONIATTE M,LAGUEUX M,et al.Differential display of peptides induced during the immune response of Drosophila:a matrix-assisted laser desorption ionization time-of-flight mass spectrometry study[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(19):11342-11347.
[28] BOUALLEGUI Y.Immunity in mussels:an overview of molecular components and mechanisms with a focus on the functional defenses[J].Fish &Shellfish Immunology,2019,89:158-169.
[29] 曹家旺.中国对虾免疫致敏(类免疫)反应的诱导及其分子机制初探[D].上海:上海海洋大学,2016. CAO J W.The preliminary study of the induction and molecular mechanism of immune priming(quasi-immune) response in Chinese shrimp Fenneropenaeus chinensis[D].Shanghai:Shanghai Ocean University,2016.(in Chinese)
[30] SELVARAJ R J,SBARRA A J.Role of the phagocyte in host-parasite interactions:8.Effect of whole-body X irradiation on nicotinamides,lysosomal enzymes and bactericidal activities of leukocytes during phagocytosis[J].Journal of Bacteriology,1967,94(1):149-156.
[31] 翟中和,王喜忠,丁明孝.细胞生物学[M].4版.北京:高等教育出版社,2011. ZHAI Z H,WANG X Z,DING M X.Cell biology[M].4th ed.Beijing:Higher Education Press,2011.(in Chinese)
[32] 孔伟丽.免疫增强剂及疫苗对刺参(Apostichopus japonicus)免疫酶活性及抗病力影响的初步研究[D].青岛:中国海洋大学,2008. KONG W L.Effects of several immunostimulants and vaccine on the activities of immunoenzyme and disease resistance of sea cucumber,Apostichopus japonicus[D].Qingdao:Ocean University of China,2008.(in Chinese)
[33] 徐镇,江宁锦,何锦锋,等.外源因子介导调控ROS对中国鲎血淋巴细胞参数的影响[J].水产学报,2021,45(12):1973-1982. XU Z,JIANG N J,HE J F,et al.Effect of ROS mediated regulation by exogenous factors on hemopoietic lymphocytes parameters of Tachypleus tridentatus[J].Journal of Fisheries of China,2021,45(12):1973-1982.(in Chinese)
[34] YAO T,LU J,BAI C M,et al.The enhanced immune protection in small abalone Haliotis diversicolor against a secondary infection with Vibrio harveyi[J].Frontiers in Immunology,2021,12:685896.
[35] 曾新洋.拟穴青蟹免疫致敏现象及相关分子机制的初步研究[D].厦门:集美大学,2018. ZENG X Y.Preliminary study on phenomenon and mechanism of immune priming in Scylla paramamosain[D].Xiamen:Jimei University,2018.(in Chinese)