Asb14a基因在斑马鱼肌间骨发育中的作用
牛明慧1,2,王化敏1,2,胡瑞芹1,2,胡鹏1,2,吴智超1,2,陈良标1,2*
(1.上海海洋大学 水产与生命学院,上海 201306;2.水产种质资源发掘与利用教育部重点实验室,上海 201306)
摘要:为进一步研究肌间骨(intermuscular bone)发育的分子机制,利用CRISPR/Cas9打靶技术、茜素红染色及实时荧光定量PCR方法,研究了斑马鱼(Danio rerio)Asb14a基因敲除后肌间骨的发育情况。结果表明:本研究中成功构建了插入2 bp和缺失50 bp的Asb14a基因敲除纯合斑马鱼品系;茜素红染色显示,成年Asb14a-/-突变体与野生斑马鱼相比,肌间骨数量显著减少了35%(P<0.000 1),说明敲除Asb14a基因会减少斑马鱼肌间骨的数量;实时荧光定量PCR结果显示,骨骼发育相关基因(bmp6、sp7、sox6、alpl、collala、sox6和smad1)在Asb14a-/-突变体中的表达水平发生了显著性变化,从分子角度验证了Asb14a基因与肌间骨发育间的关联性。研究表明,Asb14a基因参与了斑马鱼肌间骨发育,敲除该基因会影响斑马鱼肌间骨的生成,这一发现为进一步研究肌间骨发育的分子机制提供了重要线索。
关键词:斑马鱼;肌间骨;CRISPR/Cas9;Asb14a基因;纯合突变体
DOI:10.16535/j.cnki.dlhyxb.2023-173
文章编号:2095-1388(2024)02-0259-07
中图分类号:S 917.4
文献标志码:A
收稿日期:2023-07-25
基金项目:国家自然科学基金重点项目(32130109);国家重点研发计划项目(2022YFD2400800)
作者简介:牛明慧(1997—),女,硕士研究生。 E-mail:niumh2023@163.com
通信作者:陈良标(1966—),男,博士,教授。 E-mail:lbchen@shou.edu.cn
肌间骨(intermuscular bone),又称肌间刺、肌间小骨或肌隔内骨,是位于椎骨左右两侧肌间隔中的膜性硬骨[1]。淡水养殖主流品种青鱼、草鱼、鲢和鲫等鲤科鱼类中肌间骨较多,易造成食用者窒息风险。国内外对鱼类肌间骨的早期研究大多集中在形态学描述上[2-5],近年来,学者们对肌间骨的形成机理、演化规律和发育分子机制等方面的研究逐渐增多[6-7]。肌间骨的发育涉及间充质细胞、骨原细胞、成骨细胞和骨细胞等细胞,以及间充质基质、结缔组织膜、类骨质、骨质和骨化点等多种微环境[8]。目前,关于硬骨鱼类中肌间骨的研究已取得一些进展,如Nie等[7]通过单细胞转录组分析孵化后60 d野生型斑马鱼的肌肉间组织,利用CRISPR-Cas9技术对可能的关键基因进行验证,结果发现,runx2b缺失的斑马鱼完全失去了肌间骨;Xu等[9]通过敲除bmp6基因构建了两种类型的斑马鱼突变体(完全失去肌间骨和部分失去肌间骨的突变体)并进行转录组分析,结果表明,bmp6基因缺失抑制了肌间骨的形成。但有关肌间骨具体发育分子机制尚未完全清晰,有待进一步研究。
Asb14a是含锚蛋白重复序列和细胞因子信号抑制物盒蛋白家族的成员,其编码的蛋白由423个氨基酸组成且具有1个SOCS-box结构域和5个Ankyrin重复序列。已有研究表明,该家族成员包含两个功能域,即发生特异性蛋白-蛋白相互作用的锚蛋白重复区和SOCS(细胞因子信号传导的抑制因子)盒区[10],并参与多种生物学过程,包括细胞生长[11]、组织发育[12]、骨骼肌膜蛋白形成[13]、泛素蛋白解体及胰岛素信号转导[14]。研究表明,Asb14a在骨骼肌生成和肌肉代谢中发挥作用[15],参与蛋白质泛素化调节[16]。而肌间骨的发育涉及肌肉、结缔组织和血液等多种组织,且有学者推断,肌间骨长度差异与肌肉的分布间存在密切联系[17-18]。因此推测,Asb14a基因可能参与肌间骨的发生和发育。
斑马鱼(Danio rerio)作为一种模式动物,被广泛应用于遗传学、发育生物学研究。本研究中,利用CRISPR/Cas9技术[19-20]敲除斑马鱼Asb14a基因,对敲除基因后的F0代、F1代和F2代突变体进行筛选,成功获得Asb14a基因敲除的斑马鱼品系,并探究了该基因在斑马鱼肌间骨发育中的作用,以期为培育出更多无肌间骨的鱼类提供科学参考。
1 材料与方法
1.1 材料
试验用AB 品系野生斑马鱼购自中国科学院遗传与发育生物学研究所,斑马鱼饲养在上海海洋大学水产种质资源发掘与利用教育部重点实验室循环系统中。 Premix Taq 酶(RR901)购自TaKaRa公司;gRNA 体外转录试剂盒(AM1314)购自Ambion公司;Cas9 蛋白(Z03389-100)购自金斯瑞公司;T7E1内切酶(M0302S)购自 NEB 公司;反转录试剂盒(RR047A)购自TaKaRa公司。
1.2 方法
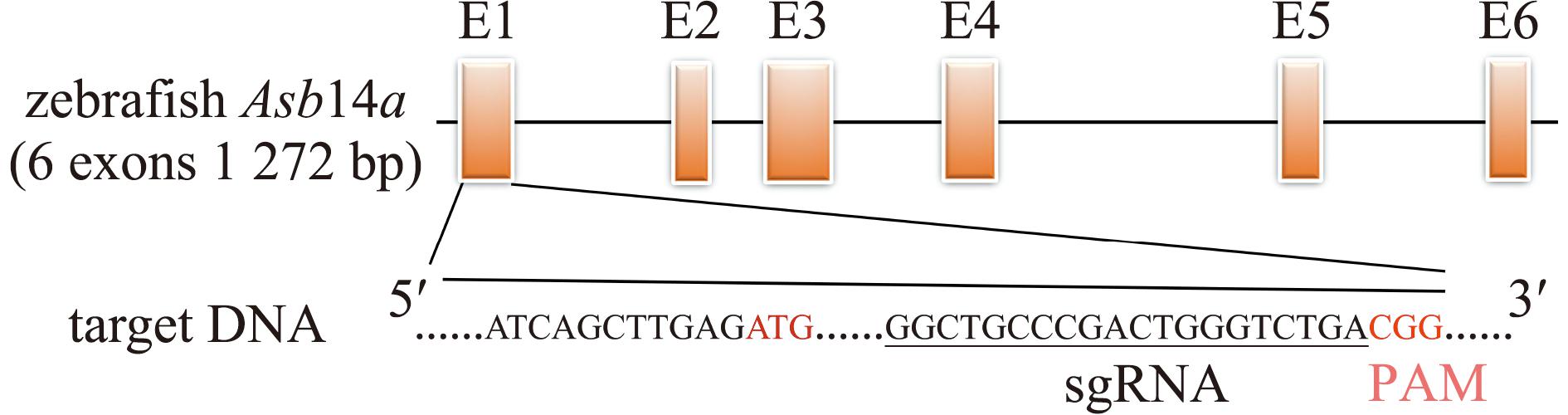
1.2.1 敲除靶点及检测引物的设计 由NCBI(http://www.ncbi.nlm.nih.gov/)网站获得斑马鱼Asb14a基因的DNA、mRNA、氨基酸及外显子序列,已知该基因位于斑马鱼11号染色体,含有1个转录本和6个外显子。基于CRISPR/Cas9基因编辑靶位点设计原则[21],通过ZiFiT(http://zifit.partners. org/ZiFiT/)网站设计靶点,在NCBI (https://blast. ncbi.nlm.nih.gov/Blast.cgi)网站上进行Blast比对,检测靶点的特异性,最后获得位于第一个外显子上的特异性靶点序列(5′GGCTGCCCGACTGGGTCTGA 3′),距翻译起始点71 bp。将含有靶点序列的Asb14a基因组序列输入到Primer软件中,在靠近靶点位置设计上、下游引物(表1)。
表1 试验所用引物及其序列
Tab.1 Primers and sequences used in this study

引物primer序列(5'-3')sequence(5'-3')用途usageAsb14a-IF:TAATACGACTCACTATAGGCTGC-CCGACTGGGTCTGAlGTTT-TAGAGCTAGAAATAGCgRNA模板扩增R:AAAAAAAGCACCGACTCGGTGC-CACAsb14aF:AGCCATCAGAAACAATCAGC鉴定引物R:AAGGAATCATTCTGCCCTGTBmp6F:TTCCCGGTCTACAGGCAAACqRT-PCRR:TAATCCAGTCCTGCCAGCTCrunx2bF:CGGCTCCTACCAGTTCTCCAqRT-PCRR:CCATCTCCCTCCACTCCTCCsp7F:CGGGAGGTCTTCTTGCGATTqRT-PCRR:TTTACCGTACACCTTCCCGCsox6F:CCTGGCTCAAGTCAAGGAGGqRT-PCRR:TCCGATGGGACTGGGTATGTalplF:GGACTTTGCTCAACGCTCACqRT-PCRR:AGGAACACCCATCCCATCTCcol1a1aF:ACTTGCGTCAACCCAACTGAqRT-PCRR:GAACTGGAAGCCATCGGTCAsmad1F:CTTCCGTAACCCACTCCACCqRT-PCRR:GATCTGAGCTGGATGGCGAAβ-actinF:GACAACGGCTCCGGTATGqRT-PCRR:CATGCCAACCATCACTCC
1.2.2 gRNA的制备 在设计好的靶点序列前端添加T7启动子,靶点后添加gRNA骨架上游序列。利用Asb14a基因上、下游引物Asb14a-I(表1),以pUC19-scaffold质粒为模板进行PCR扩增。将扩增后得到的序列PCR产物纯化,纯化产物经体外转录即得gRNA,保存于-80 ℃超低温冰箱中备用。
1.2.3 显微注射及基因敲除检测 收集斑马鱼Ⅰ细胞期胚胎,将提前混合好的Cas9蛋白(800 ng/μL)和gRNA(100 ng/μL)一同用显微注射仪注射到胚胎中,每次注射1 nL。同时收集同一缸斑马鱼所产胚胎作为对照(记为“野生型”,WT)。48 h后,各取20枚注射后的胚胎及WT胚胎通过碱裂解法提取基因组DNA,并使用Asb14a-F和Asb14a-R引物进行PCR扩增,目的片段大小约531 bp。对PCR产物进行T7E1酶切试验和Sanger测序,检测基因敲除的效果,若自靶点处起出现套峰,则说明基因敲除成功。将敲除成功的同一批显微注射胚胎饲养至成鱼。
1.2.4 突变体的筛选 胚胎有效性检测为阳性后,将该批斑马鱼养至性成熟,剪取单个斑马鱼的少许尾鳍提取基因组DNA,经PCR扩增、DNA测序,测序结果为双峰的突变个体即F0代。将F0代与WT杂交,获得F1代。F1代饲养至两个月,通过剪尾鳍提取基因组DNA,对PCR产物进行T7E1酶切试验和Sanger测序分析,筛选可稳定遗传的F1代。将缺失相同基因片段的F1代内交,采用与F1代类似的检测方式,筛选出F2代纯合突变体。
1.2.5 发育统计 选取Asb14a-/-突变体和WT斑马鱼胚胎各200粒,置于0.1 mg/g亚甲基蓝胚胎水中,放入28 ℃恒温培养箱中培养。观察胚胎在不同发育时期[0.75 hpf (hour post fertilization)合子期、2.25 hpf卵裂期、5.25 hpf囊胚期、10 hpf原肠期、24 hpf体节期、48 hpf咽囊期和72 hpf孵化期] 的发育情况,并统计胚胎发育死亡率。
1.2.6 茜素红染色 分别取20 尾Asb14a-/-突变体和WT斑马鱼成鱼,用体积分数为4%的PFA溶液浸泡过夜;使用体积分数为50%的乙醇浸泡1 h;随后用ddH2O清洗3次,每次20 min;之后进行胰蛋白酶消化;待鱼体可见清晰骨骼,加入0.1 g/L茜素红溶液浸泡过夜(按2 mL/尾的量加入);将染色完成后的斑马鱼置入甘油中保存,在体视荧光显微镜下观察,统计肌间骨数量。
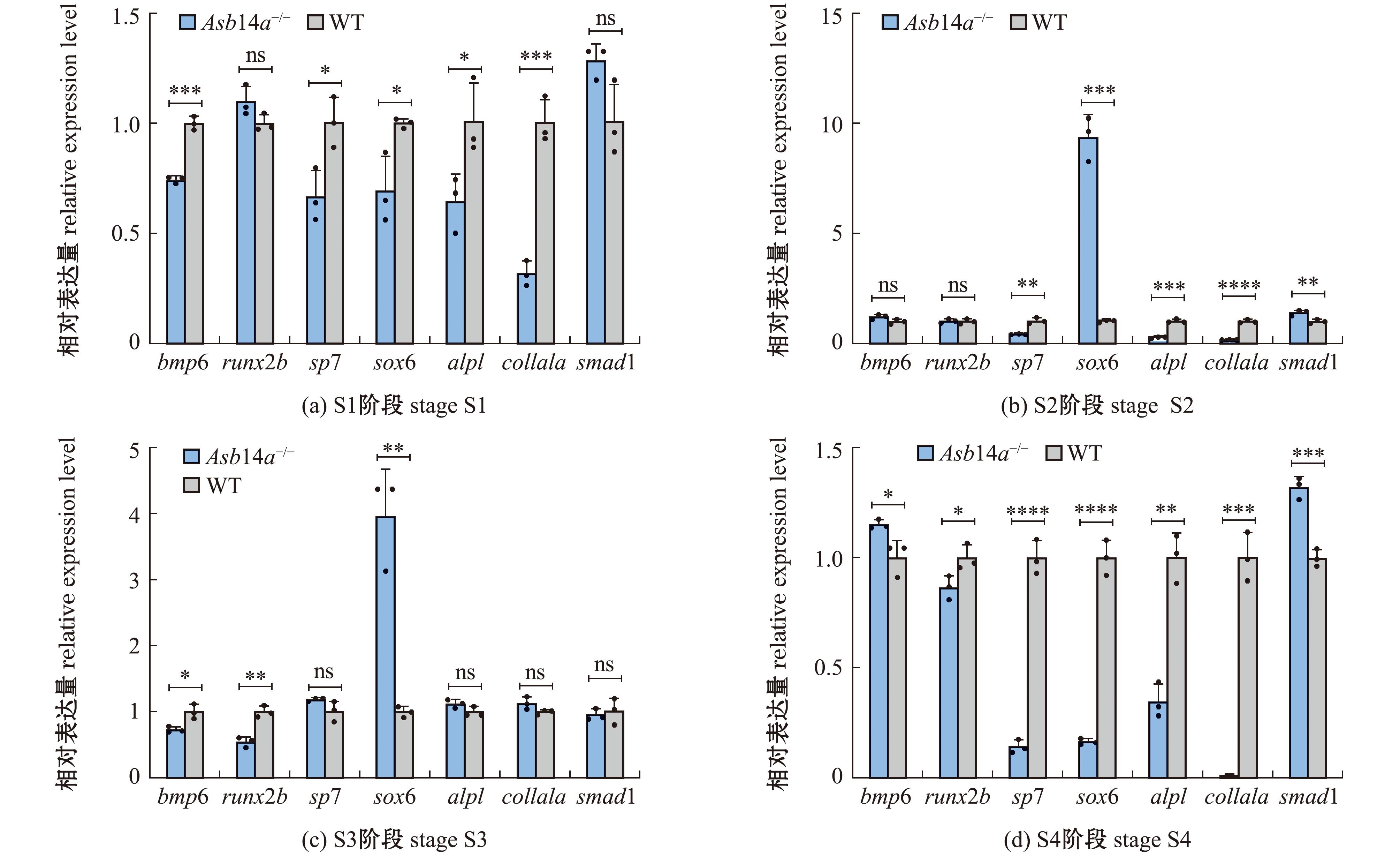
1.2.7 实时荧光定量PCR 斑马鱼肌间骨的骨化过程可分为4个发展阶段[22]:S1阶段,肌间骨尚未出现,大约为受精后360 h;S2阶段,少量肌间骨已开始骨化,大约为受精后720 h;S3阶段,肌间骨骨化并迅速出现,大约为受精后1 080 h;S4阶段,所有肌间骨均显示出成熟的形态,大约为受精后1 440 h。按照斑马鱼肌间骨发育的不同阶段,采集Asb14a-/-突变体和WT斑马鱼肌间骨组织,每个时期取3个平行样品。按照TRIZOL Reagent试剂盒的RNA提取说明提取样品中RNA,并对RNA样品进行去基因组的反转录试验,得到cDNA模板。利用Primer软件设计引物[23](表1),以斑马鱼肌间骨发育不同阶段获得的cDNA样品为模板,采用TransStart® Green qPCR SuperMix试剂盒 (北京全式金生物技术股份有限公司)在CFX96荧光反应体系为20 μL。反应程序:94 ℃下预变性30 s;94 ℃下变性 5 s,60 ℃ 下退火复性30 s,共进行40个循环。同时以斑马鱼actin为内参,每个样品设置3次重复,使用2-ΔΔCt方法计算斑马鱼肌间骨不同发育时期骨骼发育相关基因的相对表达量。
1.3 数据处理
采用GraphPad Prism 8 软件进行单因素方差分析(one-way ANOVA),显著性水平设为0.05。
2 结果与分析
2.1 靶点gRNA的鉴定
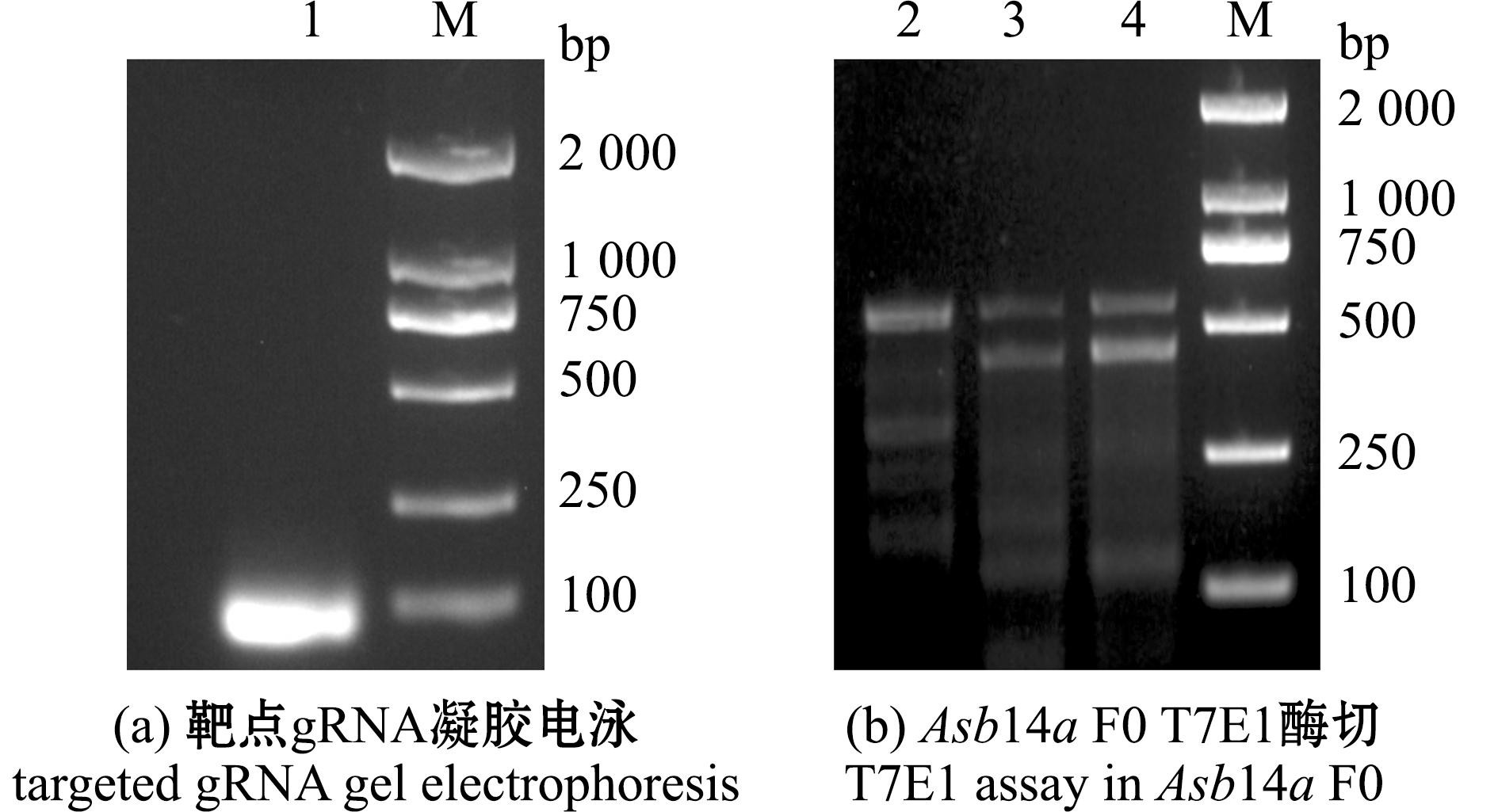
在Asb14a基因的第1个外显子上设计敲除靶点(图1),并将靶点gRNA进行体外转录。用20 g/L琼脂糖凝胶电泳后显示,条带大小正确且质量良好、无降解(图2(a)),表明成功制备出gRNA。
2.2 F0代敲除效率检测
对PCR产物使用T7E1酶进行酶切试验,结果显示,WT胚胎仅有1个条带,而注射的胚胎被切成2个条带(图2(b)),说明敲除靶点有效,且敲除效率较高。
2.3 Asb14a-/-纯合突变体的获得
将基因敲除成功的F0代胚胎饲养至性成熟,与注射时所用的WT对照进行外交,获得F1代,对F1代进行Sanger测序,筛选出突变类型为插入2 bp和缺失了50 bp类型的 F1代突变体。同种突变类型的F1代内交,获得F2代。通过Sanger测序,确定获得了插入2 bp和缺失了50 bp的Asb14a基因敲除纯合斑马鱼品系(图3),由于同一时期获得的Asb14a-/--50 bp突变体数量较少,在后续的试验中仅使用Asb14a-/-+2 bp突变体。
2.4 胚胎发育死亡统计
按照斑马鱼胚胎发育时期对Asb14a-/-突变体和WT斑马鱼在3 d内的胚胎发育情况进行观察和统计,结果显示,Asb14a-/-突变体的胚胎发育死亡数量和WT相比无显著性差异(P>0.05)(图4)。
2.5 成鱼生长及骨骼染色观察
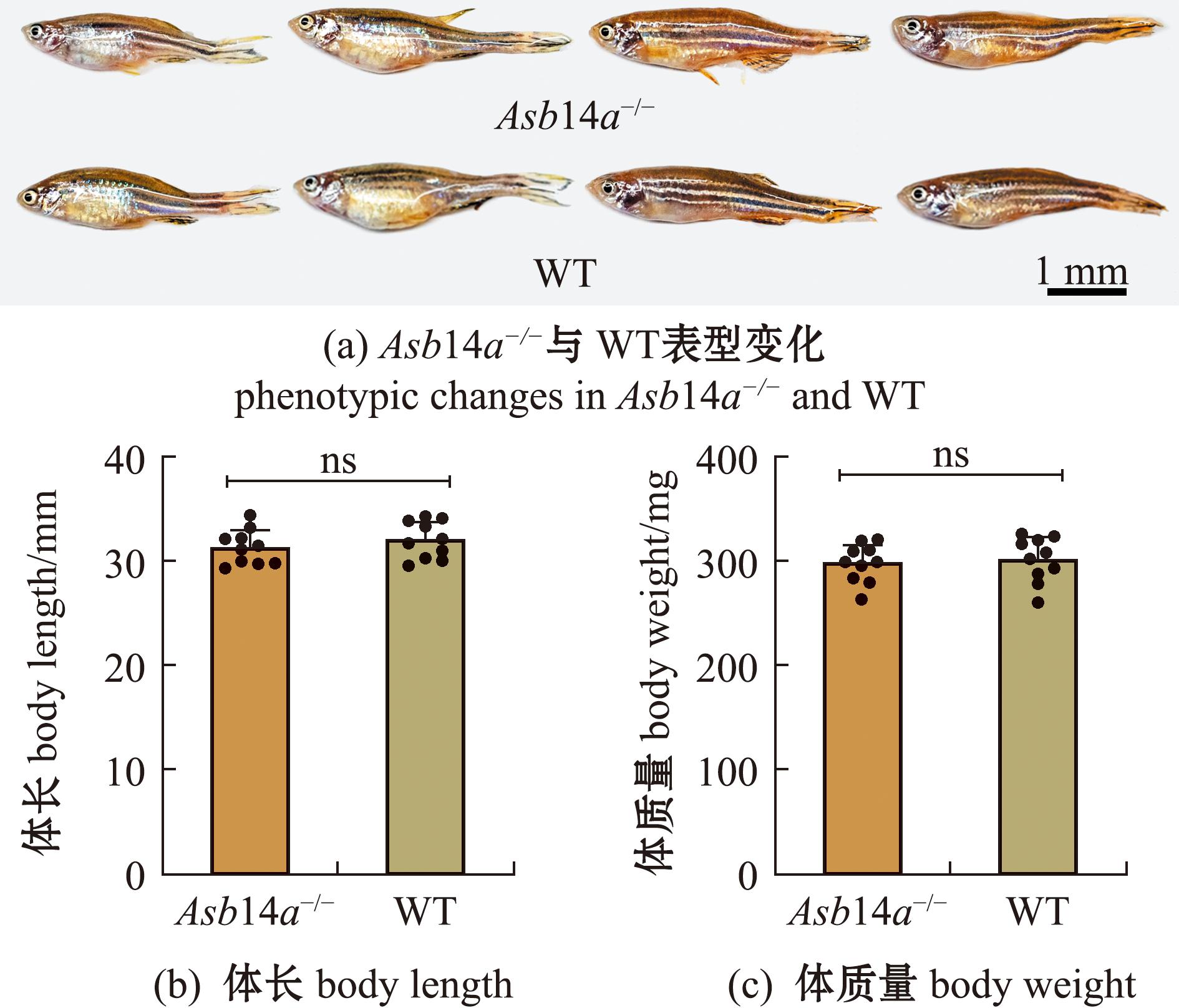
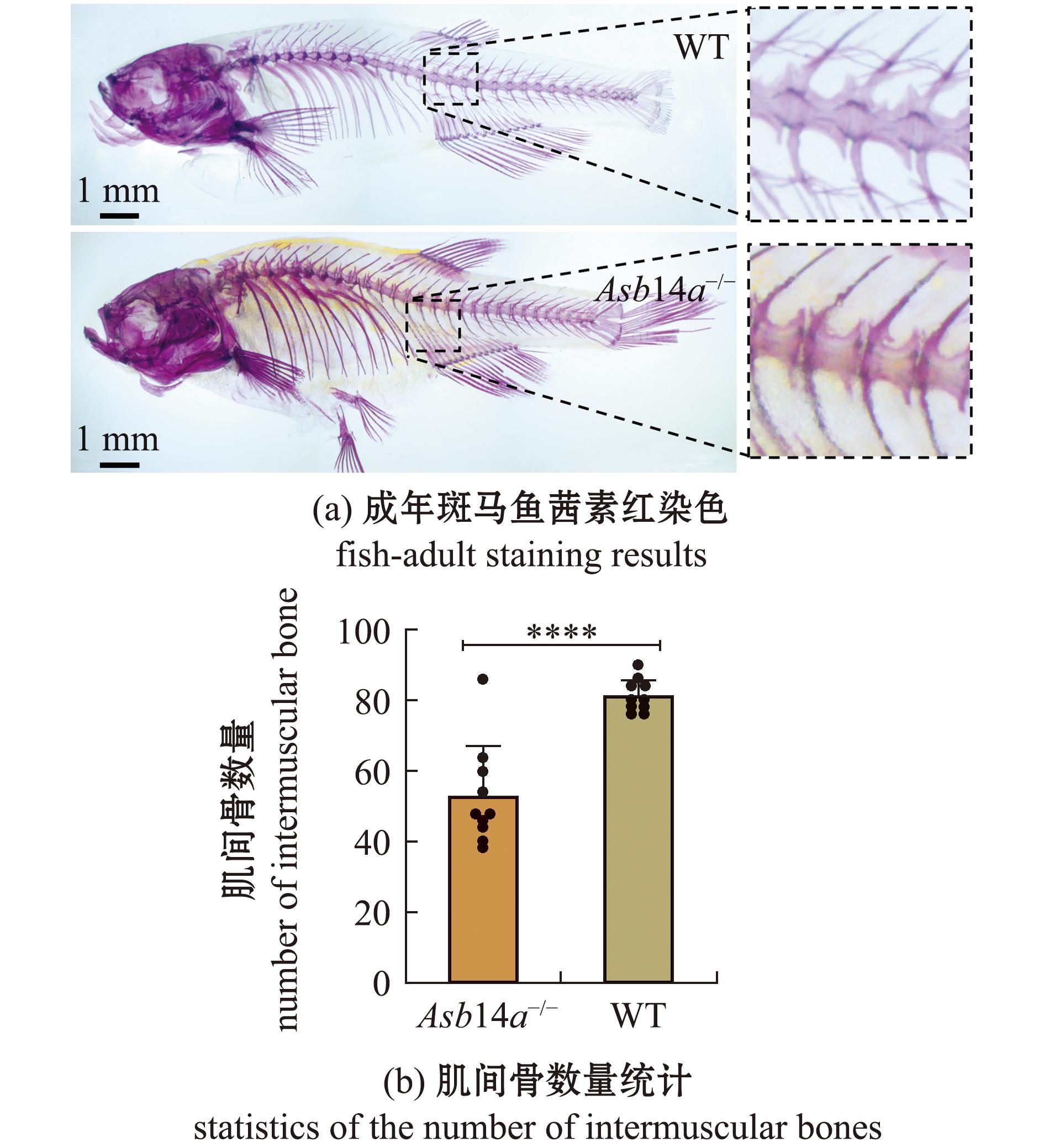
Asb14a-/-突变体的表型、体长和体质量与WT斑马鱼并无明显变化(图5)。随机选取20尾Asb14a-/-突变体和WT斑马鱼进行茜素红染色,结果显示,Asb14a-/-突变体肌间骨数量较WT斑马鱼明显减少,减少了约35%(P<0.000 1)(图6)。
2.6 肌间骨不同发育时期骨骼发育相关基因相对表达水平的变化
从图7可见:S1阶段,Asb14a-/-突变体中bmp6、sp7、sox6、alpl和collala基因表达量均显著低于WT斑马鱼(P<0.05);S2阶段,Asb14a-/-突变体中sox6和smad1基因表达量显著高于WT斑马鱼(P<0.01),而sp7、alpl和collala基因表达量均极显著低于WT斑马鱼(P<0.01);S3阶段,Asb14a-/-突变体中sox6基因表达量极显著高于WT斑马鱼(P<0.01),而bmp6和runx2b基因表达量均显著低于WT斑马鱼(P<0.05);S4阶段,Asb14a-/-突变体中bmp6和smad1基因表达量显著高于WT斑马鱼(P<0.05),而其他基因表达量均显著低于WT斑马鱼(P<0.05)。
3 讨论
3.1 敲除Asb14a基因对斑马鱼肌间骨发育的影响
在中国淡水养殖业中,大多数鱼类物种是鲤形目鱼类[24],它们的背部和尾部肌肉组织中存在大量的肌间骨,影响食用口感和摄食安全,为此许多学者对肌间骨的发生和发育开展了研究。然而,肌间骨的形成是一个复杂的生物学过程[25],广泛地开展肌肉间骨骼发育所涉及的潜在分子机制和遗传途径研究,找到调节肌间骨发育形成的基因仍然是该领域研究的主要目标。本研究团队根据Asb14a基因在骨骼肌生成中的已知作用推测,该基因可能会影响肌间骨的发生和发育。本研究中,通过CRISPR/Cas9技术对斑马鱼进行了Asb14a基因的敲除试验,成功构建了Asb14a基因敲除的斑马鱼品系。本研究表明,敲除Asb14a基因可造成斑马鱼肌间骨数量显著减少,首次证明了Asb14a基因对斑马鱼肌间骨发育具有一定影响,这为进一步研究肌间骨的发生及发育奠定了基础。
3.2 敲除Asb14a基因对斑马鱼胚胎发育及体质量、体长和表型的影响
本研究表明,Asb14a-/-突变体与野生型斑马鱼的胚胎发育死亡数量相比并无明显变化,这说明Asb14a基因敲除可能不会影响斑马鱼整体胚胎发育,但该基因是否会引起细微结构、离子通道功能的改变目前尚不清楚。随后,本研究中测量了成年Asb14a-/-突变体和野生型斑马鱼的体长和体质量,并观察了个体表型,结果发现,Asb14a基因敲除会造成鱼类肌间骨数量减少,但并不影响鱼类正常的生长及表型发育。Nie等[7]通过敲除runx2b基因使斑马鱼肌间骨完全丧失,也未对斑马鱼生长造成明显的不利影响,与本研究结果在一定程度上保持一致。然而,鱼类肌间骨的减少可能会带来意想不到的后果和潜在的副作用,需要研究人员进行长期全面的调查。因此,关于敲除Asb14a基因对斑马鱼生长情况及表型等方面的影响,需要更加深入地观察和研究,以具体评估其对鱼类的影响。
3.3 敲除Asb14a基因对斑马鱼肌间骨发育分子机制的影响
本研究中,选取了部分与骨骼发育相关的基因对Asb14a-/-突变体和野生型斑马鱼进行了qRT-PCR检测,其中,bmp家族[26]、runx2b[27]转录因子对成骨细胞的分化和骨形成起着重要的调节作用;Osx(sp7)对成骨细胞分化和骨形成起着不可替代的作用[28];sox6作为转录因子,与调节哺乳动物胚胎中软骨形成、骨骼肌分化、少突胶质细胞分化、神经元分化及红细胞生成等许多发育分化有关,并被发现为软骨和骨骼形成所共同需要[29]。本研究表明,在Asb14a-/-突变体的大多数肌间骨发育时期,与骨骼发育相关的这7个基因相对表达水平发生了显著变化,从分子角度验证了Asb14a基因与骨骼发育间存在关联。处于肌间骨发育的不同阶段,sp7基因作为成骨细胞发育的标志基因,在Asb14a-/-突变体中的相对表达水平多低于对照组。由此推测,Asb14a基因敲除对成骨细胞的发育造成了影响,其具体影响机制有待进一步探究。runx2b基因在Asb14a-/-突变体中的相对表达水平多低于对照组,这一结果与已有文献结果一致[30],从一定角度佐证了runx2b调控成骨细胞标志基因sp7和collala。处于肌间骨发育的前3个阶段,bmp6基因在Asb14a-/-突变体中的相对表达水平显著低于对照组,却在S4阶段(所有肌间骨均显示出成熟的形态)出现了上调,这与前期的研究结论不符[9],推测可能是由于其他调控途径激活了bmp6基因的上调,补偿了runx2b和sp7基因的表达下调。sox6基因可以调控软骨形成,其相对表达水平在肌间骨发育的4个时期均发生了显著变化,推测原因是Asb14a基因敲除通过影响软骨细胞发育和分化,阻碍了成骨细胞的发育和分化,进而造成肌间骨数量减少。此外,大部分骨骼发育相关基因在S3阶段(肌间骨骨化并迅速出现)的相对表达水平趋势与其他阶段未保持完全一致,推测S3阶段可能是肌间骨发育的关键阶段。
4 结论
1)通过CRISPR/Cas9技术对斑马鱼进行了Asb14a基因的敲除试验,成功构建了能够稳定遗传的Asb14a基因敲除突变品系。
2)首次证明了Asb14a基因对斑马鱼肌间骨发育具有一定的影响作用。
3)敲除Asb14a基因会造成斑马鱼肌间骨数量减少,目前并不影响其正常的胚胎发育、生长及表型发育,但需要进行长期全面的观察和评估。本研究结果为进一步研究影响鱼类肌间骨发育的关键基因和分子机制提供了新的视角。
参考文献:
[1] PATTERSON C,JOHNSON G D.The intermuscular bones and ligaments of teleostean fishes[J].Smithsonian Contributions to Zoology,1995(559):1-83.
[2] 吕耀平,鲍宝龙,蒋燕,等.低等真骨鱼类肌间骨的比较分析[J].水产学报,2007,31(5):661-668. LÜ Y P,BAO B L,JIANG Y,et al.Comparative analysis of intermuscular bones in lower teleosts[J].Journal of Fisheries of China,2007,31(5):661-668.(in Chinese)
[3] 高维竞.草鱼的肌间骨(Os intermusculare)形态及其分布的研究[J].河北农业大学学报,1984,7(4):178-184. GAO W J.A study on the morphological and distribution of Os intermusculares of Ctenopharyngodon idellus[J].Journal of Agricultural University of Hebei,1984,7(4):178-184.(in Chinese)
[4] 马良骁,董在杰,苏胜彦,等.鱼类肌间刺的研究进展[J].江苏农业科学,2012,40(4):234-235,240. MA L X,DONG Z J,SU S Y,et al.Research progress of intermuscular spines in fish[J].Jiangsu Agricultural Sciences,2012,40(4):234-235,240.(in Chinese)
[5] 周晨晨,吕耀平,陈洁,等.低等真骨鱼类肌间小骨研究现状[J].丽水学院学报,2013,35(5):32-34. ZHOU C C,LÜ Y P,CHEN J,et al.Research status of lower teleosts’ intermuscular bone[J].Journal of Lishui University,2013,35(5):32-34.(in Chinese)
[6] NIE C H,WAN S M,CHEN Y L,et al.Loss of scleraxis leads to distinct reduction of mineralized intermuscular bone in zebrafish[J].Aquaculture and Fisheries,2021,6(2):169-177.
[7] NIE C H,WAN S M,CHEN Y L,et al.Single-cell transcriptomes and runx2b-/- mutants reveal the genetic signatures of intermuscular bone formation in zebrafish[J].National Science Review,2022,9(11):nwac152.
[8] 房连聪,李学军.低等真骨鱼类肌间骨发生的研究[J].水产科学,2013,32(12):749-752. FANG L C,LI X J.A review of research on intermuscular bone formation in lower teleosts[J].Fisheries Science,2013,32(12):749-752.(in Chinese)
[9] XU H,TONG G X,YAN T,et al.Transcriptomic analysis provides insights to reveal the bmp6 function related to the development of intermuscular bones in zebrafish[J].Frontiers in Cell and Developmental Biology,2022,10:821471.
[10] ANDRESEN C A,SMEDEGAARD S,SYLVESTERSEN K B,et al.Protein interaction screening for the ankyrin repeats and suppressor of cytokine signaling (SOCS) box (ASB) family identify Asb11 as a novel endoplasmic reticulum resident ubiquitin ligase[J].The Journal of Biological Chemistry,2014,289(4):2043-2054.
[11] BOENGLE R K,PIPP F,FERNANDEZ B,et al.The ankyrin repeat containing SOCS box protein 5:a novel protein associated with arteriogenesis[J].Biochemical and Biophysical Research Communications,2003,302(1):17-22.
[12] KILE B T,METCALF D,MIFSUD S,et al.Functional analysis of Asb-1 using genetic modification in mice[J].Molecular and Cellular Biology,2001,21(18):6189-6197.
[13] LAMBERT S,YU H,PRCHAL J T,et al.cDNA sequence for human erythrocyte ankyrin[J].Proceedings of the National Academy of Sciences of the United States of America,1990,87(5):1730-1734.
[14] WILCOX A,KATSANAKIS K D,BHEDA F,et al.Asb6,an adipocyte-specific ankyrin and SOCS box protein,interacts with APS to enable recruitment of elongins B and C to the insulin receptor signaling complex[J].The Journal of Biological Chemistry,2004,279(37):38881-38888.
[15] SPURLOCK D M,MCDANELD T G,MCINTYRE L M.Changes in skeletal muscle gene expression following clenbuterol administration[J].BMC Genomics,2006,7:320.
[16] WANG C,YANG H H,GAO C Y.Potential biomarkers for heart failure[J].Journal of Cellular Physiology,2019,234(6):9467-9474.
[17] 王静,张俏,赵琼,等.合方鲫肌间骨骨化过程及形态学观察[J].湖南师范大学自然科学学报,2017,40(2):39-43. WANG J,ZHANG Q,ZHAO Q,et al.Ossification process and morphology of intermuscular bones in hybrids crucian carp[J].Journal of Natural Science of Hunan Normal University,2017,40(2):39-43.(in Chinese)
[18] 万世明,易少奎,仲嘉,等.团头鲂肌间骨发育的形态学观察[J].水生生物学报,2014,38(6):1143-1151. WAN S M,YI S K,ZHONG J,et al.Developmental and morphological observation of intermuscular bones in Megalobrama amblycephala[J].Acta Hydrobiologica Sinica,2014,38(6):1143-1151.(in Chinese)
[19] 孟琳,陈良标.CRISPR/Cas9技术敲除hbae1.1基因对斑马鱼血红蛋白生成的影响[J].生物学杂志,2021,38(5):12-16. MENG L,CHEN L B.The effect of hbae1.1 gene on hemoglobin production in zebrafish knocked out by CRISPR/Cas9[J].Journal of Biology,2021,38(5):12-16.(in Chinese)
[20] AUER T O,DEL BENE F.CRISPR/Cas9 and TALEN-mediated knock-in approaches in zebrafish[J].Methods,2014,69(2):142-150.
[21] 李石竹,方文宇,骆明飞,等.黄颡鱼GnRHR基因的克隆和表达及CRISPR/Cas9构建GnRHR基因敲除突变体[J].大连海洋大学学报,2021,36(3):383-392. LI S Z,FANG W Y,LUO M F,et al.Molecular cloning,and expression of GnRHR gene and establishment of GnRHR mutant by CRISPR/Cas9 in yellow catfish Pelteobagrus fulvidraco[J].Journal of Dalian Ocean University,2021,36(3):383-392.(in Chinese)
[22] 聂春红,陈祖萱,戴彩娇,等.不同鱼类肌间骨的骨化模式研究[J].水生生物学报,2018,42(1):131-137. NIE C H,CHEN Z X,DAI C J,et al.Ossification patterns of intermuscular bones in different fish species[J].Acta Hydrobiologica Sinica,2018,42(1):131-137.(in Chinese)
[23] 杨笑星,佟广香,闫婷,等.Cilp基因对斑马鱼肌间骨和脊椎发育的影响[J].上海海洋大学学报,2023,32(3):460-471. YANG X X,TONG G X,YAN T,et al.The effect of cilp on the development of the intermuscular bones and vertebra in zebrafish[J]. Journal of Shanghai Ocean University,2023,32(3):460-471. (in Chinese)
[24] NIE C H,WAN S M,LIU Y L,et al.Development of teleost intermuscular bones undergoing intramembranous ossification based on histological-transcriptomic-proteomic data[J].International Journal of Molecular Sciences,2019,20(19):4698.
[25] 李志,周莉,王忠卫,等.异育银鲫A+系和F系肌间骨的比较分析[J].水生生物学报,2017,41(4):860-869. LI Z,ZHOU L,WANG Z W,et al.Comparative analysis of intermuscular bones between clone A+ and clone F strains of allogynogenetic gibel carp[J].Acta Hydrobiologica Sinica,2017,41(4):860-869.(in Chinese)
[26] 车家驹,金旭红,戴涛.BMP在BMSC成骨、软骨分化中作用及机制的研究进展[J].山东医药,2020,60(16):99-101. CHE J J,JIN X H,DAI T.Research progress on the role and mechanism of BMP in BMSC osteogenesis and cartilage differentiation[J].Shandong Medical Journal,2020,60(16):99-101.(in Chinese)
[27] CAETANO-LOPES J,CANH O H,FONSECA J E.Osteoblasts and bone formation[J].Acta Reumatologica Portuguesa,2007,32(2):103-110.
O H,FONSECA J E.Osteoblasts and bone formation[J].Acta Reumatologica Portuguesa,2007,32(2):103-110.
[28] CHEN G Q,DENG C X,LI Y P.TGF-β and BMP signaling in osteoblast differentiation and bone formation[J].International Journal of Biological Sciences,2012,8(2):272-288.
[29] KONG H Y.Characterisation of sox6 function in zebrafish using mutant alleles generated by Zinc Finger Nuclease (ZFN)-mediated targeted mutagenesis[D].Singapore:Nanyang Technological University,2012. http://hdl.handle.net/10356/49908.
[30] CHEN Z J,SONG Z Y,YANG J J,et al.Sp7/osterix positively regulates dlx2b and bglap to affect tooth development and bone mineralization in zebrafish larvae[J].Journal of Biosciences,2019,44(6):127.
Role of Asb14a gene in intermuscular bone development in zebrafish (Danio rerio)
NIU Minghui1,2,WANG Huamin1,2,HU Ruiqin1,2,HU Peng1,2,WU Zhichao1,2,CHEN Liangbiao1,2*
(1.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China;2.Key Laboratory of Aquatic Germplasm Resources Exploration and Utilization,Ministry of Education,Shanghai 201306,China)
Abstract: In order to further probe the molecular mechanism of intermuscular bone development, the development of intermuscular bone was investigated in zebrafish (Danio rerio) in which Asb14a gene was knockouted by CRISPR/Cas9 targeting technology, alizarin red staining and real-time fluorescence quantitative PCR. The results showed that the homozygous zebrafish lines with 2 bp insertion and 50 bp deletion of Asb14a gene were successfully constructed in present study. Alizarin red staining test indicated that the number of intermuscular bones in adult Asb14a-/- mutants was found to be decreased by 35% compared with wild zebrafish (P<0.000 1), implying that the knockout of Asb14a gene affected the formation of intermuscular bones in zebrafish. Real-time PCR analysis revealed that the expression levels of most bone development-related genes (bmp6, sp7, sox6, alpl, collala, sox6 and smad1) in Asb14a-/-mutants were changed significantly, verifying the association between Asb14a gene and intermuscular bone development from a molecular perspective. The findings indicate that Asb14a gene plays an important role in the development of intermuscular bone in zebrafish. This discovery provides crucial clues for further investigating the molecular mechanisms underlying the development of intermuscular bones.
Key words: Danio rerio; intermuscular bone; CRISPR/Cas9; Asb14a gene; homozygous mutant



 O H,FONSECA J E.Osteoblasts and bone formation[J].Acta Reumatologica Portuguesa,2007,32(2):103-110.
O H,FONSECA J E.Osteoblasts and bone formation[J].Acta Reumatologica Portuguesa,2007,32(2):103-110.