急性低盐胁迫对绿鳍马面鲀幼鱼存活、鳃组织结构及肝脏抗氧化能力的影响
陈莹1,2,李凤辉2,张广明3,边力2,陈四清2,张子阳2,张宇傲2,严俊丽3*
(1.上海海洋大学 水产与生命学院,上海 201306;2.中国水产科学研究院黄海水产研究所,山东 青岛 266071;3.山东畜牧兽医职业学院,山东 潍坊 261061)
摘要:为揭示绿鳍马面鲀(Thamnaconus septentrionalis)幼鱼在低盐胁迫下的生理生化响应机制,试验设置3个盐度处理组(盐度15、20、25)和1个空白对照组(盐度30),对体质量为(20±5) g的绿鳍马面鲀幼鱼进行为期96 h的低盐胁迫试验,分别于胁迫试验后的24、48、72、96 h对幼鱼进行相关组织采样,分析急性低盐胁迫对绿鳍马面鲀幼鱼存活、鳃组织结构、鳃丝Na+/K+-ATP酶活性和肝脏抗氧化能力的影响。结果表明:在25~30盐度下,绿鳍马面鲀幼鱼的存活不受盐度影响,盐度小于20时对幼鱼存活有显著性影响(P<0.05),幼鱼在胁迫时间为24、48、72、96 h时所对应的低盐半致死盐度(LC50)分别为5.649、7.058、10.041和10.260;与对照组(盐度30)相比,25盐度组幼鱼鳃组织出现轻微鳃小片弯曲、末端膨大和细胞空泡化等现象,20、15盐度组鳃组织则出现不同程度的鳃小片弯曲粗大、不规则排列、基部增生与融合、线粒体丰富细胞增多、细胞空泡化和上皮细胞破裂等现象;20、15盐度组幼鱼鳃丝Na+/K+-ATP酶活性和肝脏抗氧化能力显著高于对照组(P<0.05),酶活生化指标大多在72 h时达到最高,在96 h时降低,除谷胱甘肽过氧化物酶(GSH-PX)活性、抗超氧阴离子能力和抑制羟自由基能力外,25盐度组的其他抗氧化酶活性在96 h时与对照组无显著性差异(P>0.05)。研究表明,盐度为25~30时适宜绿鳍马面鲀幼鱼生活,盐度小于25时,幼鱼机体会发生一系列应激反应,幼鱼鳃组织结构产生不同程度的适应性变化,在低盐胁迫下幼鱼有一定的自我调节能力。
关键词:低盐胁迫;绿鳍马面鲀;鳃组织结构;抗氧化能力
DOI:10.16535/j.cnki.dlhyxb.2023-205
文章编号:2095-1388(2024)02-0250-09
中图分类号:S 965.399
文献标志码:A
收稿日期:2023-09-20
基金项目:山东畜牧兽医职业学院2022年校级科研课题(2022zrkxyb016);中国水产科学研究院黄海水产研究所基本科研业务费资助(20603022022014);烟台市科技创新发展计划项目(2022XCZX078);福建省区域发展项目(2022N3015)
作者简介:陈莹(1998—),女,硕士研究生。E-mail:13155031583@163.com
通信作者:严俊丽(1990—),女,讲师。E-mail:yanjunli@sdmy.edu.cn
绿鳍马面鲀(Thamnaconus septentrionalis)隶属于鲀形目(Tetraodontiformes)单角鲀科(Monacanthidae)马面鲀属(Thamnaconus),是外海50~120 m近底层洄游性鱼类,主要分布在中国的东海、黄海、渤海及日本沿海等水域,幼鱼可存活盐度为10~45。20世纪70年代,绿鳍马面鲀捕捞量在一段时间内仅次于带鱼,成为中国第二大传统捕捞产品,其肉质细腻、营养丰富,深受广大消费者喜爱[1]。20世纪90年代以来,由于过度捕捞和环境恶化等因素,绿鳍马面鲀的渔获量显著下降,已不能满足市场需求[2-3],种质退化问题也严重制约了绿鳍马面鲀养殖业的可持续健康发展[4]。为此,绿鳍马面鲀逐渐受到广泛关注,并在中国沿海开展了育苗和养殖技术研究,形成了近万吨的养殖规模,其养殖模式有工厂化养殖、池塘养殖和网箱养殖,由于暴雨、河川径流等自然因素的存在,网箱养殖易遭遇盐度变化带来的损害。此外,绿鳍马面鲀已经实现了南北接力养殖模式,不同海域的盐度各有差异,异地养殖中的盐度差异会导致幼鱼死亡率升高、免疫力降低,极大地限制了绿鳍马面鲀的养殖推广。但目前有关绿鳍马面鲀盐度胁迫的研究甚少。因此,研究低盐胁迫对绿鳍马面鲀生理生化调控机制的影响,对开展该鱼异地增养殖、调控养殖水质和选育耐盐品种尤为重要。
盐度作为水生生物重要的环境因子之一,显著影响鱼类的存活、生长、代谢及免疫能力[5-7]。此外,盐度变化还会引起鱼类机体渗透压的改变,Na+/K+-ATP酶是细胞膜中一种可分解ATP获得能量的蛋白质,可作为渗透压调节的重要指标[8]。低盐胁迫会引起鱼类机体产生大量活性氧(ROS),发生氧化应激反应[9-10]。为了清除活性氧ROS,使其维持正常水平,保护鱼类机体免遭伤害[11-12],鱼体肝脏超氧化物歧化酶(SOD)等会做出相应变化。本试验中,研究了低盐胁迫对绿鳍马面鲀幼鱼存活、鳃组织结构、Na+/K+-ATP酶活性及肝脏抗氧化能力的影响,以期为绿鳍马面鲀在低盐胁迫下生理生化响应机制的研究,异地运输、异地养殖相关问题的解决及耐盐品种的选育等提供理论依据。
1 材料与方法
1.1 材料
本试验于2022年10月25日—2022年11月25日在烟台市天源水产有限公司进行,试验用鱼为人工繁殖培育的绿鳍马面鲀幼鱼,其体质健康且活力良好,体长为(10±2)cm,体质量为(20±5)g。将幼鱼暂养于直径60 cm、容量136 L的塑料桶中,一周后进行低盐胁迫试验。暂养期间,海水温度控制在(16±0.2)℃,盐度为30,溶解氧(DO)为7 mg/L,pH为8.0±0.1。每天8:00、17:00投喂饲料,投喂结束后捞出残饵,每天吸底、换水一次,连续充气。
低盐度海水用自然海水与淡水调配,调配的海水盐度用盐度计校正确认。
1.2 方法
1.2.1 试验设计 试验前先进行多盐度梯度预试验,预试验设置6个盐度处理组(25、20、15、10、5、0)和1个对照组(自然海水,盐度30),养殖管理与幼鱼暂养期间相同。预试验时,发现死鱼及时捞出,并记录绿鳍马面鲀幼鱼在试验期间的死亡时间和死亡数,统计绿鳍马面鲀幼鱼在不同时间段(24、48、72、96 h)内的死亡率,利用累计死亡率,通过直线内插法得到线性回归方程,求得各时间点的低盐半致死盐度(LC50)。
正式试验时,从暂养试验桶中挑选健康且活力良好的绿鳍马面鲀幼鱼,直接放入调配好的盐度组中,进行为期96 h的低盐胁迫试验。根据预试验结果,本试验设计1个空白对照组(盐度30)和3个盐度处理组(盐度25、20、15),每组设置3个平行,每个平行放10尾规格相近的幼鱼。饲养管理与幼鱼暂养期间相同。
1.2.2 样品采集 分别于低盐胁迫后24、48、72、96 h时对绿鳍马面鲀幼鱼进行相关组织采样,用于组织切片观察和免疫物质活性测定,每组随机取3尾鱼,用质量浓度为50 mg/L的MS-222进行麻醉后解剖,采样全程在灭菌操作台冰上进行。
1.2.3 鳃组织切片观察 将鳃组织用0.9%(质量分数,下同)的生理盐水清洗后放入波恩氏液中固定24 h,再用不同浓度的乙醇对鳃组织进行脱水,脱水后先浸入二甲苯与乙醇混合液(体积比为1∶1)中,再浸入纯二甲苯溶液中直至鳃组织透明为止,然后将组织进行浸蜡和包埋,使用切片机连续切片,厚度为6 μm,经烤片和二甲苯脱蜡后用苏木精-伊红染色,中性树胶封片,显微镜观察成像。
1.2.4 免疫物质活性测定 将肝、鳃组织取出并用0.9%的生理盐水冲洗干净,以质量 (g)与体积 (cm3) 比为1∶9的比例加入9倍体积的预冷生理盐水,研磨成10%的组织匀浆,在4 ℃条件下以3 500 r/min离心10 min,用移液枪吸取上清液,于-80 ℃超低温冰箱中保存。获得质量分数为10%的肝脏、鳃组织匀浆,分别用于鳃丝Na+/K+-ATP酶活性,以及肝脏超氧化物歧化酶活性、过氧化氢酶(CAT)活性、谷胱甘肽过氧化物酶(GSH-PX)活性、丙二醛(MDA)含量、抗超氧阴离子能力及抑制羟自由基能力的测定,测定试剂盒均购自建成(南京)生物工程研究所,测定步骤按说明书进行。
1.3 数据处理
试验数据采用Excel 2019和SPSS 20.0软件进行处理,对试验数据进行单因素方差分析(one-way ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05,采用Excel 2019软件作图。
2 结果与分析
2.1 低盐胁迫下绿鳍马面鲀幼鱼的存活情况
从表1可见:对照组和25盐度组无幼鱼死亡情况;20盐度组在低盐胁迫72 h时出现死亡,其死亡率显著高于25盐度组(P<0.05);15、10、5、0盐度组在低盐胁迫24 h时出现死亡,其死亡率显著高于20盐度组(P<0.05);绿鳍马面鲀幼鱼在低盐胁迫24、48、72、96 h时对应的半致死盐度LC50分别为5.649、7.058、10.041和10.260,随着胁迫时间的延长,幼鱼的LC50呈逐渐升高的趋势。
表1 低盐胁迫下幼鱼死亡率的变化(n=30)
Tab.1 Effects of low salt stress on the mortality of juvenile Thamnaconus septentrionalis(n=30)

时间/htime盐度salinity累计死亡数/ind.cumulative death累计死亡率/%cumulative mortality半致死盐度 (LC50)median lethal salinity30(对照)00±0aA2500±0aA2000±0aA241513.33±0.47bA5.6491026.67±0.47cA51550±0.82dA030100±0eA30(对照)00±0aA2500±0aA2000±0aA481513.33±0.47bA7.05810310±0.82cB51963.33±0.94dB030100±0eA30(对照)00±0aA2500±0aA2013.33±0.47bB721526.67±0.47cB10.04110413.33±0.47dC530100±0eC030100±0eA30(对照)00±0aA2500±0aA2026.67±0.47bC9615310±0cC10.26010413.33±0.47dC530100±0eC030100±0eA
注:标有不同小写字母者表示同一胁迫时间下不同盐度组之间存在显著性差异(P<0.05),标有不同大写字母者表示同一盐度组中不同胁迫时间之间存在显著性差异(P<0.05)。
Note:The means with different letters at the same stress time are significant differences in different salinity groups at the 0.05 probability level,and means with different capital letters within different stress time being significantly different in the same salinity group at the 0.05 probability level.
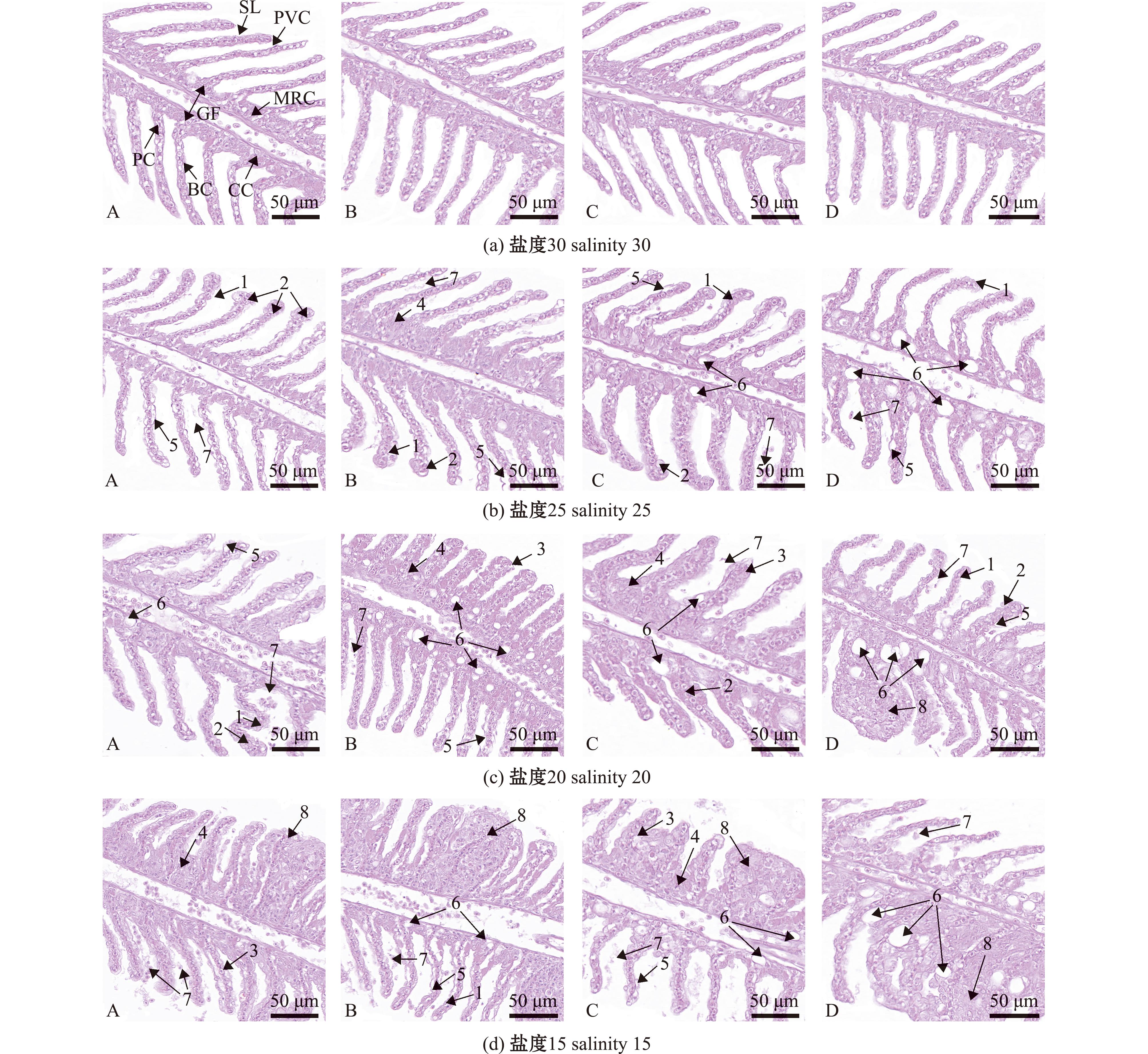
2.2 低盐胁迫下幼鱼鳃组织结构的变化
对照组,低盐胁迫24、48、72、96 h时,幼鱼鳃组织形态均无明显差异,其鳃丝发达、色泽均匀、形态正常;鳃丝两侧的鳃小片近乎平行排列,鳃小片上的细胞排列紧密,圆润饱满,细胞核清晰可见;柱细胞呈圆柱形;鳃小片基部的线粒体丰富细胞小而饱满,排列紧凑(图1(a))。
25盐度组,低盐胁迫24 h时,幼鱼少数鳃小片弯曲,多数末端增生、肥大,鳃小片上皮细胞水肿,呈透明状,少数鳃小片细胞出现破裂现象;胁迫48 h时,鳃小片基部的线粒体丰富细胞数量明显增多,出现堆积现象;胁迫72 h时,细胞出现大而明显的空泡,鳃小片弯曲加剧,呈不规则分布;胁迫96 h时,细胞空泡数量增多(图1(b))。
20盐度组,低盐胁迫24 h时,血管内红细胞数量增加,鳃小片弯曲明显;胁迫48 h时,鳃小片缩短变粗,细胞空泡化加剧,鳃小片基部的线粒体丰富细胞数量增加;胁迫72 h时,鳃小片明显缩短变粗;胁迫96 h时,少数相邻的鳃小片融合,细胞空泡化较为明显(图1(c))。
15盐度组,低盐胁迫24 h时,鳃小片上皮细胞脱落明显,鳃小片变粗融合;胁迫48 h时,鳃小片融合较多;胁迫72、96 h时,鳃小片融合现象持续增加,细胞空泡化明显(图1(d))。
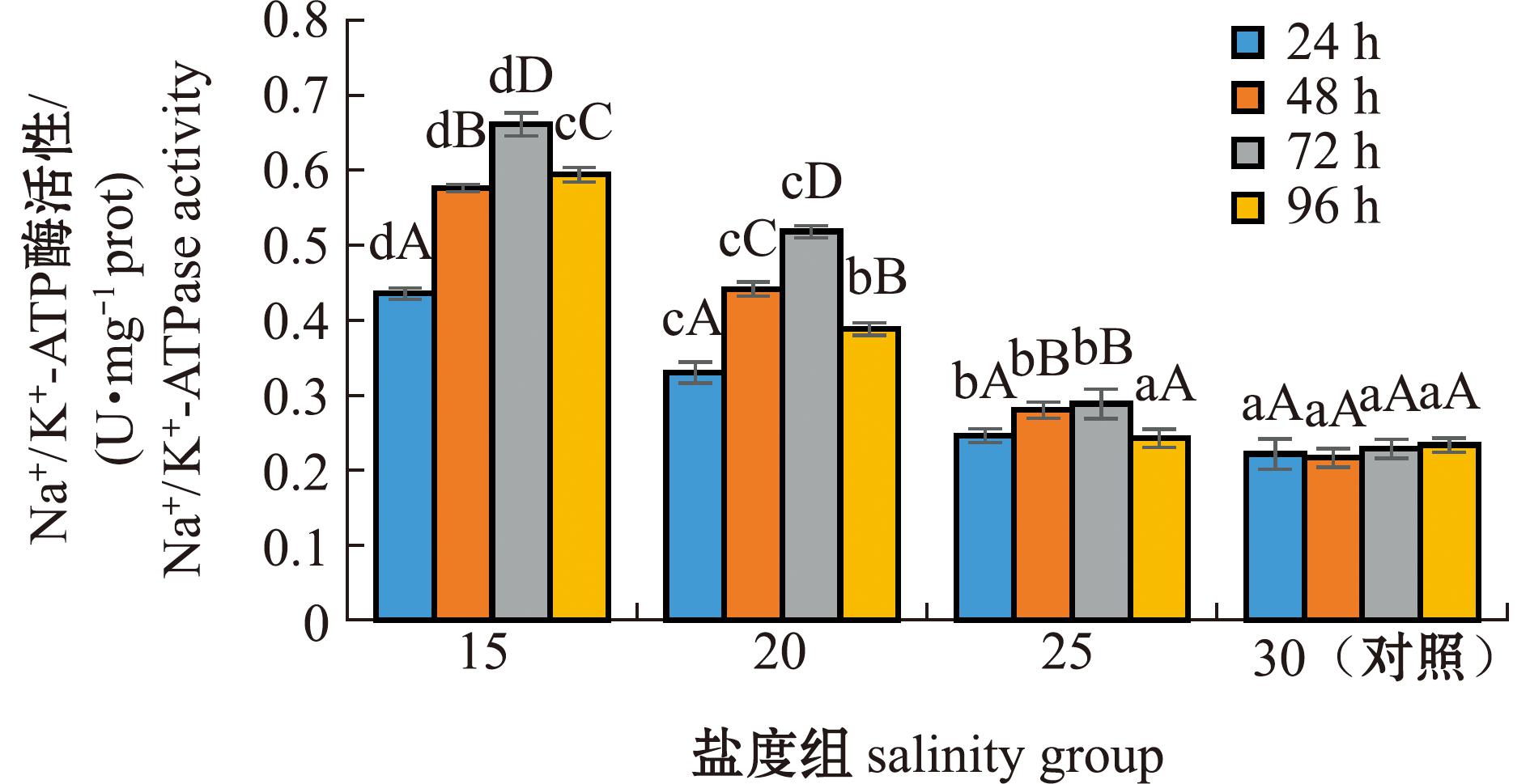
2.3 低盐胁迫下幼鱼鳃丝Na+/K+-ATP酶活性的变化
从图2可见:低盐胁迫24、48、72、96 h时,幼鱼鳃丝Na+/K+-ATP酶活性均随着盐度的降低逐渐升高,峰值出现在15盐度组(P<0.05);25、20、15盐度组的Na+/K+-ATP酶活性显著高于对照组(P<0.05)(除25盐度组在96 h外),且均随着胁迫时间的延长呈先升高后降低的趋势,并在72 h时达到峰值(P>0.05)。
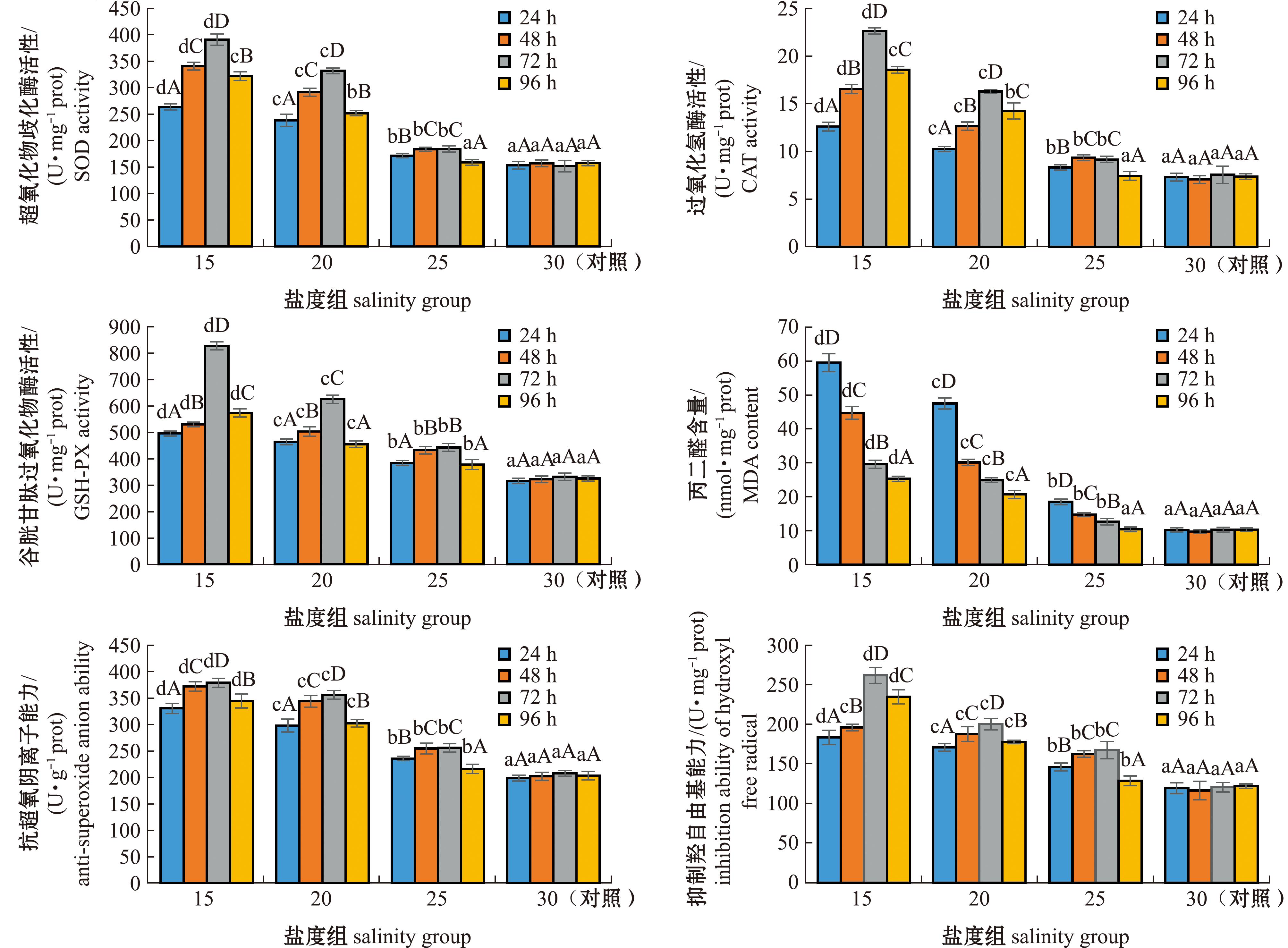
2.4 低盐胁迫下幼鱼肝脏抗氧化能力的变化
低盐胁迫24、48、72、96 h时,幼鱼肝脏SOD、CAT和GSH-PX活性均随着盐度的降低呈升高趋势;25、20、15盐度组幼鱼的这3种酶活性均显著高于对照组(P<0.05)(除25盐度组在96 h时的SOD和CAT活性外);25、20、15盐度组的SOD、CAT和GSH-PX活性均随着胁迫时间的延长呈先上升后下降趋势,并在72 h时达到峰值(P<0.05)(图3)。
低盐胁迫24、48、72、96 h时,幼鱼肝脏MDA含量均随盐度的降低逐渐升高,25、20、15盐度组的MDA含量显著高于对照组(P<0.05)(除25盐度组在96 h外);25、20、15盐度组的MDA含量均随胁迫时间的延长呈逐渐下降的趋势,并在24 h时达到峰值(P<0.05)(图3)。
抗超氧阴离子能力和抑制羟自由基能力的变化趋势基本一致,4个胁迫时间下两者均随着盐度降低呈升高趋势,最大值出现在15盐度组(P<0.05);抗超氧阴离子能力和抑制羟自由基能力随着胁迫时间的延长呈先上升后下降的趋势,并在72 h时达到峰值(P<0.05)(图3)。
3 讨论
3.1 低盐胁迫对绿鳍马面鲀幼鱼存活的影响
盐度作为水生生物重要的环境因子,对鱼类的生长、摄食、存活和免疫机能具有重要影响[13-14]。本试验中,25盐度组未出现幼鱼死亡情况,说明盐度25~30适宜绿鳍马面鲀幼鱼的存活,这与薛美岩等[15]对绿鳍马面鲀的研究结果一致。盐度25以下时,随着盐度的降低,幼鱼死亡率逐渐升高,较低盐度组的幼鱼全部死亡,说明盐度越低,幼鱼所受到的胁迫越大,其死亡率越高,这与对四指马鲅(Eleutheronema tetradactylum)[16]幼鱼的研究结果一致。半数致死浓度LC50是衡量水中毒物对水生动物毒性大小的重要参数,LC50与毒物浓度成反比,物质毒性越小LC50值越大。本试验中,胁迫时间从24 h增加到48、72、96 h时,所对应的半数致死盐度LC50也逐渐增大,即幼鱼受到的低盐胁迫强度逐渐增加,耐受低盐的值逐渐增大,说明幼鱼对低盐的耐受力随着胁迫时间的延长逐渐减弱,这与本试验得出的死亡率结果及马细兰等[17]对黑鲷(Acanthopagrus schlegelii)的研究结果均一致。
3.2 低盐胁迫对绿鳍马面鲀鳃组织结构的影响
鳃不仅是鱼类的呼吸器官,而且在渗透压调节中也发挥重要作用[16]。当鱼类生活的水环境发生变化时,鳃组织结构会做出相应改变[18],以保障生长所需。本试验中,与对照组相比,随着盐度的递减,25、20、15盐度组幼鱼的鳃小片弯曲、粗大、融合现象加剧,鳃小片表皮细胞脱落现象也加剧,说明低盐胁迫会对绿鳍马面鲀幼鱼的鳃组织结构造成一系列应激性损伤。在低盐胁迫下,25、20盐度组的鳃小片弯曲变粗,有利于增加鳃小片与外界水环境的接触面积,从而增加水氧交换量,这与对鲻(Mugil cephalus)幼鱼[19]及红鳍东方鲀(Takifugu rubripes)幼鱼[20]的研究结果相似,鳃小片肿胀也可能与短时间内水渗透进入鳃组织,幼鱼机体需达内外盐度平衡有关。15盐度组的鳃小片出现不同程度的分离脱落和融合现象,其对低盐胁迫的应激反应较25、20盐度组更为剧烈,说明15盐度组对幼鱼鳃组织造成的损伤更为严重,这与对四指马鲅幼鱼[16]和中华鲟(Acipenser sinensis)子二代幼鱼[21]的研究结果相似。原因是当盐度超过一定的耐受范围,过多的水渗透进入鳃小片,导致鳃小片细胞肿胀膨大,相邻鳃小片间距缩小直至鳃小片出现融合现象。在低盐水环境中,鳃小片变粗膨大,通过增加其与水环境的接触面积,增加水氧交换量,适应低渗环境。但在膨大的过程中,少数鳃组织细胞因膨胀程度超出其耐受极限从而出现破裂脱落现象。由此可见,低盐胁迫会对绿鳍马面鲀幼鱼的鳃组织结构造成一定损伤,但具体损伤机理还需通过蛋白质代谢、渗透压调节和蛋白质水平等对低盐胁迫的响应进行深入研究[22]。
3.3 低盐胁迫对绿鳍马面鲀鳃丝Na+/K+-ATP酶活性的影响
Na+/K+-ATP酶是鳃丝细胞膜中存在的一种特殊蛋白质,通过分解ATP获得能量进行Na+、K+的主动转运,维持细胞内外液的渗透压平衡[23]。本试验中,随着盐度的降低,Na+/K+-ATP酶活性逐渐升高,这与对鲻[24]的研究结果一致,外界水环境盐度降低,会导致进入鱼体细胞的离子含量降低,造成离子流失,此时Na+/K+-ATP酶活性升高可加强细胞对外界无机离子的摄取,以维持细胞内外离子含量稳定、渗透压平衡,适应低渗环境。本研究中,随着低盐胁迫时间的延长,25、20、15盐度组的Na+/K+-ATP酶活性呈先上升后下降的趋势,这与对克氏双锯鱼(Amphiprion clarkii) 幼鱼[8]的研究结果一致,说明本研究中绿鳍马面鲀幼鱼在低盐胁迫反应初期,机体受到刺激迫使渗透调节机制做出改变,Na+/K+-ATP酶活性增强,以提高对新环境的适应能力,而随着时间的推移,幼鱼到达环境适应期[23],机体状态逐渐接近平稳,即Na+/K+-ATP酶活性逐渐下降。20盐度组Na+/K+-ATP酶活性的下降幅度较15盐度组大,说明绿鳍马面鲀幼鱼在盐度20时所受胁迫较盐度15时低,在低盐胁迫下可迅速调节机体免疫系统做出反应,这与对钝吻黄盖鲽(Pleuronectes yokohama)幼鱼[25]的研究结果一致。25盐度组幼鱼的Na+/K+-ATP酶活性与对照组相比差异甚小,且在96 h时与对照组之间无显著性差异,说明绿鳍马面鲀幼鱼在盐度25时所受胁迫强度较低,幼鱼免疫系统只做出微小反应即可调整适应。25、20、15盐度组的Na+/K+-ATP酶活性均在72 h时达到最高,推测绿鳍马面鲀幼鱼在胁迫时间72 h时达到反应极限,开始调整适应,96 h时酶活性降低,说明通过机体自我调节逐渐适应低盐环境。
3.4 低盐胁迫对绿鳍马面鲀肝脏抗氧化能力的影响
肝脏抗氧化能力是鱼类机体抗氧化水平的重要指标[24],因为低盐胁迫会引起鱼类氧化应激和代谢紊乱,诱导机体产生大量活性氧自由基[过氧化氢(H2O2)、羟基自由基(·OH)和超氧阴离子自由基 等][26],肝脏作为机体代谢和氧化反应的主要组织,可增强其抗氧化能力来抵御活性氧自由基造成的损伤[27]。SOD、CAT和GSH-PX是生物体内重要的抗氧化酶,SOD可将活性氧转变为O2和H2O2,CAT再将有危害的H2O2转变成H2O,GSH-PX则是将H2O2降解成羟基化合物从而降低机体损伤[28-30],SOD与CAT是共同作用,CAT与GSH-PX是协同作用。本试验中,SOD、CAT和GSH-PX酶活性均随着盐度的降低逐渐升高,这与对军曹鱼( Rachycentron canadum)[31]、许氏平鲉(Sebastes schlegelii)[32]和褐牙鲆(Paralichthys olivaceus)幼鱼[33]的研究结果相似,说明盐度越低,幼鱼受到的胁迫强度越大,低盐胁迫诱发机体产生的活性氧自由基越多,所需要的抗氧化酶活性就越强。25、20、15盐度组的这3种酶活性随低盐胁迫时间的延长呈先上升后下降的趋势,这与对华贵栉孔扇贝(Mimachlamys nobilis)[34]和钝吻黄盖鲽幼鱼[25]的研究结果相似,说明幼鱼机体内的活性氧自由基被抗氧化酶逐步清除,在胁迫后期,较低的抗氧化酶活性也足以清除这些活性氧自由基,且试验盐度组的SOD、CAT和GSH-PX活性均在96 h时下降,猜测幼鱼从96 h时开始逐渐适应低盐环境,机体状态可能逐渐接近平稳。
等][26],肝脏作为机体代谢和氧化反应的主要组织,可增强其抗氧化能力来抵御活性氧自由基造成的损伤[27]。SOD、CAT和GSH-PX是生物体内重要的抗氧化酶,SOD可将活性氧转变为O2和H2O2,CAT再将有危害的H2O2转变成H2O,GSH-PX则是将H2O2降解成羟基化合物从而降低机体损伤[28-30],SOD与CAT是共同作用,CAT与GSH-PX是协同作用。本试验中,SOD、CAT和GSH-PX酶活性均随着盐度的降低逐渐升高,这与对军曹鱼( Rachycentron canadum)[31]、许氏平鲉(Sebastes schlegelii)[32]和褐牙鲆(Paralichthys olivaceus)幼鱼[33]的研究结果相似,说明盐度越低,幼鱼受到的胁迫强度越大,低盐胁迫诱发机体产生的活性氧自由基越多,所需要的抗氧化酶活性就越强。25、20、15盐度组的这3种酶活性随低盐胁迫时间的延长呈先上升后下降的趋势,这与对华贵栉孔扇贝(Mimachlamys nobilis)[34]和钝吻黄盖鲽幼鱼[25]的研究结果相似,说明幼鱼机体内的活性氧自由基被抗氧化酶逐步清除,在胁迫后期,较低的抗氧化酶活性也足以清除这些活性氧自由基,且试验盐度组的SOD、CAT和GSH-PX活性均在96 h时下降,猜测幼鱼从96 h时开始逐渐适应低盐环境,机体状态可能逐渐接近平稳。
MDA是脂质过氧化产物,反映生物机体受氧化损伤程度[33]。生物机体在正常状态下,MDA含量很低。本试验中,MDA含量随着盐度的降低逐渐升高,随着胁迫时间的延长呈逐渐下降的趋势。前者与对金钱鱼(Scatophagus argus)幼鱼[28]及多鳞四指马鲅(Eleutheronema rhadinum) 幼鱼[35]的研究结果相似,说明绿鳍马面鲀幼鱼随着盐度的降低所受到的胁迫逐渐增强,机体受氧化损伤程度逐渐增大。后者与对鲻幼鱼[24]的研究结果类似,说明绿鳍马面鲀幼鱼在逐渐适应低盐环境后,活性氧自由基的生成量逐渐接近清除量,致使MDA含量下降。抗超氧阴离子能力和抑制羟自由基能力是反映生物机体抗氧化能力的指标。本试验中,绿鳍马面鲀机体的抗超氧阴离子能力和抑制羟自由基能力随着盐度的降低不断增强,随着胁迫时间的延长呈先上升后下降的趋势,在72 h时达最大值,说明在低盐胁迫初期,绿鳍马面鲀幼鱼有较强的应激反应,机体免疫系统发挥作用,二者逐渐升高,但随着低盐胁迫时间的延长,幼鱼在72 h时达到一个从应激状态转向环境适应期的重要转折点,随后抗超氧阴离子能力和抑制羟自由基能力开始下降。虽然以上酶活试验结果说明绿鳍马面鲀幼鱼在一段时间后开始逐渐适应低盐环境,但25、20、15盐度组幼鱼在低盐胁迫下达到正常生长所需的时间,以及幼鱼机体各项生理生化指标最终是否能恢复至对照组水平,均有待进一步研究。
4 结论
1) 在盐度25~30下,绿鳍马面鲀幼鱼的存活不受盐度影响,盐度小于20对幼鱼存活有显著性影响。
2)低盐胁迫对绿鳍马面鲀幼鱼鳃丝Na+/K+-ATP酶活性及肝脏抗氧化能力造成的影响是可逆的,对鳃组织结构会造成一定损伤,但不致死。
3)绿鳍马面鲀幼鱼鳃丝Na+/K+-ATP酶活性和肝脏抗氧化能力指标在低盐胁迫96 h时下降,说明幼鱼初步适应低盐胁迫所需时间为96 h。
参考文献:
[1] 李刚,王庆龙,张凯强.绿鳍马面鲀的人工繁育技术[J].中国水产,2021(11):82-84. LI G,WANG Q L,ZHANG K Q.Artificial breeding technology of Thamnaconus septentrionalis[J].China Fisheries,2021(11):82-84.(in Chinese)
[2] 詹秉义,楼冬春,钟俊生.绿鳍马面鲀资源评析与合理利用[J].水产学报,1986,10(4):409-418. ZHAN B Y,LOU D C,ZHONG J S.An assessment of the filefish population and rational exploitation of the resource[J].Journal of Fisheries of China,1986,10(4):409-418.(in Chinese)
[3] 王九龙,叶苗,李洪莉,等.绿鳍马面鲀野生与养殖群体的微卫星遗传多样性分析[J/OL].水产科学,2024.https://doi.org/10.16378/j.cnki.1003-1111.21165. WANG J L,YE M,LI H L,et al.Analysis of microsatellite genetic diversity in wild and cultured populations of Thamnaconus septentrionalis[J/OL]. Fisheries Science,2024.https://doi.org/10.16378/j.cnki.1003-1111.21165.(in Chinese)
[4] XU Z X,ZHANG P F,CHANG Q,et al.Effects of dietary protein and lipid levels on growth performance,muscle composition,immunity index and biochemical index of the greenfin horse-faced filefish (Thamnaconus septentrionalis) juvenile[J].Journal of Ocean University of China,2021,20(5):1245-1252.
[5] SAOUD I P,KREYDIYYEH S,CHALFOUN A,et al.Influence of salinity on survival,growth,plasma osmolality and gill Na+-K+-ATPase activity in the rabbitfish Siganus rivulatus[J].Journal of Experimental Marine Biology and Ecology,2007,348(1/2):183-190.
[6] IMSLAND A 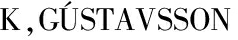 A,GUNNARSSON S,et al.Effects of reduced salinities on growth,feed conversion efficiency and blood physiology of juvenile Atlantic halibut (Hippoglossus hippoglossus L.)[J].Aquaculture,2008,274(2/3/4):254-259.
A,GUNNARSSON S,et al.Effects of reduced salinities on growth,feed conversion efficiency and blood physiology of juvenile Atlantic halibut (Hippoglossus hippoglossus L.)[J].Aquaculture,2008,274(2/3/4):254-259.
[7] SHI Z H,HUANG X X,FU R B,et al.Salinity stress on embryos and early larval stages of the pomfret Pampus punctatissimus[J].Aquaculture,2008,275(1/2/3/4):306-310.
[8] 胡静,叶乐,吴开畅,等.急性盐度胁迫对克氏双锯鱼幼鱼血清皮质醇浓度和Na+-K+-ATP酶活性的影响[J].南方水产科学,2016,12(2):116-120. HU J,YE L,WU K C,et al.Effect of acute salinity stress on serum cortisol and activity of Na+-K+-ATPase of juvenile Amphiprion clarkii[J].South China Fisheries Science,2016,12(2):116-120.(in Chinese)
[9] MADEIRA D,NARCISO L,CABRAL H N,et al.Influence of temperature in thermal and oxidative stress responses in estuarine fish[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2013,166(2):237-243.
[10] MART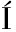 NEZ-
NEZ-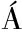 LVAREZ R M,MORALES A E,SANZ A.Antioxidant defenses in fish:biotic and abiotic factors[J].Reviews in Fish Biology and Fisheries,2005,15(1):75-88.
LVAREZ R M,MORALES A E,SANZ A.Antioxidant defenses in fish:biotic and abiotic factors[J].Reviews in Fish Biology and Fisheries,2005,15(1):75-88.
[11] TOMANEK L,ZUZOW M J.The proteomic response of the mussel congeners Mytilus galloprovincialis and M.trossulus to acute heat stress:implications for thermal tolerance limits and metabolic costs of thermal stress[J].The Journal of Experimental Biology,2010,213(Pt 20):3559-3574.
[12] CAO L,HUANG W,SHAN X J,et al.Tissue-specific accumulation of cadmium and its effects on antioxidative responses in Japanese flounder juveniles[J].Environmental Toxicology and Pharmacology,2012,33(1):16-25.
[13] KÜLTZ D.Physiological mechanisms used by fish to cope with salinity stress[J].The Journal of Experimental Biology,2015,218(Pt 12):1907-1914.
[14] KÜLTZ D,LI J,GARDELL A,et al.Quantitative molecular phenotyping of gill remodeling in a cichlid fish responding to salinity stress[J].Molecular &Cellular Proteomics,2013,12(12):3962-3975.
[15] 薛美岩,张静,杜荣斌,等.温度、盐度对绿鳍马面鲀幼鱼存活及生长的影响[J].海洋湖沼通报,2012(1):63-67. XUE M Y,ZHANG J,DU R B,et al.Effects of temperature and salinity on survival and growth of larvae Navodon septentrionalis[J].Transactions of Oceanology and Limnology,2012(1):63-67.(in Chinese)
[16] 牛莹月,罗志平,区又君,等.不同盐度对四指马鲅幼鱼存活及鳃组织形态变化的影响[J].南方农业学报,2021,52(6):1719-1726. NIU Y Y,LUO Z P,OU Y J,et al.The survival and structural changes in gill of juvenile Eleutheronema tetradactylum under different salinities[J].Journal of Southern Agriculture,2021,52(6):1719-1726.(in Chinese)
[17] 马细兰,郑陆威,叶超霞,等.胃促生长素Ghrelin在不同盐度胁迫下对黑鲷(Acanthopagrus schlegelii)部分免疫指标的影响[J].海洋与湖沼,2018,49(3):692-699. MA X L,ZHENG L W,YE C X,et al.Effects of Ghrelin on immune indexes of black seabream Acanthopagrus schlegelii under different salinity stress[J].Oceanologia et Limnologia Sinica,2018,49(3):692-699.(in Chinese)
[18] 杨建,徐伟,耿龙武,等.盐度对5种幼鱼的生存及鳃、肾组织的影响[J].淡水渔业,2014,44(4):7-12. YANG J,XU W,GENG L W,et al.Effects of salinity on survival,gill and kidney tissue in juveniles of 5 species[J].Freshwater Fisheries,2014,44(4):7-12.(in Chinese)
[19] 于娜,李加儿,区又君,等.不同盐度下鲻鱼幼鱼鳃和肾组织结构变化[J].生态科学,2012,31(4):424-428. YU,LI J E,OU Y J,et al.Structural changes in gill and kidney of juvenile grey mullet under different salinity[J].Ecological Science,2012,31(4):424-428.(in Chinese)
[20] 孙梦蕾,蒋洁兰,王莉苹,等.低盐胁迫下红鳍东方鲀幼鱼鳃、肾和肠组织结构的变化[J].广东海洋大学学报,2016,36(6):38-43. SUN M L,JIANG J L,WANG L P,et al.Structural changes in gill,kidney and intestine of juvenile Takifugu rubripes under low salinity treatment[J].Journal of Guangdong Ocean University,2016,36(6):38-43.(in Chinese)
[21] 刘娟娟,王京树,赵珣,等.不同盐度和驯养时间中华鲟子二代幼鱼鳃的显微结构变化[J].水生态学杂志,2015,36(1):60-65. LIU J J,WANG J S,ZHAO X,et al.Microstructure changes in the gill epithelia of second filial Acipenser sinensis juvenile acclimated to various salinities for different time[J].Journal of Hydroecology,2015,36(1):60-65.(in Chinese)
[22] 章霞,徐志进,李伟业,等.MS-222对大黄鱼幼鱼麻醉效果、组织结构及抗氧化酶活性的影响[J].大连海洋大学学报,2023,38(2):267-274. ZHANG X,XU Z J,LI W Y,et al.Effects of MS-222 on anaesthesia,tissue structure and antioxidant enzyme activity of juvenile large yellow croaker (Larimichthys crocea)[J].Journal of Dalian Ocean University,2023,38(2):267-274.(in Chinese)
[23] HIROSE S,KANEKO T,NAITO N,et al.Molecular biology of major components of chloride cells[J].Comparative Biochemistry and Physiology Part B:Biochemistry &Molecular Biology,2003,136(4):593-620.
[24] 吴庆元,蒋玫,李磊,等.低盐度胁迫对鲻鱼(Mugil cephalus)幼鱼鳃丝、肌肉、肠Na+-K+-ATP酶活性和MDA含量的影响[J].生态与农村环境学报,2014,30(4):481-487. WU Q Y,JIANG M,LI L,et al.Effects of chronic stress of lower salinity on activity of Na+-K+-ATPase and content of MDA in branchial filament,muscle,intestine of juvenile mullet(Mugil cephalus)[J].Journal of Ecology and Rural Environment,2014,30(4):481-487.(in Chinese)
[25] 崔前进,陈冰,邱丽华,等.低盐胁迫对钝吻黄盖鲽幼鱼鳃Na+/K+-ATP酶、肝脏抗氧化酶和非特异免疫酶的影响[J].广东海洋大学学报,2017,37(6):26-32. CUI Q J,CHEN B,QIU L H,et al.Influence of low salinity stress on the gill Na+/K+-ATPase,liver antioxidase and non-specific immune enzyme in juvenile Pleuronectes yokohama[J].Journal of Guangdong Ocean University,2017,37(6):26-32.(in Chinese)
[26] 冉凤霞,金文杰,黄屾,等.盐度变化对鱼类影响的研究进展[J].西北农林科技大学学报(自然科学版),2020,48(8):10-18. RAN F X,JIN W J,HUANG S,et al.Research progress on the effects of salinity change on fish[J].Journal of Northwest A &F University (Natural Science Edition),2020,48(8):10-18.(in Chinese)
[27] 何亮银,史晓丽,周逢芳,等.低盐胁迫对大黄鱼非特异性免疫酶活力的影响[J].应用海洋学学报,2022,41(2):347-354. HE L Y,SHI X L,ZHOU F F,et al.Effect of low salinity stress on non-specific immunity enzymatic activity of Larimichthys crocea[J].Journal of Applied Oceanography,2022,41(2):347-354.(in Chinese)
[28] 孙雪娜,冯广朋,刘鉴毅,等.盐度对金钱鱼幼鱼存活、生长和抗氧化系统的影响[J].上海海洋大学学报,2022,31(1):161-169. SUN X N,FENG G P,LIU J Y,et al.Effects of salinity on survival,growth and antioxidant defense system of Scatophagus argus[J].Journal of Shanghai Ocean University,2022,31(1):161-169.(in Chinese)
[29] 尹飞,孙鹏,彭士明,等.低盐度胁迫对银鲳幼鱼肝脏抗氧化酶、鳃和肾脏ATP酶活力的影响[J].应用生态学报,2011,22(4):1059-1066. YIN F,SUN P,PENG S M,et al.Effects of low salinity stress on the antioxidant enzyme activities in juvenile Pampus argenteus liver and the ATPase activities in its gill and kidney[J].Chinese Journal of Applied Ecology,2011,22(4):1059-1066.(in Chinese)
[30] DOYEN P,BIGOT A,VASSEUR P,et al.Molecular cloning and expression study of pi-class glutathione S-transferase (pi-GST) and selenium-dependent glutathione peroxidase (Se-GPx) transcripts in the freshwater bivalve Dreissena polymorpha[J].Comparative Biochemistry and Physiology Toxicology &Pharmacology:CBP,2008,147(1):69-77.
[31] 杨健,陈刚,黄建盛,等.温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响[J].广东海洋大学学报,2007,27(4):25-29. YANG J,CHEN G,HUANG J S,et al.Effects of temperature and salinity on the growth and activities of antioxidant enzymes of cobia (Rachycentron canadum) juveniles[J].Journal of Guangdong Ocean University,2007,27(4):25-29.(in Chinese)
[32] 王晓杰,张秀梅,李文涛.盐度胁迫对许氏平鲉血液免疫酶活力的影响[J].海洋水产研究,2005,26(6):17-21. WANG X J,ZHANG X M,LI W T.Effects of salinity on the non-specific immuno-enzymatic activity of Sebastes schlegeli[J].Marine Fisheries Research,2005,26(6):17-21.(in Chinese)
[33] 郭勤单,王有基,吕为群.温度和盐度对褐牙鲆幼鱼渗透生理及抗氧化水平的影响[J].水生生物学报,2014,38(1):58-67. GUO Q D,WANG Y J,LÜ W Q.Combined effects of temperature and salinity on the physiological osmotic induction and antioxidant responses in the juvenile Japanese flounder(Paralichthys olivaceus)[J].Acta Hydrobiologica Sinica,2014,38(1):58-67.(in Chinese)
[34] 林岗,饶小珍,吴静,等.低盐胁迫对华贵栉孔扇贝抗氧化酶、Na+/K+-ATPase活力的影响[J].福建师范大学学报(自然科学版),2018,34(1):71-78. LIN G,RAO X Z,WU J,et al.Effects of low-salinity stress on antioxidant enzymes and Na+/K+-ATPase activities of Mimachlamys nobilis[J].Journal of Fujian Normal University (Natural Science Edition),2018,34(1):71-78.(in Chinese)
[35] 张琴星,张涛,侯俊利,等.盐度变化对多鳞四指马鲅幼鱼鳃丝Na+/K+-ATP酶及肝脏抗氧化酶活性的影响[J].海洋渔业,2013,35(3):324-330. ZHANG Q X,ZHANG T,HOU J L,et al.Effects of salinity on activities of gill Na+/K+-ATPase and liver antioxidase in juvenile Eleutheronema rhadinum[J].Marine Fisheries,2013,35(3):324-330.(in Chinese)
Effects of acute low salt stress on survival, gill structure and hepatic antioxidant capacity of juvenile bluefin leatherjacket
(Thamnaconus septentrionalis)
CHEN Ying1,2,LI Fenghui2,ZHANG Guangming3,BIAN Li2,CHEN Siqing2,ZHANG Ziyang2,ZHANG Yuao2,YAN Junli3*
(1.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China;2.Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao 266071,China;3.Shandong Animal Husbandry and Veterinary Vocational College,Weifang 261061,China)
Abstract: To probe into the physiological and biochemical response mechanisms of juvenile bluefin leatherjacket (Thamnaconus septentrionalis) under low-salt stress, survival, gill histological structure, gill filament Na+/K+-ATPase activity, and hepatic antioxidant capacity were determined in juvenile bluefin leatherjacket with body weight of (20±5)g exposed to acute salinity of 15, 20, 25 and 30 (control group 30) for 24, 48, 72, and 96 h. The results showed that the survival of the juveniles was significantly affected by salinity below 20 (P<0.05), without significant effect at salinity of 25 and 30. The juvenile bluefin leatherjacket had median lethal salinity (LC50 ) of 5.649 for 24 h, 7.058 for 48 h, 10.041 for 72 h, and 10.260 for 96 h. Compared to control group 30, the gill of the juvenile in salinity 25 group was shown to be slight lamellae curvature, terminal expansion, and cell vacuolization, while gill in salinity 20 and 15 groups showed varying degrees of gill lamellae curvature and coarseness, irregular arrangement, basal hyperplasia and fusion, as well as increase in number of mitochondria-rich cells, cell vacuolization, and rupture of epithelial cells. There were significantly higher Na+/K+-ATPase activity and hepatic antioxidant capacity in salinity 20 and 15 groups than those in control group (P<0.05), with the maximal points in most of the biochemical indices of enzyme activities at 72 h and decrease at 96 h, without significant difference in other enzyme activities in salinity 25 group at 96 h compared to control group, except for GSH-PX activity, anti-superoxide anion capacity and inhibition of hydroxyl radical capacity (P>0.05). The findings indicated that the salinity of 25-30 was suitable for the juvenile, and that the juvenile experienced a series of stress reactions at salinity of below 25, with different extents of adaptive changes including activity of gill filament Na+/K+-ATPase, and the antioxidant capacity in liver.
Key words: low salt stress; Thamnaconus septentrionalis; gill histological structure; antioxidant capacity

 NEZ-
NEZ- LVAREZ R M,MORALES A E,SANZ A.Antioxidant defenses in fish:biotic and abiotic factors[J].Reviews in Fish Biology and Fisheries,2005,15(1):75-88.
LVAREZ R M,MORALES A E,SANZ A.Antioxidant defenses in fish:biotic and abiotic factors[J].Reviews in Fish Biology and Fisheries,2005,15(1):75-88.