鳗鲡疱疹病毒实时荧光重组酶辅助扩增(RAA)检测方法的建立及应用
陈曦,杨金先,葛均青*
(福建省农业科学院生物技术研究所,福建 福州 350003)
摘要:为建立鳗鲡疱疹病毒(Anguillid herpesvirus,AngHV)的实时荧光重组酶辅助扩增(recombinase-aided amplification,RAA)检测方法,根据AngHV的ORF95基因序列设计引物和探针,优化反应温度,确定反应时间,并应用该方法对采集的临床样品进行检测。结果表明:本研究中建立的实时荧光RAA检测方法的最佳反应温度为39 ℃,反应时间为20 min;实时荧光RAA检测方法的灵敏度、特异性及重复性评价显示,RAA检测AngHV的最低检测量为1×102 copies/μL,可特异性地检测AngHV,与美洲鳗鲡腺瘤病毒(American eel adomavirus,AEAdoV)、蛙虹彩病毒(Rana grylio virus,RGV)、鲤疱疹病毒(Koi herpesvirus,KHV)和对虾白斑综合征病毒(White spot syndrome virus,WSSV)均无交叉反应;实时荧光RAA检测方法的组内和组间变异系数均小于5%,表明实时荧光RAA检测方法灵敏度高、特异性强和重复性好;应用该方法对采集的25份临床样品进行检测显示,实时荧光RAA检测方法与qPCR方法的检出率一致,均为92%,高于普通PCR的检出率(76%)。研究表明,本研究中所建立的鳗鲡疱疹病毒实时荧光重组酶辅助扩增RAA检测方法快速、灵敏、可靠、准确,可用于AngHV的临床快速检测和流行病学调查。
关键词:鳗鲡疱疹病毒(AngHV);实时荧光RAA;快速检测
DOI:10.16535/j.cnki.dlhyxb.2023-216
文章编号:2095-1388(2024)02-0234-07
中图分类号:S 941.41
文献标志码:A
收稿日期:2023-10-09
基金项目:福建省公益类科研院所基本科研业务专项(2021R1027007,2023R1081);福建省农业科学院“5511”协同创新工程建设项目(XTCXGC2021013)
作者简介:陈曦(1982—),男,助理研究员。E-mail:kobeid@163.com
通信作者:葛均青(1977—),男,博士,研究员。E-mail:jqge@163.com
鳗鲡疱疹病毒(Anguillid herpesvirus,AngHV)是感染鳗鲡并引起鳗鲡病毒性疾病脱黏败血综合征的高致病性病原[1-2],最早于1990年从养殖的日本鳗鲡(Anguilla japonica)中分离鉴定[3],在全球各个国家和地区均有发现[4-7]。自20世纪90年代中国开展鳗鲡规模化养殖以来,该病就在鳗鲡养殖场中常年发生,具有发病率高、传染性强和死亡率高等特点[8-9],给养殖者造成了巨大的经济损失[10-11]。同时,AngHV在鳗鲡体内存在潜伏感染,使部分病鱼难于从体表症状判断其患病情况[12-13],因此,建立快速有效、简便灵敏的AngHV检测方法,对于AngHV的早期诊断和防控具有极其重要的意义。
AngHV是一种具有囊膜的线性双链DNA病毒[14],隶属于疱疹病毒目(Herpesvirales)异疱疹病毒科(Alloherpesviridae)鲤疱疹病毒属(Cyprinivirus)[15],可感染日本鳗鲡、欧洲鳗鲡(A.anguilla)和美洲鳗鲡(A.rostrata)等养殖鳗鲡品种[16]。目前,对AngHV的检测主要依赖于实时荧光聚合酶链式反应(qPCR)[17]、 PCR[18]等常规分子生物学检测方法,但上述方法对检测人员和设备要求较高,且程序烦琐、耗时较长,限制了其在基层的推广应用。重组酶辅助扩增 (recombinase-aided amplification,RAA) 是一种利用重组酶、单链DNA结合蛋白和DNA聚合酶等在等温条件下进行核酸扩增的技术。该技术的主要原理是重组酶与引物形成复合体,当引物在模板DNA上搜索到与之完全互补的序列时,在单链DNA结合蛋白的帮助下,使模板DNA解链,并在DNA聚合酶的作用下,形成新的DNA互补链,在等温条件下,15~30 min内完成目的DNA的快速扩增[19-20]。该技术具有反应快速、灵敏度高、特异性强及对仪器依赖程度低等优点,特别适用于基层和现场即时检测使用。
前期研究表明,ORF95基因编码AngHV病毒粒子的囊膜结构蛋白[21],序列保守且基因丰度较高[22],适合作为病毒检测的靶位点。本研究中,基于ORF95基因保守区序列设计特异性引物和探针,以鳗鲡疱疹病毒DNA为模板,建立了鳗鲡疱疹病毒实时荧光RAA检测方法,并评价其灵敏度、特异性和重复性及应用效果,以期为精准防控AngHV提供技术支持。
1 材料与方法
1.1 材料
鳗鲡疱疹病毒、美洲鳗鲡腺瘤病毒 (American eel adomavirus,AEAdoV)、蛙虹彩病毒 (Rana grylio virus,RGV)、鲤疱疹病毒 (Koi herpesvirus,KHV)及对虾白斑综合征病毒(White spot syndrome virus,WSSV) 基因组DNA均由福建省农科院生物技术研究所保存。疑似感染鳗鲡疱疹病毒的鳗鲡组织样品由本课题组于2022—2023年在福建省各鳗鲡养殖场采集并保存。
主要试剂:2×Taq master Mix(Dye Plus)、DNA Marker和pCE2-TA/Blunt载体购自诺唯赞(南京)生物科技股份有限公司;病毒基因组DNA/RNA提取试剂盒和血液/细胞/组织DNA提取试剂盒均购自天根生化科技(北京)有限公司;RAA核酸扩增试剂(基础型和荧光型)购自众测(杭州)生物科技股份有限公司。引物合成和测序均由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1 引物及探针的设计 根据AngHV的ORF95序列,利用Lasergene 7.1生物学软件,按照RAA引物设计原则设计引物,同时设计ORF95的PCR引物,序列和目的片段长度见表1,引物和探针浓度均稀释至10 μmol/L使用。将AngHV接种于EO细胞系中,待细胞产生典型病变后,收集细胞,离心取上清液,用病毒基因组DNA/RNA提取试剂盒提取总DNA。以提取的病毒DNA为模板,利用RAA核酸扩增试剂盒(基础性)对候选引物进行RAA扩增,确定获得单一扩增条带后,将其作为实时荧光RAA的候选引物,并根据引物设计相应的检测探针(表1)。
表1 实时荧光RAA和 PCR扩增的引物及探针
Tab.1 Primers and probes used for real-time fluorescence RAA and PCR amplification
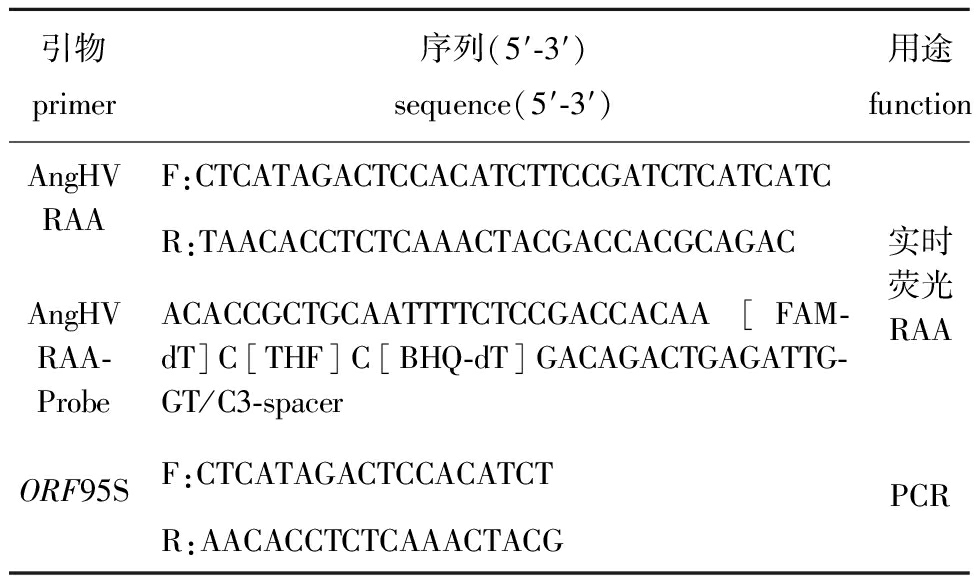
引物primer 序列(5'-3')sequence(5'-3')用途functionAngHV RAAF:CTCATAGACTCCACATCTTCCGATCTCAT-CATCR:TAACACCTCTCAAACTACGACCACG-CAGAC实时荧光RAAAngHVRAA-ProbeACACCGCTGCAATTTTCTCCGACCACAA[FAM-dT]C[THF]C[BHQ-dT]GACAGACT-GAGATTGGT/C3-spacerORF95SF:CTCATAGACTCCACATCTPCRR:AACACCTCTCAAACTACG
1.2.2 实时荧光RAA方法的扩增条件优化 以提取的病毒DNA为模板,利用RAA核酸扩增试剂(荧光型)、引物及探针进行实时荧光RAA扩增。
扩增反应体系:荧光缓冲液25 μL,上、下游引物各2 μL,探针0.6 μL,DNA模板1 μL,ddH2O 16.9 μL。将上述溶液与冻干酶粉混匀,最后加入激活剂(醋酸镁溶液)2.5 μL,分别在 37、39、42、45 ℃ 下反应 20 min,使用实时荧光定量 PCR仪检测荧光强度,每隔 30 s采集一次荧光信号,根据荧光信号强度确定最佳反应温度。同时,观察荧光信号的起峰和进入平台期时间,确定实时荧光RAA的反应时间。
1.2.3 实时荧光RAA方法的灵敏度检测 以提取的病毒DNA为模板,以设计的PCR引物ORF95S-F/ORF95S-R(表1)进行PCR扩增。将PCR扩增获得的单一片段产物进行胶回收,参考试剂盒说明书,与含有pCE2-TA/Blunt载体的反应缓冲液在室温下进行连接反应5 min,转化至大肠杆菌DH5α感受态细胞中,利用质粒小量抽提试剂盒[生工生物工程(上海)股份有限公司]提取质粒,经PCR鉴定后,对阳性克隆测序[生工生物工程(上海)股份有限公司]验证,获得质粒pCE2-TA/Blunt-ORF95S;用超微量紫外分光光度计测定其浓度和纯度,用DNA/RNA Copy Number Calculator (http://www.endmemo.com/bio/dnacopynum. php) 计算每μL提取DNA样品中质粒的拷贝数,并作为标准品,置于-80 ℃超低温冰箱中保存备用。
以梯度稀释的阳性质粒pCE2-TA/Blunt-ORF95S为模板,利用RAA核酸扩增试剂(荧光型)与筛选后的引物及探针进行实时荧光RAA检测,分析所能检测的最低鳗鲡疱疹病毒浓度。
1.2.4 实时荧光RAA方法的特异性检测 将保存的AngHV、AEAdoV、RGV和KHV菌株分别接种于细胞中,待多数细胞发生典型细胞病变后,收集细胞,提取病毒DNA,以此DNA为模板,以上述质粒pCE2-TA/Blunt-ORF95S为阳性对照,ddH2O为阴性对照,用建立的实时荧光RAA方法进行检测,评价检测方法的特异性。
1.2.5 实时荧光RAA检测方法的重复性检测 分别取浓度为1×104、1×105、1×106 copies/μL的阳性标准品重组质粒pCE2-TA/Blunt-ORF95S作为模板进行实时荧光RAA检测,每个浓度设置3个重复,根据阈值循环数 (cycle threshold value,CT) 的变异系数分析实时荧光RAA的组内重复性;重复试验3次,分析其组间重复性。
1.2.6 实时荧光RAA检测方法的应用 取本实验室采集并保存的疑似鳗鲡脱黏败血综合征病料组织样品25份,提取其总DNA,以DNA为模板,用建立的实时荧光定量qPCR检测方法确认AngHV的感染情况[17],用建立的实时荧光RAA和普通PCR方法进行检测,比较各组织样品鳗鲡疱疹病毒的检出情况,计算阳性样品检出率。
2 结果与分析
2.1 引物设计及靶序列扩增
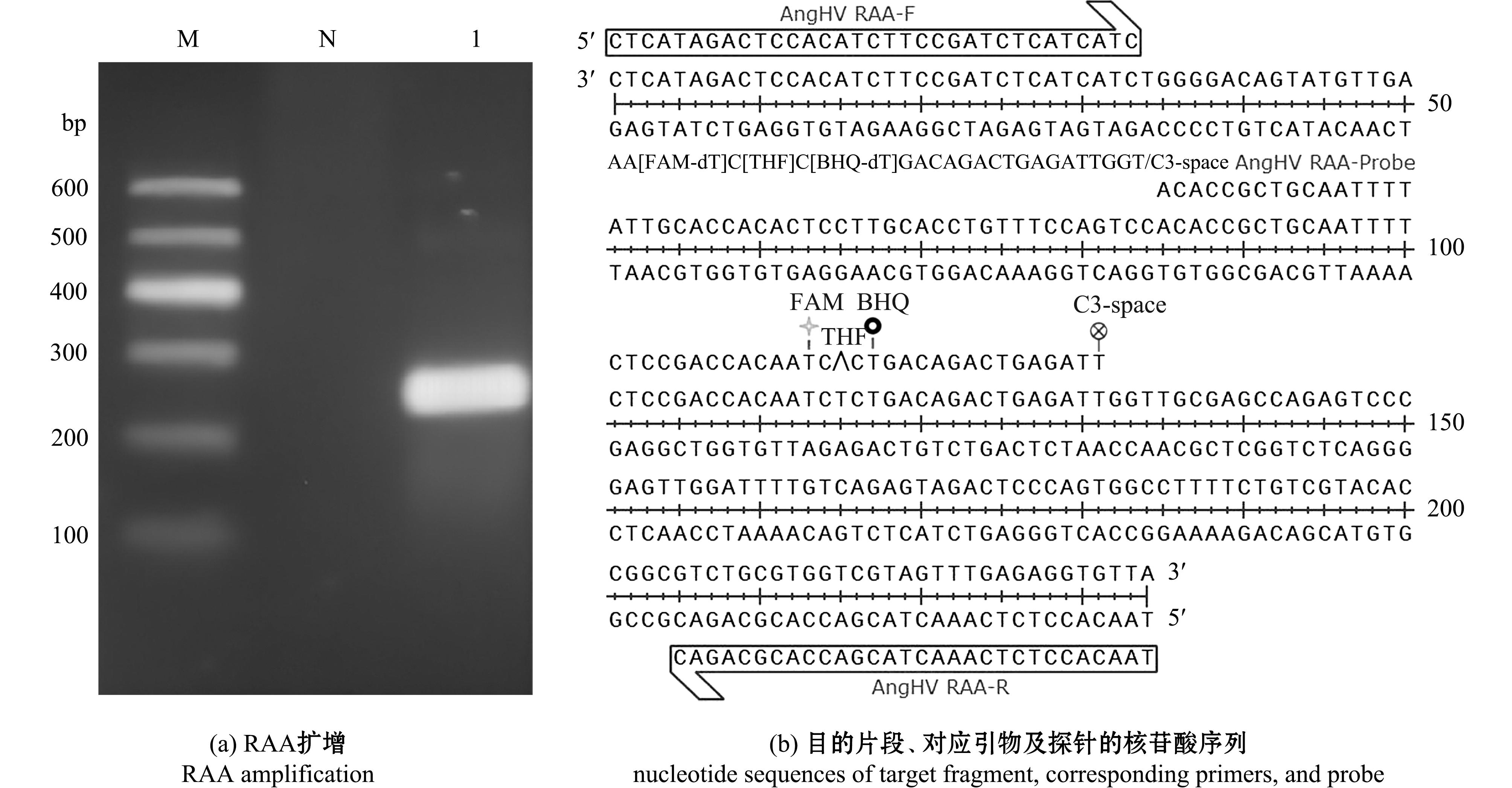
利用设计的引物对AngHV RAA-F/R,从AngHV基因组中扩增出约240 bp的单一条带(图1(a)),经测序验证,确定其为目标序列,以此设计相应探针(表1,图1(b)),用于后续构建实时荧光RAA检测方法。
2.2 反应条件的优化和确立
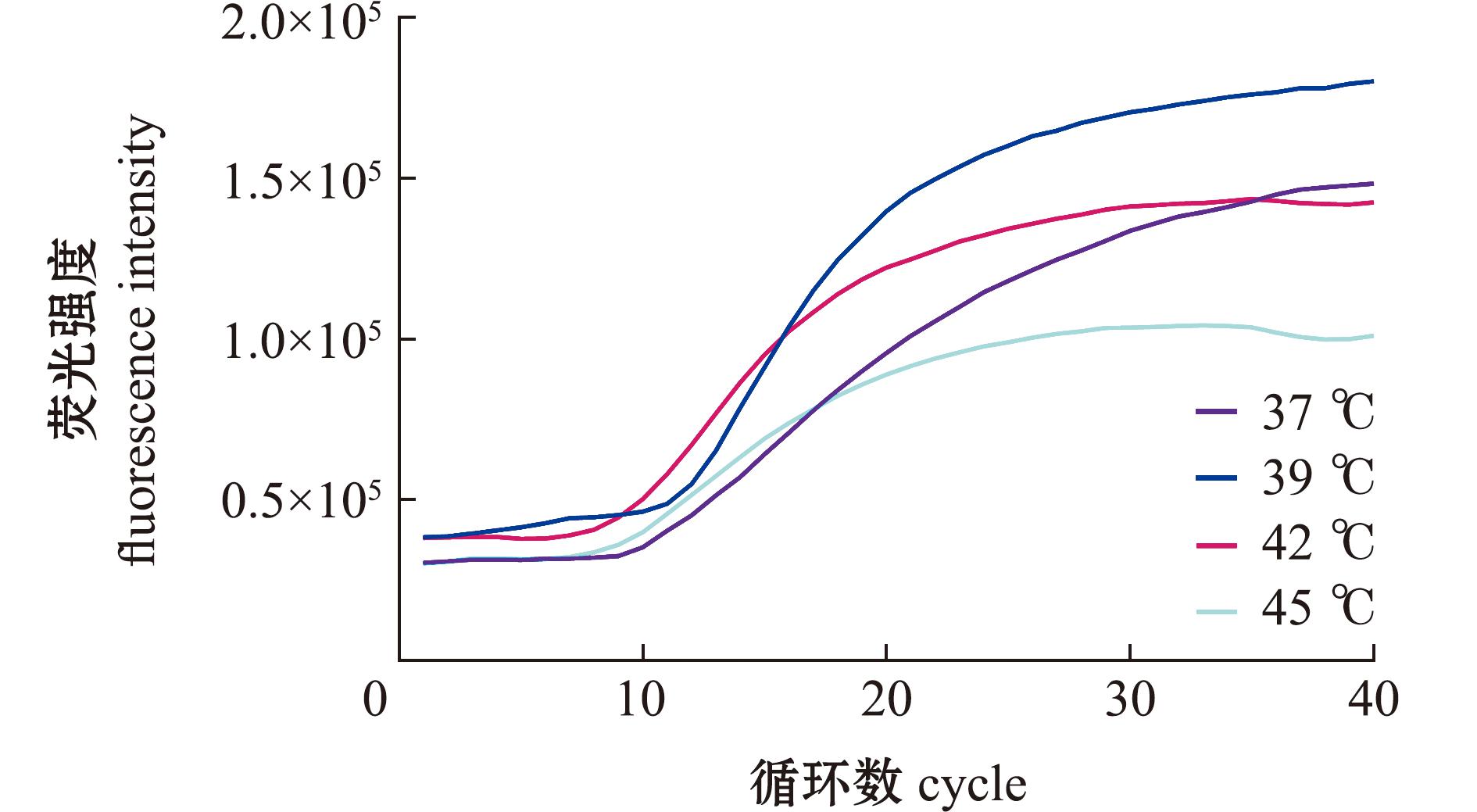
利用引物对AngHV RAA-F/R和探针AngHV RAA-Probe,在不同温度下进行实时荧光RAA检测。结果显示,在39 ℃条件下,实时荧光RAA反应可获得最高荧光吸收值;在所有温度条件下,从第 10个循环(5 min)开始出现稳定阳性信号;在39、42 ℃条件下,从第30个循环(15 min)进入荧光信号采集平台期(图2)。为确保反应充分,后续试验以39 ℃作为最优反应温度,以40个循环(20 min)作为最优反应时间。
2.3 实时荧光RAA方法的灵敏度检测
以10 倍倍比稀释的pCE2-TA/Blunt-ORF95S为模板进行实时荧光RAA 检测。结果显示:1×107~1×105 copies/μL的病毒,从第 10个循环开始出现稳定阳性信号;1×104~1×102 copies/μL的病毒,从第20个循环开始出现始稳定阳性信号;而1×101 copies/μL的病毒及阴性对照,在40个循环内均无明显的扩增信号(图3)。因此,实时荧光RAA方法的最低AngHV检测量为1×102 copies/μL。
2.4 实时荧光RAA方法的特异性检测
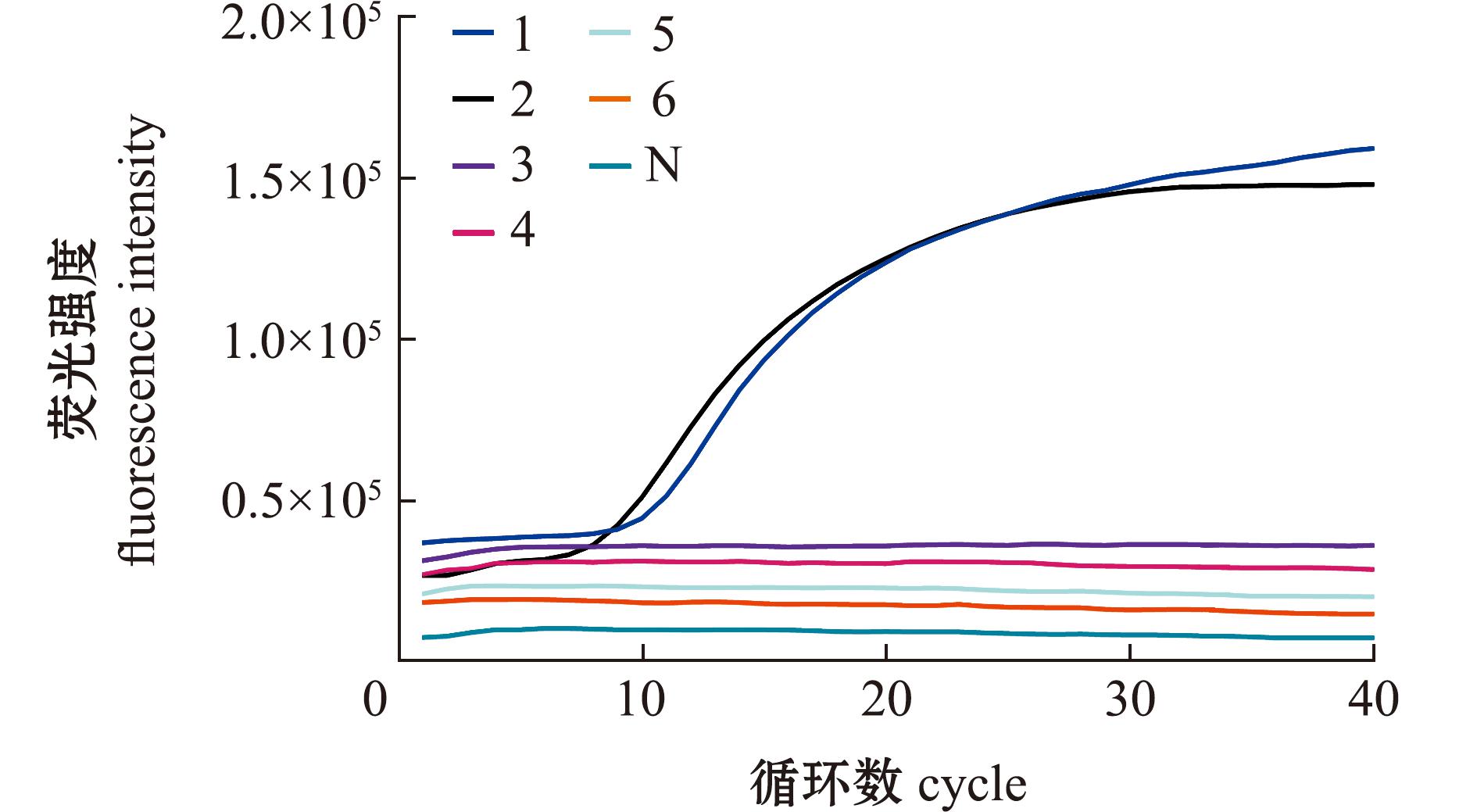
利用常见的水产动物病毒株进行特异性检测,结果显示,仅AngHV和阳性质粒pCE2-TA/Blunt-ORF95S出现扩增曲线,而AEAdoV、RGV、 KHV、WSSV和阴性对照均未出现扩增曲线(图4)。这表明,该实时荧光RAA检测方法对AngHV具有较好的特异性,且与AEAdoV、RGV、 KHV和WSSV等无交叉反应。
2.5 实时荧光RAA方法的重复性检测
用1×106、1×105、1×104 copies/μL 3个浓度的阳性标准品分别进行实时荧光RAA的重复性检测。结果显示:3个浓度样品的组内变异系数均小于5%,分别为1.7%、3.4%、4.4%;组间变异系数同样小于5%,分别为1.4%、2.9%和4.8%(表2)。这表明,该检测方法重复性好,可保证检测结果的稳定性和可靠性。
表2 AngHV实时荧光RAA检测的重复性
Tab.2 Repeatability of real-time fluorescence RAA assay for detection of AngHV

质粒浓度/(copies·μL-1)plasmid concentration组内变异系数 coefficient of variation in the groups组间变异系数coefficient of variation among the groups组内CT值CT value in the group变异系数/%coefficient of variation组间CT值CT value among the groups变异系数/%coefficient of variation1×1065.82±0.101.75.76±0.0811.41×1057.50±0.253.47.73±0.2302.91×1048.81±0.394.48.48±0.4104.8
2.6 实时荧光RAA检测方法的应用
利用前期建立的qPCR方法对收集的25个鳗鲡脱黏败血综合征病料样品进行检测,共检出AngHV阳性样品23个,阴性样品2个。
进一步用实时荧光RAA和普通PCR方法对样品进行检测,结果显示,实时荧光RAA的检测结果与qPCR的检测结果一致,阳性检出数均为23个,而普通PCR的阳性检出数为19个,普通PCR的阳性检出率(76%)明显低于实时荧光RAA的检出率(92%)(表3)。
表3 AngHV实时荧光RAA的应用
Tab.3 Application of real-time fluorescence RAA assay for detection of AngHV

方法method 阳性样品检出数量detection number of the positive阳性检出率/%detection rate of the positive实时荧光RAA2392qPCR2392PCR1976
3 讨论
3.1 建立实时荧光RAA检测方法的依据
由AngHV感染所引起的脱黏败血综合征是鳗鲡黑仔和幼鳗阶段发生率最高、危害严重的传染性疾病[8,10],病鳗常出现皮肤脱黏、红头、烂鳃和败血等症状,严重威胁着鳗鲡养殖业的发展[11]。AngHV的一个重要特征是可形成潜伏感染,此时病毒在鱼体中的载量较低,并不会引起典型的临床症状[5,12]。因此,对AngHV进行快速、灵敏和准确的检测,尽快采取积极的防控措施,是降低AngHV感染的关键环节,也是避免引入潜伏感染苗种的重要保障。
目前,AngHV核酸分子检测技术主要依赖于PCR和qPCR[17-18],但上述方法对设备和操作有较高的要求,且耗时较长。RAA作为一种新型的核酸扩增技术,与PCR技术相比,可在35~45 ℃的恒温条件下进行扩增,一般在30 min内即可获得结果,且不需要昂贵的变温热循环仪,操作相对简单[19-20]。因此,RAA技术在食品安全[23]、病原微生物检测 [24]等方面均具有广泛的应用潜力。在水生动物的疫病检测方面,Kanitchinda等[25]将该技术应用在虾肝肠胞虫(Enterocytozoon hepatopenaei)的检测上,Wang等[26]建立了针对草鱼呼肠孤病毒 (grass carpreo virus,GCRV)的实时荧光RAA检测方法,杨惠源等[27]建立了鰤诺卡氏菌(Nocardia seriolae)的RAA检测方法。上述工作为在AngHV上实现实时荧光RAA的检测提供了可靠的参考依据。
3.2 实时荧光RAA检测方法的影响因素
靶序列选择是影响实时荧光RAA检测效率和特异性的主要决定因素。前期研究表明,AngHV病毒粒子由核衣壳、间质层和囊膜组成[22],囊膜蛋白与病毒入侵宿主细胞等密切相关[28]。在编码病毒囊膜蛋白的基因中,ORF95基因丰度相对较高[22],且在不同AngHV毒株间的序列保守性较强[29],因此,本研究中设计的引物和探针,以ORF95基因的保守区序列为模板。在对检测方法的优化中,本研究中确认了AngHV实时荧光RAA反应的最佳温度为39 ℃,且5 min左右即开始出现稳定荧光信号,15 min可到达荧光信号采集平台期。这表明,AngHV的实时荧光RAA检测方法所需时间较短。需要注意的是,由于反应速率快,在充分混匀各组分后,应尽快置入仪器采集荧光信号,避免错过起峰时间而直接进入荧光信号采集平台期,从而造成结果误判[30]。
灵敏度是影响病毒早期诊断结果的一个重要因素。病毒性疾病一般在暴发之前,存在一个低水平感染的积累期。高灵敏的方法可以更早地检测到病毒感染,以便尽早地进行预警。本研究中建立的AngHV实时荧光RAA检测方法最低可以检测到1×102 copies/μL病毒,其灵敏度为普通PCR的100倍,因此,可在较低感染水平上检测出AngHV。同时,实时荧光RAA对AngHV具有良好的特异性,对几种常见的水生动物DNA病毒无交叉反应。该检测方法的重复性较佳,组间和组内变异系数均小于5%。上述结果表明,实时荧光RAA检测方法具有较高的可靠性。而在临床样品的应用检测中,实时荧光RAA的阳性检出率(92%)远高于普通 PCR的检出率(76%)。加上实时荧光RAA在操作性能方面具有的优势,如反应体系所需的酶均以冻干粉形式保存,方便运输;反应不需要精确的热循环,只需要有限的设备支持,如便携式迷你离心机、水/金属浴和小型荧光采集仪等,因此,该检测方法更加适合基层或简易实验室对AngHV的快速检测。
4 结论
1)本研究中根据AngHV的ORF95基因序列,通过引物设计、反应温度优化及反应时间确定,建立了AngHV的实时荧光RAA检测方法,该方法的阳性检出率远高于普通 PCR,与实时荧光PCR的检出率相当。
2)实时荧光RAA检测方法最佳反应温度为39 ℃,可在20 min内得到检测结果,对AngHV的最低检测量为1×102 copies/μL,且特异性强、重复性好,对于临床样品的检出率高,可用于AngHV的临床快速检测。
参考文献:
[1] 葛均青,杨金先,龚晖,等.鳗鲡疱疹病毒的分离与鉴定[J].水产学报,2014,38(9):1579-1583. GE J Q,YANG J X,GONG H,et al.Isolation and identification of a herpesvirus from cultured European eels Anguilla anguilla in China[J].Journal of Fisheries of China,2014,38(9):1579-1583.(in Chinese)
[2] 杨金先,李英英,陈强,等.美洲鳗鲡“脱黏败血综合征”病原的分离鉴定及其致病性研究[J].中国预防兽医学报,2023,45(2):138-143. YANG J X,LI Y Y,CHEN Q,et al.Isolation,identification and pathogenicity of the pathogen of “mucus sloughing and hemorrhagic septicemia disease” in American eel,Anguilla rostrata[J].Chinese Journal of Preventive Veterinary Medicine,2023,45(2):138-143.(in Chinese)
[3] SANO M,FUKUDA H,SANO T.Isolation and characterization of a new herpesvirus from eel[M]//Pathology in marine science.Amsterdam:Elsevier,1990:15-31.
[4] CHANG P H,PAN Y H,WU C M,et al.Isolation and molecular characterization of herpesvirus from cultured European eels Anguilla anguilla in Taiwan [J].Diseases of Aquatic Organisms,2002,50(2):111-118.
[5] JAKOB E,NEUHAUS H,STEINHAGEN D,et al.Monitoring of Herpesvirus anguillae (HVA) infections in European eel,Anguilla anguilla (L.),in northern Germany[J].Journal of Fish Diseases,2009,32(6):557-561.
[6] KIM H J,YU J H,KIM D W,et al.Molecular evidence of anguillid herpesvirus-1 (AngHV-1) in the farmed Japanese eel,Anguilla japonica Temminck &Schlegel,in Korea[J].Journal of Fish Diseases,2012,35(4):315-319.
[7] MCCONVILLE J,FRINGUELLI E,EVANS D,et al.First examination of the lough neagh European eel (Anguilla anguilla) population for eel virus European,eel virus European X and Anguillid herpesvirus-1 infection by employing novel molecular techniques[J].Journal of Fish Diseases,2018,41(12):1783-1791.
[8] 樊海平.养殖美洲鳗鲡的主要疾病与防治[J].台湾海峡,1998,17(4):477-481. FAN H P.Diseases prevention and treatment of cultured American eel,Anguilla rostrata[J].Journal of Oceanography in Taiwan Strait,1998,17(4):477-481.(in Chinese)
[9] 樊海平,杨明,张蕉霖,等.鳗鲡疱疹病毒的流行情况与控制技术[J].科学养鱼,2019(8):46-48. FAN H P, YANG M, ZHANG J L,et al.Epidemic situation and control technique for anguillid herpesvirus HVA[J].Scientific Fish Farming,2019(8):46-48.(in Chinese)
[10] 樊海平.鳗鲡病害发生的现状及防治关键[J].科学养鱼,2000(5):5-6. FAN H P.Current situation and control key of eel diseases[J].Scientific Fish Farming,2000(5):5-6.(in Chinese)
[11] 陈强,李英英,杨金先,等.鳗鲡疱疹病毒对欧洲鳗鲡的致病性[J].水产学报,2021,45(6):940-947. CHEN Q,LI Y Y,YANG J X,et al.Pathogenicity of anguillid herpesvirus to Anguilla anguilla[J].Journal of Fisheries of China,2021,45(6):940-947.(in Chinese)
[12] VAN NIEUWSTADT A P,DIJKSTRA S G,HAENEN O.Persistence of herpesvirus of eel Herpesvirus anguillae in farmed European eel Anguilla anguilla[J].Diseases of Aquatic Organisms,2001,45:103-107.
[13] HANSON L,DISHON A,KOTLER M.Herpesviruses that infect fish[J].Viruses,2011,3(11):2160-2191.
[14] DAVIDSE A,HAENEN O L M,DIJKSTRA S G,et al.First isolation of herpesvirus of eel (Herpesvirus anguillae) in diseased European eel (Anguilla anguilla L.) in Europe[J].Bulletin of the European Association of Fish Pathologists,1999,19(4):137-141.
[15] DAVISON A J,EBERLE R,EHLERS B,et al.The order Herpesvirales[J].Archives of Virology,2009,154(1):171-177.
[16] 杨金先,陈强,李英英,等.鳗鲡疱疹病毒的生物学及理化特性[J].水产学报,2020,44(9):1435-1440. YANG J X,CHEN Q,LI Y Y,et al.Biological and physicochemical characteristics of anguillid herpesvirus[J].Journal of Fisheries of China,2020,44(9):1435-1440.(in Chinese)
[17] 李英英,杨金先,陈曦,等.鳗鲡疱疹病毒SYBR Green Ⅰ实时荧光定量PCR检测方法的建立与应用[J].水产学报,2021,45(5):769-777. LI Y Y,YANG J X,CHEN X,et al.Establishment and application of SYBR Green Ⅰ real-time fluorescence quantitative PCR for detection of anguillid herpesvirus[J].Journal of Fisheries of China,2021,45(5):769-777.(in Chinese)
[18] 葛均青,杨金先,李友娟,等.鳗鲡病毒性疾病病料中鳗鲡疱疹病毒的PCR检测[J].福建农业学报,2012,27(9):961-964. GE J Q,YANG J X,LI Y J,et al.Polymerase chain reaction for the detection of herpesvirus anguillae in eel viral disease samples[J].Fujian Journal of Agricultural Sciences,2012,27(9):961-964.(in Chinese)
[19] PIEPENBURG O,WILLIAMS C H,STEMPLE D L,et al.DNA detection using recombination proteins[J].PLoS Biology,2006,4(7):e204.
[20] 吕蓓,程海荣,严庆丰,等.用重组酶介导扩增技术快速扩增核酸[J].中国科学:生命科学,2010,40(10):983-988. LÜ B,CHENG H R,YAN Q F,et al.Recombinase-aid amplification:a novel technology of in vitro rapid nucleic acid amplification[J].Scientia Sinica (Vitae),2010,40(10):983-988.(in Chinese)
[21] CHEN X,YANG J X,LI Y Y,et al.Anguillid herpesvirus 1 (AngHV) ORF95 encodes a late,structural envelope protein[J].Virus Genes,2021,57(3):280-283.
[22] VAN BEURDEN S J,LEROY B,WATTIEZ R,et al.Identification and localization of the structural proteins of anguillid herpesvirus 1[J].Veterinary Research,2011,42:105.
[23] 曹丙蕾,王群,刘敏,等.重组酶聚合酶扩增技术在动物源性食品检测中的应用[J].食品科技,2022,47(8):312-316. CAO B L,WANG Q,LIU M,et al.Application of recombinant enzyme polymerase amplification technology in the detection of animal derived food[J].Food Science and Technology,2022,47(8):312-316.(in Chinese)
[24] 马巧妮,王萌,朱兴全.重组酶介导扩增技术及其在病原微生物快速检测中的应用进展[J].中国生物工程杂志,2021,41(6):45-49. MA Q N,WANG M,ZHU X Q.Research advances in recombinase-aided amplification technology and its application in rapid detection of pathogenic microorganisms[J].China Biotechnology,2021,41(6):45-49.(in Chinese)
[25] KANITCHINDA S,SRISALA J,SUEBSING R,et al.CRISPR-Cas fluorescent cleavage assay coupled with recombinase polymerase amplification for sensitive and specific detection of Enterocytozoon hepatopenaei[J].Biotechnology Reports,2020,27:e00485.
[26] WANG H,ZHOU S T,WEN J X,et al.A real-time reverse-transcription isothermal recombinase polymerase amplification assay for the rapid detection of genotype III grass carp (Ctenopharyngodon idella) reovirus[J].Journal of Virological Methods,2020,277:113802.
[27] 杨惠源,陈国权,温依铭,等.重组酶介导等温扩增技术检测鰤鱼诺卡氏菌方法的建立[J].大连海洋大学学报,2023,38(1):104-111. YANG H Y,CHEN G Q,WEN Y M,et al.Establishment of a recombinase-aided amplification (RAA) assay for detection of Nocardia seriolae[J].Journal of Dalian Ocean University,2023,38(1):104-111.(in Chinese)
[28] BRIDEAU A D,ENQUIST L W,TIRABASSI R S.The role of virion membrane protein endocytosis in the herpesvirus life cycle[J].Journal of Clinical Virology,2000,17(2):69-82.
[29] DONOHOE O,ZHANG H Y,DELREZ N,et al.Genomes of anguillid herpesvirus 1 strains reveal evolutionary disparities and low genetic diversity in the genus Cyprinivirus[J].Microorganisms,2021,9(5):998.
[30] 施奕,徐昌平,余蓓蓓,等.重组酶聚合酶扩增技术研究进展[J].病毒学报,2020,36(3):522-532. SHI Y,XU C P,YU B B,et al.Research progress in recombinase polymerase amplification(RPA)[J].Chinese Journal of Virology,2020,36(3):522-532.(in Chinese)
Development and application of a real-time fluorescence recombinase- aided amplification method for detection of Anguillid herpesvirus
CHEN Xi,YANG Jinxian,GE Junqing*
(Institute of Biotechnology,Fujian Academy of Agricultural Science,Fuzhou 350003,China)
Abstract: In order to establish a real-time fluorescence recombinase-aided amplification (RAA) method for detection of Anguillid herpesvirus (AngHV), a primer pair and probe targeting ORF95 sequence of AngHV was designed, followed by optimizing the reaction temperature and fixing the reaction time. The results showed that the established real-time fluorescence RAA had optimal reaction temperature of 39 ℃, with the reaction time of 20 min. The further evaluation of sensitivity, specificity, and repeatability showed that the detection method had the minimum AngHV detection concentration of 1×102 copies/μL and had high specificity on AngHV, and showed no cross amplification reaction with American eel adomavirus(AEAdoV), Rana grylio virus(RGV), Koi herpesvirus(KHV), and White spot syndrome virus (WSSV). There was less than 5% of co-efficiency of variation within and between groups for the method which was then applied to analyse 25 collected samples. It was found that the detection rate of the real-time fluorescence RAA was consistent with that by qPCR of 92%, but much higer than PCR with the detection rate of 76%. These results revealed that the established RAA method for detection of AngHV was rapid, sensitive, reliable, and accurate, which is used for rapid clinical detection and conducting epidemiological investigations on AngHV.
Key words: Anguillid herpesvirus (AngHV); real-time fluorescence recombinase-aided amplification; rapid detection