中国花鲈(Lateolabrax maculatus)又名花鲈,生性凶猛,为肉食性鱼类,分布于日本北海道、俄罗斯滨海边疆区、朝鲜到中国雷州半岛以西海域[1]。中国花鲈富含蛋白质、脂肪和碳水化合物等营养成分,具有极高的经济价值,是中国水产养殖3大鱼类之一,在中国的多个沿海省区均有养殖,其中在广东省的产量位居前列,年生产量占中国该品种总产量的一半以上。2021年,中国的该品种花鲈年产量超过19.9万t,在中国经济鱼类的养殖产量中居于顶端位置[1]。
动物的生长发育受诸多因子调控(如环境因子、营养条件和遗传因素等)[2-3],经过不断地深入研究,人们开始意识到肠道微生物在动物生长发育方面起到重要作用[3]。肠道微生物与动物生理状态息息相关,即使是同一物种也可能存在巨大差异,这些微生物根据数量可分为优势菌群和次要菌群。优势菌群一般指种群密度大的菌类,如人类肠道中常见的类杆菌、双歧杆菌和肠杆菌等。优势菌群很大程度上决定了菌群的功能,对动物生理调节起到重要作用[4]。有些菌群数量虽少,但也被认为是优势菌群,这是因为其对动物生理调控的功能较为重要。次要菌群一般指在动物肠道中数量较少的菌类,这类菌的特点是流动性大且具有潜在致病性[4-5]。
肠道微生物对动物生理调控是多方面的。如在吸收代谢方面,日常食物中有多种糖类动物并非都可以自行利用,此时寄宿在动物肠道中的菌群开始发挥作用,如厚壁菌门作为人体肠道中的优势菌群之一,该门的大多数菌可以将一些宿主无法吸收的多糖通过发酵转化为丁酸最终被利用;人体肠道内第二大优势类群拟杆菌门能够降解碳水化合物,为宿主提供来自食物10%~15%的能量[6-7]。现已确定肠道微生物和宿主健康存在直接关系,并对宿主生长发育具有积极作用[4] ,水产养殖生产过程中也会使用微生物制剂,或是将某些有益菌拌料进行投喂。在此条件下养殖的鱼虾生长往往更快且有更强的抗病力。Ji等[8]通过向中国鲈鱼投喂拌有不同浓度枯草芽孢杆菌(Bacillus subtilis)的饲料,发现饲料中适量添加枯草芽孢杆菌可有效提升试验个体的抗病力。枯草芽孢杆菌常被用作水产养殖的微生物制剂,主要作用是改善养殖动物肠道微生物结构并提高抗病力。Taoka等[9]也表明,充足的枯草芽孢杆菌膳食补充可以提高水生动物的抗病能力和抗氧化能力。Barnes等[10]认为,肠道微生物在宿主生命周期中发挥着不可或缺的作用,其丰度和结构与宿主生命活动密切相关。变形杆菌和放线杆菌是常见的致病菌,与动物肠道炎症、免疫紊乱和其他疾病密切相关,其丰度的增加可能在一定程度上改变动物肠道微生物结构,进而引发疾病。芽孢杆菌可以分泌淀粉酶和脂肪酶,这可以减少动物肝脏的代谢压力,从而降低肝炎发生的概率[11]。
肠道微生物在鱼类生长阶段处在一个动态平衡的状态,并受到多重因素的影响。微生物的定植在宿主还是幼体时就已开始[12],对斑点叉尾鮰(Ictalurus punctatus)[13]和斑马鱼(Danio rerio)[14]的研究表明,鱼类在生长发育过程中肠道菌群是在不断变化的。饮食被认为是贯穿始终并对动物肠道微生物有重大影响的因素之一,食性会对动物肠道微生物有显著影响,食性差异越大,动物肠道菌群差异就越大[15],即使食性相同,投喂饲料所含蛋白质的占比不同也会影响动物肠道菌群的丰度[16]。还有研究表明,为了适应肠道状态的改变,亚洲鲈在饥饿时肠道中拟杆菌门和β-变形菌门会迅速增加[17]。此外,能够影响动物肠道微生物的因素甚至还包括季节变化等[15]。
水产养殖中,养殖户开始使用一些有益菌调节养殖生物的肠道微生物,如厚壁菌门下的枯草芽孢杆菌,就常被用于拌料投喂凡纳滨对虾(Litopenaeus vannamei)[18]和石斑鱼[Epinephelus fuscoguttatus(♀)×E.lanceolatus(♂)][19]。Tsai等[20]用拌有芽孢杆菌的饲料喂养凡纳滨对虾60 d,结果发现,试验组生长显著优于对照组,且肠道总菌数和枯草芽孢杆菌种群密度也高于对照组。细菌性肠炎是对虾养殖中经常遇到的问题,其主要原因之一是肠道微生物紊乱。此时,对虾肠道内致病菌如发光弧菌和大肠杆菌增加,伴随着有益菌丰度降低,与之相关的免疫、营养功能出现异常。为此养殖户会使用微生物制剂预防疾病暴发。Mahjoub等[21]和Wu等[22]研究表明,额外添加有益菌可以改善养殖动物肠道微生物结构,其作用之一就是通过生态位竞争降低致病菌丰度。可见,通过改善肠道微生物可提升宿主的生长、免疫和营养等水平。
肠道微生物被广泛认为可以有效调节水生动物的生长,然而关于中国花鲈不同生长阶段的肠道微生物差异及环境对其肠道微生物的影响尚未见报道[23]。本研究中,分析了中国花鲈不同生长阶段的肠道微生物差异及环境对其肠道微生物的影响,以期为促进中国花鲈的健康养殖提供基础数据。
试验于2020年9月22日在广东省珠海市斗门区白蕉镇中国花鲈养殖区进行,试验选取9口传统养殖土塘(每个塘平均0.667 hm2,养殖密度为1万尾/0.0667 hm2),根据不同生长阶段将中国花鲈分为小规格组(3月龄)、中规格组(6月龄)和大规格组(9月龄),小、中、大规格组体质量分别为(79.89±14.97)、(212.67±30.32)、(427.56±69.56)g,每组设3个平行。随机从各不同月龄的养殖池塘中分别取中国花鲈50尾,测量其平均体质量。
1.2.1 肠道和养殖环境样本采集
肠道样本:从每个组取18尾健康的中国花鲈用于肠道菌群分析,根据Rungrassamee等[24]的方法,在10 mL离心管中收集来自每个池塘3尾鱼的肠道内容物,每组分为6份样品。根据取样鱼的月龄分别标记为SI组(SI1~SI6)、MI组(MI1~MI6)和BI组(BI1~BI6)(SI、MI和BI分别代表 3、6、9月龄中国花鲈肠道样品)。
水体样本:使用梅花点取样法(4条对角线和池塘中心区域)在水面以下50 cm的深度采集1 L水样,使用隔膜真空泵(GM-1.0A,Jinteng)通过膜(0.45 μm)过滤,收集生物样品,分别标记为SW组、MW组和BW组(SW、MW和BW分别代表 3、6、9月龄中国花鲈养殖水体样品),每组设置6个重复[25]。
底泥样本:用类似的方法采集底泥,在池塘的不同点用采泥器取样并在无菌研钵中混匀再保存,分别标记为SS组、MS组和BS组(SS、MS和BS分别代表 3、6、9月龄中国花鲈养殖底泥样品),每组设置6个重复。所有样品在-80 ℃下超低温冰箱中保存,直到送检。
1.2.2 水质指标测定 养殖水体样本用0.45 μm玻璃纤维微过滤器(天津市津腾实验设备有限公司)过滤。使用上海三新仪器厂生产的SX-610电分析仪检测水温和pH值,使用光学盐度计检测盐度,采用纳氏试剂法、锌-镉还原法和重氮-偶氮光度法分别测定氨氮![]() 亚硝酸盐氮
亚硝酸盐氮![]() 和硝酸盐氮
和硝酸盐氮![]() 的含量[26]。
的含量[26]。
1.2.3 DNA提取和测序 采用CTAB/SDS法提取样品的全基因组DNA,用10 g/L琼脂糖凝胶检测脱氧核糖核酸的浓度和纯度。使用无菌水将DNA稀释至1 ng/μL,将得到的DNA进行扩增,对得到的PCR产物在20 g/L琼脂糖凝胶上进行电泳检测。将PCR产物以等密度比例混合,用Qiagen凝胶提取试剂盒(Qiagen,德国)纯化混合PCR产物[27]。
使用TruSeq®DNA PCR-Free Sample Preparation Kit进行文库构建,并添加索引代码。在Qubit@2.0荧光计(Thermo Scientific)和安捷伦生物分析仪2100系统上评估文库质量。最后在Illumina NovaSeq平台上对文库进行测序,并产生250 bp的配对末端读数[28]。
1.2.4 数据处理和物种注释 首先对原始数据(raw data)进行拼接、过滤,得到有效数据(clean data),然后基于有效数据进行OTUs(operational taxonomic units )聚类和物种分类分析。根据OTUs聚类结果,对每个OTU的代表序列做物种注释,得到对应的物种信息和物种丰度分布情况。同时,对OTUs进行丰度、Alpha多样性和Venn等分析,得到样本内物种丰富度和均匀度信息,以及不同样本或分组间的共有和特有OTUs信息等。
1.2.5 微生物多样性分析 对OTUs进行多序列比对并构建系统发生树,通过PCoA、PCA和NMDS等降维分析,探究不同样本或组别间的群落结构差异。为进一步挖掘分组样本间的群落结构差异,选用T-test、Simper、LefSe等统计分析方法对分组样本的物种组成和群落结构进行差异显著性检验。
1.2.6 环境因子分析与微生物功能预测 结合环境因素进行CCA分析及多样性指数与环境因子的相关性分析,得到显著影响组间群落变化的环境因子。扩增子的注释结果还与相应的功能数据库相关联,采用Tax4Fun软件对生态样本中的微生物群落进行功能预测分析。
从表1可见:随花鲈生长发育阶段的改变,养殖水体pH略呈上升趋势,亚硝酸盐氮和氨氮含量均呈先升高后降低的趋势,硝酸盐氮含量则呈先降低后升高的趋势;3个养殖阶段水体中,仅氨氮含量有显著性差异(P<0.05),其他3个水环境指标均无显著性差异(P>0.05)。
表1 不同生长阶段中国花鲈养殖水体水质的变化
Tab.1 Change in water quality in culture of Lateolabrax maculatus at different growth stages
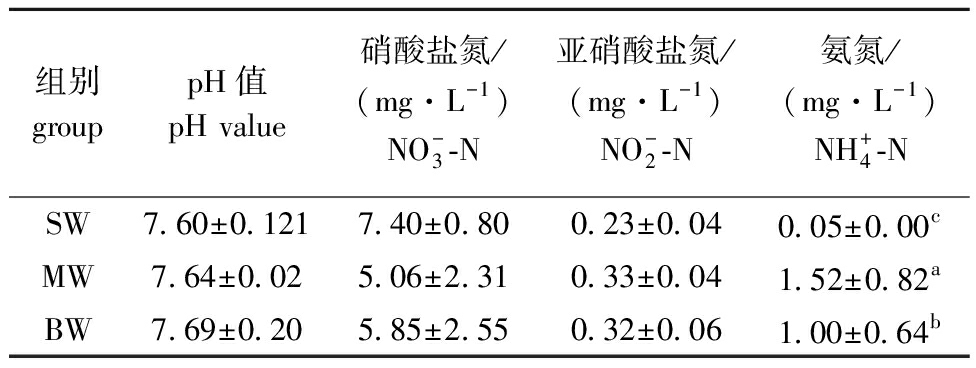
组别grouppH值pH value硝酸盐氮/(mg·L-1)NO-3-N亚硝酸盐氮/(mg·L-1)NO-2-N氨氮/(mg·L-1)NH+4-NSW7.60±0.1217.40±0.800.23±0.040.05±0.00cMW7.64±0.025.06±2.310.33±0.041.52±0.82aBW7.69±0.205.85±2.550.32±0.061.00±0.64b
注:SW、MW、BW分别代表3、6、9月龄中国花鲈养殖水体水样。同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:SW,MW,and BW represent 3,6 and 9-month-old Lateolabrax maculatus aquaculture water sample.The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
样本16S rDNA测序结果显示,平均每个样品测得83 170条tags,经过质控平均得到78 552条有效数据,质控有效数据量达53 169 条,质控有效率达63.81%。以97%的一致性(identity)将序列聚类成OTUs,共得到8 809个OTUs,然后对OTUs序列与Silva132数据库进行物种注释。
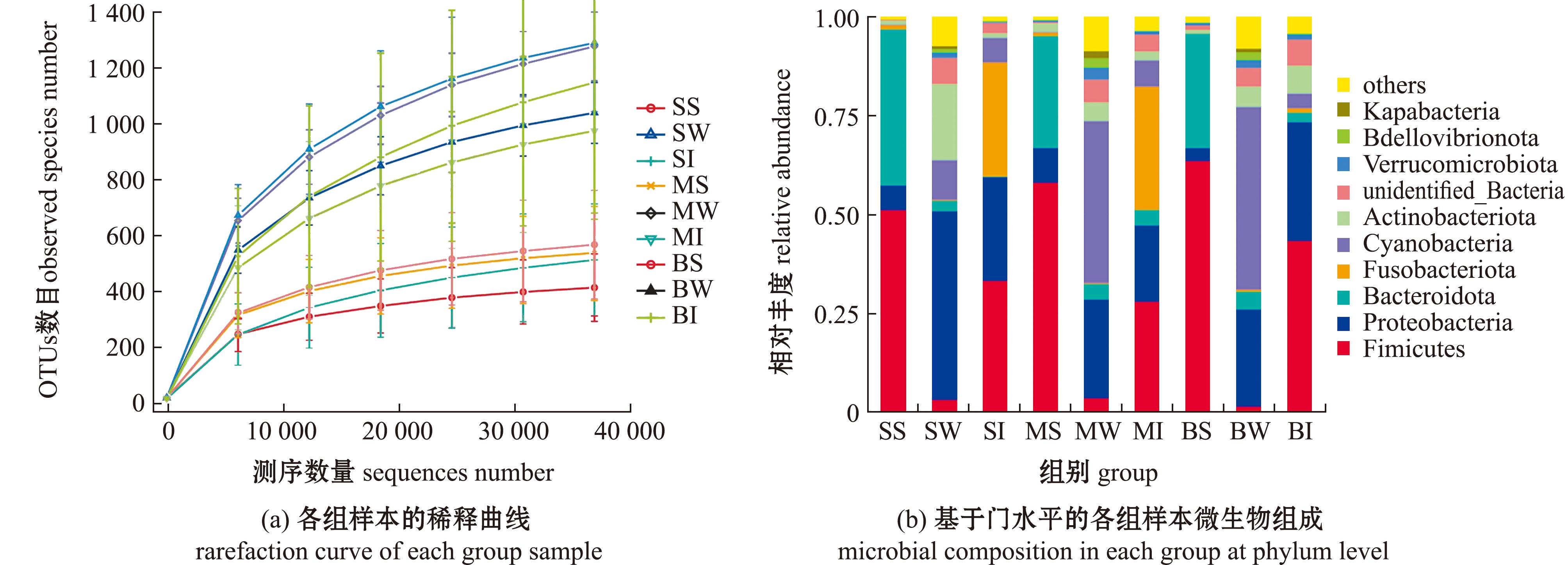
与数据库Silva132比对并进行物种注释,共鉴定出2界84门183纲400目585科1 070属634种,并对不同分类层级统计发现,共有 8 809个OTUs,其中,能够注释到数据库的OTUs数目为 7 942(占比90.16%),注释到界水平的比例为90.16%,门水平的比例为78.87%,纲水平的比例为76.81%,目水平的比例为69.81%,科水平的比例为58.10%,属水平的比例为38.24%,种水平的比例为8.34%。对各组样本的稀释曲线分析显示,各组样本稀释曲线最终趋于平坦,说明测序更多的数据量,OTU的种类只会少量增加(图1(a))。表明这些测序数据结果合理。
SI、MI和BI分别代表 3、6、9月龄中国花鲈肠道样品;SW、MW和BW分别代表3、6、9月龄中国花鲈养殖水体样品;SS、MS和BS分别代表 3、6、9月龄中国花鲈养殖底泥样品,下同。
Note:SI,MI,and BI represent intestinal samples of 3,6,and 9-month-old Lateolabrax maculatus,respectively;SW,MW,and BW represent water samples from 3,6,and 9-month-old Lateolabrax maculatus aquaculture ,respectively;SS,MS,and BS represent sediment samples from 3-month-old,6-month-old,and 9-month-old Lateolabrax maculatus culture,respectively,et sequentia.
图1 各组样本稀释曲线及门水平的微生物群落组成
Fig.1 Rarefaction curves and microbiota composition of samples in each group at phylum level
在门水平上,各组样本微生物的优势物种主要包括厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidota)(图1(b));在属水平上,各组样本微生物的优势物种为罗姆布茨菌属(Romboutsia)、普雷沃氏菌属(Prevotella)和邻单胞菌属(Plesiomonas),优势种为类志贺邻单胞菌(Plesiomonas shigelloides)、皮氏罗尔斯顿菌(Ralstonia pickettii)和巴黎链球菌(Streptococcus lutetiensis)。
2.3.1 养殖水体、底泥和中国花鲈肠道微生物群落Alpha多样性指数 养殖水体、底泥和中国花鲈肠道微生物群落Alpha多样性指数见表2,并通过等级聚类曲线进行可视化分析(图2(a))。Alpha多样性分析显示:3月龄和6月龄中国花鲈肠道微生物的Observed species、Shannon、Chao 1和ACE指数均比9月龄中国花鲈低,但仅3月龄与9月龄的这些指标间有显著性差异(P<0.05);3月龄、6月龄和9月龄中国花鲈养殖水体微生物各项指数间无显著性差异(P>0.05);3月龄、6月龄和9月龄中国花鲈的池塘底泥微生物各项指数间也无显著性差异(P>0.05)(表2)。每一组的覆盖率均不低于99.0%,表明测序深度已经基本覆盖到样品中所有的物种,所得数据基本能反映样品真实物种组成情况。从Venn图可见:所有样本共有的OTU为109个,其中,3月龄中国花鲈的池塘底泥微生物特有OTU 45个,养殖水体微生物特有OTU 696个,中国花鲈肠道微生物特有OTU 212个;6月龄中国花鲈的池塘底泥微生物特有OTU 87个,养殖水体微生物特有OTU 510个,中国花鲈肠道微生物特有OTU 605个;9月龄中国花鲈的池塘底泥微生物特有OTU 106个,养殖水体微生物特有OTU 653个,中国花鲈肠道微生物特有OTU 1 374个(图2(b))。
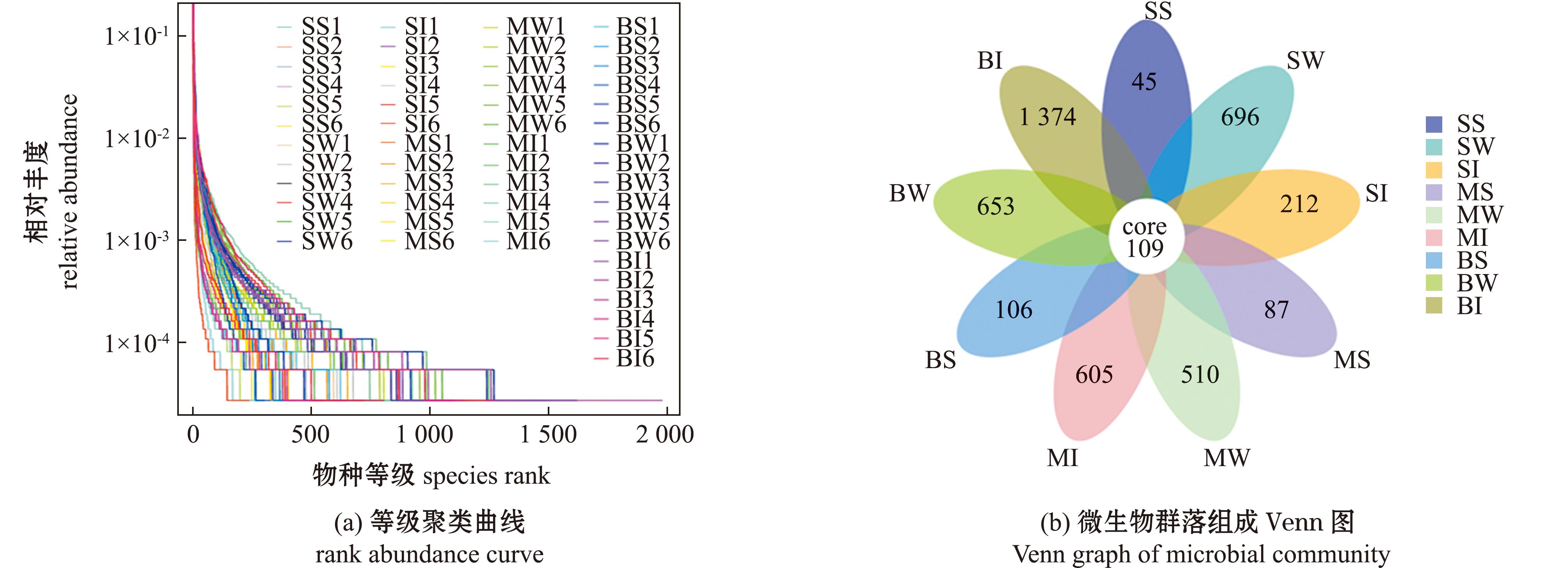
图2 Alpha多样性分析
Fig.2 Alpha diversity analysis
表2 不同样品的Alpha多样性指数
Tab.2 Alpha diversity indices of different samples
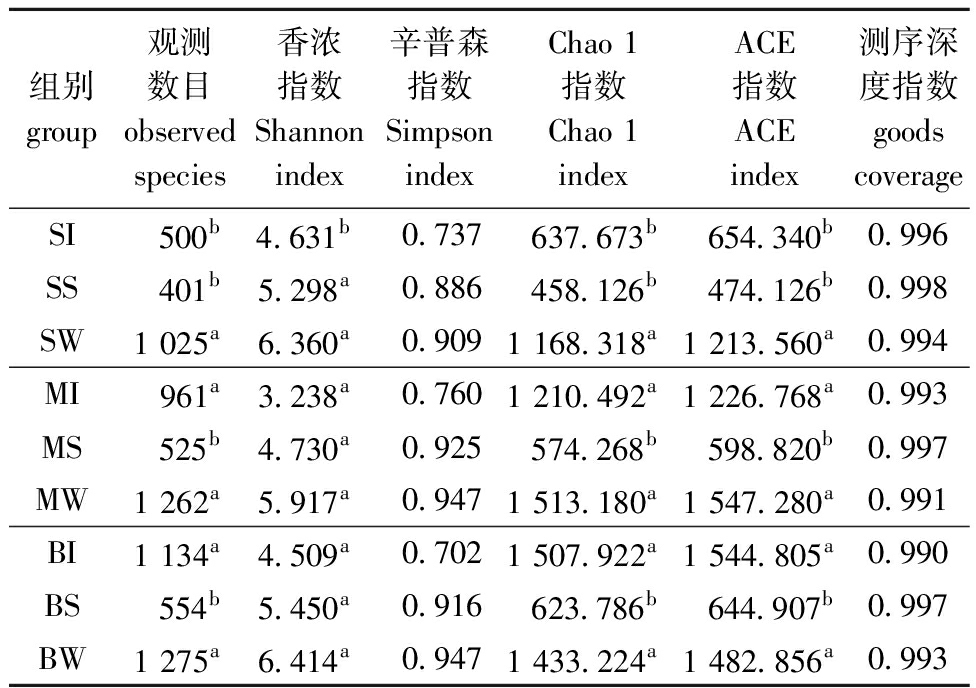
组别group观测数目observed species香浓指数Shannonindex辛普森指数SimpsonindexChao 1指数Chao 1indexACE指数ACEindex测序深度指数goods coverageSI500b4.631b0.737637.673b654.340b0.996SS401b5.298a0.886458.126b474.126b0.998SW1 025a6.360a0.9091 168.318a1 213.560a0.994MI961a3.238a0.7601 210.492a1 226.768a0.993MS525b4.730a0.925574.268b598.820b0.997MW1 262a5.917a0.9471 513.180a1 547.280a0.991BI1 134a4.509a0.7021 507.922a1 544.805a0.990BS554b5.450a0.916623.786b644.907b0.997BW1 275a6.414a0.9471 433.224a1 482.856a0.993
注:SI、MI和BI分别代表 3、6、9月龄中国花鲈肠道样品;SW、MW和BW分别代表 3、6、9月龄中国花鲈养殖水体样品;SS、MS和BS分别代表3月龄、6月龄和9月龄中国花鲈养殖底泥样品,下同。
Note:SI,MI,and BI represent intestinal samples of 3,6,and 9-months-old Lateolabrax maculatus,respectively;SW,MW,and BW represent water samples from 3,6,and 9-months-old Lateolabrax maculatus culture pond,respectively;SS,MS,and BS represent sediment samples from 3-month-old,6-month-old,and 9-month-old Lateolabrax maculatus culture,respectively,et sequentia.
2.3.2 微生物群落特征与环境因子的影响分析 对属水平上中国花鲈肠道、底泥和水中主要细菌群的物种组成进行分析,所有样本中未在该分类级别上注释的物种被合并到“others”中,各组微生物群落属水平组成见图3(a),包括罗姆布茨菌属、普雷沃氏菌属、邻单胞菌属、鲸杆菌属(Cetobacterium)、双色藻属(Cyanobium_PCC-6307)和梭状芽孢杆菌属(Clostridium_sensu_stricto_1)等。
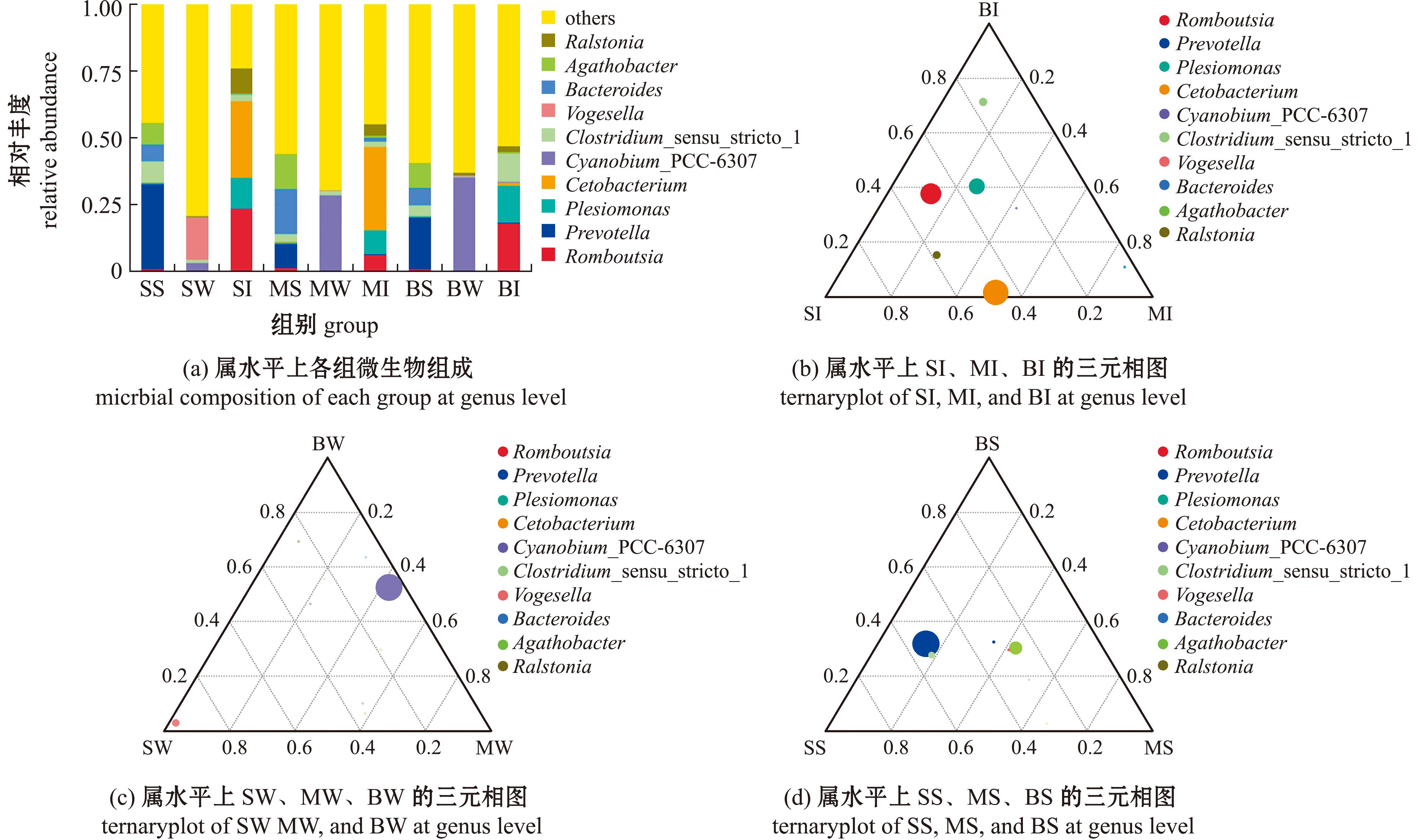
图3 不同样品微生物群落结构差异分析
Fig.3 Analysis of differences in microbial community structure among different samples
对肠道微生物分析显示,在属水平上,3月龄和6月龄中国花鲈肠道微生物中鲸杆菌属含量较高,9月龄肠道微梭状芽孢杆菌属含量较高(图3(b)),根据Bray-Curtis差异指数的分解,量化每个物种对两组之间差异的贡献度,对3月龄、6月龄和9月龄肠道微生物差异贡献度最高的是罗姆布茨菌属。对水体微生物分析显示,在属水平上,3月龄中国花鲈养殖水体中福格斯氏菌属(Vogesella)含量较高,6月龄和9月龄中国花鲈养殖水体中双色藻属含量较高(图3(c))。对底泥微生物分析显示,在属水平上,3月龄中国花鲈的养殖池底泥中普雷沃氏菌属丰度较高(图3(d))。结合环境因子分析显示,双色藻属与氨氮和亚硝酸盐氮呈正相关,与硝酸盐氮呈负相关,福格斯氏菌与硝酸盐氮呈正相关;只有3月龄中国花鲈养殖水体微生群落与氨氮和亚硝酸盐氮呈负相关(图4)。
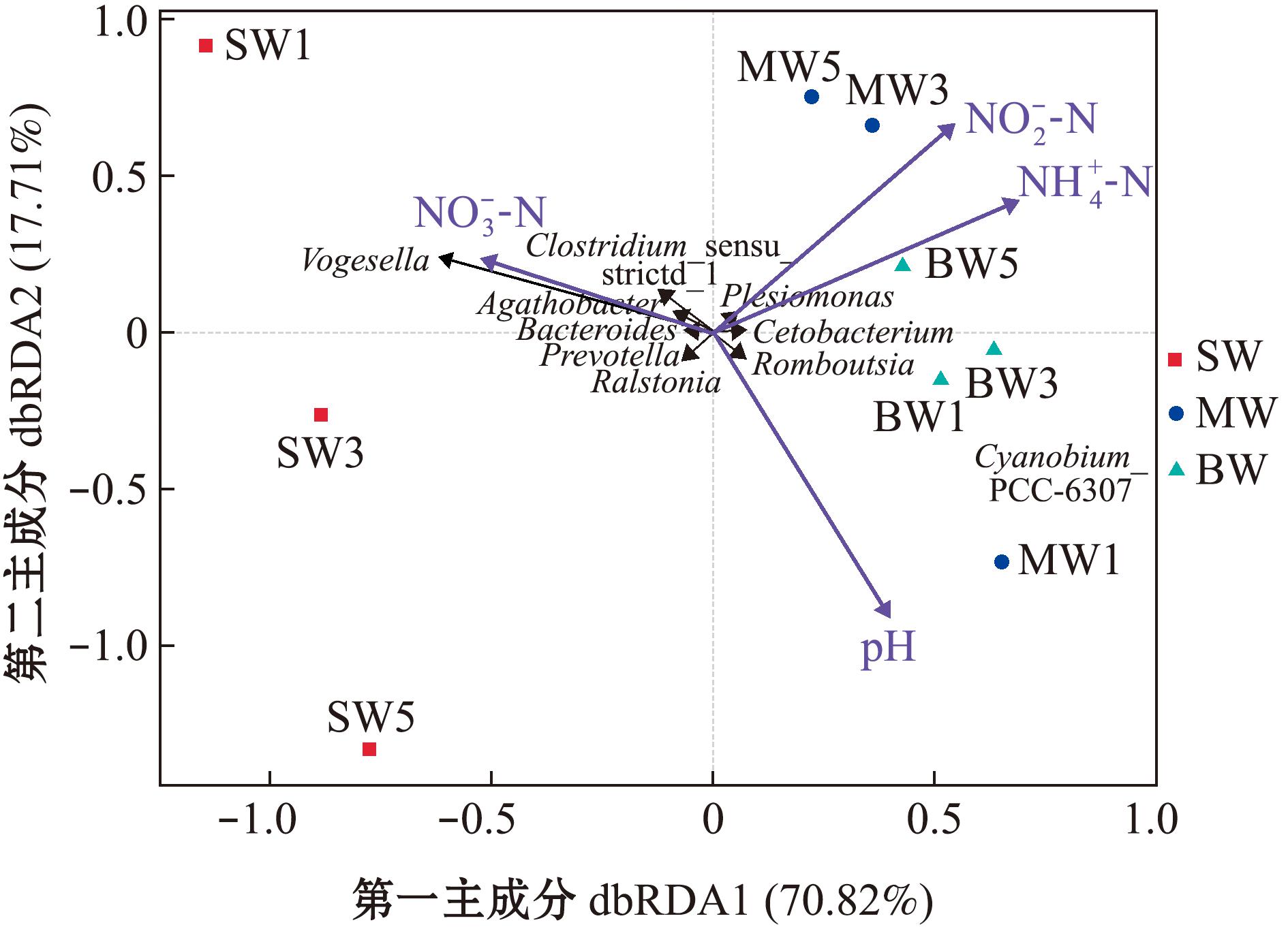
图4 水体微生物与环境因子的关联分析
Fig.4 Correlation analysis between microorganisms in water and environmental factors
PCoA分析显示,水平轴PCoA1对样品的贡献率为43.22%,而垂直轴PCoA2贡献率为16.12%(图5)。不同月龄的底泥微生物样品都聚集在第二象限,3个不同月龄的中国花鲈底泥微生物群落紧密聚类,再结合Adonis分析(表3),表明3个不同生长阶段的中国花鲈底泥微生物群落结构无显著性差异(P>0.05);不同月龄的水体微生物样品均聚集在第一象限,6月龄和9月龄中国花鲈养殖水体微生物群落紧密聚类但二者无显著性差异(P>0.05),3月龄中国花鲈养殖水体微生物群落倾向于单独聚类且与6月龄和9月龄无显著性差异(P>0.05);3月龄和9月龄中国花鲈肠道微生物距离较远,说明两个组的中国花鲈肠道微生物间有显著性差异(P<0.05),6月龄中国花鲈肠道微生物与3月龄和9月龄中国花鲈均倾向紧密聚集,6月龄中国花鲈肠道微生物与3月龄和9月龄中国花鲈间无显著性差异(P>0.05)。中国花鲈的肠道微生物在第三、四象限聚集,养殖水体微生物在第一象限聚集,底泥微生物在第二象限聚集,表明环境微生群落和肠道微生物间存在较大差异。
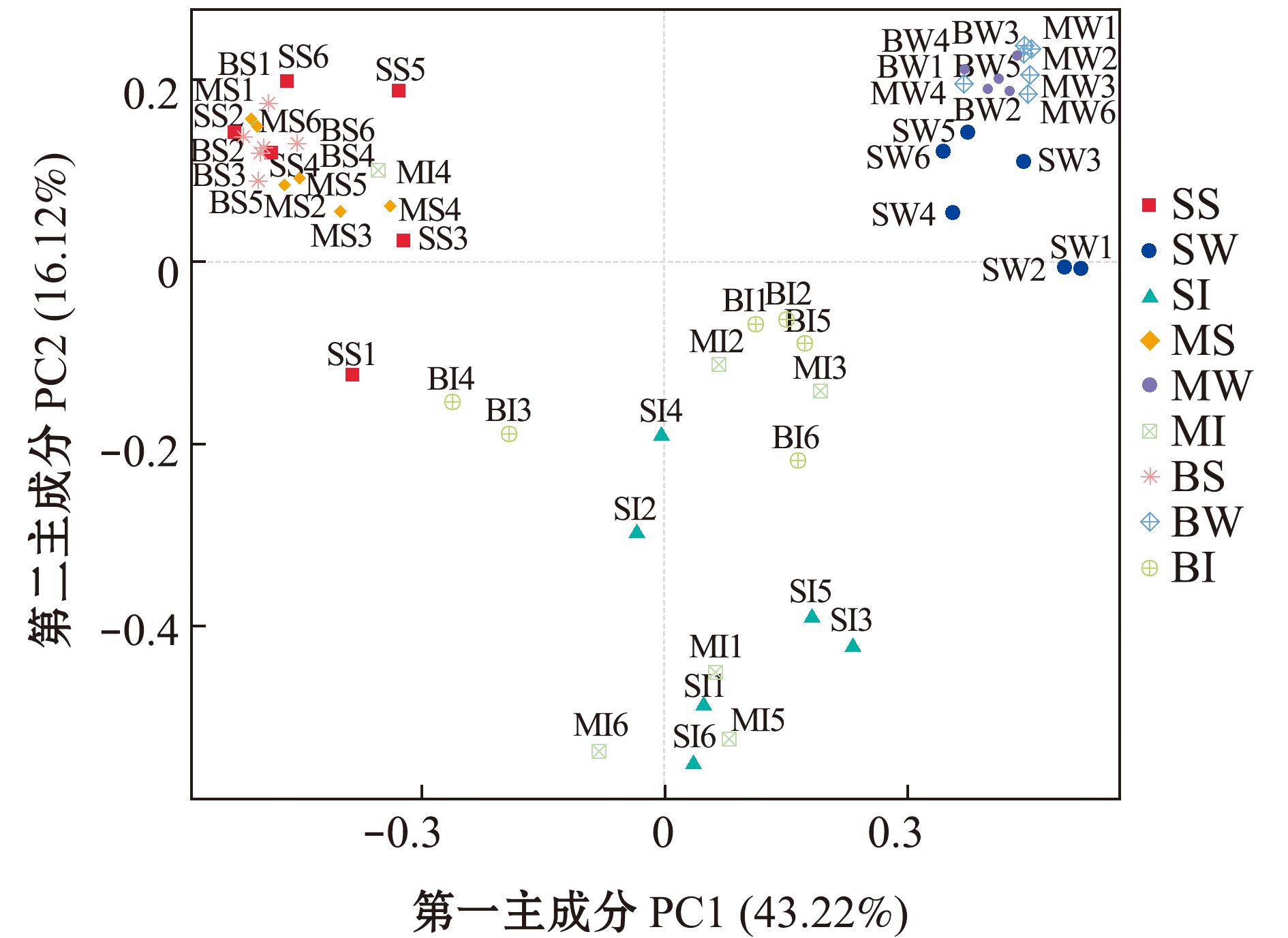
图5 基于Weighted Unifrac距离的PCoA分析
Fig.5 PCoA analysis based on Weighted Unifrac distance
表3 基于Adonis的组间差异分析
Tab.3 Analysis of differences between groups based on Adonis
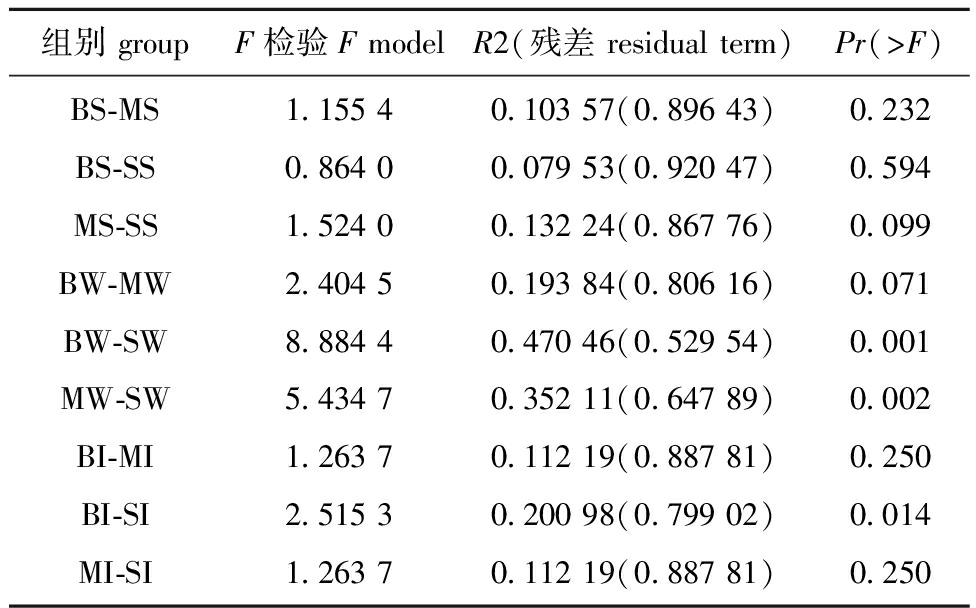
组别 groupF检验F modelR2(残差 residual term)Pr(>F)BS-MSBS-SSMS-SSBW-MWBW-SWMW-SWBI-MIBI-SIMI-SI1.155 40.864 01.524 02.404 58.884 45.434 71.263 72.515 31.263 70.103 57(0.896 43)0.079 53(0.920 47)0.132 24(0.867 76)0.193 84(0.806 16)0.470 46(0.529 54)0.352 11(0.647 89)0.112 19(0.887 81)0.200 98(0.799 02)0.112 19(0.887 81)0.2320.5940.0990.0710.0010.0020.2500.0140.250
注:R2 表示不同分组对样本差异的解释度,即分组方差与总方差的比值,R2 越大表示分组对差异的解释度越高;Pr表示P值,当其小于0.05时说明本次检验的可信度高。
Note:R2 represents the explanatory power of different groups on sample differences,that is,the ratio of group variance to total variance.A larger R2 indicates a higher explanatory power of the group on differences;Pr represents the P-value,which is less than 0.05,indicating a high reliability in this test.
对所有样本组进行LefSe分析,3、6、9月龄中国花鲈肠道微生物拥有差异微生物群落分别为5、4、13个;3、6、9月龄中国花鲈养殖水体微生物拥有差异微生物群落分别为13、4、3个;6、9月龄中国花鲈池塘底泥微生物拥有差异微生物群落分别为5、6个,最少的是3月龄中国花鲈池塘底泥,为3个(图6)。结合Bray-Curtis的MRPP分析结果,得出3月龄中国花鲈肠道微生物群落结构与9月龄相比有显著性差异(P<0.05)。
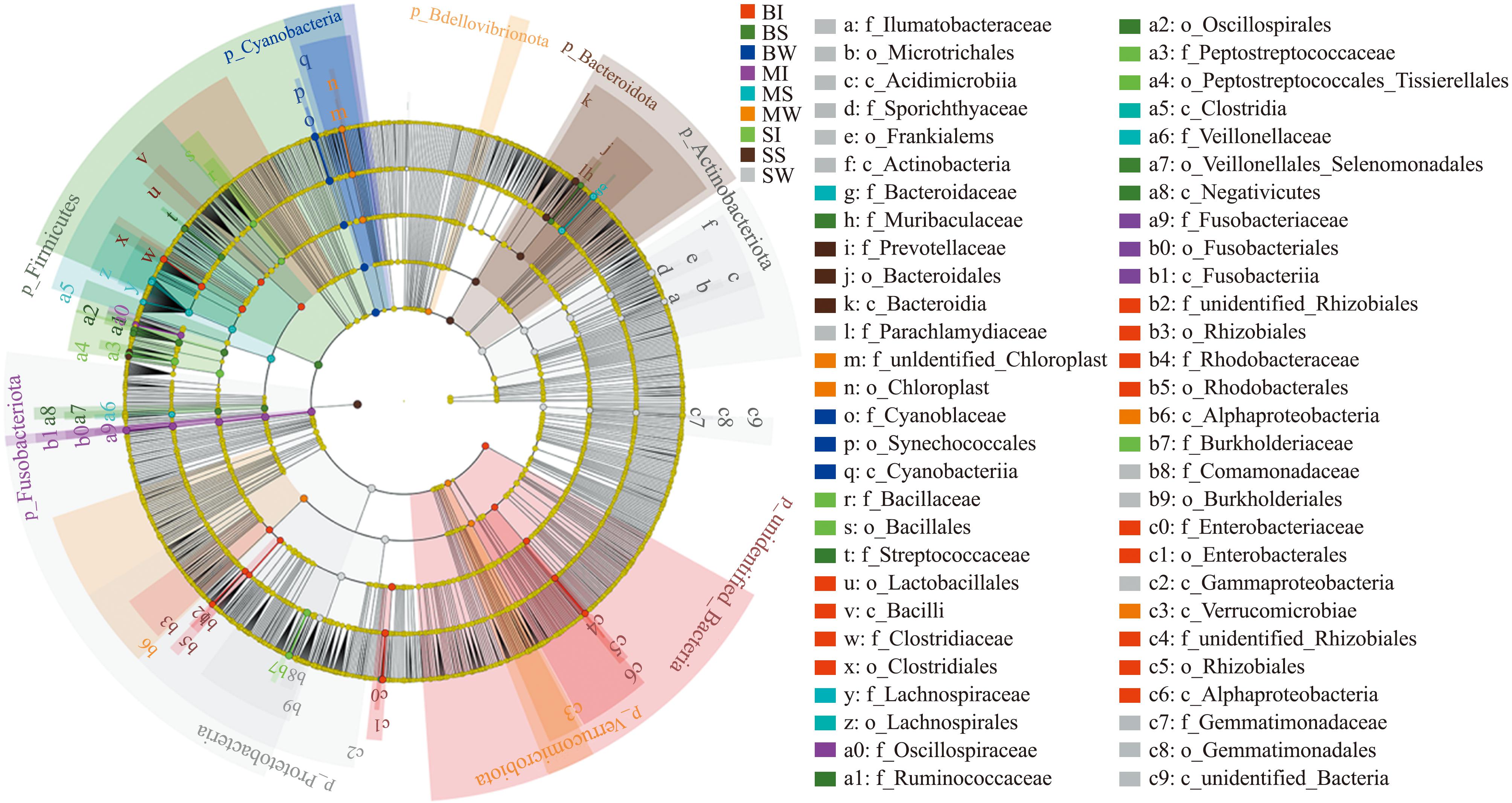
图6 基于LefSe 分析的样本间显著差异微生物
Fig.6 Significant differences microorganisms between samples based on LefSe analysis
通过Tax4Fun对16S序列的SILVA注释进行KEGG功能预测,获得样本中KO、Pathway等功能的相对丰度。
通过Welch’s T检验获得丰度平均值显著差异的菌群功能聚类(图7),其中,9月龄中国花鲈肠道微生物的甘氨酸、丝氨酸和苏氨酸代谢,染色体和相关蛋白,细胞运动蛋白,乙氧基化物与二羧酸盐代谢,双组分系统等功能丰度高于3月龄中国花鲈肠道微生物,9月龄中国花鲈肠道微生物的淀粉与蔗糖代谢,肽聚糖生物合成和蛋白质降解,氧化磷酸化等功能丰度高于6月龄中国花鲈肠道微生物。这表明,在新陈代谢和环境信息处理方面9月龄的中国花鲈道菌群具有优势。
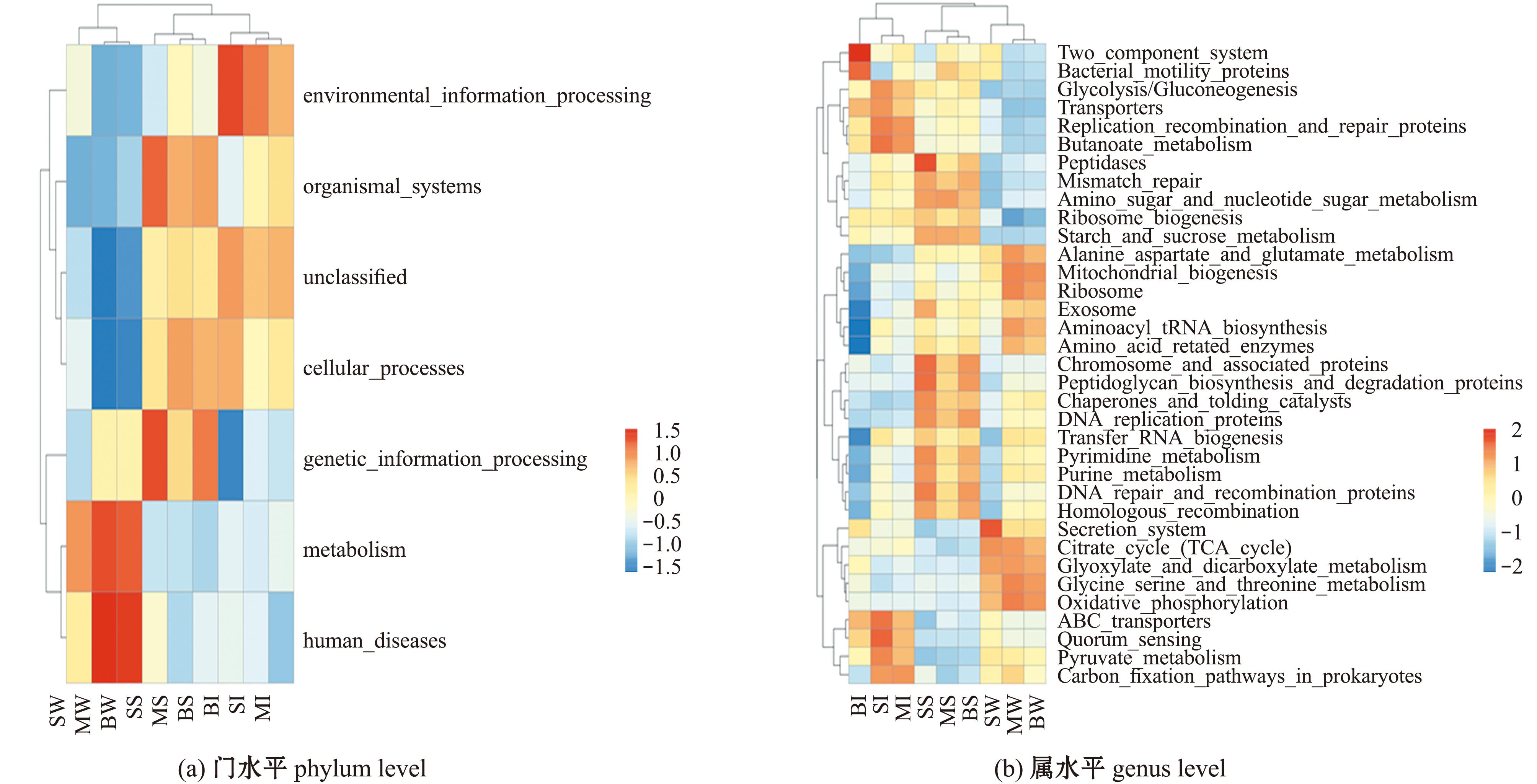
图7 基于Tax4Fun分析的功能注释聚类热图
Fig.7 Functional annotation clustering heatmap based on Tax4Fun analysis
肠道微生物受多方面因素影响,包括宿主年龄和环境因子等。本研究中从总体上来看,9月龄中国花鲈肠道微生物无论是观测数量、物种多样性和分布均匀程度均比6月龄和3月龄中国花鲈高。这与王文娟等[29]的研究结果类似。这表明,鱼类从幼苗到成熟的过程中,肠道机能不断完善,肠道微生物种类和数量也不断增加,以满足不同阶段的生理需求,且食性的转变和食物的变化对肠道微生物也有较大影响。郁二蒙等 [30]关于摄食不同饵料的大口黑鲈肠道菌群分析的结果也证明了这一观点。
肠道微生物结构是影响菌群功能的重要因素之一[31]。本研究中,3、6、9月龄3组不同生长阶段的中国花鲈肠道微生物群落结构有显著性差异,在门水平上差异贡献度最大的是厚壁菌门,厚壁菌门的许多细菌已被证实具有转化碳水化合物的能力,有助于宿主对饲料的利用[32]。拟杆菌门与厚壁菌门同为肠道主要菌群,二者存在一种互相促进的共生关系,可共同促进宿主吸收或储存能量,故消化道内拟杆菌门与厚壁菌门对发酵多糖十分重要;此外,二者的比例也十分重要,拟杆菌门降低或者厚壁菌门升高均有助于促进增肥[32-33]。
本研究表明,在属水平上肠道微生物差异贡献度最大的是罗姆布茨菌,其次是普雷沃氏菌。罗姆布茨菌能将宿主难以消化的大分子碳水化合物发酵代谢为丁酸等短链脂肪酸,降低肠道pH,提高宿主的免疫调节能力,维持肠道微生态平衡[34]。功能预测结果也表明,9月龄中国花鲈肠道微生物的氨基酸代谢、脂肪酸代谢和消化系统功能等类群的丰度较高。普雷沃氏菌有助于分解蛋白质和碳水化合物食物,该菌通常被认为是一种与健康的植物性饮食相关的菌,且普雷沃氏菌的减少与某些疾病相关[35]。可见,肠道微生物不仅调控宿主的代谢,同时也受到宿主肠道环境变化的影响,如罗姆布茨菌可以促进糖类大分子的吸收,食物中糖类大分子增多也为罗姆布茨菌提供了合适的条件,使其成为优势菌群。此外,本研究中还发现,在3月龄和6月龄中国花鲈肠道中鲸杆菌的丰度高于9月龄中国花鲈,这与前人的研究结果不同。Wang等 [36]研究表明,醋酸杆菌(Acetobacterium balch)会在杂食性和植食性组中富集,而本研究中则是投喂蛋白质含量较高的3月龄和6月龄中国花鲈肠道中富集了更多的醋酸杆菌。现已确认,醋酸杆菌属下的索氏鲸杆菌和乙酸均可通过副交感神经系统调控激活胰岛素表达,促进鱼体糖利用能力[37]。
本研究3组肠道微生物数据中,9月龄中国花鲈肠道中邻单胞菌属丰度最高。类志贺邻单胞菌作为邻单胞菌属唯一的一个种,可对营养吸收造成影响。未造成疾病暴发原因可能是数量未超过安全阈值[38],也有可能是9月龄中国花鲈肠道中其他有益菌发挥了作用,具体原因有待研究,这也间接表明9月龄中国花鲈的免疫力优于其他组。这与人们通常的认知一致,成熟个体在营养、代谢和免疫等方面均优于幼体。许多疾病多发生在鱼类幼期,如细菌性肠炎、烂鳃和水霉病等。这些疾病多是细菌性疾病,当个体发育成熟,各项生理机能逐渐完善,肠道内也建立起了一个结构稳定的微生物群落,病害的发生会显著降低。
环境微生物群落会因水体理化因子而发生改变。如本研究中梭状芽孢杆菌、普雷沃氏菌、罗姆布茨菌均表现出与氨氮、亚硝酸盐氮和硝酸盐氮具有相关性,双色藻与氨氮和亚硝酸盐氮呈正相关,与硝酸盐氮呈负相关,水体中双色藻的占比随生长阶段的改变而增加。双色藻可以利用水体中的氨氮和亚硝酸盐氮,水生生物养殖过程中氨氮和亚硝酸盐氮的不断累积给双色藻提供了充足的营养条件,使其可以快速生长,当水中双色藻密度变大,被水中生物刻意或无意摄入的可能性也会增加,进而影响生物的肠道微生物,其他菌种也可能通过类似的方法影响生物的肠道微生物。但9月龄中国花鲈肠道中的双色藻数量低于3月龄中国花鲈,这可能与早期中国花鲈以小型浮游动物为食有关,小型浮游动物又以双色藻为食,中国花鲈捕食后将双色藻一并带入体内,其具体原因还有待研究。结合花鲈养殖水体中氨氮、亚硝酸盐氮和硝酸盐氮的变化趋势推断,双色藻对减少水体中氮元素的积累可能有积极作用,进而推动水体氮循环,使普雷沃氏菌、罗姆布茨菌等有益菌在水体中丰度增加,促进环境微生物对肠道微生群落的影响。
1)不同月龄的中国花鲈肠道微生物群落结构存在明显差异,罗姆布茨菌和普雷沃氏菌是主要差异微生物,在9月龄中国花鲈肠道中富集最高。
2)不同养殖阶段水环境微生物群落结构无显著性差异,氨氮、硝酸盐氮和亚硝酸盐氮均会影响环境微生物在群落中的占比。
3)养殖环境微生物对中国花鲈肠道微生物有一定影响。
[1] 郭海威.花鲈NOD2基因在抗菌免疫中的功能分析[D].大连:大连海洋大学,2023. GUO H W.Functional analysis of NOD2 gene of Lateolabrax japonicus in antibacterial immunity[D].Dalian:Dalian Ocean University,2023.(in Chinese)
[2] SALGUEIRO M J,ZUBILLAGA M B,LYSIONEK A E,et al.The role of zinc in the growth and development of children[J].Nutrition,2002,18(6):510-519.
[3] NEUFELD S J,WANG F,COBB J.Genetic interactions between Shox2 and Hox genes during the regional growth and development of the mouse limb[J].Genetics,2014,198(3):1117-1126.
[4] MITSUOKA T.Prebiotics and intestinal flora[J].Journal of Intestinal Microbiology,2002,21(1):3-12.
[5] JANDHYALA S M,TALUKDAR R,SUBRAMANYAM C,et al.Role of the normal gut microbiota[J].World Journal of Gastroenterology,2015,21(29):8787-8803.
[6] YANG L P.Research progress of intestinal flora and health[J].Advances in Clinical Medicine,2021,11(5):2221-2227.
[7] 刘昭曦,王禄山,陈敏.肠道菌群多糖利用及代谢[J].微生物学报,2021,61(7):1816-1828. LIU Z X,WANG L S,CHEN M.Glycan utilization and metabolism by gut microbiota[J].Acta Microbiologica Sinica,2021,61(7):1816-1828.(in Chinese)
[8] JI Z H,ZHU C Z,ZHU X Y,et al.Dietary host-associated Bacillus subtilis supplementation improves intestinal microbiota,health and disease resistance in Chinese perch (Siniperca chuatsi)[J].Animal Nutrition,2023,13:197-205.
[9] TAOKA Y,MAEDA H,JO J Y,et al.Use of live and dead probiotic cells in tilapia Oreochromis niloticus[J].Fisheries Science,2006,72(4):755-766.
[10] BARNES E M.Anaerobic bacteria of the normal intestinal microflora of animals[J].Society for Applied Bacteriology Symposium Series,1986,13:225-238.
[11] MOHAPATRA S,CHAKRABORTY T,PRUSTY A K,et al.Use of different microbial probiotics in the diet of rohu,Labeo rohita fingerlings:effects on growth,nutrient digestibility and retention,digestive enzyme activities and intestinal microflora[J].Aquaculture Nutrition,2012,18(1):1-11.
[12] YAN Q Y,VAN DER GAST C J,YU Y H.Bacterial community assembly and turnover within the intestines of developing zebrafish[J].PLoS One,2012,7(1):e30603.
[13] BLEDSOE J W,PETERSON B C,SWANSON K S,et al.Ontogenetic characterization of the intestinal microbiota of channel catfish through 16S rRNA gene sequencing reveals insights on temporal shifts and the influence of environmental microbes[J].PLoS One,2016,11(11):e0166379.
[14] STEPHENS W Z,BURNS A R,STAGAMAN K,et al.The composition of the zebrafish intestinal microbial community varies across development[J].Isme Journal Emultidisciplinary Journal of Microbial,2016,10(3):644-654.
[15] 翟万营,郭安宁.鱼类肠道微生物研究进展[J].河南水产,2016(4):18-21,40. ZHAI W Y,GUO A N.Research progress on the fish intestinal microbiota[J].Henan Fisheries,2016(4):18-21,40.(in Chinese)
[16] 麦浩彬,郭鑫伟,王金港,等.摄食不同水平饲料蛋白质对珍珠龙胆石斑鱼幼鱼肠道组织形态和菌群组成的影响[J].大连海洋大学学报,2020,35(1):63-70. MAI H B,GUO X W,WANG J G,et al.Effects of dietary protein levels on intestinal tract histomorphology and microflora composition in juvenile pearl gentian grouper (Epinephelus lanceolatu♂×E.fuscoguttatus♀)[J].Journal of Dalian Ocean University,2020,35(1):63-70.(in Chinese)
[17] XIA J H,LIN G,FU G H,et al.The intestinal microbiome of fish under starvation[J].BMC Genomics,2014,15(1):266.
[18] XU D F,WANG Y L,SUN L J,et al.Inhibitory activity of a novel antibacterial peptide AMPNT-6 from Bacillus subtilis against Vibrio parahaemolyticus in shrimp[J].Food Control,2013,30(1):58-61.
[19] ZHOU S,SONG D,ZHOU X,et al.Characterization of Bacillus subtilis from gastrointestinal tract of hybrid Hulong grouper (Epinephelus fuscoguttatus × E.lanceolatus) and its effects as probiotic additives[J].Fish &Shellfish Immunology,2019,84.
[20] TSAI C Y,CHI C C,LIU C H.The growth and apparent digestibility of white shrimp,Litopenaeus vannamei,are increased with the probiotic,Bacillus subtilis[J].Aquaculture Research,2019,50(5):1475-1481.
[21] MAHJOUB M,MIRBAKHSH M,AFSHARNASAB M,et al.Effect of probiotic Bacillus subtilis IS02 of Litopenaeus vannamei shrimp on pathogenic Vibrio harveyi[J].Online Journal of Veterinary Research,2016,20(11):712-719.
[22] 吴正存,傅玲琳,李卫芬,等.枯草芽孢杆菌WB600芽孢和营养体耐受凡纳滨对虾胃肠道环境及定殖存活的研究[J].水产科学,2011,30(6):311-316. WU Z C,FU L L,LI W F,et al.The resistance and survival of Bacillus subtilis within gastrointestinal environment of Pacific white leg shrimp(Litopenaeus vannamei)[J].Fisheries Science,2011,30(6):311-316.(in Chinese)
[23] 范嗣刚,黄皓,王鹏飞,等.基于cox1序列的中国6个花鲈野生群体遗传多样性[J].广东海洋大学学报,2022,42(3):11-17. FAN S G,HUANG H,WANG P F,et al.Population genetic diversity of spotted sea bass (Lateolabrax maculatus) from China based on mitochondrial cox1 gene sequence[J].Journal of Guangdong Ocean University,2022,42(3):11-17.(in Chinese)
[24] RUNGRASSAMEE W,KLANCHUI A,MAIBUNKAEW S,et al.Bacterial dynamics in intestines of the black tiger shrimp and the Pacific white shrimp during Vibrio harveyi exposure[J].Journal of Invertebrate Pathology,2016,133:12-19.
[25] LIAO M Z,LONG X X,HE Z H,et al.The effect of “Fishery-PV Integration” on Penaeus monodon culture and research on the micro-ecological environment[J].Frontiers in Marine Science,2022,9:963331.
[26] LIAO W Q,LIN Z X,LIAO M Z,et al.Effects of sodium humate and probiotics on growth performance enzyme activity and microbial environment of Litopenaeus vannamei in high-density zero-water exchange systems[J].Frontiers in Marine Science,2022,9:989325.
[27] EDGAR R C.UPARS E:highly accurate OTU sequences from microbial amplicon reads[J].Nature Methods,2013,10(10):996-998.
[28] QUAST C,PRUESSE E,YILMAZ P,et al.The SILVA ribosomal RNA gene database project:improved data processing and web-based tools[J].Nucleic Acids Research,2013,41(D1):D590-D596.
[29] 王文娟,潘宝海,孙冬岩,等.水产动物肠道菌群的形成及其生理作用[J].饲料研究,2012(2):37-39. WANG W J,PAN B H,SUN D Y,et al.Formation and physiological function of intestinal flora in aquatic animals[J].Feed Research,2012(2):37-39.(in Chinese)
[30] 郁二蒙,张振男,夏耘,等.摄食不同饵料的大口黑鲈肠道菌群分析[J].水产学报,2015,39(1):118-126. YU E M,ZHANG Z N,XIA Y,et al.Effects of different diets on intestinal microflora of largemouth bass (Micropterus salmoides)[J].Journal of Fisheries of China,2015,39(1):118-126.(in Chinese)
[31] HEJIN X U,YOU F,DING L,et al.Application of Bacillus subtilis in shrimp production[J].Feed Review,2013
[32] SUN M Z,WANG Q Y,ZHANG M M,et al.Leuconostoc pseudomesenteroides improves microbiota dysbiosis and liver metabolism imbalance and ameliorates the correlation between dihydroceramide and strains of Firmicutes and Proteobacteria in high fat diet obese mice[J].Food &Function,2020,11(8):6855-6865.
[33] CHEN Y H,CHIU C C,HUNG S W,et al.Gnotobiotic mice inoculated with Firmicutes,but not Bacteroidetes,deteriorate nonalcoholic fatty liver disease severity by modulating hepatic lipid metabolism[J].Nutrition Research,2019,69:20-29.
[34] MIYAZAKI K,MARTIN J C,MARINSEK-LOGAR R,et al.Degradation and utilization of xylans by the rumen anaerobe Prevotella bryantii (formerly P.ruminicola subsp.brevis) B(1)4[J].Anaerobe,1997,3(6):373-381.
[35] BROOK I,FOOTE P A,SLOTS J.Immune response to Fusobacterium nucleatum,Prevotella intermedia and other anaerobes in children with acute tonsillitis[J].Journal of Antimicrobial Chemotherapy,1997,39(6):763-769.
[36] WANG A R,ZHANG Z,DING Q W,et al.Intestinal Cetobacterium and acetate modify glucose homeostasis via parasympathetic activation in zebrafish[J].Gut Microbes,2021,13(1):1-15.
[37] 陈浔,韩冬,骆作勇,等.饲料中添加酵母培养物对大口黑鲈生长、肠道健康和免疫力的影响[J].水生生物学报,2024,48(1):23-33. CHEN X,HAN D,LUO Z Y,et al.Dietary yeast culture on growth,intestinal health and immunity of Micropterus salmoides[J].Acta Hydrobiologica Sinica,2024,48(1):23-33.(in Chinese)
[38] BRENDEN R A,MILLER M A,JANDA J M.Clinical disease spectrum and pathogenic factors associated with Plesiomonas shigelloides infections in humans[J].Reviews of Infectious Diseases,1988,10(2):303-316.