罗氏沼虾Spo11基因克隆、表达及其在卵巢发育中的作用
杨彦豪1,2,王瑞2,李莉萍2,阮志德2,黄彬胜2,卢智发2,杨明伟3*,林勇2*
(1.上海海洋大学 农业农村部淡水水产种质资源重点实验室,水产科学国家级实验教学示范中心,教育部上海水产养殖工程技术研究中心,上海 201306;2.广西壮族自治区水产科学研究院 广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021;3.广西水产畜牧学校,广西 南宁 530021)
摘要:为研究减数分裂相关基因Spo11(meiotic protein covalently bound to DSB homolog)在罗氏沼虾(Macrobrachium rosenbergii)卵巢发育中的调控作用,采用RACE技术、荧光定量PCR、原位杂交和RNA干扰等方法,对罗氏沼虾Spo11基因(MrSpo11)及其编码氨基酸的分子特征、MrSpo11基因的组织表达、分布和生物学功能进行了研究。结果表明:MrSpo11基因cDNA序列全长为2 298 bp,其中,5′端和3′端非编码区分别为457、701 bp,开放阅读框为1 140 bp,共编码379个氨基酸残基;MrSpo11基因在罗氏沼虾鳃中的相对表达量最高,在卵巢、肝胰腺和心脏中表达量较高,在脑、眼和肌肉中微量表达;MrSpo11基因在罗氏沼虾卵巢发育Ⅰ期相对表达量最高,在卵巢发育Ⅲ期次之,在Ⅱ期和Ⅳ期表达量最低;MrSpo11基因在卵黄发生前期、中期、晚期卵母细胞的细胞质,以及卵黄发生早期卵母细胞的细胞质和细胞核中均有表达;注射dsRNA后第2、4天,试验组MrSpo11基因的表达量分别比对照组下降45.8%、11.6%,注射dsRNA后第4天,试验组卵巢发育成熟度略低于对照组。研究表明,MrSpo11基因参与了罗氏沼虾卵巢发育过程,本研究结果可为进一步探究罗氏沼虾卵巢发育分子调控机制提供有益参考。
关键词:罗氏沼虾;Spo11基因;克隆;表达;卵巢发育
DOI:10.16535/j.cnki.dlhyxb.2024-036
文章编号:2095-1388(2024)02-0193-10
中图分类号:S 917.4
文献标志码:A
收稿日期:2024-02-26
基金项目:广西科技基地和人才专项(桂科AD24010034);广西农业科技自筹经费项目(Z202282);广西虾类贝类产业创新团队项目(nycytxgxcxtd-2023-14-02);广西重点研发项目(AB19245033)
作者简介:杨彦豪(1979—),男,博士研究生。E-mail:haoyyh2006@163.com
通信作者:杨明伟(1978—),男,工程师。E-mail:632052618@qq.com
林勇(1969—),男,研究员。E-mail:linnn2005@126.com(并列通信作者)
减数分裂是生物细胞中染色体数目减半的分裂方式,是有性生殖生物性腺发育、配子发生的关键生物学过程。减数分裂是一个复杂的分裂过程,染色体通过同源染色体配对、联会、交叉互换、姐妹染色单体分离等过程保证配子的正常发生。同时,此分裂过程受许多基因和蛋白因子的共同调控,这些调控基因和蛋白的异常都会导致配子发生甚至性腺发育的异常[1]。Spo11(meiotic protein covalently bound to DSB homolog)基因是影响减数分裂过程的关键基因,该基因所编码产生的拓扑异构酶,是在减数分裂染色体同源重组过程中参与DNA双链断裂复合物(double-strand breaks,DSBs)形成的重要蛋白。目前,已在多个物种中开展了Spo11基因的相关研究,如Shimoi等[2]克隆获得了酿酒酵母(Saccharomyces cerevisiae)的Spo11基因,并发现SPO11蛋白可以修复K7减数分裂重组缺陷;Mckim等[3]克隆了果蝇(Drosophila melanogaster)Spo11基因的同源基因mei-W68,并对其表达规律进行了分析;Yeh等[4]开发了表达和纯化秀丽隐杆线虫(Caenorhabditis elegans)SPO11蛋白的方法,发现该蛋白可以结合双链DNA,且本身无DNA切割活性,需要辅助因子来诱导DSB的活性;Romanienko等[5]克隆了人(Homo sapiens)和小鼠(Mus musculus)的Spo11基因序列,并对其特征和定位进行了研究,发现小鼠Spo11基因定位在2号染色体H4,而人Spo11基因定位在20号染色体q13.2~q13.3;Metzler-Guillemain等[6]鉴定了小家鼠的Spo11基因,发现该基因只在精巢中表达,并将该基因定位在2号染色体H2~H4;水产动物方面,已在日本鳗鲡(Anguilla japonica)[7]、尼罗罗非鱼(Oreochromis niloticus)[8]、斑马鱼(Danio rerio)[6]、鲫(Carassius auratus)[10]和鲫鲤杂交鱼(Carassius auratus♀×Cyprinus carpio♂)[11]等物种中开展了Spo11基因研究。上述研究表明,Spo11基因作为减数分裂前期的关键基因,在脊椎动物和低等动物的减数分裂过程中发挥着重要作用,但Spo11基因在甲壳动物中的研究还相对较少。
罗氏沼虾(Macrobrachium rosenbergii)属长臂虾科沼虾属,是主要的淡水养殖虾类,具有食性广、养殖周期短、营养价值高和抗病力强等生物学特性,在淡水养殖业中占有重要地位。近年来,罗氏沼虾种质退化问题日渐突出,个体小型化、性早熟问题严重,通过遗传育种培育优良品种是解决以上问题的有效途径,因此,开展罗氏沼虾性腺发育相关基因研究,阐明其卵巢发育的分子机制,对促进罗氏沼虾遗传育种的发展具有重要意义。目前,罗氏沼虾的研究工作主要集中在生物形态学[12-13]、种群生态学[14-15]和遗传学[16-17]等方面,对罗氏沼虾生殖发育相关的研究较少,关于罗氏沼虾Spo11基因的研究尚未见报道。本研究中,以罗氏沼虾为研究对象,采用RACE技术克隆了MrSpo11基因的cDNA序列,并对该序列及其编码的氨基酸序列进行了生物信息学分析,再通过荧光定量PCR分析MrSpo11基因在不同组织及不同发育时期卵巢中的表达情况,利用原位杂交技术检测MrSpo11基因mRNA在不同发育时期卵巢中的分布情况,最后通过RNA干扰技术对MrSpo11基因的生物学功能进行了研究,以期为探究罗氏沼虾卵巢发育分子调控机制提供科学参考。
1 材料与方法
1.1 材料
试验用虾来自广西南宁罗氏沼虾良种场,选择健康的5月龄雌虾,平均体质量为30 g左右。
1.2 方法
1.2.1 样本采集 随机采集3尾虾的肝胰腺、肌肉、卵巢、脑、心脏、眼和鳃等组织样本立即置于液氮中速冻后,于-80 ℃冰箱保存,用于提取RNA。
根据卵母细胞的类型确定卵巢发育Ⅰ、Ⅱ、Ⅲ、Ⅳ 4个不同发育时期[18]。另取30尾虾的卵巢组织,用原位杂交固定液固定后进行组织切片分析,采集处于卵巢发育Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期的卵巢各3尾用于原位杂交试验;同时取卵巢组织置于液氮中速冻后,于-80 ℃超低温冰箱中保存,用于提取RNA。
1.2.2 总RNA提取及cDNA合成 根据试剂盒说明书,采用Trizol试剂(InvitrogenTM,USA)从收集的组织样本中提取总RNA。RNA样本用DNaseⅠ(TaKaRa,Dalian,China)处理以消除基因组DNA的污染。用琼脂糖凝胶电泳和Nanodrop®ND-2000分光光度计(Thermo Scientific Nanodrop,美国)评估RNA的质量。总RNA逆转录:在0.2 mL PCR管中加入试剂,总RNA 5 μL,随机引物1 μL,ddH2O 1 μL,70 ℃下温浴5 min,冰浴2 min;离心后再加入试剂,5×第一链缓冲液2.0 μL,10 mmol/L dNTP 0.5 μL,Rnase inhibitor 0.25 μL,逆转录酶0.25 μL,总体积为10.0 μL,42 ℃下温浴60 min,72 ℃下温浴10 min。
1.2.3 卵巢组织切片及H.E染色 取用原位杂交固定液固定的卵巢组织,经过梯度乙醇脱水浸蜡、包埋、石蜡切片后,再经过脱蜡至水、苏木素染色、伊红染色和脱水封片等操作,在显微镜下镜检后,通过卵母细胞的类型确定卵巢的发育时期[19]。
1.2.4 MrSpo11基因克隆 根据本实验室构建的罗氏沼虾卵巢转录组文库中注释为Spo11的unigene序列,设计合成5′RACE和3′RACE特异性引物(表1)。
表1 试验用引物序列
Tab.1 Primer sequence used in experiments

引物 primer引物序列 primer sequence(5'-3')用途 applicationadaptor5':GCTGTCAACGATACGCTACGTAACGGCAT-GACAGTGGGIIGGGIIGGGIIG'接头引物adaptor3':GCTGTCAACGATACGCTACGTAACGGCAT-GACAGTGTTTTTTTTTTTTTTTTTT接头引物5'/3'outer:GCTGTCAACGATACGCTACGTAAC接头引物inner:GCTACGTAACGGCATGACAGTG接头引物Spo11RT3:5'-CAGTGCGACGTTTTCGTAGTAGAC5'RACERT4:GCCAGGTCCTCAACTGCTCG5'RACESpo11R5:TCGCCGTGAAAAGTTCGACCTGAC5'RACE R6:CTACGGCAGCCTTCTCTTTATTTCCTTG5'RACESpo11 F1:AATTTGGAGCTATCGCACGGGACG3'RACEF2:CCCTGACGCCAAGAGACTGTGGTAAG3'RACESpo11F:CTGCCTCACCTACACCACGAATGqPCRR:GTATCTGGCTTCTGACGACACTTCCqPCRβ-actinF:CTGCCGCCTCCTCCTCTTCCqPCRR:TGAATGCCGCACGATTCCATACCqPCRSpo11-FISH5'-CGATCCAACCACCCTGGCGTAACTTCCT-3'原位杂交Spo11正F:TAATACGACTCACTATAGGGAGATAAGGAGCAGATTGRNAiR:AAGAGAAGCCAGCTTACCACAGTCTCTTGGCGTCAGGGGCRNAiSpo11反F:TAATACGACTCACTATAGGGAAGAGAAGCCAGCTTARNAiR:AGATAAGGAGCAGATTGAAAGGAAAGTCATCGRNAi
1) 3′-RACE克隆。以3′adaptor为引物反转录获得的cDNA为模板进行巢式PCR反应。第一轮反应体系(25 μL):cDNA 1.0 μL,2×GC Buffer Ⅰ 12.5 μL,Spo11 F1和5′/3′outer 各0.5 μL,2.5 mmol/L dNTP 4 μL,Taq酶0.2 μL,ddH2O 6.3 μL。扩增程序:95 ℃下预变性3 min;94 ℃下变性30 s,58 ℃下退火30 s,72 ℃下延伸60 s,共进行33个循环;最后在72 ℃下再延伸7 min。第二轮反应体系(50 μL):第一轮PCR产物稀释液1.0 μL,2×GC Buffer Ⅰ 25.0 μL,Spo11 F2和5′/3′ inner各 1.0 μL,2.5 mmol/L dNTP 8.0 μL,Taq酶0.5 μL,ddH2O 13.5 μL,扩增程序同第一轮。
2) 5′-RACE克隆。以特异性引物Spo11 RT3和Spo11 RT4反转录得到cDNA,经RNase H和TdT酶处理后,进行巢氏PCR。第一轮反应体系(25 μL):cDNA 1.0 μL,2×GC Buffer Ⅰ 12.5 μL,5′adaptor 和Spo11 R5各0.5 μL,2.5 mmol/L dNTP4.0 μL,Taq酶0.2 μL,ddH2O 6.3 μL。扩增程序:95 ℃下预变性3 min;94 ℃下变性30 s,68 ℃下退火30 s,72 ℃下延伸60 s,共进行33个循环;最后在72 ℃下再延伸7 min。第二轮反应体系(50 μL):第一轮PCR产物稀释液1.0 μL,2×GC Buffer I 25.0 μL,5′/3′outer和Spo11 R6各1.0 μL,2.5 mmol/L dNTP 8.0 μL,Taq酶0.5 μL,ddH2O 13.5 μL,扩增程序同第一轮。
3)克隆测序。5′RACE和3′RACE扩增产物经15 g/L琼脂糖凝胶电泳检测后切胶回收纯化,纯化产物分别与pMD18-T载体连接后转入DH5α感受态,37 ℃下倒置培养过夜,对菌落进行PCR检测,将目的菌送至生工生物工程(上海)股份有限公司测序。
1.2.5 生物信息学分析 通过NCBI ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)分析基因的开放阅读框(ORF)及其编码的氨基酸序列;在NCBI conserved domain (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)上分析MrSPO11蛋白的保守结构域;采用Expasy ProtParam(http://web.expasy.org/protparam/)分析MrSPO11蛋白的氨基酸组成、分子量和理论等电点等;采用SignalP 6.0和TMHMM 2.0分析信号肽和跨膜结构;采用NetNGlyc 1.0和NetPhos 3.1预测MrSPO11蛋白的糖基化位点和磷酸化位点;采用PSORTⅡ Prediction在线软件(http://psort.hgc.jp/form2.html)进行亚细胞定位;采用SOPMA和SWISS-MODEL在线分析MrSPO11蛋白的二级结构和三级结构;利用DNAMAN对MrSPO11氨基酸序列与其他物种的SPO11进行多序列比对,并使用MEGA 11.0软件,采用邻接法(Neigbbor-joining method,NJ)构建MrSPO11氨基酸系统进化树。
1.2.6 MrSpo11基因在不同组织及不同发育时期卵巢中的表达模式 根据MrSpo11基因的cDNA序列,利用Primer Premier 5.0软件设计实时荧光定量PCR反应特异性引物(表1)。
以β-actin为内参基因进行实时荧光定量PCR,分析MrSpo11基因在罗氏沼虾不同组织中及不同发育时期卵巢中的表达情况。反应体系(20 μL):Premix Ex TaqTMⅡ 10 μL,上、下游引物各0.5 μL,cDNA 5.0 μL,ddH2O 4.0 μL。扩增程序:95 ℃下预变性30 s;95 ℃下变性15 s,60 ℃下退火30 s,共进行40个循环;每个PCR反应设置3个重复。利用2-ΔΔCt法计算MrSpo11基因的相对表达量。
1.2.7 原位杂交分析MrSpo11基因mRNA在不同发育时期卵巢中的分布 利用T7反转录酶和荧光素FAM进行体外合成得到反义RNA探针。取原位杂交固定液固定的4个不同发育时期的卵巢组织,经梯度乙醇脱水浸蜡、包埋、切片后,62 ℃下烤片2 h。依次将切片放入二甲苯、无水乙醇、乙醇和DEPC水中脱蜡至水,煮沸冷却后用蛋白酶K消化,滴加不含探针的预杂交液,37 ℃下孵育1 h后,滴加含探针Spo11-FISH的杂交液,37 ℃下杂交过夜,再利用SSC溶液洗去杂交液后,滴加DAPI染液避光孵育8 min,冲洗后滴加抗荧光淬灭封片剂封片,切片于正置荧光显微镜下观察并采集图像,检测MrSpo11基因mRNA在不同发育时期卵巢中的分布情况。
1.2.8 MrSpo11基因的RNAi干扰试验 使用含有T7启动子的干扰链引物和卵巢组织cDNA,按照MEGAscript TM T7 Transcription Kit(AMB13345)进行体外转录合成dsRNA。取12只卵巢发育Ⅲ期的罗氏沼虾成虾,分成试验组(6尾)和对照组(6尾),分别在第5步足基部注射质量浓度为3 μg/g dsRNA溶液或等体积的DEPC Water。注射后第2天、第4天,分别从试验组和对照组各取3尾虾的卵巢组织,测定MrSpo11基因的表达水平;另取注射dsRNA后第0天和第4天试验组和对照组的卵巢组织切片,观察卵巢的发育情况。
1.3 数据处理
试验数据均以平均值±标准误(mean±S.E.)表示,利用SPSS 22.0软件进行单因素方差分析(one-way ANOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 MrSpo11基因克隆及生物信息学分析
通过RACE克隆得到MrSpo11基因全长cDNA序列,该基因序列全长为2 298 bp,其中,5′端非编码区(5′-UTR)为457 bp,3′端非编码区(3′-UTR)为701 bp,ORF为1 140 bp,共编码379个氨基酸残基(图1)。利用软件对MrSpo11基因编码蛋白的理化性质进行分析,结果显示,该基因共编码379个氨基酸,分子式为C1907H3043N523O552S9,理论相对分子质量为42 420,理论等电点为8.11,带负电荷残基(Asp+Glu)为43,带正电荷残基(Arg+Lys)为45,不稳定系数为36.55,脂肪族氨基酸指数和亲水性总平均(GRAVY)分别为100.08和-0.173,推测该蛋白为稳定亲水性蛋白。保守结构域预测发现,MrSPO11蛋白含有SPO11超级家族结构域。对MrSPO11蛋白进行跨膜结构和信号肽预测,发现MrSPO11蛋白不存在跨膜结构和信号肽。二级结构预测发现,MrSPO11蛋白由α-螺旋(42.22%)、延伸链(16.89%)、β-翻转(5.8%)和无规卷曲(35.09%)构成;三级结构预测发现,与Ⅱ型DNA拓扑异构酶Ⅵ亚基A相似。亚细胞定位分析显示,MrSPO11蛋白主要分布在细胞质(65.2%)、细胞核(21.7%)中。糖基化和磷酸化位点预测显示,MrSPO11蛋白在130位氨基酸处存在1个糖基化位点,且该蛋白存在42个磷酸化位点,包括17个丝氨酸磷酸化位点、17个苏氨酸磷酸化位点和8个络氨酸磷酸化位点。
2.2 MrSPO11氨基酸序列的系统进化分析
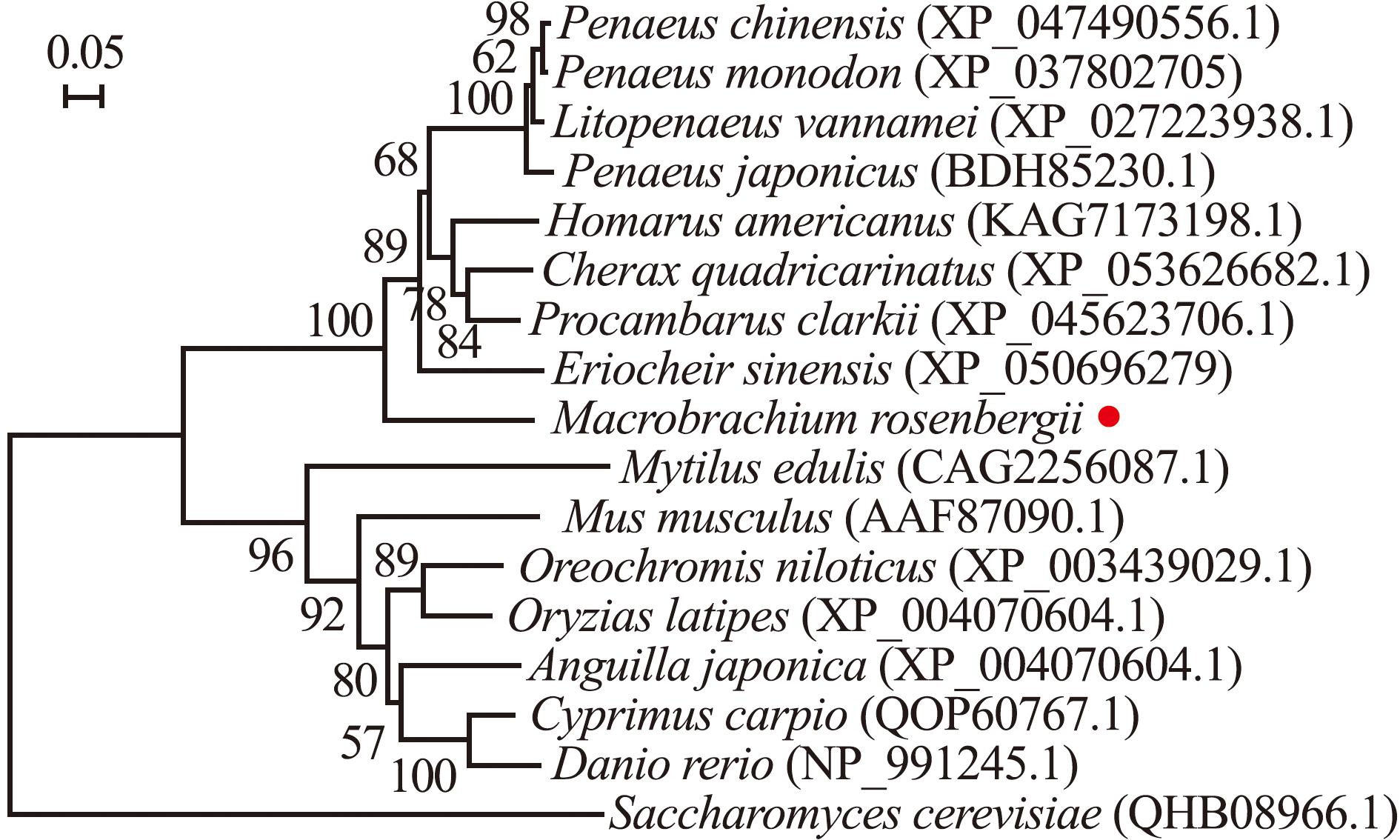
将罗氏沼虾MrSPO11与其他物种的SPO11氨基酸序列进行多序列比对分析,结果显示,罗氏沼虾与红螯螯虾(Cherax quadricarinatus)SPO11氨基酸序列的一致性最高,为67%(图2)。基于不同物种SPO11氨基酸序列构建的系统发育进化树分析显示,罗氏沼虾与凡纳滨对虾(Litopenaeus vannamei)、日本对虾(Penaeus japonicus)等甲壳动物的SPO11氨基酸序列聚为一支(图3)。
2.3 MrSpo11基因的表达模式
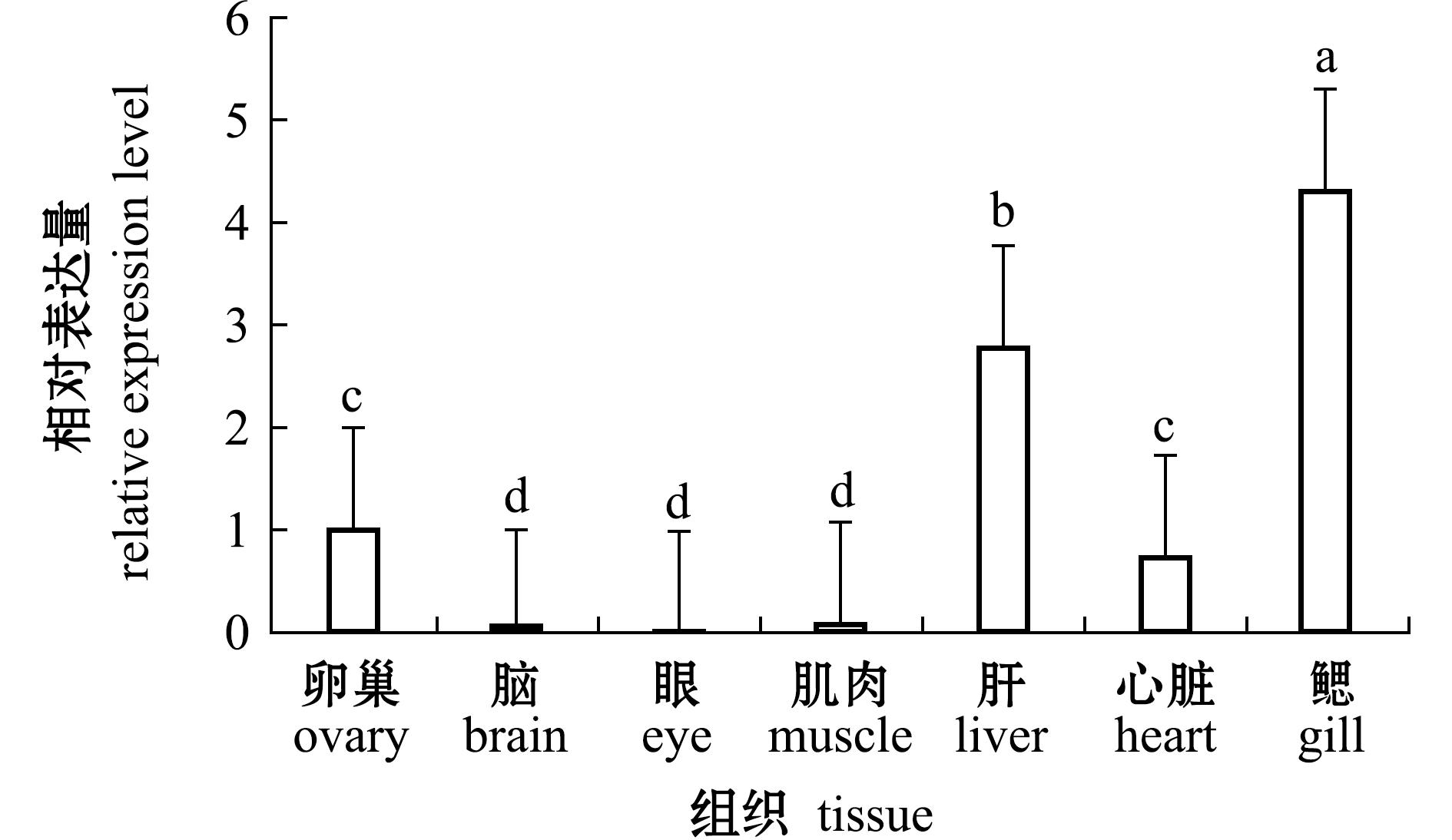
MrSpo11基因的组织表达谱分析显示,MrSpo11基因在罗氏沼虾鳃中的相对表达量最高(4.31),在卵巢、肝胰腺和心脏中表达量较高,在脑、眼和肌肉中微量表达(图4)。单因素方差分析显示,除卵巢与心脏间,以及脑、眼、肌肉间的表达量无显著性差异(P>0.05)外,其他组织间的表达量均存在显著性差异(P<0.05)。
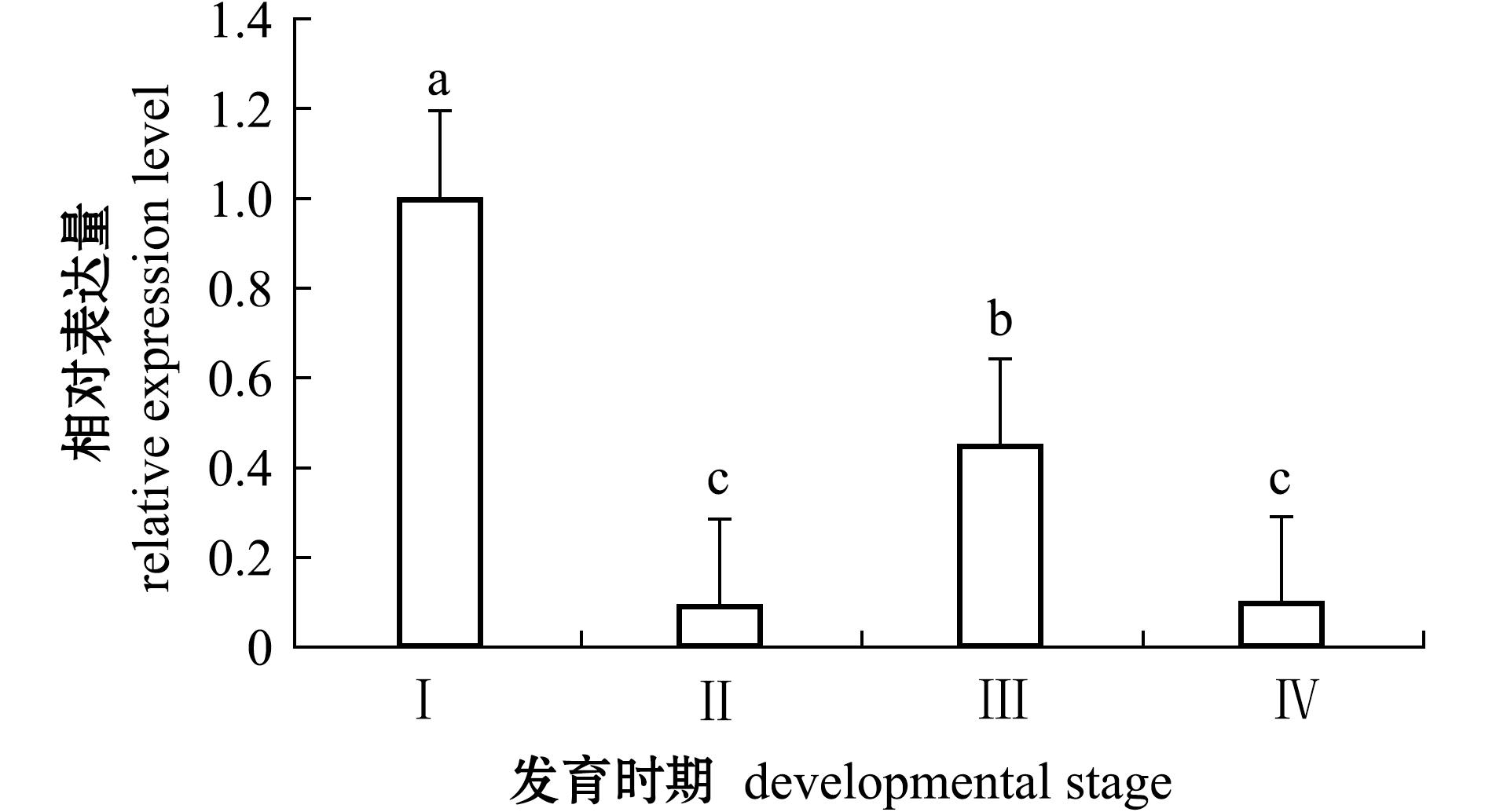
MrSpo11基因在罗氏沼虾4个不同发育时期卵巢中的表达谱分析显示,MrSpo11基因在4个不同发育时期的卵巢中均有表达,且在卵巢发育Ⅰ期相对表达量最高,卵巢发育Ⅲ期次之,Ⅱ期和Ⅳ期表达量最低。单因素方差分析显示,MrSpo11基因除在卵巢发育Ⅱ期和Ⅳ期的表达量无显著性差异(P>0.05)外,在其他卵巢发育时期均存在显著性差异(P<0.05)(图5)。
2.4 MrSpo11基因mRNA在不同发育时期卵巢中的分布
为了进一步研究MrSpo11基因mRNA在罗氏沼虾卵巢发育过程中的分布情况,对不同发育时期卵巢进行了原位杂交试验。结果显示:在卵巢发育Ⅰ期中,杂交信号出现在卵黄发生前期(pVt)卵母细胞的细胞质中;在卵巢发育Ⅱ期,杂交信号出现在卵黄发生早期(eVt)卵母细胞的细胞质和细胞核中;在卵巢发育Ⅲ期,杂交信号出现在卵黄发生中期(mVt)卵母细胞的细胞质中;在卵巢发育Ⅳ期,出现在卵黄发生晚期(lVt)卵母细胞的细胞质中的杂交信号进一步减弱(图6)。
2.5 MrSpo11基因dsRNA干扰试验
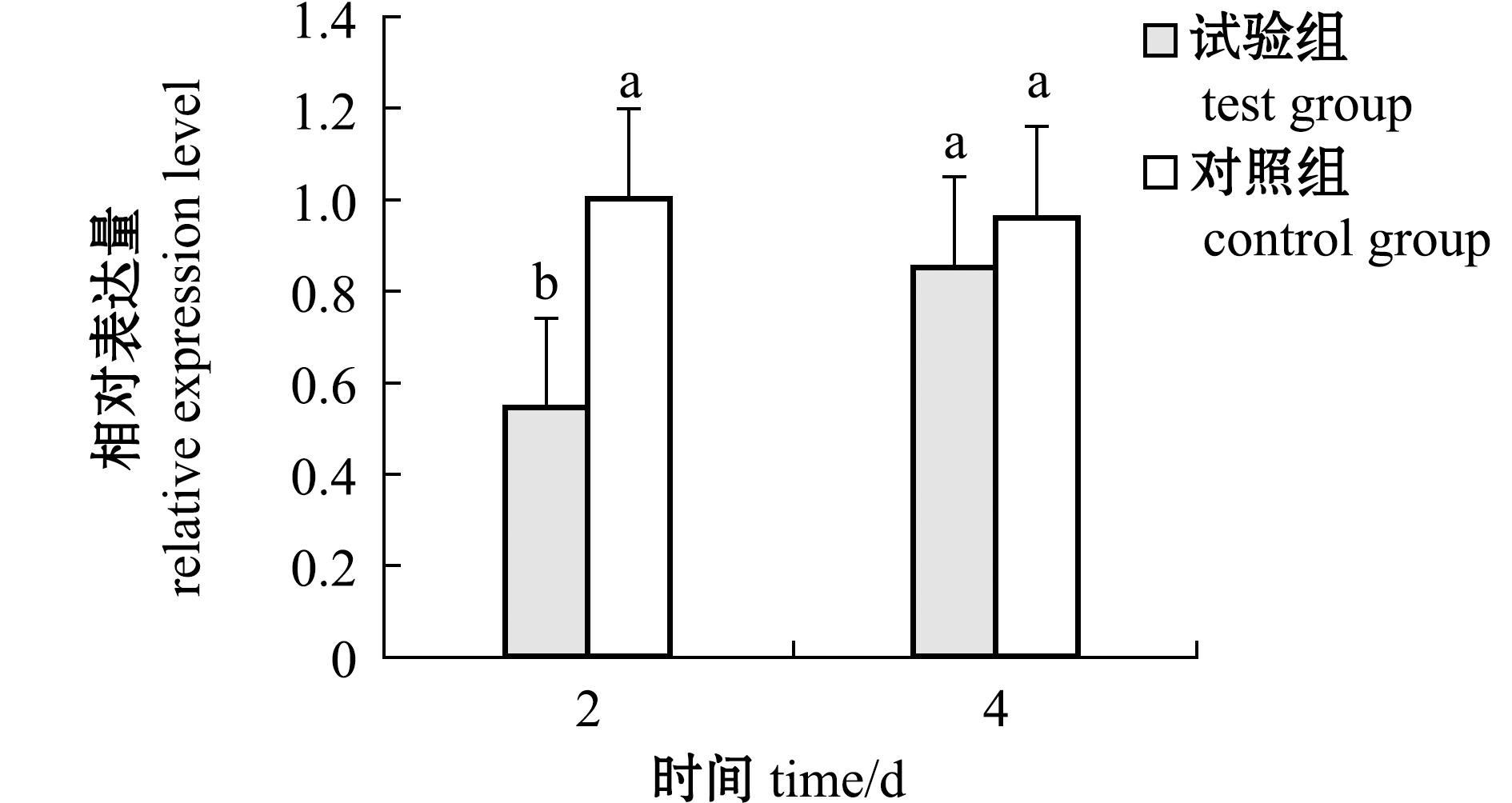
使用荧光定量PCR检测dsRNA干扰后,MrSpo11基因在罗氏沼虾卵巢中的表达情况。结果显示:注射dsRNA后第2天,试验组的MrSpo11基因表达量显著低于对照组(P<0.05),注射dsRNA后第4天,试验组和对照组中MrSpo11基因表达量无显著性差异(P>0.05);注射dsRNA后第2、4天,试验组MrSpo11基因表达量分别比对照组下降45.8%、11.6%(图7)。
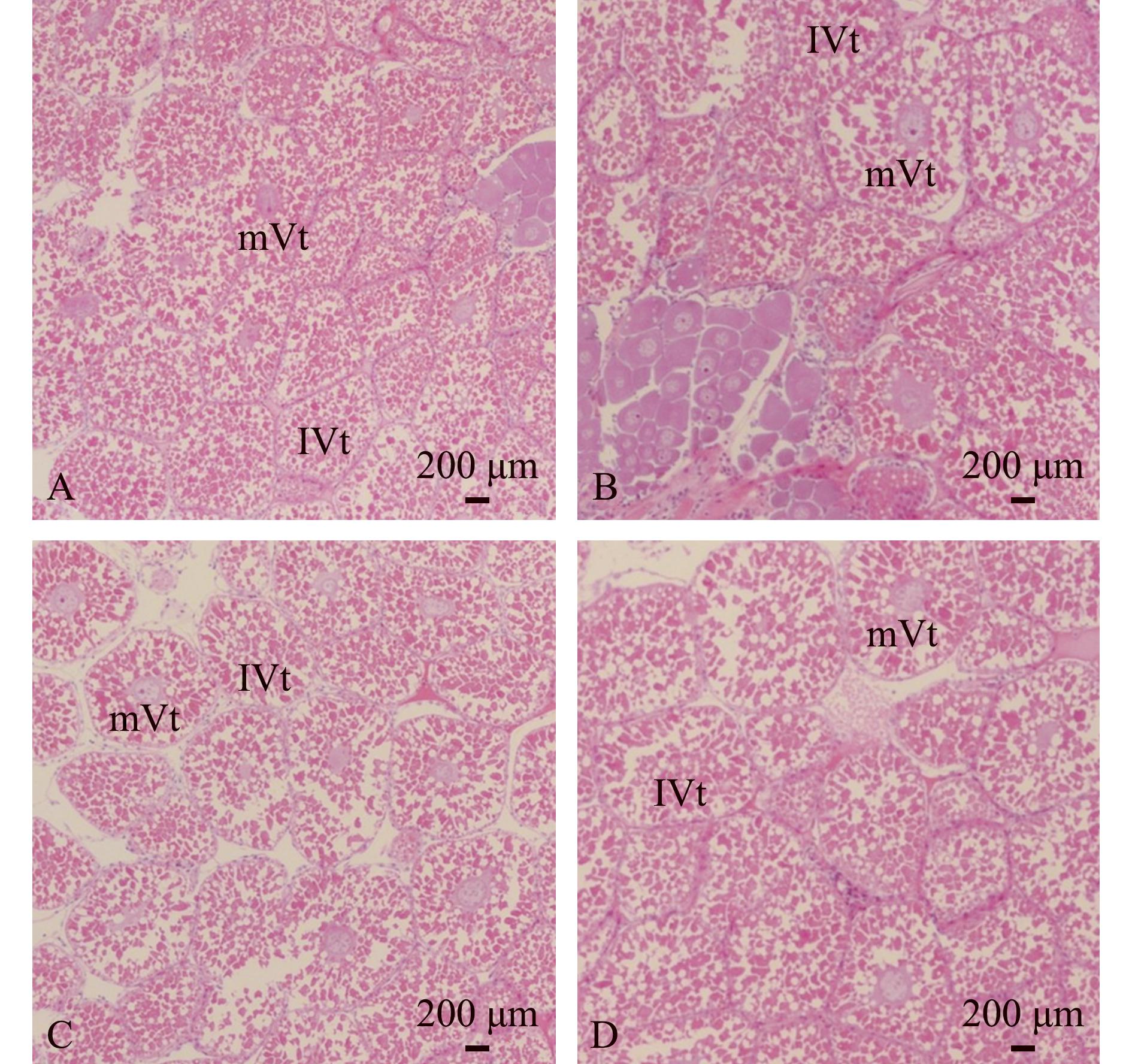
卵巢组织切片观察显示:注射dsRNA后第0天,试验组和对照组的卵巢组织细胞大部分处于卵黄发生中期和卵黄发生晚期,表明试验用虾的卵巢发育均处于卵巢发育Ⅲ期;注射dsRNA第4天,试验组和对照组的卵巢组织细胞大部分仍处于卵黄发生中期和卵黄发生晚期,表明试验组和对照组的卵巢发育仍处于卵巢发育Ⅲ期(图8)。试验组的卵巢组织中处于卵黄发生中期的卵母细胞比例略高于对照组,说明试验组的卵巢发育成熟度略低于对照组。
3 讨论
3.1 罗氏沼虾MrSpo11基因序列特征及进化分析
DSBs(double strand breaks)的产生是减数分裂过程中染色体发生同源重组的前提条件,也为生物进化过程中基因多样性的发展和新性状的产生奠定了分子基础[20-21]。SPO11是一种在酿酒酵母中首次发现、仅在减数分裂中起催化DSB作用的蛋白[22]。随后,从人类和小鼠中鉴定出脊椎动物Spo11的cDNA,提示哺乳动物Spo11基因的作用与酵母相同[5];小家鼠Spo11 cDNA编码了一个与Spo11/TOPVIA家族所有成员密切相关的蛋白[6];Shimoi等[2]利用酿酒酵母的单拷贝质粒基因组DNA文库转化,筛选到弥补K7衍生物减数分裂染色体重组缺陷的Spo11基因,进一步研究发现,酿酒酵母Spo11基因(ScSpo11)修复了K7衍生物的减数分裂重组缺陷和孢子活力;Ozaki等[7]从日本鳗鲡中分离到编码Spo11的cDNA,制备了针对鳗鲡SPO11的特异性抗体作为减数分裂的标记,并观察了注射HCG的日本鳗鲡在精子发生过程中Spo11基因的表达变化;尚婉婧等[8]通过PCR技术克隆获得了尼罗罗非鱼Spo11基因的cDNA序列,并利用实时定量PCR和原位杂交技术研究了该基因在雌雄性腺中的表达模式;董然然等[10]克隆获得了贵州草海鲫Spo11基因的cDNA序列,并对不同剂量NP处理组中Spo11基因的表达情况进行了分析;朱辣等[11]为明确减数分裂关键基因的序列和表达特征,通过分子克隆、序列比对等方法研究了鲫鲤杂交鱼Spo11基因和Mlh1基因的遗传规律和表达特征。本研究中,通过RACE技术成功克隆了罗氏沼虾MrSpo11基因的全长cDNA序列,并对其进行生物信息学分析。结果显示,MrSpo11基因共编码379个氨基酸,MrSPO11蛋白为稳定亲水性蛋白,含有SPO11超级家族结构域,不存在跨膜结构和信号肽;MrSPO11氨基酸序列与红螯螯虾SPO11的一致性最高(67%),且MrSPO11与凡纳滨对虾、日本对虾等甲壳动物的SPO11聚为一支,表明Spo11基因的结构在甲壳动物间是保守的,暗示该基因在甲壳动物中可能具有相似的生物学功能。
3.2 罗氏沼虾MrSpo11基因的表达模式
Spo11基因在减数分裂过程中起催化DSB的作用,因此,Spo11基因应该在性腺组织中表达,但已有的研究表明,Spo11基因在不同物种的组织表达存在差异。尚婉婧等[7]发现,罗非鱼Spo11基因在雌、雄成鱼性腺中特异性表达,且在精巢中的表达量远高于卵巢;Ozaki等[6]发现,日本鳗鲡Spo11基因仅在精子发生过程中的精母细胞中表达,而在卵子发生过程的卵黄生成早期检测不到该基因表达,提示日本鳗鲡Spo11在向减数分裂增殖的精原细胞中表达水平较低,在减数分裂早期表达增加;Romanienko等[5]发现,人类和小鼠Spo11基因在性腺、肺、肌肉和胸腺等组织中都有表达;Mckim等[3]发现,果蝇mei-W68基因在胚胎、幼虫和蛹中都有表达;Zhang等[9]发现,斑马鱼Spo11基因在性腺组织中表达,在精巢中的表达水平高于卵巢,并且Spo11基因在斑马鱼胚胎中也有表达,尤其在圆顶期。
本研究中,荧光定量PCR显示,MrSpo11基因在鳃中的相对表达量最高,在卵巢、肝胰腺、心脏和鳃中表达量较高,在脑、肌肉和眼中微量表达;同时,MrSpo11基因在4个不同发育时期卵巢中均有表达,并且在卵巢发育Ⅰ期相对表达量最高,卵巢发育Ⅲ期次之,Ⅱ期和Ⅳ期表达量最低。原位杂交结果也显示,在卵巢发育Ⅰ期中,杂交信号出现在卵黄发生前期卵母细胞的细胞质中;在卵巢发育Ⅱ期,杂交信号出现在卵黄发生早期卵母细胞的细胞质和细胞核中;在卵巢发育Ⅲ期,杂交信号出现在卵黄发生中期卵母细胞的细胞质中;在卵巢发育Ⅳ期,在卵黄发生晚期卵母细胞细胞质中的杂交信号进一步减弱。这表明,MrSpo11基因在卵巢发育过程中都有表达,并且在卵巢发育Ⅰ期相对表达量最高,暗示该基因与其他物种的Spo11基因一样,可能在卵巢发育特别是减数分裂过程中发挥重要作用。此外,除了在卵巢中表达外,MrSpo11基因在鳃、肝胰腺和心脏等体细胞组织中也有较高表达。鳃是甲壳动物免疫的第一道防线,直接与外界环境接触,容易受到病原菌的侵害而产生免疫反应,肝胰腺是甲壳动物重要的免疫器官,这揭示了MrSpo11基因可能在罗氏沼虾机体免疫过程中也发挥作用,但该基因介导机体免疫的机制仍需要进一步探究。
3.3 罗氏沼虾MrSpo11基因的功能分析
RNAi是由 dsRNA 介导的特异性基因表达抑制或沉默现象,将dsRNA注入细胞后,由生物酶剪切成小分子RNA,通过与靶基因的特定转录产物结合,从而使特定目标基因的功能失效。目前,RNAi技术已经在甲壳动物生长发育、免疫和性别控制等领域的研究中发挥了巨大作用。Liu等[23]通过RNA干扰技术研究了小龙虾(Pacifastacus leniusculus)酚氧化酶对感染嗜水气单胞菌的影响;Lee等[24]通过RNA干扰技术研究了MSTN/GDF11基因对凡纳滨对虾生长的影响,发现在注射dsRNA 8周的过程中,注射dsRNA组的虾死亡率(71%)明显高于对照组(40%);Bai等[25-26]通过对日本沼虾卵黄蛋白和卵黄蛋白原受体基因进行RNA干扰,研究了卵黄蛋白和卵黄蛋白原受体基因对卵巢发育的影响,发现RNA干扰后日本沼虾的性腺指数明显降低;Lezer等[27]利用RNAi干扰IAG基因,使得罗氏沼虾雄性个体反转成伪雌性,进而培育出全雄子代个体;陈雪峰[28]通过RNAi技术研究了Cyclin A和Cyclin B2基因对罗氏沼虾卵巢发育的影响。本研究中,通过体外注射dsRNA对罗氏沼虾MrSpo11基因干扰,研究了MrSpo11基因对罗氏沼虾卵巢发育的影响。结果发现,在注射dsRNA后第2、4天,试验组MrSpo11基因表达量分别比对照组下降45.8%、11.6%;注射dsRNA后第4天,试验组和对照组的卵巢组织仍处于卵巢发育Ⅲ期,但试验组卵巢组织中处于卵黄发生中期的卵母细胞比例略高于对照组。试验结果表明,RNA干扰可以降低MrSpo11基因在卵巢中的相对表达量,同时,试验组的卵巢发育成熟度略低于对照组,暗示MrSpo11基因可能是调控罗氏沼虾卵巢发育的重要功能基因。
4 结论
1)通过RACE技术成功克隆获得了MrSpo11基因全长cDNA序列,MrSPO11氨基酸序列与红螯螯虾SPO11一致性最高(67%),与凡纳滨对虾、日本对虾等甲壳动物的SPO11聚为一支,表明SPO11蛋白的结构在甲壳动物间是保守的。
2)MrSpo11基因在罗氏沼虾4个不同发育时期卵巢中均有表达,其中,在卵巢发育Ⅰ期表达量最高,表明该基因对罗氏沼虾卵巢发育具有重要作用。
3)MrSpo11基因被敲降后卵巢发育减缓,表明该基因参与了调控罗氏沼虾卵巢发育的过程。
参考文献:
[1] GHELDOF A,MACKAY D J G,CHEONG Y,et al.Genetic diagnosis of subfertility:the impact of meiosis and maternal effects[J].Journal of Medical Genetics,2019,56(5):271-282.
[2] SHIMOI H,KAWAMURA N,YAMADA M.Cloning of the SPO11 gene that complements a meiotic recombination defect in sake yeast[J].Journal of Bioscience and Bioengineering,2020,130(4):367-373.
[3] MCKIM K S,HAYASHI-HAGIHARA A.Mei-W68 in Drosophila melanogaster encodes a Spo11 homolog:evidence that the mechanism for initiating meiotic recombination is conserved[J].Genes &Development,1998,12(18):2932-2942.
[4] YEH H Y,LIN S W,WU Y C,et al.Functional characterization of the meiosis-specific DNA double-strand break inducing factor SPO-11 from C.elegans[J].Scientific Reports,2017,7:2370.
[5] ROMANIENKO P J,CAMERINI-OTERO R D.Cloning,characterization,and localization of mouse and human SPO11[J].Genomics,1999,61(2):156-169.
[6] METZLER-GUILLEMAIN C,DE MASSY B.Identification and characterization of an SPO11 homolog in the mouse[J].Chromosoma,2000,109(1/2):133-138.
[7] OZAKI Y,MIURA C,MIURA T.Molecular cloning and gene expression of Spo11 during spermatogenesis in the Japanese eel,Anguilla japonica[J].Comparative Biochemistry and Physiology Part B:Biochemistry &Molecular Biology,2006,143(3):309-314.
[8] 尚婉婧,罗凤,罗廷文,等.尼罗罗非鱼Spo11基因的克隆表达及RU486处理对其表达的影响[J].水生生物学报,2016,40(2):403-407. SHANG W J,LUO F,LUO T W,et al.Molecular cloning and expression analysis of Spo11 gene and expression change under Ru486 treatment in Nile tilapia[J].Acta Hydrobiologica Sinica,2016,40(2):403-407.(in Chinese)
[9] ZHANG Y S,LI Z P,NIE Y,et al.Sexually dimorphic reproductive defects in zebrafish with Spo11 mutation[J].Aquaculture Research,2020,51(12):4916-4924.
[10] 董然然,陈修云,王岗屹,等.贵州草海鲫鱼Spo11基因的克隆、生物信息学和表达分析[J].重庆师范大学学报(自然科学版),2018,35(4):25-30,2. DONG R R,CHEN X Y,WANG G Y,et al.Cloning,bioinformatic,and expression analysis of Spo11 gene of crucian carp in Caohai Lake of Guizhou Province[J].Journal of Chongqing Normal University (Natural Science Edition),2018,35(4):25-30,2.(in Chinese)
[11] 朱辣,张美文,朱明,等.减数分裂关键基因Spo11和Mlh1在鲫鲤杂交鱼中的遗传分析[J].南方农业学报,2021,52(8):2251-2258. ZHU L,ZHANG M W,ZHU M,et al.Genetic analysis of key genes Spo11 and Mlh1 controlling meiosis in hybrid fish of Carassius auratus red var.(♀)×Cyprinus carpio L.(♂)[J].Journal of Southern Agriculture,2021,52(8):2251-2258.(in Chinese)
[12] 倪蒙,陈雪峰,高强,等.放养密度对温棚养殖罗氏沼虾生长、生化指标、水质及养殖效益的影响[J].大连海洋大学学报,2021,36(3):423-429. NI M,CHEN X F,GAO Q,et al.Effects of stocking density on growth performance,biochemical indices,water quality and economic benefits of giant freshwater prawn Macrobrachium rosenbergii in a greenhouse[J].Journal of Dalian Ocean University,2021,36(3):423-429.(in Chinese)
[13] 施金谷,武霞,黄光华,等.不同种群罗氏沼虾幼体的肠道菌群结构与功能特征分析[J].水产科学,2023,42(4):674-681. SHI J G,WU X,HUANG G H,et al.Structural and functional characteristics of intestinal microbiota in different populations of Macrobrachium rosenbergii larvae[J].Fisheries Science,2023,42(4):674-681.(in Chinese)
[14] 邹松保,原居林,程海华,等.罗氏沼虾育苗期浮游细菌群落演替模式、驱动因素及其生物标志物[J].水生生物学报,2023,47(8):1323-1334. ZOU S B,YUAN J L,CHENG H H,et al.The dynamics of bacterioplankton communities associated with Macrobrachium rosenbergii across whole larval development:successional processes,environmental drivers,and developmental biomarkers[J].Acta Hydrobiologica Sinica,2023,47(8):1323-1334.(in Chinese)
[15] 王靖文,杨国梁,孔杰,等.罗氏沼虾(Macrobrachium rosenbergii)雌雄虾不同形态阈值性状的遗传变异分析[J].海洋与湖沼,2022,53(3):710-717. WANG J W,YANG G L,KONG J,et al.An analysis on genetic variation of threshold traits of female and male morphotypes in Macrobrachium rosenbergii[J].Oceanologia et Limnologia Sinica,2022,53(3):710-717.(in Chinese)
[16] 熊昭娣,高翔,邓平平,等.罗氏沼虾形态性状对体长影响的通径分析[J].水产科学,2022,41(3):417-423. XIONG Z D,GAO X,DENG P P,et al.Path analysis of effects of morphometric traits on body length in giant river prawn Macrobrachium rosenbergii[J].Fisheries Science,2022,41(3):417-423.(in Chinese)
[17] 邢钱钱,杨旻珉,陈国柱,等.罗氏沼虾性成熟前后形态性状对体质量的通径分析[J].水产学报,2022,46(9):1632-1645. XING Q Q,YANG M M,CHEN G Z,et al.Path analysis of phenotypic traits on body weight of Macrobrachium rosenbergii before and after sexual maturity[J].Journal of Fisheries of China,2022,46(9):1632-1645.(in Chinese)
[18] 杨彦豪,黎铭,王瑞,等.罗氏沼虾Dmc1基因的克隆及表达分析[J].江苏农业科学,2022,50(21):173-181. YANG Y H,LI M,WANG R,et al.Cloning and expression analysis of Dmc1 gene in Macrobrachium rosenbergii[J].Jiangsu Agricultural Sciences,2022,50(21):173-181.(in Chinese)
[19] MEERATANA P,SOBHON P.Classification of differentiating oocytes during ovarian cycle in the giant freshwater prawn,Macrobrachium rosenbergii de man[J].Aquaculture,2007,270(1/2/3/4):249-258.
[20] KEENEY S.Spo11 and the formation of DNA double-strand breaks in meiosis[J].Genome Dynamics and Stability,2008,2:81-123.
[21] SUN H,TRECO D,SCHULTES N P,et al.Double-strand breaks at an initiation site for meiotic gene conversion[J].Nature,1989,338(6210):87-90.
[22] KEENEY S,GIROUX C N,KLECKNER N.Meiosis-specific DNA double-strand breaks are catalyzed by Spo11,a member of a widely conserved protein family[J].Cell,1997,88(3):375-384.
[23] LIU H P,JIRAVANICHPAISAL P,CERENIUS L,et al.Phenoloxidase is an important component of the defense against Aeromonas hydrophila infection in a crustacean,Pacifastacus leniusculus[J].The Journal of Biological Chemistry,2007,282(46):33593-33598.
[24] LEE J H,MOMANI J,KIM Y M,et al.Effective RNA-silencing strategy of Lv-MSTN/GDF11 gene and its effects on the growth in shrimp,Litopenaeus vannamei[J].Comparative Biochemistry and Physiology Part B,Biochemistry &Molecular Biology,2015,179:9-16.
[25] BAI H K,QIAO H,LI F J,et al.Molecular characterization and developmental expression of vitellogenin in the oriental river prawn Macrobrachium nipponense and the effects of RNA interference and eyestalk ablation on ovarian maturation[J].Gene,2015,562(1):22-31.
[26] BAI H K,QIAO H,LI F J,et al.Molecular and functional characterization of the vitellogenin receptor in oriental river prawn,Macrobrachium nipponense[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology,2016,194:45-55.
[27] LEZER Y,AFLALO E D,MANOR R,et al.On the safety of RNAi usage in aquaculture:the case of all-male prawn stocks generated through manipulation of the insulin-like androgenic gland hormone[J].Aquaculture,2015,435:157-166.
[28] 陈雪峰.罗氏沼虾卵巢发育相关基因的功能研究[D].宁波:宁波大学,2021. CHEN X F.Functional analysis of ovarian development related genes in Macrobrachium rosenbergii[D].Ningbo:Ningbo University,2021.(in Chinese)
Cloning, expression and role in ovarian development of Spo11 gene in Malaysian prawn (Macrobrachium rosenbergii)
YANG Yanhao1,2,WANG Rui2,LI Liping2,RUAN Zhide2,HUANG Binsheng2,LU Zhifa2,YANG Mingwei3*,LIN Yong2*
(1.Key Laboratory of Freshwater Aquatic Genetic Resources,Ministry of Agriculture and Rural Affairs,National Demonstration Center for Experimental Fisheries Science Education,Shanghai Engineering Research Center of Aquaculture,Ministry of Education,Shanghai Ocean University,Shanghai 201306,China;2.Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture,Guangxi Institute of Fisheries,Nanning 530021,China;3.Guangxi Aquatic Animal Husbandry School,Nanning 530021,China)
Abstract: In order to investigate the regulatory role of meiotic protein covalently bound to DSB homolog (MrSpo11) in ovarian development of Malaysian prawn (Macrobrachium rosenbergii), the molecular characteristics, encoded amino acid, tissue expression, distribution and biological function of MrSpo11 gene were investigated in Malaysian prawn by RACE technique, fluorescence quantitative PCR, in situ hybridization and RNA interference. The results showed that the MrSpo11 cDNA sequence had total length of 2 298 bp, with the 5′end non-coding region of 457 bp, the 3′ end non-coding region of 701 bp, and the open reading frame of 1 140 bp encoding 379 amino acid residues. There was the maximal relative expression level of MrSpo11 gene in gill, higher level in ovary, hepatopancreas and heart, and slightly expression level in brain, eye and muscle. The maximal relative expression level of MrSpo11 gene was observed in stage Ⅰ of ovarian development, followed by stage Ⅲ, and the minimal level in stage Ⅱ and stage Ⅳ. MrSpo11 gene was showed to be expressed in the cytoplasm of pre-vitellogenesis, mid-vitellogenesis and late vitellogenesis oocytes and in the cytoplasm and nucleus of early vitellogenesis oocytes. The expression of MrSpo11 gene was decreased in experimental group by 45.8% and 11.6% on 2nd and 4th day after dsRNA injection, respectively, compared with control group, with slightly lower ovarian development maturity in the experimental group than that in the control group in 4 days of injection, indicating that MrSpo11 gene is involved in the ovarian development. The finding lays a foundation for further research on the molecular regulation mechanism of ovarian development of Malaysian prawn.
Key words: Macrobrachium rosenbergii; Spo11 gene; cloning;expression; ovarian development