卵形鲳鲹(Trachinotus ovatus),俗称“金鲳”,以其肉质细嫩、无肌间刺而闻名,是一种在商业上极具价值的海洋鱼类[1]。根据2023年中国渔业统计年鉴,2022年卵形鲳鲹的养殖总产量达到了24.54万t[2]。在广东和广西地区,卵形鲳鲹常通过传统发酵工艺加工成梅香鱼等地方特色产品。这种发酵过程在复杂微生物的作用下,不仅赋予产品独特风味,还提升了原料的附加值。然而,传统发酵过程依赖于自然微生物群落的自发发酵,在开放系统中进行,导致最终产品品质不可控[3]。随着经济的发展和人们对食品安全及营养的日益关注[4],相关产业迫切需要对发酵卵形鲳鲹的生产工艺进行标准化和技术优化,以确保食品的高品质和安全性,从而突破该产业的发展瓶颈。
近年来,利用接种发酵剂提升产品品质的研究日益增多[5-6]。与传统发酵相比,接菌发酵不仅保留了传统产品的特性,还能进一步提升产品的风味和品质[7]。刘洒洒[8]研究表明,接菌发酵能够加速风味物质的生成,从而提升臭鳜鱼产品品质。尹红梅等[9]从江西传统发酵霉鱼中筛选到一株优势菌——清酒乳杆菌JXNU1-3,发现在2%的盐浓度下,接菌发酵3 d的霉鱼具有更佳的色泽、质构和感官,说明接菌发酵能够保持传统发酵霉鱼的主要风味组分,并改善感官品质。周长艳等[10]从传统发酵腊鱼中分离出优势菌,并将其应用于接菌发酵腌制鱼制品,结果显示,接菌发酵能有效保留发酵鱼制品的香腊味,同时显著降低咸度、过氧化值及挥发性盐基氮含量。这些研究结果表明,接菌发酵能有效改善鱼制品的感官品质、风味和贮藏性,缩短发酵周期,对于促进发酵鱼制品的商业化和产业化具有重要的研究和应用价值。
前期研究中,本团队通过HS-GC-IMS技术对传统发酵卵形鲳鲹风味化合物组成进行了分析[11],并从传统发酵卵形鲳鲹中定向筛选得到一株耐盐、具有降解肌肉蛋白作用的高产蛋白酶菌株热带芽孢杆菌(Bacillus tropicus)MX-8[12]。在此基础上,本研究中采用热带芽孢杆菌MX-8作为发酵剂进行接种发酵,全面评估了不同发酵时间(0、5、10、15、20 d)下传统发酵与接菌发酵卵形鲳鲹的质构(弹性、硬度、内聚性和咀嚼度)、挥发性风味化合物组成及蛋白质氧化(羰基、总巯基、Ca2+-ATPase活性)的变化情况,旨在确定接菌发酵卵形鲳鲹的可行性及优势,为开发新型发酵剂和规模化生产发酵卵形鲳鲹提供科学参考。
1 材料与方法
1.1 材料
原料:鲜活卵形鲳鲹30尾,购自广东省广州市当地养殖场,体质量为(500±50)g;热带芽孢杆菌MX-8菌株为课题组前期从传统发酵卵形鲳鲹中筛选得到。
试剂:Tris-Maleate缓冲液、葡萄糖、蛋白胨、LB琼脂培养基、氯化钾、氯化钙、磷酸钠、吐温80、磷酸二氢钠、磷酸氢二钠、碳酸钠、蛋白质羰基含量测定试剂盒(微量法)、蛋白质总巯基含量检测试剂盒(微量法)、Bradford蛋白浓度测定试剂盒、超微量Ca2+-ATPase试剂盒。所有化学试剂均为分析纯。
发酵培养基(g/L):葡萄糖5 g、蛋白胨5 g、CaCl2 0.1 g、Na2HPO4 0.1 g、吐温80 1 mL。
仪器与设备:QTS-25质构分析仪(英国Farbell公司);多标记微孔板检测器(瑞士Tacan公司);AvantiJ26XP型高速离心机(美国贝克曼库尔特公司);FlavourSpec® 1H1-00053型气相离子迁移谱(德国G.A.S.公司)。
1.2 方法
1.2.1 传统发酵卵形鲳鲹的制备 卵形鲳鲹在4 ℃下2 h内运至实验室,去除内脏与鱼鳃,用水清洗鱼样除去血液和污垢。除去水后,在鱼身体和腹腔表面均匀地涂上海盐,分层堆放在发酵罐内(长为1.5 m,宽为1 m,高为1 m),覆盖海盐至超出鱼体表面2 cm,加盖密封后置于常温下发酵20 d。第0天(未发酵的鱼)及此后每5 d从发酵罐中随机收集20尾鱼的肌肉样本(相应的样本分别标记为0、5、10、15、20 d)。将这些鱼肉样本进行去皮和剔骨处理后用搅拌器粉碎,并储存在灭菌袋中,在-20 ℃条件下冷冻保存,以备后续指标检测。待测样品从3个发酵罐中获取,设置3次平行试验。
1.2.2 接菌发酵卵形鲳鲹的制备
1)菌株的活化。将课题组前期筛选得到的Bacillus tropicus MX-8[12]接种于LB肉汤培养基中,于30 ℃恒温培养24 h后以1%接种量转移至发酵培养基中,以30 ℃、180 r/min培养24 h。
2)发酵剂的制备。将培养后的菌于4 ℃下以10 000 r/min离心5 min,弃去上清液收集菌体,随后置于无菌生理盐水中重悬,制备菌悬液,使最终菌悬液浓度为105~106 CFU/mL,备用。
3)样品前处理及接菌发酵。将鲜活卵形鲳鲹宰杀,去除其内脏和鱼鳃,之后用清水清洗鱼体的血污。将鱼体在25 ℃菌悬液中浸泡4 h,使菌液充分覆盖于鱼体表面,通过取肉测定确保最终鱼体中菌浓度为105~106 CFU/g。鱼体沥干表面菌液后按照传统发酵处理方法发酵20 d。在0 d(未发酵的鱼)及此后每5 d从发酵罐中随机收集20尾鱼的肌肉样本(相应的样本分别标记为0、5、10、15、20 d),将3个批次收集到的样本进行随机混合,对这些鱼肉样本进行去皮和剔骨处理后,用搅拌器粉碎并储存在灭菌袋中,在-20 ℃条件下冷冻保存,等待后续指标的检测。
1.2.3 肌原纤维蛋白的提取 鱼肉肌原纤维蛋白的提取参考Li等[13]的方法略加修改。准确称取2 g鱼肉于100 mL离心管中,加入20 mL预冷的Tris-buffer A(0.05 mol/L KCl,20 mmol/L Tris-maleate,pH 7.0)后均质1 min,并将混合物以1 000 g,4 ℃下离心15 min,弃掉上清液后继续加入20 mL Tris-buffer A,重复上述步骤。随后在沉淀物中加入20 mL Tris-buffer B(0.6 mol/L KCl,20 mmol/L Tris-maleate,pH 7.0),充分匀浆1 min后于4 ℃下放置1 h,在10 000 g,4 ℃下离心15 min,收集上清液即为肌原纤维蛋白溶液。采用Bradford蛋白浓度测定试剂盒测定肌原纤维蛋白的含量。
1.2.4 总巯基、羰基、Ca2+-ATPase活性的测定 肌原纤维蛋白中的总巯基含量、羰基含量及Ca2+-ATPase活性的测定均采用试剂盒进行。
1.2.5 质构特性测定 鱼肉的质构测定参考王鑫等[14]的方法略加修改。将鱼肉切成方块(长为3 cm,宽为2 cm,高为1.5 cm),采用质构分析仪对鱼肉的硬度、弹性、咀嚼性和内聚性进行测定。质构分析仪采用直径为50 mm的圆柱形P25探头,质构参数如下:压缩形变为60%,触发力为5 g,测试前速度为3 mm/s,以1 mm/s的测试速度,1 mm/s的测试后速度,测试间隔时间为5 s,压缩比为50%。
1.2.6 挥发性有机化合物分析 发酵鱼样品的挥发性有机化合物分析采用FlavourSpec气相离子迁移谱测定[15]。将2 g切碎后的样品转移到20 mL顶空瓶中,拧紧瓶盖,放入GC-IMS顶空进样器上(每个阶段设置3个平行样品)。
顶空进样条件:孵化温度为60 ℃,孵化时间为15 min,进样针温度为85 ℃,进样体积为500 μL,振动速度为500 r/min。
色谱条件:色谱柱为MXT-5 15 mL,ID为0.53 mm,FT为1 μm,色谱柱温度为60 ℃,分析时间为20 min。
离子迁移谱条件:漂移气为高纯N2,流速为150 mL/min,IMS探测器温度为45 ℃。
GC-IMS在正离子模式下通过有线网络将数据传输并保存到计算机中,每张谱图平均扫描32次,使用网格脉冲宽度为100 μs,重复率为21 ms,采样频率为150 kHz。所有分析设置3份,通过VOCal软件内置的NIST数据库与IMS数据库对挥发性化合物进行鉴定。
1.3 数据处理
所有试验结果均采用平均值±标准差(mean±S.D.)表示。试验数据采用SPSS 16.0软件进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05。使用Origin 2021软件进行图形绘制。
2 结果与分析
2.1 接菌发酵卵形鲳鲹中肌原纤维蛋白的氧化
从图1(a)可见,在发酵过程中,肌原纤维蛋白的总巯基含量呈现逐渐下降的趋势,发酵第0天和第20天总巯基含量分别为127.23、84.07 μmol/g,与传统发酵相比无显著性差异(P>0.05)。然而,在发酵的5~15 d,接菌发酵组的总巯基含量显著低于传统发酵组(P<0.05)。从图1(b)可见,肌原纤维蛋白羰基含量随着发酵时间的延长而增加。在发酵的前10 d内,羰基含量的增加速率在接菌发酵组中超过了传统发酵组,反映出蛋白质氧化速率的加快。到了发酵后期(15~20 d),尽管接菌发酵组样品的羰基含量继续增加,但其增速低于传统发酵组。至发酵第20天,接菌发酵组的羰基含量为23.38 μmol/g,显著低于传统发酵组的28.38 μmol/g(P<0.05)。另外,图1(c)展示发酵过程中肌原纤维蛋白的Ca2+-ATPase活性逐渐降低,与总巯基含量的变化趋势一致。在发酵初期(0 d),接菌发酵和传统发酵组样品的Ca2+-ATPase活性无显著性差异(P>0.05),但随着发酵的进行,下降趋势显示出明显差异。发酵前15 d,接菌发酵组的Ca2+-ATPase活性下降更为显著,到第10天时几乎完全失活,仅为0.09 U/mg,而传统发酵组为0.13 U/mg。到发酵第20天,两组样品的Ca2+-ATPase活性无显著性差异(P>0.05)。
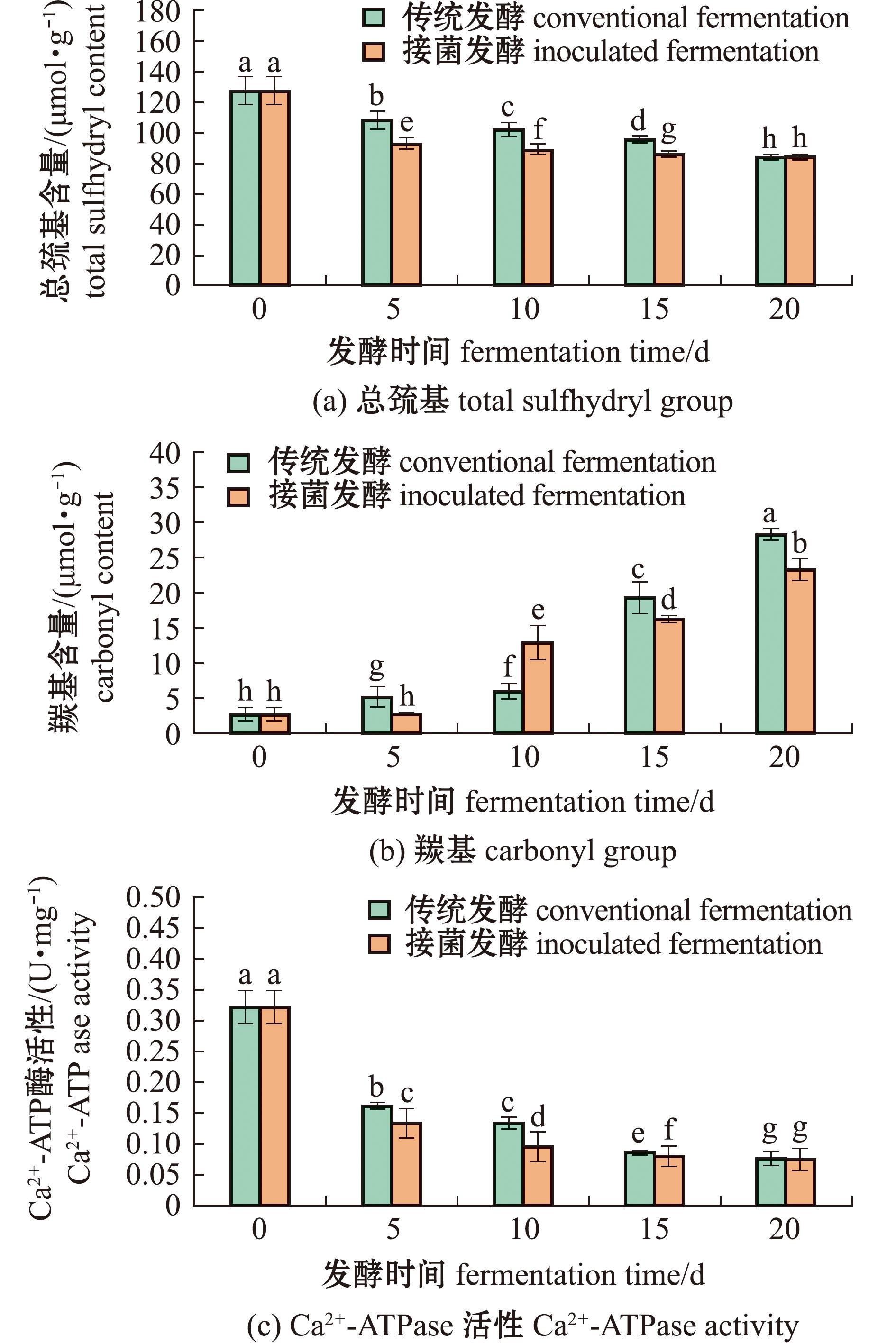
注:标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图1 接菌发酵组与传统发酵肌原纤维蛋白氧化情况
Fig.1 Oxidation of myofibrillar protein in inoculated fermentation and traditional fermentation groups
2.2 接菌发酵卵形鲳鲹的质构分析
将接菌发酵后卵形鲳鲹与传统发酵卵形鲳鲹的质构变化进行对比分析(图2)。结果显示,添加发酵剂后鱼肉的硬度随着发酵时间的延长而增加,与传统发酵的趋势相同。稍有不同的是,在发酵前期(0~10 d)硬度上升速率相比传统发酵更慢,发酵20 d时硬度明显高于传统发酵组。其次,接菌发酵后鱼肉的内聚性与咀嚼性均呈现先上升后下降的趋势,这与传统发酵的趋势相同。然而,接菌发酵组样品的咀嚼性和内聚性相较于传统发酵组变化幅度小,在发酵20 d时仍能保持较高的咀嚼性和内聚性。此外,接菌发酵后鱼肉弹性呈现上升趋势,与传统发酵趋势不同,且接菌发酵后鱼肉弹性显著高于传统发酵组(P<0.05)。
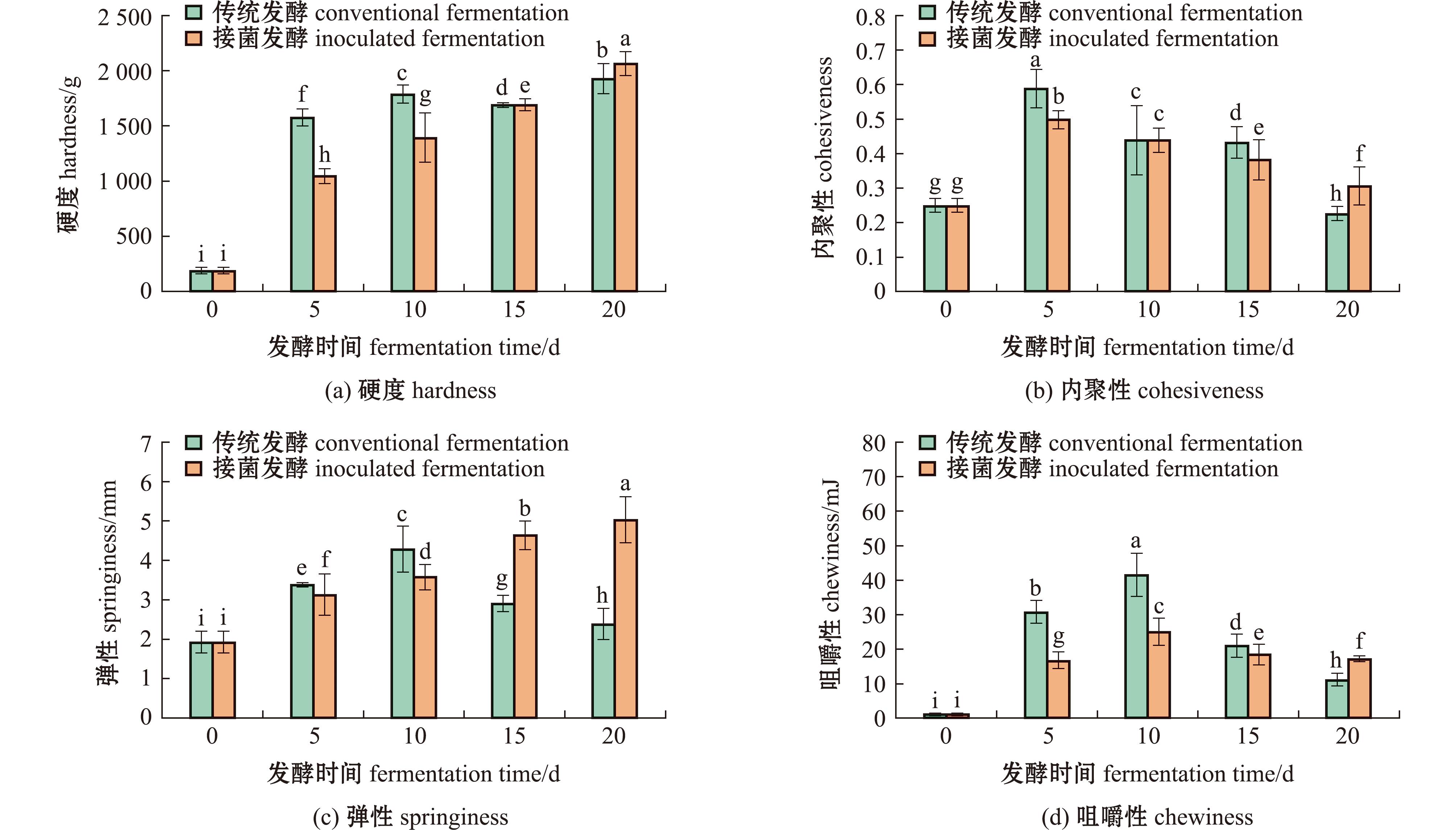
图2 接菌发酵组与传统发酵组鱼肉的质构变化
Fig.2 Textural changes in the inoculated fermentation group and the conventional fermentation group
2.3 接菌发酵卵形鲳鲹中挥发性化合物含量的变化
本研究中分析了接菌发酵后卵形鲳鲹样品中挥发性化合物的组成,共检测到75个信号峰,从图3(a)可见,横坐标1.0处的红色竖线为RIP峰(反应离子峰,经归一化处理)。RIP峰两侧的每一个点代表一种挥发性有机物,白色表示浓度较低,红色表示浓度较高,颜色越深表示浓度越大。通过NIST与IMS数据库对信号峰进行定性分析(表1),共鉴定到57种挥发性化合物,其中醛类20种,醇类14种,酮类7种,酯类7种,酸类3种,以及烯和呋喃类6种,相较于传统发酵组的35种更加丰富。将挥发性化合物的信号峰进行可视化处理,得到挥发性化合物的3D地形图。从图3(b)可见,接菌发酵后样品中的信号峰均多于0 d样品,且呈现出相似的可视化效果,但信号强度表现出一些差异。以发酵0 d为参照物,以区分不同发酵阶段的挥发性化合物,并得到差异比较谱图,从图3(c)可见,红色代表该物质在该样品中浓度高于参照样品,而蓝色则代表低于参照样品。大多数的信号峰出现在0~300 s的保留时间(Rt)和1.0~1.5 s的迁移时间(Dt),且随着发酵时间的进行逐渐延长,相较于传统发酵的范围更大,信号峰更多,表明鉴定到的挥发性化合物更多。
表1 接菌发酵卵形鲳鲹中挥发性化合物列表
Tab.1 List of volatile compounds in inoculated fermented Trachinotus ovatus
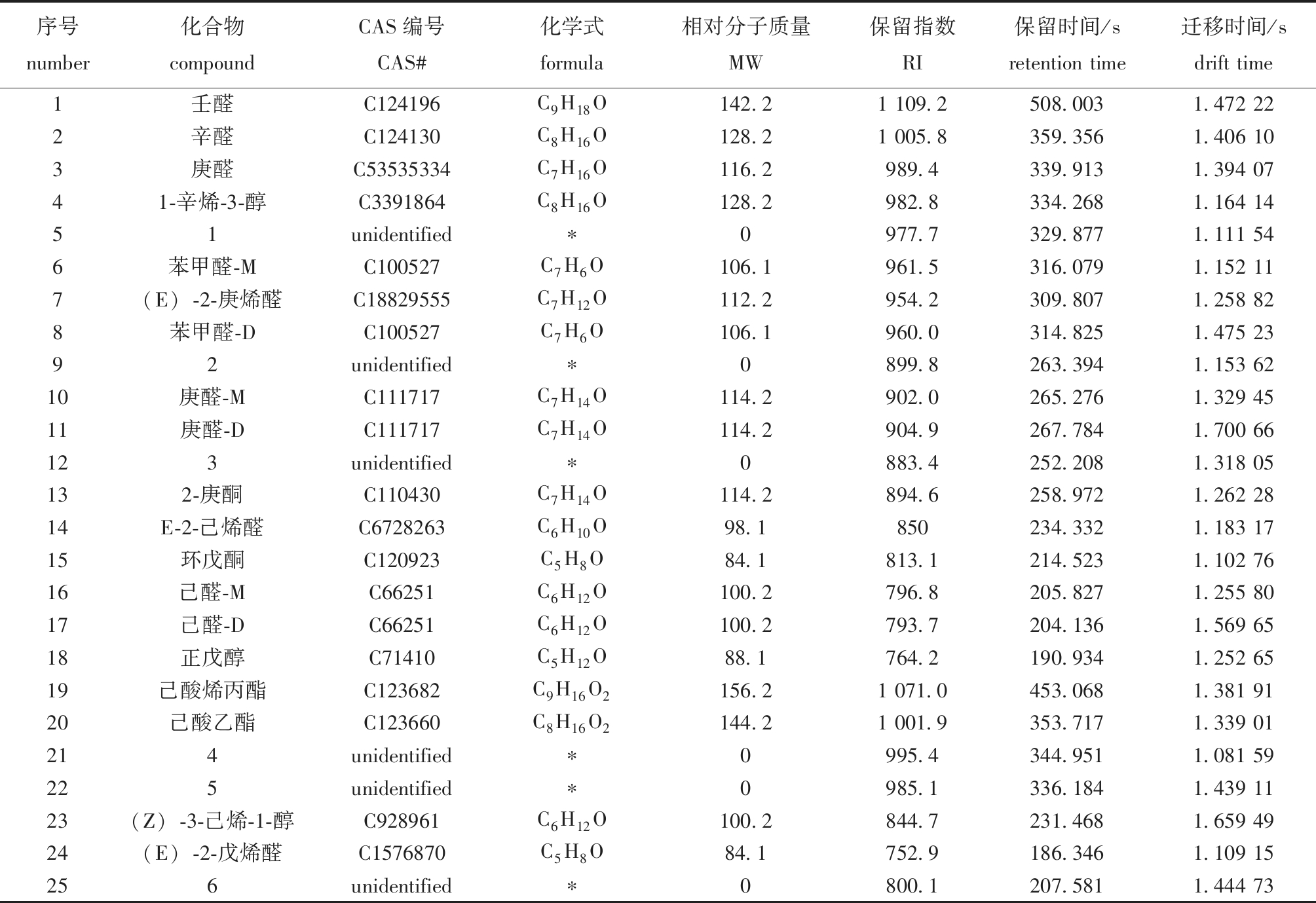
序号number化合物compoundCAS编号CAS#化学式formula相对分子质量MW保留指数RI保留时间/sretention time迁移时间/sdrift time1壬醛C124196C9H18O142.21 109.2508.0031.472 222辛醛C124130C8H16O128.21 005.8359.3561.406 103庚醛C53535334C7H16O116.2989.4339.9131.394 0741-辛烯-3-醇C3391864C8H16O128.2982.8334.2681.164 1451unidentified∗0977.7329.8771.111 546苯甲醛-MC100527C7H6O106.1961.5316.0791.152 117(E)-2-庚烯醛C18829555C7H12O112.2954.2309.8071.258 828苯甲醛-DC100527C7H6O106.1960.0314.8251.475 2392unidentified∗0899.8263.3941.153 6210庚醛-MC111717C7H14O114.2902.0265.2761.329 4511庚醛-DC111717C7H14O114.2904.9267.7841.700 66123unidentified∗0883.4252.2081.318 05132-庚酮C110430C7H14O114.2894.6258.9721.262 2814E-2-己烯醛C6728263C6H10O98.1850234.3321.183 1715环戊酮C120923C5H8O84.1813.1214.5231.102 7616己醛-MC66251C6H12O100.2796.8205.8271.255 8017己醛-DC66251C6H12O100.2793.7204.1361.569 6518正戊醇C71410C5H12O88.1764.2190.9341.252 6519己酸烯丙酯C123682C9H16O2156.21 071.0453.0681.381 9120己酸乙酯C123660C8H16O2144.21 001.9353.7171.339 01214unidentified∗0995.4344.9511.081 59225unidentified∗0985.1336.1841.439 1123(Z)-3-己烯-1-醇C928961C6H12O100.2844.7231.4681.659 4924(E)-2-戊烯醛C1576870C5H8O84.1752.9186.3461.109 15256unidentified∗0800.1207.5811.444 73
续表1 接菌发酵卵形鲳鲹中挥发性化合物列表
Cont. Tab.1 List of volatile compounds in inoculated fermented Trachinotus ovatus
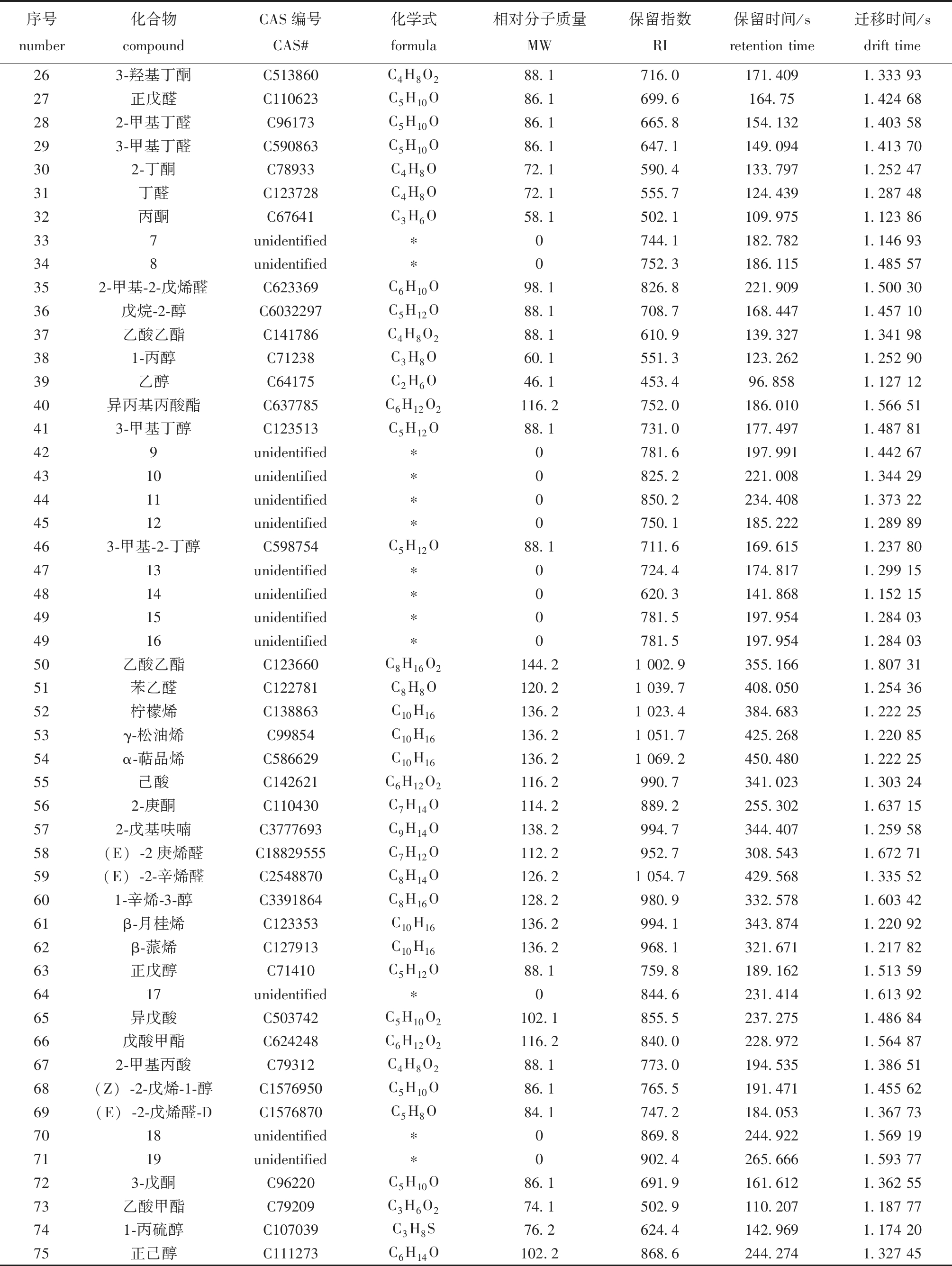
序号number化合物compoundCAS编号CAS#化学式formula相对分子质量MW保留指数RI保留时间/sretention time迁移时间/sdrift time263-羟基丁酮C513860C4H8O288.1716.0171.4091.333 9327正戊醛C110623C5H10O86.1699.6164.751.424 68282-甲基丁醛C96173C5H10O86.1665.8154.1321.403 58293-甲基丁醛C590863C5H10O86.1647.1149.0941.413 70302-丁酮C78933C4H8O72.1590.4133.7971.252 4731丁醛C123728C4H8O72.1555.7124.4391.287 4832丙酮C67641C3H6O58.1502.1109.9751.123 86337unidentified∗0744.1182.7821.146 93348unidentified∗0752.3186.1151.485 57352-甲基-2-戊烯醛C623369C6H10O98.1826.8221.9091.500 3036戊烷-2-醇C6032297C5H12O88.1708.7168.4471.457 1037乙酸乙酯C141786C4H8O288.1610.9139.3271.341 98381-丙醇C71238C3H8O60.1551.3123.2621.252 9039乙醇C64175C2H6O46.1453.496.8581.127 1240异丙基丙酸酯C637785C6H12O2116.2752.0186.0101.566 51413-甲基丁醇C123513C5H12O88.1731.0177.4971.487 81429unidentified∗0781.6197.9911.442 674310unidentified∗0825.2221.0081.344 294411unidentified∗0850.2234.4081.373 224512unidentified∗0750.1185.2221.289 89463-甲基-2-丁醇C598754C5H12O88.1711.6169.6151.237 804713unidentified∗0724.4174.8171.299 154814unidentified∗0620.3141.8681.152 154915unidentified∗0781.5197.9541.284 034916unidentified∗0781.5197.9541.284 0350乙酸乙酯C123660C8H16O2144.21 002.9355.1661.807 3151苯乙醛C122781C8H8O120.21 039.7408.0501.254 3652柠檬烯C138863C10H16136.21 023.4384.6831.222 2553γ-松油烯C99854C10H16136.21 051.7425.2681.220 8554α-萜品烯C586629C10H16136.21 069.2450.4801.222 2555己酸C142621C6H12O2116.2990.7341.0231.303 24562-庚酮C110430C7H14O114.2889.2255.3021.637 15572-戊基呋喃C3777693C9H14O138.2994.7344.4071.259 5858(E)-2庚烯醛C18829555C7H12O112.2952.7308.5431.672 7159(E)-2-辛烯醛C2548870C8H14O126.21 054.7429.5681.335 52601-辛烯-3-醇C3391864C8H16O128.2980.9332.5781.603 4261β-月桂烯C123353C10H16136.2994.1343.8741.220 9262β-蒎烯C127913C10H16136.2968.1321.6711.217 8263正戊醇C71410C5H12O88.1759.8189.1621.513 596417unidentified∗0844.6231.4141.613 9265异戊酸C503742C5H10O2102.1855.5237.2751.486 8466戊酸甲酯C624248C6H12O2116.2840.0228.9721.564 87672-甲基丙酸C79312C4H8O288.1773.0194.5351.386 5168(Z)-2-戊烯-1-醇C1576950C5H10O86.1765.5191.4711.455 6269(E)-2-戊烯醛-DC1576870C5H8O84.1747.2184.0531.367 737018unidentified∗0869.8244.9221.569 197119unidentified∗0902.4265.6661.593 77723-戊酮C96220C5H10O86.1691.9161.6121.362 5573乙酸甲酯C79209C3H6O274.1502.9110.2071.187 77741-丙硫醇C107039C3H8S76.2624.4142.9691.174 2075正己醇C111273C6H14O102.2868.6244.2741.327 45
注:*表示未被鉴定出的风味化合物。
Note:*represents unidentified flavour compounds.
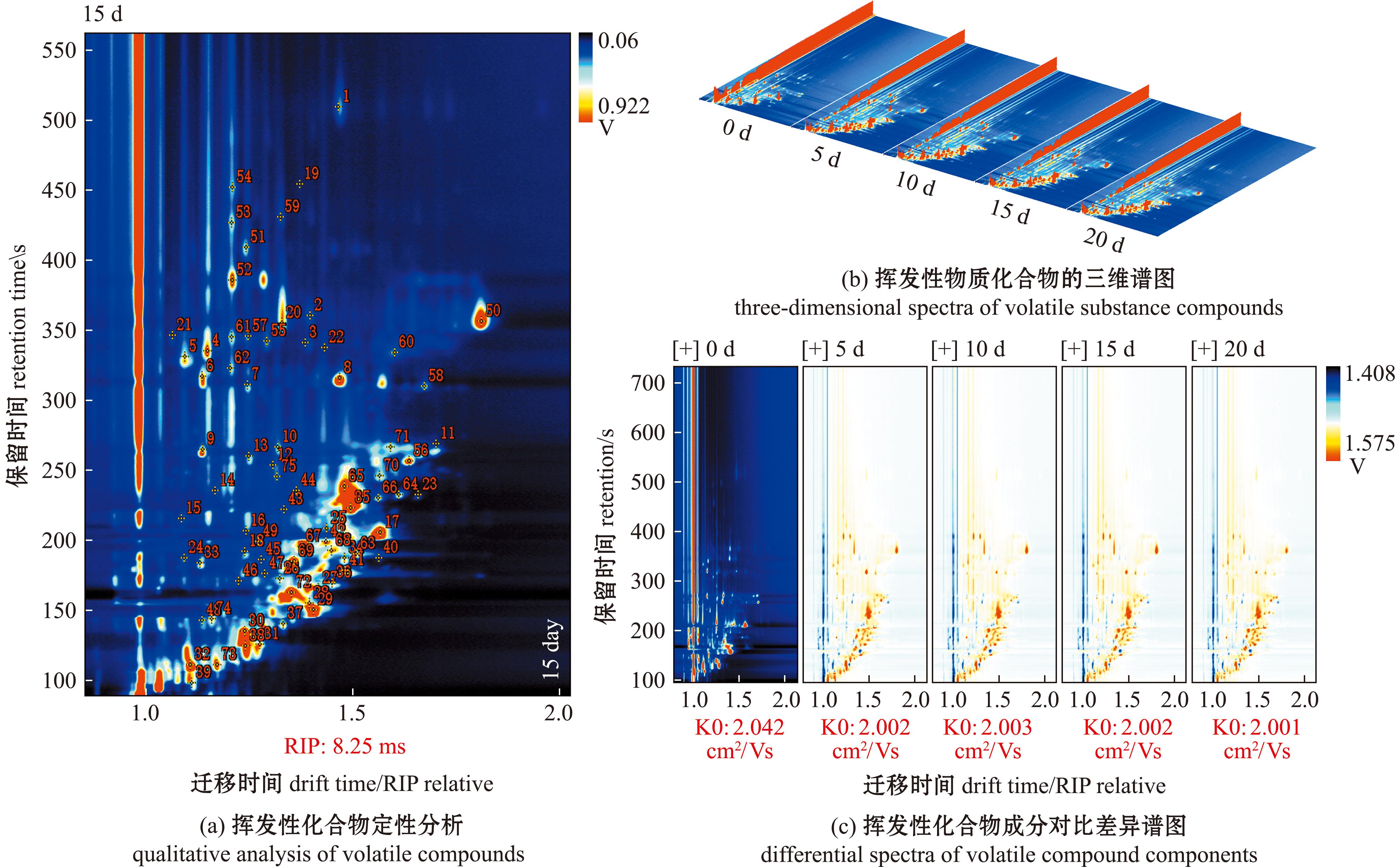
图3 挥发性化合物表征图谱
Fig.3 Characterization mapping of volatile compounds
为了直观地展示样品在各个阶段挥发性物质的变化规律和相对含量,绘制了挥发性物质的指纹谱图(图4)。从图4可见,丙酸异丙酯、己酸、戊酸甲酯、庚醛、辛醛、壬醛和1-辛烯-3-醇等挥发性化合物在20 d发酵样品中含量最为丰富。此外,发酵5~15 d样品的挥发性化合物组成较为相似,暗示挥发性化合物的生成与积累从发酵5 d开始。另外,在接菌发酵样品中,检测到了丁醛、己醛、壬醛、苯甲醛、3-甲基丁醛、2-甲基丁醛、1-辛烯-3-醇、3-甲基丁醇、2-丁酮和丙酮等挥发性成分,这与传统发酵样品的挥发性成分一致。然而,接菌发酵样品中的苯乙醛、正己醇、1-丙硫醇、3-戊酮、2-甲基丙酸、异戊烯酸、己酸,以及柠檬烯、蒎烯、γ-萜品烯等萜烯类化合物在传统发酵样品中未检测到,这表明接菌发酵后样品的风味化合物种类更加多样化。
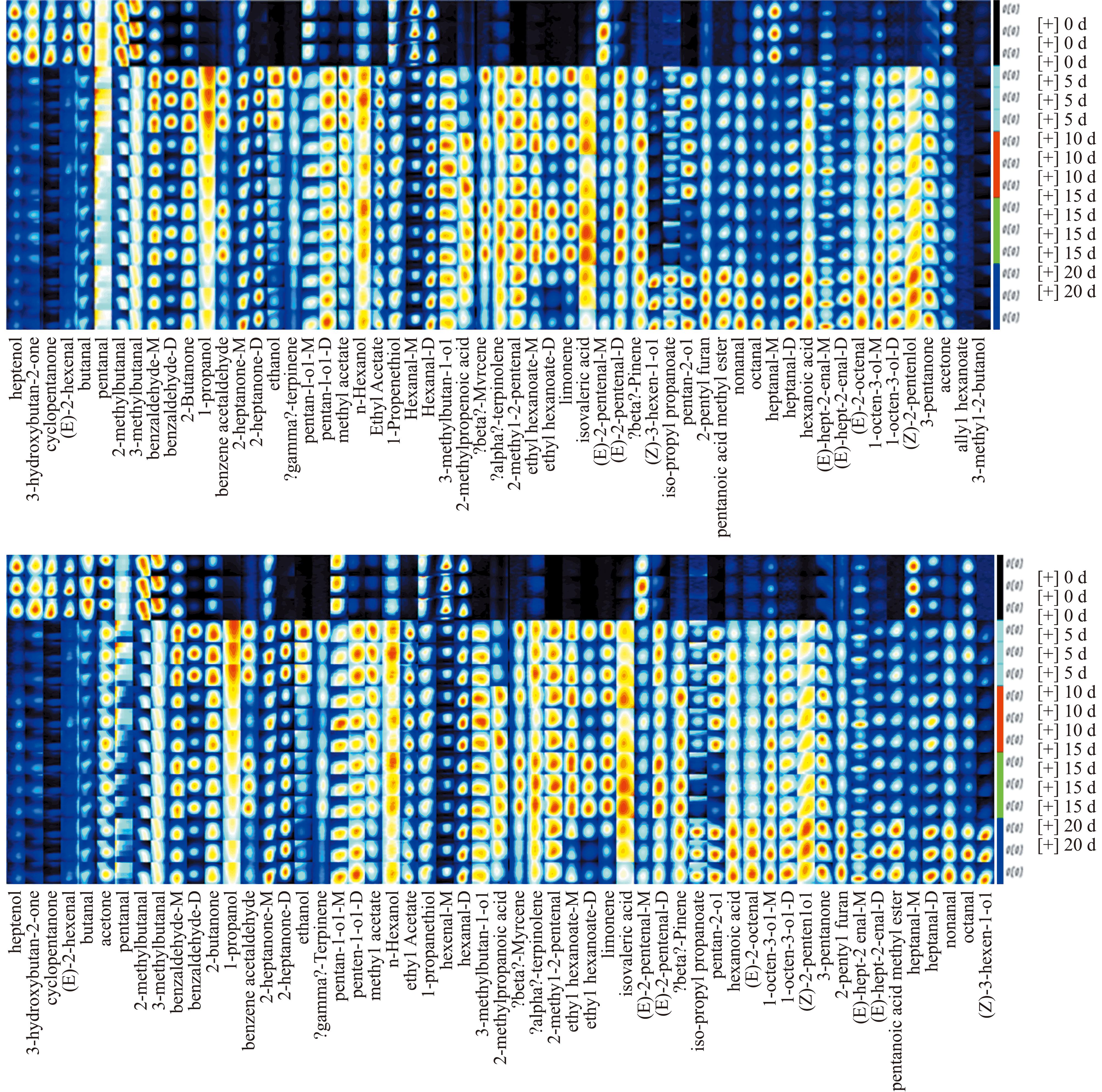
图4 接菌发酵卵形鲳鲹挥发性化合物指纹谱图
Fig.4 Fingerprint of volatile compounds of inoculated fermented Trachinotus ovatus
3 讨论
3.1 接菌发酵对蛋白质氧化程度的影响
蛋白质氧化是导致肉类在加工过程中品质下降的重要因素之一,长期接触氧化的肉类蛋白质和脂质会增加慢性疾病的风险[16]。Chen等[17]认为,一些发酵剂具有一定的自由基清除能力,在发酵过程中它们能够增强基质的供电子能力,促进Fe3+还原为Fe2+,从而抑制自由基和其他物质的氧化过程。王雍雍[18]研究认为,通过接菌在促进发酵肉制品蛋白质降解的同时,也在一定程度上降低了蛋白质的氧化程度,有利于提高产品品质。
为了解接菌发酵对卵形鲳鲹中肌原纤维蛋白氧化的影响,对肌原纤维蛋白的总巯基、羰基及Ca2+-ATPase活性进行测定,并与传统发酵组进行比较。结果表明,接种热带芽孢杆菌MX-8发酵卵形鲳鲹后,肌原纤维蛋白总巯基含量在发酵前期下降明显,而发酵后期下降速率减慢,这可能是因为发酵前期微生物间的竞争作用大,在多种蛋白酶系的作用下促使蛋白质氧化进程加快。而到了发酵后期发酵剂成为优势微生物,竞争作用减弱,蛋白质氧化速率有所减弱[18]。图1(b)显示了肌原纤维蛋白中羰基含量的变化情况,羰基化合物能够与非氧化赖氨酸的氨基反应形成亚胺键,从而形成蛋白质聚集体,降低蛋白质的消化率[17]。从图1可见,发酵前期羰基含量上升迅速,验证了蛋白质氧化速率的上升。发酵后期羰基含量低于传统发酵组,与巯基变化反应现象一致。
肌球蛋白是构成肌原纤维蛋白的主要蛋白质,其含量占45%左右。ATP酶与肌原纤维蛋白的关系十分密切,其中,Ca2+-ATPase活性主要反映了肌球蛋白构象的完整性[19]。本研究中,接菌发酵和传统发酵后肌原纤维蛋白的Ca2+-ATPase活性随着发酵时间的延长而降低,且接菌发酵组下降程度更大(图3(c))。由于蛋白酶的作用,肌球蛋白不断降解,在发酵第10天时接菌发酵组蛋白质的Ca2+-ATPase活性仅剩0.09 U/mg,几乎完全失活,说明此时肌球蛋白几乎完全降解。Liu等[20]认为,Ca2+-ATPase活性的降低与肌球蛋白球状头部中巯基的氧化与肌球蛋白的聚集有关。还有报道表明,高离子浓度或低pH可能导致肌球蛋白头部的变化,并影响蛋白分子结构的稳定性[21]。因此推断,在发酵过程中,由于蛋白质分子之间的相互作用而发生的蛋白质分子重排、巯基氧化及发酵过程形成的有机酸导致的pH降低,共同导致了Ca2+-ATPase的下降。到发酵后期时,肌球蛋白结构发生严重变化,使Ca2+-ATPase近乎失活。通过以上结果可以发现,接种发酵剂能够延缓蛋白质氧化进程,促进蛋白质降解,表明热带芽孢杆菌 MX-8可能具有一定的抗氧化活性,有利于提高产品整体的安全性与稳定性。
3.2 接菌发酵对卵形鲳鲹质构的影响
食品的质地对消费者的接受度有着决定性的影响。鱼肉质构的变化能够反映鱼体内肌肉组织与结缔组织的变化情况。由于盐的存在,水分发生流失,鱼肉的硬度不断增大。鱼肉中丰富的蛋白质能够形成网状结构的水化层,对外界具有抵抗能力,即表现为肉的弹性。内聚性则反映鱼肉组织紧密结合的程度,代表了鱼肉中内部结合键的强度[22-23]。本研究中,相较于传统发酵组,接菌发酵20 d后卵形鲳鲹的硬度、弹性、内聚性和咀嚼性均有显著提升。发酵前期硬度上升速率相比传统发酵慢,可能是由于发酵剂分泌的蛋白酶,以及肌纤维中的结构蛋白发生降解,引发鱼肉的软化[24-25]。硬度能直接反映食品口感,经接菌发酵后鱼肉硬度增加,这可能是由于在盐和微生物的作用下,鱼肉中水分、蛋白质和脂质含量及比例发生了变化[26]。咀嚼性是综合反映硬度和弹性的指标,接菌发酵后卵形鲳鲹的咀嚼性增加,说明接菌发酵可以提高产品的口感,使产品的咀嚼性更好。发酵时间也会影响微生物生长及产品质地,故选择合适的发酵时间对卵形鲳鲹发酵至关重要。杨培周等[27]研究发现,臭鳜鱼在发酵前10 d,鱼的硬度、咀嚼性和胶着性随发酵时间延长而增加,与本研究结果一致。通过以上结果推断,发酵剂可能通过分泌蛋白酶促进蛋白质的降解,从而改变了肌肉的组织特性,相较于传统发酵组,接菌发酵能够赋予卵形鲳鲹更好的口感,并提高其质构特性[28- 29]。
3.3 接菌发酵对卵形鲳鲹中挥发性化合物的影响
通过HS-GC-IMS技术,本研究中分析了接菌发酵后卵形鲳鲹样品中挥发性化合物的组成,并与前期传统发酵卵形鲳鲹风味化合物组成研究结果[11]进行了对比,以评估接菌发酵对卵形鲳鲹风味化合物变化的影响。研究发现,在接菌发酵5 d时鱼体内就已经开始产生与积累挥发性化合物。且发酵前期主要以醛酮类化合物为主,与传统发酵组类似。这可能是因为卵形鲳鲹富含较高的油脂,发酵过程中经过氧化降解后产生大量的不饱和脂肪酸,这些脂肪酸可以作为醛酮类化合物产生的前体物质[30]。在传统发酵与接菌发酵组样品中均观察到丁醛、己醛、壬醛、苯甲醛、3-甲基丁醛、2-甲基丁醛、1-辛烯-3-醇、3-甲基丁醇、2-丁酮和丙酮等挥发性成分,表明这些化合物是发酵卵形鲳鲹中常见的风味物质,决定了鱼整体的风味。此外,苯乙醛、正己醇、1-丙硫醇、3-戊酮、2-甲基丙酸、异戊烯酸、己酸,以及柠檬烯、蒎烯、γ-萜品烯等萜烯类化合物仅在接菌发酵组样品中鉴定得到,表明接菌发酵样品中风味化合物更加丰富。
醛类作为发酵肉制品中含量丰富的挥发性成分,气味阈值低,与其他物质具有较强的风味协同作用。如苯乙醛作为Strecker醛类之一,存在于许多发酵肉制品中,有助于产生蜂蜜的气味[16]。醇类化合物作为发酵鱼产品中第二大类挥发性化合物,有助于形成独特的风味。Xiao等[31]在发酵草鱼中鉴定到11种醇类,其中,正己醇能够丰富发酵鱼的果香味与甜味,硫醇化合物的存在,能够赋予产品特殊的榴莲香气。蛋白质的氧化沉淀会改变酮类引起的风味,Chen等[32]认为,蛋白质的氧化促进了酮类的产生,从而使产品的风味得到加强。酸类化合物主要在脂质的氧化水解过程中产生,由于其香气阈值较高,对于气味的贡献有限,主要作用是加强鱼肉的酸味。烯烃,尤其是萜烯类化合物,主要来自于不饱和脂肪酸的氧化分解,由不饱和烯烃自由基和氢自由基结合而成[33],柠檬烯作为萜类化合物,具有柠檬和柑橘的香味。Yu等[34]在对发酵虾酱的挥发性化合物的鉴定中发现,蒎烯、γ-萜品烯是主要的挥发性化合物之一,能够提供柑橘气味和木香。呋喃类化合物是一类含氧杂环化合物,是美拉德反应中形成的特征性挥发性化合物,主要通过脱水、分解和环化等糖类与氨基酸之间的反应生成[35]。在接菌发酵组中鉴定出的2-戊基呋喃,是一种衍生自亚油酸和其他n-6脂肪酸的非羧基化合物,具有豆香和类似蔬菜的香韵,主要起到协调发酵鱼风味的作用[36]。综上,接菌发酵卵形鲳鲹在传统发酵的基础上形成了更多的挥发性风味化合物,使发酵卵形鲳鲹的风味更加丰富。
根据以上研究结果,将热带芽孢杆菌MX-8接种于卵形鲳鲹中进行发酵,相较于传统发酵而言使蛋白质的降解程度更大,进而形成了更多的风味前体物质,促进了挥发性化合物的释放。从这个角度而言,通过接菌发酵不仅可以使发酵卵形鲳鲹的风味更加丰富,还有利于解决目前传统发酵效率低与产品不稳定等问题,具有很高的应用价值。但本研究中仅聚焦于热带芽孢杆菌对发酵卵形鲳鲹蛋白质特性及其风味的影响,缺乏对其他微生物或环境因素在蛋白质特性和风味形成中潜在的交互作用研究。因此,后续研究可结合风味组学和宏基因组学多角度进一步了解不同微生物之间复杂的相互关系对蛋白质和风味的影响机制,为深入解析热带芽孢杆菌在发酵卵形鲳鲹中的作用以及优化相关工艺提供更有力的支持,填补当前研究的不足,推动该领域的进一步发展。
4 结论
1)相较于传统发酵卵形鲳鲹,通过接种热带芽孢杆菌MX-8发酵剂进行发酵,在一定程度上抑制了蛋白质的氧化,提高了产品整体的安全性与稳定性。说明添加合适的发酵剂可能通过分泌蛋白酶促进蛋白质的降解,从而改变肌肉的组织特性,有效改善鱼肉的弹性和咀嚼性,提升鱼肉口感。
2)HS-GC-IMS分析显示,丁醛、己醛、壬醛、苯甲醛、3-甲基丁醛、2-甲基丁醛、1-辛烯-3-醇、3-甲基丁醇、2-丁酮和丙酮等挥发性成分是发酵卵形鲳鲹中常见的风味物质,决定了整体的风味。而苯乙醛、正己醇、1-丙硫醇、3-戊酮、2-甲基丙酸、异戊烯酸、己酸,以及柠檬烯、蒎烯和γ-萜品烯等萜烯类化合物只在接菌发酵鱼肉制品中检测得到。说明接菌发酵有利于提升鱼肉整体风味,使其挥发性化合物增多。
3)接菌发酵卵形鲳鲹后形成了更多的挥发性化合物,使风味更加丰富,同时也在一定程度上提高了产品的品质与稳定性。本研究结果为实现新型发酵卵形鲳鲹的工业化生产提供了有益参考。
[1] WANG H F,WU Y Y,XIANG H,et al.UHPLC-Q-Exactive Orbitrap MS/MS-based untargeted lipidomics reveals molecular mechanisms and metabolic pathways of lipid changes during golden pomfret (Trachinotus ovatus) fermentation[J].Food Chemistry,2022,396:133676.
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2023中国渔业统计年鉴 [M].北京:中国农业出版社,2023:22-23.
Fisheries and Fishery Administration,Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries.China fisheries statistic yearbook 2023[M].Beijing: China Agriculture Press,2023:22-23.(in Chinese)
[3] XIANG H,SUN-WATERHOUSE D,WATERHOUSE G I N,et al.Fermentation-enabled wellness foods:a fresh perspective[J].Food Science and Human Wellness,2019,8(3):203-243.
[4] 黄卉,陈胜军,赵永强,等.水产品预制菜加工与质量安全控制技术研究进展[J].南方水产科学,2022,18(6):152-160.
HUANG H,CHEN S J,ZHAO Y Q,et al.Research advances on processing and quality safety control technology of aquatic pre-made products[J].South China Fisheries Science,2022,18(6):152-160.(in Chinese)
[5] LU H H,HUANG C J,YU K N,et al.Effects of mixed inoculation of Leuconostoc citreum and Lactobacillus plantarum on Suansun (Sour bamboo shoot) fermentation[J].Food Bioscience,2022,47:101688.
[6] WANG Y Q,CHEN Q,LI L H,et al.Transforming the fermented fish landscape:microbiota enable novel,safe,flavorful,and healthy products for modern consumers[J].Comprehensive Reviews in Food Science and Food Safety,2023,22(5):3560-3601.
[7] 吴燕燕,王悦齐,沈颖莹,等.基于混菌发酵的鳜鱼发酵工艺优化与品质分析[J].南方水产科学,2022,18(2):105-114.
WU Y Y,WANG Y Q,SHEN Y Y,et al.Process optimization and quality analysis of Siniperca chuatsi fermentation based on mixed bacteria fermentation[J].South China Fisheries Science,2022,18(2):105-114.(in Chinese)
[8] 刘洒洒.臭鳜鱼自然及接菌发酵过程中微生物菌落演化与品质变化规律研究[D].大连:大连工业大学,2018.
LIU S S.Microbial community succession and the quality changes during spontaneous and inoculation fermentation of stinky mandarin fish(Chouguiyu)[D].Dalian:Dalian Polytechnic University,2018.(in Chinese)
[9] 尹红梅,陈浩然,尹紫冉,等.传统发酵和接种发酵霉鱼的品质比较分析[J].食品工业科技,2024,45(15):56-65.
YIN H M,CHEN H R,YIN Z R,et al.Comparison of volatile flavor compounds and qualities between traditional fermented mouldy fish and inoculated fermented mouldy fish[J].Science and Technology of Food Industry,2024,45(15):56-65.(in Chinese)
[10] 周长艳,黄泽元,田国军.乳杆菌在腌制腊鱼制品中的应用[J].食品科学,2012,33(1):215-218.
ZHOU C Y,HUANG Z Y,TIAN G J.Application of lactobacilli in cured fish[J].Food Science,2012,33(1):215-218.(in Chinese)
[11] QIU Y J,WU Y Y,LI L H,et al.Elucidating the mechanism underlying volatile and non-volatile compound development related to microbial amino acid metabolism during golden pomfret (Trachinotus ovatus) fermentation[J].Food Research International,2022,162:112095.
[12] WANG H F,QIU Y J,CHEN S J,et al.Whole-genome sequencing of a protease-producing strain isolated from fermented golden pompano and molecular docking of the protease to fish proteins[J].Food Bioscience,2024,57:103598.
[13] LI P Y,MEI J,XIE J.Chitosan-sodium alginate bioactive coatings containing ε-polylysine combined with high CO2 modified atmosphere packaging inhibit myofibril oxidation and degradation of farmed pufferfish (Takifugu obscurus) during cold storage[J].LWT,2021,140:110652.
[14] 王鑫,李梦哲,张伟,等.4个家系斑点叉尾鮰鱼肉形成热诱导鱼糜凝胶性能的评价[J].南方水产科学,2023,19(3):164-172.
WANG X,LI M Z,ZHANG W,et al.Evaluation of gel properties of heat-induced surimi of Ictalurus punctatus from four genealogies[J].South China Fisheries Science,2023,19(3):164-172.(in Chinese)
[15] 于美娟,杨慧,余长生,等.两种养殖模式金背鲤肠道微生物菌群和主体风味差异分析[J].南方水产科学,2023,19(3):151-163.
YU M J,YANG H,YU C S,et al.Analysis on differences of microbial community structure and main flavor substances of Cyprinus carpio var. jinbei cultured in paddy fields and ponds[J].South China Fisheries Science,2023,19(3):151-163.(in Chinese)
[16] 赵阳美瑾,林徐,李雨羲,等.水产品脂质与蛋白质氧化的相互作用及对其品质影响的研究进展[J].大连海洋大学学报,2024,39(2):360-368.
ZHAO Y M J,LIN X,LI Y X,et al.Research progress on interaction of aquatic protein and lipid oxidation and its effect on its quality: a review[J].Journal of Dalian Ocean University,2024,39(2):360-368.(in Chinese)
[17] CHEN W D,XIE C Y,HE Q Q,et al.Improvement in color expression and antioxidant activity of strawberry juice fermented with lactic acid bacteria:a phenolic-based research[J].Food Chemistry:X,2023,17:100535.
[18] 王雍雍.功能菌株发酵剂的制备及其对香肠品质的影响研究[D].扬州:扬州大学,2023.
WANG Y Y.Preparation of functional strain starter and its effect on sausage quality[D].Yangzhou:Yangzhou University,2023.(in Chinese)
[19] VATE N K,BENJAKUL S.Combined effect of squid ink tyrosinase and tannic acid on heat induced aggregation of natural actomyosin from sardine[J].Food Hydrocolloids,2016,56:62-70.
[20] LIU Q,CHEN Q,KONG B H,et al.The influence of superchilling and cryoprotectants on protein oxidation and structural changes in the myofibrillar proteins of common carp (Cyprinus carpio) surimi[J].LWT-Food Science and Technology,2014,57(2):603-611.
[21] LI Y P,ZHANG X H,LU F,et al.Effect of sodium bicarbonate and sodium chloride on aggregation and conformation of pork myofibrillar protein[J].Food Chemistry,2021,350:129233.
[22] 聂诗,吴燕燕,赵永强,等.海鲈混菌发酵工艺优化及其品质分析[J].大连海洋大学学报,2023,38(5):885-892.
NIE S,WU Y Y,ZHAO Y Q,et al.Optimization and quality analysis of mixed bacterial fermentation in sea bass[J].Journal of Dalian Ocean University,2023,38(5):885-892.(in Chinese)
[23] 徐鸣,万金庆,侯博玉,等.风味蛋白酶对冰温腌制鳜鱼肉品质的影响[J].大连海洋大学学报,2022,37(3):513-523.
XU M,WAN J Q,HOU B Y,et al.Effects of flavor protease on quality of marinated mandarin fish at ice temperature[J].Journal of Dalian Ocean University,2022,37(3):513-523.(in Chinese)
[24] 吴燕燕,陈茜,王悦齐,等.传统发酵水产品微生物群落与品质相关性的研究进展[J].水产学报,2021,45(7):1248-1258.
WU Y Y,CHEN Q,WANG Y Q,et al.Advances in research on the correlation between microbial community and quality of traditional fermented aquatic products[J].Journal of Fisheries of China,2021,45(7):1248-1258.(in Chinese)
[25] 韦诚,段珍珍,常荣,等.酸肉发酵过程中蛋白质的变化及对消化特性的影响[J].食品与发酵工业,2018,44(11):97-104.
WEI C,DUAN Z Z,CHANG R,et al.Changes of protein in sour meat during fermentation and its effects on digestive characteristics[J].Food and Fermentation Industries,2018,44(11):97-104.(in Chinese)
[26] 郝红涛,赵改名,柳艳霞,等.肉类制品的质构特性及其研究进展[J].食品与机械,2009,25(3):125-128.
HAO H T,ZHAO G M,LIU Y X,et al.The texture characteristics and advances of meat products[J].Food &Machinery,2009,25(3):125-128.(in Chinese)
[27] 杨培周,钱静,姜绍通,等.臭鳜鱼的质构特性、特征气味及发酵微生物的分离鉴定[J].现代食品科技,2014,30(4):55-62.
YANG P Z,QIAN J,JIANG S T,et al.Texture properties,characteristic smell,microbial isolation and identification of smelly and arinfish[J].Modern Food Science and Technology,2014,30(4):55-62.(in Chinese)
[28] 冯美琴,余頔,孙健.发酵剂对发酵香肠蛋白质降解及多肽抗氧化能力的影响[J].食品科学,2020,41(20):97-104.
FENG M Q,YU D,SUN J.Effect of starter cultures on protein degradation and antioxidant capacity of peptides from fermented sausages[J].Food Science,2020,41(20):97-104.(in Chinese)
[29] 李松林,钱心睿,张艺彤,等.发酵过程中乌鳢鱼糜的品质特征变化[J].食品科学,2024,45(2):203-210.
LI S L,QIAN X R,ZHANG Y T,et al.Changes in quality characteristics of snakehead surimi during fermentation[J].Food Science,2024,45(2):203-210.(in Chinese)
[30] 蔡嘉铭,王际辉,陶冶,等.霉菌发酵剂对干发酵香肠的理化指标、氧化程度及风味的影响[J].食品与发酵工业,2020,46(5):17-22.
CAI J M,WANG J H,TAO Y,et al.The effects of mould starter on the physicochemical parameters,oxidation degree and flavor of dry-cured sausage[J].Food and Fermentation Industries,2020,46(5):17-22.(in Chinese)
[31] XIAO N Y,XU H Y,HU Y,et al.Unraveling the microbial succession during the natural fermentation of grass carp and their correlation with volatile flavor formation[J].Food Research International,2023,165:112556.
[32] CHEN Y P,CAI D D,LI W Q,et al.Application of gas chromatography-ion mobility spectrometry (GC-IMS) and ultrafast gas chromatography electronic-nose (uf-GC E-nose) to distinguish four Chinese freshwater fishes at both raw and cooked status[J].Journal of Food Biochemistry,2022,46(6):e13840.
[33] YU J,ZHANG Y R,WANG Q J,et al.Capsaicinoids and volatile flavor compounds profile of Sichuan hotpot as affected by cultivar of chili peppers during processing[J].Food Research International,2023,165:112476.
[34] YU J,LU K,ZI J W,et al.Halophilic bacteria as starter cultures:a new strategy to accelerate fermentation and enhance flavor of shrimp paste[J].Food Chemistry,2022,393:133393.
[35] SHEN M Y,LIU L C,ZHANG F,et al.Effects of processing parameters on furan formation in canned strawberry jam[J].Food Chemistry,2021,358:129819.
[36] 滕迪克,许洪高,袁芳,等.脂质降解产物在肉类香气形成中的作用[J].中国调味品,2008,33(6):71-76,83.
TENG D K,XU H G,YUAN F,et al.The contribution of lipids degradation products to meat aroma[J].China Condiment,2008,33(6):71-76,83.(in Chinese)