黄颡鱼(Pelteobagrus fulvidraco)为鲇形目鲿科黄颡鱼属,在中国除西部高原以外的各大水系均有分布,因其肉质鲜美细嫩,营养丰富,无肌间刺,广受消费者欢迎,其人工养殖产量连年增加[1]。目前在中国被广泛养殖的杂交黄颡鱼“黄优1号”是以黄颡鱼为母本,瓦氏黄颡鱼(P.vachell)为父本杂交得到,于2018年经全国水产原种和良种审定委员会审定为新品种(品种号GS-02-001-2018)[2]。“黄优1号”个头大、生长快、耐运输,且有较强的抗病能力,近年来已成为广受欢迎的水产养殖品种之一[3]。
光泽黄颡鱼(P.nitidus)主要分布于中国长江上游的干流和一些支流,以及长江中下游的湖泊中,其肉质细嫩、肌间刺少、营养价值高,具有广阔的市场前景,然而由于其鳍棘有毒,人易被刺伤,光泽黄颡鱼在中国的养殖规模还非常有限[4]。目前关于光泽黄颡鱼的研究多见于野生资源保护、生态评估等,关于光泽黄颡鱼疾病方面的研究尚不多见[5-6]。
黄颡鱼易暴发红头病(头顶溃疡症)、腹水症(腹水病)、体表溃疡病(烂身病)等细菌性疾病[7]。春季水温16~20 ℃时易暴发黄颡鱼烂身病,死亡率达80%以上,对养殖户造成巨大的经济损失[8]。“黄优1号”也曾被报道出现体表溃烂、肌肉红肿溃烂脱落、烂鳃及胸鳍臀鳍充血等烂身病症状,发病情况与普通黄颡鱼无明显差异[9]。嗜水气单胞菌和温和气单胞菌等可导致黄颡鱼发生烂身病,其中由嗜水气单胞菌引起的黄颡鱼烂身病症状为体表发红,下颌、胸鳍基部充血,腹水、肠道发炎、肝脏和胆囊肿大等症状;由温和气单胞菌引起的烂身病症状为鱼体中后部出现浅色斑块,胸鳍和背鳍基部发红、溃烂,尾鳍腐烂,下颌和腹部发红,口周和鳃盖边缘溃烂等[10-11]。2021年5月,四川农业大学生命科学学院动物学实验室从四川省内江市凌家镇某水产养殖场购入一批“黄优1号”黄颡鱼,在实验室内暂养过程中暴发大规模感染性疾病,症状为皮肤溃烂、腹水、胸鳍基部充血,严重者可致死;使用该菌感染光泽黄颡鱼后,也出现了类似症状。该症状与文献报道中的黄颡鱼烂身病症状高度相似,但又与嗜水气单胞和维氏气单胞菌病等引发的烂身病症状均有所不同[12-14]。
为探究该杂交黄颡鱼烂身病的病原,本研究以此次患病濒死的黄颡鱼为样本,从其皮肤组织中分离出优势菌株,经人工回归感染试验证实其具有致病能力,同时分析了获得菌株的致病性及药敏特征,以期为研究黄颡鱼烂身病的致病机制及其科学防控提供参考。
1 材料与方法
1.1 材料
杂交黄颡鱼“黄优1号”于2021年5月购于四川省内江市凌家镇某水产养殖场(体长为11.5~12.3 cm,体质量为50.6~58.3 g),随后养殖于四川省雅安市雨城区动物学系实验室内,2021年6月开始暴发烂身病,其中用于病原分离的样品为出现患病症状的“黄优1号”个体,回归攻毒感染试验为2021年8月购自于内江市同一水产养殖场的健康的“黄优1号”(体长为10.6~11.8 cm,体质量为45.3~55.2 g)和2021年9月购于内江市同一水产养殖场的光泽黄颡鱼(体长为8.7~10.6 cm,体质量为31.9~41.7 g)。
试剂:牛肉膏蛋白胨培养基(广东中山百微生物技术有限公司),LB液体培养基(定州百科赛斯生物科技有限公司),生理生化鉴定管(青岛海博生物技术有限公司),2×Pfu Master Mix聚合酶(北京宝日医生物技术有限公司),药敏纸片(杭州微生物有限公司),引物合成和PCR扩增产物的测序均委托北京阅微生物科技有限公司完成。
1.2 方法
1.2.1 病原菌的分离纯化 取症状明显、病情较严重的杂交黄颡鱼,在无菌条件下对其体表进行消毒后刮取皮肤表面样品,稀释后接种于牛肉膏蛋白胨培养基,25 ℃下培养48 h,挑取形态一致的优势单菌落接种于LB液体培养基,并使用牛肉膏蛋白胨培养基进行单菌落纯化,随后进行革兰氏染色并观察。
1.2.2 人工回归感染试验 采用1 mL 0.85%生理盐水重悬菌株后,在600 nm下测定菌液的吸光度,按照1 OD=1.0×109 CFU/mL计算原始菌液浓度。将菌液稀释为1×108、5×108、2.5×109、1.25×1010 CFU/mL 4个组,分别按照10尾/组将其按200 μL/g体质量的剂量对健康杂交黄颡鱼和光泽黄颡鱼进行腹腔注射,同时设置无菌生理盐水注射对照组。持续观察15 d,每天记录并观察黄颡鱼的死亡情况,使用SPSS软件基于Karber法计算病原菌对杂交黄颡鱼和光泽黄颡鱼的半数致死剂量(LD50)[15]。
1.2.3 病原菌的生理生化鉴定及16S rRNA鉴定 参考《常见细菌系统鉴定手册》,使用细菌微量鉴定管对菌株进行生理生化鉴定。采用16S rRNA的通用引物F:5′ AGAGTTTGATCCTGGCTCAG 3′和R:5′ GGTTACCTTGTTACGACTT 3′对分离纯化后的菌株进行PCR扩增[16-17]。反应采用25 μL体系,包括2×Pfu Mastermix12.5 μL、菌液1 μL和16S rRNA的上下游引物各0.5 μL,余量为ddH2O。PCR扩增条件为94 ℃下预变性5 min,94 ℃下变性30 s,54 ℃下退火30 s,72 ℃下延伸90 s,共进行30个循环,最后在72 ℃下再延伸7 min。扩增完毕后,采用15 g/L琼脂糖凝胶进行电泳,并送至公司测序。采用NCBI的Nucleotide Blast对测序结果进行检索及同源性分析,采用MEGA5.0软件构建菌株系统发育邻接树。
1.2.4 毒力基因检测 根据发表文献[18-21]及NCBI中的荧光假单胞菌(Pseudomonas fluorescens)的毒力相关基因的核苷酸序列合成荧光假单胞菌的ATP依赖性Clp蛋白酶水解亚基基因(clpP)、铁吸收调节蛋白基因(fur)、溶血素基因(hly)、胞外金属蛋白酶基因(aprX)、血红素加氧酶基因(hem O)、丝状血凝素基因(fha)、丝氨酸蛋白酶基因(pspb)和Ton B依赖型外膜受体(tfeR)等8个毒力基因的引物(表1)。采用与上述相同的25 μL体系进行PCR扩增,PCR反应条件为94 ℃下预变性5 min,94 ℃下变性30 s,54 ℃下退火30 s,72 ℃下延伸60 s,共进行35个循环,最后在72 ℃下再延伸10 min。使用15 g/L琼脂糖凝胶电泳对PCR产物进行验证。
表1 毒力基因引物信息
Tab.1 Primer information of virulence genes

目的基因 target gene 引物序列 primer sequence(5′-3′)退火温度 annealing temperature/℃片段大小 fragment length/bpclpPF:TTGGTGCAAATGTTTCR:TCACTTTCCAGCCTACT52615furF:ATGGTTGAAAATAGCGAACTR:CTTTTTCTTACGGATGTACA50408hlyF:AAACATATGTATCACGGAGAACGATTCR:AAACTCGAGTCAGAGCACGTAGCGCATG55624aprXF:AAATCGATAGCTTCAGCCATR:TTGAGGTTGATCTTCTGGTT55607hem0F:TCGACAGCACGACCTTCCAR:TGATGCGTTTGTGCGCTTC53554fhaF:TGTGGTGTTGAACAACGCCT R:TATCGGCCGCCTGGCCGAA65500psp bF:GCATCTGAACAGCGAGTCCTTR:GCCCCAGCCGTACAGCGAGT601 426tfeRF:TCTCAATTCAGGCTCAGCCAR:CGATGTAGTCACCGACGCGAA541 631
1.2.5 抗菌药物敏感性试验 纯化后的菌株培养24 h后采用无菌生理盐水制成 108 CFU/mL 的菌悬液,取 0.1 mL 涂布到牛肉膏蛋白胨平板上,并将药敏纸片贴于该培养基上,每组设置3次重复,在25 ℃下恒温培养 16 h 后测量抑菌圈直径,根据抑菌圈的大小判断该菌的药物敏感性。
2 结果与分析
2.1 杂交黄颡鱼烂身病症状
发病初期,鱼体腹部明显肿胀,鱼体表面局部存在明显红肿发炎,鱼体两侧和胸鳍、背鳍底部最明显。胸鳍和背鳍底部及下颌充血,肛门外翻并存在红肿,体侧胸鳍基部后方1~3 cm处两侧首先出现圆形斑块,皮肤逐渐溃烂,肌肉坏死,集中在胸鳍基部及往后位置形成大小不等、深浅不一的溃疡,严重时露出红色肌肉,溃烂,继而穿孔,体表黏液增多。典型症状为体侧两边穿孔,溃疡边缘整齐,与周围正常组织界线清晰(图1)。

图1 杂交黄颡鱼烂身病的早期临床表现
Fig.1 Early clinical symptoms of rotten disease in the hybrid yellow catfish
2.2 杂交黄颡鱼烂身病病原菌的分离纯化
从患病杂交黄颡鱼体表皮肤上经过两次分离纯化共获得3株优势菌(图2A~C),分别编号为BC1、BC2、BC3,在牛肉膏蛋白胨培养基上观察到3株菌菌落形态基本一致,菌落直径为1 mm左右,呈圆形,表面光滑湿润,边缘清晰整齐,中央微隆起,呈淡黄色或灰白色、半透明。革兰氏染色结果(图2D)证明其均为革兰氏阴性菌,显微观察发现菌株均呈短杆状。
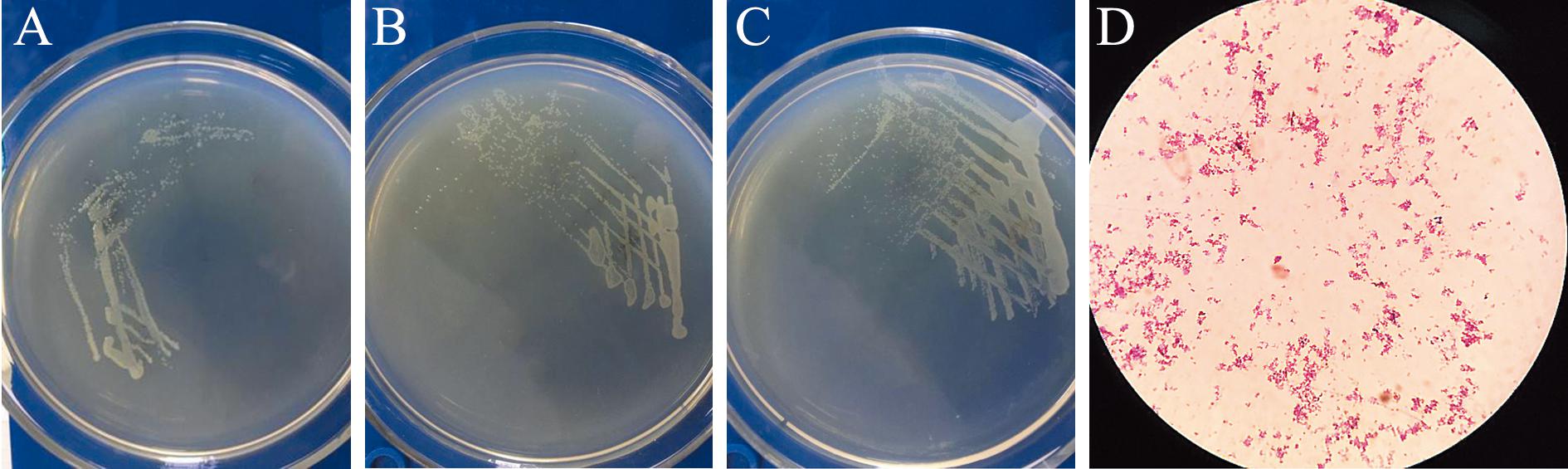
A—菌株BC1;B—菌株BC2;C—菌株BC3;D—革兰氏染色图。
A—strains of BC1;B—strains of BC2;C—strains of BC3;D—Gram staining patterns.
图2 菌株BC1、BC2、BC3及其革兰氏染色图
Fig.2 Strains and Gram staining patterns of BC1,BC2,and BC3
2.3 人工回归感染试验
在水族箱中进行人工回归感染试验后,结果显示,杂交黄颡鱼和光泽黄颡鱼均出现了与自然发病鱼相同的症状:首先出现食欲减退并离群独游,体侧胸鳍后部出现黄色斑块(图3A),继续发展为体表溃烂,露出红色肌肉(图3B);部分病鱼腹部肿大(图3C),胸鳍、背鳍及下颌部充血(图3D),吻端轻度溃烂(图3E);病情严重的鱼腹部朝上漂浮于水面,或阵发性疯狂游动,并在发病2~3 min后死亡。随后,再次从人工感染的发病杂交黄颡鱼和光泽黄颡鱼中进行优势菌分离,并使用二次分离得到的菌株感染健康黄颡鱼,鱼体出现的烂身病症状与自然发病症状完全相同,菌株形态特征与BC1~BC3一致。分别将从回归感染后发病的杂交黄颡鱼和光泽黄颡鱼中获得的菌株命名为PBC和NBC。
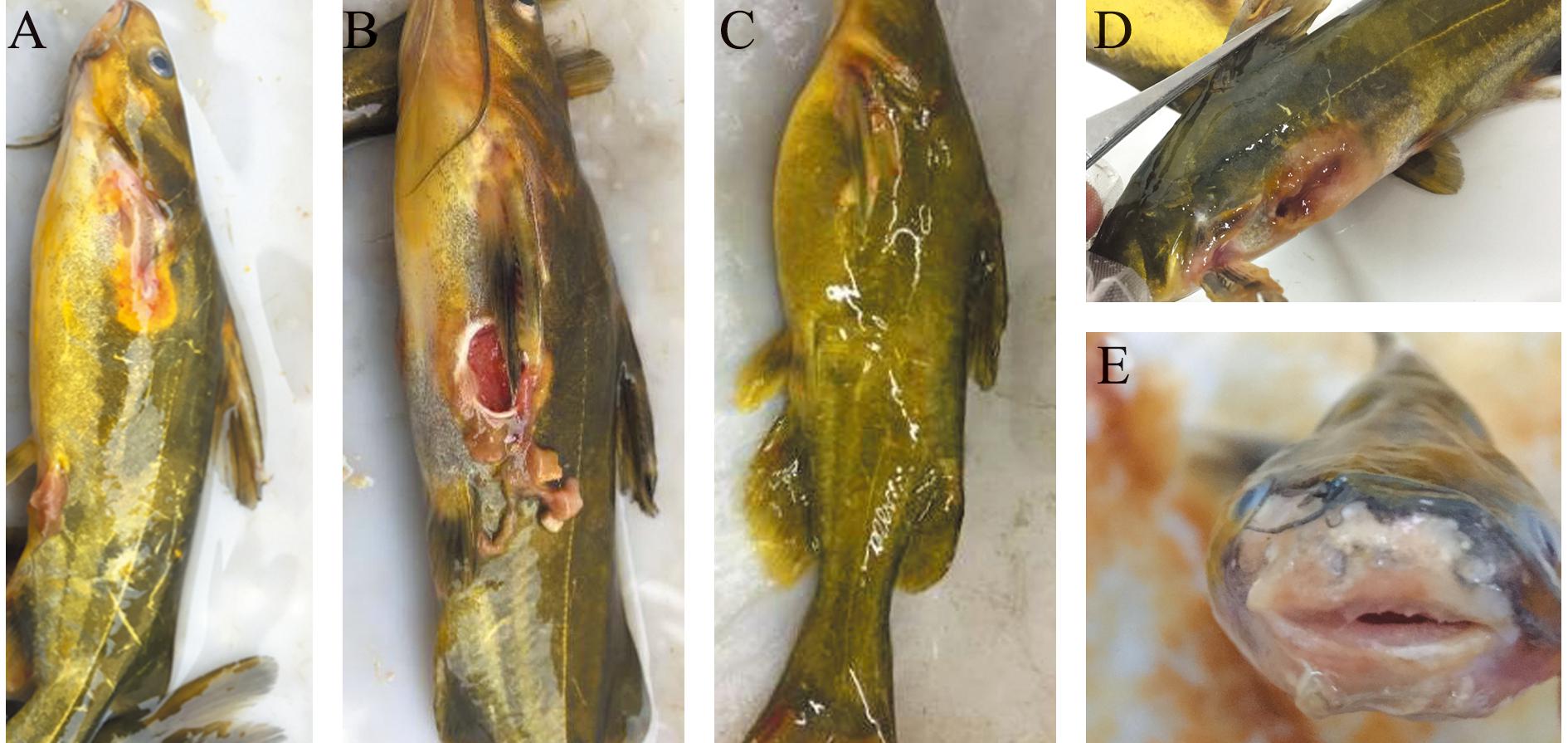
A—C—均为杂交黄颡鱼;D、E—均为光泽黄颡鱼。
A—C—hybrid yellow catfish;D,E—Pelteobagrus nitidus.
图3 人工回归感染试验后杂交黄颡鱼和光泽黄颡鱼临床表现
Fig.3 Clinical symptoms of hybrid yellow catfish and Pelteobagrus nitidus exposed to artificial regression infection
2.4 病原菌对杂交黄颡鱼和光泽黄颡鱼的致病性
使用分离出的病原菌PBC分别以1×108、5×108、2.5×109、1.25×1010 CFU/mL注射杂交黄颡鱼后,15 d的死亡率分别为30%、70%、100%、100%,其中2.5×109 CFU/mL组在第12天时即全部死亡,1.25×1010 CFU/mL组在第9天时全部死亡。使用不同浓度的NBC菌株注射光泽黄颡鱼后,15 d的死亡率分别为10%、60%、90%、100%,其中1.25×1010 CFU/mL组在第14天时全部死亡(表2)。计算病原菌株PBC的LD50为2.11×108 CFU/mL,95%置信区间为(0.68~4.44)×108 CFU/mL;病原菌株NBC的LD50为4.27×108 CFU/mL,95%置信区间为(1.83~8.87)×108 CFU/mL。
表2 病原菌注射后杂交黄颡鱼和光泽黄颡鱼的死亡情况
Tab.2 Death status of hybridy yellow catfish and P.nitidus injected with pathogenic bacterium
组别group病原菌浓度/(CFU·mL-1)pathogen concentration数量/尾quantity注射剂量/μLinjection dose死亡数/尾death number死亡率/%death rate010200001×10810200330杂交黄颡鱼(PBC)5×108102007702.5×10910200101001.25×10101020010100010200001×10810200110光泽黄颡鱼(NBC)5×108102006602.5×109102009901.25×10101020010100
2.5 生理生化鉴定分析
通过细菌微量鉴定管对菌株PBC和NBC进行鉴定,结果显示,两菌株的甲基红反应均为阴性,能够液化明胶。两株菌株均不可以利用丙二酸盐、麦芽糖、D-阿拉伯糖醇、甘露醇、葡萄糖、V-P反应、鸟氨酸、D-甘露醇、甲基红反应、D-山梨醇、甘油和淀粉;可以利用苯丙氨酸、阿拉伯糖、海藻糖、半乳糖和乳糖,均为非发酵型严格的需氧菌。NBC在海藻糖的利用上呈现弱性反应,这虽与PBC略不同,但均符合假单胞菌属的生理生化特性(表3)。
表3 PBC和NBC菌株的生理生化特征
Tab.3 Biochemical and physiological characteristics of PBC strain and NBC strain

检测项目 detected itemPBCNBC检测项目 detected itemPBCNBC明胶生化管 Gelation medium++V-P反应 Voges-Prokauer test--苯丙氨酸转氨酶 Phenylalanine deaminase++鸟氨酸脱羧酶 Ornithine decarboxylase--阿拉伯糖 Arabinose++D-甘露醇 D-mannitol--丙二酸盐 Malonate——甲基红反应 Methyl red test——麦芽糖 Maltose——D-山梨醇 D-sorbitol——海藻糖 Trehalose+W半乳糖 Galactose++D-阿拉伯糖醇 D-arabinitol——甘油 Glycerinum——甘露醇 Mannitol——乳糖 Lactose++葡萄糖 Glucose——淀粉 Starch——
注:+表示阳性;—表示阴性;W为弱性反应。
Note:+means positive;—means negative;W means weak reaction.
2.6 16S rRNA的序列分析及构建系统发育树
菌株PBC和NBC的16S rRNA基因PCR扩增均获得了1 450 bp左右的核苷酸序列,BLAST分析显示其与假单胞菌属(Pseudomonas)的16S rRNA序列高度相似,尤其与荧光假单胞菌(Pseudomonas fluorescens)的一致性达99.86%,与伞菌假单胞菌(Pseudomonas agaric)的一致性达99.10%(图4)。

深色部分为差异碱基。
The differential bases are marked with dark color.
图4 菌株PBC和NBC与荧光假单胞菌和伞菌假单胞菌的序列比对图
Fig.4 Sequence alignment of strains PBC,and NBC,Pseudomonas fluorescens and Pseudomonas agaric
PBC和NBC的序列一致达到99.94%,显示其应为同一个物种。从NCBI下载荧光假单胞菌(P.fluorescens)、伞菌假单胞菌(P.agaric)、萨拉曼卡假单胞菌(P.helmanticensis)、贝提卡假单胞菌(P.baetica)、阴城假单胞菌(P.umsong)、温哥华假单胞菌(P.vancouverensis)和基尔假单胞菌(P.kilonensis)等假单胞菌属7个物种的16S rRNA序列,构建的系统发育树显示,PBC和NBC的16S rRNA序列聚为一支后,又与荧光假单胞菌(P.fluorescens)聚为一支,确定PBC和NBC为同一菌种,均为荧光假单胞菌(图5)。

▲表示本研究中的菌株。
▲ indicates the bacterial strain in present experiment.
图5 基于16S rRNA序列构建的分离菌株及亲缘菌株系统发育树
Fig.5 Phylogenetic tree of isolated strains and related strains construced based on 16S rRNA sequence
2.7 毒力基因检测
对荧光假单胞菌8个毒力基因的PCR扩增产物的琼脂糖凝胶电泳图(图6)显示,PBC和NBC的毒力基因PCR扩增结果高度一致,所扩增的片段大小与相应毒力基因片段大小相同,表明其为同一菌株,且毒力基因型为clpP-、fur+、hly+、aprX-、hem0+、fha+、pspb+、tfeR+。
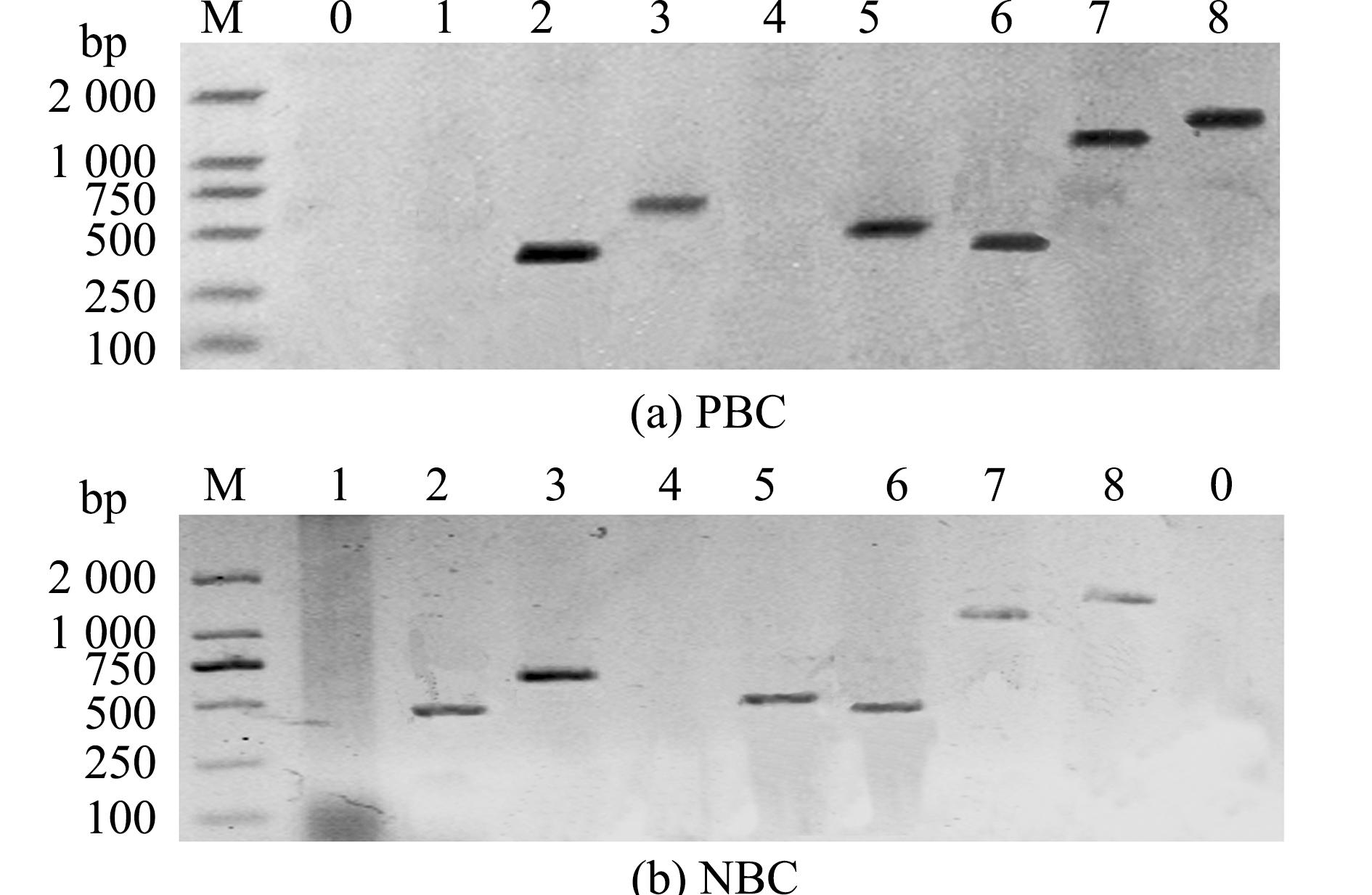
M—DL2000 DNA Marker;0—空白对照;1~8—clpP、fur、hly、aprX、hem0、fha、pspb和tfeR。
M—DL2000 DNA marker;0—control;1-8—represent clpP,fur,hly,aprX,hem0,fha,pspb,and tfeR,respectively.
图6 PBC和NBC的毒力基因扩增结果
Fig.6 Amplification results of virulence genes of PBC and NBC
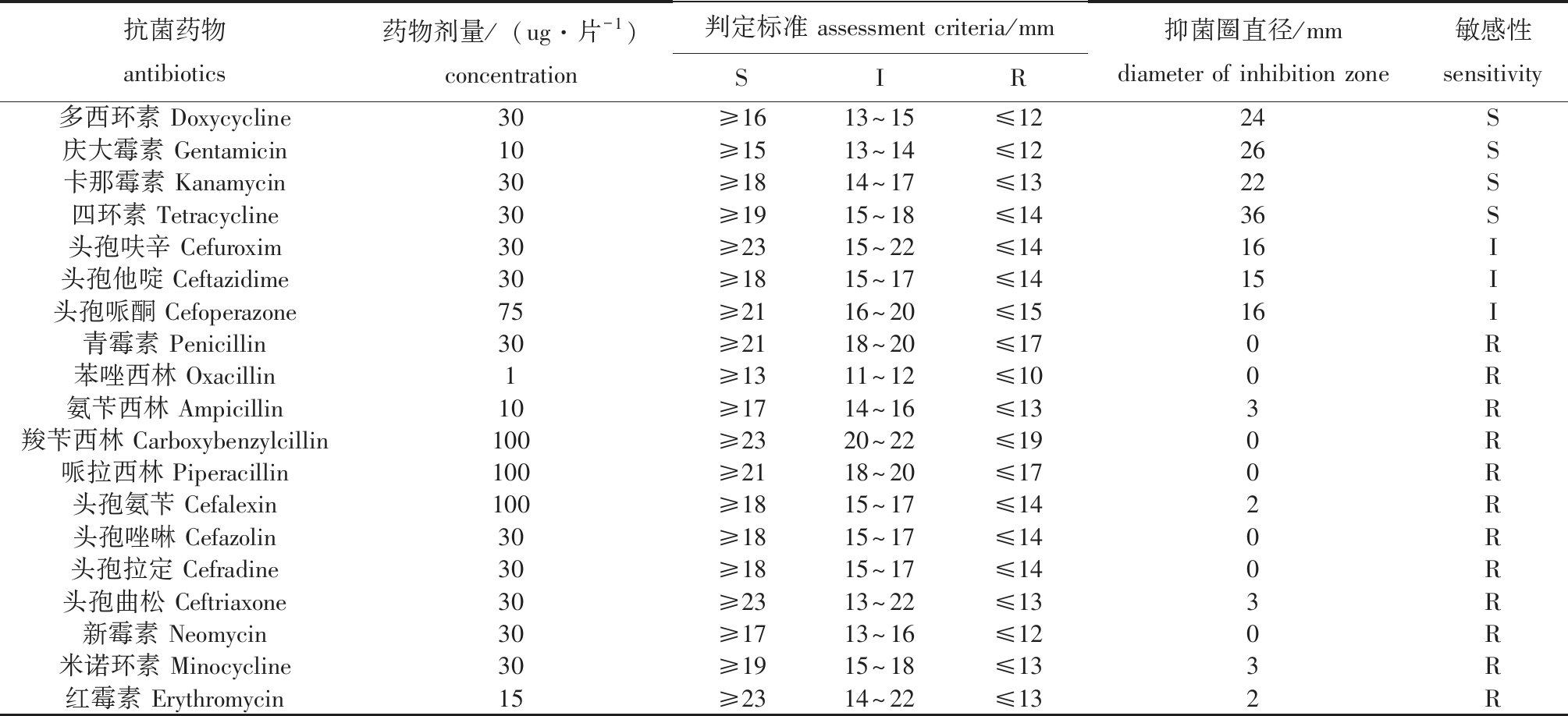
2.8 病原菌株对不同药物的敏感性
PBC和NBC的药物敏感特性高度一致,表现为对19种常见抗菌药物中的多西环素、庆大霉素、卡那霉素和四环素等4种抗菌药物高度敏感;对头孢呋辛、头孢他啶和头孢哌酮等3种抗菌药物中度敏感;而对青霉素、苯唑西林、氨苄西林和红霉素等 12种抗菌药物具有耐药性(表4)。
表4 分离菌株对药物的敏感性
Tab.4 Sensitivities of the isolated strain to antibiotics
抗菌药物antibiotics药物剂量/(ug·片-1)concentration判定标准 assessment criteria/mmSIR抑菌圈直径/mmdiameter of inhibition zone敏感性sensitivity多西环素 Doxycycline30≥1613~15≤1224S庆大霉素 Gentamicin10≥1513~14≤1226S卡那霉素 Kanamycin30≥1814~17≤1322S四环素 Tetracycline30≥1915~18≤1436S头孢呋辛 Cefuroxim30≥2315~22≤1416I头孢他啶 Ceftazidime30≥1815~17≤1415I头孢哌酮 Cefoperazone75≥2116~20≤1516I青霉素 Penicillin30≥2118~20≤170R苯唑西林 Oxacillin1≥1311~12≤100R氨苄西林 Ampicillin10≥1714~16≤133R羧苄西林 Carboxybenzylcillin100≥2320~22≤190R哌拉西林 Piperacillin100≥2118~20≤170R头孢氨苄 Cefalexin100≥1815~17≤142R头孢唑啉 Cefazolin30≥1815~17≤140R头孢拉定 Cefradine30≥1815~17≤140R头孢曲松 Ceftriaxone30≥2313~22≤133R新霉素 Neomycin30≥1713~16≤120R米诺环素 Minocycline30≥1915~18≤133R红霉素 Erythromycin15≥2314~22≤132R
注:S—敏感;I—中度敏感;R—耐药。 Note:S—sensitivity;I—moderate sensitivity;R—resistance.
3 讨论
3.1 荧光假单胞菌在鱼类中的致病作用
荧光假单胞菌属于假单胞菌科假单胞菌属,是一种革兰氏阴性菌,广泛分布于土壤、水、食物和空气中,为常见的环境污染菌,可引起蛋白质类食物的腐败和动物的感染性疾病[22-23]。在水生动物中,荧光假单胞菌属于致死率较高的条件致病菌,其全年均可感染动物发病,尤其动物在养殖或捕捞运输过程中体表发生损伤时,更易感染荧光假单胞菌。荧光假单胞菌可引起鲤(Cyprinus carpio)、草鱼(Ctenopharyngodon idellus)和青鱼(Mylopharyngodon piceus)等发生赤皮病,鳜(Siniperca chuatsi)和半滑舌鳎(Cynoglossus semilaevis)等发生细菌性败血症[19,24-25]。近年来,随着荧光假单胞菌感染引起的水产动物疾病发病率逐年增高,该菌相关致病性研究越来越完善。何文涛等[26]发现,荧光假单胞菌感染虹鳟(Oncorhynchus mykiss)后病鱼体表鳞片脱落,皮肤出血发炎,鱼体两侧发生溃疡。王晓磊等[27]发现,草鱼感染荧光假单胞菌后,病鱼体表鳞片脱落且皮肤溃烂、臀鳍基部充血。徐悦玉等[28]从患烂身病的棘胸蛙(Quasipaa spinosa)中分离获得荧光假单胞菌,患病蛙食欲减退、活动迟缓、头部和四肢皮肤溃烂且其边缘整齐,与周围正常组织界线清晰。本研究中通过革兰氏染色、生理生化鉴定、16S rRNA基因序列分析和毒力基因检测等方法,确定导致本次杂交黄颡鱼烂身病的致病菌为荧光假单胞菌,为首次报道从患烂身病的黄颡鱼中分离获得荧光假单胞菌。此外,本研究中还发现,感染荧光假单胞菌后的杂交黄颡鱼和光泽黄颡鱼的临床症状高度一致,与前人研究中其他水生动物荧光假单胞菌感染后的症状存在一定程度的吻合。
3.2 荧光假单胞菌致杂交黄颡鱼和光泽黄颡鱼发生烂身病
黄颡鱼属多为小型经济鱼类,目前中国大部分省份都开展了黄颡鱼养殖[29-30]。黄颡鱼是四川省传统主导的水产养殖品种,养殖的黄颡鱼品种主要为“黄优1号”和“全雄1号”等,目前多以小规模池塘静养为主,养殖方式灵活[31]。光泽黄颡鱼是长江水系中常见的野生鱼类,近年来,在四川省内江市的一些家庭农场已开始尝试对其进行小规模池塘养殖。黄颡鱼暴发性疾病是影响产业发展的重要因素之一,常会给养殖户造成了巨大的经济损失;而野生鱼类面临复杂的自然环境,易感菌群复杂[32]。本研究中从“黄优1号”黄颡鱼中鉴定出的荧光假单胞菌还可引起光泽黄颡鱼患烂身病,症状与杂交黄颡鱼高度一致,且该菌感染可引起两种黄颡鱼的死亡,提示该菌很可能会对野外黄颡鱼的健康造成一定影响。然而,被荧光假单胞菌感染后光泽黄颡鱼的死亡率明显低于杂交黄颡鱼,这可能与该菌来源为“黄优1号”染病个体有关,其详细机制有待进一步深入研究。
3.3 荧光假单胞菌的毒力基因与致病力
目前,荧光假单胞菌引发的水产病害已受到一定重视,但关于荧光假单胞菌致病机制的研究仍十分有限。已有研究显示,荧光假单胞菌含有多种毒力因子,这些因子可以单个作用或多个共同发挥作用,致病机制复杂[33-34]。ATP依赖性Clp蛋白酶水解亚基基因clpP、铁吸收调节蛋白基因fur、丝氨酸蛋白酶基因pspB和血红素加氧酶基因hem O等在荧光假单胞菌侵染宿主组织、抗宿主血清杀伤和引起宿主死亡等过程中发挥关键作用;溶血素Hly可破坏宿主细胞膜,利于菌体顺利入侵宿主细胞;胞外金属蛋白酶AprX可水解酪蛋白而引起组织腐坏;丝状血凝素(FHA)可影响荧光假单胞菌生物膜的形成、鞭毛运动,改变宿主细胞黏附力,并参与凝血和抗宿主血清杀伤;TonB依赖型外膜受体TfeR与荧光假单胞菌侵染宿主组织的能力密切相关[18,34-35]。通常认为,荧光假单胞菌的毒力强弱与其所携带的毒力基因型和数量密切相关[36]。本研究中获得的荧光假单胞菌同时携带fur、hly、hemO、fha、pspB和tfeR等6个毒力基因,显示其具有溶血活性和蛋白酶活性。
3.4 荧光假单胞菌致黄颡鱼“烂身病”的防控措施
体外抗菌药物敏感性试验结果可作为临床抗感染治疗的重要依据。沈晓静等[33]发现,鱼源性荧光假单胞菌可能由于分布区域、分离环境、宿主来源和临床用药等因素的影响,对抗菌药物的敏感性存在一定差异。高桂生等[37]发现,鱼源荧光假单胞菌对氧氟沙星、氨曲南和红霉素等药物敏感,对利福平、妥布霉素等药物中度敏感,对卡那霉素、新霉素有耐药性。Shabana等[21]对尼罗罗非鱼鱼源荧光假单胞菌进行药敏感试验,结果发现,该菌对头孢噻肟、头孢曲松和左氧氟沙星等药物高度敏感。胡安东等[38]对鲟源荧光假单胞菌的药物敏感性试验表明,该菌对氧氟沙星、环丙沙星、多西环素、四环素、磺胺异恶唑和复方新诺明等6种药物敏感,对诺氟沙星、利福平、头孢哌酮、多粘菌素B、庆大霉素和新霉素等6种药物中度敏感,对氟苯尼考、卡那霉素、阿莫西林和泰乐菌素等4种药物有耐药性。徐悦玉等[28]对棘胸蛙源荧光假单胞菌的药物敏感性试验表明,该菌对链霉素、庆大霉素、阿米卡星、多粘菌素和左氧氟沙星高度敏感,对氯霉素和复方新诺明中度敏感,对红霉素、头孢唑林、青霉素和氨苄西林具有耐药性。本研究中分离的荧光假单胞菌对多西环素、庆大霉素、卡那霉素和四环素高度敏感,对头孢呋辛、头孢他啶和头孢哌酮中度敏感,而对青霉素、苯唑西林、氨苄西林和红霉素等具有耐药性。荧光假单胞菌感染黄颡鱼的研究目前少见报道,参考《水产养殖用药明白纸》及本研究结果,建议当杂交黄颡鱼发生因荧光假单胞菌引起的烂身病时,可选择使用氟苯尼考粉、氟苯尼考注射液和盐酸多西环素粉等四环素类抗生素,以及硫酸新霉素粉等氨基糖苷类抗生素类药物进行治疗。本研究可对荧光假单胞菌感染黄颡鱼的预防和治疗提供有益参考。
4 结论
1)从患烂身病的杂交黄颡鱼“黄优1号”皮肤中分离获得1株优势菌,菌株呈短杆状,为革兰氏阴性菌;分离的菌株可感染杂交黄颡鱼和光泽黄颡鱼引起相似的症状,但杂交黄颡鱼的死亡率高于光泽黄颡鱼,该菌株对杂交黄颡鱼15 d的LD50值小于光泽黄颡鱼。
2)通过形态学观察、生理生化鉴定、16S rRNA测序分析、毒力基因检测等方法,确定该菌株应为荧光假单胞菌,且携带有fur、hly、hem0、fha、pspb和tfeR等毒力基因。
3) 分离的荧光假单胞菌对多西环素、庆大霉素、卞那霉素和四环素等4种抗菌药物高度敏感;对头孢呋辛、头孢他啶和头孢哌酮等 3种抗菌药物中度敏感。
[1] 高炜烨,费树站,刘昊昆,等.投喂策略对黄颡鱼生长和繁殖的影响[J].水生生物学报,2023,47(3):462-472.
GAO W Y,FEI S Z,LIU H K,et al.Feeding strategies on growth and reproduction of yellow catfish (Pelteobagrus fulvidraco)[J].Acta Hydrobiologica Sinica,2023,47(3):462-472.(in Chinese)
[2] 樊启学,梅洁,袁勇超,等.杂交黄颡鱼“黄优1号”[J].中国水产,2020,7:92-96.
FAN Q X,MEI J,YUAN Y C,et al.The hybrid yellow catfish “Huangyou No.1” [J].China Fisheries,2020,7:92-96.(in Chinese)
[3] 张保发,陈碧波,曹胜欢,等.黄颡鱼“黄优1号”养殖技术[J].科学养鱼,2021,43(9):45-47.
ZHANG B F,CHEN B B,CAO S H,et al.The culture technology of yellow catfish “Huangyou No.1” [J].Scientific Fish Farming,2021,43(9):45-47.(in Chinese)
[4] 刘其根,吴杰洋,颜克涛,等.淀山湖光泽黄颡鱼食性研究[J].水产学报,2015,39(6):859-866.
LIU Q G,WU J Y,YAN K T,et al.Feeding habits of Pelteobagrus nitidus in Dianshan Lake [J].Journal of Fisheries of China,2015,39(6):859-866.(in Chinese)
[5] LIANG H W,CAO L,LI Z,et al.Mitochondrial genome sequence of the shining catfish (Pelteobagrus nitidus)[J].Mitochondrial DNA,2012,23(4):280-282.
[6] 廖传松,李为,苑晶,等.三峡水库光泽黄颡鱼年龄、生长与死亡特征研究[J].水生生物学报,2022,46(1):29-36.
LIAO C S,LI W,YUAN J,et al.Age,growth,and mortality characteristics of Pelteobagrus nitidus (sauvage et dabry) in the Three Gorges Reservoir[J].Acta Hydrobiologica Sinica,2022,46(1):29-36.(in Chinese)
[7] 温周瑞,许钦涵,卢伶俐,等.黄颡鱼暴发性疾病病因分析及防治措施[J].湖北农业科学,2021,60(20):119-124.
WEN Z R,XU Q H,LU L L,et al.Etiology and prevention countermeasures of the outbreak disease of yellow catfish(Pelteobagrus fulvidraco)[J].Hubei Agricultural Sciences,2021,60(20):119-123.(in Chinese)
[8] 徐洋,蔺凌云,姚嘉赟,等.黄颡鱼“溃疡综合征”病原的分离鉴定及药敏试验[J].淡水渔业,2015,45(5):100-104.
XU Y,LIN L Y,YAO J Y,et al.Pathogen isolation,identification and susceptibility test ulcerative disease on Pelteobagrus fulvidraco [J].Freshwater Fisheries,2015,45(5):100-104.(in Chinese)
[9] 宋立民,张韦,刘肖莲,等.杂交黄颡鱼新品种试养效果评估[J].农学学报,2021,11(12):100-104.
SONG L M,ZHANG W,LIU X L,et al.Experimental rearing effects of a new breed of hybrid yellow catfish:an evaluation[J].Journal of Agriculture,2021,11(12):100-104.(in Chinese)
[10] ZHOU Q C,JIN M,ELMADA Z C,et al.Growth,immune response and resistance to Aeromonas hydrophila of juvenile yellow catfish,Pelteobagrus fulvidraco,fed diets with different arginine levels[J].Aquaculture,2015,437:84-91.
[11] 刘方,孟丽华,杨淑英,等.黄颡鱼肌肉腐烂病研究及治疗技术初探[J].中国渔业质量与标准,2016,6(1):63-70.
LIU F,MENG L H,YANG S Y,et al.The study of yellow catfish muscle decay and its therapy technique[J].Chinese Fishery Quality and Standard,2016,6(1):63-70.(in Chinese)
[12] 金玉林.网箱养殖黄颡鱼烂身病全方位解读[J].海洋与渔业:水产前沿,2017,10(2):85-87.
JIN Y L.Comprehensive interpretation of rot disease of cage-cultured Pelteobagrus pelteobagrus [J].Oceans and Fisheries:Aquatic Frontiers,2017,10(2):85-87.(in Chinese)
[13] 喻大鹏,唐怀庆,丘金珠,等.乌鳢烂身病病原的分离鉴定及病理组织观察[J].大连海洋大学学报,2021,36(5):745-751.
YU D P,TANG H Q,QIU J Z,et al.Isolation and identification of bacterial pathogen and histopathological change in skin ulcer disease of Chinese snakehead Channa argus[J].Journal of Dalian Ocean University,2021,36(5):745-751.(in Chinese)
[14] 涂志刚,崔婧,严耿杰,等.网箱养殖卵形鲳鲹 “烂身病” 病原分离鉴定及药敏分析[J].水产科学,2018,37(5):634-639.
TU Z G,CUI J,YAN G J,et al.Isolation,identification and antibiotic sensitivity of bacterial pathogen in ovate pompano Trachinotus ovatus with rot body disease in deep-sea cage aquaculture[J].Fisheries Science,2018,37(5):634-639.(in Chinese)
[15] HAMILTON M A,RUSSO R C,THURSTON R V.Trimmed Spearman-Karber method for estimating median lethal concentrations in toxicity bioassays[J].Environmental Science &Technology,1977,11(7):714-719.
[16] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
DONG X Z,CAI M Y.Handbook of identification of common bacterial systems[M].Beijing:Science Press,2001.(in Chinese)
[17] POLZ M F,CAVANAUGH C M.Bias in template-to-product ratios in multitemplate PCR[J].Applied and Environmental Microbiology,1998,64(10):3724-3730.
[18] LIU L,CHI H,SUN L.Pseudomonas fluorescens:identification of fur-regulated proteins and evaluation of their contribution to pathogenesis[J].Diseases of Aquatic Organisms,2015,115(1):67-80.
[19] SWAIN P,BEHURA A,DASH S,et al.Serum antibody response of Indian major carp,Labeo rohita to three species of pathogenic bacteria;Aeromonas hydrophila,Edwardsiella tarda and Pseudomonas fluorescens[J].Veterinary Immunology and Immunopathology,2007,117(1/2):137-141.
[20] ZHANG S R,ZHANG L,SUN L.Identification and analysis of three virulence-associated TonB-dependent outer membrane receptors of Pseudomonas fluorescens[J].Diseases of Aquatic Organisms,2014,110(3):181-191.
[21] SHABANA B M,ELKENANY R M,YOUNIS G.Sequencing and multiple antimicrobial resistance of Pseudomonas fluorescens isolated from Nile tilapia fish in Egypt[J].Brazilian Journal of Biology,2022,84:e257144.
[22] GUO M, TAN S Q, ZHU J L, et al. Genes involved in biofilm matrix formation of the food spoiler Pseudomonas fluorescens PF07 [J]. Frontiers in Microbiology, 2022, 13:881043.
[23] WANG Y Y, HONG X L, LIU J C, et al. Interactions between fish isolates Pseudomonas fluorescens and Staphylococcus aureus in dual-species biofilms and sensitivity to carvacrol [J]. Food Microbiology, 2020, 91:103506.
[24] SHAH S Q A,SØRUM H.Genetic localization of a TetR-like transcriptional regulator gene in Pseudomonas fluorescens isolated from farmed fish[J].Journal of Applied Genetics,2014,55(4):541-544.
[25] 耿晓修,丁诗华,孙翰昌,等.荧光假单胞菌灭活疫苗对草鱼的免疫保护效应[J].西南农业大学学报(自然科学版),2006,28(1):120-123.
GENG X X,DING S H,SUN H C,et al.Immunogenicity and protective effects of Pseudomonas fluoroscens vaccines on grass carp[J].Journal of Southwest University (Natural Science Edition),2006,28(1):120-123.(in Chinese)
[26] 何文涛,谢洪霞.虹鳟荧光假单胞菌的分离鉴定[J].甘肃畜牧兽医,2019,49(2):57-59.
HE W T,XIE H X.Isolation and identification of Pseudomonas fluorescens from rainbow trout[J].Gansu Animal Husbandry and Veterinary,2019,49(2):57-59.(in Chinese)
[27] 王晓磊,姜彤彤,张洁,等.一株草鱼源荧光假单胞菌的分离鉴定及其耐药特性分析[J].河北渔业,2023(6):14-17.
WANG X L,JIANG T T,ZHANG J,et al.Isolation,identification and antibiotic susceptibility analysis of Pseudomonas fluorescens from infected grass carp(Ctenopharyngodon idellus)[J].Hebei Fisheries,2023(6):14-17.(in Chinese)
[28] 徐悦玉,林德,赵淑芳.棘胸蛙致病性荧光假单胞菌的分离鉴定[J].丽水学院学报,2023,45(2):17-22.
XU Y Y,LIN D,ZHAO S F.Isolation and identification of pathogenic Pseudomonas fluorescens from Quasipaa spinosa[J].Journal of Lishui University,2023,45(2):17-22.(in Chinese)
[29] 褚新洛,莫天培,戴定远.中国动物志[M].北京:科学出版社,1999.
CHU X L,MO T P,DAI D Y.Zoology of China [M].Beijing:Science Press,1999.(in Chinese)
[30] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2021中国渔业统计年鉴[M].北京:中国农业出版社,2021.
Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.Statistical yearbook of fishing industry in China from 2021[M].Beijing:China Agriculture Press,2021.(in Chinese)
[31] 龚全,李青芝,张继业,等.四川黄颡鱼产业发展现状及建议[J].四川农业科技,2022(2):62-64
GONG Q,LI Q Z,ZHANG J Y,et al.The current situation and suggestions for the development of Sichuan yellow catfish industry [J].Sichuan Agricultural Science and Technology,2022,2:62-64.(in Chinese)
[32] 张宝龙,曲木,暴丽梅,等.饲料中不同叶酸、 维生素B12水平对黄颡鱼生长及免疫力的影响[J].大连海洋大学学报,2018,33(6):729-735.
ZHANG B L,QU M,BAO L M,et al.Effects of dietary folic acid and vitamin B12 levels on growth performance and immunity of yellow catfish Pelteobagrus fulvidraco[J].Journal of Dalian Ocean University,2018,33(6):729-735.(in Chinese)
[33] 沈晓静,胡秀彩,兰云,等.锦鲤荧光假单胞菌的分离鉴定及药敏试验[J].水产科学,2014,33(7):443-446.
SHEN X J,HU X C,LAN Y,et al.Drug susceptibility,isolation and identification of pathogenic bacterium Pseudomonas fluorescens from koi carp (Cyprinus carpio)[J].Fisheries Science,2014,33(7):443-446.(in Chinese)
[34] PATEL S K,PRATAP C B,VERMA A K,et al.Pseudomonas fluorescens-like bacteria from the stomach:a microbiological and molecular study[J].World Journal of Gastroenterology,2013,19(7):1056-1067.
[35] SATICIOGLU I B,MULET M,DUMAN M,et al.First occurrence and whole-genome comparison of Pseudomonas haemolytica isolated in farmed rainbow trout[J].Aquaculture Research,2022,53(12):4472-4486.
[36] ZHANG W W,HU Y H,WANG H L,et al.Identification and characterization of a virulence-associated protease from a pathogenic Pseudomonas fluorescens strain[J].Veterinary Microbiology,2009,139(1/2):183-188.
[37] 高桂生,张艳英,吉志新,等.半滑舌鳎致病性荧光假单胞菌的分离鉴定及其感染的病理损伤[J].中国兽医学报,2016,36(7):1145-1150.
GAO G S,ZHANG Y Y,JI Z X,et al.Isolation,identification and pathogenicity of pathogenic Pseudomonas fluorescens from Cynoglossus semilaevis Gunther[J].Chinese Journal of Veterinary Science,2016,36(7):1145-1150.(in Chinese)
[38] 胡安东,张明洋,张安青,等.鲟源荧光假单胞菌的分离鉴定及药敏特性分析[J].畜牧与兽医,2019,51(7):107-111.
HU D A,ZHANG M Y,ZHANG A Q,et al. Isolation, identification and antibiotic sensitivity of pathogenic Pseudomonas fluorescens from sturgeons[J].Animal Husbandry &Veterinary Medicine,2019,51(7):107-111. (in Chinese)