厚壳贻贝(Mytilus coruscus)作为中国主要的养殖贝类之一,以其强大的生态适应力和繁育能力应对于不同的海洋环境[1]。在其生长周期中,需要经历浮游阶段和附着阶段,从浮游生活的幼虫期进入附着生长的稚贝期这一过程,被称为“附着变态”[2]。在贻贝的生长过程中,当环境发生变化不再适合其生活时,它们会自断足丝寻找新的附着基,此行为即“二次附着”[3-5]。提升附着变态和二次附着的能力对于人工养殖过程中的育苗和包苗环节具有重要意义,且这一行为受到海洋细菌生物被膜的影响。因此,探究海洋细菌生物被膜与贻贝附着之间的关系对海产贝类的养殖具有重要的经济意义。
海洋环境中微生物主要以生物被膜的形式存在,它们并非单独存在的个体,而是黏附于各种接触面并分泌多种胞外聚合物包裹自身[6]。在生物被膜中微生物仅占大约10%的成分,其主要成分是由多糖、蛋白质、胞外DNA(extracellular DNA,eDNA)和其他物质构成的细胞外基质(extracellular polymeric substances,EPS)[7]。生物被膜的生活方式与游离状态下的细菌存在一定差异[8]。因此,生物被膜中出现的特性无法从游离的细菌研究中预测[9]。同时大量研究表明,生物被膜中EPS可以诱导海洋无脊椎动物的附着变态,如海绵、线虫和牡蛎[10-12]。生物被膜同样可以诱导厚壳贻贝的稚贝附着,在EPS的研究中,荚膜多糖、可拉酸等胞外多糖可以提升生物被膜诱导稚贝附着的效果[13-15]。此外,胞外蛋白中的鞭毛蛋白同样能够提高贻贝附着诱导活性[16]。由此可见,在诱导海洋无脊椎动物附着变态的过程中,生物被膜中的胞外物质发挥着关键性的作用。
深渊是地球上探索度最低且最神秘的海洋环境,深度距海平面6 000~11 000 m[17-18]。与近海环境相比,深渊环境具有强大的压力、极低的温度、完全黑暗的环境、有限的营养水平 [19]等特点,也让处在深渊环境中的细菌所形成的生物被膜具有独特的胞外物质[20]和功能。Xu等[21]研究发现,深海细菌链霉菌属(Streptomyces)产生的胞外物质可以影响线虫的附着变态,而在本实验室已有研究中也同样发现,8株深海细菌的生物被膜均可促进厚壳贻贝幼虫的附着变态[22]。然而,对于深渊区域内10 000 m深处的海洋细菌能否在近海环境中形成生物被膜及如何诱导厚壳贻贝的稚贝附着,还需做进一步的研究和探讨。
本研究中旨在探讨8株深渊细菌生物被膜对厚壳贻贝附着的潜在效应,通过分析生物被膜的细菌密度、细菌活性水平、胞外多糖及eDNA等胞外物质与附着诱导活性之间的相关性,揭示了深渊细菌生物被膜在诱导厚壳贻贝附着过程中的影响,以期为深渊微生物资源的开发利用提供新策略,为深渊细菌在近海贝类养殖中的实际应用提供有益参考。
1 材料与方法
1.1 材料
本试验用厚壳贻贝稚贝壳长为(1.57±0.15)mm,壳高为(1.25±0.17)mm,共810只,采自浙江省嵊泗县枸杞岛(30°42′ N,122°57′ E)。暂养条件:18 ℃、黑暗环境下暂时培养一周后开始试验,盐度均为30,海水由孔径为0.45 μm的滤膜过滤所得。每隔2 d换一次过滤海水,每日投喂新鲜等量青岛大扁藻(Tetraselmis helgolandica),按时充气。
试验用菌株由上海深渊工程科学技术研究中心魏玉利教授赠予。8株菌株来源于马里亚纳海沟11 000 m处采集的海水与沉积物中,包含了优势菌属及代表性革兰氏阴性、阳性菌株。
1.2 方法
1.2.1 细菌纯化 对细菌悬液进行接种划线,置于ZoBell 2216E固体培养平板上,25 ℃下避光培养48 h后挑选单菌落,对菌落进行多次纯化步骤,以获得纯菌株。接种于同类型液体培养基中扩大培养48 h,将培养的菌液以3 500 r/min离心5 min,与30%甘油-NaCl溶液按体积比1∶1混合,冷冻保存在-80 ℃冰箱中。
1.2.2 深渊细菌16S rRNA基因测序 依照天根生化科技(北京)有限公司的细菌基因组DNA提取试剂盒(DP302)进行基因组DNA提取,利用27 F与1492 R两种引物对细菌16S rRNA进行序列扩增PCR。由生工生物技术(上海)有限公司检测产物并测序,测序结果提交至NCBI进行菌种对比分析,以确定细菌种属。
1.2.3 生物被膜制备 生物被膜制备参照Yang等[4]方法,将保存的细菌保种液接种于100 mL 2216E液体培养基中,25 ℃下恒温扩大培养48 h,将培养后的细菌悬浮液以3 500 r/min转速离心15 min,去除上清,尽可能充分保留沉淀。用灭菌过滤海水(autoclaved filtered seawater,AFSW)清洗,设置3次重复(下同),直至上清液澄清。使用50 mL AFSW重悬菌体,100倍稀释菌悬液,将1 mL稀释液用0.22 μm滤膜过滤,用体积分数为0.1%吖啶橙染色5 min后,在荧光显微镜(Olympus BX51)下计数,确定细菌含量。根据初始浓度1×108 cells/mL的标准,将菌悬液和AFSW添加到无菌玻璃培养皿中,终体积为20 mL,设置9个平行,以AFSW和空白灭菌玻片为对照组。18 ℃下避光培养48 h形成深渊细菌生物被膜。
1.2.4 厚壳贻贝稚贝附着 生物被膜分别置入灭菌玻璃皿中,并加入20 mL的AFSW。用玻璃吸管将10只稚贝平均置于生物被膜两边。对照组为灭菌空白玻片,每株细菌设置9个重复组。将玻璃皿放回原环境,记录生物被膜稚贝附着率。
1.2.5 生物被膜细菌密度测定 参照Peng等[23]方法,将培养好的生物被膜用体积分数为5%甲醛溶液浸泡固定24 h,取出后用AFSW轻轻冲洗生物被膜,再用0.1%的吖啶橙避光染色5 min,制片后在荧光显微镜下用100倍油镜观察,随机选取10个视野,每个组设置3个重复。
1.2.6 胞外物质共聚焦拍摄 所有菌株生物被膜染色方法与之前的研究相同[24]。胞外物质染色液选取参考文献[25],染料信息见表1。采用激光共聚焦扫描显微镜(CLSM)技术实现照片捕捉,按照不同物质相对应的染液工作液浓度,对每张生物被膜样本避光滴加50 μL染液进行染色。染色20 min后使用生理盐水轻轻冲洗残留染液,室温避光放置,等待自然风干后进行拍摄,每组样片随机拍摄9个视野,每组设置3个重复。
表1 共聚焦胞外物质染液
Tab.1 Confocal extracellular material dyeing
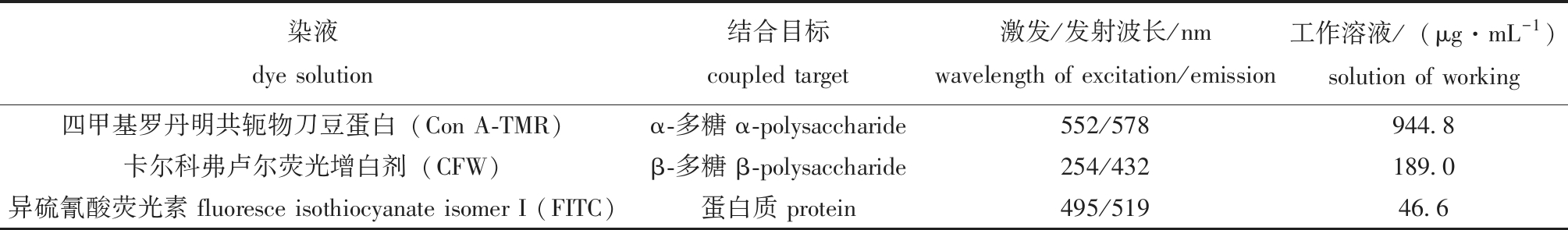
染液dye solution结合目标coupled target激发/发射波长/nmwavelength of excitation/emission工作溶液/(μg·mL-1)solution of working四甲基罗丹明共轭物刀豆蛋白(Con A-TMR)α-多糖 α-polysaccharide552/578944.8 卡尔科弗卢尔荧光增白剂(CFW)β-多糖 β-polysaccharide254/432 189.0异硫氰酸荧光素 fluoresce isothiocyanate isomer I (FITC)蛋白质 protein495/51946.6
1.2.7 生物被膜活/死细菌活性检测 参考Yu等[26]的方法,采用活/死细菌活力试剂盒(LIVE/DEAD BacLight bacterial viability kit InvitrogenTM)对生物被膜进行染色检测,将component A(PI)与component B(SYTO 9)用ddH2O稀释1 000倍后,按体积比1∶1比例混合。每张生物被膜滴加50 μL混合染料,在黑暗中染色20 min,将生物被膜在AFSW中浸泡3次,以清洗残留染液。待自然风干后随机选取3个显微镜视野进行激光共聚焦(LSM 710)拍摄。混合比例使用SYTO 9与PI时,活细菌呈现绿色荧光,死细菌或受损细菌呈现红色荧光。
1.2.8 生物被膜胞外DNA含量检测 生物被膜胞外DNA定量参考Dominiak等[27]的方法,采用PicoGreen dsDNA定量检测试剂盒,在96孔黑色微量滴定板中制备生物被膜。首先去除上清液,用PBS轻轻冲洗生物被膜两次,加入100 μL TE缓存液和100 μL稀释过后的PicoGreen染液(1 μL PicoGreen+200 μL TE缓冲液),将两种溶液混合吹打10次,避光染色5 min,使用多功能酶标仪检测荧光强度(激发485 nm/发射535 nm),每组设定9个重复。
1.3 数据处理
采用JMP 10.0.0与IBM SPSS Statistics 20.0.0软件对试验数据进行差异性与相关性分析。具体方法为应用Spearman秩相关检验进行相关性分析,而r值则作为相关性系数,显著性差异设为0.05,采用Graphpad Prism 8.0软件完成图表处理。
2 结果与分析
2.1 深渊细菌的测序与表型分析
本研究中使用的8株深渊细菌的16S rRNA 基因信息见表2。8株细菌来自不同的菌属,其中,交替单胞菌属有4种、盐单胞菌属有2种、假嗜杆菌属1种、微杆菌属1种。菌株表型如图1所示,除氧化微杆菌(Microbacterium oxydans)的菌落颜色为黄色外,其他菌株颜色无明显差异;菌落大小中盐单胞菌属Halomonas与微杆菌属Microbacterium的3株细菌形成的菌落较小,其余菌株的菌落大小均匀。
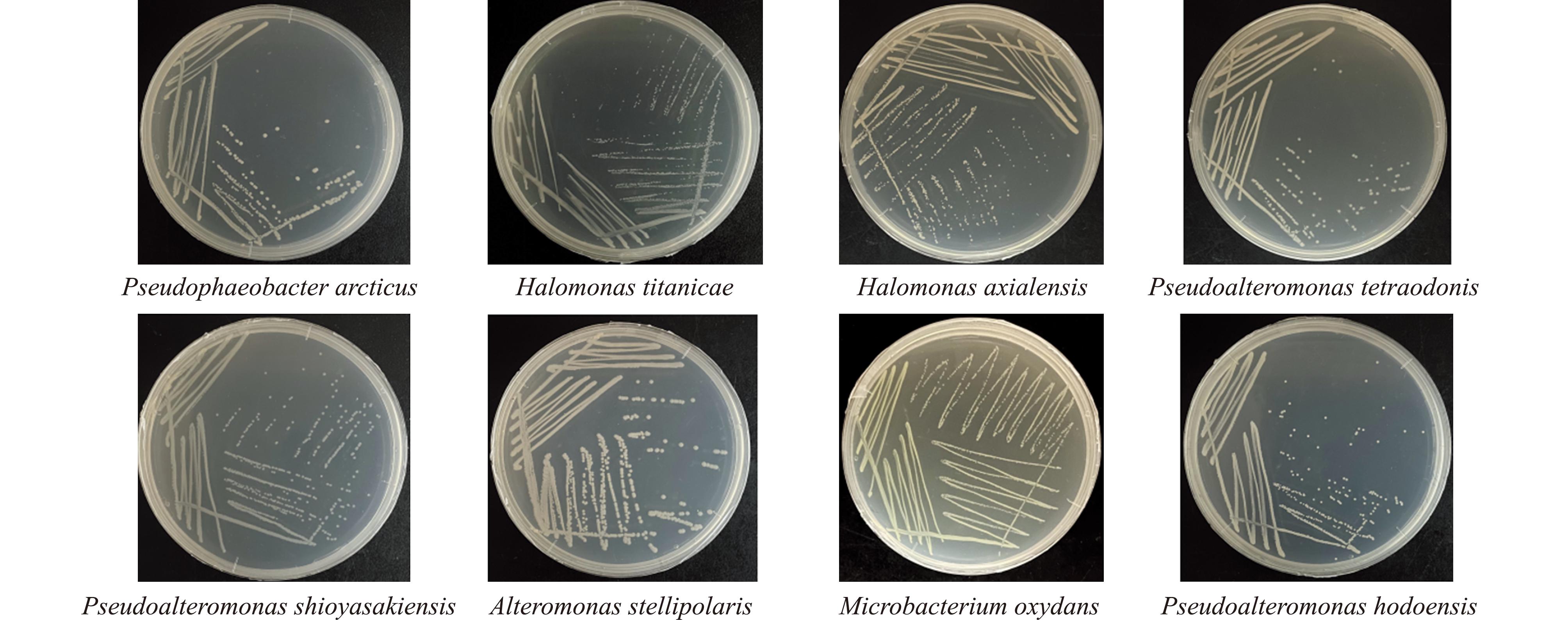
图1 8株深渊细菌纯化表型图
Fig.1 Phenotypic plot of eight hadal bacteria purification
表2 不同深渊细菌16S rRNA序列比对及基本信息
Tab.2 Comparison of 16S rRNA sequences and basic information of different hadal bacteria
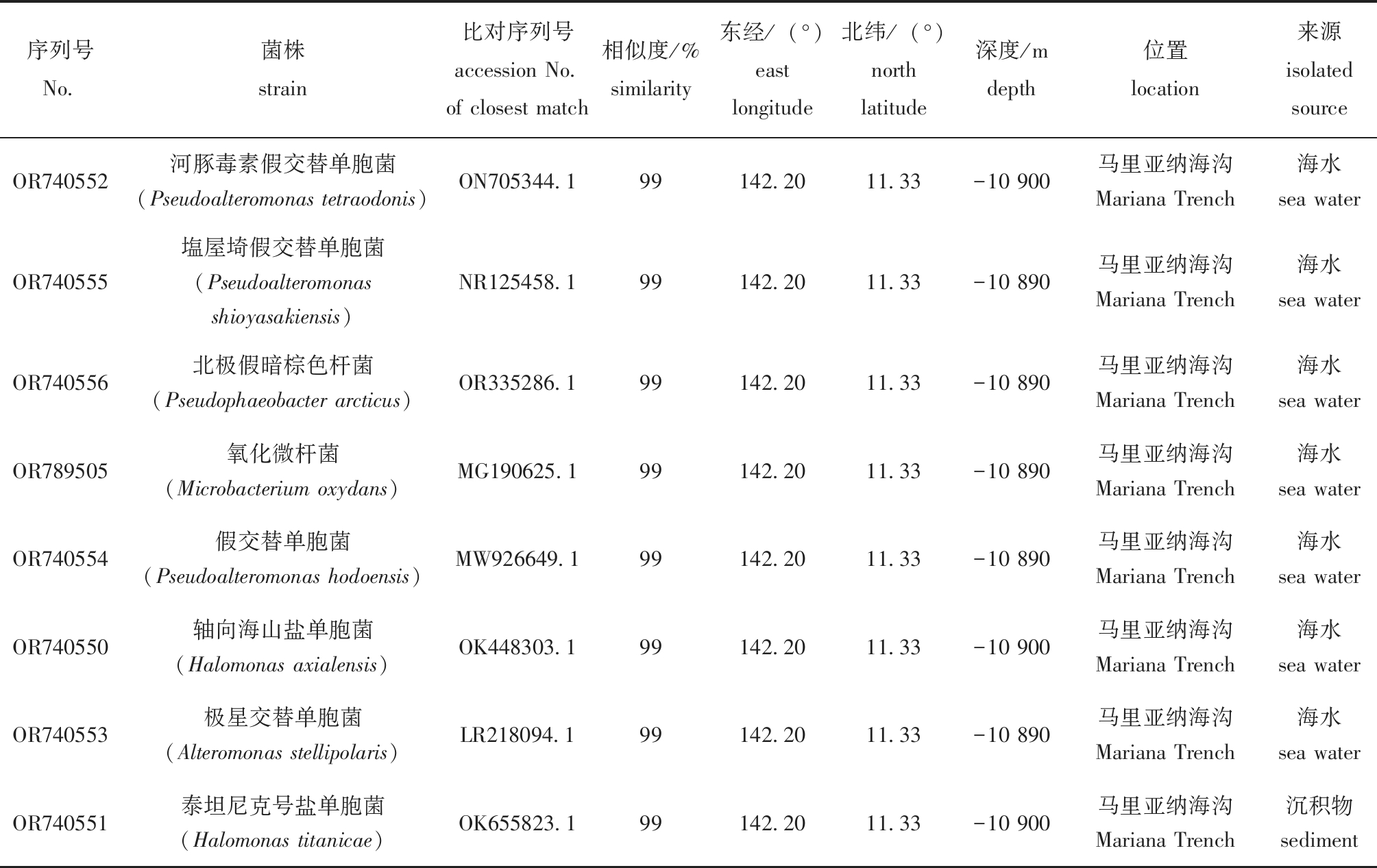
序列号No.菌株strain比对序列号accession No.of closest match相似度/%similarity东经/(°)east longitude北纬/(°)north latitude深度/mdepth位置location来源isolated sourceOR740552河豚毒素假交替单胞菌(Pseudoalteromonas tetraodonis)ON705344.199142.2011.33-10 900马里亚纳海沟Mariana Trench海水sea waterOR740555塩屋埼假交替单胞菌(Pseudoalteromonas shioyasakiensis)NR125458.199142.2011.33-10 890马里亚纳海沟Mariana Trench海水sea waterOR740556北极假暗棕色杆菌(Pseudophaeobacter arcticus)OR335286.199142.20 11.33-10 890马里亚纳海沟Mariana Trench海水sea waterOR789505氧化微杆菌(Microbacterium oxydans)MG190625.199142.20 11.33-10 890马里亚纳海沟Mariana Trench海水sea waterOR740554假交替单胞菌(Pseudoalteromonas hodoensis)MW926649.199142.20 11.33-10 890马里亚纳海沟Mariana Trench海水sea waterOR740550轴向海山盐单胞菌(Halomonas axialensis)OK448303.199142.20 11.33-10 900马里亚纳海沟Mariana Trench海水sea waterOR740553极星交替单胞菌(Alteromonas stellipolaris)LR218094.199142.20 11.33-10 890马里亚纳海沟Mariana Trench海水sea waterOR740551泰坦尼克号盐单胞菌(Halomonas titanicae)OK655823.199142.2011.33-10 900马里亚纳海沟Mariana Trench沉积物sediment
2.2 深渊细菌的系统发育分析
通过邻接法分析结果构建系统发育树(图2),并计算出遗传距离(表3)。研究结果显示,亲缘关系最近的是同为假交替单胞菌属的假交替单胞菌(Pseudoalteromonas hodoensis)与塩屋埼假交替单胞菌(Pseudoalteromonas shioyasakiensis),遗传距离最近,为0.039 6。同为盐单胞菌属的轴向海山盐单胞菌(Halomonas axialensis)与泰坦尼克号盐单胞菌(Halomonas titanicae),遗传距离为0.040 3。研究中还发现,α-变形菌门中的北极假暗棕色杆菌(Pseudophaeobacter arcticus)与γ-变形菌门中的河豚毒素假交替单胞菌(Pseudoalteromonas tetraodonis)遗传距离最远,为0.441 9,这表明二者亲缘关系较远。
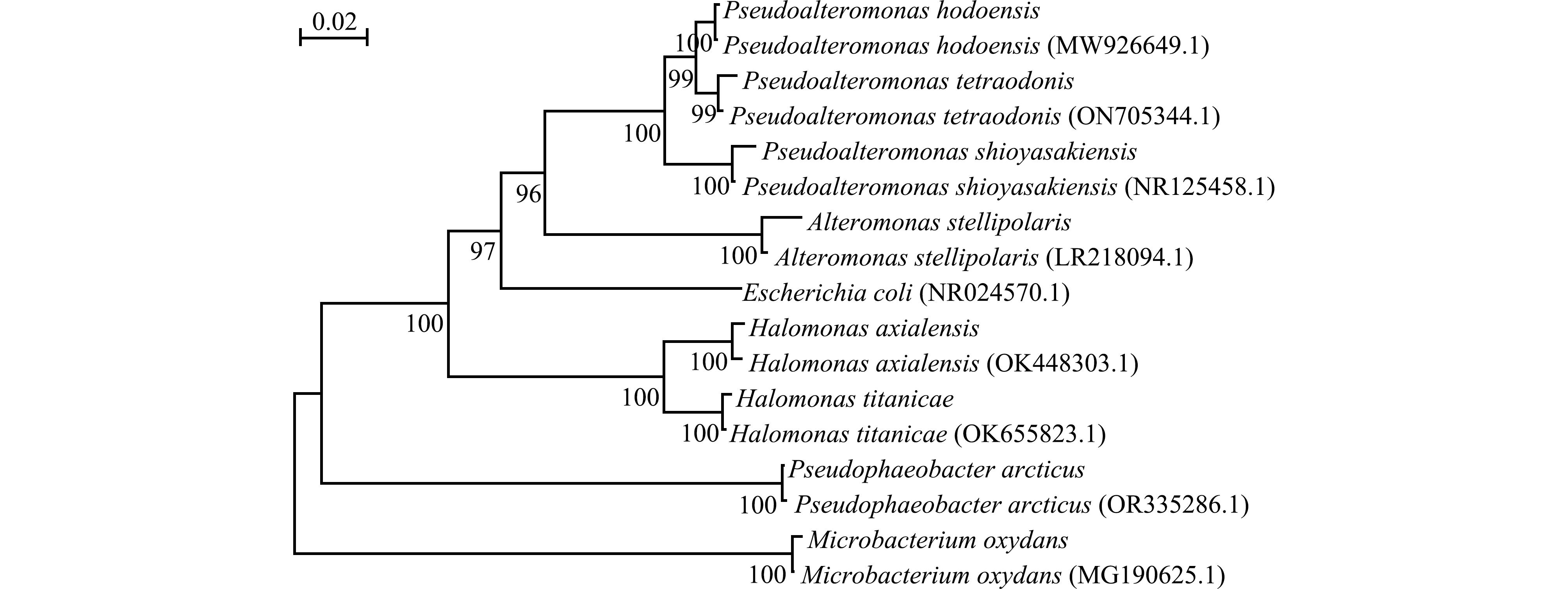
图2 通过Neighbor-Joining(NJ)构建系统发育树
Fig.2 Phylogenetic tree construction by Neighbor-Joining(NJ)method
表3 深渊细菌系统发育遗传距离
Tab.3 phylogenetic genetic distance of hadal bacteria
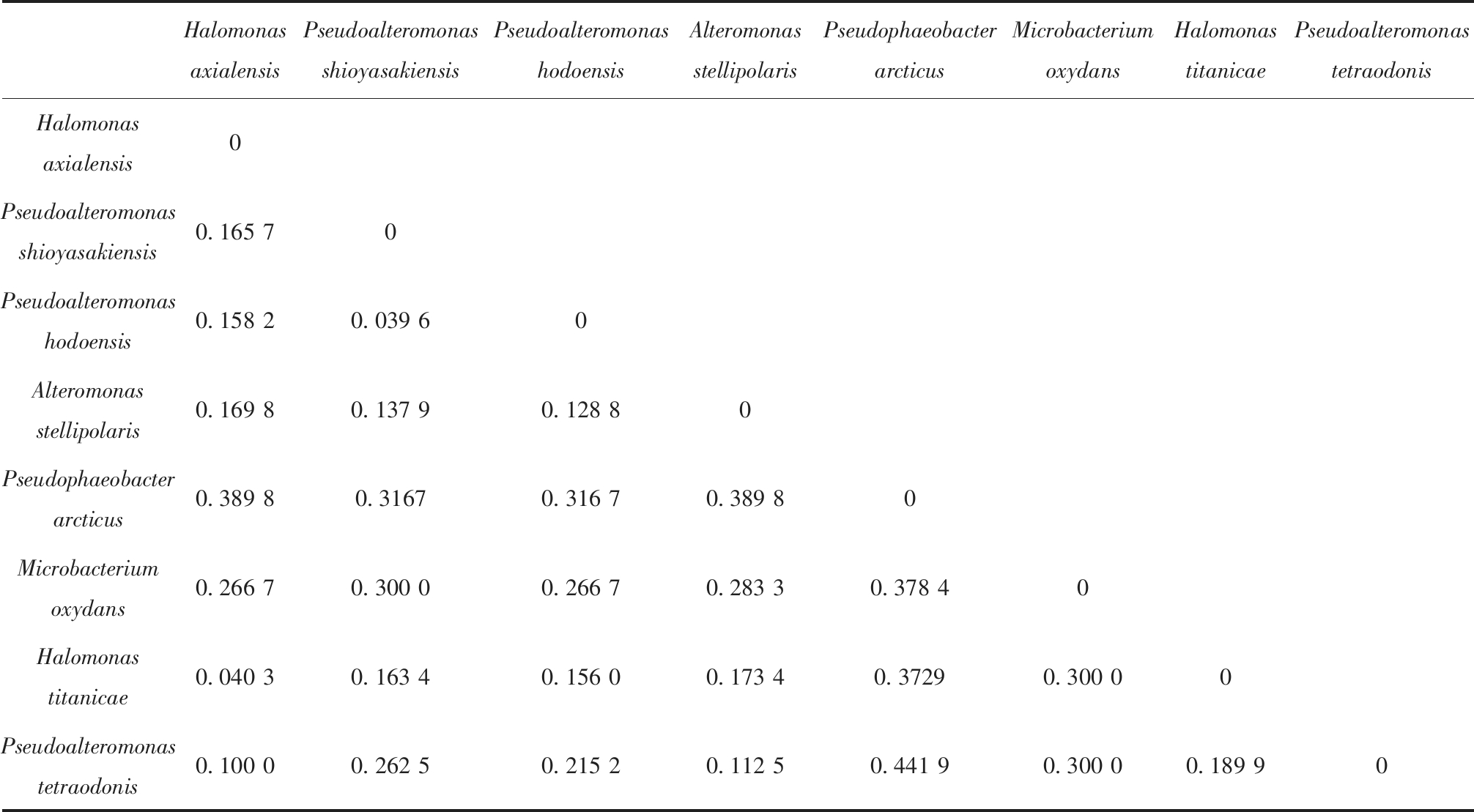
Halomonas axialensisPseudoalteromonas shioyasakiensisPseudoalteromonas hodoensisAlteromonas stellipolarisPseudophaeobacterarcticusMicrobacterium oxydansHalomonas titanicaePseudoalteromonas tetraodonisHalomonasaxialensis0Pseudoalteromonas shioyasakiensis0.165 70Pseudoalteromonas hodoensis0.158 20.039 60Alteromonas stellipolaris0.169 80.137 90.128 80Pseudophaeobacter arcticus0.389 80.31670.316 70.389 80Microbacterium oxydans0.266 70.300 00.266 70.283 30.378 40Halomonas titanicae0.040 30.163 40.156 00.173 40.37290.300 00Pseudoalteromonas tetraodonis0.100 00.262 50.215 20.112 50.441 90.300 00.189 90
2.3 不同深渊细菌生物被膜诱导稚贝附着的活性
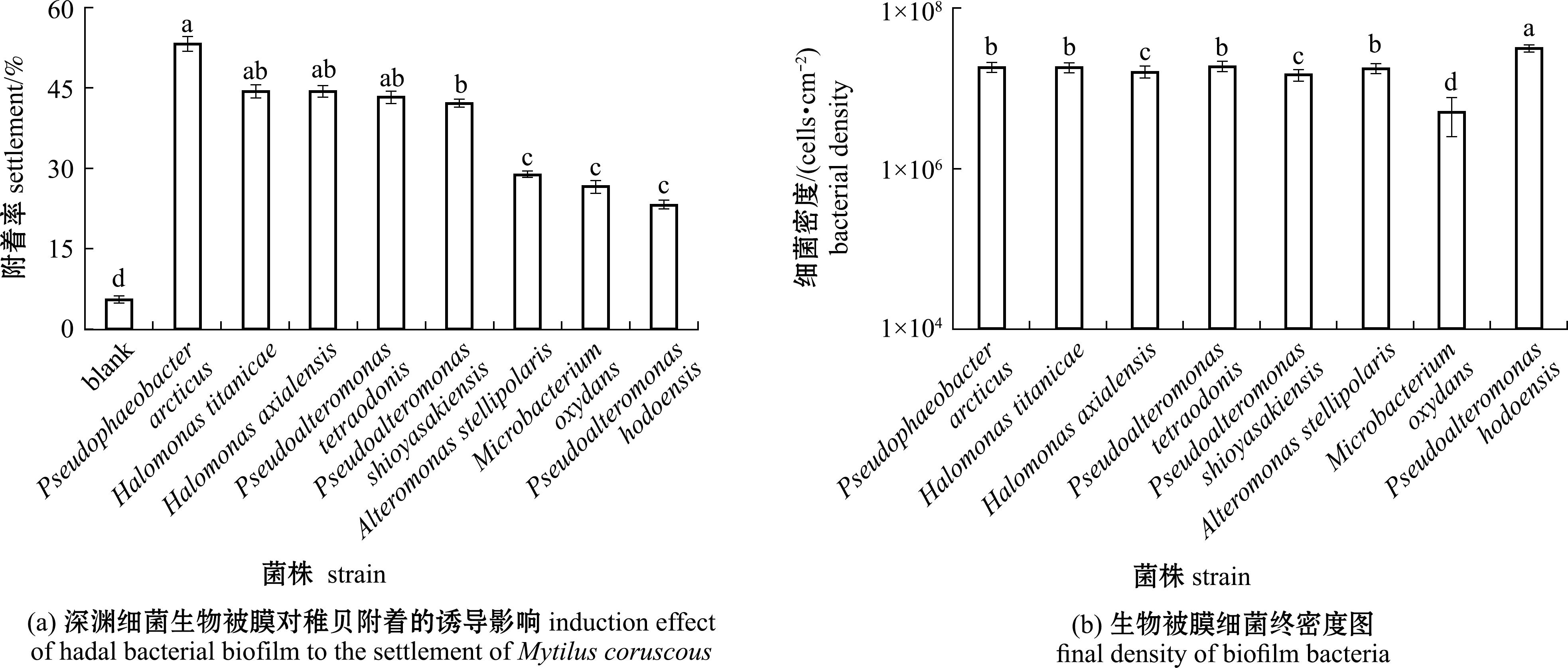
8株深渊细菌生物被膜具有不同诱导活性(图3(a)),与空白对照组的稚贝附着率相比,北极假暗棕色杆菌、泰坦尼克号盐单胞菌、轴向海山盐单胞菌和河豚毒素假交替单胞菌的生物被膜均具有中等诱导活性(>30%),其中北极假暗棕色杆菌生物被膜具有最高诱导活性(53.3%),与塩屋埼假交替单胞菌生物被膜具有显著性差异(P<0.05)。
标有不同字母者表示菌株间有显著性差异(P<0.05),标有相同字母者表示菌株间无显著性差异(P>0.05),下同。
The means with different letters are significantly different between strains at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图3 深渊细菌生物被膜对稚贝附着的诱导影响和生物被膜细菌终密度图
Fig.3 Induction effect of hadal bacterial biofilm to the settlement of Mytilus coruscous and the final density of biofilm bacteria
极星交替单胞菌(Alteromonas stellipolaris)、氧化微杆菌(Microbacterium oxydans)与假交替单胞菌表现出低诱导活性(<30%),3株细菌生物被膜诱导活性无显著性差异(P>0.05),其中假交替单胞菌为最低诱导活性23%。
在相同初始细菌密度1×108 cells/mL下形成生物被膜(图3(b)),假交替单胞菌的生物被膜具有最高细菌密度(3.17×107 cells/cm2),与其他7株细菌具有显著性差异(P<0.05)。氧化微杆菌生物被膜的细菌密度最低(5.06×106 cells/cm)。3株低诱导活性菌株中,极星交替单胞菌和氧化微杆菌的生物被膜细菌密度间无显著性差异(P>0.05)。5株中等诱导活性菌株的生物被膜细菌密度有显著性差异。不同诱导活性菌株所形成的生物被膜细菌密度均有所不同。
2.4 生物被膜胞外多糖与胞外蛋白差异分析
对不同诱导活性菌株的生物被膜胞外产物(α-多糖、β-多糖和蛋白)进行共聚焦定性分析(图4(a)),通过CLSM图像计算生物量,从图4(b)可见,北极假暗棕色杆菌生物被膜中的α-多糖含量最高,为2 237.67 μm3,泰坦尼克号盐单胞菌生物被膜中的β-多糖含量最高,为3 898.63 μm3。不同菌株生物被膜中胞外蛋白含量差异较大,其中极星交替单胞菌的生物被膜胞外蛋白含量显著高于其他菌株(P<0.05)。
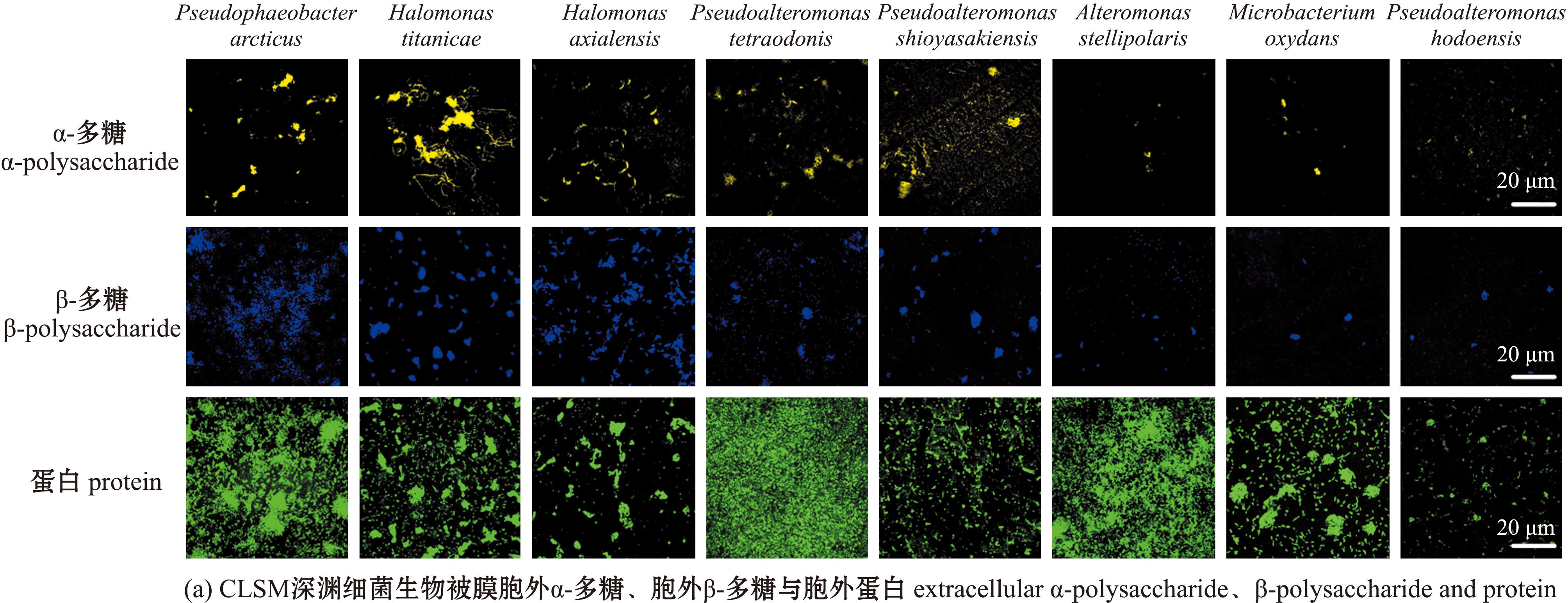
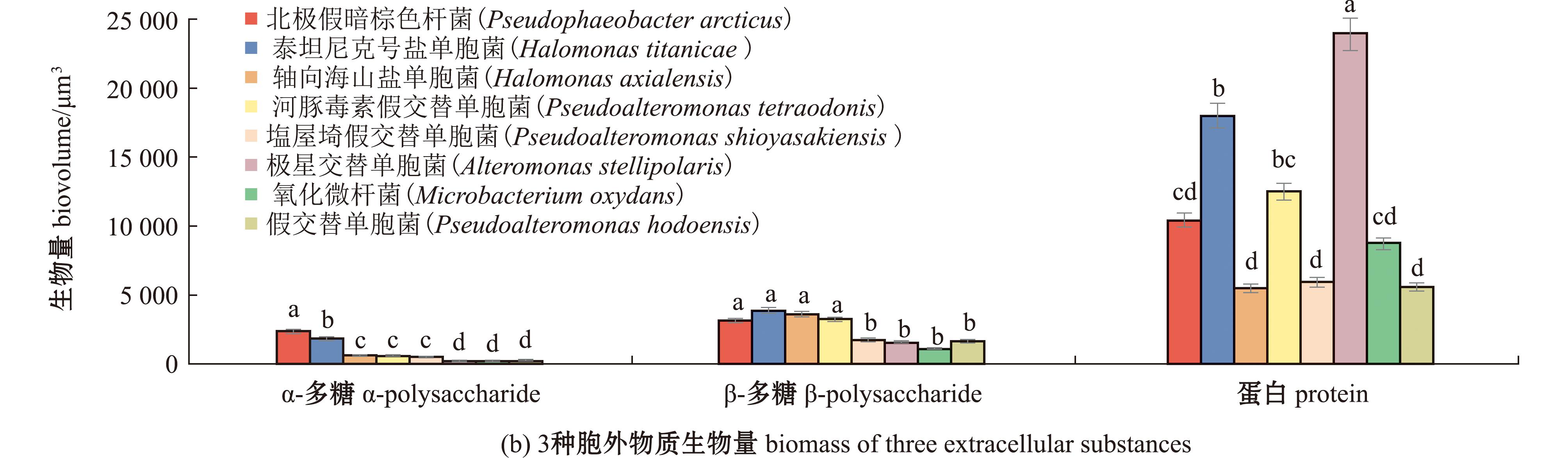
图4 CLSM深渊细菌生物被膜胞外α-多糖、胞外β-多糖与胞外蛋白3种胞外物质生物量
Fig.4 Extracellular α-polysaccharide,β-polysaccharide and protein biomass of three extracellular substances
2.5 生物被膜中eDNA的定量
为了检测深渊细菌生物被膜中eDNA含量的变化,使用PicoGreen定量检测试剂盒。从图5可见,低诱导活性菌株假交替单胞菌生物被膜中的eDNA含量最高,为411 mg/mL,中等诱导活性菌株轴向海山盐单胞菌生物被膜中的eDNA含量最低,为171 mg/mL。
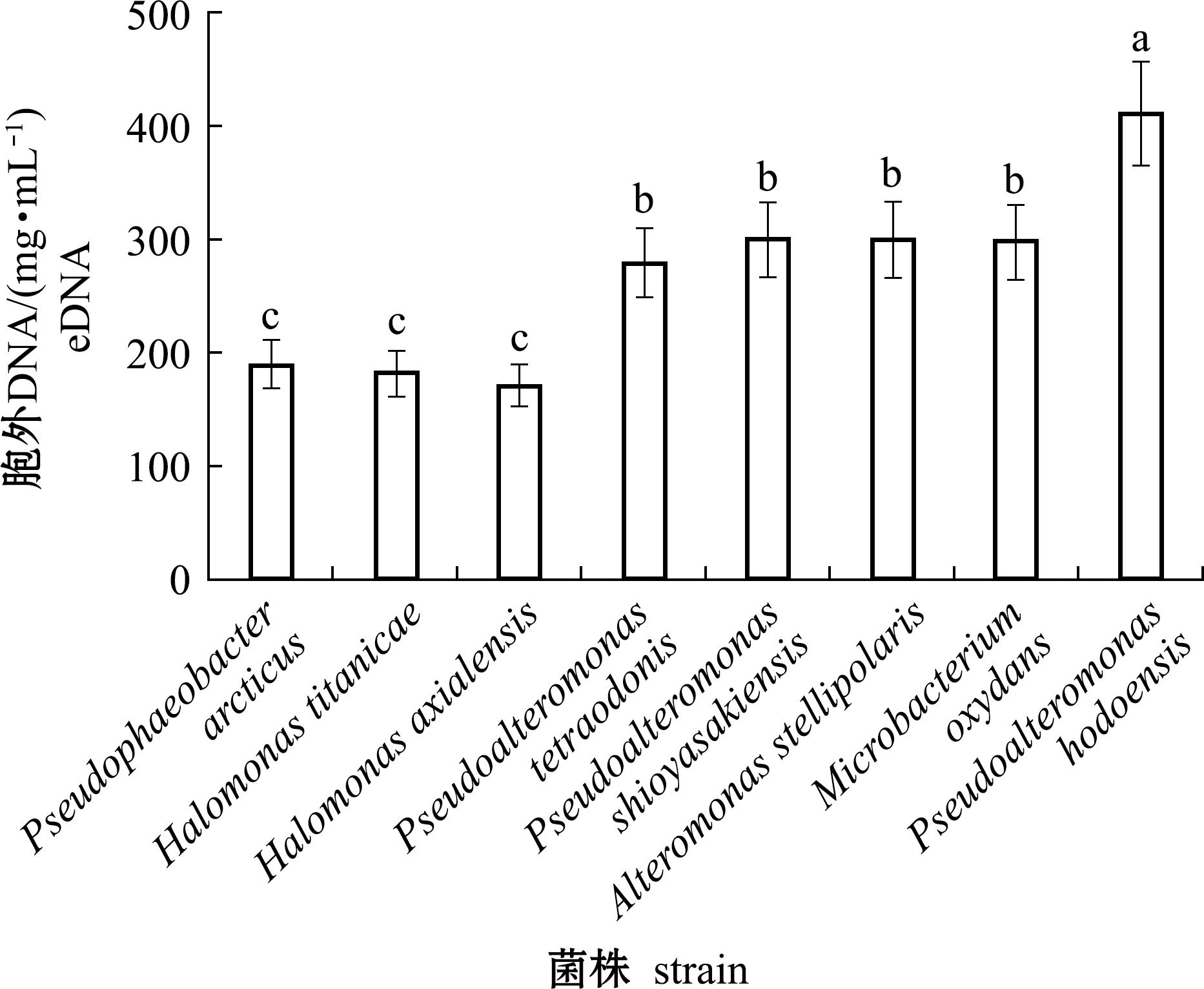
图5 生物被膜胞外DNA含量测量
Fig.5 Determination of extracellular DNA content of biofilm
2.6 生物被膜细菌活性能力检测
为了探究深渊细菌生物被膜在18 ℃海洋环境下活性程度的变化,采用活/死细菌活力检测试剂盒在Zeiss LSM 710共聚焦显微镜下检测,混合使用两种染料对生物被膜进行染色分析,在合成图像下观察细菌活性程度。从图6可见,其中中等诱导活性菌株的生物被膜中活细菌含量相对较高,泰坦尼克号盐单胞菌生物被膜中活细菌含量比例为95.5%。低诱导活性菌株的生物被膜中死细菌含量较高,氧化微杆菌生物被膜中死细菌含量比例为85.8%。
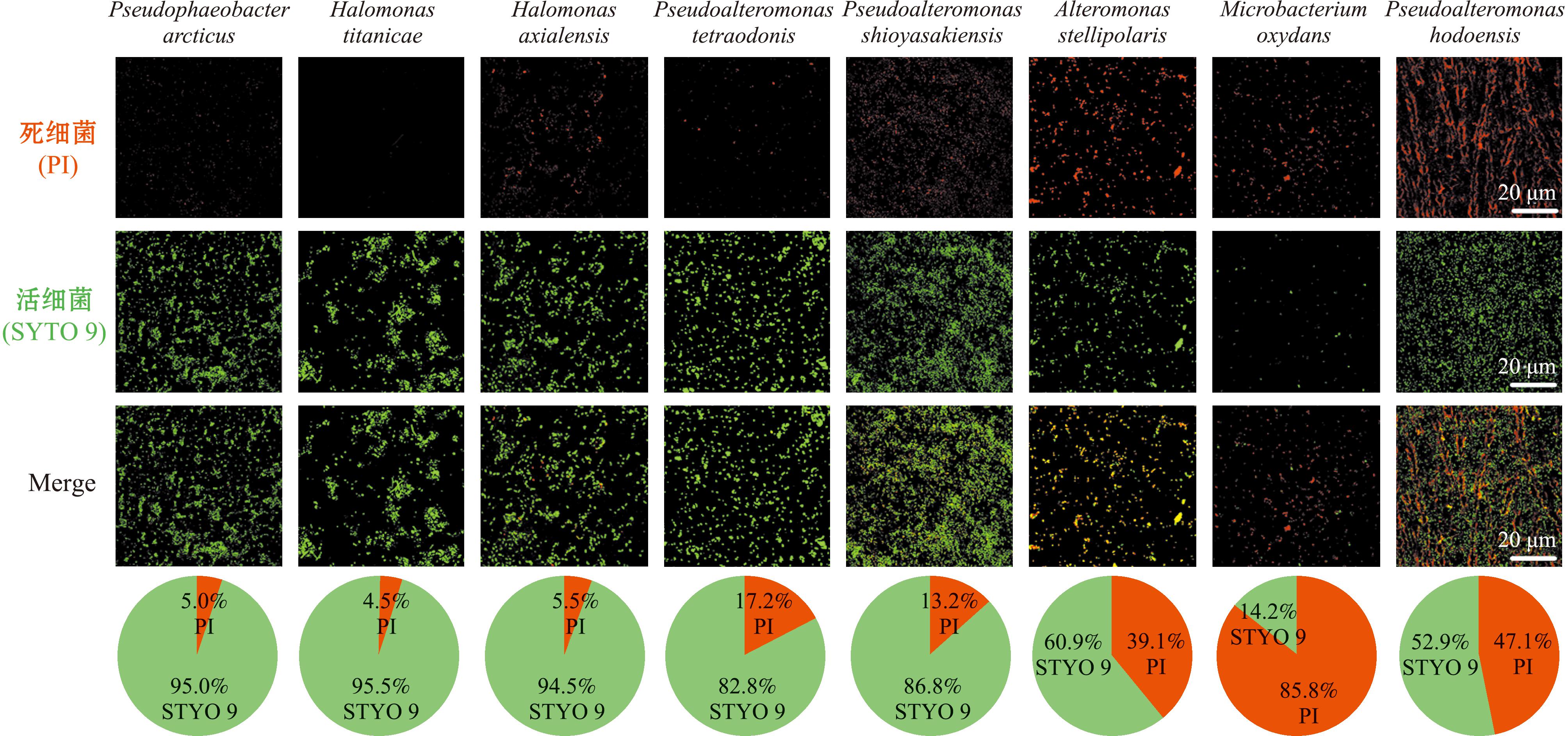
图6 细菌生物被膜活/死菌共聚焦染色与比例分析
Fig.6 Confocal staining and ratio analysis of live/dead bacteria in biofilm
2.7 不同相关因素差异性分析
本研究中根据以上不同检测结果进行多因素相关性分析,以探究8株深渊细菌生物被膜的诱导活性与其他因素的相关性。从图7可见,附着诱导能力与胞外α-多糖、β-多糖和活/死菌比例呈显著正相关(P<0.05),与生物被膜eDNA含量呈显著负相关(P<0.05),与胞外蛋白和细菌密度无显著相关性(P>0.05)。生物被膜eDNA含量与活/死菌比例呈显著负相关(P<0.05)。
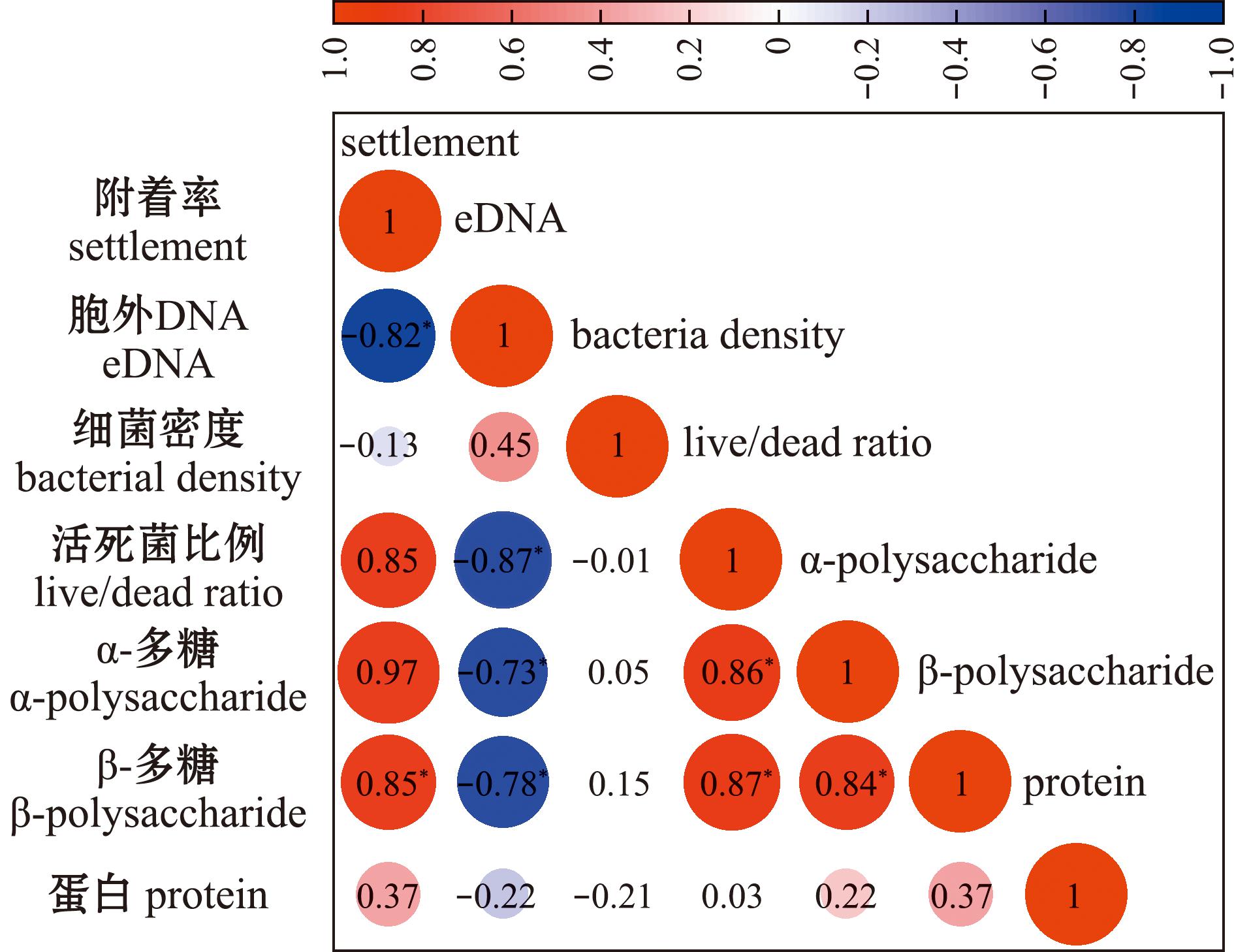
*表示与对应组有显著性差异(P<0.05),红色为正相关系数,蓝色为负相关系数。
Note:*means significant difference compared with the group (P<0.05),the positive correlation coefficient is shown in red,and the negative correlation coefficient is shown in blue.
图7 多因素相关性分析
Fig.7 Multi-factor correlation analysis
3 讨论
目前,关于近海及深海细菌对海洋无脊椎动物附着变态的研究均取得了一定进展,随着技术的不断进步,更深入的万米海水区域——“深渊”逐渐解锁,这为挖掘和利用深渊细菌在近海贝类养殖领域中的作用提供了不可忽视的价值和潜力。本研究中以近海贻贝厚壳贻贝为研究对象,将分离于马里亚纳海沟-10 890 m的8株深渊细菌在18 ℃下形成生物被膜,同时对8株深渊细菌生物被膜的特性,以及其对厚壳贻贝稚贝附着过程中的影响进行了深入分析,首次证明深渊细菌能够形成生物被膜并对厚壳贻贝的稚贝附着产生有效的诱导作用。
3.1 深渊细菌生物被膜对厚壳贻贝稚贝附着的诱导
在海洋无脊椎动物附着变态的过程中,细菌生物被膜中的多种因素发挥着至关重要的作用。以往的研究发现,从近海和深海环境分离出的各种海洋细菌在诱导贻贝附着变态过程中具有不同程度的诱导效果[21,28]。其中,从近海海域形成的生物被膜中分离出的海假交替单胞菌(Pseudoalteromonas marina)对厚壳贻贝附着具有40%左右的诱导活性[13]。而在本研究中,8株不同种属的深渊细菌生物被膜诱导厚壳贻贝稚贝附着的能力具有显著差异。其中,一株北极假暗棕色杆菌的生物被膜具有53.3%的诱导活性,高于近海细菌海假交替单胞菌的诱导活性。作为相同属的河豚毒素假交替单胞菌与塩屋埼假交替单胞菌、泰坦尼克号盐单胞菌与轴向海山盐单胞菌表现出中等诱导活性,明显高于假交替单胞菌。由此推断,细菌的种属差异与贻贝附着诱导活性无必然联系。
此前的研究证实,生物被膜的细菌密度与秀丽隐杆线虫的幼虫附着变态呈现正相关,并且认为细菌密度是诱导秀丽隐杆线虫幼虫附着变态的一个重要诱因[29]。前期研究显示,5株深海细菌生物被膜的细菌密度与诱导活性表现出显著相关性,其他3株无显著相关性[21]。而本研究表明,8株深渊细菌生物被膜的细菌密度与稚贝附着诱导活性无显著相关性(P>0.05)。这一结果揭示了生物被膜中细菌密度在不同细菌种属之间对于诱导活性存在一定差异。
3.2 生物被膜特性在贻贝附着过程中的影响
生物被膜中的细菌及胞外基质成分被广泛认为是诱导海洋无脊椎动物附着变态的重要外部诱因,如有研究发现,一株从自然海域生物被膜中分离出的Shewanella sp.1在诱导厚壳贻贝稚贝附着过程中表现出极高的诱导活性,使用福尔马林对生物被膜处理,以此杀死生物被膜细菌但并不破坏表面化学信号,结果导致诱导活性显著下降[28]。与本研究结果类似,生物被膜中的活/死菌比例与诱导活性有显著正相关(P<0.05),生物被膜中活细菌与死细菌的比例反映了活性水平,活细菌含量越高的生物被膜越具有较好的诱导活性。在深海细菌中发现,生物被膜诱导厚壳贻贝幼虫附着变态的必要条件是需要有活性的细菌来促进这一过程[22]。相似研究[30]也表明,其他海洋无脊椎动物的附着变态同样需要活性较高的生物被膜来诱导。以上研究结果表明,生物被膜中的细菌活性对厚壳贻贝稚贝的附着过程具有重要意义。
在诱导海洋无脊椎动物附着变态过程中,细胞外基质组分中的胞外多糖和胞外蛋白被广泛认为是关键因素之一。解静仪等[13]研究表明,8株细菌生物被膜胞外β-多糖的产生量与厚壳贻贝稚贝附着结果呈正相关。与本研究结果类似,8株深渊细菌生物被膜的胞外多糖含量与附着率、活/死菌比例呈显著正相关(P<0.05)。因此推测,当生物被膜中活细菌数量增加时,胞外多糖产生量增加,导致稚贝附着率上升。由此可见,胞外多糖在诱导稚贝附着过程中具有关键作用。有研究表明,细菌鞭毛蛋白亚基的缺失,会导致细菌生物被膜诱导活性降低,同时鞭毛蛋白的提取物能够促进厚壳贻贝幼虫的附着变态[31]。而本研究相关性分析表明,胞外蛋白与附着率及活/死菌比例无显著相关性(P>0.05)。
大量研究证明,生物被膜中的胞外产物,如多糖和蛋白质均影响贻贝的附着变态[32-34]。然而,eDNA在诱导附着变态过程中的作用尚不明确。生物被膜中eDNA的主要来源包括细菌囊泡释放和死细菌裂解释放两种途径[35]。生物被膜中死细菌的含量与诱导活性相关,死细菌含量的增加会导致生物被膜诱导活性的下降[28]。本研究中发现,eDNA含量与生物被膜活/死菌的比例呈显著负相关(P<0.05),表明死细菌增加的同时eDNA含量也在增加。因此推测,生物被膜中死细菌的增加会导致eDNA含量的提高,而死细菌含量增加也会导致生物被膜的诱导活性下降。
综上所述,细菌生物被膜的特性及产生胞外物质是影响厚壳贻贝稚贝附着的主要因素,且细菌生物被膜的活性能力是重要的前提条件。在厚壳贻贝稚贝附着过程中,只有产生有诱导活性的胞外物质才能促进稚贝附着。本研究结果表明,深渊细菌生物被膜均具有不同程度的诱导活性,首次论证了细菌生物被膜的附着诱导活性与胞外多糖及活/死菌比例、eDNA等多种因素之间的相关性。
4 结论
1)8株深渊细菌生物被膜均可诱导厚壳贻贝稚贝附着。
2)8株深渊细菌生物被膜稚贝附着诱导活性与胞外多糖含量、活/死菌比例呈显著正相关。
3)生物被膜活/死菌比例与eDNA含量呈显著负相关,推断细菌死亡损伤裂解会导致eDNA含量增加。
[1] 梁加越,赵广华,臧佳辰.贝类水产品干燥技术研究进展[J].食品工业,2022,43(11):257-260.
LIANG J Y,ZHAO G H,ZANG J C.Research progress in drying technology of shellfish aquatic products[J].The Food Industry,2022,43(11):257-260.(in Chinese)
[2] 梁箫,丁文扬,张驰,等.3种脂肪酸对生物被膜形成及厚壳贻贝幼虫附着变态的影响[J].大连海洋大学学报,2021,36(4):580-586.
LIANG X,DING W Y,ZHANG C,et al.Effects of three fatty acids on biofilm formation and settlement and metamorphosis of hard shelled mussel Mytilus coruscus[J].Journal of Dalian Ocean University,2021,36(4):580-586.(in Chinese)
[3] YANG J L,LI S H,BAO W Y,et al.Effect of different ions on larval metamorphosis of the mussel Mytilus galloprovincialis[J].Aquaculture Research,2015,46(1):155-162.
[4] YANG J L,SHEN P J,LIANG X,et al.Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to monospecific bacterial biofilms[J].Biofouling,2013,29(3):247-259.
[5] PETRONE L.Molecular surface chemistry in marine bioadhesion[J].Advances in Colloid and Interface Science,2013,195:1-18.
[6] FLEMMING H C,WINGENDER J.The biofilm matrix[J].Nature Reviews Microbiology,2010,8(9):623-633.
[7] FLEMMING H C,VAN HULLEBUSCH E D,NEU T R,et al.The biofilm matrix:multitasking in a shared space[J].Nature Reviews Microbiology,2023,21(2):70-86.
[8] FLEMMING H C,WINGENDER J,SZEWZYK U,et al.Biofilms:an emergent form of bacterial life[J].Nature Reviews Microbiology,2016,14(9):563-575.
[9] KONOPKA A.What is microbial community ecology?[J].The ISME Journal,2009,3(11):1223-1230.
[10] WEBSTER N S,SMITH L D,HEYWARD A J,et al.Metamorphosis of a scleractinian coral in response to microbial biofilms[J].Applied and Environmental Microbiology,2004,70(2):1213-1221.
[11] CAMPBELL A H,MERITT D W,FRANKLIN R B,et al.Effects of age and composition of field-produced biofilms on oyster larval setting[J].Biofouling,2011,27(3):255-265.
[12] WHALAN S,WEBSTER N S.Sponge larval settlement cues:the role of microbial biofilms in a warming ocean[J].Scientific Reports,2014,4:4072.
[13] 解静仪,王小雨,李局,等.海洋细菌生物被膜可拉酸含量影响厚壳贻贝稚贝附着[J].海洋学报,2023,45(8):96-107.
XIE J Y,WANG X Y,LI J,et al.Effect of the content of colanic acid in marine bacterial biofilms on the settlement of Mytilus coruscus plantigrades[J].Haiyang Xuebao,2023,45(8):96-107.(in Chinese)
[14] HE C H,ZHANG W,HU X M,et al.Larval settlement and metamorphosis of Mytilus coruscus in response to varying bacterial capsular polysaccharide[J].Frontiers in Marine Science,2023,10:1089024.
[15] 吴冠举,缪天音,胡晓梦,等.外源添加胞外囊泡对海假交替单胞菌生物被膜形成及厚壳贻贝附着的影响[J].大连海洋大学学报,2023,38(6):994-1002.
WU G J,MIAO T Y,HU X M,et al.Effects of exogenous addition of outer membrane vesicles on biofilm formation of Pseudoalteromonas marina and settlement of mussel (Mytilus coruscus)[J].Journal of Dalian Ocean University,2023,38(6):994-1002.(in Chinese)
[16] 蔡雨珊,张秀坤,竹攸汀,等.海假交替单胞菌(Pseudoalteromonas marina)鞭毛蛋白对生物被膜形成及厚壳贻贝附着的影响[J].海洋学报,2021,43(4):75-83.
CAI Y S,ZHANG X K,ZHU Y T,et al.Effects of Pseudoalteromonas marina flagellin on biofilm formation and settlement of Mytilus coruscus[J].Haiyang Xuebao,2021,43(4):75-83.(in Chinese)
[17] JAMIESON A J,FUJII T,MAYOR D J,et al.Hadal trenches:the ecology of the deepest places on Earth[J].Trends in Ecology &Evolution,2010,25(3):190-197.
[18] ICHINO M C,CLARK M R,DRAZEN J C,et al.The distribution of benthic biomass in hadal trenches:amodelling approach to investigate the effect of vertical and lateral organic matter transport to the seafloor[J].Deep Sea Research Part I:Oceanographic Research Papers,2015,100:21-33.
[19] LEDUC D,ROWDEN A A,GLUD R N,et al.Comparison between infaunal communities of the deep floor and edge of the Tonga Trench:possible effects of differences in organic matter supply[J].Deep Sea Research Part I:Oceanographic Research Papers,2016,116:264-275.
[20] ZHAI X F,CAO W,ZHANG Y M,et al.Study on the bacterial communities of the biofilms on titanium,aluminum,and copper alloys at 5,772 m under sea in Yap trench[J].Frontiers in Microbiology,2022,13:831984.
[21] XU Y,LI H L,LI X C,et al.Inhibitory effects of a branched-chain fatty acid on larval settlement of the polychaete Hydroides elegans[J].Marine Biotechnology,2009,11(4):495-504.
[22] CHANG R H,YANG L T,LUO M,et al.Deep-sea bacteria trigger settlement and metamorphosis of the mussel Mytilus coruscus larvae[J].Scientific Reports,2021,11(1):919.
[23] PENG L H,LIANG X,CHANG R H,et al.A bacterial polysaccharide biosynthesis-related gene inversely regulates larval settlement and metamorphosis of Mytilus coruscus[J].Biofouling,2020,36(7):753-765.
[24] HU X M,ZHANG J B,DING W Y,et al.Reduction of mussel metamorphosis by inactivation of the bacterial thioesterase gene via alteration of the fatty acid composition[J].Biofouling,2021,37(8):911-921.
[25] GONZ LEZ-MACHADO C,CAPITA R,RIESCO-PEL
LEZ-MACHADO C,CAPITA R,RIESCO-PEL EZ F,et al.Visualization and quantification of the cellular and extracellular components of Salmonella agona biofilms at different stages of development[J].PLoS One,2018,13(7):e0200011.
EZ F,et al.Visualization and quantification of the cellular and extracellular components of Salmonella agona biofilms at different stages of development[J].PLoS One,2018,13(7):e0200011.
[26] YU S M,LI G W,ZHAO P H,et al.NIR-laser-controlled hydrogen-releasing PdH nanohydride for synergistic hydrogen-photothermal antibacterial and wound-healing therapies[J].Advanced Functional Materials,2019,29(50):1905697.
[27] DOMINIAK D M,NIELSEN J L,NIELSEN P H.Extracellular DNA is abundant and important for microcolony strength in mixed microbial biofilms[J].Environmental Microbiology,2011,13(3):710-721.
[28] LI Y F,GUO X P,YANG J L,et al.Effects of bacterial biofilms on settlement of plantigrades of the mussel Mytilus coruscus[J].Aquaculture,2014,433:434-441.
[29] CHUNG H C,LEE O O,HUANG Y L,et al.Bacterial community succession and chemical profiles of subtidal biofilms in relation to larval settlement of the polychaete Hydroides elegans[J].The ISME Journal,2010,4(6):817-828.
[30] BAO W Y,YANG J L,SATUITO C G,et al.Larval metamorphosis of the mussel Mytilus galloprovincialis in response to Alteromonas sp.1:evidence for two chemical cues?[J].Marine Biology,2007,152(3):657-666.
[31] LIANG X,ZHANG X K,PENG L H,et al.The flagellar gene regulates biofilm formation and mussel larval settlement and metamorphosis[J].International Journal of Molecular Sciences,2020,21(3):710.
[32] WANG J S,ZHANG W,WANG X Y,et al.Mussel settlement mediated by bacterial VgrG proteins via extracellular outer membrane vesicles[J].International Biodeterioration &Biodegradation,2023,180:105595.
[33] 陈慧娥,贺康,贺楚晗,等.藻酸盐对海假交替单胞菌生物被膜形成及厚壳贻贝附着变态的影响[J].大连海洋大学学报,2022,37(4):620-626.
CHEN H E,HE K,HE C H,et al.Effects of alginate on biofilm formation of Pseudoalteromonas marina and larval settlement and metamorphosis of the mussel Mytilus coruscus[J].Journal of Dalian Ocean University,2022,37(4):620-626.(in Chinese)
[34] 梁箫,童欢,彭莉华,等.纤维素对海洋细菌生物被膜形成及厚壳贻贝幼虫附着变态的调控[J].大连海洋大学学报,2020,35(1):75-82.
LIANG X,TONG H,PENG L H,et al.Regulation of formation of biofilms and larval settlement and metamorphosis of mussel Mytilus coruscus by cellulose[J].Journal of Dalian Ocean University,2020,35(1):75-82.(in Chinese)
[35] PENG N,CAI P,MORTIMER M,et al.The exopolysaccharide-eDNA interaction modulates 3D architecture of Bacillus subtilis biofilm[J].BMC Microbiology,2020,20(1):115.