鱼类作为水域生态系统中重要的组成部分,其生存和繁衍受到水温等环境因素的影响较大[1]。全球气候变化导致水温上升,进一步加剧了水域中温度的波动性,对鱼类生理产生了多方面影响,包括增加鱼类代谢率和对溶解氧的需求等[2]。温度升高会导致机体对热刺激做出反应,这一过程的特征是基因表达的快速重编程,并导致与耐热性相关的热休克蛋白迅速积累。热休克反应是生物机体在热应激状态下所表现的以基因表达变化为特征的防御适应反应,具体表现为一种或多种热休克蛋白(heat-shock proteins,HSPs)表达的增强。HSPs是参与细胞应激等过程的分子伴侣,尤其是保护多肽在膜上的折叠和易位等方面发挥重要作用[3]。为保护机体免受热刺激等侵害,HSPs能够维持蛋白质正确结构并保持细胞稳态,如细胞应激能力、抗氧化、抗凋亡及免疫调节等[4-6]。鱼类中的主要热休克基因不含内含子,在处于应激时可以直接翻译成新的蛋白质[7]。因此,鱼类被认为是研究热休克蛋白的生理、生态和进化基因组学的理想模型系统[8]。
TRPA1(transient receptor potential ankyrin 1,TRPA1)是锚蛋白家族成员,主要在背根神经节和三叉神经节神经元中表达,能够被ATP、缓激肽或其他促痛觉剂激活,通过刺激磷脂酶C,促进 Ca2+的释放[9-10]。TRPA1能够在传入神经末梢时,将有害信号转化为电信号进行传导,在感觉传导、疼痛感知和温度调节等方面发挥作用[9,11]。在探究温度变化与trpa1基因的表达中发现,大鼠和小鼠TRPA1在受冷刺激时被激活[12-13],而人类和恒河猴的TRPA1则不能被冷刺激激活[13]。相反,在昆虫和一些四足动物中,TRPA1是一种具有高温依赖型的阳离子通道蛋白编码基因,与热敏感性有关[14-16]。在斑马鱼中,trpa1包括trpa1a和trpa1b两个同源基因,其中,trpa1b体外研究发现能够对冷刺激和热刺激产生特异性反应[17]。红鳍东方鲀(Takifugu rubipes)的trpa1b在冷刺激下被激活,而青鳉(Oryziaslatipes)的trpa1b则在高于25 ℃时才被激活,且无明显的阈值[18-19]。不同温度激活trpa1b基因后,细胞中游离的钙离子浓度升高,形成Ca2+-CaM复合物,这在调节热刺激转录因子的活性、HSP蛋白编码基因表达及耐热性等方面发挥着重要作用[20-22]。
斑马鱼(Danio rerio)作为一种已完成基因组测序的模式生物,在进行高通量筛选、基因编辑时具有极大优势[23]。为了明确trpa1b基因在鱼类温度耐受中的生物学功能,本研究中以斑马鱼为试验对象,通过CRISPR-Cas9技术构建了trpa1b基因缺陷型斑马鱼,采用组织学和转录组学技术,证明了trpa1b基因在斑马鱼高温耐受中起到关键调控作用,以期为解析斑马鱼高温耐受分子调控级联网络提供科学参考。
1 材料与方法
1.1 材料
本试验以AB品系斑马鱼为材料,置于上海海洋大学斑马鱼鱼房28 ℃循环系统中养殖,每日早晚人工投喂新鲜的丰年虾。
1.2 方法
1.2.1 斑马鱼胚胎的获取 准备盛有约500 mL养殖水的配种缸,将雌鱼和雄鱼分别放置于挡板两侧,避光。按照正常光周期(8:00—23:00)给予光照,抽去隔板使雌、雄鱼接触。雌、雄鱼在光照后开始交配产卵。将收集的胚胎置于E3培养基中,于28 ℃培养箱中培养。
1.2.2 CRISPR/Cas9靶位点设计及单链导向RNA(sgRNA)的合成 在本研究中,trpa1b基因敲除的斑马鱼是通过CRISPR/Cas9介导技术在AB品系的斑马鱼中实现的。采用ZiFiTTargeter在线软件(http://zifit.partners.org/ZiFiT/)设计靶点,其靶点为GGCCCATCAGGGCATTGTTG,其位于ATG起始密码子的正下游,并在整个trpa1b基因序列前端。使用MAXIscriptTM SP6/T7转录试剂盒(AM1320,InvitrogenTM)合成引导RNA(gRNA)。采用Nanodrop ND-2000分光光度计(Thermo,USA)评估RNA浓度和纯度,并通过琼脂糖凝胶电泳确认质量。
1.2.3 trpa1b突变株系的建立 将800 ng/μL GenCrispr NLS-Cas NLS核酸酶(Z03389-100,GenScript)和200 ng/μL gRNA共同注射到一细胞期斑马鱼胚胎的动物极中。注射后,将这些胚胎培养至成年,然后与WT斑马鱼杂交以产生F1代。通过TA克隆和DNA测序证实了F1基因的突变类型。随后,将具有相同突变的F1个体进行杂交以获得F2代。通过对F2代斑马鱼基因型鉴定,成功获得trpa1b敲除的纯合子品系。
1.2.4 斑马鱼Trpa1b多克隆抗体的制备 由华安生物技术公司制备聚合物样品,以在兔体内产生针对Trpa1b的多克隆抗体。每7 d将1 mg肽样品(QKGPEHLSLRDENGC)注射到健康的试验兔中,共进行35 d。在第一次注射过程中,将蛋白质与完全弗氏佐剂混合,而在随后的4次注射中,将蛋白与不完全弗氏辅料混合。在最后一次抗原注射后7 d,收集血清用于制备多克隆抗Trpa1b抗体。
1.2.5 Western Blot检测 为了证实trpa1b基因是否成功敲除,使用PierceTMBCA蛋白质测定试剂盒(Thermo,德国)从WT和trpa1b-/-斑马鱼中提取总蛋白质。测定蛋白质浓度后,在8% SDS-PAGE上分离蛋白质,随后转移到0.45 μm的PVDF膜(Millipore,USA)上。对于一抗,使用1∶500稀释液,并将膜与一抗在4 ℃下孵育过夜。随后,于室温下在含有0.1% 吐温的PBS中洗涤PVDF膜。采用1∶4 000稀释的二抗(HUABIO,中国)孵育1 h。最后,使用显影液(Beyotime,中国)进行检测。
1.2.6 高温处理升温方案 在进行升温试验前24 h,对斑马鱼进行禁食。将25尾野生型和25尾trpa1b-/-斑马鱼,分别置于同一水箱(60 cm×48 cm×38 cm)但不同多孔隔离盒中适应24 h,通过加热棒对养殖水加热进行升温试验,水温以1 ℃/h的速度从28 ℃持续升温至40 ℃。当斑马鱼不游动且身体失去平衡后,将斑马鱼捞至28 ℃的水中,观察状态,若不能恢复则判定为死亡。试验开始前,统计不同基因型斑马鱼的体质量、体长并记录。高温处理试验进行3次,处理组和对照组各取3尾以上,同时进行3个生物学重复,分别用作TUNEL染色和RNA提取。
1.2.7 石蜡切片和TUNEL染色 当升高温度到达40 ℃时进行解剖取样。将解剖斑马鱼的鳃、脑和肠组织采用体积分数为4%的多聚甲醛保存,固定24 h,置于摇床上分别用不同浓度的乙醇进行梯度脱水,每个阶段持续1 h。通过二甲苯透明处理后,使用石蜡包埋。待石蜡冷却后连续切片,切片厚度为6 μm。随后,将烘干的切片组织在二甲苯中脱蜡,梯度乙醇复水。采用FITC凋亡检测试剂盒(Vazyme,A11103)对不同组织进行凋亡检测。采用蛋白酶K(20 μL/mL)通透处理20 min,随后用Equilibration Buffer缓冲20 min,37 ℃下按照说明书配制TdT孵育缓冲液并避光孵育1 h。将染色的切片用DAPI(1 μg/mL)复染,用荧光显微镜(Zeiss)下观察和拍照,在每个切片中随机采集3个成像视野(×10),计算凋亡细胞比例的平均值。采用ImageJ软件测量荧光强度。
1.2.8 RNA-seq测序 本研究中选取了凋亡程度最显著的鳃组织进行研究。分别对野生型(C)和trpa1b-/-纯合子(T)在常温(28 ℃)、达到斑马鱼开始死亡温度(38 ℃)及最高存活温度(40 ℃)时进行取样,分别命名为C0、T0、C1、T1、C2、T2。将新鲜的鳃组织加入Trizol(Invitrogen,美国)进行总RNA提取,每组设置3个生物学重复,共计18个样本。通过琼脂糖电泳和Nanodrop 2000(Thermo,美国)检测RNA的浓度和纯度。将RNA样本送往北京安诺优达基因技术有限公司进行建库测序,测序平台为Illumina HiSeq X Ten。
1.3 数据处理
对原始数据进行质控,采用Hisat2-2.0.4软件将读数与斑马鱼参考基因组进行比对,使用Featurecount进行定量处理。为进行差异表达分析,采用DEseq2软件对测序结果进行差异分析,采用统计模型计算假设检验概率(P值)。筛选条件:P值<0.05且|log2(Fold Change)|>1。使用计算样本的归一化FPKM(每千个碱基的转录每百万映射读取的转录本)值以表征基因转录丰度。
试验首先对3组相同温度下,不同基因型之间差异基因进行了比较,即C0 vs T0,C1 vs T1,C2 vs T2,筛选出C1 vs T1,C2 vs T2共有的差异基因,且排除C0vsT0中的差异基因,即为高温处理(38 ℃、40 ℃)才导致试验组与对照组出现差异基因,记作C vs T。将获得的差异基因全部注释到GO(Gene Ontology)数据库中。
2 结果与分析
2.1 利用CRISPR/Cas9构建trpa1b突变株系
Trpa1b基因位于24号染色体,共有28个外显子,其编码蛋白包含1 120个氨基酸。本试验构建的trpa1b敲除品系斑马鱼,其突变位点位于4号外显子上,包含-3 bp(ATG)的DNA序列和一个+9 bp(TCCGCTGAC)的插入序列,在插入的序列中包括一个终止密码子TGA(图1(a)),使得Trpa1b蛋白提前终止翻译。通过蛋白质翻译预测,发现离子通道(760~976 aa)位于该突变位点之后,证明了该基因的功能丧失(图1(b))。为了确定该品系Trpa1b蛋白质的缺失,通过Western blot检测斑马鱼Trpa1b蛋白(相对分子质量约125 000)。结果表明,WT显示出独特的单一蛋白条带,而trpa1b-/-纯合子则缺乏该蛋白条带(图1(c)),表明trpa1b基因敲除品系构建成功。
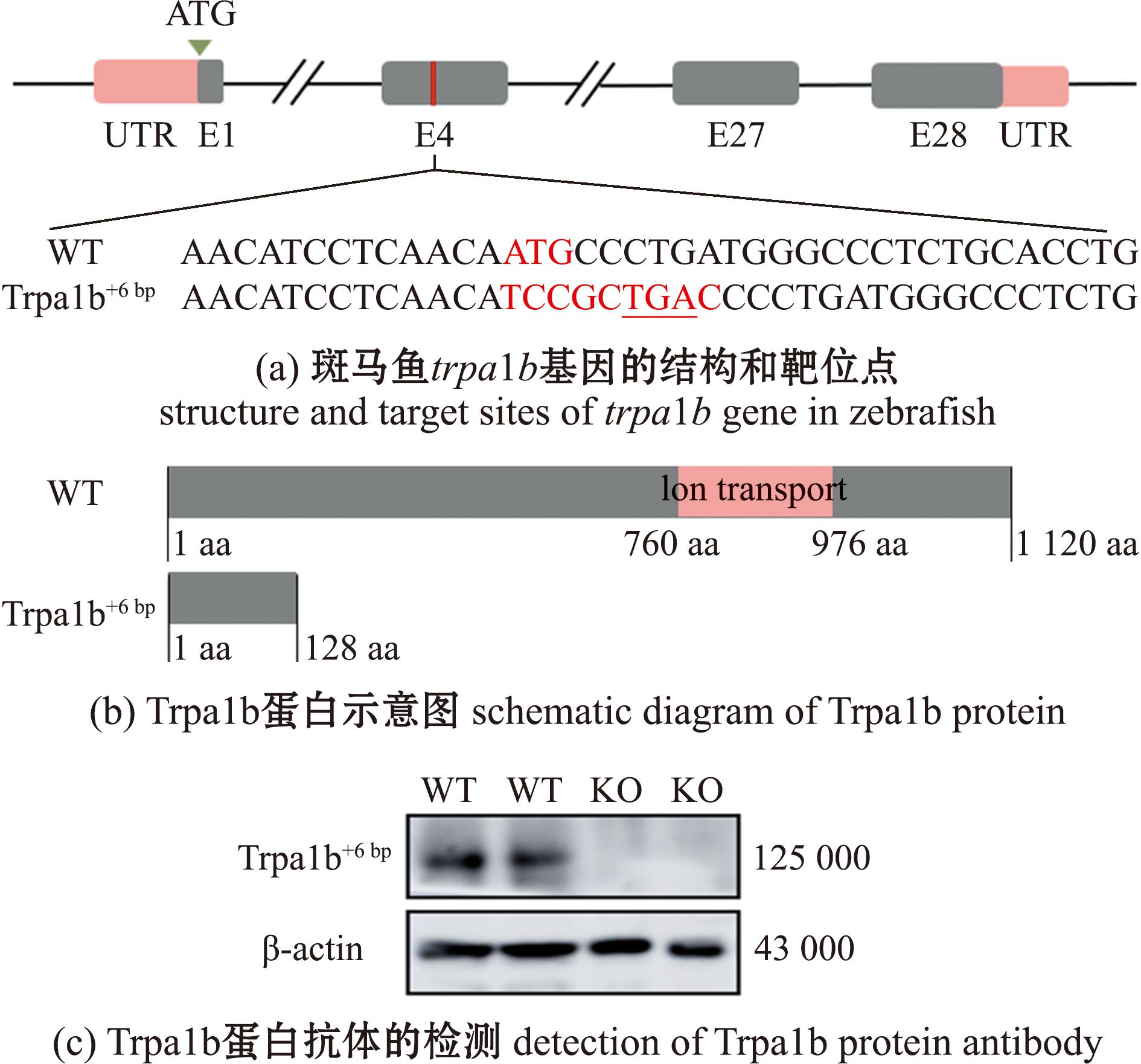
(a)中突变位点包含3 bp(ATG)的敲除序列和9 bp(TCCGCTGAC)的插入序列,其中包括一个终止密码子。(b)中红色区域代表离子通道结构域。
The mutation site contains a 3 bp (ATG) deletion sequence and a 9 bp (TCCGCTGAC) insertion sequence,including a termination codon in Fig(a);Schematic diagram of Trpa1b proteinin Fig(b).
图1 斑马鱼trpa1b基因敲除位点
Fig.1 Trpa1b knockout site in Danio rerio
2.2 敲除trpa1b基因对斑马鱼高温存活时间影响
本试验中对WT斑马鱼和trpa1b-/-纯合子进行了高温处理。对试验用斑马鱼的体质量及体长进行测量,结果显示,WT和trpa1b-/-纯合子的体质量及体长无显著性差异(图2(a)、(b))。本试验采用1 ℃/h的升温速率,缓慢进行升温(图2(c)),更加客观反映了鱼类本身对热的耐受力。随着温度的逐渐升高,当温度达到38 ℃时,每10 min对斑马鱼的存活情况进行统计(图2(d))。与野生型相比,trpa1b-/-纯合子率先死亡且在高温下存活时间显著降低(P<0.001)。
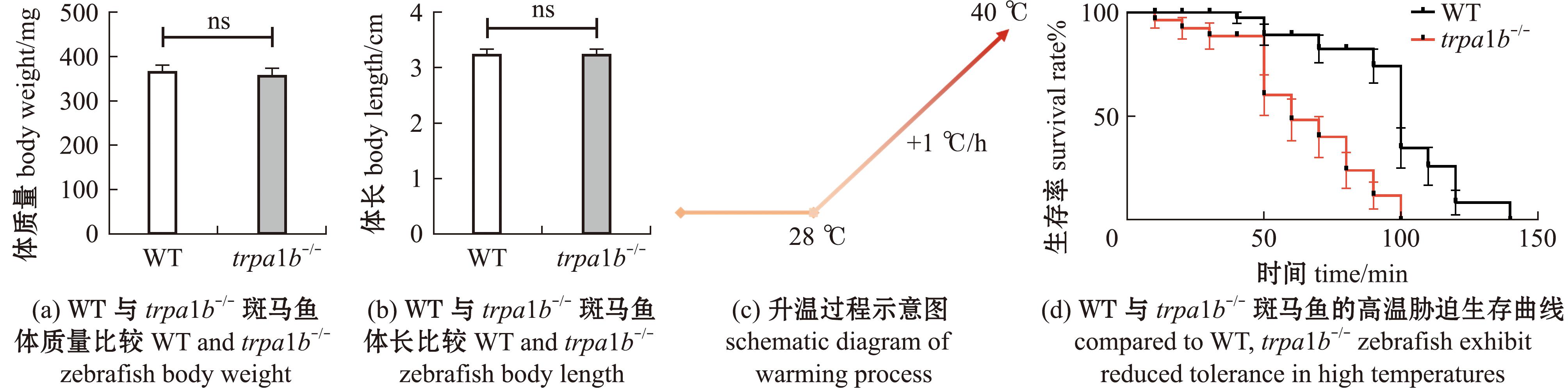
图2 野生型和trpa1b-/-斑马鱼高温耐受能力检测
Fig.2 Detection of high temperature tolerance in WT and trpa1b-/- Danio rerio
为了定量评估高温对斑马鱼的组织损伤程度,温度达到40 ℃时,对不同基因型个体进行了组织取样,并检测组织凋亡程度。TUNEL染色结果显示,trpa1b-/-纯合子鳃和脑组织中的平均凋亡信号显著高于野生型个体,但肠道中的凋亡信号并不明显且基因型间无显著性差异(图3)。因此,trpa1b基因的缺失,以及在高温环境中鳃和脑组织细胞凋亡过度降低了斑马鱼的高温耐受能力。
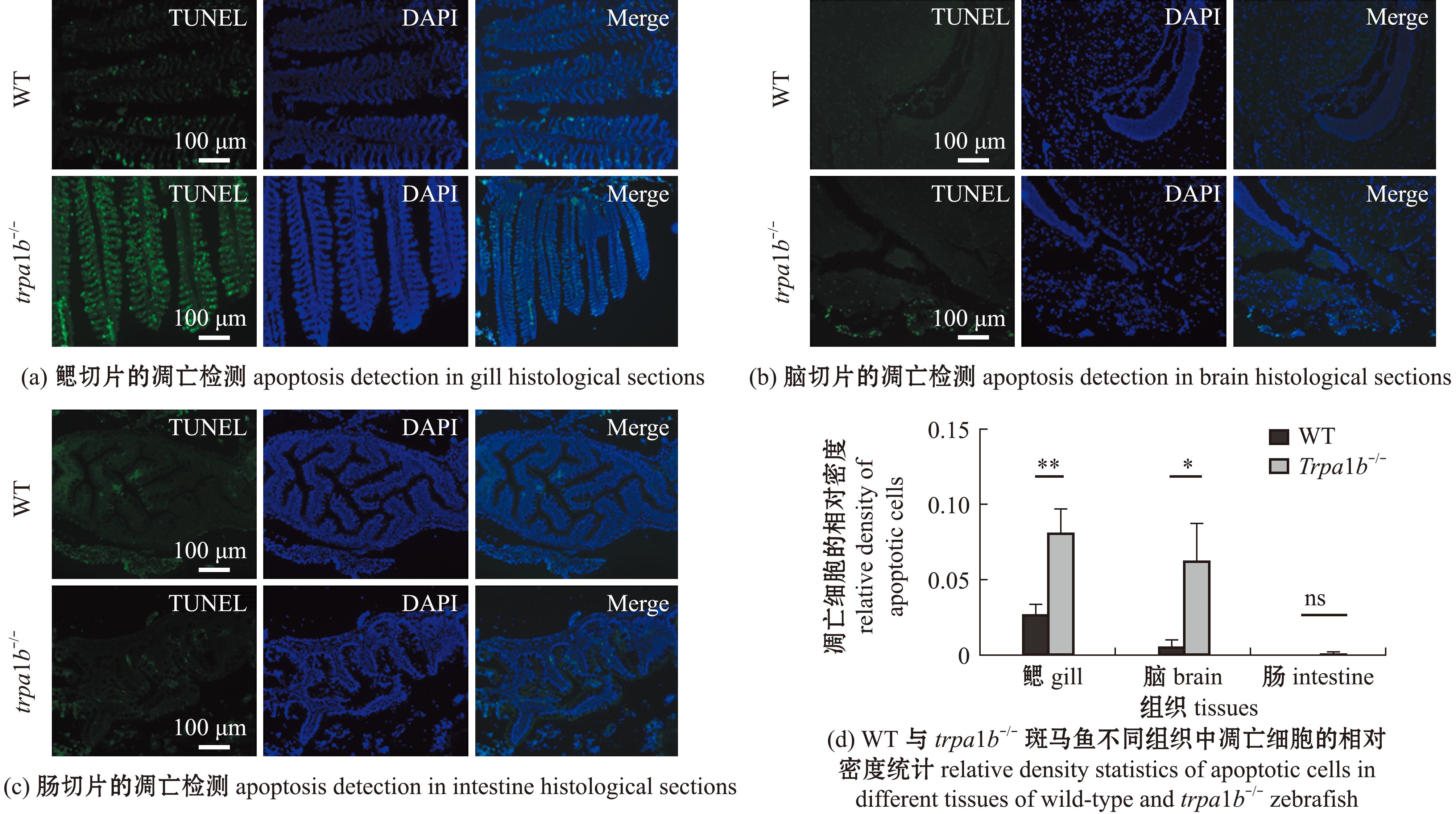
*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01)。
* means significant difference compared with the control(P<0.05);** means very significant difference compared with the control(P<0.01).
图3 野生型和trpa1b-/-斑马鱼中不同组织的切片凋亡检测
Fig.3 Apoptosis detection in different tissues of wild-type and trpa1b-/- Danio rerio
2.3 高温下trpa1b纯合子差异性基因的筛选
对28 ℃、38 ℃、40 ℃温度下的转录组数据进行分析,其差异基因数目如图4(a)所示。在38 ℃、40 ℃条件下的转录组数据中,野生型和trpa1b-/-纯合子的差异基因共有差异基因660个,其中在28 ℃下出现的差异基因有101个,因此,仅在高温条件下(38 ℃、40 ℃)有差异但28 ℃下无差异的基因共计559个(图4(b)),其中上调基因211个,下调基因348个(图4(c))。具有显著性差异的热休克蛋白共有3种,分别为HSP90蛋白家族的hsp90aa1.1、hsp90a8及HSP70家族的hspa1b。结果表明,相较于28 ℃,两种基因型斑马鱼在40 ℃时hsp90aa1.1和hspa1b均呈现极显著上调(T2 vs T0,C2 vs C0)。但同样处于40 ℃条件下,trpa1b-/-纯合子相较于野生型斑马鱼(T2 vs C2)hsp90aa1.1和hspa1b的表达量显著下降(图4(d)),因此,trpa1b基因的缺失,会导致高温下hsp90aa1.1和hspa1b表达量的显著减少。
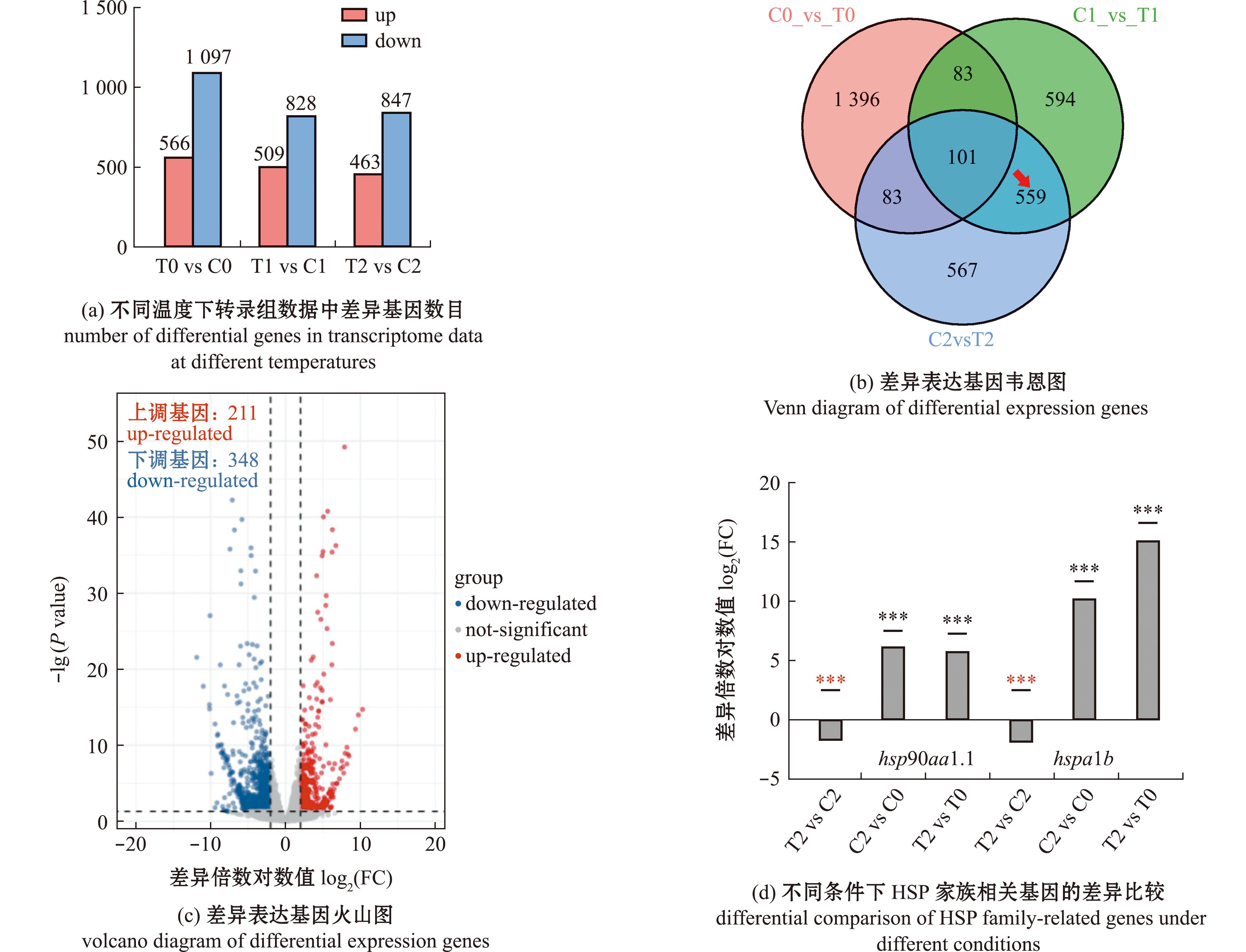
***表示P<0.001。***means P<0.001.
图4 野生型与trpa1b-/-纯合子之间的差异基因
Fig.4 Differential genes in wild-type and trpa1b-/-homozygous Danio rerio
通过对差异基因进行功能富集发现,与trpa1b功能相关的钙离子转运调节通路相关基因,cacng1a,casq2,lgals3b及homer1b基因均表现为显著性下调(图5(a)),与组织切片染色处理显示部分组织存在不同程度的细胞凋亡情况,而与之表型一致的凋亡相关信号相关基因cblb、mdm2、klhl21、arih1、trim101、dtx3及birc2基因表现为显著性下调(图5(b)),参与蛋白质水解相关泛素-蛋白转移酶活性相关基因lgals3b、mdm2、hipk1a、zgc:73226基因表现为显著性下调(图5(c)),因此这些基因的表达差异可能是导致trpa1b-/-纯合子斑马鱼在高温环境中组织表达异常的原因,进而与野生型斑马鱼在不同环境条件下生存状况存在显著性差异。
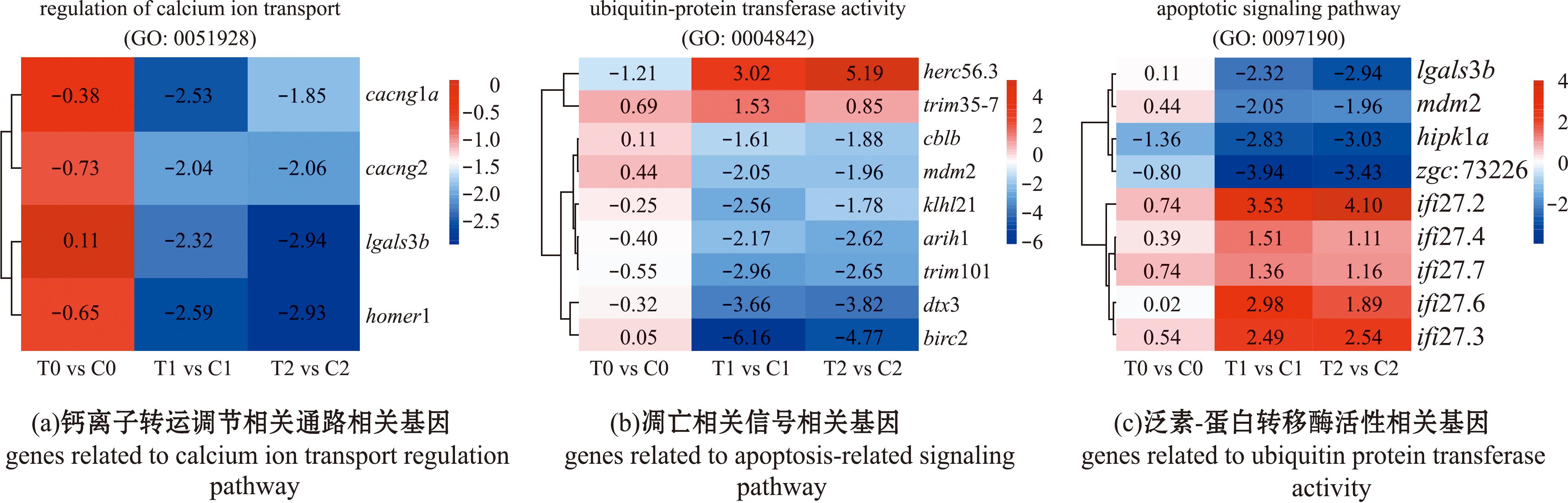
图5 关键通路的差异基因表达水平
Fig.5 Differential genes expression levels in key pathways
3 讨论
Trpa1b是一种非选择性阳离子离子通道,通过调节细胞内钙离子浓度参与感知和响应环境中的压力、温度和化学刺激,发挥着重要的痛觉传导和防御功能。为了确定trpa1b在高温耐受中是否发挥了重要作用,本研究中通过基因编辑、组织学和转录组学测序方法证明了trpa1b基因在斑马鱼高温耐受过程中发挥的重要作用。
3.1 高温胁迫下trpa1b对斑马鱼的生存影响
高温与鱼类的氧化损伤和程序性细胞死亡密切相关[24]。高温会导致鱼类体内活性氧(ROS)水平的增加。活性氧是细胞代谢过程中产生的副产品,通常在正常情况下被抗氧化酶如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPX)清除。然而,在高温条件下,这些酶的活性可能不足以完全中和过量的ROS,从而导致氧化应激[25]。通过Log-rank检验检测野生型和trpa1b-/-纯合子之间生存曲线差异,结果表明具有显著性差异(P<0.001)。高温下trpa1-/-纯合子斑马鱼相比于野生型斑马鱼存活能力的显著下降,表明trpa1b基因影响斑马鱼对于氧化应激反应的适应与生存。生物体中,细胞凋亡是一种自然发生的细胞死亡过程,对于维持组织和器官的正常功能、清除受损或多余细胞及维持内环境的稳定具有重要作用[26]。细胞凋亡主要有内源性和外源性两种途径,在内源性途径中,线粒体起着核心作用。细胞凋亡的开始可能归因于ROS水平的增加,ROS作为细胞凋亡的重要信号分子,其增多会导致细胞凋亡的发生[27]。为探究热刺激下的细胞凋亡过程,可对温度敏感的鳃、脑和肠[28]进行组织学凋亡检测,鳃是斑马鱼呼吸的重要器官,其功能异常会导致呼吸困难,影响氧气的摄入,进而影响斑马鱼的代谢和能量供应,脑细胞凋亡则直接影响斑马鱼的认知和行为能力,本研究结果表明,trpa1b-/-纯合子斑马鱼相比野生型鳃和脑组织细胞凋亡程度存在明显差异(P<0.01),而肠组织细胞凋亡无显著性变化,凋亡程度较弱。trpa1b-/-纯合子斑马鱼鳃和脑细胞的过度凋亡可能导致其组织功能异常进而影响其生存适应能力。胡玲红等[29]通过对青鳉进行温度处理,发现其鳃组织中caspase3、caspase9和p53基因的表达量显著升高,其中caspase3在不同的凋亡途径中发挥核心作用[30],并猜测其凋亡途径可能通过内在的线粒体途径。然而,热应激不仅可以诱导细胞凋亡和引发DNA损伤,还伴随其他过程,如损害其蛋白质和脂质等。因此,关于敲除trpa1b基因对斑马鱼氧化应激和免疫损伤等方面的影响,需进一步研究来明确其具体机制和影响程度,包括对基因表达、抗氧化酶活性和免疫指标等的深入观察,以评估其对斑马鱼及其他鱼类健康的影响。
3.2 trpa1b基因缺失使斑马鱼高温不耐受的可能原因分析
细胞内外钙离子浓度是TRP通道的关键性调节因子,高浓度的钙离子能够激活Trpa1离子通道[31],而钙离子的内流或局部浓度过高会使得钙通道失活[32]。在热刺激下,鳃组织的钙离子转运相关蛋白基因(cacng1a、casq2、lgals3b及homer1)表达下降,影响神经突触信号的转导和细胞内内质网钙结合蛋白的表达等。
在不利环境条件下,HSPs会使得机体耐受增强并能修复由此引起的组织损伤[33]。高温环境下,虹鳟 (Oncorhynchus mykiss)[34]等鱼类,HSP70和HSP90家族基因表达均显著上调,以维持细胞的稳定。hspa1b基因编码的HSP70的β形式,通过抑制错误折叠和聚集的多肽[35],在细胞应激和环境压力下发挥保护细胞免受损害作用,对维持细胞内稳态和生存至关重要。本试验中采用凋亡程度最为显著的鳃组织,通过多组转录组数据联合分析发现,热刺激下,分别属于HSP70和HSP90家族的hspa1b和hsp90aa1.1基因表达量上升,但在trpa1b-/-纯合子中,表达量显著性下调(P<0.001)。由此猜测在热刺激下,trpa1b基因的缺失会导致hsp90aa1.1和hspa1b基因的转录水平降低,热休克蛋白表达降低,导致细胞在热刺激下难以维持自身稳态。
细胞应激包括破坏蛋白质折叠的热刺激,由此导致错误折叠的蛋白质不断积累,进而导致包括HSP90在内的分子伴侣过载[36]。错误折叠的蛋白质能够通过蛋白酶水解去除,主要包括泛素-蛋白酶体和自噬溶酶体系统,并导致氧化应激的产生[37],而DNA和蛋白质的损伤将诱导细胞凋亡[32]。本研究中发现,由于高温下trpa1b基因缺失,细胞内钙离子转运调节(GO:0051928)受到抑制,由此钙离子参与调节的热激蛋白基因hsp90aa1.1和hspa1b基因显著下调,同时通过抑制泛素-蛋白质转移酶活性(GO:0004842),使得错误折叠的蛋白质无法及时清除,mdm2和lgals3b等基因受到抑制,引起细胞凋亡(GO:0097190)。
4 结论
1)在高温下,trpa1b-/-纯合子的温度耐受能力降低,且鳃和脑的凋亡更明显。首次证明了trpa1b基因在斑马鱼温度耐受方面不可缺少。
2)高温下,trpa1b基因的缺失抑制多种钙离子转运蛋白,影响细胞内外正常钙离子浓度,导致钙离子相关的热休克蛋白表达下降、泛素-蛋白质转移酶活性降低,细胞内错误折叠蛋白质堆积增多,细胞凋亡异常,使得trpa1b-/-纯合子斑马鱼在高温下耐受能力降低。
[1] CHABOT D,GU NETTE S.Physiology of water breathers:effects of temperature,dissolved oxygen,salinity and pH[J].Climate Change Impacts,Vulnerabilities and Opportunities Analysis of the Marine Atlantic Basin,2013:16-44.
NETTE S.Physiology of water breathers:effects of temperature,dissolved oxygen,salinity and pH[J].Climate Change Impacts,Vulnerabilities and Opportunities Analysis of the Marine Atlantic Basin,2013:16-44.
[2] HOEKSTRA L A,JULICK C R,MIKA K M,et al.Energy demand and the context-dependent effects of genetic interactions underlying metabolism[J].Evolution Letters,2018,2(2):102-113.
[3] ARISPE N,DE MAIO A.ATP and ADP modulate a cation channel formed by Hsc70 in acidic phospholipid membranes[J].Journal of Biological Chemistry,2000,275(40):30839-30843.
[4] DIMAURO I,MERCATELLI N,CAPOROSSI D.Exercise-induced ROS in heat shock proteins response[J].Free Radical Biology and Medicine,2016,98:46-55.
[5] DEMYANENKO S V,PITINOVA M A,DZREYAN V A,et al.Therole of p53 protein in the realization of the exogenous heat shock protein 70 anti-apoptotic effect during axotomy[J].Cells,2021,11(1):93.
[6] BERKA M,KOPECK R,BERKOV
R,BERKOV V,et al.Regulation of heat shock proteins 70 and their role in plant immunity[J].Journal of Experimental Botany,2022,73(7):1894-1909.
V,et al.Regulation of heat shock proteins 70 and their role in plant immunity[J].Journal of Experimental Botany,2022,73(7):1894-1909.
[7] KREGEL K C.Heat shock proteins:modifying factors in physiological stress responses and acquired thermotolerance[J].Journal of Applied Physiology,2002,92(5):2177-2186.
[8] BASU N,TODGHAM A E,ACKERMAN P A,et al.Heat shock protein genes and their functional significance in fish[J].Gene,2002,295(2):173-183.
[9] BANDELL M,STORY G M,HWANG S W,et al.Noxious cold ion channel TRPA1 is activated by pungent compounds and bradykinin[J].Neuron,2004,41(6):849-857.
[10] BAUTISTA D M,JORDT S E,NIKAI T,et al.TRPA1 mediates the inflammatory actions of environmental irritants and proalgesic agents[J].Cell,2006,124(6):1269-1282.
[11] ZURBORG S,YURGIONAS B,JIRA J A,et al.Direct activation of the ion channel TRPA1 by Ca2+[J].Nature Neuroscience,2007,10:277-279.
[12] KARASHIMA Y,TALAVERA K,EVERAERTS W,et al.TRPA1 acts as a cold sensor in vitro and in vivo[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(4):1273-1278.
[13] CHEN J,KANG D,XU J,et al.Species differences and molecular determinant of TRPA1 cold sensitivity[J].Nature Communications,2013,4:2501.
[14] KANG K,PANZANO V C,CHANG E C,et al.Modulation of TRPA1 thermal sensitivity enables sensory discrimination in Drosophila[J].Nature,2012,481:76-80.
[15] GRACHEVA E O,INGOLIA N T,KELLY Y M,et al.Molecular basis of infrared detection by snakes[J].Nature,2010,464:1006-1011.
[16] SAITO S,NAKATSUKA K,TAKAHASHI K,et al.Analysis of transient receptor potential ankyrin 1 (TRPA1) in frogs and lizards illuminates both nociceptive heat and chemical sensitivities and coexpression with TRP vanilloid 1 (TRPV1) in ancestral vertebrates[J].Journal of Biological Chemistry,2012,287(36):30743-30754.
[17] ODA M,KUROGI M,KUBO Y,et al.Sensitivities of two zebrafish TRPA1 paralogs to chemical and thermal stimuli analyzed in heterologous expression systems[J].Chemical Senses,2016,41(3):261-272.
[18] ODA M,KUBO Y,SAITOH O.Sensitivity of Takifugu TRPA1 to thermal stimulations analyzed in oocytes expression system[J].Neuroreport,2018,29(4):280-285.
[19] ODA M,SAITO K,HATTA S,et al.Chemical and thermal sensitivity of medaka TRPA1 analyzed in heterologous expression system[J].Biochemical and Biophysical Research Communications,2017,494(1/2):194-201.
[20] LIU H T,LI B,SHANG Z L,et al.Calmodulin is involved in heat shock signal transduction in wheat[J].Plant Physiology,2003,132(3):1186-1195.
[21] LIU H T,GAO F,LI G L,et al.The calmodulin-binding protein kinase 3 is part of heat-shock signal transduction in Arabidopsis thaliana[J].The Plant Journal:for Cell and Molecular Biology,2008,55(5):760-773.
[22] ZHANG W,ZHOU R G,GAO Y J,et al.Molecular and genetic evidence for the key role of AtCaM3 in heat-shock signal transduction in Arabidopsis[J].Plant Physiology,2009,149(4):1773-1784.
[23] JINEKM,CHYLINSKI K,FONFARA I,et al.A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J].Science,2012,337(6096):816-821.
[24] CHEN X X,ZHANG L,LI J L,et al.Hydrogen peroxide-induced change in meat quality of the breast muscle of broilers is mediated by ROS generation,apoptosis,and autophagy in the NF-κB signal pathway[J].Journal of Agricultural and Food Chemistry,2017,65(19):3986-3994.
[25] PICHAUD N,EKSTRÖM A,BRETON S,et al. Adjustments of cardiac mitochondrial phenotype in a warmer thermal habitat is associated with oxidative stress in European perch,Perca fluviatilis[J].Sci Rep,2020,10(1): 17697.
[26] MA X, NI J, WANG W,et al. Protective effect of epigallocatechin-3-gallate against hepatic oxidative stress induced by tert-butyl hydroperoxide in yellow-feathered broilers[J].Antioxidants (Basel),2024,13(10).
[27] OBIANWUNA U E,OLEFORUH-OKOLEH V U,WANG J,et al. Potential implications of natural antioxidants of plant origin on oxidative stability of chicken albumen during storage:a review[J].Antioxidants (Basel),2022,11(4).
[28] TATTERSALL G J,SINCLAIR B J,WITHERS P C,et al.Coping with thermal challenges:physiological adaptations to environmental temperatures[J].Comprehensive Physiology,2012,2(3):2151-2202.
[29] 胡玲红,王映,王化敏,等.不同温度胁迫对青鳉鳃凋亡的影响[J].大连海洋大学学报,2021,36(6):929-936.
HU L H,WANG Y,WANG H M,et al.Effects of different temperature stress on gill apoptosis of medaka Oryzias latipes[J].Journal of Dalian Ocean University,2021,36(6):929-936.(in Chinese)
[30] YAN Y,CHEN X,HUANG J,et al. H2O2-induced oxidative stress impairs meat quality by inducing apoptosis and autophagy via ROS/NF-κB signaling pathway in broiler thigh muscle[J]. Poult Sci, 2022,101(4):101759.
[31] KURGANOVE,SAITO S,TANAKA SAITO C,et al.Requirement of extracellular Ca2+ binding to specific amino acids for heat-evoked activation of TRPA1[J].The Journal of Physiology,2017,595(8):2451-2463.
[32] WANG Y Y,CHANG R B,WATERS H N,et al.The nociceptor ion channel TRPA1 is potentiated and inactivated by permeating calcium ions[J].Journal of Biological Chemistry,2008,283(47):32691-32703.
[33] LIUX,KANG Z W,YU X L,et al.Role of TRP channels and HSPs in thermal stress response in the aphid parasitoid Aphelinus asychis (Hymenoptera:Aphelinidae)[J].Journal of Integrative Agriculture,2020,19(6):1530-1542.
[34] ZHOU C Q,KA W,YUAN W K,et al.The effect of acute heat stress on the innate immune function of rainbow trout based on the transcriptome[J].Journal of Thermal Biology,2021,96:102834.
[35] DEKA K,SAHAS.Regulation of mammalian HSP70 expression and stress response[J].Regulation of Heat Shock Protein Responses,2018:3-25.
[36] HAN B S,LUO J T,JIANG P L,et al.Inhibition of embryonic HSP 90 function promotes variation of cold tolerance in zebrafish[J].Frontiers in Genetics,2020,11:541944.
[37] GREGERSEN N,BROSSP.Protein misfolding and cellular stress:an overview[J].Protein Misfolding and Cellular Stress in Disease and Aging:Concepts and Protocols,2010:3-23.