有些微藻可以附着在基质表面生长,有利于藻类发育和优化生物量富集状态,从而提高其对水体中营养盐的吸收率[1]。当基质上的微藻积累到一定程度后可以通过外物刮除或挤压等方式收获藻类,使微藻采收技术更加简单,减少了投资费用[2],增强了环境耐受性[3]。
目前,研究人员通常使用小球藻(Chlorella)等绿藻作为目标藻,当光照强度为99 μmol/(m2·s)时才可达到小球藻最适光强[4],同时因为小球藻属于浮游藻类,不利于长时间附着在基质材料上。卵形藻(Cocconei sp.)细胞扁平,能够分泌丰富的胞外聚合物,具有附着能力[5],与其他附着型硅藻相比,卵形藻对环境的变化反应更加敏感且在受到干扰后群落恢复能力较快,延长了硅藻生物膜的使用时间,同时附着型硅藻的光合能力较强,无论是弱光还是强光,附着型硅藻都能够正常生长[6]。
藻类生物膜的应用效果不仅与藻种有关,还与其附着基质材料密切相关[7],Zhang等[8]以松木屑、甘蔗渣、稻壳、弹性填料和石英砂为基质,发现表面粗糙度可以影响藻类细胞在基质表面的附着量,但因其基质为颗粒状,不易制备为片状,限制了该类基质的应用。Venable等[7]通过鱼腥藻和小球藻的混合培养物在平纹细布、烯烃、培纶、涤纶和尼龙上生长情况分析发现,烯烃最大程度促进了生物量的增长,培纶材料易分解,不利于经济环保。Niloofar等[9]采用毛细陶瓷膜作为微藻表面附着培养的基质,并对附着在该基质上的普通小球藻进行了培养,研究发现,培养8 d的小球藻生物量生长力最高,为(4.65±0.42)ind./mL,但其基质材料成本较高。因此,选择易得、经济实用且为环境友好型材料作为基质是其能够被广泛使用的前提条件。
海洋生态系统的氮循环中,氨氮通常被认为是再生氮,它是由水生动物排泄和细菌对沉积物和水体中有机氮化合物的再生循环产生的[10],而氨氮对水生生物具有一定毒性[11],《污水综合排放标准》显示,氨氮浓度需要降至50 mg/L时才可达到排放标准[12],研究人员利用藻类能够通过光合作用吸收氨氮进行生命活动的特性,将其应用于氨氮的吸收处理中[13]。Craggs等[14]在波纹滚道表面反应器内接种三角褐指藻和颤藻处理海洋排污口处污水,可完全吸收污水中的氨氮。栅藻生物膜对高浓度氨氮有较强的耐受性,能更有效地吸收氨氮,在5 d内能吸收富营养化水体中93.8%的氨氮[15]。Cheng等[16]将废水稀释5倍后,使用小球藻生物膜吸收废水中氨氮,其吸收率可达94.1%。然而,已研究报道的藻生物膜主要以浮游型微藻为主,有关附着型硅藻生物膜构建及处理氨氮的研究尚不多见。
本研究中,以卵形藻为研究对象,拟从帆布网、亚麻布网、涤纶网和聚乙烯网等4种基质中筛选相对最适合卵形藻附着生长的一种基质,在此基础上探究其建膜的适宜光照强度,并研究了该藻生物膜在不同光照条件下对氨氮的吸收情况,以期为微藻生物膜在营养盐吸收过程中的实际应用和推广提供参考。
1 材料与方法
1.1 材料
1.1.1 藻种及培养 卵形藻由烟台大学生命科学学院生物资源与环境工程研究室提供,利用加硅F/2培养基培养[17],置于温度为(20±2) ℃,光照强度为54 μmol/(m2·s),光照周期为12 L∶12 D的培养箱中培养7 d,收获用于后续生物膜接种。
1.1.2 基质材料 选用麻布网、帆布网、涤纶网及聚乙烯网4种材料作为生物膜基质,试验前经过去离子水清洗两遍后于70 ℃烘箱中烘干备用。
1.2 方法
1.2.1 卵形藻生物膜的构建 试验中4种基质材料,均裁剪为大小为3 cm×3 cm的正方形,置于13 cm×22 cm×17 cm玻璃器皿底部,设置3组平行。加入密度为1×105 ind./mL的卵形藻,置于温度为(22±2) ℃,光照强度为54 μmol/(m2·s),光照周期为12 L∶12 D的F/2培养基中静态培养13 d,形成卵形藻生物膜,每2 d测定细胞密度,每4 d进行形态学观察,在7、13 d时测定光合色素含量。选取附着效果良好的基质作为后续试验附着基质。
1.2.2 光照强度对卵形藻附膜影响 通过光照强度单因素试验确定后续试验的光照条件。将“1.2.1节”中制备的卵形藻密度为1×105 ind./mL的帆布网基质藻生物膜置于硅藻生物膜培养装置中(图1),每个装置中放置一张生物膜,设置3组平行。分别置于不同光照强度[0、1.8、18、54、90、126 μmol/(m2·s)]下,培养温度为(20±2) ℃,光照周期为12 L∶12 D的F/2培养基中培养,采用批次培养模式,培养9 d。每2 d测定细胞密度和Fv/Fm,每3 d测定光合色素。
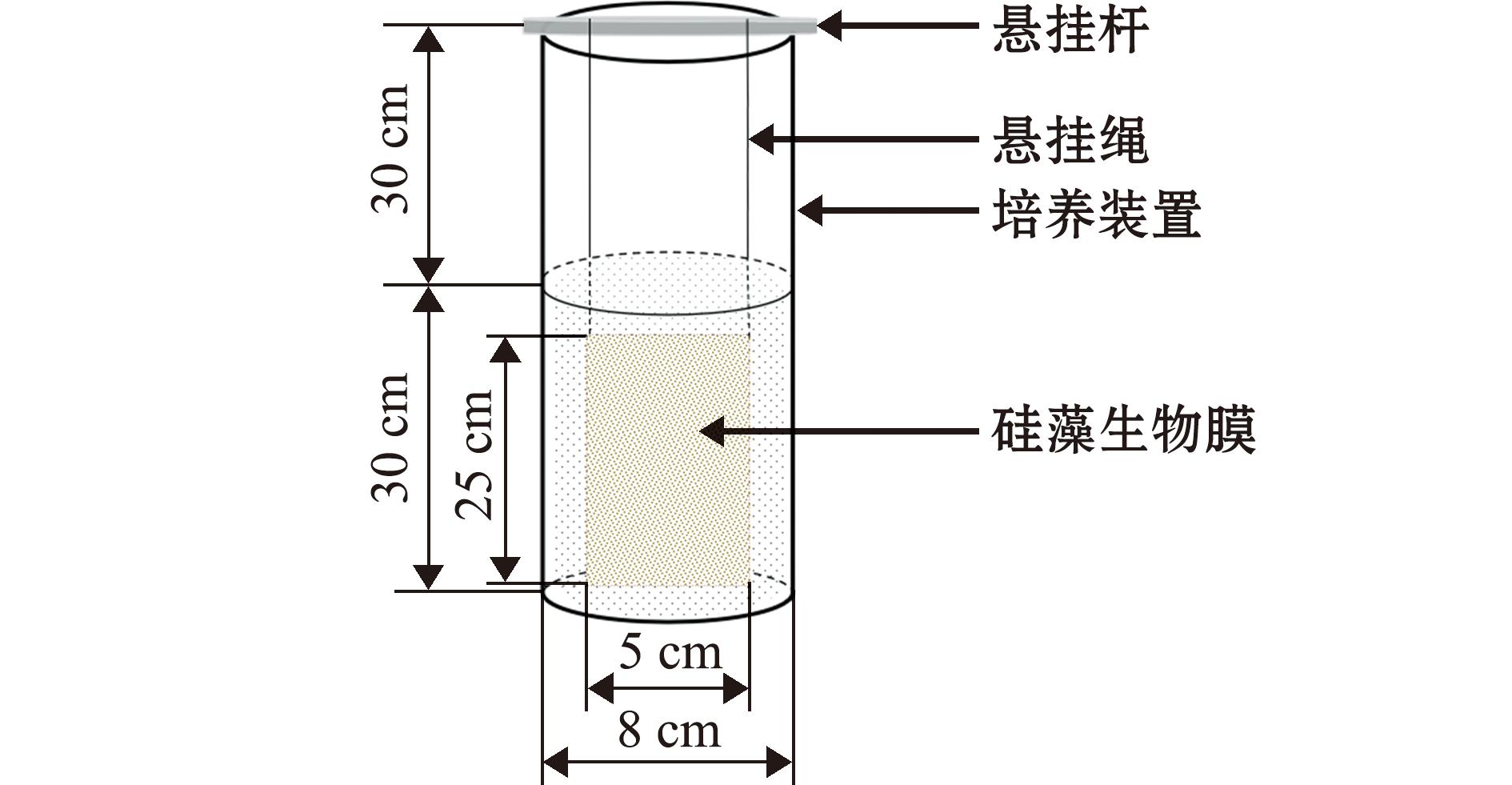
图1 硅藻生物膜培养装置
Fig.1 Diatom biofilm culture apparatus
1.2.3 不同光照条件下卵形藻帆布生物膜对![]() 吸收量 挑选“1.2.1节”中制备的密度为1×105 ind./mL的帆布网基质卵形藻生物膜,试验设计见表1。置于温度为(20±2) ℃,光照周期为12 L∶12 D的氨氮水体中培养。分别于0、24、48、72、96、120、144 h取氨氮水体,设置3组平行,经0.45 μm混合纤维素酯膜过滤后测定培养液中
吸收量 挑选“1.2.1节”中制备的密度为1×105 ind./mL的帆布网基质卵形藻生物膜,试验设计见表1。置于温度为(20±2) ℃,光照周期为12 L∶12 D的氨氮水体中培养。分别于0、24、48、72、96、120、144 h取氨氮水体,设置3组平行,经0.45 μm混合纤维素酯膜过滤后测定培养液中![]() 浓度、pH、藻细胞密度、Fv/Fm及类胡萝卜素含量。
浓度、pH、藻细胞密度、Fv/Fm及类胡萝卜素含量。
表1 卵形藻生物膜对![]() 吸收量
吸收量![]() absorption experiment of Cocconei sp. biofilm
absorption experiment of Cocconei sp. biofilm

NH4Cl浓度/ (mmol·L-1)NH4Cl concentration培养光强/ (μmol·m-2·s-1)culture light intensity取样时间/ h time测定指标determination018,54,902018,54,900,24,48,72,96,120,144培养液中NH+4-N浓度、pH、藻生物量、Fv/Fm及类胡萝卜素含量6018,54,9010018,54,90
1.2.4 形态学观察 利用硅胶刷或硅藻刀将藻细胞从基质上刮下,置于载玻片上,使用光学显微镜对其生长状态进行观察。
为进一步了解微藻细胞贴附生长的微观状态,参考Surman等[18]试验方法,利用扫描电子显微镜进行形态观察。
1.2.5 卵形藻细胞密度测定 为量化附着在膜上的卵形藻数量,采用血球计数板计数法测定细胞密度。利用硅胶刷或刮藻刀在生物膜上同方向刮8~10次,使附着的卵形藻从膜上脱离,直至在显微镜下观察基质上微藻细胞数小于5个,认定为卵形藻已收集完全,将脱离的卵形藻重新悬浮在10 mL浓度为1.5 mol/L氯化钠溶液中,以保持渗透平衡并防止细胞溶解。在样本采集后,立即使用血球计数板进行计数,计算公式为
N=n/80×400×104。
(1)
式中:N为细胞密度(ind./mL);n为80个中格藻总个数(ind.)。
1.2.6 卵形藻光合色素测定 采用丙酮法[19]测定的卵形藻光合色素有叶绿素a(Chl-a)、叶绿素c(Chl-c)和类胡萝卜素(Car)。利用式(2)~(4)计算650、665、470 nm处的样本吸光度值,计算公式为
Chl-a=11.47×Abs665-0.40×Abs650,
(2)
Chl-c=24.36×Abs650-3.73×Abs665,
(3)
Car=(1 000Abs470-2.05×Chl-a)/245。
(4)
1.2.7 卵形藻最大光量子产量Fv/Fm Fv/Fm的测量方法:取2 mL藻液加入比色皿,将比色皿置于黑暗环境,15 min后使用手持便携式叶绿素荧光仪(AquaPen)测量Fv/Fm。
1.2.8 水体氨氮含量和pH的测定 采用次溴酸盐氧化法[20]测定氨氮。采用pH计(pHS-3C)对水体进行pH检测。
量取10 mL已过滤的水样分别置于25 mL具塞比色管中,测定水样的吸光度Aw;量取1 mL刚配制的次溴酸钠溶液于25 mL具塞比色管中,立即加入1 mL磺胺溶液,混匀放置5 min后加10 mL水,然后加入0.2 mL盐酸萘乙二胺溶液,15 min后测定分析空白的吸光值A。
用线性回归方程计算总浓度,按式(5)计算水样中氨氮的浓度,计算公式为
(5)
式中:![]() 为氨氮浓度(mg/L);NT为查工作曲线获得的氨氮(包括亚硝酸盐氮)浓度
为氨氮浓度(mg/L);NT为查工作曲线获得的氨氮(包括亚硝酸盐氮)浓度![]() 为亚硝酸盐氮浓度(mg/L)。
为亚硝酸盐氮浓度(mg/L)。
1.3 数据处理
采用WPS Office 软件对试验数据进行统计,试验结果用平均值±标准差(mean±S.D.)表示。采用SPSS 18.0软件进行显著性分析。使用t检验确定各处理组与对照组间的差异性。采用GraphPad Prism 9.4.0软件及origin 2021软件进行图表的绘制,显著性水平设为0.05。
2 结果与分析
2.1 附着型硅藻生物膜的筛选
2.1.1 附着型硅藻生物膜形态学观察 卵形藻在不同基质上附着细胞密度随时间变化如图2所示,从图2可见,卵形藻在4种基质上均可正常生长,颜色均逐步加深,卵形藻细胞密度逐步增加。在培养5 d后,基质材料开始呈现棕褐色,此时基质材料上已附着一层硅藻生物膜。通过扫描电镜结果显示,在9 d时,卵形藻已附着于基质上(图3),帆布网(图3(a))和亚麻布网(图3(b))上附着的卵形藻细胞相比于聚乙烯网(图3(c))和涤纶网(图3(d))更多。

图2 卵形藻生物膜附膜图
Fig.2 Membrane attachment diagram of Cocconei sp. biofilm

图3 卵形藻生物膜电镜图(×400)
Fig.3 SEM of Cocconei sp.biofilm(×400)
2.1.2 基质上卵形藻的细胞密度 图4为卵形藻细胞密度在不同基质材料上随时间的变化。从图4可见,卵形藻均可在4种基质上生长。通过方差分析,4种基质材料上硅藻细胞量有显著性差异(P<0.05),在培养9 d时,4种基质上卵形藻细胞密度均达到最大值,在13 d时帆布基质材料上藻细胞密度最高,为(1.80±0.52)×106 ind./mL。
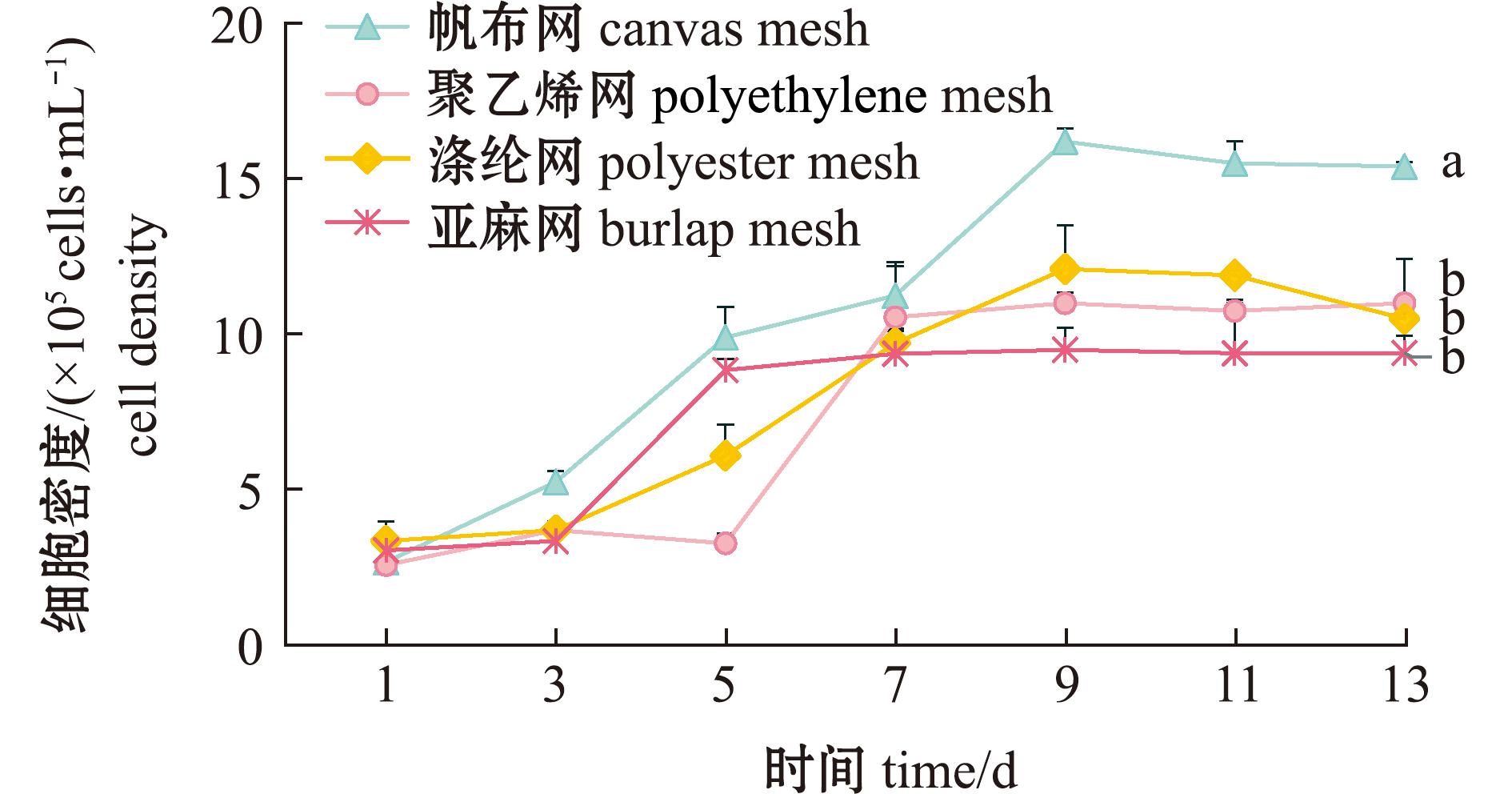
标有不同字母者表示同一时间下不同组间有显著性差异(P<0.05),下同。
The means with different letters in same indicator are significant differences in different groups at the 0.05 probability level,et sequentia.
图4 基质材料对卵形藻细胞密度的影响
Fig.4 Effect of substrate materials on the biomass of Cocconei sp.
除涤纶外,其他3种基质生物膜的细胞密度在9~13 d趋于稳定,且帆布的生物膜细胞密度在7~13 d时显著高于其他试验组(P<0.05)。
2.1.3 基质上卵形藻光合色素含量的变化 不同基质材料制备的卵形藻生物膜含量变化显著(P<0.05),试验结束后,叶绿素a的含量组间有显著性差异,帆布组可达到(11.8±1.3) mg/g,同时其叶绿素c含量也显著高于其他试验组(P<0.05),能够达到(3.58±2.4) mg/g,类胡萝卜素的含量为(3.21±2.1) mg/g,显著高于其他试验组(P<0.05),而聚乙烯网类胡萝卜素的含量(1.3 mg/g)显著低于其他试验组(图5)(P<0.05)。综合卵形藻细胞密度及叶绿素含量,选择帆布网进行后续试验。
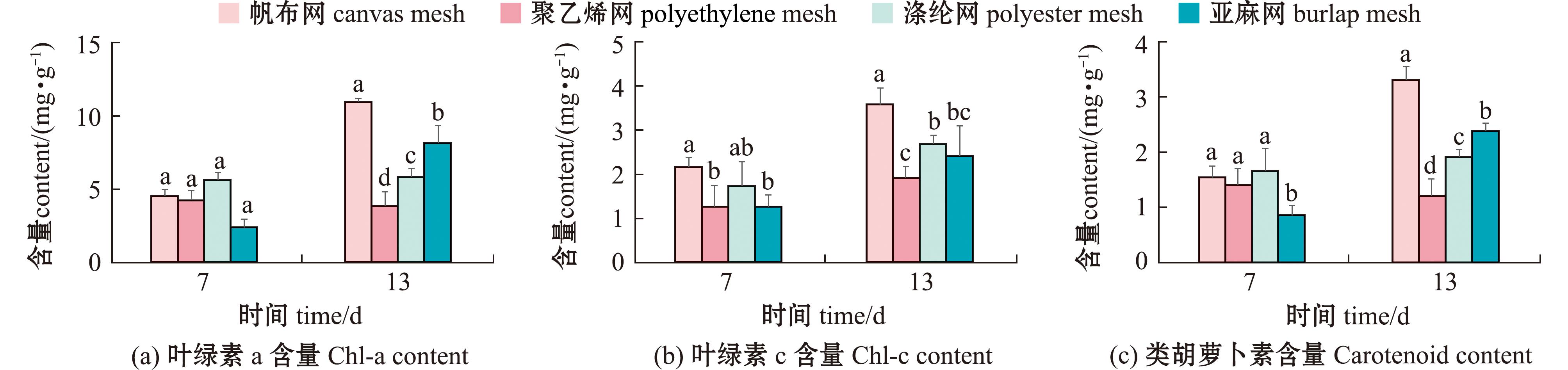
图5 基质材料上卵形藻光合色素含量的变化
Fig.5 Effect of substrate materials on photosynthetic pigment content of Cocconei sp.
2.2 光照强度对卵形藻附膜的影响
2.2.1 光照强度对卵形藻细胞密度的影响 不同光照下生物膜上卵形藻细胞密度随时间的变化如图6(a)所示,从图6(a)可见,在培养周期内,卵形藻细胞密度在不同光照下均可生长,而不同组间呈现出不同的生长趋势。5 d内,细胞密度均呈增长趋势,5 d后,光照强度126 μmol/(m2·s)组开始呈现下降趋势,最高细胞密度只能达到1.06×105 ind./mL。在9 d时,54 μmol/(m2·s)组细胞密度显著高于其他组(P<0.05),为4.02×106 ind./mL,而其他3组间无显著性差异(P>0.05)。
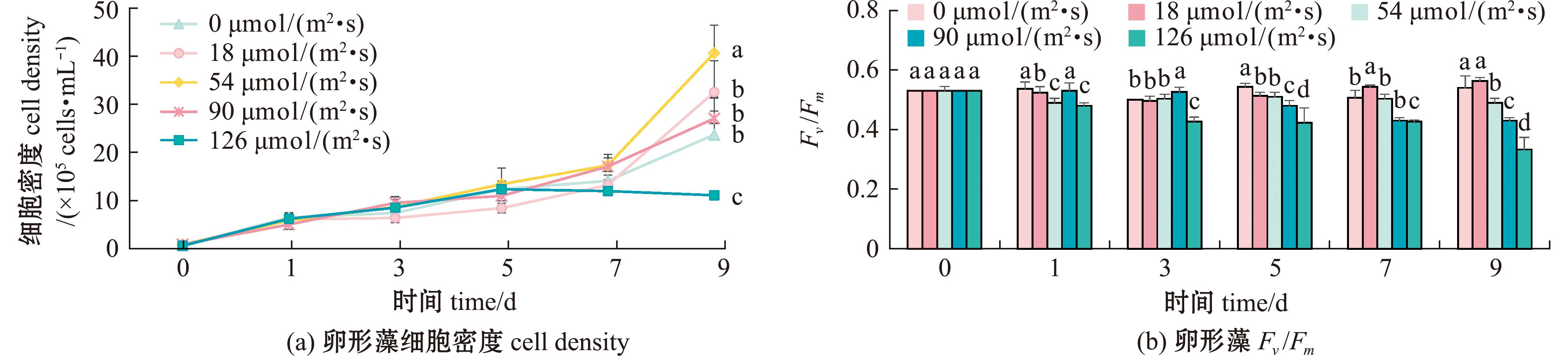
图6 光照对生物膜上卵形藻密度的影响
Fig.6 Effect of light on the biomass of Cocconei sp.
2.2.2 光照强度对卵形藻Fv/Fm的影响 图6(b)为不同光照条件下生物膜上卵形藻Fv/Fm随时间的变化。在培养周期内,除126 μmol/(m2·s)组外,其余组均处于0.4以上。当光照高于54 μmol/(m2·s)时,随光照强度持续增加,逐渐下降,其中,126 μmol/(m2·s)组Fv/Fm持续降低,且在9 d时显著低于其他光照强度组(P<0.05),为0.34±0.30。当光照强度为18 μmol/(m2·s)时,卵形藻Fv/Fm最高,为0.58±0.10。
2.2.3 光照强度对卵形藻光合色素含量的影响 不同光照下生物膜上卵形藻光合色素含量随时间的变化如图7所示。从图7可见,随着时间延长,光合色素含量逐步积累。当光照为54 μmol/(m2·s)时,光合色素含量显著高于其他组(P<0.05),叶绿素a含量达到(2.59±2.01)mg/g,叶绿素c含量达(3.61±1.63)mg/g,类胡萝卜素含量达到(1.00±2.11)mg/g。研究表明,光照强度126 μmol/(m2·s)时卵形藻光合作用较弱,故后续试验选择18、54、90 μmol/(m2·s)光照强度。
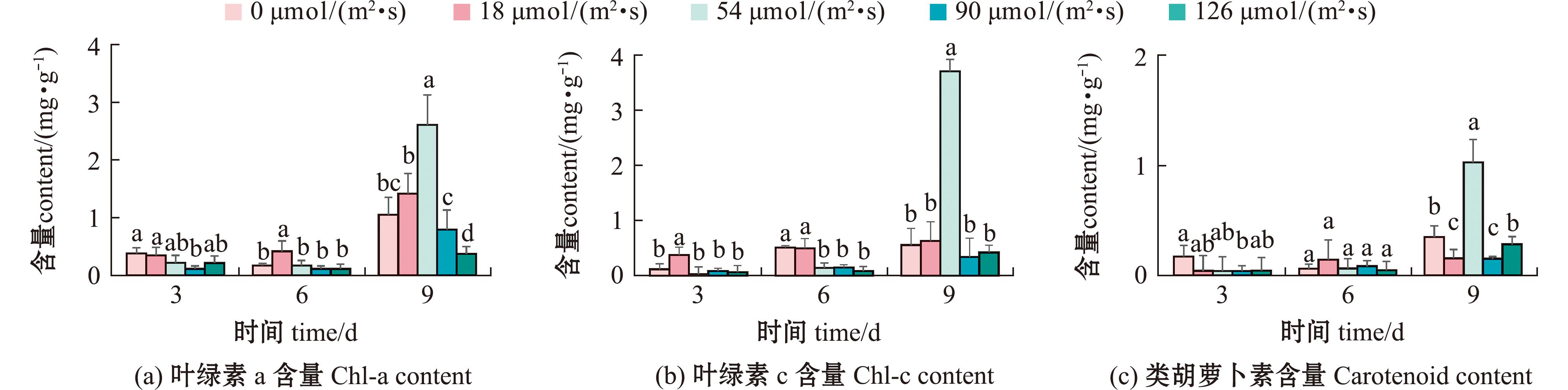
图7 光照强度对生物膜上卵形藻光合色素含量的影响
Fig.7 Effect of light intensity on photosynthetic pigment content of Cocconei sp. on biofilm
2.3 光照强度对附膜卵形藻氨氮吸收及其生长状态的影响
2.3.1 附膜卵形藻对氨氮的吸收 不同光照下卵形藻帆布生物膜对水体![]() 含量的影响如图8。从图8可见,在各个光照条件下,随着培养时间的延长,水体中
含量的影响如图8。从图8可见,在各个光照条件下,随着培养时间的延长,水体中![]() 浓度均呈现降低趋势,且培养至96 h时20 mmol/L组基本降至0 mmol/L,为不完全吸收,96 h后趋于平缓,60、100 mmol/L组达到完全吸收,且
浓度均呈现降低趋势,且培养至96 h时20 mmol/L组基本降至0 mmol/L,为不完全吸收,96 h后趋于平缓,60、100 mmol/L组达到完全吸收,且![]() 初始浓度越高,吸收速率越快。当浓度为60 mmol/L时,54、90 μmol/(m2·s)组
初始浓度越高,吸收速率越快。当浓度为60 mmol/L时,54、90 μmol/(m2·s)组![]() 吸收效果显著高于18 μmol/(m2·s)(P<0.05)。
吸收效果显著高于18 μmol/(m2·s)(P<0.05)。
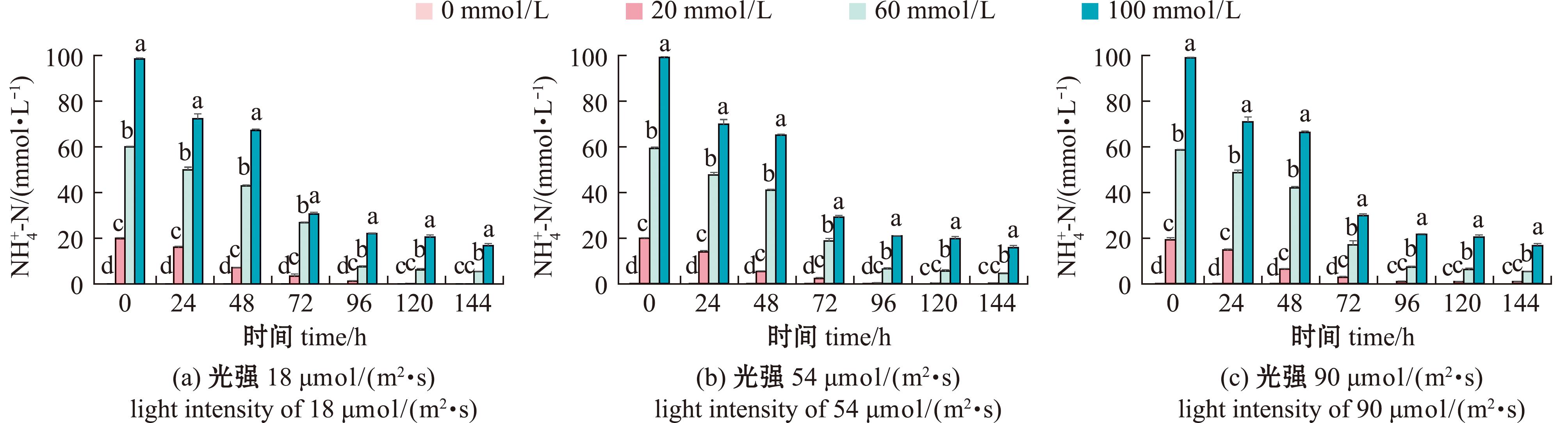
图8 光照条件对卵形藻帆布生物膜对水体![]() 含量的影响
含量的影响
Fig.8 Effects of light conditions on ![]() content in water with the canvas biofilm of Cocconei sp.
content in water with the canvas biofilm of Cocconei sp.
2.3.2 水体中pH的变化 在测定氨氮的同时对水体pH也进行了检测(图9),结果发现,在不同光照条件下,随着培养时间延长,水体中pH呈现先下降后上升趋势,且在48 h时pH达到最低。在光照强度分别为18、54 μmol/(m2·s)时,随着培养时间的延长,各浓度氨氮组pH均有不同幅度下降。
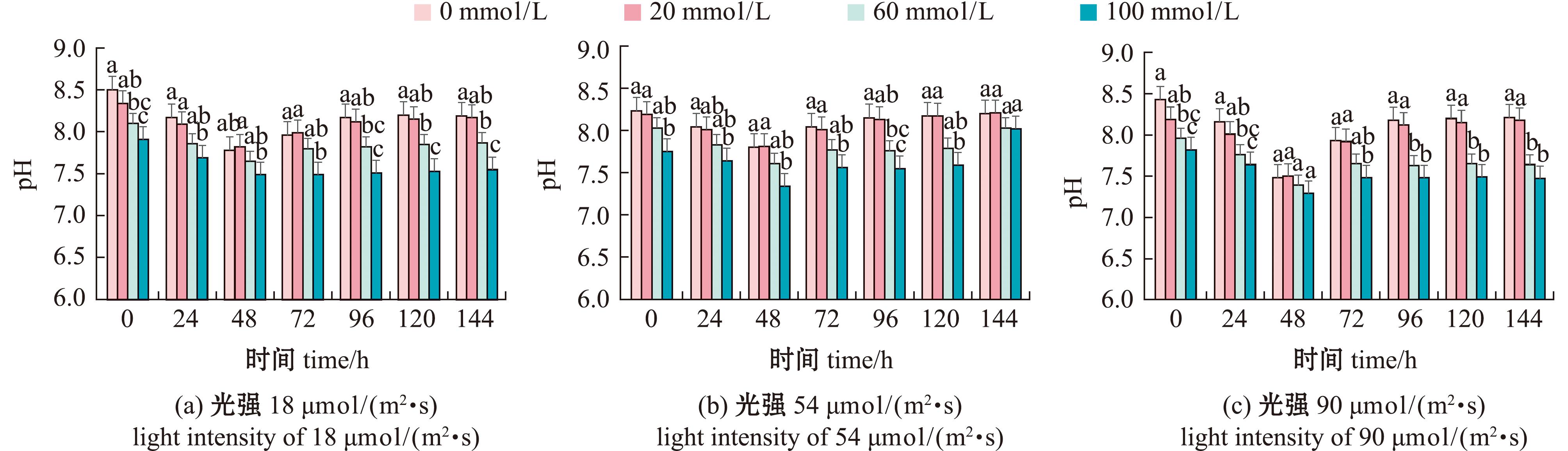
图9 光照条件对卵形藻帆布生物膜对水体pH的影响
Fig.9 Effect of light conditions on pH in water of the Cocconei sp. canvas biofilm
2.3.3 附膜卵形藻细胞密度的变化 在不同光照条件,不同氨氮浓度下生物膜上卵形藻细胞密度随时间的变化如图10所示,从图10可见,卵形藻细胞密度在不同光强均可快速生长。在培养期间,细胞密度呈现稳步增长,培养结束后,氨氮浓度为60 mmol/L组卵形藻细胞密度显著高于其他组(P<0.05),达到(2.90±0.12)×106 ind./mL。
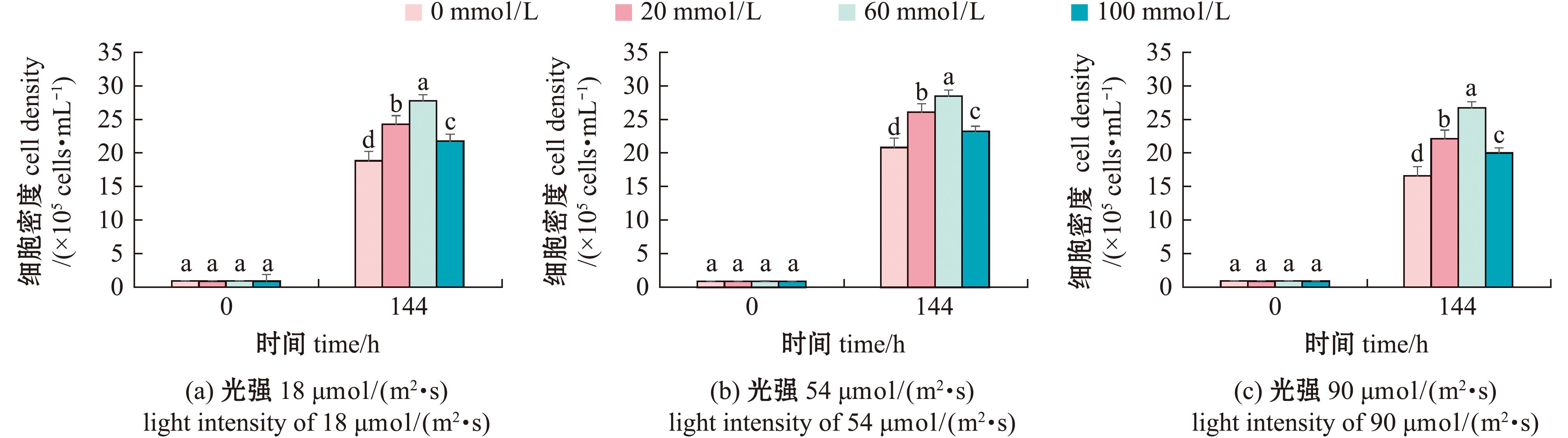
图10 光照条件对卵形藻帆布生物膜上卵形藻细胞密度变化
Fig.10 Changes in cell density on Cocconei sp.canvas biofilm under light conditions
2.3.4 附膜卵形藻Fv/Fm的变化 光照、初始![]() 浓度对卵形藻Fv/Fm影响显著(P<0.05),从图11可见,在90 μmol/(m2·s)时,初始浓度为0 mmol/L条件下卵形藻Fv/Fm显著高于其他浓度(P<0.05)。光照强度为18 μmol/(m2·s)时,60、100 mmol/L条件下的卵形藻除120、144 h外,其Fv/Fm均显著低于其他试验组(P<0.05)。当光照强度为54 μmol/(m2·s)时,60 mmol/L条件下的卵形藻除120、144 h外,其他时间点均显著低于0、20 mmol/L试验组(P<0.05);而100 mmol/L条件下的卵形藻始终显著低于前两个试验组(P<0.05)。当光照强度达到90 μmol/(m2·s)时,60 mmol组的Fv/Fm显著高于100 mmol组(P<0.05)。
浓度对卵形藻Fv/Fm影响显著(P<0.05),从图11可见,在90 μmol/(m2·s)时,初始浓度为0 mmol/L条件下卵形藻Fv/Fm显著高于其他浓度(P<0.05)。光照强度为18 μmol/(m2·s)时,60、100 mmol/L条件下的卵形藻除120、144 h外,其Fv/Fm均显著低于其他试验组(P<0.05)。当光照强度为54 μmol/(m2·s)时,60 mmol/L条件下的卵形藻除120、144 h外,其他时间点均显著低于0、20 mmol/L试验组(P<0.05);而100 mmol/L条件下的卵形藻始终显著低于前两个试验组(P<0.05)。当光照强度达到90 μmol/(m2·s)时,60 mmol组的Fv/Fm显著高于100 mmol组(P<0.05)。
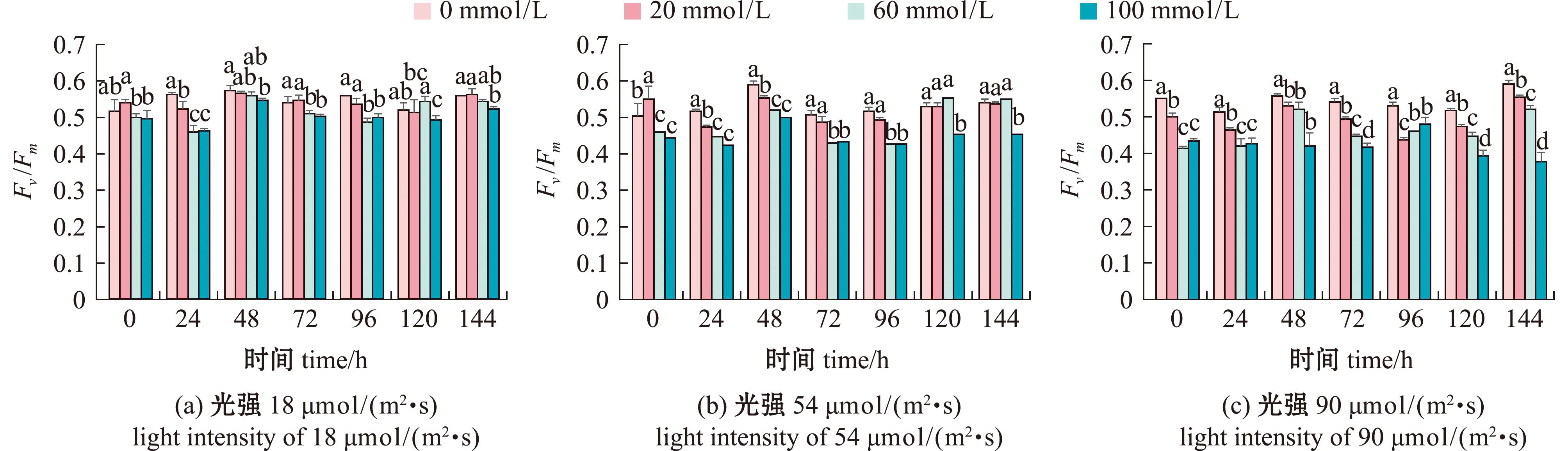
图11 光照条件对卵形藻帆布生物膜上的卵形藻Fv/Fm
Fig.11 Light conditions for Fv/Fm on Cocconei sp. canvas biofilm
2.3.5 卵形藻类胡萝卜素的变化 在测定卵形藻细胞密度及Fv/Fm的同时也测定了生物膜上所附着的卵形藻的类胡萝卜素含量(图12),从图12可见,培养结束后,在光强为54 μmol/(m2·s)组类胡萝卜素积累最多,其中当氨氮浓度为60 mmol/L时类胡萝卜素含量达到最高,为(0.52±0.013)mg/g。
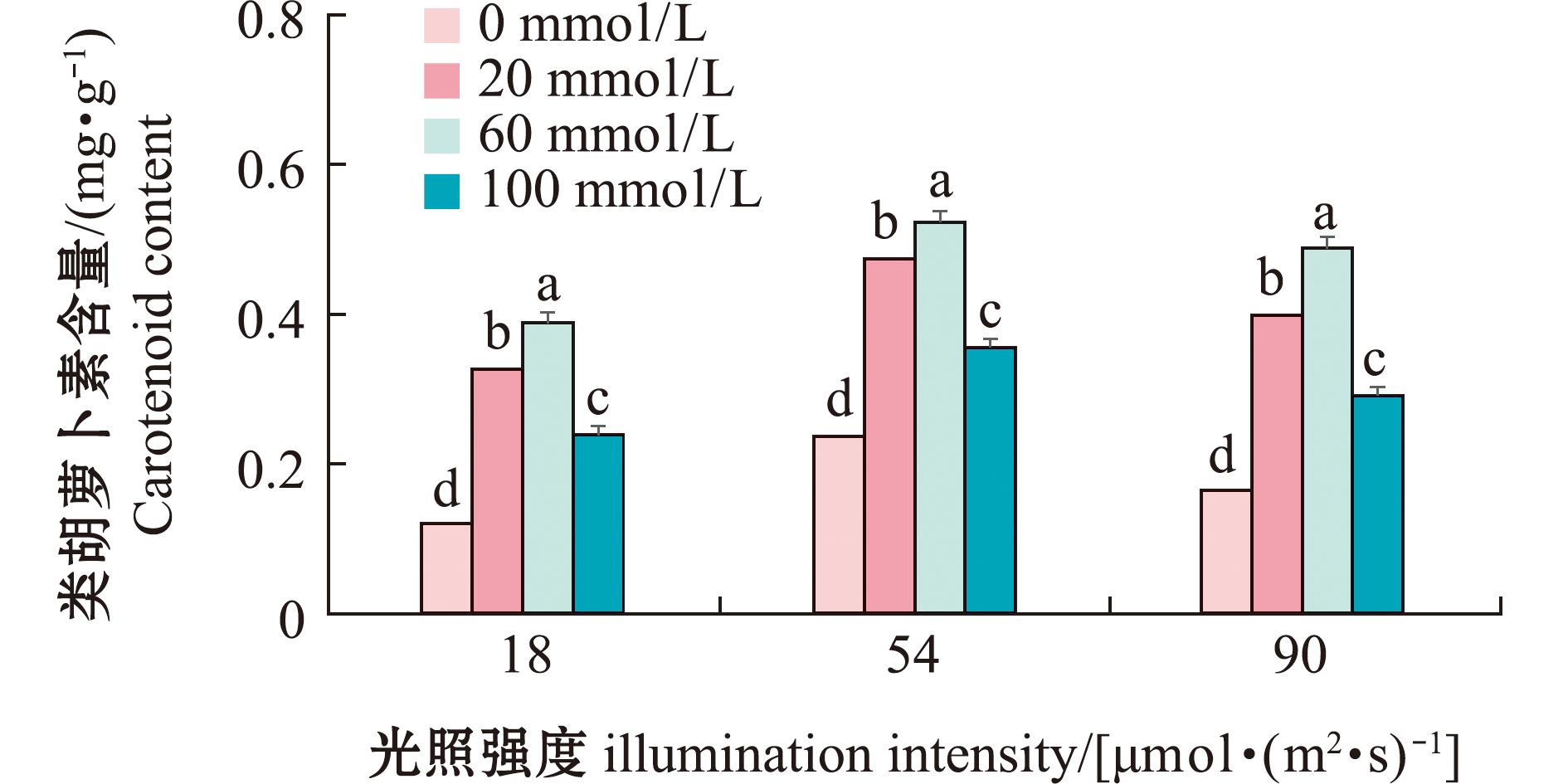
图12 144 h时卵形藻类胡萝卜素含量
Fig.12 Carotenoid content of Cocconei sp.at 144 h
3 讨论
3.1 卵形藻生物膜的筛选
藻类生物膜是藻类在静电作用力或者胞外分泌物的黏附作用下附着在基质表面所形成的生物膜,对于有胞外分泌物的附着型藻类更具有构建优势。试验所用的卵形藻为附着型硅藻,利用该藻构建的生物膜颜色逐步加深,说明卵形藻细胞密度在同步增加,帆布网相比于其他3种基质材料而言,颜色加深现象更为明显,卵形藻培养前期因营养物质丰富,生长空间充足,卵形藻呈现快速生长的趋势,这可能因为帆布网表面粗糙且纤维较细密,纵横交错,生长空间更为充足,利于卵形藻附着,而涤纶网和聚乙烯网因孔隙大,表面光滑,不易附着,通过扫描电镜更加印证帆布网表面相较于其他3种材料来说更为粗糙,卵形藻更易附着。Tong等[21]利用微孔聚偏氟乙烯膜材料作为基质材料培养咖啡形双眉藻生物膜、舟形藻生物膜及细柱藻生物膜,研究发现,粗糙度对藻类附着有显著影响,故更为粗糙帆布网上附着的卵形藻生物量高于其他基质。
3.2 光照强度对卵形藻附膜影响
光照是藻类细胞生长、繁殖及物质代谢过程中的必要条件[22]。在适光范围内,细胞分裂速度加快,在卵形藻培养前期,藻细胞密度较低,细胞间彼此无遮挡,可接收到充足的光照,藻生物量迅速增加。当藻细胞分裂速度达到最高时的光强为饱和光强,若超过饱和光强,光合作用就会减弱甚至受到抑制[23]。研究发现,当小球藻处于光照强度高于46 μmol/(m2·s)条件下,光强成为限制性条件[24]。当光强为90 μmol/(m2·s)时,卵形藻仍然保持正常生长状态,且细胞密度持续增加。
Fv/Fm是探测和分析植物光合作用的有效手段,可以反映环境胁迫对植物光合作用影响,藻细胞Fv/Fm在0.4以上为正常生长[25]。除126 μmol/(m2·s)外,其余光强条件下卵形藻最大光量子产量均在正常范围内,说明卵形藻拥有更强的光照适应性,这拓宽了生物膜应用的光照条件范围。
3.3 藻生物膜上卵形藻对氨氮的吸收
水体中![]() 浓度越高,吸收速率越快。卵形藻培养96 h后,当
浓度越高,吸收速率越快。卵形藻培养96 h后,当![]() 浓度高于60 mmol/L时,卵形藻可以达到对
浓度高于60 mmol/L时,卵形藻可以达到对![]() 的完全吸收,低于60 mmol/L时均呈现不完全吸收状态,但已达到污水排放标准。可能是过高的
的完全吸收,低于60 mmol/L时均呈现不完全吸收状态,但已达到污水排放标准。可能是过高的![]() 浓度会抑制卵形藻的光合作用,从而减慢其对
浓度会抑制卵形藻的光合作用,从而减慢其对![]() 的吸收速率,延长吸收时间。生理学上对
的吸收速率,延长吸收时间。生理学上对![]() 吸收现象的解释为,当氨氮浓度较小时,铵高亲和力转运系统(HATS)在吸收过程中起主导作用,表现出吸收完全的特征;而当氨氮浓度较大时,铵低亲和力转运系统(LATS)在吸收过程中起主导作用,表现出吸收不完全的特征[26]。卵形藻表现出吸收不完全的现象,可能是由于铵低亲和力转运系统起主导作用[27]。当光照强度逐渐增加时,氨氮消耗量逐渐增加,并与卵形藻生长呈现正相关性,若要继续提高光合作用效率,则需提高暗反应速度[28],当添加底物增加同化作用并提高光合作用速率后,藻细胞密度有所增加,且类胡萝卜素含量也呈现上升趋势,回收后更有利于作为饵料或饲料用于养殖生产中。培养过程中,pH呈现先下降后上升的现象,可能因为以
吸收现象的解释为,当氨氮浓度较小时,铵高亲和力转运系统(HATS)在吸收过程中起主导作用,表现出吸收完全的特征;而当氨氮浓度较大时,铵低亲和力转运系统(LATS)在吸收过程中起主导作用,表现出吸收不完全的特征[26]。卵形藻表现出吸收不完全的现象,可能是由于铵低亲和力转运系统起主导作用[27]。当光照强度逐渐增加时,氨氮消耗量逐渐增加,并与卵形藻生长呈现正相关性,若要继续提高光合作用效率,则需提高暗反应速度[28],当添加底物增加同化作用并提高光合作用速率后,藻细胞密度有所增加,且类胡萝卜素含量也呈现上升趋势,回收后更有利于作为饵料或饲料用于养殖生产中。培养过程中,pH呈现先下降后上升的现象,可能因为以![]() 为氮源时,由于氢离子释放导致pH降低[29],故pH先呈现下降趋势,在48 h后,
为氮源时,由于氢离子释放导致pH降低[29],故pH先呈现下降趋势,在48 h后,![]() 被消耗,pH逐渐开始上升。综上所述,卵形藻帆布生物膜不仅在氨氮吸收方面有良好效果,而且在增加细胞密度的同时还可积累类胡萝卜素,从而更有利于成为水生生物饵料。
被消耗,pH逐渐开始上升。综上所述,卵形藻帆布生物膜不仅在氨氮吸收方面有良好效果,而且在增加细胞密度的同时还可积累类胡萝卜素,从而更有利于成为水生生物饵料。
4 结论
1)粗糙的帆布网为卵形藻附着提供了更加有利的生长环境。
2)该藻生物膜能够在较广的光照范围[18~90 μmol/(m2·s)]内生长,拥有较强的光照适应性,拓宽了藻生物膜应用的光照范围。
3)当藻生物膜处于适宜的光照条件[18~54 μmol/(m2·s)]时,其对氨氮具有良好的吸收效果,吸收率最高可达98.3%。
4)附膜卵形藻在有效吸收氨氮的同时,其细胞密度也不断增加,且其能够累积类胡萝卜素,有可能成为优质饲料,这为新藻种生物膜的开发利用提供了参考依据。
[1] LIU Y B,ZHANG G Y,LI W R,et al.The characteristic evolution and formation mechanism of hybrid microalgae biofilm and its application in mariculture wastewater treatment[J].Journal of Environmental Chemical Engineering,2023,11(3):109645.
[2] WANG J F,CHENG W T,LIU W,et al.Field study on attached cultivation of Arthrospira (Spirulina) with carbon dioxide as carbon source[J].Bioresource Technology,2019,283:270-276.
[3] SHEN Y,WANG S,HO S H,et al.Enhancing lipid production in attached culture of a thermotolerant microalga Desmodesmus sp. F51 using light-related strategies[J].Biochemical Engineering Journal,2018:119-128.
[4] 徐慧,纪道斌,崔玉洁,等.不同光照强度对小球藻生长的影响[J].微生物学通报,2016,43(5):1027-1034.XU H,JI D B,CUI Y J,et al.Effects of different light intensity on the growth of Chorella vulgaris[J].Microbiology China,2016,43(5):1027-1034.(in Chinese)
[5] 于潘,尤庆敏,王全喜.真卵形藻属(硅藻门)的中国新记录植物[J].西北植物学报,2016,36(7):1474-1481.YU P,YOU Q M,WANG Q X.Newly recorded species of Eucocconeis (Bacillariophyta) in China[J].Acta Botanica Boreali-Occidentalia Sinica,2016,36(7):1474-1481.(in Chinese)
[6] 蔡雯沁,黄恩清,柳双权,等.大洋硅藻席沉积与冰期旋回中的碳-氮循环[J].海洋地质与第四纪地质,2024,44(1):96-108.CAI W Q,HUANG E Q, LIU S Q,et al.Massive deposition of oceanic diatom mat and its impact on the carbon-nitrogen cycle over glacial-interglacial periods[J].Marine Geology &Quaternary Geology,2024,44(1):96-108.(in Chinese)
[7] VENABLE M E,PODBIELSKI M R.Impact of substrate material on algal biofilm biomass growth[J].Environmental Science and Pollution Research International,2019,26(7):7256-7262.
[8] ZHANG Q,LIU C X,LI Y B,et al.Cultivation of algal biofilm using different lignocellulosic materials as carriers[J].Biotechnology for Biofuels,2017,10:115.
[9] NILOOFAR D,HAMED A N,SALMAN M.Surface attached cultivation and filtration of microalgal biofilm in a ceramic substrate photobioreactaor[J].Algal Research,2021,55:102239.
[10] GALLOWAY J N,WINIWARTER W,LEIP A,et al.Nitrogen footprints:past,present and future[J].Environmental Research Letters,2014,9(11):115003.
[11] LI H Y,LI Q Y,WANG S,et al.Ammonia nitrogen stress increases susceptibility to bacterial infection via blocking IL-1R-Relish axis mediated antimicrobial peptides expression in shrimp[J].Aquaculture,2023,563:738934.
[12] 国家环境保护总局.污水综合排放标准:GB 8978—1996[S].北京:中国标准出版社,1998.State Environmental Protection Administration of the People’s Republic of China.Integrated wastewater discharge standard:GB 8978—1996[S].Beijing:Standards Press of China,1998.(in Chinese)
[13] GUTIERREZ J,KWAN T A,ZIMMERMAN J B,et al.Ammonia inhibition in oleaginous microalgae[J].Algal Research,2016,19:123-127.
[14] CRAGGS R J,MCAULEY P J,SMITH V J.Wastewater nutrient removal by marine microalgae grown on a corrugated raceway[J].Water Research,1997,31(7):1701-1707.
[15] LIU X,WANG K J,ZHANG J,et al.Ammonium removal potential and its conversion pathways by free and immobilized Scenedesmus obliquus from wastewater[J].Bioresource Technology,2019,283:184-190.
[16] CHENG P F,CHU R R,ZHANG X Z,et al.Screening of the dominant Chlorella pyrenoidosa for biofilm attached culture and feed production while treating swine wastewater[J].Bioresource Technology,2020,318:124054.
[17] HAO T B,YANG Y F,BALAMURUGAN S,et al.Enrichment of f/2 medium hyper accumulates biomass and bioactive compounds in the diatom Phaeodactylum tricornutum[J].Algal Research,2020,47:101872.
[18] SURMAN S B,WALKER J T,GODDARD D T,et al.Comparison of microscope techniques for the examination of biofilms[J].Journal of Microbiological Methods,1996,25(1):57-70.
[19] 刘湘庆,姜美洁,刘璐,等.浒苔藻体叶绿素提取方法的比较[J].海洋环境科学,2016,35(1):144-148.LIU X Q,JIANG M J,LIU L,et al.A comparative study of the different extraction techniques about chlorophyll concentration of Ulva prolifera[J].Marine Environmental Science,2016,35(1):144-148.(in Chinese)
[20] 国家市场监督管理总局,中国国家标准化管理委员会.海洋监测规范 第4部分:海水分析:GB 17378.4—2007[S].北京:中国标准出版社,2008.State Administration for Market Regulation of the People’s Republic of China,Standardization Administration of the People’s Republic of China.The specification for marine monitoring:Part 4:Seawater analysis:GB 17378.4—2007[S].Beijing:Standards Press of China,2008.(in Chinese)
[21] TONG C Y,LEW J K,DEREK C J C.Algal extracellular organic matter pre-treatment enhances microalgal biofilm adhesion onto microporous substrate[J].Chemosphere,2022,307(Pt 1):135740.
[22] 孙双,张婷,方琰,等.雨生红球藻高产虾青素的培养条件优化[J].现代食品科技,2021,37(6):98-107.SUN S,ZHANG T,FANG Y,et al.Optimization of culture medium for high-yield astaxanthin in Haematococcus pluvialis[J].Modern Food Science and Technology,2021,37(6):98-107.(in Chinese)
[23] 石娟,潘克厚.不同光照条件对小新月菱形藻和等鞭金藻8701生长及生化成分的影响[J].中国水产科学,2004,11(2):121-128.SHI J,PAN K H.Effects of different light intensities on growth and biochemical composition of Nitzschia closterium F. minutissima and Isochrysis galbana Parke 8701[J].Journal of Fishery Sciences of China,2004,11(2):121-128.(in Chinese)
[24] 李春,王胜威,张磊,等.膜生物反应器中小球藻生物膜生长与代谢的光调控特性[J].环境工程学报,2018,12(2):670-676.LI C,WANG S W,ZHANG L,et al.Regulation of light intensity on characteristics of growth and metabolism of Chlorella biofilm in a membrane bioreactor[J].Chinese Journal of Environmental Engineering,2018,12(2):670-676.(in Chinese)
[25] 魏群,毛瑞,马湘蒙,等.光质对蛋白核小球藻膜生长及除镉效果的影响[J].华北水利水电大学学报(自然科学版),2021,42(1):16-21.WEI Q,MAO R,MA X M,et al.Effects of light quality on the growth of Chlorella pyrenoidosa biofilm and cadmium removal[J].Journal of North China University of Water Resources and Electric Power (Natural Science Edition),2021,42(1):16-21.(in Chinese)
[26] 李玉静,冯雨晴,赵园园,等.不同形态氮素吸收利用及其对植物生理代谢影响的综述[J].中国农业科技导报,2023,25(2):128-139.LI Y J,FENG Y Q,ZHAO Y Y,et al.Review of absorption and utilization of different nitrogen forms and their effects on plant physiological metabolism[J].Journal of Agricultural Science and Technology,2023,25(2):128-139.(in Chinese)
[27] ZHOU Y,BAI L,SONG C P.Ammonium homeostasis and signaling in plant cells[J].Science Bulletin,2015,60(8):741-747.
[28] SOHANI E,PAJOUM SHARIATI F,PAJOUM SHARIATI S R.Assessment of various colored lights on the growth pattern and secondary metabolites synthesis in Spirulina platensis[J].Preparative Biochemistry &Biotechnology,2023,53(4):412-423.
[29] MARKOU G,GEORGAKAKIS D.Cultivation of filamentous cyanobacteria (blue-green algae) in agro-industrial wastes and wastewaters:a review[J].Applied Energy,2011,88(10):3389-3401.