绿潮是由大型绿藻如石莼属(Ulva)、硬毛藻属(Chaetomorpha)和刚毛藻属(Cladophora)[1]悬浮并大量繁殖而形成的一种有害藻华现象。自2007年以来,黄海海域持续暴发特大规模浒苔绿潮,最大分布面积超过20 000 km2,持续时间约3个月。黄海绿潮具有季节性强、分布广、生物量大和运输距离远等特点,引起了生物学、生态学、物理海洋学和水文动力学等专家的广泛关注[2]。国内学者对黄海绿潮藻生长的环境条件、绿潮暴发的生态学机制、绿潮发生和发展的控制方法、绿潮监测和预测方法及绿潮藻的资源化利用等进行了大量研究,通过对中国南黄海绿潮的监测和分子系统分析发现,绿潮发生过程中浒苔属物种种群随季节变化呈现演替现象[3]。由于每种绿潮藻的最适温度和最适光强不同,在漂移过程中,漂浮的浒苔(Ulva prolifera)逐渐取代了盘苔(Blidingia sp.)、扁浒苔(Ulva compressa)、曲浒苔(Ulva flexuosa)和缘管浒苔(Ulva linza)[4]等其他绿潮藻,成为主要优势物种。此后,漂浮浒苔在风和洋流的作用下向北漂移,在山东半岛近海海域暴发大规模绿潮[5],然而,目前对其演替机制的认识还较有限。
为进一步揭示中国黄海绿潮早期种群演替规律,探索绿潮暴发机制,许多学者研究了绿潮藻对主要生态因子温度、光照强度等的适应性。研究表明,扁浒苔属低温种,曲浒苔属高温种,仅浒苔属广温种,浒苔对海水温度、盐度、酸碱度和光照强度的适应性均较广[6]。张必新[7]研究表明,浒苔具有较强的耐寒性,在5~15 ℃时藻体的存活率高达60%,在0 ℃时藻体的正常存活达到40%。罗民波等[8]发现,温度为8~30 ℃、光照强度为50~500 μmol/(m2·s)的条件下,浒苔的生长速率高于缘管浒苔,在温度为15~30 ℃和光照强度为200~600 μmol/(m2·s)的条件下,浒苔生长良好,表明浒苔对高光和高温胁迫具强耐受性。同时,王建伟等[9]发现,浒苔在释放微繁殖体时也能适应高盐度、高温、高光照和强碱性的不利环境条件。此外,近期研究发现,浒苔含有C3和C4途径的基因,特别是C4途径的关键酶[10]。因此,对生态因子的广泛适应性有效提高了浒苔在各种条件下的存活率,且C4途径关键酶可能使得其在生存竞争中具有优势,有助于其成为黄海绿潮的优势种。
近年来,转录组学等生物测序技术逐渐应用于绿潮研究中,其研究表明,不同温度和光强均会影响藻体光合作用相关蛋白基因差异性表达,这有助于阐明优势绿潮藻对逆境的反应和抗性机制等。Zhao等[11]结合多组学分析发现,在30 ℃的高温环境中,浒苔通过改变光合作用、氨基酸代谢、蛋白质合成和其他信号传导途径的相关基因表达提高抗逆性。Fan等[12]发现,35 ℃下培养浒苔会导致与应激反应、氧化磷酸化、谷胱甘肽代谢及细胞分裂素和脱落酸信号转导途径相关蛋白质表达量的上调,同时伴随光合作用天线蛋白和碳固定途径相关蛋白表达量的减少。Gu等[13]采用多组学方法研究了浒苔对强光胁迫12 h的响应机制,结果显示,在12 h强光照射后,ABC转运蛋白、CP43蛋白、P700叶绿素载脂蛋白A1、细胞色素b6-f复合体亚基和ATP合酶亚基相关蛋白表达量均显著上调,浒苔整体光合活性增强。此外,强光会导致浒苔中非光化学猝灭相关基因如PsbS/LHCSR的表达。作为仅在藻类中发现的LHC家族的应激相关蛋白,LHCSR的类似物在衣藻中被发现响应各种压力并用于能量猝灭[14]。Dong等[15]从浒苔中克隆了LHCSR全长cDNA序列,发现其表达受光强胁迫而上调,在1 h内迅速积累。因此,探究不同温度和光照条件下浒苔光合作用相关基因的表达情况,对进一步了解浒苔在逆境中的光合作用机制具有重要意义。
本研究中,设置了温度与光强正交条件的多个组合,使用转录组学和光合生理数据联合分析了温度与光强对浒苔光合作用的影响,初步阐释了浒苔应对温度与光强交叉影响的响应机制,不仅为构建浒苔生物模型以应对野外胁迫环境提供了新的研究基础和思路,也为探索浒苔如何成为黄海绿潮中的优势物种提供了有益参考。
1 材料与方法
1.1 材料
试验用浒苔采自青岛海域(120°11′24″ E,36°2′24″ N)。选择健康的藻体,对其进行清洁并去除表面附着物,培养于VSE培养基中,试验周期为24 h,培养条件为温度20 ℃,光照强度为140 μmol/(m2·s),光照周期(L∶D)为12 h∶12 h,盐度为25,每隔7 d更换一次VSE培养基。
1.2 方法
1.2.1 光合荧光参数的测定 将鲜质量的藻体分9个处理组,每组设置3个平行,每个平行浒苔质量均为5 g。采用VSE培养液培养于恒温光照培养箱中,试验周期为24 h,光照周期(L∶D)为12 h∶12 h。培养条件见表1,将浒苔最适的生长条件温度20 ℃,140 μmol/(m2·s)作为对照组(HT140,20)。培养24 h后,将藻体在黑暗中处理15 min,采用荧光分析仪(PHYTO-PAM WALZ)测定光合荧光参数(Fv/Fm),每组设置3次重复。
表1 浒苔温度、光照强度试验设计
Tab.1 Experimental design of effects of temperature and light intensity on green alga Enteromotphaprolifera
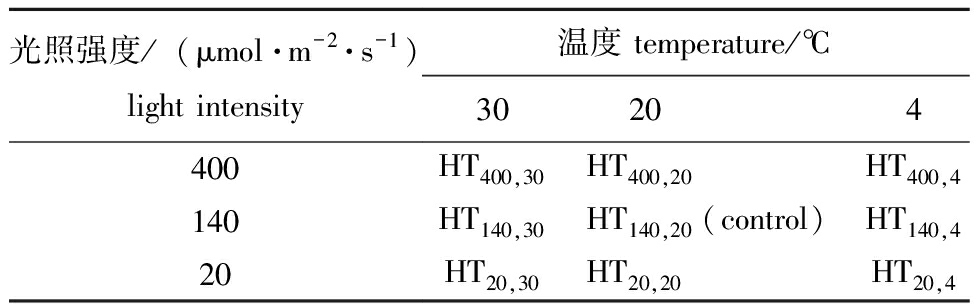
光照强度/(μmol·m-2·s-1)light intensity温度 temperature/℃30 204400HT400,30HT400,20HT400,4140HT140,30HT140,20(control)HT140,420HT20,30HT20,20HT20,4
1.2.2 总RNA的提取与质控检测 按“1.2.1节”方法培养藻体(9组藻体,每组设置3个平行),黑暗处理15 min后,置于液氮中速冻,于-80 ℃超低温冰箱中保存。提取RNA后,由华大基因公司构建转录组文库。通过含有Oligo(dT)的磁珠将mRNA富集,合成cDNA片段,经过末端修饰和纯化连接后通过Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System对构建的cDNA进行质检,合格后,使用Illumina HiSeqTM 2000对构建好的cDNA文库进行双末端测序[24]。
1.2.3 转录组注释与组装 使用Trinity(http://trinityrnaseq.sourcef-orge.net/)将短reads组装,经过Inchworm、Chrysalis和Butterfly 3步进行组装最后得到的序列为Unigenes,再将所得的Unigene序列通过蛋白数据库NR、Swiss-Prot、KEGG和COG做功能注释(e<0.000 01)。对已知的相同功能的Unigene基因序列通过DNAMAN软件进行多序列分析。根据KEGG注释信息进一步得到Unigene的Pathway注释,分析Pathway显著性基因富集结果确定参与最主要生化代谢途径或信号转导途径的差异表达基因。
1.2.4 生物信息学分析 各试验组的基因表达量均与对照组HT140,20做对比。通过FPKM法计算获得的基因表达量可以直接对不同样本间基因表达量进行比较。FPKM法计算Unigene的表达量的计算公式为
FPKM(A)=106C/(N×L/103)。
(1)
式中:FPKM(A)为Unigene A的表达量;C为唯一比对到Unigene A的fragments数;N为唯一比对到所有Unigene的总fragments数;L为Unigene A的碱基数。本文差异表达基因筛选条件为FDR≤0.001,|log2Ratio|≥1,P<0.05;若log2 (HT400,30_FPKM/HT140,20_FPKM)>0,为上调,反之为下调,其他组同理。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 26.0软件进行单因素方差分析(one-way ANOVA,Tukey),采用GraphPad Prism软件进行图表绘制,显著性水平设为0.05。
2 结果与分析
2.1 光合荧光参数的测定结果
从图1可见,与对照组相比,温度与光强对光合荧光参数的影响呈现显著性差异(P<0.05);单强光(HT400,20)、单高温(HT140,30)、高温强光(HT400,30)和低温弱光(HT20,4)组均可显著降低浒苔的Fv/Fm值,其中,温度和光强的协同效应大于温度或光照强度的单一变化的效应。高温强光(HT400,30)对浒苔光合作用的负面影响小于单一强光(HT400,20),这说明高温减轻了强光对浒苔的胁迫,而低温强光(HT400,4)处理显著降低了浒苔的Fv/Fm。研究表明,在正常生理状态下,绝大多数植物Fv/Fm值为0.6~0.7,而在不同温度和光照胁迫下,只有低温高光(HT400,4)处理后浒苔的Fv/Fm值低于0.6,其余条件下浒苔Fv/Fm值均处于正常范围内,表明浒苔在遭受胁迫时仍能依靠内在机制调节维持正常的光合作用,正常存活。
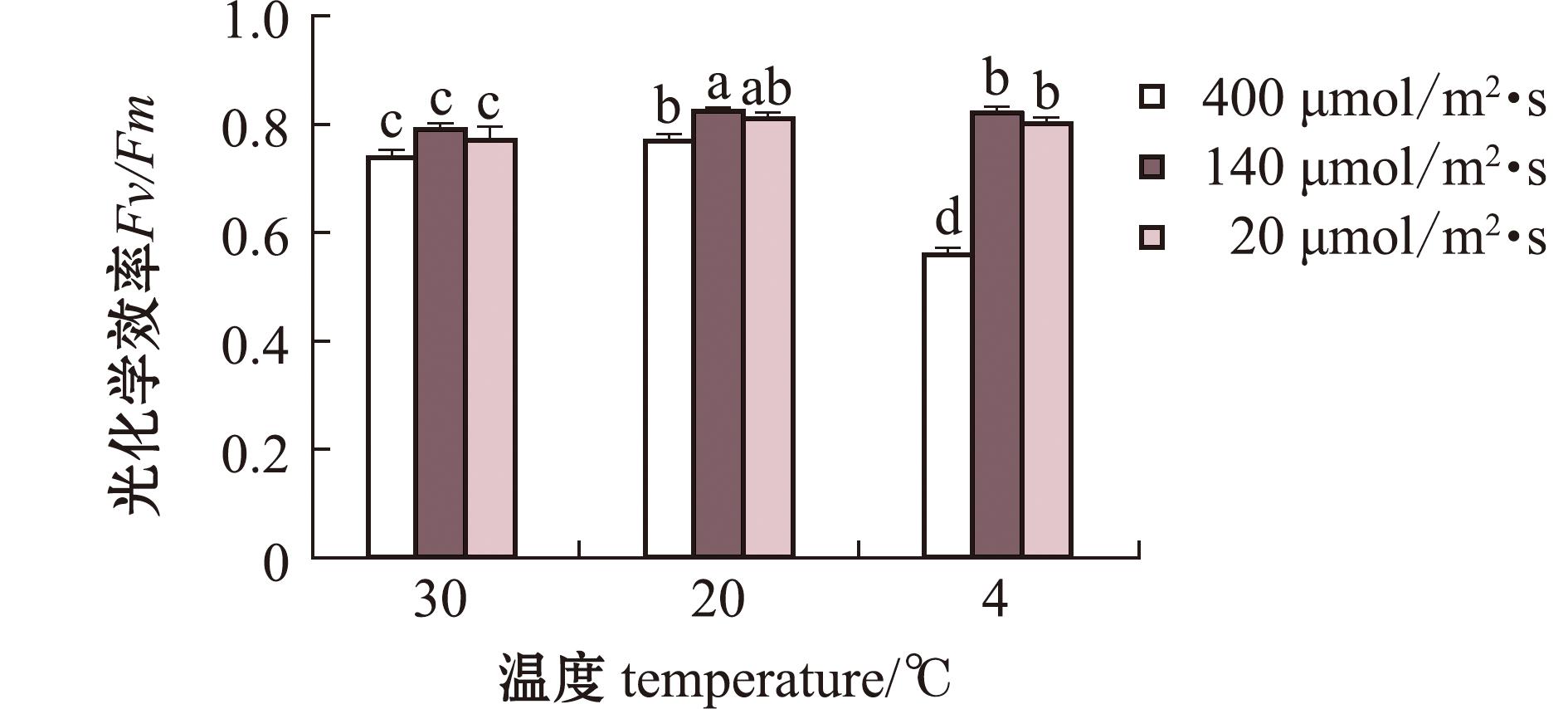
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences.
图1 不同条件下浒苔的光化学效率
Fig.1 Photochemical efficiency of green alga Enteromotphaprolifera under different conditions
2.2 转录组测序结果
通过Illumina Hiseq 2000平台进行基因测序,测试共产出21 479 016 330 bp数据(表2)。组装结果总Unigene为109 239个,总长度为115 647 875 bp,平均长度为1 058.5 bp,N50达到2 258.5 bp。Unigene功能注释到NR、NT、Swiss-Prot、KEGG、COG和GO库的Unigene分别是61 285、13 388、43 182、46 481、45 543、30 557个,所有注释的Unigene是64 931个。各组差异表达基因的情况如图2所示。转录组测序结果表明,HT140,30基因表达的差异性最大,HT400,30的基因上调情况最显著。
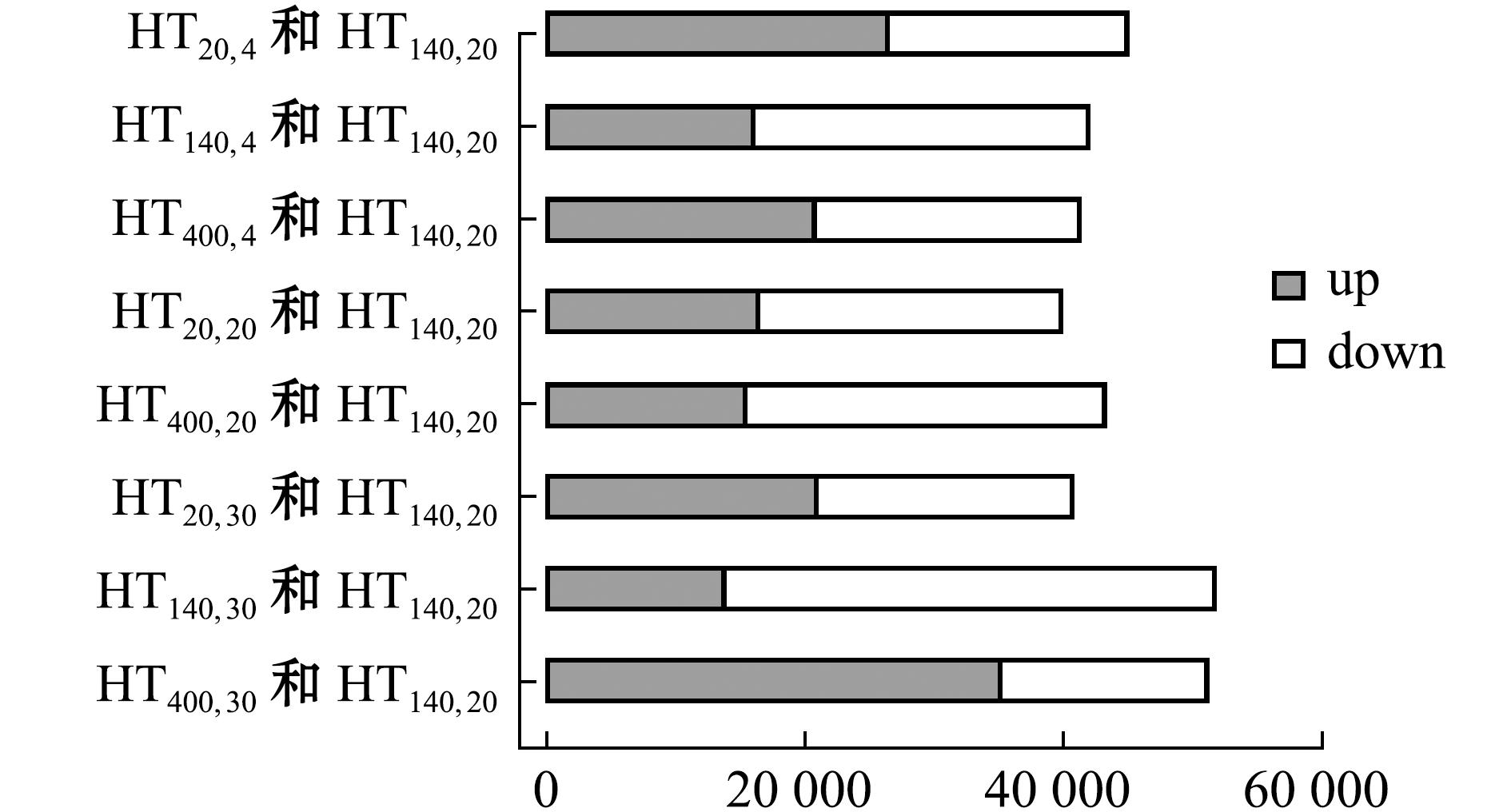
图2 差异表达基因的统计图谱
Fig.2 Statistical map of differentially expressed genes
表2 测序产量统计
Tab.2 Sequencing yield statistics

sampletotal raw readstotal clean readstotal clean base pairs/bpQ20 percent/%GC percent/%HT400,3055 029 14852 512 0362 363 041 62098.6655.38HT140,3054 958 41252 389 7982 357 540 91098.5655.62HT20,3056 274 92651 908 8142 335 896 63097.9558.41HT400,2056 604 16654 065 0102 432 925 45098.5956.14HT140,2056 926 55453 049 4022 387 223 09097.6656.62HT20,2057 004 18652 305 3742 353 741 83097.3556.61HT400,455 936 72252 358 3442 356 125 48097.9856.72HT140,458 675 13854 406 4582 448 290 61097.6956.69HT20,456 990 10854 316 2382 444 230 71098.5956.62
注:total reads和total base pairs代表过滤后的reads数以及碱基对数;Q20 percentage表示过滤后质量不低于20的碱基的比例;GC percentage表示过滤后碱基G和C占总碱基数的比例。
Note:total reads and total base pairs represent the number of filtered reads and bases;Q20 percent indicates the proportion of bases with a mass of at least 20 after filtration;GC percent indicates the proportion of filtered bases G and C to the total number of bases.
2.3 光合作用相关差异表达基因的分析
2.3.1 捕光蛋白色素复合体基因表达情况 LHCⅠ和LHCⅡ捕光蛋白复合物存在于绿藻和其他藻类的光系统I(Photosystem Ⅰ,PSⅠ)和光系统Ⅱ(Photosystem Ⅱ,PSⅡ)中(图3)。从基因类别和表达变化看,HT20,4基因表达最显著,上调基因最多(表3)。在相同温度下随着光强的降低(HT400,20和HT20,20),LHCB家族捕光复合物基因的表达量显著增加(表3);在相同光强(HT140,30和HT140,4)下,LHCB家族捕光复合物基因的表达量也随温度的降低而显著增加(表3)。表明低光和低温胁迫均会促进捕光蛋白复合体基因的表达。

图3 捕光色素-蛋白质复合物和光系统的结构
Fig.3 Structure of light harvesting pigment protein complex and photosystem
表3 不同温度和光照强度下与光捕获蛋白相关的差异表达基因
Tab.3 Differentially expressed genes related to light-trapping proteins under different temperatures and light intensities

注释 annotation基因编号gene IDHT400,30HT140,30HT20,30HT400,20HT20,20HT400,4HT140,4HT20,4Lhca2Unigene30276_All-2.9Lhca4Unigene23789_All-1.7Lhca5Unigene23800_All-1.61.7Unigene4240_All-5.42.42.11.41.81.9Unigene 49132_All-4.52.72.01.32.72.53.33.5Lhcb1Unigene 3284_All-4.41.42.32.42.43.03.5Unigene 4240_All-5.41.92.11.41.82.4Unigene 4786_All-3.51.31.11.11.51.8Lhcb2Unigene 23869_All-3.41.21.71.72.73.6Lhcb5Unigene 23800_All-1.61.7
此外,浒苔捕光色素蛋白复合体相关基因仅在高温高光(HT400,30)的双重胁迫下表达量下调。
2.3.2 PSⅠ和PSⅡ结构蛋白基因表达情况 各试验组中PSⅠ基因表达水平变化较为一致,其中,HT400,30和HT20,30相关基因下调,表明高温下极端光照条件可以抑制浒苔PSⅠ相关基因表达;HT400,4、HT140,4、HT20,4相关基因上调,表明在4 ℃低温条件下,光系统I相关基因的表达增强。
PSⅡ相关基因表达发生显著变化的蛋白亚基包括大亚基D1、CP43、MSP(锰稳定蛋白)及其对应的小亚基,其中,仅HT20,4条件下D1蛋白基因(PsbA)表达上调,其余条件均未发生显著变化,可能是在较低温度条件下藻细胞的酶活性不高,藻体通过提高D1蛋白基因的表达量以应对环境的急剧变化。CP43色素蛋白相关基因在HT400,30和HT400,20条件下表达上调,而在HT140,30和HT20,20条件下其相关基因表达下调,表明高光在一定程度上提高了藻体的耐受性,缓解了高温对浒苔的胁迫,促进了CP43色素蛋白基因的表达。此外,在HT400,30和HT20,4条件下的锰稳定蛋白相关基因(MSP)显著上调,而在HT140,30条件下显著下调(表4),表明高温高光可以促进锰稳定蛋白相关基因的表达,而单高温抑制锰稳定蛋白基因的表达。由此可得,高光可缓解高温对藻细胞中锰稳定蛋白基因表达的抑制作用,使藻体在不适环境下具有一定的耐受性。
表4 PSⅠ和PSⅡ结构蛋白相关基因在不同温度和光照强度下的差异表达
Tab.4 Differential expression of PSⅠ and PSⅡ structural protein related genes under different temperature and light intensities

注释 annotation基因编号 gene IDHT400,30HT140,30HT20,30HT400,20HT20,20HT400,4HT140,4HT20,4PCUnigene18910_All2.23.2Unigene29854_All1.9PSⅠFdUnigene482_All-1.5-2.31.21.1Unigene21825_All2.7Cystc6Unigene11155_All-1.5-1.51.41.41.2D1PsbAUnigene8975_All1cp43PsbCUnigene29657_All2.1-3.53.1-2.7PSⅡMSPPsbOUnigene30860_All13.7-13.612. 9PsbUUnigene10094_All7.2-7.16.2
2.3.3 C3和C4途径 测序结果显示,C3途径相关的酶编码基因表达量在不同温度和光强下均发生显著变化。适温(HT400,20/HT20,20)条件下,C3途径相关的酶编码基因表达量变化不显著;适光(HT140,30/HT140,4)条件下,高温抑制相关酶编码基因的表达,表明浒苔C3途径的反应受温度的影响大于光照。核酮糖-1,5-二磷酸羧化酶/加氧酶编码基因表达水平在低温条件下发生显著上调,推测浒苔在低温时通过上调此酶编码基因来抵御胁迫。3-磷酸甘油酸激酶和甘油醛-3-磷酸脱氢酶编码基因表达的变化趋势较为一致,在HT140,30条件下均显著下调,表明高温抑制3-磷酸甘油醛的合成。磷酸丙糖异构酶编码基因表达水平仅在HT140,30条件下显著下调,果糖-1,6-二磷酸酶编码基因表达水平仅在HT400,30条件下显著下调(表5),表明高温抑制两种酶编码基因的表达,抑制核酮糖-1,5-二磷酸的再生。综上所述,高温对C3途径相关的酶编码基因表达具有显著的抑制作用。
表5 不同温度和光照强度对C3途径酶差异表达的影响
Tab.5 Effects of different temperature and light intensities on the differential expression of some enzymes in C3 pathway
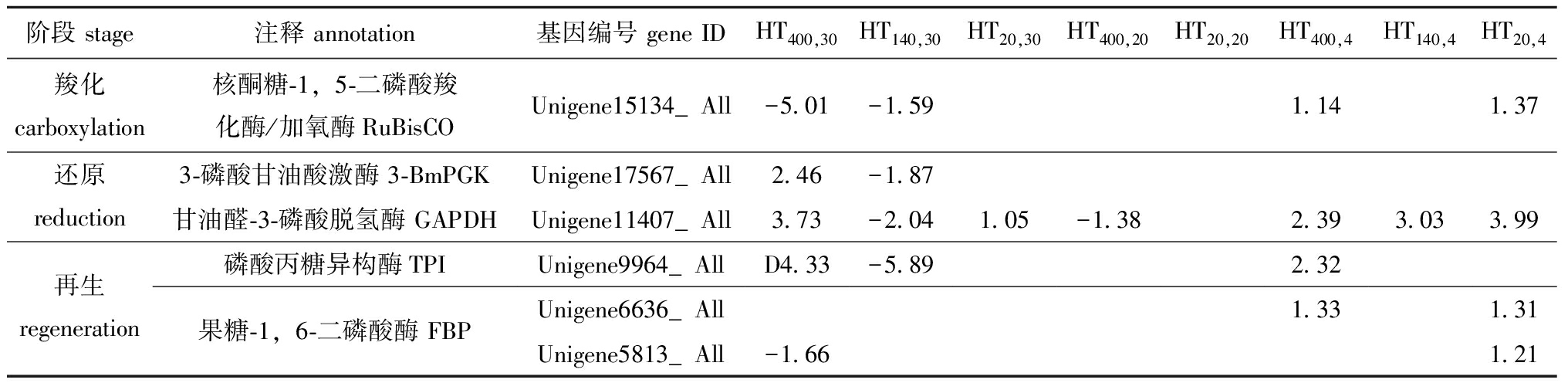
阶段 stage注释 annotation基因编号 gene IDHT400,30HT140,30HT20,30HT400,20HT20,20HT400,4HT140,4HT20,4羧化carboxylation核酮糖-1,5-二磷酸羧化酶/加氧酶RuBisCOUnigene15134_All-5.01-1.591.141.37还原reduction3-磷酸甘油酸激酶 3-BmPGKUnigene17567_All2.46-1.87甘油醛-3-磷酸脱氢酶 GAPDHUnigene11407_All3.73-2.041.05-1.382.393.033.99再生regeneration磷酸丙糖异构酶TPIUnigene9964_AllD4.33-5.892.32果糖-1,6-二磷酸酶 FBPUnigene6636_All1.331.31Unigene5813_All-1.661.21
本试验的测序结果表明,磷酸烯醇式丙酮酸羧化酶(PEPC)是C4光合途径最初CO2固定的光合酶,此酶编码基因在高温高光(HT400,30)条件下表达水平显著上调,而在其他条件下并未发生显著变化,表明PEPC编码基因受温度和光强的双重调控,只有在高温与高光强的双重作用下才可以显著诱导基因表达。测序结果显示,C4途径的谷草转氨酶(GOT)和NADP-苹果酸酶(NADP-ME)两种关键酶编码基因在HT140,30条件下均发生显著下调,在HT400,30、HT400,4、HT140,4和HT20,4条件下均发生显著上调,在HT20,30和HT20,20条件下均未发生显著变化(表6),表明高温显著抑制酶编码基因表达。但当同时受到高温和高光强的双重胁迫及单低温影响时,两种酶编码基因表达水平发生显著上调。测序结果还显示,丙酮酸磷酸双激酶(PPDK)在HT140,30和HT140,4条件下均发生显著下调,在HT20,30和HT400,20条件下均发生显著上调,在HT20,20条件下未发生显著变化,表明在最适光强条件下,高温或低温均会抑制PPDK编码基因表达;在高温条件下,弱光强促进PPDK编码基因表达;在最适温度条件下,高光强促进PPDK编码基因的表达(表6,表7)。
表6 不同温度和光照强度对C4途径酶差异表达的影响
Tab.6 Effects of different temperature and light intensities on the differential expression of some enzymes in C4 pathway
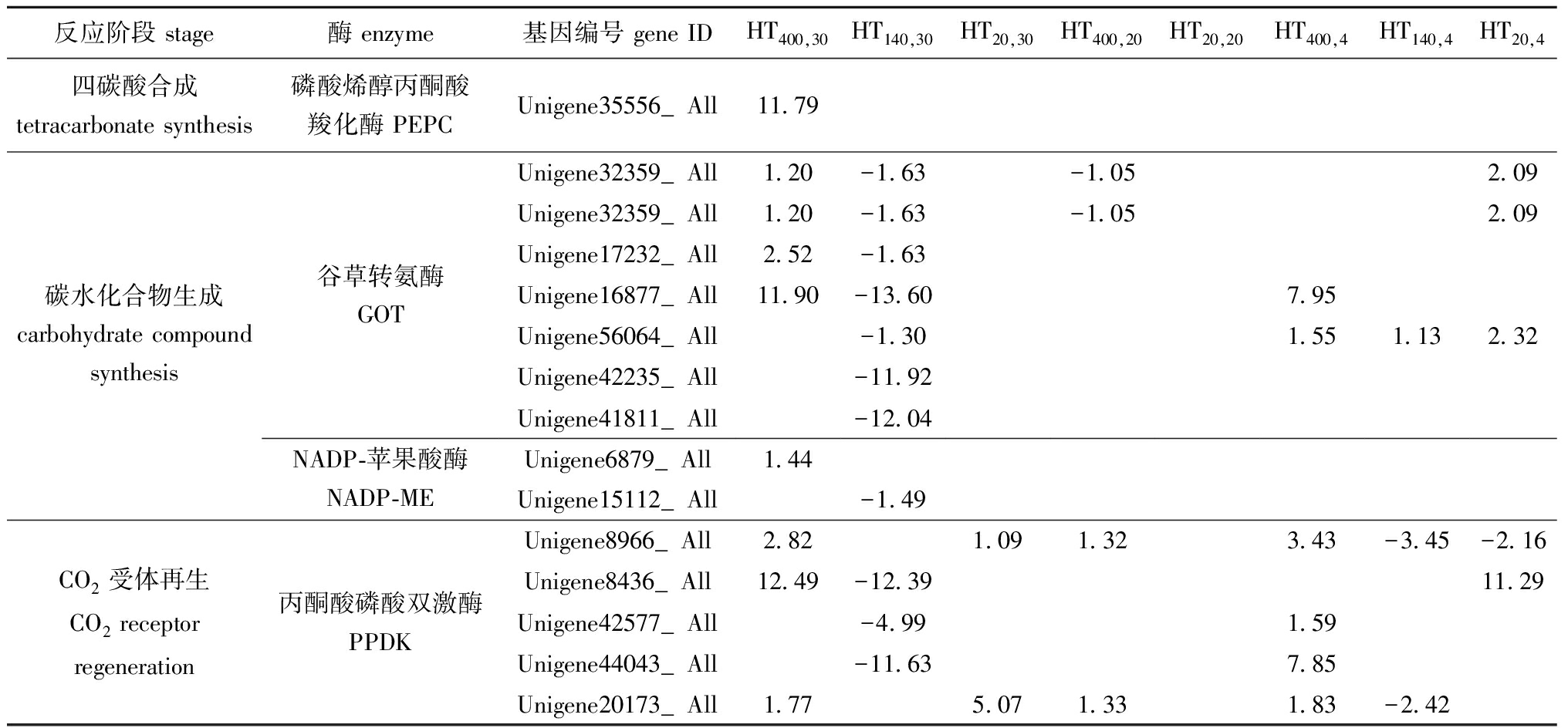
反应阶段 stage酶 enzyme基因编号 gene IDHT400,30HT140,30HT20,30HT400,20HT20,20HT400,4HT140,4HT20,4四碳酸合成tetracarbonate synthesis磷酸烯醇丙酮酸羧化酶 PEPCUnigene35556_All11.79Unigene32359_All1.20-1.63-1.052.09Unigene32359_All1.20-1.63-1.052.09Unigene17232_All2.52-1.63碳水化合物生成carbohydrate compound synthesis谷草转氨酶GOTUnigene16877_All11.90-13.607.95Unigene56064_All-1.301.551.132.32Unigene42235_All-11.92Unigene41811_All-12.04NADP-苹果酸酶NADP-MEUnigene6879_All1.44Unigene15112_All-1.49Unigene8966_All2.821.091.323.43-3.45-2.16Unigene8436_All12.49-12.3911.29CO2受体再生CO2 receptor regeneration丙酮酸磷酸双激酶PPDKUnigene42577_All-4.991.59Unigene44043_All-11.637.85Unigene20173_All1.775.071.331.83-2.42
表7 不同光温下各蛋白复合体差异基因表达情况
Tab.7 Differential gene expression of various protein complexes under different light and temperature conditions
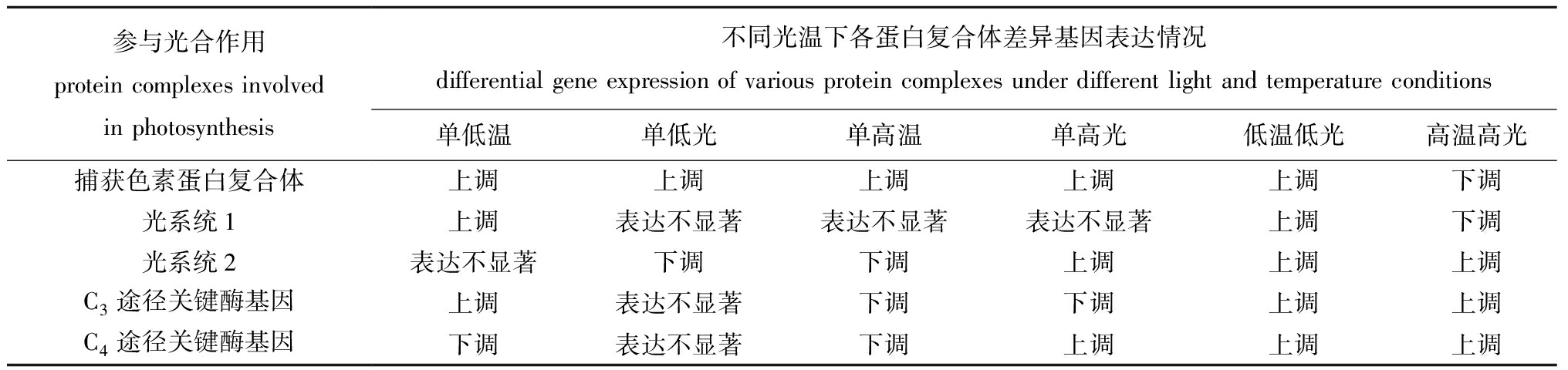
参与光合作用 protein complexes involved in photosynthesis不同光温下各蛋白复合体差异基因表达情况differential gene expression of various protein complexes under different light and temperature conditions单低温单低光单高温单高光低温低光高温高光捕获色素蛋白复合体上调上调上调上调上调下调光系统1上调表达不显著表达不显著表达不显著上调下调光系统2表达不显著下调下调上调上调上调C3途径关键酶基因上调表达不显著下调下调上调上调C4途径关键酶基因下调表达不显著下调上调上调上调
3 讨论
3.1 关于浒苔种群的演替
黄海绿潮早期漂浮优势种群逐年发生变化且呈现一定的演替规律。监测结果显示,最早出现漂浮的绿潮藻是扁浒苔。扁浒苔属低温低光物种,在早期绿潮藻零星漂浮时,海水温度为10 ℃左右,适宜扁浒苔生长,其最早漂浮起来并迅速成为优势种,并在15 ℃、30 μmol/(m2·s)时达到最高生长率,但仍不足浒苔整个生长阶段生长率的一半[16]。随着温度的逐步升高,缘管浒苔和曲浒苔相继出现,缘管浒苔为窄温种,其最适生长温度为20 ℃,曲浒苔属高温种,其最适生长温度为25 ℃,但其对高于200 μmol/(m2·s)的高光极不耐受,在夏季海区高温高光的环境下,两种藻的生长明显受抑制[17]。最后,随温度和光强的逐步升高,扁浒苔、缘管浒苔和曲浒苔因不能适应高温和高光环境而逐步衰亡,而广温种浒苔耐受高光并迅速繁殖扩大,成为南黄海绿潮的主要优势种[18]。且在东南季风的影响下,浒苔一直向北漂向山东青岛等海域,其温度也由南向北沿海逐步升温,使漂浮的浒苔一直处于最适温度下不断生长,导致绿潮规模越来越大。作为藻类中的绿潮成因种,浒苔具有极高的生长速率,日相对生长速率可以高达25%,且发现浒苔具有二氧化碳浓缩机制以及C4途径,表明浒苔具有很强的光合作用能力。浒苔在光合作用过程中除了能够利用可溶性无机碳(DIC)外,还可以直接利用空气中的CO2。导致南黄海绿潮灾害的浒苔为漂浮种,在漂浮过程中藻体会露出水面,当藻体暴露于空气中时,CO2是其进行光合作用的唯一碳源,同时藻体表面高pH的水膜会促进空气CO2进入水膜,进而被藻体利用[19]。
结合本研究结果可以推测,在冬季低温环境下,藻体上调捕光色素蛋白复合体相关基因和部分光系统相关基因,但光合固碳C3反应受到抑制,浒苔生长较缓慢,仅维持必要的生理活动;春末夏初温度逐渐升高,藻体通过差异性表达C3和C4途径中相关基因从而调节光合固碳反应以适应夏季高温高光的极端环境。可见,浒苔对适应环境的自我调节是精妙又灵敏的。
3.2 不同温度和光强下浒苔光合作用光反应阶段相关基因表达差异分析
大量绿潮藻的微观繁殖体存在于水体及底泥中,在漂移过程中会经历四季轮回及周期性潮涨潮落的生境变化。浒苔在秋冬季节或潮落沉水时,处于低温低光环境,海水温度最低可达3~5 ℃。此时浒苔可能通过上调LHCB蛋白相关基因以诱导藻体产生更多的光合色素,捕获更多光能以抵御胁迫。这也与马汶菲等[20]的研究结果一致,即当藻细胞受到低温或低光胁迫时,其生长速率和酶反应速率均会受限,此时,藻体内色素和酶的浓度会补偿性增加以提高其吸收水体中营养盐的能力,并更加有效地利用光能以维持其生长和代谢的正常状态。这种补偿性增加可以看作是藻类的一种自身调节机制,以帮助藻细胞适应不利的环境条件[21]。此外,早期研究发现,浒苔对非生物胁迫因子的响应机制极其复杂,几乎所有的生理过程在逆境条件下都会发生变化,浒苔独特的光保护机制与其细胞内的光捕获复合体家族中的光诱导蛋白及光保护蛋白有关,且这些蛋白均在浒苔处于低温时诱导表达[22]。此结论也与本试验结果相互印证。
到春末海区温度回升,大量微观繁殖体迅速萌发,直至盛夏海区成为高温高光环境,特别是在晴天正午,海面温度可达25 ℃,光强可达300 μmol/(m2·s)[23]。且在落潮时,由于潮间带藻体大部分暴露于干旱、高温高光环境中,在这种环境状态下,浒苔细胞中叶绿体部分降解,光合作用减弱。同时,浒苔细胞中参与光合作用的光呼吸系统或光系统等其他组分均会受损。于是浒苔通过下调捕光蛋白复合体相关基因的表达以降低能量捕获,从而减弱强光对其光合器官造成的损伤。研究表明,在海区高温高光环境下,浒苔藻体内部存在一种保护性反应——光抑制[24]。其中,PSⅡ是光合器官中对高温胁迫最敏感的部分之一,也是光抑制的主要发生部位。光抑制发生后,当光合系统吸收的激发能过剩而不能被及时耗散时,容易引发活性氧在细胞内大量积累,破坏藻细胞内氧化还原的平衡[25]。过量的活性氧不仅会直接破坏PSⅡ反应中心蛋白,还可能通过抑制D1蛋白的从头合成阻碍PSⅡ修复过程,从而加剧PSⅡ光抑制[26]。还有研究表明,光抑制除造成PSⅡ量子效率降低,还会造成PSⅡ反应中心D1蛋白的降解[27]。由结果可推测,浒苔还可能通过下调铁氧还原蛋白和细胞色素复合体相关基因来降低电子传递效率,以提高抗氧化能力来维持活性氧的平衡。
此外,试验组PSⅡ系统反应中心的CP43蛋白和D1蛋白相关基因在高温高光(HT400,30)和低温低光(HT20,4)这两种极端条件下均显著上调。在高温高光或低温低光的胁迫下,D1蛋白受损,上调CP43基因可能是通过CP43蛋白的水解活性将部分失效的D1蛋白快速降解以促进D1蛋白的更新,使PSⅡ重新组装从而对抗光抑制[28]。同时,浒苔通过上调D1蛋白相关基因从而冲抵D1蛋白损耗对PSⅡ电子传递过程造成的负面影响。此外,在高温高光、低温低光下锰稳定蛋白基因也显著上调,而在高温中光下锰稳定蛋白基因显著下调。这可能与锰稳定蛋白参与植物体内的抗氧化反应和防御逆境的活动有关。作为光合作用放氧复合体的重要组成部分之一,锰稳定蛋白参与水裂解过程并与放氧复合体的稳定性密切相关[29]。研究表明,锰稳定蛋白能提高放氧效率,减少光抑制[30]。在逆境中上调锰稳定蛋白有助于维持锰簇的完整和活性,减少逆境对植物光合作用产生的负面影响[31]。还有报道指出,上调锰稳定蛋白的表达量可提高藻体的环境适应性,诱导植物体显著增强对各种光照和温度等非生物因素的耐受性[32]。
3.3 不同温度和光强下浒苔光合作用暗反应阶段相关酶基因表达差异分析
自2023年5月下旬起南黄海海域海表温度均超过15 ℃,全海域进入适宜绿潮藻快速生长的温度范围。至7月,南黄海海域海表温度可达25 ℃,且暴发绿潮时晴天海面的光照强度一般为300 μmol/(m2·s),最高时可达2 000 μmol/(m2·s),海区监测结果显示,浒苔能够在此环境下存活并迅速扩大规模。绿潮浒苔在暴发过程中能避开高温和高光强的伤害,与其C3和C4途径[33]相结合的碳同化过程密切相关。
夏季高温高光时,藻细胞接收的光能过剩,光抑制现象尤为严重,产生的各种活性氧会引发浒苔的氧化胁迫。此时,浒苔通过促进C3途径的光呼吸作用来消耗过剩的能量(ATP和NADPH)以减少胁迫环境对藻体的损伤,提高藻细胞抗逆性,但光呼吸会使30%以上的光合作用产物消耗。研究表明,每轮光呼吸作用会利用2个2-磷酸乙醇酸形成1个3-磷酸甘油酸,同时损失1个CO2,导致植物体产生碳损失,藻体营养物质积累缓慢[34]。不仅如此,在高温高光环境下C3途径的限速酶核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)的活性也会受到抑制,极大限制C3途径三碳糖的生成和积累[35]。而浒苔为了规避光呼吸产生的损耗进化出C4途径和二氧化碳浓缩机制[36]。C4途径中的磷酸烯醇式丙酮酸羧化酶(PEPC)会对大气中的CO2进行初固定,转运一系列的中间产物进行脱羧和再固定过程,使得O2无法与RuBisCO接触,基本消除了光呼吸[37],同时高温胁迫对PEPC活性抑制相对较弱,这与在HT400,30条件下PEPC编码基因表达水平发生显著上调的情况相符。C4途径的另一关键酶丙酮酸磷酸双激酶(PPDK)也可能在消耗细胞中多余的能量和ATP方面发挥重要作用[38]。因为它负责催化细胞质中磷酸烯醇式丙酮酸的再生,而在由丙酮酸形成磷酸烯醇式丙酮酸的过程中存在ATP的消耗[37]。这一推测的依据来自Haimovich-Dayan等[39]的试验,他们利用RNA干扰沉默三角褐藻中编码PPDK的单基因,发现PPDK活性的变化几乎不影响净CO2固定,但明显参与细胞中多余能量和ATP的消耗。因此,从进化的角度看,C4阶段光合作用相关酶编码基因的表达可能是一种适应性反应,使浒苔能够快速利用变化的环境,在绿潮暴发海域大量生长,成为南黄海绿潮藻中的优势种。可见,浒苔这种C3和C4途径的进化调节策略有助于其形成大规模绿潮。
4 结论
1)高温和高光下,浒苔通过特异性表达捕光蛋白复合体相关基因和PSⅡ相关的基因以减少对藻类的光抑制损伤,而通过下调其PSⅠ相关基因的表达来提高抗氧化能力和对环境胁迫的抵抗力,从而降低了浒苔的电子转移速率。
2)在低温和低光条件下,浒苔的捕光蛋白复合体相关基因和光系统相关基因均显著上调,表明浒苔对冬季和夏季的极端条件具有特殊的适应机制,也使浒苔成为黄海绿潮藻演替过程中的唯一幸存种。
3)据C3和C4途径相关的基因表达情况,推测高温和高光条件诱导了浒苔的光呼吸过程,抑制了Rubisco酶的活性,并减弱了C3途径。浒苔通过上调C4途径的磷酸烯醇式丙酮酸羧化酶和丙酮酸磷酸双激酶减弱光呼吸,浒苔的两种碳同化途径结合的策略有助于其形成大规模的绿潮。
[1] XIA Z Y,YUAN H Q,LIU J L,et al.Biomass and species composition of green macroalgae in the Binhai Harbor intertidal zone of the Southern Yellow Sea[J].Marine Pollution Bulletin,2023,186:114407.
[2] KEESING J K,LIU D Y,FEARNS P,et al.Inter- and intra-annual patterns of Ulva prolifera green tides in the Yellow Sea during 2007-2009,their origin and relationship to the expansion of coastal seaweed aquaculture in China[J].Marine Pollution Bulletin,2011,62(6):1169-1182.
[3] WANG J F,JIANG P,CUI Y L,et al.Molecular analysis of green-tide-forming macroalgae in the Yellow Sea[J].Aquatic Botany,2010,93(1):25-31.
[4] TONG Y C,XIA L H,LIU J L,et al.Distribution and identification of Ulva aragoensis (Ulvaceae,Chlorophyta),a constituent species of green tides in the southern Yellow Sea,based on molecular data[J].Journal of Marine Science and Engineering,2022,10(11):1767.
[5] STEINHAGEN S,HOFFMANN S,PAVIA H,et al.Molecular identification of the ubiquitous green algae Ulva reveals high biodiversity,crypticity,and invasive species in the Atlantic-Baltic Sea Region[J].Algal Research-Biomass Biofuels and Bioproducts,2023,73.
[6] LIU D Y,KEESING J K,XING Q G,et al.World’s largest macroalgal bloom caused by expansion of seaweed aquaculture in China[J].Marine Pollution Bulletin,2009,58(6):888-895.
[7] 张必新.浒苔的生长发育和再生研究[D].苏州:苏州大学,2011.ZHANG B X.Growth,Development and reproduction of the green macroalga Ulva prolifera[D].Suzhou:Soochow University,2011.(in Chinese)
[8] 罗民波,刘峰.南黄海浒苔绿潮的发生过程及关键要素研究进展[J].海洋渔业,2015,37(6):570-574.LUO M B,LIU F.Research progress in the key process and main factors of occurrence and development of green tide(Ulva prolifera)in the South Yellow Sea[J].Marine Fisheries,2015,37(6):570-574.(in Chinese)
[9] 王建伟,阎斌伦,林阿朋,等.浒苔(Enteromorpha prolifera)生长及孢子释放的生态因子研究[J].海洋通报,2007,26(2):60-65.WANG J W,YAN B L,LIN A P,et al.Ecological factor research on the growth and induction of spores release in Enteromorpha prolifera(Chlorophyta)[J].Marine Science Bulletin,2007,26(2):60-65.(in Chinese)
[10] O’NEILL E C,SAALBACH G,FIELD R A.Gene discovery for synthetic biology:exploring the novel natural product biosynthetic capacity of eukaryotic microalgae[J].Methods in Enzymology,2016,576:99-120.
[11] ZHAO H,LIU X H,JIANG T,et al.Activated abscisic acid pathway and C4 pathway,inhibited cell cycle progression,responses of Ulva prolifera to short term high temperature elucidated by multi-omics[J].Marine Environmental Research,2023,183:105796.
[12] FAN M H,SUN X,LIAO Z,et al.Comparative proteomic analysis of Ulva prolifera response to high temperature stress[J].Proteome Science,2018,16:17.
[13] GU K,LIU Y L,JIANG T,et al.Molecular response of Ulva prolifera to short-term high light stress revealed by a multi-omics approach[J].Biology,2022,11(11):1563.
[14] UENO Y,AIKAWA S,KONDO A,et al.Adaptation of light-harvesting functions of unicellular green algae to different light qualities[J].Photosynthesis Research,2019,139(1/2/3):145-154.
[15] DONG M T,ZHANG X W,ZOU J,et al.Identification and expression analysis of the gene lhcSR associated with adaptation to light and low temperature stress in the green tide forming alga Ulva prolifera[J].Marine Biology Research,2012,8(8):746-755.
[16] 王阳阳,霍元子,曹佳春,等.低温、低光照强度对扁浒苔生长的影响[J].中国水产科学,2010,17(3):593-599.WANG Y Y,HUO Y Z,CAO J C,et al.Influence of low temperature and low light intensity on growth of Ulva compessa[J].Journal of Fishery Sciences of China,2010,17(3):593-599.(in Chinese)
[17] METAXA E,DEVILLER G,PAGAND P,et al.High rate algal pond treatment for water reuse in a marine fish recirculation system:water purification and fish health[J].Aquaculture,2006,252(1):92-101.
[18] SONG W,WANG Z L,LI Y,et al.Tracking the original source of the green tides in the Bohai Sea,China[J].Estuarine,Coastal and Shelf Science,2019,219:354-362.
[19] XU J, FAN X,ZHANG X,et al. Evidence of coexistence of C3 and C4 photosynthetic pathways in a green-tide-forming alga, Ulva prolifera[J].PloS one, 2012, 7(5): e37438.
[20] 马汶菲,李景玉.从藻类生理生态学角度解析绿潮爆发的内在机制[J].应用生态学报,2022,33(5):1420-1428.MA W F,LI J Y.Analysis of the underlying mechanisms of green tide with a perspective of algae ecophysiology[J].Chinese Journal of Applied Ecology,2022,33(5):1420-1428.(in Chinese)
[21] PULLERITS T,SUNDSTRÖM V.Photosynthetic light-harvesting pigment-protein complexes:toward understanding how and why[J].Accounts of Chemical Research,1996,29(8):381-389.
[22] ZHANG X W,CAO S N,LI Y X,et al.Expression of three putative early light-induced genes under different stress conditions in the green alga Ulva linza[J].Plant Molecular Biology Reporter,2012,30(4):940-948.
[23] MEN Y Z,LIU Y Y,MA Y F,et al.Remote sensing monitoring of green tide disaster using MODIS and GF-1 data:a case study in the Yellow Sea[J].Journal of Marine Science and Engineering,2023,11(12):2212.
[24] JAUFFRAIS T,BRISSET M,LAGOURGUE L,et al.Seasonal changes in the photophysiology of Ulva batuffolosa in a coastal barrier reef[J].Aquatic Botany,2022,179:103515.
[25] 张娟,李翔宇,窦勇,等.混合光照对雨生红球藻PSⅡ光化学活性与色素积累的影响[J].食品研究与开发,2023,44(20):39-46.ZHANG J,LI X Y,DOU Y,et al.Effects of mixed illumination on photochemical activity and pigment accumulation of Haematococcus pluvialis PSⅡ[J].Food Research and Development,2023,44(20):39-46.(in Chinese)
[26] 张犇,郭悦,武钰馨,等.叶片温度检测技术与植物高温胁迫响应机制研究进展[J].山西大学学报(自然科学版),2024,4(3):657-672.ZHANG B,GUO Y,WU Y X,et al.Advances in leaf temperature detection technology and plant high temperature stress response mechanism[J].Journal of Shanxi University(Natural Science Edition),2024,4(3):657-672.(in Chinese)
[27] 林雪乔.豌豆光系统Ⅰ的捕光天线复合体光保护机制的生理学研究[D].济南:济南大学,2019.LIN X Q.Physiological study on photoprotection mechanism of light-harvesting complex I from pea[D].Jinan:University of Jinan,2019.(in Chinese)
[28] 张子山,杨程,高辉远.植物光系统I的低温光抑制及恢复[J].植物生理学报,2013,49(4):301-308.ZHANG Z S,YANG C,GAO H Y.Chilling photoinhibition of photosystem Ⅰ and its recovery after photoinhibition[J].Plant Physiology Journal,2013,49(4):301-308.(in Chinese)
[29] BRICKER T M,FRANKEL L K.Carboxylate groups on the manganese-stabilizing protein are required for efficient binding of the 24 kDa extrinsic protein to photosystem Ⅱ[J].Biochemistry,2003,42(7):2056-2061.
[30] YI X P,MCCHARGUE M,LABORDE S,et al.The manganese-stabilizing protein is required for photosystem Ⅱ assembly/stability and photoautotrophy in higher plants[J].The Journal of Biological Chemistry,2005,280(16):16170-16174.
[31] ROOSE JL,YOCUM C F,POPELKOVA H.Binding stoichiometry and affinity of the manganese-stabilizing protein affects redox reactions on the oxidizing side of photosystem Ⅱ[J].Biochemistry,2011,50(27):5988-5998.
[32] GURURANI M A,UPADHYAYA C P,STRASSER R J,et al.Evaluation of abiotic stress tolerance in transgenic potato plants with reduced expression of PSⅡ manganese stabilizing protein[J].Plant Science:an International Journal of Experimental Plant Biology,2013,198:7-16.
[33] LIU D Y,MA Q,VALIELA I,et al.Role of C4 carbon fixation in Ulva prolifera,the macroalga responsible for the world’s largest green tides[J].Communications Biology,2020,3(1):494.
[34] 欧阳宁.TlPDRP对转ZmPEPC+ZmPPDK基因水稻光合生理的影响[D].长沙:湖南大学,2021.OUYANG N.Effect of TIPDRP on photosynthetic physiology of transgenic rice with ZmPEPC+ZmPPDK gene[D].Changsha:Hunan University,2021.(in Chinese)
[35] SUN J Y,ZHAO C Y,ZHAO S,et al.Diversity of CO2 concentrating mechanisms in macroalgae photosynthesis:a case study of Ulva sp.[J].Journal of Marine Science and Engineering,2023,11(10):1911.
[36] 张桂芳,丁在松.C3植物的C4光合途径[J].生物学通报,2015,50(3):12-16.ZHANG G F,DING Z S. C4 photosynthetic pathway of C3 plants [J].Bulletin of Biology,2015,50(3):12-16.(in Chinese)
[37] HAIMOVICH-DAYAN M,GARFINKEL N,EWE D,et al.The role of C4 metabolism in the marine diatom Phaeodactylum tricornutum[J].New Phytologist,2013,197(1):177-185.
[38] SHA H, WASIFA H, et al. Decarboxylation mechanisms of the C4 cycle in foxtail millet observed under salt and selenium treatments[J].Plant Growth Regulation, 2023, 99(1):65-83.
[39] CALACE P, TONETTI T, MARGARIT E, et al.The C4 cycle and beyond: diverse metabolic adaptations accompany dual-cell photosynthetic functions in Setaria [J].Journal of Experimental Botany, 2022, 72(22): 7876-7890.