海水养殖是中国农业的支柱产业之一[1]。海水贝类养殖是中国海水养殖的重要组成部分,占中国海水养殖总产量的70%左右[2]。中国海水养殖贝类多为双壳、滤食性和不投饵种类,在产生良好经济效益的同时,兼具重要的生态服务功能,在服务国家“双碳”战略目标中具有重要潜力[3]。近年来,因养殖规模扩大、种质退化及养殖生态环境恶化等原因,海水贝类大规模死亡事件频发,严重制约了贝类养殖产业的健康发展。多营养层次综合养殖(integrated multi-tropic aquaculture,IMTA)被认为是一种有利于水产养殖可持续发展的养殖模式,是解决中国海水贝类养殖问题的一种可参考途径[4]。在以往开放海域综合养殖实践过程中,黄海水产研究所探索了贝藻养殖[5]、贝藻参[6]养殖等多种经典综合养殖模式,但受加工场地及养殖条件等因素限制[7],大面积推广难度较大。因此,需要开发一种适应范围更广的开放海域综合养殖模式。
受限于笼具空间等条件限制,滤食性贝类养殖实践中均未引入高营养级混养生物。在同样采用笼具养殖的皱纹盘鲍(Haliotis discus hannai Ino)中,引入甲虫螺(Cantharus cecillei)这一高营养级混养生物[8],取得了良好生态效益。因此,在双壳贝类养殖笼具内添加活动能力较弱的高营养级腹足类动物是一种可参考的综合养殖方案。香螺(Neptunea cumingii)是中国北方一种重要的海水经济螺类,自然分布于中国、日本、韩国及俄罗斯等东亚海域,是中国黄渤海常见种[9]。香螺自然生活在潮下带,分布水深从数米至80余米,分布区域与中国北方大部分海水养殖贝类重叠,具备与双壳贝类综合养殖的空间生态位基础。在本团队前期研究中发现,香螺对双壳贝类摄食偏好较低,具备贝螺综合养殖营养生态位基础。目前,有关香螺的研究多主要集中在群体遗传[10-11]、胚胎发育[12]、生态习性[13]及繁殖生物学[14-16]等方面,在涉及香螺食性研究中,Yang等[17]利用营养标志物法分析了香螺营养级及在食物网中的地位,李华煜等[18]采用试验观察法分析了香螺对双壳贝类的摄食偏好,贺加贝等[19]采用行为观察法分析了养殖条件下香螺对不同种类饵料的摄食选择及摄食节律。然而,目前尚未有自然条件下香螺具体食性的相关研究,且香螺作为混养生物,开展贝螺综合养殖尚未见报道。
本研究在室外池塘条件下,将香螺与魁蚶(Scapharca broughtonii)、栉孔扇贝(Chlamys farreri)、海湾扇贝(Argopecten irradians)、长牡蛎(Crassostrea gigas)和紫贻贝(Mytilus galloprovincialis)进行混养,并在同等条件下选择其中3种双壳贝类单独养殖,以月增重率、存活率及终末湿质量等作为评价指标,对双壳贝类+香螺的综合养殖可行性及养殖效果进行了探索,另采集野生香螺,基于DNA条形码技术对其食性进行分析,以期揭示香螺在自然条件下的营养来源,为更好地开展贝螺综合养殖提供科学指导。
1 材料与方法
1.1 材料
本试验于2023年10—11月在烟台牟平室外海水养殖池塘(面积约为7 000 m2,平均水深约为2 m,底质为沙泥底,每7 d换水1/3)开展,试验期间水温为4.8~17.4 ℃,盐度为30~31。试验所用养殖笼具为常见鲍养殖笼(规格约为40 cm×30 cm×15 cm),贴底放置。香螺采集自威海龙须岛海域,体质量为(19.71±4.36)g,壳高为(5.23±3.21)cm;魁蚶、长牡蛎、紫贻贝、栉孔扇贝和海湾扇贝等5种双壳贝类均采集自本地养殖场。其中,栉孔扇贝、紫贻贝及海湾扇贝分大小两种规格(表1)。
表1 试验所用贝类及壳长
Tab.1 Shellfish species and shell length in the experiment mm
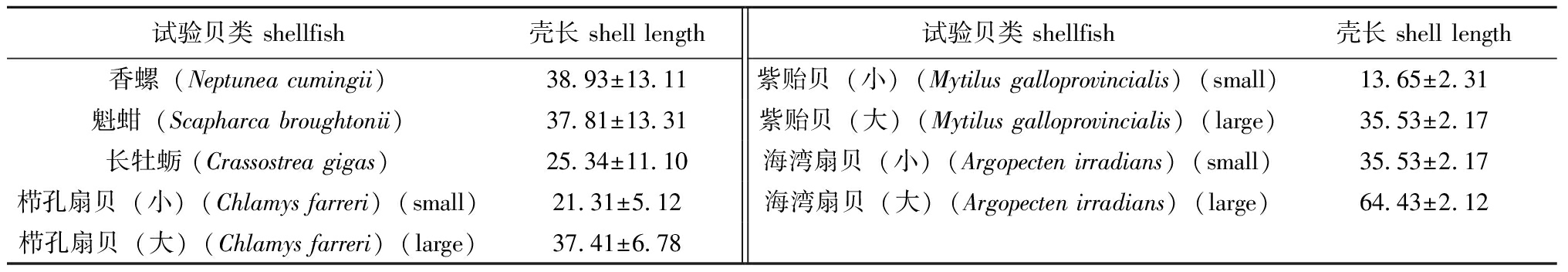
试验贝类 shellfish壳长 shell length试验贝类 shellfish壳长 shell length香螺(Neptunea cumingii)38.93±13.11紫贻贝(小)(Mytilus galloprovincialis)(small)13.65±2.31魁蚶(Scapharca broughtonii)37.81±13.31紫贻贝(大)(Mytilus galloprovincialis)(large)35.53±2.17长牡蛎 (Crassostrea gigas)25.34±11.10海湾扇贝(小)(Argopecten irradians)(small)35.53±2.17栉孔扇贝(小)(Chlamys farreri)(small)21.31±5.12海湾扇贝(大)(Argopecten irradians)(large)64.43±2.12栉孔扇贝(大)(Chlamys farreri)(large)37.41±6.78
1.2 方法
试验开始前将香螺于室内暂养5 d,使之处于同等饥饿状态;将双壳贝类置于试验池塘鲍鱼笼内适应5 d,剔除死亡个体。试验开始后,准确称取香螺湿质量,按照试验设计将香螺与双壳贝类同笼混养或双壳贝类单养,每7~8 d观测一次,统计死亡香螺和双壳贝类种类及个数,并补充壳长接近的同种贝类。混养试验共分7组,分别是香螺与魁蚶(A组)、长牡蛎(B组)、紫贻贝(C组)、栉孔扇贝(D组)、海湾扇贝(E组)、5种混合贝类(F组)混养组及高密度香螺与5种混合贝类混养组(G组);在同样试验条件下开展魁蚶(H组)、栉孔扇贝(I组)和海湾扇贝(J组)单养试验。其中,C、D、E 3组中双壳贝类均分为大小两种规格。具体试验设计见表2。每组设置4个重复,试验期间共计进行4次观测,试验周期30 d。
表2 香螺与混养双壳贝类数量
Tab.2 Number of Neptuneacumingii and bivalves in polyculture

组别 group香螺数量 number of N.cumingii双壳贝类 bivalve双壳贝类数量 number of bivalvesA5魁蚶(Scapharca broughtonii)10B5长牡蛎(Crassostrea gigas)10C5紫贻贝(小)(Mytilus galloprovincialis)(small)紫贻贝(大)(Mytilus galloprovincialis)(large)55D5栉孔扇贝(小)(Chlamys farreri)(small)栉孔扇贝(大)(Chlamys farreri)(large)55E5海湾扇贝(小)(Argopecten irradians(small)海湾扇贝(大)(Argopecten irradians)(large)55F5魁蚶(Scapharca broughtonii)长牡蛎(Crassostrea gigas)紫贻贝(Mytilus galloprovincialis)栉孔扇贝(Chlamys farreri)海湾扇贝(Argopecten irradians)22222G20魁蚶(Scapharca broughtonii)长牡蛎(Crassostrea gigas)紫贻贝(Mytilus galloprovincialis)栉孔扇贝(Chlamys farreri)海湾扇贝(Argopecten irradians)22222H0魁蚶(Scapharca broughtonii)10I0栉孔扇贝(Chlamys farreri)10J0海湾扇贝(Argopecten irradians)10
1.2.1 香螺对双壳贝类的摄食选择偏好 香螺对不同规格双壳贝类摄食偏好中,根据C~E 3组中每次观测每笼被摄食不同规格双壳贝类个数,计算每次观测单笼不同规格双壳贝类被捕食率。香螺对不同种类双壳贝类摄食偏好中,根据F、G 2组每次观测每笼被捕食不同种类双壳贝类个数,计算每次观测单笼不同种类双壳贝类被捕食率。香螺不同水温条件下对双壳贝类摄食偏好中,以水温10 ℃为分界线,将试验区间分为两组。根据A~G 7组每次观测每笼被捕食所有双壳贝类个数,计算每次观测单笼被捕食率。
1.2.2 混养双壳贝类对香螺生长及存活的影响 试验过程中,准确称取单笼所有存活香螺总湿质量,并根据A~F 6组每次观测单笼香螺最终存活数和试验期间补充数,计算单笼香螺月增重率及每次观测香螺存活率;投放不同数量香螺对香螺生长及存活的影响中,准确称取试验结束单笼所有存活香螺总湿质量,并根据F、G 2组每次每笼香螺最终存活数和试验期间补充数,计算单笼香螺月增重率及每次观测香螺存活率;不同摄食状态对香螺生长及存活的影响中,根据整个试验周期内所观测香螺摄食情况,将所有笼分为摄食组及不摄食组两组,并利用单笼内香螺月增重率及每次观测香螺存活率,分析不同摄食状态下香螺月增重率及存活率差异。
1.2.3 混养香螺对双壳贝类生长及存活的影响 根据A、D、E、H、I和J 6组中每次观测每笼被捕食所有双壳贝类个数,计算每次观测每笼双壳贝类存活率;试验结束时,将各组剩余双壳贝类分别混合,随机称取双壳贝类湿质量,每组称取30只,之后以A-H、D-I和E-J进行两两分组,用作后续比较3对分组中双壳贝类终末湿质量差异。
1.2.4 香螺单独养殖对其生长的影响 2024年3—4月,于水温5.2~13.6 ℃条件下,采用“1.1节”中相同试验条件。将单独香螺称重并标记后,每笼20只养殖30 d,期间不投喂饵料。试验结束,对香螺进行逐个称重。
1.2.5 自然条件下香螺摄食选择 2023年12月,采集自然条件下香螺个体16只,解剖取得胃含物,每4只胃含物混成1个样品,共4个样品,于-20 ℃下保存。利用E.Z.N.A.® soil DNA kit (Omega Bio-tek,Norcross,GA,U.S.)试剂盒,根据说明书提取DNA,溶于30 μL的Tris-HCl (10 mmol/L,pH 8.0)中,使用NanoDrop 2000检测DNA纯度和浓度,使用10 g/L琼脂糖凝胶电泳检测DNA完整性;采用引物547F和V4R对18S~V4区间进行扩增(表3),PCR反应体系参照文献所述。扩增产物进行高通量测序分析。
表3 香螺胃含物种类鉴定PCR引物
Tab.3 PCR primers for species identification of stomach contents of Neptuneacumingii
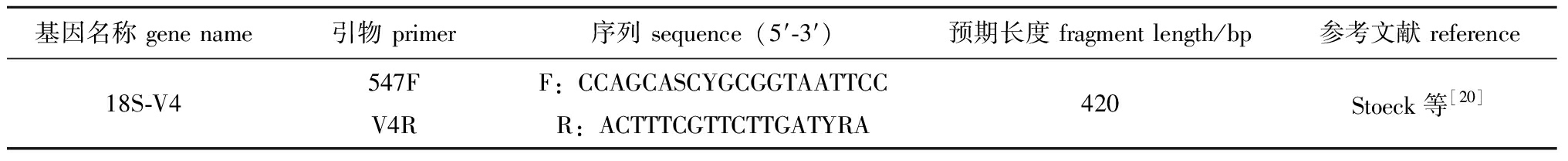
基因名称 gene name引物 primer序列 sequence(5′-3′)预期长度 fragment length/bp参考文献 reference18S-V4547FV4RF:CCAGCASCYGCGGTAATTCCR:ACTTTCGTTCTTGATYRA420Stoeck等[20]
1.2.6 生长性能指标的测定 香螺月增重率(WGR,%)、双壳贝类被捕食率(SR,%)和存活率(PR,%)计算公式为
RWGR=100%×[(mt-m0)/m0],
(1)
RSR=100%×Nfi/Nsi,
(2)
RPR =100%×Npi/Nsi。
(3)
式中:mt和m0分别为试验结束和开始时单笼内香螺的总湿质量(g);Nsi为试验开始时单笼第i种贝类的个数;Nfi为每次观测单笼剩余的第i种贝类个数;Npi为每次观测单笼被捕食的第i种双壳贝类个数。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示。利用R 4.3.2软件对数据进行正态分布检验(Shapiro-Wilk检验)和方差齐性检验(Levene’s检验),利用GraphPad Prism 10.1.0软件对数据进行Wilcoxon秩和检验、Kruskal-Wallis秩和检验、单因素方差分析(one-way ANOVA)及独立t检验等分析,差异显著性水平为0.05。利用Trimmomatic 0.36软件采用滑动窗口策略,窗口大小设置50 bp,平均质量值为20,最小保留序列长度为120,Pear 0.9.6用于去除具有N的序列,对原始下机数据进行质控;利用Flash 1.20、Pear 0.9.6根据PE的overlap关系对两端序列进行拼接(merge)处理,最小overlap设置10 bp,错配率为0.1,得到Fasta序列;根据已知数据库用uchime方法比对去除Fasta序列的嵌合体,对于未知数据库使用自比对(denovo)方法进行去除,同时去除不合要求的短序列,生成优质序列(clean tags)。将clean tags用uparse聚类法生成OTUs。选择 OTU 代表序列采用RDP Classifier算法,设置置信度阈值为0.7,与NCBI Nucleotide (https://www.ncbi.nlm.nih.gov/)数据库比对进行物种注释。通过 OTU 分析得出胃含物组成的多样性和不同物种的相对丰度(relative abundance,即单个物种的序列数/总序列数)。
2 结果与分析
2.1 香螺对双壳贝类的摄食选择偏好
本试验过程中,香螺对紫贻贝、栉孔扇贝和海湾扇贝大小两种规格捕食率均较低,对小规格紫贻贝捕食率最高,为2.50%±5.78%;对大规格栉孔扇贝捕食率最低,为0.00%;在同种贝类中,香螺对大、小规格贝类捕食率标准差均较大,且对大、小规格捕食率间并无显著性差异(P>0.05)(表4)。在低密度(F组)和高密度(G组)香螺混养组中,仅海湾扇贝出现被捕食情况,捕食率分别为0.63%±2.50%和2.50%±6.83%,其他4组中贝类均未出现被捕食情况。香螺在10 ℃以下时对双壳贝类捕食率明显偏高,达到4.64%±10.36%,且与10 ℃以上时有显著性差异(P<0.05);两种温度条件下捕食率标准差均较大,数据离散程度较高(图1)。
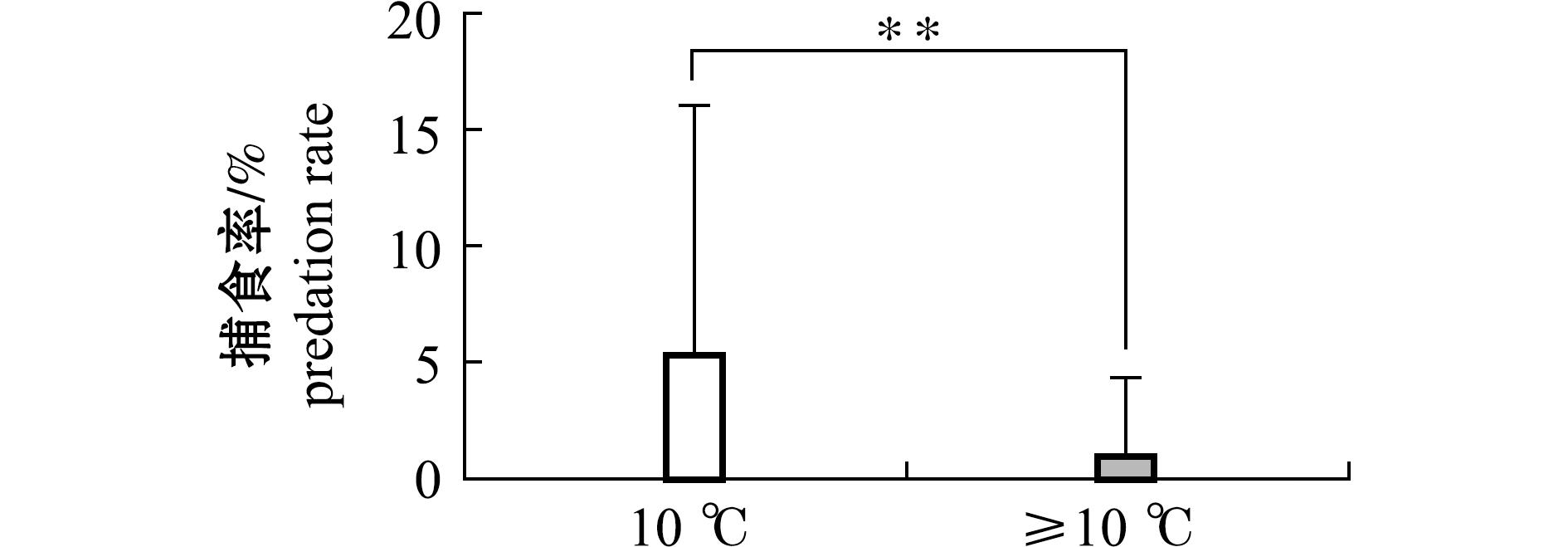
**表示组间差异显著,下同。
** means significant difference in different groups,et sequentia.
图1 香螺不同温度下捕食率
Fig.1 Predation rate of Neptuneacumingii at different temperature
表4 香螺对不同规格双壳贝类捕食率
Tab.4 Predation rate of Neptuneacumingii on different size bivalves %

双壳贝类规格 size of bivalves紫贻贝(Mytilus galloprovincialis)栉孔扇贝(Chlamys farreri)海湾扇贝(Argopecten irradians)小 small2.50±5.780.63±2.501.25±3.42大 large0.63±2.500.00±0.001.25±3.42
2.2 贝螺综合养殖对香螺生长及存活的影响
香螺与不同种类双壳贝类综合养殖,其体质量均有所增长,与栉孔扇贝混养香螺月增重率最高,达到22.85%±5.34%,与魁蚶混养香螺月增重率最低,为16.83%±2.76%,但与不同种类双壳贝类综合养殖对香螺增重率影响无显著性差异(P>0.05)(图2(a))。在不同投放密度香螺增重率的比较中,投放高密度(G组)香螺组增重率更高,达到19.28%±0.62%,但与投放低密度(F组)香螺组增重率(18.37%±1.79%)无显著性差异(P>0.05)(图2(b))。不同摄食状态香螺增重率的比较中,摄食过双壳贝类的香螺增重率更高,达到21.12%±14.12%,但与未摄食状态香螺组增重率(18.73%±3.63%)无显著性差异(P>0.05)(图2(c))。在本试验进行过程中,香螺均无死亡,贝螺综合养殖对香螺存活无影响,香螺单独养殖30 d后,前后体质量无显著性差异(P>0.05)。
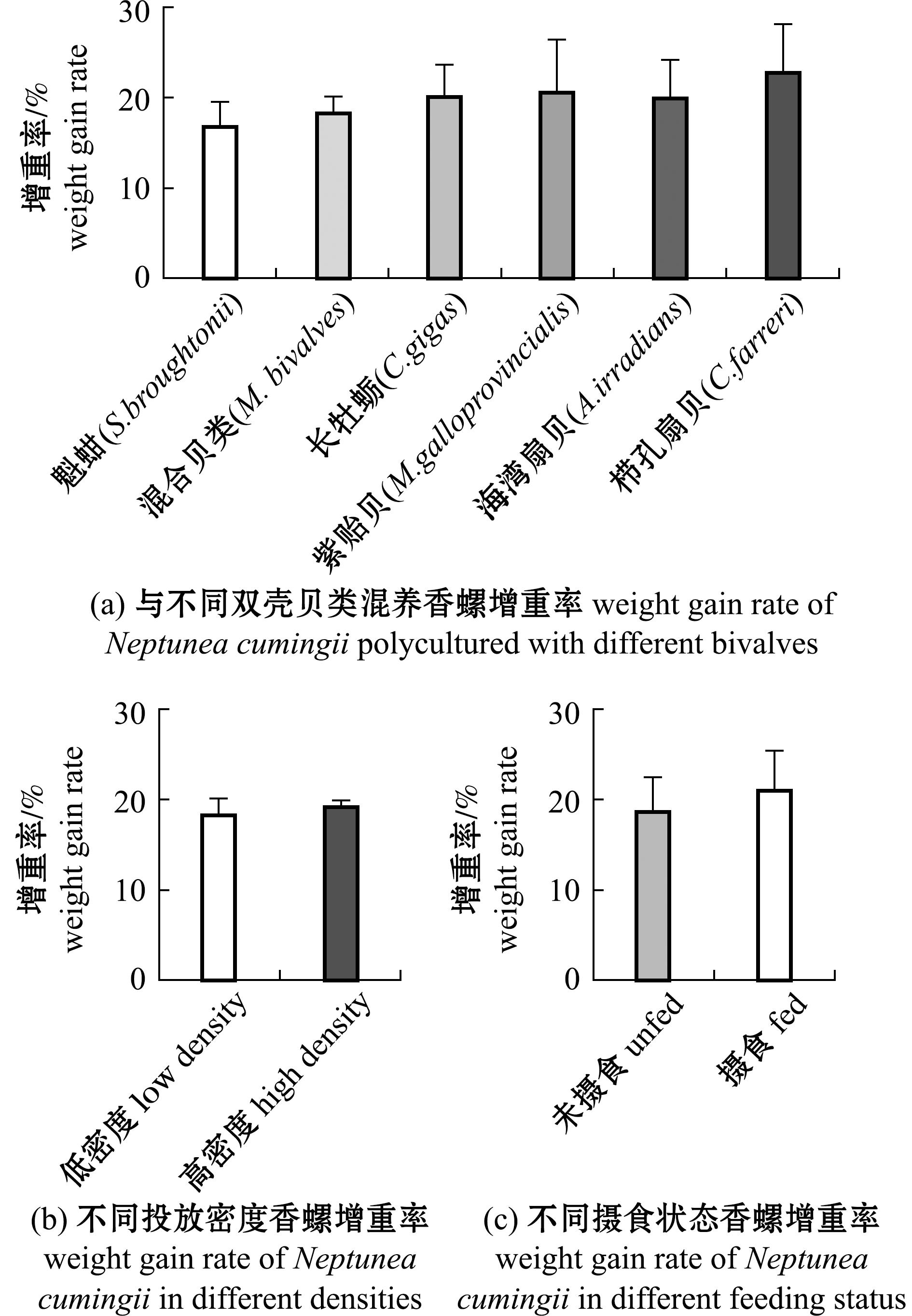
图2 不同条件下香螺增重率
Fig.2 Weight gain rate of Neptuneacumingii in different conditions
2.3 贝螺综合养殖对双壳贝类生长及存活的影响
综合养殖模式下,魁蚶(15.93±1.98)g和栉孔扇贝(14.32±3.72)g最终湿质量均较单独养殖模式略高,海湾扇贝单独养殖模式(39.05±3.85)g最终湿质量较高,但同种双壳贝类不同养殖模式间单位湿质量均无显著性差异;综合养殖模式下的魁蚶、单养模式下的栉孔扇贝和海湾扇贝均未见死亡,同时,单独养殖模式下魁蚶(99.38%±2.50%)和混合养殖模式下栉孔扇贝(99.38%±2.50%)、海湾扇贝(96.25%±10.88%)存活率也均较高,同种双壳贝类不同养殖模式间存活率无显著性差异(P>0.05)(表5)。
表5 不同养殖模式下双壳贝类最终湿质量及存活率
Tab.5 Final wet body weight and survival rate of bivalves in different aquaculture modes
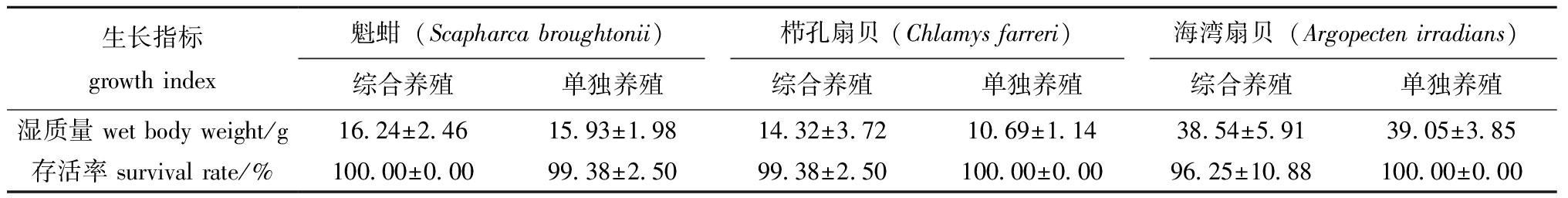
生长指标growth index魁蚶(Scapharca broughtonii) 栉孔扇贝 (Chlamys farreri)海湾扇贝(Argopecten irradians) 综合养殖单独养殖综合养殖单独养殖综合养殖单独养殖湿质量 wet body weight/g16.24±2.4615.93±1.9814.32±3.7210.69±1.1438.54±5.9139.05±3.85存活率 survival rate/%100.00±0.0099.38±2.5099.38±2.50100.00±0.0096.25±10.88100.00±0.00
2.4 香螺自然条件下摄食选择
本次测序获得优化序列信息519 101,230 057 438 bases,平均序列长度为443 bp;经OTU聚类,获得6 769个OTU单元,注释到6界14门35纲49目58科59属67种。自然条件下,香螺冬季现场食物组成较为复杂,去除未能获得准确注释及香螺自身序列后,香螺胃含物共注释到囊括哺乳纲、线虫纲、有胚植物纲、纤毛亚门的Postciliodesmatophora、腹足纲、银耳纲、马拉色菌纲、辅鳍鱼纲、伞菌纲、变形虫纲、散囊菌纲、酵母纲、子囊菌纲、座囊菌纲、蛭态纲、色矛纲、类锥体纲及枝黏菌纲等18个纲(图3)。
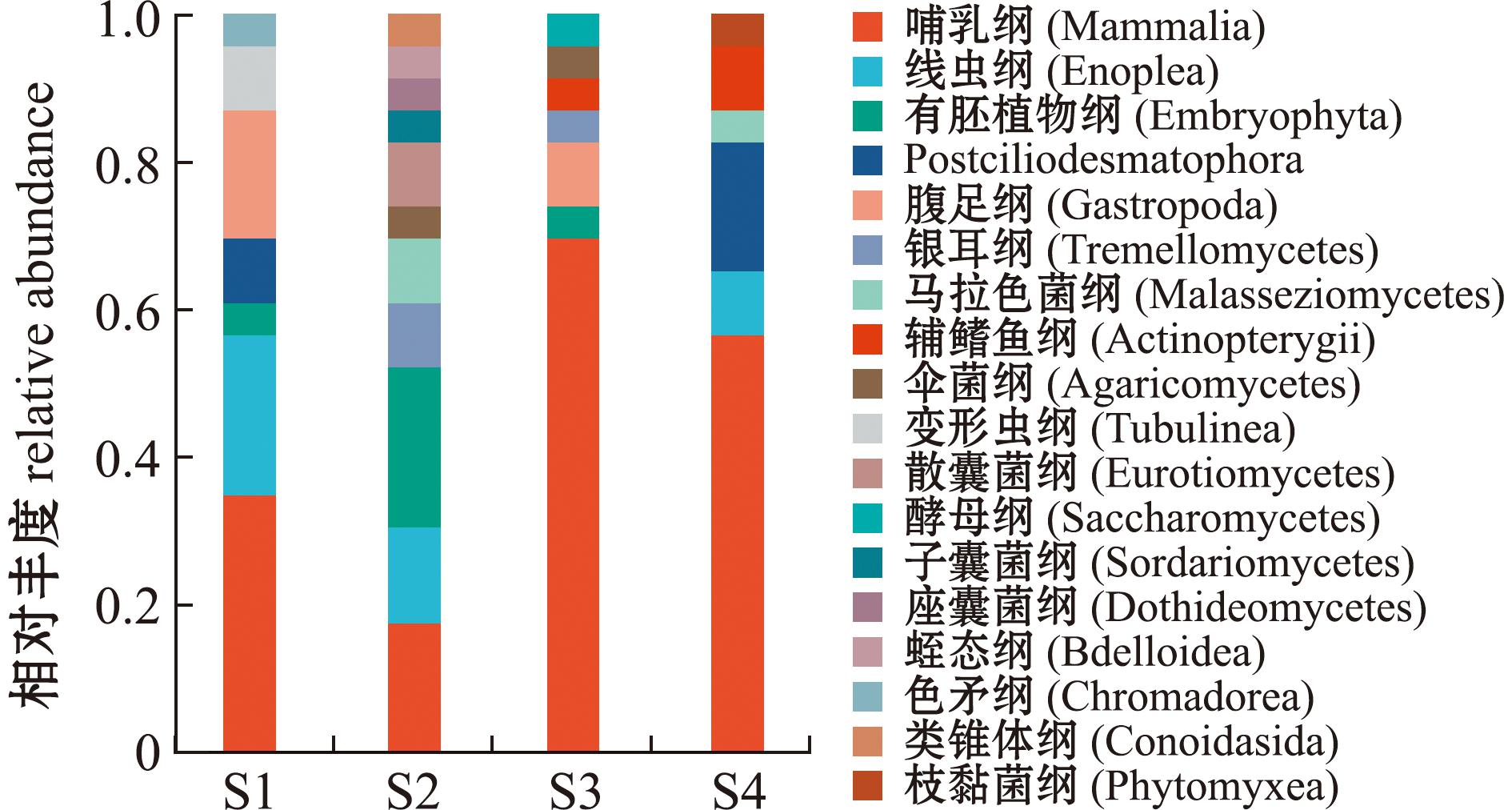
图3 香螺胃含物纲水平相对丰度组成百分比
Fig.3 Relative abundance proportion of stomach contents for Neptuneacumingii in class level
3 讨论
3.1 香螺摄食选择性
了解养殖生物相互间的营养关系是开展综合养殖工作的前提条件。本研究中发现,香螺对不同规格双壳贝类捕食率平均值均偏低,数据离散程度较高,且相互间无显著性差异,这表明香螺对不同规格贝类无明显摄食偏好,摄食与否存在较大偶然性。这与贺加贝等[21]在脉红螺(Rapana venosa)中的研究不一致,可能是由于两种腹足类动物捕食方式差异较大。脉红螺主要采用腹足包裹窒息杀死猎物[22],相较于脉红螺,香螺更偏向腐食性[17],捕食中较少包含杀死猎物过程,故其对贝类规格并无明显选择性。
香螺对不同种类双壳贝类捕食率无显著性差异,且同样均值偏低,标准差偏大,表明双壳贝类种类也不是决定香螺摄食与否的关键因素,这与李华煜等[18]的研究不一致。这可能是因试验生物状态差异导致的,本研究中所用双壳贝类均为活体,而之前对香螺摄食行为研究中,所采用的饵料生物为开壳双壳贝类,香螺在杀死猎物时基本无须耗费能量。根据最优觅食理论(optimal foraging theory)[23-24],可能是由于香螺杀死猎物能力不足,与双壳贝类综合养殖过程中,其摄食活体贝类所获得能量不足以弥补杀死猎物所耗费能量,因此,相较于贝类种类,贝类活力在香螺摄食选择中的优先级更高。
在低温条件下,香螺摄食率显著升高,且与较高温度组有显著性差异,但摄食率数据离散程度仍较高,表明在此环境条件下,香螺摄食行为仍存在较大的偶然性。有研究发现,香螺摄食峰值的温度为15~17 ℃[18,25],这与本研究不一致。可能是因为在本试验后期,寒流导致池塘水温骤降,海湾扇贝活力降低,香螺对海湾扇贝捕食率升高;试验前期虽水温条件为香螺最适宜摄食水温,但多数双壳贝类均处于活力旺盛状态,香螺无法捕食,故捕食率较后期偏低。也有研究发现,双壳贝类不同活力状态对香螺摄食影响极大[18],这较好地解释了本试验中低温状态下香螺摄食率更高的问题,即在适温范围内,双壳贝类活力状态是决定香螺摄食与否的关键因素。
3.2 贝螺综合养殖模式下香螺生长及存活分析
在多营养级综合养殖实践中,通常会确定一种经济价值较高的生物作为主养对象,其他生物会根据主养对象的生态习性引入,如贝+虾、虾+河鲀综合养殖模式均以对虾作为主养对象[4]。香螺经济价值较高,具备成为主养对象的潜力,探明综合养殖对其生长及存活指标的影响,是后期确定综合养殖方案的必要条件。
本试验中,香螺并未见死亡,表明香螺是一种较为理想的养殖对象,具备与双壳贝类综合养殖的基础条件。与不同双壳贝类开展综合养殖,香螺月增重率均可达到20%左右,且各组间无显著性差异(P>0.05),这与朱建业[26]的研究不一致。这可能是因为在其他研究中,双壳贝类等作为主要饵料生物被大量摄食,是香螺生长及营养积累的最主要能量来源;本试验中香螺对双壳贝类的摄食量较少,对香螺的生长并未起到主要营养供给作用。
高密度混养组香螺增重率较高,但不同养殖密度的香螺增重率无显著性差异(P>0.05),表明养殖密度对香螺生长影响不大,这与Stoeck[20]在脉红螺中的研究一致。动物放养密度与生长之间的关系较为复杂,因养殖物种种类、规格而异[27],本试验中香螺并未对双壳贝类表现出明显的营养竞争行为,也未见相互间争斗等社会等级行为,因此,本研究认为在适当范围内养殖密度对香螺生长影响不大。
3.3 贝螺综合养殖模式下能量来源分析
在试验过程中摄食双壳贝类组香螺相较于未摄食组增重率偏高,但并未达到显著性差异水平。可能是因为香螺对双壳贝类的摄食水平普遍较低,并不能对其生长起到明显促进作用。相较于其他研究[26],本试验中香螺增重率均处于较高水平,这可能是因为在香螺生长过程中,双壳贝类并非唯一能量来源。虽有报道表明,贝类可直接利用水体中的无机物合成贝壳[28],但在本研究中,单养试验组香螺体质量并未产生明显增长,表明本试验中香螺体质量增重部分并非来源于贝壳增重。野生香螺胃含物分析表明,香螺食性较为复杂,其中哺乳纲及辅鳍鱼纲来源于动物尸体,与已报道的香螺的偏向腐食性相一致[17,19];相关研究发现,野生香螺胃含物中另一个重要食物来源于海洋真菌及纤毛虫等小型生物,其主要来自海洋沉积物,表明沉积物中丰富的有机碎屑和小型生物可能是香螺重要的食物来源,这与周天成等[29]中塔形马蹄螺(Tectus pyramis)研究一致;另外,高等植物在香螺胃含物中检出,暗示香螺具备一定植食性能力,这与Yang等[17]研究一致。
基于自然条件下香螺复杂的食性组成,本试验地点位于室外养殖池塘,底泥及水体沉降物可以为养殖笼内带来部分有机物,双壳贝类滤食作用亦可耦合水体中颗粒有机物[30],以粪便或假粪形式排出,这些有机物可能作为香螺能量来源。另外,在甲虫螺相关研究中[8],甲虫螺可以在牡蛎等附着生物非常微小的阶段将其捕食,同为蛾螺科动物,香螺可能具备类似能力,从而以贝壳表面微小附着生物为能量来源。另外,本试验地点位于室外养殖池塘,试验时间适逢秋季,附着生物生物量较多[31-32],这些附着生物也可能作为香螺能量来源,香螺在不同时空及贝螺综合养殖条件下的营养生态位尚需后期试验验证。
3.4 贝螺综合养殖模式下双壳贝类生长存活分析
在本试验的综合养殖模式下,双壳贝类与单养模式相比,成活率及终末湿质量均无显著性差异,表明贝螺综合养殖对双壳贝类养殖无显著性影响。通常情况下,捕食者胁迫对被捕食者运动、生长及生殖等指标均会产生一定影响[33-34]。但本试验中,香螺对同笼养殖的双壳贝类生长及存活基本无影响。这可能是因为香螺对活体双壳贝类捕食能力过弱,不能构成捕食威胁。在双壳贝类养殖生产实践中,整个养殖过程要经历数次人工分苗、养殖水层调整或极端天气等不利因素胁迫,不可避免地产生病害乃至死亡现象[35-37]。贝类病害发生是病原、宿主和环境共同作用结果[38],香螺对活力弱个体的捕食行为减少了病原生物的传播,可以起到生态防病作用,减少了大规模病害暴发的风险,有利于双壳贝类养殖产量提升。
4 结论
本试验在室外池塘开展了香螺与双壳贝类综合养殖探索,并基于DNA条形码技术分析了自然条件下香螺的胃含物组成。得出以下结论。
1)在综合养殖模式下,香螺摄食与否主要决定因素为双壳贝类活力,混养不同种类贝类香螺均增重明显,且不同混养条件对香螺生长存活无显著影响,双壳贝类生长及存活与单独养殖模式亦无显著差异。
2)自然条件下,香螺胃含物组成复杂,具备与双壳贝类综合养殖条件,且香螺增速明显,具备成为主养对象潜力,是一种可示范可推广的开放海域综合养殖模式。
[1] 宋林生.我国海水养殖贝类病害发生现状及防控策略[J].水产学报,2023,47(11):146-150.SONG L S.The occurrence and prevention and control strategies of mollusc diseases in marine aquaculture of China[J].Journal of Fsheries of China,2023,47(11):146-150.(in Chinese)
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.中国渔业统计年鉴[M].北京:中国农业出版社,2023.Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.Statistical yearbook of fishing industry in China from 2001 to 2023[M].Beijing:China Agriculture Press,2023.(in Chinese)
[3] 唐启升,蒋增杰,毛玉泽.渔业碳汇与碳汇渔业定义及其相关问题的辨析[J].渔业科学进展,2022,43(5):1-7.TANG Q S,JIANG Z J,MAO Y Z.Clarification on the definitions and its relevant issues of fisheries carbon sink and carbon sink fisheries[J].Progress in Fishery Sciences,2022,43(5):1-7.(in Chinese)
[4] 董双林,田相利,高勤峰.水产养殖生态学[M].2版.北京:科学出版社,2021.DONG S L,TIAN X L,GAO Q F.Aquaculture ecology[M].2nd ed.Beijing:Science Press,2021.(in Chinese)
[5] FANG J G,SUN H L,YAN J P,et al.Polyculture of scallop Chlamys farreri and kelp Laminaria japonica in Sungo Bay[J].Chinese Journal of Oceanology and Limnology,1996,14(4):322-329.
[6] FANG J G,FUNDERUD J,QI Z H,et al.Sea cucumbers enhance IMTA system with abalone,kelp in China[J].Global Aquaculture Advocate,2009,12(4):49-51.
[7] 贺加贝,孙俊荣,赵强,等.烟台市贝藻养殖的碳汇贡献及能力评价[J].海洋湖沼通报,2022,44(3):117-122.HE J B,SUN J R,ZHAO Q,et al.Contribution and ability assessments of carbon sink by marine bivalves and seaweeds in Yantai coastal water[J].Transactions of Oceanology and Limnology,2022,44(3):117-122.(in Chinese)
[8] 王英朴,李加琦,薛素燕,等.3种螺对养殖鲍外壳附着牡蛎的防除作用[J].中国水产科学,2023,30(3):344-351.WANG Y P,LI J Q,XUE S Y,et al.Effects of three kinds of snails on the control of oysters attached to the shell of cultured abalone[J].Journal of Fishery Sciences of China,2023,30(3):344-351.(in Chinese)
[9] 郭栋,刘修泽,王爱勇,等.辽东湾香螺资源的分布研究[J].水产科学,2015,34(11):718-721.GUO D,LIU X Z,WANG A Y,et al.Stock distribution of whelk Neptunea arthritica crosse in Liaodong Bay[J].Fisheries Science,2015,34(11):718-721.(in Chinese)
[10] MA P Z,ZHANG T,LI H Z,et al.Construction and characterization of microsatellite markers for the neptune whelk,Neptunea cumingii[J].Molecular Biology Reports,2022,49(9):9065-9069.
[11] HAO Z L,YANG L M,ZHAN Y Y,et al.The complete mitochondrial genome of Neptunea arthritica cumingii Crosse,(Gastropoda:Buccinidae)[J].Mitochondrial DNA Part B,Resources,2016,1(1):220-221.
[12] HAO Z L,LIU H Y,YU Y Y,et al.Reproductive characteristics and variations in the biochemical composition of Neptunea arthritica cumingii crosse through embryonic development[J].Aquaculture Research,2021,52(1):1-11.
[13] YU Z L,HU Z,SONG H,et al.Aggregation behavior of juvenile Neptunea cumingii and effects on seed production[J].Journal of Oceanology and Limnology,2020,38(5):1590-1598.
[14] 高岩,侯林,周革.香螺卵母细胞营养方式的研究[J].安徽农学通报,2008,14(11):36-38.GAO Y,HOU L,ZHOU G.Study on nutritional mode of oogenesis in Naptunea cumingii Crosse(Gastropoda:Prosobranchia)[J].Anhui Agricultural Science Bulletin,2008,14(11):36-38.(in Chinese)
[15] PARK G,KIM Y H,KIM E J,et al.Oogenesis and reproductive cycle in Neptunea (Barbitonia) arthritica cumingii on the west coast of Korea[J].Korean Journal of Malacology,2006,22(1):1-11.
[16] CHUNG E Y,KIM S Y,RYOU D K.Ultrastructure of germ cells during spermatogenesis and structural changes in the seminal vesicle in male Neptunea (Barbitonia) arthritica cumingii (Crosse,1862)[J].Fisheries and Aquatic Sciences,2005,8(1):17-26.
[17] YANG M J,FENG J,YU Z L,et al.Comparative analysis of the feeding habits of Rapana venosa and Neptunea arthritica cumingii near Zhangzi Island,China,based on stable isotope ratios and fatty acid profiles[J].Aquaculture Research,2021,52(5):1846-1854.
[18] 李华煜,王元宁,孟良,等.饵料、温度对香螺摄食的影响[J].海洋科学,2023,47(8):17-22.LI H Y,WANG Y N,MENG L,et al.Effects of feeding preferences and temperature on Neptunea arthritica cumingii[J].Marine Science,2023,47(8):17-22.(in Chinese)
[19] 贺加贝,赵晓伟,汲生磊,等.人工养殖条件下香螺摄食行为研究[J].海洋科学,2024,48(6):43-49.HE J B,ZHAO X W,JI S L,et al.Study on feeding behavior of Neptunea arthritica cumingii under artificial culture conditions[J].Marine Sciences,2024,48(6):43-49.(in Chinese)
[20] STOECK T,BASS D,NEBEL M,et al.Multiple marker parallel tag environmental DNA sequencing reveals a highly complex eukaryotic community in marine anoxic water[J].Molecular Ecology,2010,19(sup 1):21-31.
[21] 贺加贝,胡丽萍,曲忠,等.饵料种类、规格、投喂量和养殖密度对脉红螺存活及生长的影响[J].水产学杂志,2021,34(6):36-40,48.HE J B,HU L P,QU Z,et al.Effects of diet species, size, weight and stocking density on survival and growth of rock shell Rapana venosa[J].Chinese Journal of Fisheries,2021,34(6):36-40,48.(in Chinese)
[22] 徐希震,房景辉,方建光,等.脉红螺对不同贝类的摄食行为特征研究[J].渔业科学进展,2023,44(5):193-201.XU X Z,FANG J H,FANG J G,et al.Study on the behaviors of Rapana venosa feeding on different bivalves[J].Progress in Fishery Science,2023,44(5):193-201.(in Chinese)
[23] PYKE G H,PULLIAM H R,CHARNOV E L.Optimal foraging:a selective review of theory and tests[J].The Quarterly Review of Biology,1977,52(2):137-154.
[24] PYKE G.Optimal foraging theory:a critical review[J].Annual Review of Ecology and Systematics,1984,15:523-575.
[25] ZHANG D,DONG X, ZHU J, et al.Effect of water temperature on the behavior of Neptunea cumingii and the histology, immune enzyme activity, and transcriptome of its gills and kidneys[J].Invertebrate Survival Journal,2022,19(1):1-12.
[26] 朱建业.不同饲料对香螺生长的影响及肝脏转录组分析[D].大连:大连海洋大学,2020.ZHU J Y.Effects of different diets on growth of Neptunea arthritica cumingii and analysis of liver transcriptome[D].Dalian:Dalian Ocean University,2020.(in Chinese)
[27] 秦浩,王仁杰,来守敏,等.养殖密度、饵料种类和丰度对日本囊对虾(Marsupenaeus japonicus)争胜行为的影响[J].渔业科学进展,2015,36(4):111-123.QIN H,WANG R J,LAI S M,et al.Effects of stocking density and food on agonistic behavior of Marsupenaeus japonicus[J].Progress in Fishery Sciences,2015,36(4):111-123.(in Chinese)
[28] CHAUVAUD L,THOMPSON J K,CLOERN J E,et al.Clams as CO2 generators:the Potamocorbula amurensis example in San Francisco Bay[J].Limnology and Oceanography,2003,48(6):2086-2092.
[29] 周天成,胡思敏,林先敏,等.基于18S rDNA 条形码技术的珊瑚礁区塔形马蹄螺(Tectus pyramis)食性分析[J].海洋科学,2020,44(2):99-107.ZHOU T C,HU S M,LIN X M,et al.Study on the feeding habits of Tectus pyramis in the coral reef ecosystem based on 18S rDNA barcoding[J].Marine Science,2020,44(2):99-107.(in Chinese)
[30] NAKAMURA Y,KERCIKU F.Effects of filter-feeding bivalves on the distribution of water quality and nutrient cycling in a eutrophic coastal lagoon[J].Journal of Marine Systems,2000,26(2):209-221.
[31] 齐占会,方建光,张继红,等.桑沟湾贝藻养殖区附着生物群落季节演替研究[J].渔业科学进展,2010,31(4):72-77.QI Z H,FANG J G,ZHANG J H,et al.Seasonal succession of fouling communities in the poly-culture area of scallop Chlamys farreri and kelp Laminaria japonica in Sanggou Bay[J].Progress in Fishery Sciences,2010,31(4):72-77.(in Chinese)
[32] 李继业,冷宇,潘玉龙,等.石岛海域污损生物生态学研究[J].海洋湖沼通报,2019(6):139-146.LI J Y,LENG Y,PAN Y L,et al.An ecological research on marine fouling organisms in Shidao Island areas[J].Transactions of Oceanology and Limnology,2019(6):139-146.(in Chinese)
[33] 龙珍满,朱峰跃,郭杰,等.捕食胁迫对“四大家鱼”幼鱼生理反应的影响[J].渔业科学进展,2023,44(3):111-123.LONG Z M,ZHU F Y,GUO J,et al.Effects of predation stress on the physiological responses of juvenile four major Chinese carps[J].Progress in Fishery Sciences,2023,44(3):111-123.(in Chinese)
[34] WERNER E E,PEACOR S D.A review of trait-mediated indirect interactions in ecological communities[J].Ecology,2003,84(5):1083-1100.
[35] 董莎莎,聂鸿涛,闫喜武. 贝类低温胁迫响应机制研究进展[J].大连海洋大学学报,2019,34(3): 457-462. (in Chinese)DONG S S,NIE H T,YAN X W. Research progresses on mechanisms of cold stress responses in shellfish: a review[J]. Journal of Dalian Ocean University,2019,34(3): 457-462.(in Chinese)
[36] 赵春暖,蔡忠强,郑言鑫,等.渤海湾魁蚶吊笼与底播增殖实验研究[J].海洋科学,2017,41(11): 15-24.ZHAO C N,CAI Z Q,ZHENG Y X,et al. Experiment research of the cage culture and bottom sowing culture of Scapharca broughtonii in Bohai Gulf[J].Marine Science,2017,41(11): 15-24. (in Chinese)
[37] 白昌明,辛鲁生,王崇明. 软体动物疱疹病毒及其对贝类养殖产业的危害[J].渔业科学进展,2021,42(1): 214-226.BAI C M,XIN L S,WANG C M. Malacoherpesviruses and their associated damages to mollusk aquaculture industry[J]. Progress in Fishery Sciences,2021,42(1): 214-226. (in Chinese)
[38] 董波,相建海,杨鸣,等.海水养殖生物病害发生和抗病力的基础研究[J].中国基础科学,2003,5(6):19-24.DONG B,XIANG J H,YANG M,et al.Research on the disease occurrence and disease resistance of the commercially important organisms in mariculture[J].China Basic Science,2003,5(6):19-24.(in Chinese)