磺胺类抗生素(sulfonamide antibiotics,SAs)是一类以对氨基苯磺酸为基本结构的合成类药物[1]。作为广谱抗生素,SAs能够抑制多数球菌及某些杆菌,具有疗效强、性质稳定、价格便宜等优点,在畜牧业和水产养殖业中应用广泛[2-3],中国2020年SAs的使用量约4 800 t,其中,动物SAs使用量将近4 300 t[4]。目前,由于缺乏科学有效的监管措施,SAs在中国养殖业中的滥用问题已十分严峻,其所带来的人体健康和环境问题已日益突出,并引起广泛关注。
现有研究指出,人或动物服用SAs后通常无法完全代谢,部分SAs会以原形或代谢产物的形式排出体外,最终进入水体环境[5-6]。SAs亲水性强,挥发性低,在环境中不易被降解,即使在低的环境暴露浓度下SAs类抗生素也会引发生物富集现象。研究发现,在大连沿海环境的底栖生物中测得的SMZ、磺胺甲噻唑、磺胺间甲氧嘧啶和多西环素的生物累积因子(BAF)分别为3 501、2 332、3 076、4 456 L/kg[7]。有些种类SAs能随水生食物链传递发生生物放大进而威胁人类的健康[7]。此外,长期暴露下SAs会导致抗性基因污染,从而破坏生态系统[8-9]。目前,水产品中SAs的残留问题已成为学界的研究热点。
相关研究显示,富集在鱼体内的SAs对鱼的存活率影响较小,然而,SAs即使在低浓度下也能引起某些鱼类的生理和遗传变化[10]。此外已有研究显示,SAs的化学结构可以被修饰,富集在生物体内的SAs能够形成代谢物。从毒理学的角度分析,虽然在许多情况下,代谢物的药理学活性和毒性低于母体化合物,但其中一些代谢物仍然具有生物活性,且可能在环境中毒性更大、更稳定和更可移动[11]。鉴于磺胺代谢产物的物种复杂性和潜在高危害性,SAs及其代谢物研究正在引起人们的重视[1],然而,目前针对SAs在鱼体内的代谢产物及代谢路径研究尚不多见。
本研究中以海洋经济养殖鱼种许氏平鲉(Sebastes schlegelii)为研究对象,基于海水半静态流水式养殖方法开展了常用SAs药物磺胺二甲嘧啶(SMZ)的生物富集和代谢研究,以期了解SMZ在海水鱼体内的富集及代谢变化规律。为SAs抗生素的生态风险评价及在海水养殖中的安全使用提供数据支撑和科学参考。
1 材料与方法
1.1 材料
试验鱼:许氏平鲉幼鱼120尾,体质量为(16.80±5.46)g,全长为(9.75±1.36)cm,体长为(8.25±1.15)cm,体表光滑,无外伤,购自大连天正实业有限公司。
试剂:供试药物选用SMZ(纯度≥99.0%,SMT,美国Sigma公司)。内标物质为氘代SMX-d4(纯度98.0%,SMX-d4,多伦多研究化学品公司)。乙二胺四乙酸二钠·二水,氢氧化钠(分析纯);正己烷(分析纯);无水硫酸钠(分析纯);冰乙酸(优级纯)。Oasis HLB小柱(3 cc,60 mg;Waters,Milford,MA,USA),0.22 μm滤膜,定性滤纸。
仪器与设备:高效液相色谱串联质谱仪(ABSciex 6500,美国),高分辨线性离子肼质谱仪(Q Exactive Orbitrap,Thermo Fisher scientific 美国)TGL-16B高速离心机(上海安亭科学仪器厂),氮吹仪(杭州奥盛仪器有限公司),ASE-12固相萃取仪(天津奥特塞恩斯仪器有限公司)。
1.2 方法
1.2.1 试验设计 试验前在室内暂养两周,水温为(20±0.5)℃,pH为6.8~7.0,溶氧充足。期间正常投喂不含抗生素的商业饲料,投饵率1%,残饵粪便用虹吸管吸出,死亡率小于5%。
试验主要参照《化学品测试导则OECD 305—鱼类生物富集试验方法》及国家质量监督检验检疫总局《化学品生物富集 半静态式鱼类试验》(GB/T 21858—2008)标准[12],试验用水为经过滤后曝气贮存24 h的天然海水,试验玻璃容器容积为30 L。
试验设置空白对照组、10 μg/L低浓度组和100 μg/L高浓度组,每组设置3个平行,采用半静态药浴式富集,每隔24 h更换1次药液,每日换水率50%,重新投加1/2的药量,以保持试验药液浓度不低于初始浓度的80%。富集阶段鱼样的采样时间为药物暴露后的0.25、0.5、1、2、3、5、8 d,8 d后为清除阶段,养殖体系内停止药物暴露,14 d后终止试验。每一试验组取3尾鱼采集样本并在48 h内进行检测。鱼体用超纯水冲洗干净并用吸水纸吸干表面,测量体长和体质量。解剖采集鳃、肝脏和肌肉组织等进行称重,置于-20 ℃下保存。
1.2.2 样品前处理 鱼样前处理参考《农业部1077号公告-1—2008》[13]和GB 31658.17—2021标准[14]方法,经适当调整,将鱼样不同部位组织分别搅碎匀质,称取1 g组织样品加入内标,加入Mcllvaine Na2EDTA饱和溶液8 mL,涡旋1 min,超声20 min,随后在4 ℃下以11 000 r/min离心5 min后取上清液。经HLB固相萃取柱,依次用水5 mL和20%甲醇水溶液5 mL淋洗,抽干,用洗脱液(甲醇)10 mL洗脱。收集洗脱液,45 ℃下水浴,氮气吹干。加入复溶液(初始流动相)1.0 mL,涡旋1 min溶解残余物以14 000 r/min离心5 min,经0.22 μm微孔滤膜过滤,待分析。
1.2.3 SMZ定量及产物分析 液相色谱条件:使用Agilent Eclipse Plus C18反相色谱柱(3 mm×150 mm 1.8 μm)实现色谱分离,选择0.1%甲酸水(A相)和0.1%甲酸乙腈(B相)作为流动相,等度洗脱,流速为0.3 mL/min,柱温为30 ℃,进样量为5 μL。
高效液相色谱串联质谱仪(HPLC-MS/MS)分析条件:电喷雾离子源,正离子扫描模式(ESI+);检测方式为多反应监测(MRM),离子化电压(IS)550 V,雾化气压力345 kPa,辅助气压力345 kPa,气帘气压力242 kPa,雾化温度500 ℃,质谱采集参数见表1。
表1 SMZ及同位素内标的定性离子对、定量离子对和质谱分析参数
Tab.1 Qualitative and quantitative ion pairing,and mass spectrometry analysis parameters for sulfamethazine and isotope internal standards
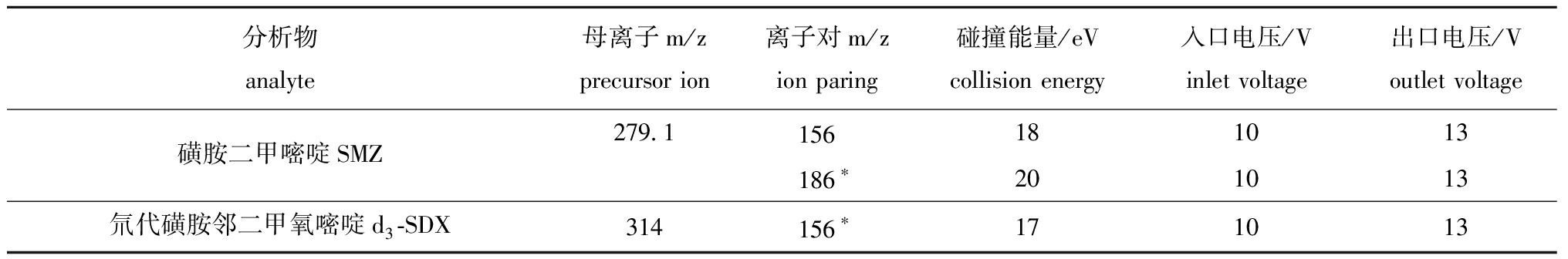
分析物analyte母离子m/zprecursor ion离子对m/zion paring碰撞能量/eVcollision energy入口电压/Vinlet voltage出口电压/Voutlet voltage磺胺二甲嘧啶SMZ279.1156 181013186∗201013氘代磺胺邻二甲氧嘧啶d3-SDX314156∗171013
注:*表示定性离子对。
Note:*means qualitative ion pairing.
高分辨线性离子肼质谱(QExactiveOrbitrap)分析条件:喷雾电压3 500(+),雾化温度400 ℃,离子传输管温度350 ℃,全扫描分辨率70 000,ddMS2分辨率17 500,采用Thermo Scientific Xcalibur软件进行谱图分析。
1.2.4 质量控制 试验所用玻璃器皿均采用自来水超声清洗30 min后,用去离子水清洗,烘干后用甲醇清洗两次,在通风橱挥发至干后,于马弗炉450 ℃下煅烧3 h,自然冷却后取出待用。同时进行方法空白平行样及样品平行样的测定,以进行质量控制保证。为确保目标化合物定量的准确性,减少液质分析时的基质效应对定量结果的影响,采用内标法分析,待分析物SMZ在鱼体内的加标回收率为88.2%,以满足GB 27404—2008实验室质量控制规范的要求[15]。
1.2.5 生物富集系数(BCF) 生物富集系数通过双箱模型理论[16],计算公式为
BCFkg=k1/k2g。
(1)
式中:k1为吸收速率常数;k2g为清除速率常数。
本试验中,通过非线性拟合得到动力学参数k1和k2g,通过公式(1)计算BCFkg值[17-18]。
1.3 数据处理
采用origin 2018进行图形数据处理,采用Excel 2019对鱼组织中SMZ数据进行统计学比较分析。
2 结果与分析
2.1 SMZ在许氏平鲉体内的富集变化趋势
SMZ在不同暴露时间及清除恢复阶段各组织的富集浓度如图1所示,随着SMZ在鱼体内的迁移转化,其在许氏平鲉肝、肌肉及鳃中均有检出。从图1可见,在富集试验阶段,经10、100 μg/L的暴露浓度影响,第3天时高浓度组与低浓度组SMZ在鱼体内的富集浓度均达到了整个暴露期的最高水平,随着暴露时间的延长,鱼体内肝脏、肌肉和鳃中SMZ的富集浓度逐渐降低,至第8天时SMZ在许氏平鲉体内不同组织器官的清除已达90%以上,第8天之后各器官浓度恢复到初始状态。此外在富集试验阶段发现,在第3天低浓度组鱼鳃中SMZ的检测浓度(283 μg/g)明显高于高浓度组(104 μg/g)。
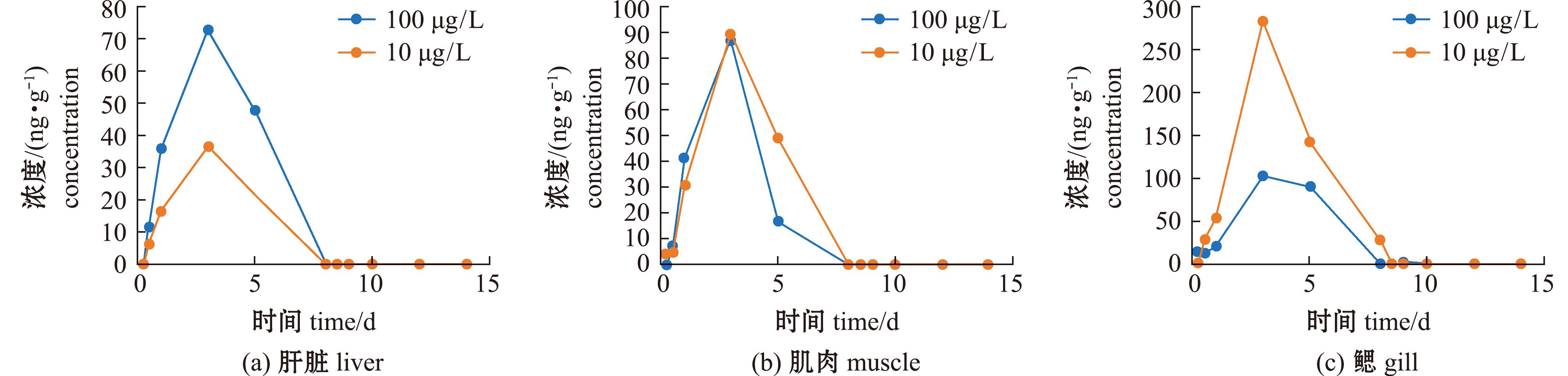
图1 SMZ在许氏平鲉不同器官组织中的富集消除变化趋势
Fig.1 Trend of enrichment and elimination of sulfamethazine in different tissues and organs of the Sebastesschlegelii
SMZ在许氏平鲉体内不同器官组织中的BCF值见表2。其在高浓度与低浓度组的肝脏、肌肉和鳃中BCF值范围为0.014~0.128 L/kg。比较各组织BCF值,发现在低浓度条件下试验鱼体鳃的BCF值最高,肝脏的BCF值最低。试验鱼体对SMZ的富集能力由高至低依次为鳃>肌肉>肝脏,且在高浓度和低浓度条件下该鱼体对SMZ的富集趋势一致。
表2 SMZ在许氏平鲉不同器官组织中的富集动力学参数
Tab.2 Kinetic parameters of bioconcentration of sulfamethazine in different tissues and organs of the Sebastesschlegelii exposed to different concentrations
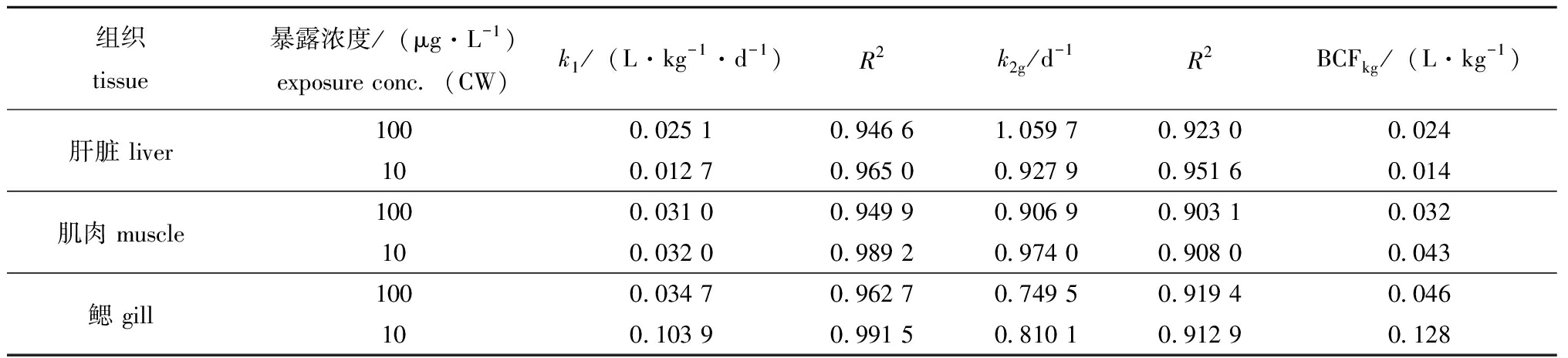
组织tissue暴露浓度/(μg·L-1)exposure conc.(CW)k1/(L·kg-1·d-1)R 2k2g/d-1R 2BCFkg/(L·kg-1)肝脏 liver1000.025 10.946 61.059 70.923 00.024100.012 70.965 00.927 90.951 60.014肌肉 muscle1000.031 00.949 90.906 90.903 10.032100.032 00.989 20.974 00.908 00.043鳃 gill1000.034 70.962 70.749 50.919 40.046100.103 90.991 50.810 10.912 90.128
2.2 SMZ在许氏平鲉体内的代谢产物结构分析
本研究采用线性离子肼Orbitrap技术,对空白组和试验组的鱼体组织提取物进行分析。首先对照其一级质谱的差异,筛选出可能存在的SMZ代谢产物,然后对其进行二级质谱分析,并结合母体化合物的结构,推测出产物可能存在的分子结构。其中,在一级质谱中共检测到两种代谢产物(M1和M2)。
M1代谢产物的色谱保留时间为1.7 min,其准分子离子的精确质量数m/z为321.101 13,二级质谱主要的碎片离子有m/z 134.059 86[C8H8ON]+、124.086 82[C6H9N3]+和198.021 67[C8H8NSO3]+。M1的相对分子质量比SMZ多42 000,推测是乙酰化加成产物N4-乙酰化磺胺二甲嘧啶(图2)。
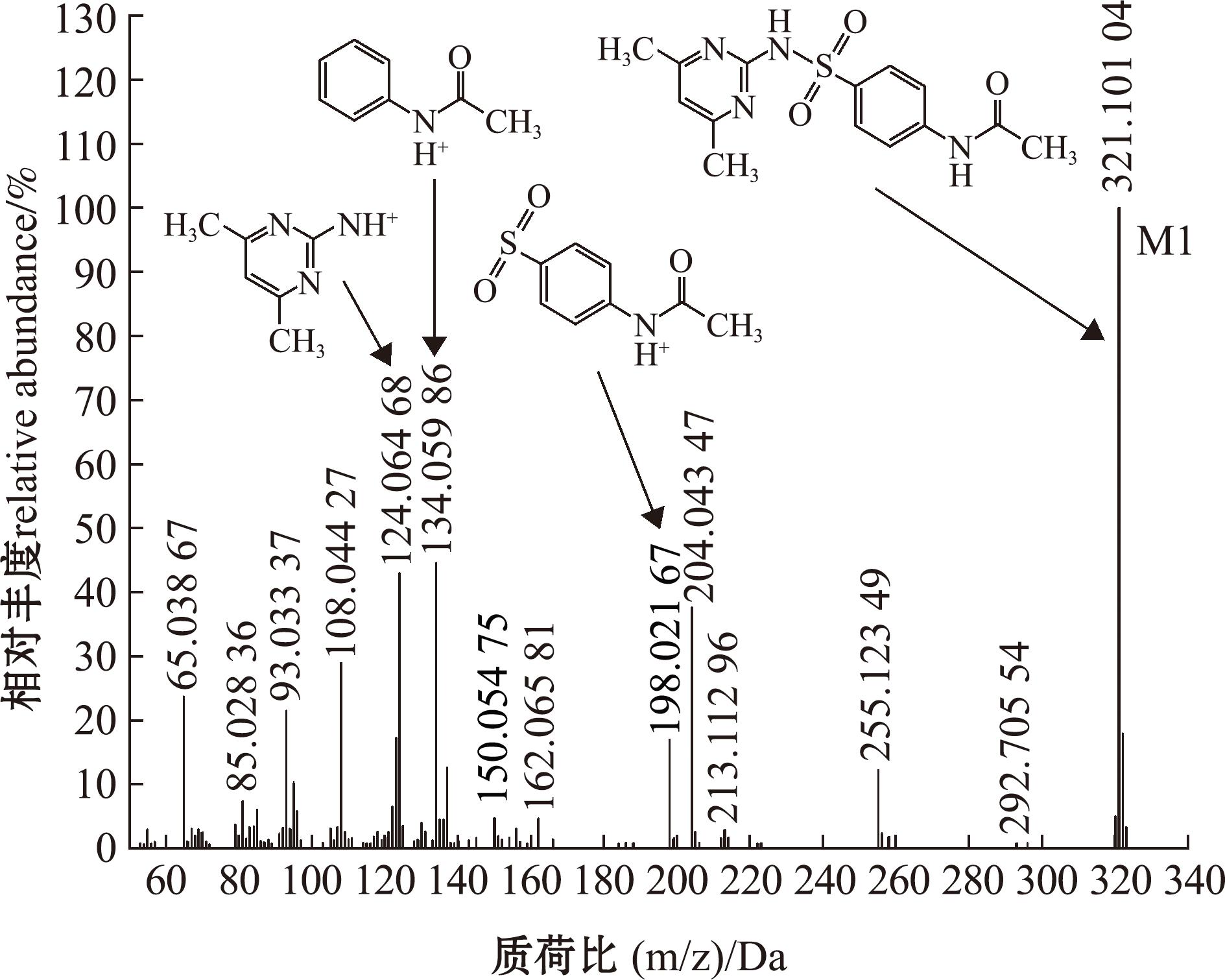
图2 M1代谢产物的二级质谱谱图
Fig.2 Secondary mass spectra of the M1 metabolite
M2代谢产物的色谱保留时间为1.24 min,其准分子离子的精确质量数为m/z 124.086 76,二级质谱主要碎片离子有m/z 83.060 33[C4H7N2]+和107.060 25[C6H8N2]+。其相对分子质量比SMZ少155 000,推测是氮硫键断裂解产物二甲基嘧啶(图3)。
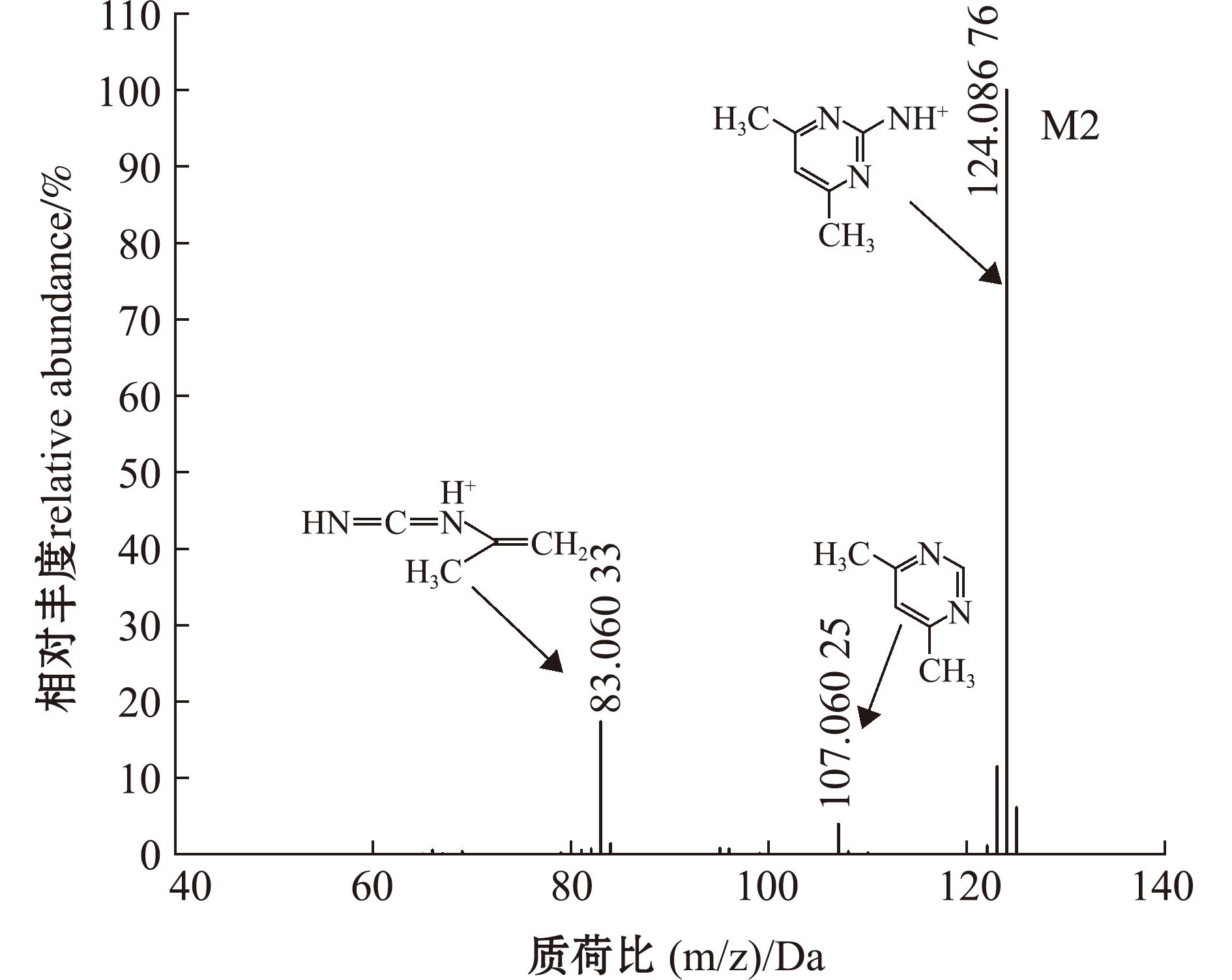
图3 M2代谢产物的二级质谱谱图
Fig.3 Secondary mass spectra of M2 metabolites
2.3 SMZ在许氏平鲉体内的代谢路径
已有研究显示,SMZ在生物体内的代谢方式主要有两种:一种是发生于对位氨基上的乙酰化反应;另一种是在嘧啶环上5位与6位发生羟基化反应[19-21]。本研究中,针对SMZ在海鱼许氏平鲉体内代谢同样检测乙酰化代谢产物,并未检测到羟基化产物。此外检测到另一代谢产物为2-氨基-4,6-二甲基嘧啶。SMZ在海鱼许氏平鲉体内可能的代谢途径如图4所示,其中存在3条代谢路径,第一条路径是SMZ乙酰化生成N4-乙酰化磺胺二甲嘧啶;第二条路径是SMZ直接断裂生成2-氨基-4,6-二甲基嘧啶;第三条路径是SMZ乙酰化生成N4-乙酰化磺胺二甲嘧啶后再裂解生成2-氨基-4,6-二甲基嘧啶。
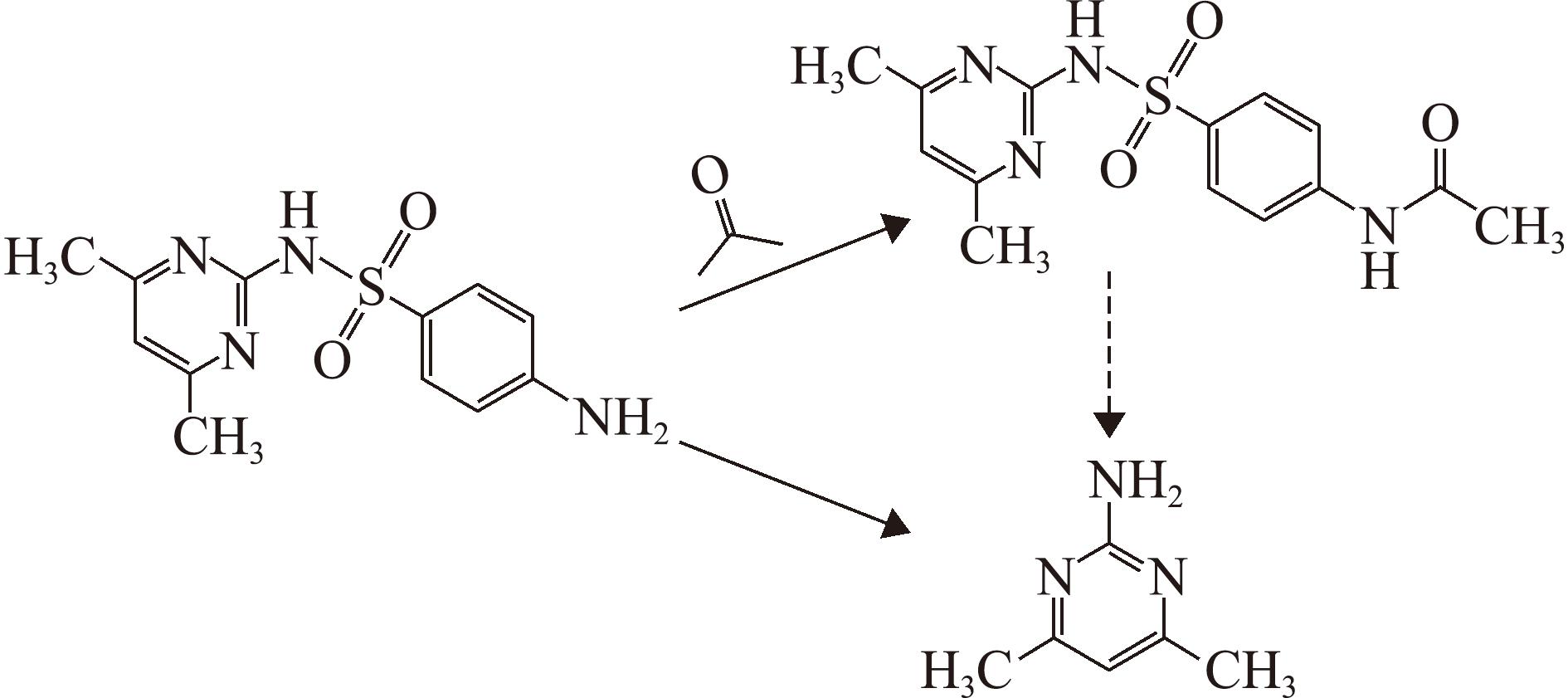
图4 SMZ在许氏平鲉体内的代谢路径
Fig.4 Metabolic pathways of sulfadimethazine in the body of Sebastesschlegelii
3 讨论
3.1 SMZ在鱼体内的生物富集
暴露初期SMZ在鱼体内表现为快速吸收,可能与鱼体对外界环境未完全适应有关,体内未产生相关代谢和排出机制,在鱼体内有一定程度的富集。随着暴露时间延长,生物体内富集浓度降低,可能是由生物体产生相关适应机制所引发[22],SMZ在鱼体内经吸收、代谢排出并逐渐达到稳定状态(图1)。此外,在斑马鱼(Danio rerio)研究中SMZ的生物富集也有类似的结果[23]。
在药物暴露过程中,高、低浓度组并无明显的浓度变化趋势差异。高浓度组(100 μg/L)SMZ在许氏平鲉体内的肝脏富集效率更高,富集浓度近80 ng/g(湿质量),而鳃和肌肉在低浓度组(10 μg/L)富集效率更高,低浓度的高富集效率可能与低剂量兴奋效应有关[17]。
生物富集系数表明(表2),SMZ在许氏平鲉体内属于低生物富集[24],在所检测的组织中,鳃具有最大的BCF值,肝脏具有最小的BCF值,这与肝组织有较小的吸收速率常数(k1)和较大的清除速率常数(k2g)有关。SMZ在许氏平鲉肌肉组织中的k1值是肝脏组织中1.23~2.50倍,鳃组织中的k1值是肝脏组织的1.38~8.18倍;而在肌肉和鳃组织中的k2g值分别是其在肝脏中的1.16和1.41倍。因此,由k1和k2g的比值计算得到的BCFkg值,在鳃和肌肉组织中分别比其在肝组织中高1.91~9.14倍和1.33~1.79倍。
化合物的性质决定了其在生物体内的分布状态,SMZ的正辛醇水分配系数(logKow)<0.5[25],表明该化合物亲脂性较弱。在鱼体内更倾向于在血液中富集,由于鳃含有丰富的毛细血管,SMZ可以通过鳃富集在鱼体内。在本研究中,鱼体肝脏对SMZ的富集能力最低,可能是由于动物肝脏易于富集亲脂性的化合物,而对于富集在肝脏中的SMZ会通过肝部代谢而降低其含量。在鲟(Acipenser)及海水青鳉(Oryzias latipes)对SMZ生物富集的研究中也有类似现象[20,26]。
3.2 SMZ在鱼体内的代谢产物及路径分析
富集在生物体内的SAs经生物转化其化学结构能够被修饰,从而形成代谢产物。其生物转化过程主要通过Ⅰ相氧化和Ⅱ相乙酰化反应生成N1和N4衍生物[21]。在生物降解研究中,SAs通常会在5个位置发生裂解,裂解部位如图5所示[11],包括α位置(苯环上的N—H键)、β位置(苯环上的C—N键)、γ位置(C—S键)、δ位置(S—N键)和ε位置(N—C键)。
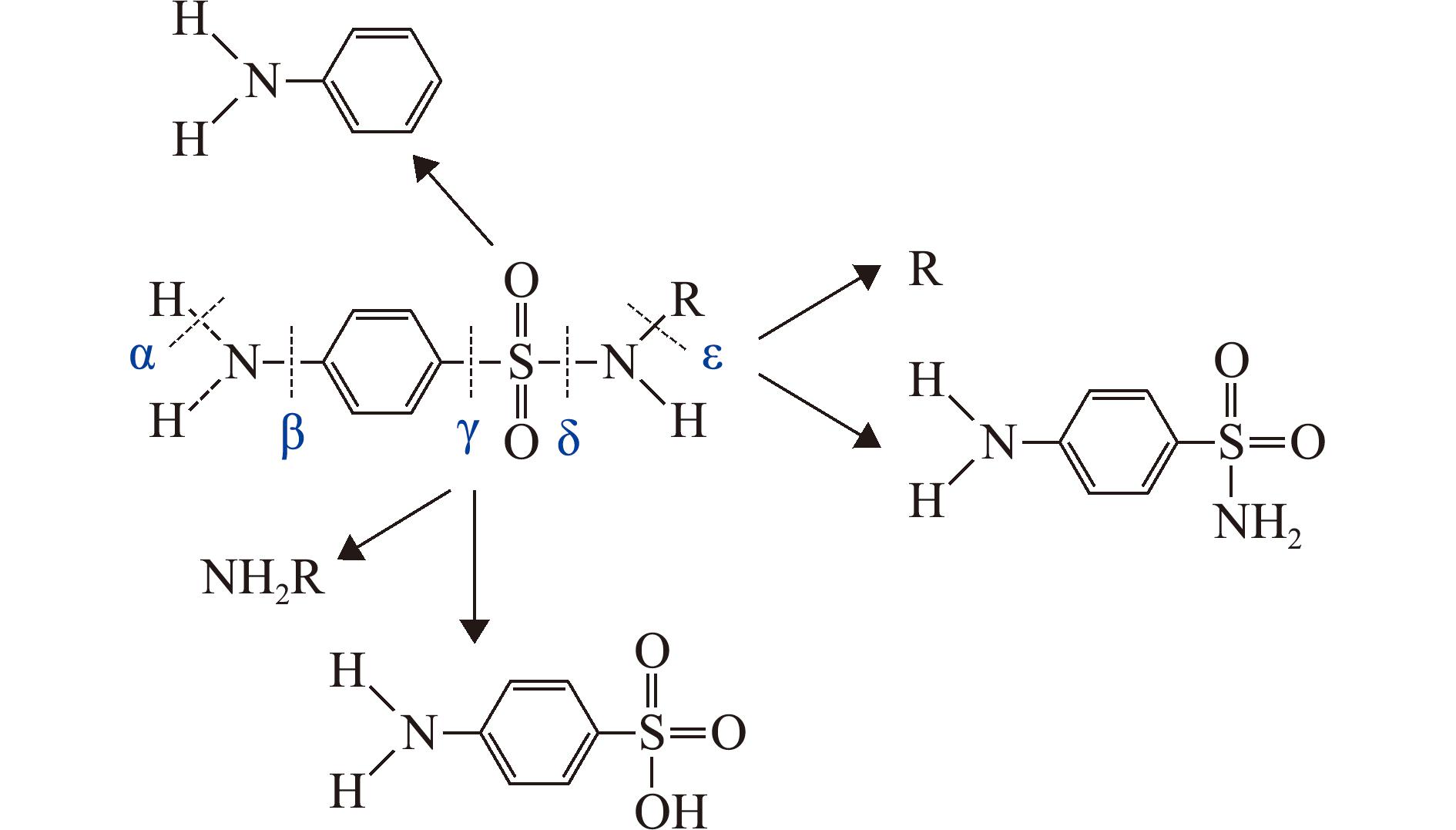
图5 磺胺类化合物的裂解部位[11]
Fig.5 Degradation sites of sulfonamides
通过Q Exactive Orbitrap分析SMZ在鱼体内转化和降解的电荷质量比(m/z),并与相关文献比较,共有2个中间体/产物(图2和图3)。产物M1发生在α位置(苯环上的N—H键),可能由于鱼体内的N-乙酰转移酶促进乙酰辅酶A的供体乙酰基与SMZ相结合,进而经转乙酰基酶催化氨基去质子化,使SMZ处于亲核状态,进而亲核进攻乙酰辅酶A的羰基碳,最终形成乙酰化加成产物N4-乙酰化磺胺二甲嘧啶。研究表明,SMZ在人、猪、兔和猴体内的主要代谢方式是乙酰化,其次是羟基化。在本研究中,许氏平鲉体内也检测到乙酰化产物。产物M2发生在δ位置(S—N键),由SMZ的N-S键直接裂解生成嘧啶环产物,在Lin等[26]研究的SMZ氧化降解过程中嘧啶环产物是主要的副产物,由于新形成的乙酰化代谢产物和母体都有相同的二甲基嘧啶连接部位,所形成的产物2-氨基-4,6-二甲基嘧啶的来源有待进一步确认。
不同SAs的生物转化程度取决于其化学结构和生物体的特征,据估算,生物体给药后,有50%~70%的化合物是以N4-乙酰化产物的形式被排出体外,尽管有研究显示SAs的代谢产物不如SAs那样具有较高的生物活性。但这种活性在体外条件下较容易恢复[27]。因此,针对SMZ的代谢产物及其环境效应仍需持续关注。
4 结论
1)在环境水体暴露至第3天鱼体内的富集浓度达到整个暴露期的最高水平,随暴露时间延长,鱼体内肝脏、肌肉和鳃中SMZ的富集浓度降低,至第8天达到富集与消除平衡。许氏平鲉对SMZ表现出较快的环境适应能力。
2)在整个药物暴露过程中,鱼体内SMZ最大富集浓度与药物浓度高、低无明显的变化趋势差异。鱼体不同部位的富集研究表明,在最佳富集期内,许氏平鲉体内不同组织器官对SMZ表现出鳃>肌肉>肝脏的富集趋势。迁移至鱼体内的抗生素在不同组织器官的富集能力不同。
3)代谢研究表明,SMZ在许氏平鲉体内的代谢产物有两种,N4-乙酰化磺胺二甲嘧啶和2-氨基-4,6-二甲基嘧啶。主要的代谢路径为SMZ乙酰化加成及于2-氨基-4,6-二甲基嘧啶相连的N-S键断裂。乙酰化加成和N-S键断裂是SMZ在许氏平鲉体内的主要转化机制。
综上所述,针对SMZ在海水鱼体内的生物富集规律及其在鱼体内中间代谢产物的有效识别可为SMZ在海水养殖中的安全使用提供数据支撑。
[1] JIA W,ZHANG M,DU A,et al.Accurate quantification of sulfonamide metabolites in goat meat:a new strategy for minimizing interaction between sheep serum albumin and sulfonamide metabolites[J].Journal of Agricultural and Food Chemistry,2021,69(23):6556-6568.
[2] ZHENG J R,WANG S F,ZHOU A J,et al.Efficient elimination of sulfadiazine in an anaerobic denitrifying circumstance:biodegradation characteristics,biotoxicity removal and microbial community analysis[J].Chemosphere,2020,252:126472.
[3] XU R Y,YANG C,HUANG L,et al.Broad-specificity aptamer of sulfonamides:isolation and its application in simultaneous detection of multiple sulfonamides in fish sample[J].Journal of Agricultural and Food Chemistry,2022,70(37):11804-11812.
[4] 戴佳佳,宋金明,李学刚,等.中国典型水域磺胺类合成药物的环境生物地球化学特征[J].海洋与湖沼,2023,54(4):935-950.DAI J J,SONG J M,LI X G,et al.Environmental biogeochemical characteristics of sulfonamides in typical aquatic environments of China[J].Oceanologia et Limnologia Sinica,2023,54(4):935-950.(in Chinese)
[5] 万位宁,陈熹,居学海,等.固相萃取-超高效液相色谱串联质谱法同时检测禽畜粪便中多种抗生素残留[J].分析化学,2013,41(7):993-999.WAN W N,CHEN X,JU X H,et al.Simultaneous determination of residual antibiotics in livestock manure by solid phase extraction-ultra-high performance liquid chromatography tantem mass spectrometry[J].Chinese Journal of Analytical Chemistry,2013,41(7):993-999.(in Chinese)
[6] ZHENG H S,ZHANG Y F,LI S,et al.Antibiotic sulfadiazine degradation by persulfate oxidation:intermediates dependence of ecotoxicity and the induction of antibiotic resistance genes[J].Bioresource Technology:Biomass,Bioenergy,Biowastes,Conversion Technologies,Biotransformations,Production Technologies,2023,368:128306
[7] LIU S S,ZHAO H X,LEHMLER H J,et al.Antibiotic pollution in marine food webs in Laizhou Bay,North China:trophodynamics and human exposure implication[J].Environmental Science &Technology,2017,51(4):2392-2400.
[8] 张秀,宋建宇,高欢,等.我国不同利用方式土壤的磺胺类和大环内酯类抗生素抗性基因积累[J].环境科学,2023,44(10):5610-5621.ZHANG X,SONG J Y,GAO H,et al.Accumulation of sulfonamides and macrolides antibiotic resistance genes in soils with different utilization patterns in China[J].Environmental Science,2023,44(10):5610-5621.(in Chinese)
[9] DUNGAN R S,MCKINNEY C W,LEYTEM A B.Tracking antibiotic resistance genes in soil irrigated with dairy wastewater[J].Science of the Total Environment,2018,635:1477-1483.
[10] YANG C,SONG G,LIM W.A review of the toxicity in fish exposed to antibiotics[J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2020,237:108840.
[11] GARC A-GAL
A-GAL N M J,SILVIA D
N M J,SILVIA D AZ-CRUZ M,BARCEL
AZ-CRUZ M,BARCEL D.Identification and determination of metabolites and degradation products of sulfonamide antibiotics[J].TrAC Trends in Analytical Chemistry,2008,27(11):1008-1022.
D.Identification and determination of metabolites and degradation products of sulfonamide antibiotics[J].TrAC Trends in Analytical Chemistry,2008,27(11):1008-1022.
[12] 国家市场监督管理总局,国家标准化管理委员会.化学品 生物富集 半静态式鱼类试验:GB/T 21858—2008[S].北京:中国标准出版社,2008.State Administration for Market Regulation of the People’s Republic of China,Standardization Administration of the People’s Republic of China.Testing of chemicals-bioconcentration-semi-static fish test:GB/T 21858—2008[S].Beijing:Standards Press of China,2008.(in Chinese)
[13] 中华人民共和国农业农村部.中华人民共和国农业农村部1077号公告-1—2008水产品中17种磺胺类及15种喹诺酮类药物残留量的测定液相色谱-串联质谱法[S].中华人民共和国农业农村部发布,2008.Ministry of Agriculture and Rural Affairs of the People’s Republic of China.Announcement No.1077-2008 of the Ministry of Agriculture and Rural Affairs of the People’s Republic of China-Determination of residues of 17 sulfonamides and 15 quinolones in aquatic products-liquid chromatography-tandem mass spectrometry [S].Published by the Ministry of Agriculture and Rural Affairs of the People’s Republic of China,2008.(in Chinese)
[14] 中华人民共和国农业农村部,中华人民共和国国家卫生健康委员会,国家市场监督管理总局.中华人民共和国国家标准.GB31658.17—2021 食品安全国家标准 动物性食品中四环素类、磺胺类和喹诺酮类药物残留量的测定 液相色谱-串联质谱法[S].北京:中国农业出版社,2021.Ministry of Agriculture and Rural Affairs of the People’s Republic of China,National Health Commission of the People’s Republic of China,State Administration for Market Regulation.National Standards of the People’s Republic of China GB31658.17—2021 National Food Safety Standard-Determination of tetracycline,sulfonamide,and quinolone residues in animal food-Liquid chromatography-tandem mass spectrometry[S].Beijing:China Agricultural Press,2021.(in Chinese)
[15] 国家市场监督管理总局,中国国家标准化管理委员会.实验室质量控制规范 食品理化检测:GB/T 27404—2008[S].北京:中国标准出版社,2008.State Administration for Market Regulation of the People’s Republic of China,Standardization Administration of the People’s Republic of China.Criterion on quality control of laboratories-Chemical testing of food:GB/T 27404—2008[S].Beijing:Standards Press of China,2008.(in Chinese)
[16] MACKAY D,FRASER A.Bioaccumulation of persistent organic chemicals:mechanisms and models[J].Environmental Pollution,2000,110(3):375-391.
[17] ZHAO H X,LIU S S,CHEN J W,et al.Biological uptake and depuration of sulfadiazine and sulfamethoxazole in common carp (Cyprinus carpio)[J].Chemosphere,2015,120:592-597.
[18] 陈默.氟喹诺酮类抗生素在鲤鱼体内的富集与代谢[D].大连:大连理工大学,2019.CHEN M.Bioconcentration and metabolism of fluoroquinolones(FQs) in common carp(Cyprinus carpio)[D].Dalian:Dalian University of Technology,2019.(in Chinese)
[19] NOUWS J F,VREE T B,BAAKMAN M,et al.Disposition of sulfadimidine and its N4-acetyl and hydroxy metabolites in horse plasma[J].Journal of Veterinary Pharmacology and Therapeutics,1985,8(3):303-311.
[20] 陈茜茜.海水青鳉(Oryzias melastigma)在磺胺二甲基嘧啶食物相暴露下的生物富集、代谢及毒理效应研究[D].厦门:厦门大学,2020.CHEN Q Q.Study on the bioaccumulation,metabolism and toxicology mechanism of marine medaka in dietary exposure of sulfamethazine[D].Xiamen:Xiamen University,2020.(in Chinese)
[21] ABDALLAH H,ARNAUDGUILHEM C,JABER F,et al.Multiresidue analysis of 22 sulfonamides and their metabolites in animal tissues using quick,easy,cheap,effective,rugged,and safe extraction and high resolution mass spectrometry (hybrid linear ion trap-orbitrap)[J].Journal of Chromatography A,2014,1355:61-72.
[22] MILLER T H,BURY N R,OWEN S F,et al.Uptake,biotransformation and elimination of selected pharmaceuticals in a freshwater invertebrate measured using liquid chromatography tandem mass spectrometry[J].Chemosphere,2017,183:389-400.
[23] 许静,王娜,孔德洋,等.磺胺类抗生素在斑马鱼体内的生物富集性及模型预测评估[J].生态毒理学报,2015,10(5):82-88.XU J,WANG N,KONG D Y,et al.Bioconcentration of sulfonamide antibiotics in zebrafish(Brachydanio rerio) and model prediction assessment[J].Asian Journal of Ecotoxicology,2015,10(5):82-88.(in Chinese)
[24] 国家质量监督检验检疫总局,中国国家标准化管理委员会.化学农药环境安全评价试验准则 第7部分:生物富集试验:GB/T 31270.7—2014[S].北京:中国标准出版社,2015.General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,Standardization Administration of the People’s Republic of China.Test guidelines on environmental safety assessment for chemical pesticides:Part 7:Bioconcentration test:GB/T 31270.7—2014[S].Beijing:Standards Press of China,2015.(in Chinese)
[25] 张从良,王岩.磺胺类药物正辛醇/水分配系数与分子价键连接性指数相关性研究[J].计算机与应用化学,2008,25(11):1465-1468.ZHANG C L,WANG Y.Study on correlation between 1-octanol/water partition coefficient and molecular valance connectivity index for sulfonamides[J].Computers and Applied Chemistry,2008,25(11):1465-1468.(in Chinese)
[26] LIN Y Z,CHEN J,ZHOU M L,et al.Efficiency and mechanism of zero-valent iron/nitrilotriacetic acid/peroxymonosulfate system for degrading sulfamethazine[J].Process Safety and Environmental Protection,2022,168:993-1008.
[27] BARAN W,ADAMEK ![]() J,et al.Effects of the presence of sulfonamides in the environment and their influence on human health[J].Journal of Hazardous Materials,2011,196:1-15.
J,et al.Effects of the presence of sulfonamides in the environment and their influence on human health[J].Journal of Hazardous Materials,2011,196:1-15.