多溴联苯醚(PBDEs)作为溴代阻燃剂在电器产品、纺织品、建筑材料和塑料制品中广泛应用。其挥发性和亲脂性强,可以在商品生产、使用和废弃处理过程中释放到环境中,并在大气沉降、地表径流等过程中迁移至海洋,最终在食物链中富集和放大[1]。根据流行病学调查资料显示[2-3],PBDEs在多种环境介质及生物组织中均有检出。其中,2,2′,4,4′-四溴联苯醚(BDE-47)是环境样品及生物组织中检测含量最高的PBDEs类似物,对生物体的神经、发育和生殖等方面均具有一定毒性作用[4]。联合国环境规划署于2009年5月将BDE-47作为持久性有机污染物列入《斯德哥尔摩公约》附录A。据Zheng等[5]报道,BDE-47可能通过Sonic hedgehog信号通路影响斑马鱼(Danio rerio)神经发育。庄娟等[6]研究表明,BDE-47能够影响斑马鱼胚胎的生长发育,导致斑马鱼胚胎畸形率和心率增加,阻碍卵黄延伸部和胚体的发育,抑制与生长发育相关的基因表达。迟潇等[7]测定了不同浓度BDE-47对半滑舌鳎(Cynoglossus semilaevis)肝脏过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶活性的影响,并采用IBR模型探究了BDE-47对半滑舌鳎的毒性效应,试验结果表明,BDE-47对半滑舌鳎的毒性效应呈现出显著的剂量效应。张赛赛等[8-9]研究表明,不同剂量的BDE-47对大泷六线鱼(Hexagrammos otakii)的发育和抗氧化酶产生影响,研究结果显示,BDE-47并未对大泷六线鱼产生致死毒性,但随着污染物浓度增加,鱼的生长受到抑制,当污染物浓度达到50 ng/L以上时,鱼的体质量开始下降,此外,污染物还显著影响了大泷六线鱼肝脏的超氧化物歧化酶和过氧化氢酶活性。
黄盖鲽(Pseudopleuronectes yokohamae)隶属于鲽形目(Pleuronectiformes)鲽科(Pleruonectida)黄盖鲽属(Pseudopleuronectes)[10],俗名“小嘴”、“黄盖”、“沙板”、“沙盖”和“小高眼”等。在中国主要分布于黄渤海及东海北部,以甲壳类、小型鱼类等为食。黄盖鲽是冷温性底栖鱼类,活动性较弱,洄游范围小,适应能力强。黄盖鲽是研究有机污染物对海水鱼类毒性效应的理想模型,其肉质鲜美,营养丰富,具有较高的食用价值和经济价值,在中国海水鱼类捕捞品种中占据极其重要的位置,也是网箱养殖、渔业增殖放流及休闲渔业的理想品种,前景十分广阔。然而,随着海洋资源的开发利用、污染物的沉积及人类过度捕捞等因素,黄盖鲽种质资源面临严重退化的风险。研究持久性有机污染物对黄盖鲽的毒性效应,对其资源可持续利用及绿色健康养殖具有重要意义。
随着高通量测序技术的发展及其在水产动物免疫调节、疾病治疗、营养代谢和生殖发育等研究中的应用,microRNAs(miRNAs)在水生动物的神经系统发育、生长发育、胚胎发育和细胞分化等生物学途径中的重要调节作用得到广泛关注[11-12]。本研究中以黄盖鲽幼鱼为受试生物,探讨了BDE-47慢性胁迫对黄盖鲽幼鱼鳃组织结构的影响,通过miRNA和mRNA联合分析揭示了黄盖鲽幼鱼鳃组织响应四溴联苯醚胁迫的潜在分子机制,以期为研究环境中新型有机污染物BDE-47的生态毒理效应及其生态风险评价提供理论依据。
1 材料与方法
1.1 材料
黄盖鲽幼鱼购自大连颢霖水产有限公司,试验开始前在养殖槽内暂养7 d,保证溶氧充足、饵料充足,每日换水1次,换水量为1/2。暂养期间观察幼鱼的摄食情况和活动状态。
主要试剂:2,2′,4,4′-四溴联苯醚(BDE-47,购自Sigma-Aldrich公司,纯度大于98%)和二甲基亚砜(DMSO,购自科密欧化学试剂有限公司,纯度大于99%),以DMSO作为助溶剂,配置2×104 mg/L BDE-47母液备用。
1.2 方法
1.2.1 试验设计 四溴联苯醚暴露试验参照《环境监测手册》进行[13]。选取体长为(37.9±0.9)mm,体质量为(1.31±0.03)g,生长良好、无病害、无损伤的黄盖鲽幼鱼150尾,随机分为空白对照组(CK)、溶剂对照组(DMSO)、0.25 mg/L BDE-47低浓度处理组(LC)、0.5 mg/L BDE-47中浓度处理组(MC)和2 mg/L BDE-47高浓度处理组(HC),每组设置3个平行,每个平行设置10尾鱼,置于含40 L水体的养殖槽中。试验期间连续曝气,水温为(18.4±0.85)℃、溶解氧为(6.68±0.36)mg/L、pH为8.50±0.08。每日换水1/4,换水后重新添加BDE-47至试验浓度。
1.2.2 样品采集 养殖28 d后,每组随机取5尾黄盖鲽幼鱼,采用质量浓度为75 mg/L渔安宝溶液将其麻醉后置于解剖盘中,取完整鳃组织,用预冷PBS溶液进行冲洗,随后将样品浸泡于体积分数为4%多聚甲醛中进行固定,用于制备石蜡组织切片及苏木精-伊红(HE)染色。从DMSO组和HC组各取6尾鱼,取鳃组织样本,分别进行两两混样,DMSO组样本命名为D1、D2、D3,HC组样本命名为B1、B2、B3,经液氮迅速冷冻后送至北京诺禾致源科技股份有限公司进行转录组测序分析。
1.2.3 石蜡组织切片制作及HE染色 取固定好的鳃组织样品经梯度乙醇脱水,二甲苯透明,石蜡包埋,然后使用切片机连续切片,切片厚度为5 μm,进行HE染色,中性树脂封片,最后使用荧光显微镜观察并拍照。
1.2.4 RNA提取、文库构建及测序 每组设置3个生物学重复。首先,提取鳃组织总RNA。然后,利用琼脂糖凝胶电泳分析样品RNA降解及DNA污染情况。接着,采用NanoPhotometer spectrophotometer检测RNA纯度并利用Qubit2.0 Fluorometer 测定RNA浓度。通过Agilent 2100 bioanalyzer精确检测RNA完整性,选择符合质控标准的RNA样品进行mRNA富集。随后,构建cDNA文库。完成文库质检合格后,采用Illumina进行测序。
1.2.5 转录组测序数据分析 将高通量测序仪测得的图像数据转化为序列数据(reads)。测序获得的原始数据经过滤成为高质量测序序列。使用Trinity软件对这些序列进行拼接,作为参考序列(ref)。将各样品的序列与参考序列进行比对,进一步获得每个样品在每个基因上的read count数目,并对其进行FPKM转换,以分析基因的表达水平。采用DESeq2分析差异表达基因,筛选标准为Padj<0.05。采用KEGG、GO等数据库进行基因功能注释,并采用KOBAS软件对差异基因集进行KEGG通路富集分析。
1.2.6 miRNA测序数据分析 通过miRBase序列比对获得已知miRNA信息,利用miREvo和miRDeep2预测新miRNA。对各样本中已知miRNA和新miRNA进行表达量统计,采用TPM(Transcripts per million)进行表达量归一化处理。利用DESeq2分析miRNA差异表达情况,筛选条件为P<0.05,预测差异表达miRNA的靶基因,对靶基因集合进行KEGG富集分析。
1.2.7 miRNA-mRNA联合分析 筛选BDE-47处理组与对照组差异表达mRNA和miRNA,以差异miRNA和差异mRNA为一组。将差异miRNA和差异mRNA为一组。将差异下调miRNA和差异上调mRNA为一组。对应miRNA的靶基因与转录组测序得到的差异基因进行KEGG富集分析。
2 结果与分析
2.1 BDE-47胁迫下黄盖鲽幼鱼的行为变化
在试验过程中,空白对照组、溶剂对照组及0.25、0.5 mg/L的BED-47处理组黄盖鲽均未显示明显的应激反应,但是在2 mg/L BED-47处理组中,黄盖鲽表现出躁动不安、急促窜游、惊跳和翻滚现象,最终导致鱼体失去平衡并侧翻。
2.2 BDE-47胁迫下黄盖鲽幼鱼的组织病理学变化
利用显微镜观察黄盖鲽幼鱼鳃组织切片,发现BDE-47处理组与对照组鳃组织结构明显不同(图1),空白对照组黄盖鲽鳃小片均匀排列在鳃丝两侧,其上皮细胞略肿胀,存在少许黏液细胞(图1(a));溶剂对照组鳃小片上皮细胞发生轻度肿胀,偶见即将脱落的上皮细胞,鳃小片上皮细胞增生不明显且结构清晰,黏液细胞不明显(图1(b));0.25 mg/L BDE-47处理组鳃小片上皮细胞肿胀脱落,存在明显增生,黏液细胞数量明显增多(图1(c));0.5 mg/L BDE-47处理组黄盖鲽幼鱼鳃组织出现损伤,鳃小片出血严重,炎症细胞浸润,从而引发炎症反应,鳃丝毛细血管壁上有扁平上皮细胞增生增厚(图1(d));2 mg/L BDE-47处理组鳃小片间隙基部有成排黏液细胞,上皮细胞出现增生增厚,鳃小片出现变形弯曲和粘连融合现象(图1(e))。BDE-47胁迫下黄盖鲽幼鱼的鳃小片上皮细胞整体变化趋势为先肿胀后脱落再增生修复的生理过程,并伴随炎症反应的发生。
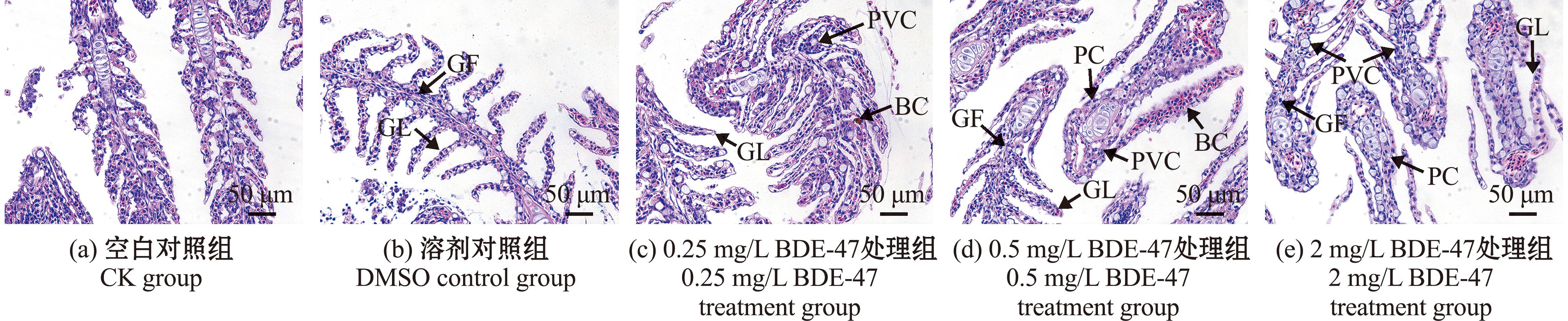
GF—鳃丝;GL—鳃小片;BC—血细胞;PC—柱细胞;PVC—扁平上皮细胞。
GF—gill filament;GL—gill lamellae;BC—blood cells;PC—columnar cells;PVC—squamous epithelial cells.
图1 黄盖鲽幼鱼鳃组织切片(10×40倍)
Fig.1 Histological sections of gill in Pseudopleuronectesyokohamae (10×40 times)
2.3 BDE-47胁迫下差异表达mRNA分析
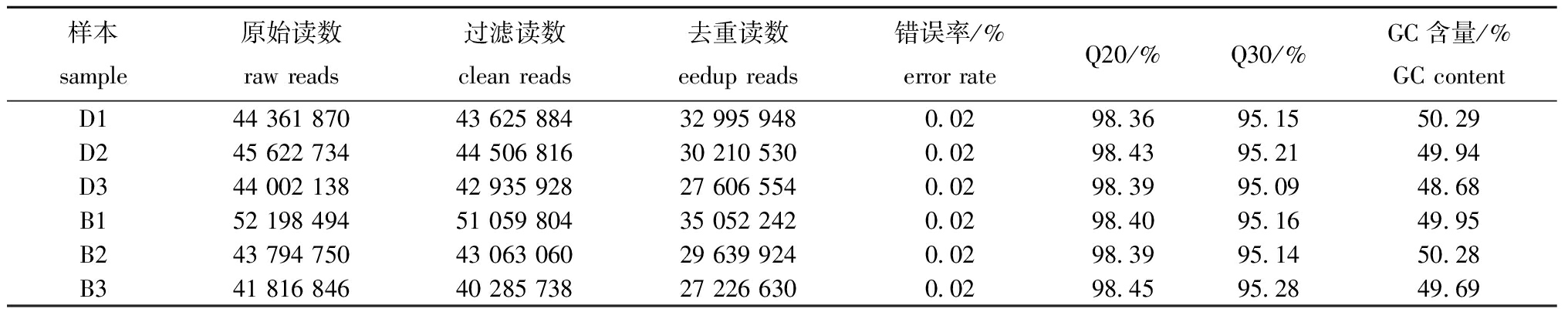
构建溶剂对照组和2 mg/L BDE-47处理组黄盖鲽鳃组织cDNA文库,利用Illumina平台进行测序,共获得271 796 832个原始读数。对照组(D1、D2、D3)和处理组(B1、B2、B3)的原始读数分别为44 361 870、45 622 734、44 002 138、52 198 494、43 794 750、41 816 846。经过筛选和过滤后得到265 477 230个过滤读数,D1、D2、D3、B1、B2、B3过滤读数分别为43 625 884、44 506 816、42 935 928、51 059 804、43 063 060、40 285 738(表1)。差异基因分析显示,共有652个基因表达存在差异,其中283个基因上调,369个基因下调(图2(a))。KEGG富集分析结果(图2(b))显示,差异表达基因主要富集在紧密连接(tight junctions)和心肌收缩(cardiac muscle contraction)等信号通路,本研究重点关注促红细胞癌基因B信号通路(ErbB signaling pathway),在环境影响下,该通路可能被激活,影响细胞增殖、迁移、分化、凋亡和运动。研究推测,在BDE-47胁迫下,黄盖鲽幼鱼鳃小片上皮细胞增生增厚可能与该信号通路相关。
表1 测序数据统计
Tab.1 Summary of RAN-seq data
样本sample原始读数raw reads过滤读数clean reads去重读数eedup reads错误率/%error rateQ20/%Q30/%GC含量/%GC contentD144 361 87043 625 88432 995 9480.0298.3695.1550.29D245 622 73444 506 81630 210 5300.0298.4395.2149.94D344 002 13842 935 92827 606 5540.0298.3995.0948.68B152 198 49451 059 80435 052 2420.0298.4095.1649.95B243 794 75043 063 06029 639 9240.0298.3995.1450.28B341 816 84640 285 73827 226 6300.0298.4595.2849.69
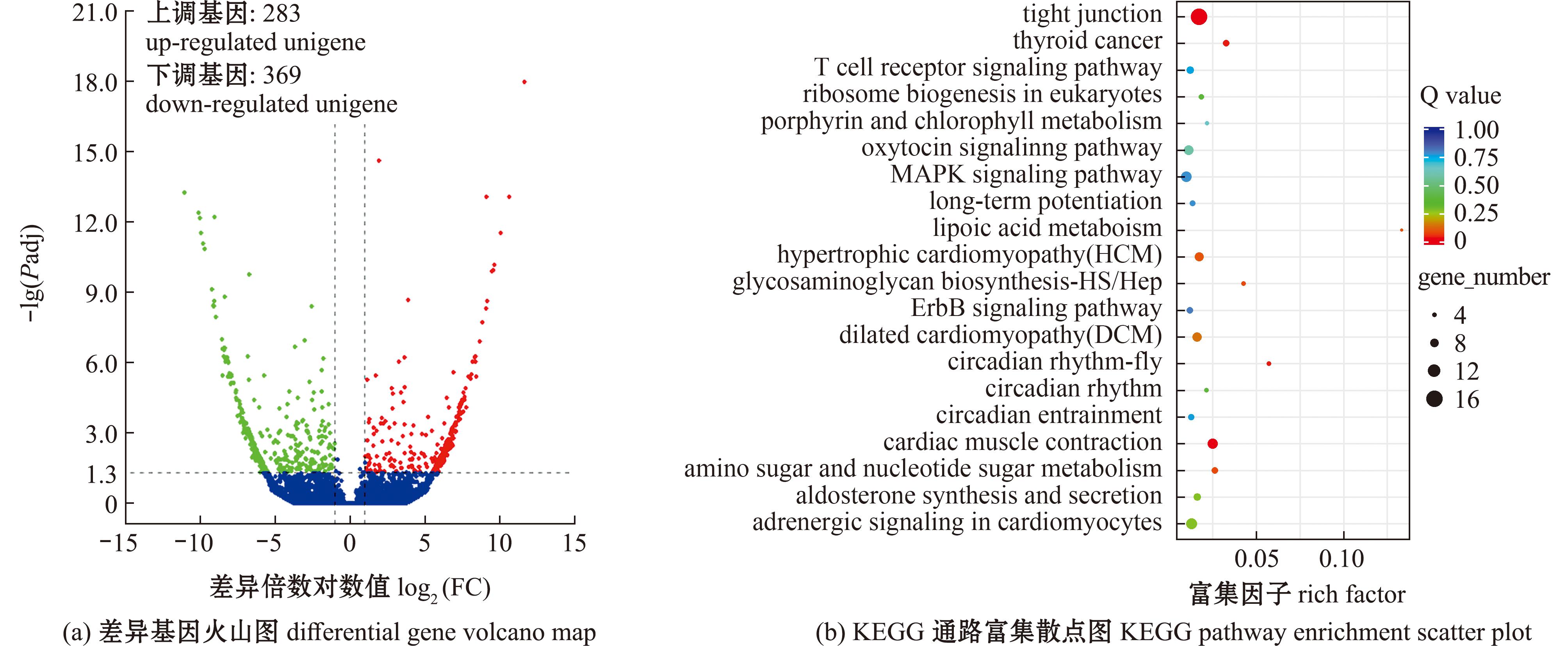
图2 BDE-47对黄盖鲽幼鱼鳃mRNA表达水平的影响
Fig.2 Effect of BDE-47 on gill mRNA expression level of juvenile Pseudopleuronectesyokohamae
2.4 BDE-47胁迫下差异表达miRNA分析
利用bowtie2将经过长度筛选的sRNA定位到参考序列上,分析sRNAs在参考序列上的分布情况,与miRBase数据库中的牙鲆(Paralichthys olivaceus)、庸鲽(Hippoglossus)和斑马鱼进行序列比对。在此过程中,D1、D2、D3、B1、B2、B3分别鉴定出了127、137、132、127、131、131个已知miRNA。根据二级结构、Dicer酶切位点信息和能量等特征,预测出新的miRNA。其中,D1、D2、D3、B1、B2、B3分别获得了169、165、183、150、170、166个新miRNA。
差异表达miRNAs的分析结果显示,在2 mg/L BDE-47处理组与溶剂对照组之间共有24个差异表达miRNA(图3(a))。其中包括了9个已知miRNA和15个新miRNA。相较于对照组,BDE-47处理组有7个miRNA呈显著上调状态(包括novel_423、novel_28、dre-miR-26a-5p、hhi-miR-26、novel_68、novel_88和dre-miR-301b-5p),而有17个miRNA呈显著下调状态(包括dre-miR-133a-3p、novel_101、hhi-miR-147b、novel_301、novel_111、novel_420、novel_156、novel_174、dre-miR-210-3p、novel_261、novel_226、novel_341、pol-miR-133-3p、dre-miR-133b-3p、dre-miR-142a-3p、novel_427和novel_221)。对差异表达miRNA的靶基因进行预测及KEGG分析(图3(b))。在差异表达miRNA富集的通路中,最多的是癌症通路(pathways in cancer),共计840个富集基因;其次是丝裂原活化蛋白激酶信号通路(MAPK signaling pathway),富集了509个基因,MAPK信号通路能够与单体小分子三磷酸鸟苷酶信号通路(ras signaling pathway)组成Ras/Raf/MEK/ERK通路,参与信号传导调节。在试验过程中,黄盖鲽幼鱼鳃小片上皮细胞的肿胀脱落可能与这两条通路调控相关,但具体的影响机制尚不明确。
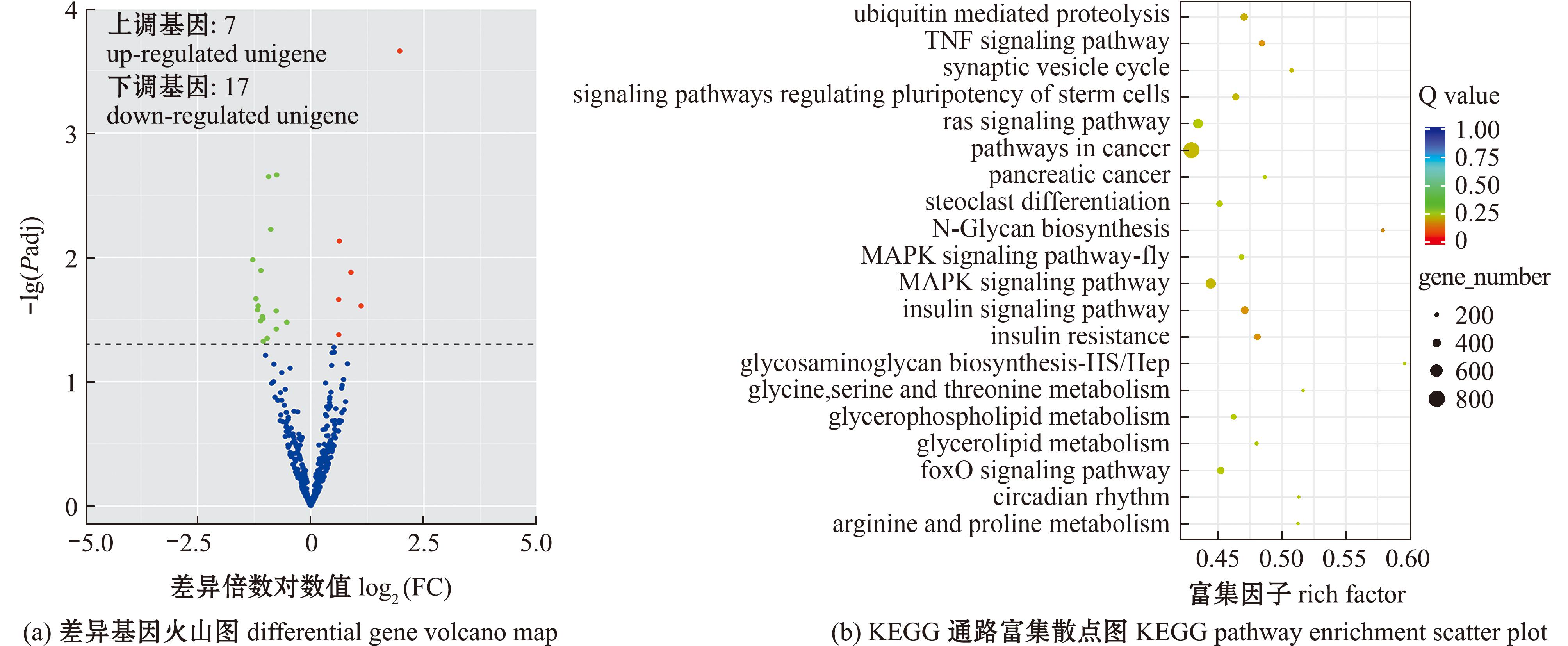
图3 BDE-47对黄盖鲽幼鱼鳃miRNA表达水平的影响
Fig.3 Effect of BDE-47 on gill miRNA expression level of juvenile Pseudopleuronectesyokohamae
2.5 miRNA-mRNA关联分析
miRNA通过与mRNA特异结合抑制转录后基因表达。为了解析BDE-47胁迫下黄盖鲽幼鱼鳃组织miRNA-mRNA调控网络的功能,本研究中分别对差异miRNA-差异mRNA、上调miRNA-下调mRNA和下调miRNA-上调mRNA 3个组合的差异基因交集进行KEGG通路富集分析。结果表明,差异miRNA靶基因富集最显著的20个通路中,主要包括甲状腺癌(thyroid cancer)、醛固酮的合成和分泌(aldosterone synthesis and secretion)、氨基糖和核苷酸糖代谢(amino sugar and nucleotide sugar metabolism)、硫辛酸的新陈代谢(lipoic acid metabolism)通路等(图4(a))。本研究中关注硫辛酸信号通路,发现dre-miR-26a-5p、hhi-miR-26和novel_88表达上调,而dre-miR-142a-3p、novel_111、dre-miR-210-3p、novel_427和novel_226表达下调。推测在BDE-47胁迫下,黄盖鲽幼鱼内部激活硫辛酸信号通路以调节炎症反应。在差异下调的miRNA和上调的mRNA组合中,靶基因富集的通路包括心肌收缩、肾上腺素能信号(adrenergic signaling in cardiomyocytes)和甲状腺癌(thyroid cancer)通路等(图4(b))。miRNA上调与mRNA下调的差异组合中(图4(c)),差异基因在醛固酮合成和分泌(aldosterone synthesis and secretion)、氨基糖和核苷酸糖代谢(amino sugar and nucleotide sugar metabolism)及Toll样受体信号通路(Toll-like receptor signaling pathway)等方面富集。Toll样受体在先天免疫过程中扮演关键角色,本研究中发现,Toll样受体信号通路相关基因存在差异富集,表明BDE-47胁迫会影响黄盖鲽幼鱼的免疫功能。

图4 mRNA-miRNA关联分析差异表达基因KEGG富集结果
Fig.4 KEGG enrichment results of differentially expressed genes in mRNA-miRNA association analysis
3 讨论
3.1 BDE-47胁迫对黄盖鲽幼鱼鳃组织结构的影响
底栖生物是水生生态系统中的重要组成部分,黄盖鲽属于冷温性底栖鱼类,活动能力较弱,洄游范围小,易受污染物影响,是研究有机污染物对水产动物毒性作用的理想模型。鳃是鱼类重要的呼吸器官,同时也是病原体和有毒物质进入鱼体的入口,其上皮组织中存在淋巴细胞、巨噬细胞等免疫细胞。鳃组织受水体中有毒物质作用导致的损伤通常可分为两类[14]:一类是由防御反应引起的损伤,如溴氰菊酯胁迫导致食蚊鱼(Gambusia affinis)[15]鳃丝上皮细胞肿胀、增生,鳃小片的呼吸上皮水肿等;另一类是由有害物质直接导致的损伤,如全氟辛烷磺酸急性胁迫引起斑马鱼[16]鳃小片前端细胞不可修复损伤。黄盖鲽鳃组织在不同浓度BDE-47作用下表现出不同类型的损伤,低浓度处理组属于第一类损伤,而中、高浓度处理组则属于第二类损伤,同时还具有第一类损伤的表现。黄盖鲽幼鱼鳃组织的病理学变化显示,在四溴联苯醚胁迫下,鳃小片上皮细胞经历了肿胀、脱落和增生修复的生理过程。可以推测,鳃组织长时间接触BDE-47后,鳃小片会受到刺激而发生细胞肿胀,可能诱发炎症反应,导致细胞凋亡、自噬,然后促进机体细胞的增殖和分化,以修复BDE-47引起的损伤。
3.2 转录组分析BDE-47胁迫对黄盖鲽幼鱼鳃的影响
ErbBs是表皮生长因子受体家族的成员,包括ErbB1、2、3、4共4个成员,具有细胞外、跨膜和酪氨酸激酶结构域 [17]。ErbB受体家族成员需要形成同源或异源二聚体后,才能激活酪氨酸激酶区,从而影响细胞的多种生物学过程[18]。当环境发生改变时,ErbB受体家族的信号调控也会发生变化。这些调控机制主要通过影响下游信号通路来调节细胞的生长、迁移和凋亡等过程[19]。在本研究中,差异基因在该途径中富集了6个基因。其中,与细胞迁移有关的Ras基因及作用于血管生成的Jnkk基因表达量上调;代谢相关的Gsk-3及作用于靶细胞的Camk基因表达量下调。推测BDE-47暴露下黄盖鲽幼鱼鳃组织Ras、Jnkk、Gsk-3、Camk基因表达量变化,可能引起鳃小片上皮细胞自噬与凋亡,从而导致鳃小片上皮细胞增生和修复。
MAPK信号通路是丝氨酸-苏氨酸蛋白激酶的一种,能够受细胞外不同刺激而产生相应反应。该信号通路通过三级酶促级联反应激活下游转录因子,参与调节细胞增殖、分化、转化及凋亡,并与炎症、肿瘤等多种疾病的发生紧密相连[20]。Ras是一种具有弱GTP酶活性的GTP结合蛋白,其活性状态与细胞分化、蛋白运输和分泌等功能相关[21]。对贻贝进行多环芳烃(polycyclic aromatic hydrocarbon,PAH)和苯并芘胁迫试验可导致DNA链断裂、组织损伤和肿瘤调控基因的表达,Ras编码蛋白以组织特异性方式表达,并与组织特异性功能协作以响应基因毒性应激[22]。MAPK及Ras信号通路可组成Ras/Raf/MEK/ERK通路。这两条通路的变化可能与试验过程中黄盖鲽幼鱼鳃小片上皮细胞的脱落有关,但具体影响机制尚不明确。
硫辛酸是一种高效的抗氧化剂[23],参与多个炎症反应的调节作用[24]。张丽等[25]研究表明,向奥尼罗非鱼(Oreochromis niloticus×O.aureus)饲料中添加硫辛酸可以有效缓解微囊藻毒素的毒性效应。本研究中,与硫辛酸代谢相关的dre-miR-26a-5p、hhi-miR-26和novel_88表达量上调,dre-miR-142a-3p、novel_111、dre-miR-210-3p、novel_427及novel_226表达量下调。在这些miRNAs的共同调节下,LipB基因表达量上调。推测在BDE-47胁迫下,黄盖鲽幼鱼机体可调节体内硫辛酸代谢来发挥机体修复的作用。Toll样受体(TLRs)是病原相关分子模式的重要识别受体,在机体应对病原体入侵引起先天免疫的过程中发挥关键作用,可以激活多条信号通路。王孟强[26]研究表明,TLR通路在栉孔扇贝(Chlamys farreri)先天免疫系统起关键作用,其作用机制可能与调控抗氧化基因表达、维持内环境稳定及调控抗菌蛋白基因表达有关。詹秋羽等[27]研究发现,TLRs在健康尼罗罗非鱼(Oreochromis niloticus)的鳃、脑、心脏、肠、肝、脾、肾和皮肤中均有表达,但不同TLRs在各部位的表达量有所差异。本研究中结果显示,BDE-47胁迫会导致黄盖鲽幼鱼鳃组织中相关miRNAs的表达量增加,通过miRNA-mRNA转录后基因表达调控网络,抑制Toll样受体信号通路相关的基因表达,从而影响黄盖鲽幼鱼的免疫功能。
4 结论
1)BDE-47胁迫会导致黄盖鲽幼鱼鳃组织结构发生病理性改变,使鳃小片上皮细胞肿胀脱落和增生,黏液细胞数量显著增加,导致鳃小片出现粘连融合和变形弯曲现象。
2)通过mRNA和miRNA测序分析探讨黄盖鲽幼鱼对四溴联苯醚胁迫的潜在响应机制,高通量测序共获得652个差异表达基因和24个差异表达miRNA。在差异基因和靶基因富集的KEGG通路中,本研究中主要关注ErbB、MAPK和Ras信号通路,推测ErbB、MAPK和Ras信号通路可能与黄盖鲽幼鱼鳃小叶上皮细胞脱落、增生和修复有关。
3)通过构建miRNA-mRNA调控网络,推测黄盖鲽幼鱼鳃组织中miRNAs可能通过调节硫辛酸代谢改变BDE-47对其毒性效应,进而通过调节Toll样受体信号通路相关基因mRNA的稳定性和翻译,影响水体中BDE-47对幼鱼免疫应答的干扰作用。
[1] 顾怡然,黄文聪,李菊英,等.多溴联苯醚的微生物降解机制研究进展[J].生物工程学报,2019,35(11):2121-2132.GU Y R,HUANG W C,LI J Y,,et al.Advances in microbial degradation of polybrominated diphenyl ethers (PBDEs)[J].Chinese Journal of Biotechnology,2019,35(11):2121-2132.(in Chinese)
[2] 张照祥,翟金霞.多溴联苯醚神经发育毒性的研究进展[J].中国工业医学杂志,2009,22(4):278-282.ZHANG Z X,ZHAI J X.Research progress on neurodevelopmental toxicity of polybrominated diphenyl ethers(PBDEs)[J].Chinese Journal of Industrial Medicine,2009,22(4):278-282.(in Chinese)
[3] 颜世帅,徐海明,秦占芬.多溴二苯醚毒理学研究进展及展望[J].生态毒理学报,2010,5(5):609-617.YAN S S,XU H M,QIN Z F.Advances in microbial degradation of polybrominated diphenyl ethers and future perspectives in toxicology study on polybrominated diphenyl ethers[J].Asian Journal of Ecotoxicology,2010,5(5):609-617.(in Chinese)
[4] LIANG R Y,CHEN J,SHI Y J,et al.Toxicological effects on earthworms (Eisenia fetida) exposed to sub-lethal concentrations of BDE-47 and BDE-209 from a metabolic point[J].Environmental Pollution,2018,240:653-660.
[5] ZHENG S K,LIU C X,HUANG Y H,et al.Effects of 2,2’,4,4’-tetrabromodiphenyl ether on neurobehavior and memory change and bcl-2,c-fos,grin1b and lingo1b gene expression in male zebrafish (Danio rerio)[J].Toxicology and Applied Pharmacology,2017,333:10-16.
[6] 庄娟,石晗波,秦颖,等.2,2’,4,4’-四溴联苯醚对斑马鱼胚胎生长发育的影响研究[J].安全与环境学报,2023,23(2):595-602.ZHUANG J,SHI H B,QIN Y,et al.Effect of 2,2’,4,4’-tetrabromodiphenyl ether on growth and development in zebrafish embryos[J].Journal of Safety and Environment,2023,23(2):595-602.(in Chinese)
[7] 迟潇,陈碧鹃,孙雪梅,等.基于IBR模型研究BDE-47和BDE-153对半滑舌鳎的毒性效应[J].生态毒理学报,2020,15(4):192-202.CHI X,CHEN B J,SUN X M,et al.Toxic effects of BDE-47 and BDE-153 on Cynoglossus semilaevis Gunther based on IBR model[J].Asian Journal of Ecotoxicology,2020,15(4):192-202.(in Chinese)
[8] 张赛赛,姜欣彤,王伟,等.四溴联苯醚慢性胁迫对大泷六线鱼血液生化指标的影响[J].中国渔业质量与标准,2018,8(3):1-10.ZHANG S S,JIANG X T,WANG W,et al.Effects of tetra-brominated diphenyl ethers stress on the plasma biochemical index of Hexagrammos otakii[J].Chinese Fishery Quality and Standards,2018,8(3):1-10.(in Chinese)
[9] 张赛赛,孙德启,姜欣彤,等.四溴联苯醚慢性胁迫对大泷六线鱼生长及抗氧化酶活力的影响[J].大连海洋大学学报,2017,32(6):700-707.ZHANG S S,SUN D Q,JIANG X T,et al.Effects of chronic tetrabromodiphenyl ether stress on growth and antioxidant enzyme activity in fat greenling Hexagrammos otakii[J].Journal of Dalian Ocean University,2017,32(6):700-707.(in Chinese)
[10] 王伟,武世雄,林茂上,等.北方黄盖鲽人工育苗及养殖技术研究[J].经济动物学报,2017,21(1):1-4,10,69.WANG W,WU S X,LIN M S,et al.Artificial seedling and breeding technology of north Pseudopleuronectes yokohamae[J].Journal of Economic Animal,2017,21(1):1-4,10,69.(in Chinese)
[11] DU T T,ZAMORE P D.MicroPrimer:the biogenesis and function of microRNA[J].Development,2005,132(21):4645-4652.
[12] WANG X W,WANG X H.Systematic identification of microRNA functions by combining target prediction and expression profiling[J].Nucleic Acids Research,2006,34(5):1646-1652.
[13] 韦进宝,吴峰.环境监测手册[M].北京:化学工业出版社,2006:62-75.WEI J B, WU F.Environmental monitoring manual[M].Beijing:Chemical Industry Press,2006:62-75.(in Chinese)
[14] WONG C K C,WONG M H.Morphological and biochemical changes in the gills of tilapia (Oreochromis mossambicus) to ambient cadmium exposure[J].Aquatic Toxicology,2000,48(4):517-527.
[15] CENGIZ E I,UNLU E.Sublethal effects of commercial deltamethrin on the structure of the gill,liver and gut tissues of mosquitofish,Gambusia affinis:a microscopic study[J].Environmental Toxicology and Pharmacology,2006,21(3):246-253.
[16] 胡芹,周珍,周群芳,等.全氟辛烷磺酸(PFOS)急性暴露对斑马鱼鳃显微结构的影响[J].生态毒理学报,2009,4(4):530-536.HU Q,ZHOU Z,ZHOU Q F,et al.Acute effects of perfluorooctane sulfonate on microstructure of the gill of zebrafish(Danio rerio)[J].Asian Journal of Ecotoxicology,2009,4(4):530-536.(in Chinese)
[17] 彭健豪,张连峰.ErbBs受体在心脏发育和心肌病中的作用[J].中国比较医学杂志,2006,16(6):376-378.PENG J H,ZHANG L F.The function of ErbBs in heart development and myocardial diseases[J].Chinese Journal of Comparative Medicine,2006,16(6):376-378.(in Chinese)
[18] 曹俊燕.ErbB信号通路调控大脑皮层病理性激活星形胶质细胞转分化潜能及其与神经元间蛋白质运输的研究[D].杭州:杭州师范大学,2019.CAO J Y.ErbB signaling pathway regulates the transdifferentiation potential of reactive astrocytes in cortex and protein transportation between astrocytes and neurons[D].Hangzhou:Hangzhou Normal University,2019.(in Chinese)
[19] KUMAGAI S,KOYAMA S,NISHIKAWA H.Antitumour immunity regulated by aberrant ERBB family signalling[J].Nature Reviews Cancer,2021,21(3):181-197.
[20] 陈露,江俊超,戴兴兴,等.丝裂原活化蛋白激酶对卵母细胞减数分裂成熟和排卵的调控作用及机制[J].生理学报,2020,72(1):48-62.CHEN L,JIANG J C,DAI X X,et al.Function and molecular mechanism of mitogen-activated protein kinase (MAPK) in regulating oocyte meiotic maturation and ovulation[J].Acta Physiologica Sinica,2020,72(1):48-62.(in Chinese)
[21] 张宝警,常亚青,黄慧玲,等.海洋生物小GTPase蛋白家族研究进展[J].大连海洋大学学报,2019,34(2):288-295.ZHANG B J,CHANG Y Q,HUANG H L,et al.Research progress on small GTPases in marine animals:a review[J].Journal of Dalian Ocean University,2019,34(2):288-295.(in Chinese)
[22] DI Y N,AMINOT Y,SCHROEDER D C,et al.Integrated biological responses and tissue-specific expression of p53 and ras genes in marine mussels following exposure to benzo(α)pyrene and C60 fullerenes,either alone or in combination[J].Mutagenesis,2017,32(1):77-90.
[23] TRATTNER S,PICKOVA J,PARK K H,et al.Effects of α-lipoic and ascorbic acid on the muscle and brain fatty acids and antioxidant profile of the South American pacu Piaractus mesopotamicus[J].Aquaculture,2007,273(1):158-164.
[24] SHAY K P,MOREAU R F,SMITH E J,et al.Alpha-lipoic acid as a dietary supplement:molecular mechanisms and therapeutic potential[J].Biochimica et Biophysica Acta (BBA)-General Subjects,2009,1790(10):1149-1160.
[25] 张丽,许国焕,熊达,等.罗非鱼饲料添加α-硫辛酸对藻毒素的解毒作用[J].淡水渔业,2014,44(3):75-79.ZHANG L,XU G H,XIONG D,et al.Effects of dietary supplemental α-lipoic acid on the toxicity of microcystins in hybrid tilapia(Oreochromis niloticus×O.aureus)[J].Freshwater Fisheries,2014,44(3):75-79.(in Chinese)
[26] 王孟强.栉孔扇贝(Chlamys farreri) Toll样受体信号通路免疫功能研究[D].青岛:中国科学院研究生院(海洋研究所),2010.WANG M Q.Study on the Toll like receptor signal pathway and its immune function in Zhikong scallop Chlamys farreri[D].Qingdao:Institute of Oceanology,Chinese Academy of Sciences,2010.(in Chinese)
[27] 詹秋羽,王骥腾,韩涛.鱼类摄食调控的研究进展[J].饲料工业,2020,41(16):41-47.ZHAN Q Y,WANG J T,HAN T.Research progress of fish feeding regulation[J].Feed Industry,2020,41(16):41-47.(in Chinese)