中草药黄芩是唇形科黄芩属黄芩(Scutellaria baicalensis Georgi)的干燥根部,呈棕黄色,性寒,味苦,具有抗氧化、抗炎、抗菌和保护肝脏等功效[1],是一种广泛应用的中草药。黄芩的主要活性成分包含黄芩素、黄芩苷、汉黄芩苷和汉黄芩素等黄酮类物质,以及挥发油类、多糖类和多种微量元素等[2]。在畜禽动物中,黄芩可以提升肉猪[3]、蛋雏鸡[4]和肉鸭[5]的生长性能与免疫性能。在水产动物中,黄芩对罗非鱼(Oreochromis niloticus)[6]、牙鲆(Paralichthys olivaceus)[7]、鲤(Cyprinus carpio)[8]、珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×E.lanceo-latus♂) [9]、褐篮子鱼(Siganus fuscescen)[10]和凡纳滨对虾(Litopenaeus vannamei)[11]的生长性能或抗氧化及免疫性能具有改善作用。
斑点叉尾鮰(Ictalurus punctatus)属于鲇形目鮰科,是一种淡水温水型杂食性鱼类。目前,已有研究表明,黄芪[12]、杜仲叶[13]和牛至[14]可以提升斑点叉尾鮰的生长性能或抗氧化及免疫性能。但关于黄芩是否具有改善斑点叉尾鮰生长性能、血清和肝脏生化指标及肝脏健康的效果,目前尚无相关报道。本试验中探讨了饲料中添加不同水平黄芩对斑点叉尾鮰幼鱼的生长性能、形体指标、血清生化指标、肝脏抗氧化能力、非特异性免疫能力及肝脏健康的影响,以期为黄芩在水产养殖中的合理利用提供科学参考。
1 材料与方法
1.1 材料
斑点叉尾鮰鱼苗购自广东众汇水产养殖公司,共800尾,平均体质量为3.15 g。
1.2 方法
1.2.1 试验饲料的配制 使用鱼粉、豆粕、菜粕和棉籽粕作为蛋白源,配制成粗蛋白质含量为380 g/kg的基础饲料,将基础饲料分为4组,分别添加0(SA0组)、5(SA5组)、10(SA10组)和15(SA15组) g/kg的黄芩,配制为4组等氮等脂饲料。为确保饲料组成的平衡,在添加了黄芩的各组中相应降低小麦麸的含量。加入黄芩时,先将粉碎并过165 μm筛的黄芩与9倍质量的水小火熬制1 h,将汁液和药渣一起加入粉碎好的饲料原料中混合均匀。黄芩购于河北安国药源有限责任公司,药材原产地为河北省。
所有饲料原料经过粉碎机处理,通过350 μm筛进行筛选,并逐级混合后,使用单螺杆挤压机(LX-75型,河北隆尧县龙翔食品机械厂制造)在90 ℃下,将原料加工成直径为2 mm的沉性饲料。加工完成后,饲料在60 ℃下烘干,然后存放在阴凉干燥的地方备用。饲料配方和营养成分含量见表1和表2。
表1 饲料配方(风干质量)
Tab.1 Ingredient of experimental diets g/kg
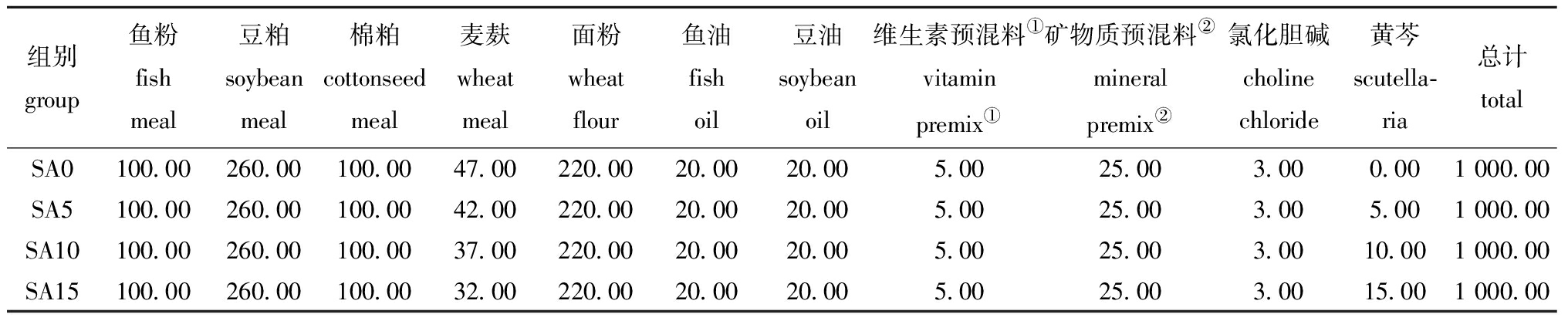
组别group鱼粉fish meal豆粕soybean meal棉粕cottonseed meal麦麸wheat meal面粉wheat flour鱼油fish oil豆油soybean oil维生素预混料①vitamin premix①矿物质预混料②mineral premix②氯化胆碱choline chloride黄芩scutella-ria总计totalSA0100.00260.00100.0047.00220.0020.0020.005.0025.003.000.001 000.00SA5100.00260.00100.0042.00220.0020.0020.005.0025.003.005.001 000.00SA10100.00260.00100.0037.00220.0020.0020.005.0025.003.0010.001 000.00SA15100.00260.00100.0032.00220.0020.0020.005.0025.003.0015.001 000.00
注:①表示维生素预混料向每千克饲料提供维生素A 6 000 IU,维生素B1 15 mg,维生素B2 15 mg,维生素B3 30 mg,维生素B5 35 mg,维生素B6 5 mg,维生素B12 0.03 mg,生物素2 mg,叶酸4 mg,维生素D 2 000 IU,维生素E 55 IU和维生素K 5mg;②表示矿物质预混料向每千克饲料提供FeSO4·H2O 0.443 g,ZnSO4·H2O 0.233 g,MnSO4·H2O 0.062 g,MgSO4·7H2O 0.647 g,Ca(IO3)2 0.03 g,CoCl2·6H2O 0.01 g和NaSeO3·5H2O 0.01 g。
Note:① vitamin premix provides the following(IU or mg/kg diet):VA 6 000 IU,VB1 15 mg,VB2 15 mg,VB3 30 mg,VB5 35 mg,VB6 5 mg,VB12 0.03 mg,biotin 2mg,folic acid 4mg,VD 2 000 IU,VE 55 IU,VK 5 mg;② mineral premix provides the following(g/kg diet):FeSO4·H2O 0.443 g,ZnSO4·H2O 0.233 g,MnSO4·H2O 0.062 g,MgSO4·7H2O 0.647 g,Ca(IO3)2 0.03 g,CoCl2·6H2O 0.01 g,and NaSeO3·5H2O 0.01 g.
表2 饲料常规成分含量
Tab.2 Proximate composition of experimental diets g/kg
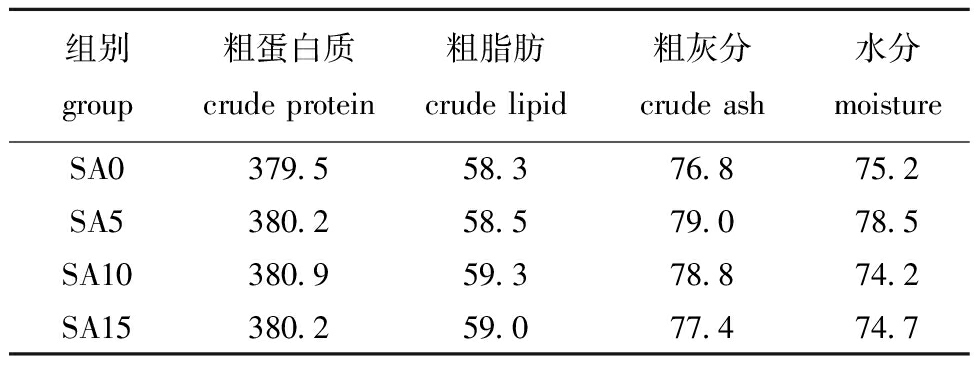
组别group粗蛋白质crude protein粗脂肪crude lipid粗灰分crude ash水分moistureSA0379.558.376.875.2SA5380.258.579.078.5SA10380.959.378.874.2SA15380.259.077.474.7
1.2.2 试验设计与饲养管理 试验鱼采用上海海洋大学滨海基地水泥池用商品饲料(福建天马科技集团股份有限公司,粗蛋白质含量≥330 g/kg,粗脂肪含量≥30 g/kg)驯养2周,随机选取体格强壮、规格均一、平均体质量为(4.68±0.02) g的斑点叉尾鮰360尾进行试验。试验用鱼被随机分为4个处理组,每组设置3个重复,共置于12个网箱(1.0 m×1.0 m×1.2 m)中进行养殖,每个网箱放置30尾鱼,分别投喂4种试验饲料。
在养殖期间,于每日8:00和17:00对斑点叉尾鮰进行两次投喂,日投喂量控制在鱼体质量的3%~5%,每周根据投喂量估算鱼体质量并改变投喂量,保证斑点叉尾鮰可在10 min内将饲料吃完。水体24 h充气,每周换水两次,每次更换水量的1/3,水源采用过滤后的池塘水,养殖试验在上海海洋大学滨海基地进行,期间严格控制水体参数:溶氧含量>5 mg/L,pH值为7.5~8.0,氨氮含量<0.2 mg/L,亚硝酸盐浓度<0.1 mg/L,试验共持续60 d。
1.2.3 样品采集 试验样品采集过程严格遵守中国实验动物学会所制定的试验动物福利条例,确保充分尊重试验动物的福利并遵守试验道德规范。
试验结束后,将试验用鱼饥饿24 h。对每个网箱内的所有斑点叉尾鮰进行称重和数量清点,以计算增重率(WGR)、特定生长率(SGR)、存活率SR和饲料系数(FCR)。从每个网箱中随机选取3尾鱼,将其在-20 ℃下冷冻保存,以便后续测定全鱼的常规营养成分含量。另随机取3尾鱼测量体长和体质量,并尾静脉采血,血样立刻置于4 ℃下静置24 h,离心(3 000 r/min,10 min),将血清样品存放于-80 ℃冰箱中冷冻保存,用于血清免疫指标与常规生化指标测定。采血完成后进行解剖,测定内脏和肝脏的质量,以计算肥满度(CF)、肝体比(HSI)和脏体比(VSI),并留取肝脏鲜活样本在-80 ℃冰箱中冷冻保存,用于抗氧化指标的测定。另取3尾鱼取肝脏切片样本在Bouin氏液中常温保存,用于制作HE染色石蜡组织切片。
1.2.4 生长指标与形体指标的测定 生长与形体指标包括存活率(SR,%)、增重率(WGR,%)、特定生长率(SGR,%/d)、饲料系数(FCR)、肝体比(HSI,%)、脏体比(VSI,%)和肥满度(CF,g/cm3),计算公式为
RSR=Nt/Ns×100%
(1)
RWGR=(Wt-Ws)/Ws×100%,
(2)
RSGR=100%×(lnWt-lnWs)/d,
(3)
RFCR=Wf/(Wt-Ws),
(4)
IHSI=Wh/Wb×100%,
(5)
IVSI=Wv/Wb×100%,
(6)
FCF=Wb/L3×100。
(7)
式中:Nt为每个网箱终末尾数;Ns为每个网箱初始尾数;Wt为终末体质量(g);Ws为初始体质量(g);Wf为摄入饲料量(g);Wh为鱼肝脏质量(g);Wv为鱼内脏质量(g);Wb为鱼体质量(g);L为鱼体长(cm);d为养殖时间(d)。
1.2.5 常规营养成分的测定 采用105 ℃烘箱干燥法、凯氏定氮法、氯仿甲醇法和550 ℃灼烧法分别测定饲料及全鱼水分、粗蛋白质、粗脂肪和粗灰分含量,常规营养成分含量以鲜质量计。
1.2.6 血清和肝脏生化指标的测定 肝脏样品的预处理:取肝脏组织,按照质量与体积比例1∶9加入生理盐水。在冰水浴的环境下,将其制备成10%的匀浆液。随后进行离心处理(2 500 r/min,10 min),取上清液以备后续测定。
血清与肝脏样本委托上海顺实科技有限公司检测,采用COD-PAP法、GPO-PAP法和考马斯亮蓝法分别测定总胆固醇含量、甘油三酯含量和蛋白浓度;采用比浊法、比色法和微量法分别测定溶菌酶、碱性磷酸酶和谷丙转氨酶活性;采用可见光分光光度法分别测定酸性磷酸酶、谷草转氨酶和过氧化氢酶活性;采用比色法、TBA法和黄嘌呤氧化酶法分别测定总抗氧化能力、丙二醛含量和超氧化物歧化酶活性。
1.2.7 肝脏组织切片的制作 肝脏组织经乙醇脱水、二甲苯透明和石蜡包埋后切片,再进行HE染色和封片处理。在光学显微镜下观察肝脏组织的形态并拍照。
1.3 数据分析
试验数据采用平均值±标准差(mean±S.D.)表示,采用SPSS 26.0统计软件进行单因素方差分析(one-way ANOVA),采用Duncan氏法进行组间差异显著性多重比较,显著性水平设为0.05。
2 结果与分析
2.1 饲料中添加黄芩后斑点叉尾鮰生长性能与形体指标的变化
从表3可见,黄芩添加量为5、10 g/kg时,终末体质量、增重率和特定生长率有升高趋势(P>0.05),10 g/kg黄芩组的饲料系数与对照组相比显著性降低(P<0.05)。黄芩添加量为15 g/kg时,饲料系数显著增加(P<0.05),斑点叉尾鮰终末体质量、增重率和特定生长率有下降趋势(P>0.05)。肥满度、肝体比和脏体比在各组间无显著性差异(P>0.05)。
表3 饲料中添加黄芩后斑点叉尾鮰生长性能与形体指标的变化
Tab.3 Effects of dietary Scutellariabaicalensis on growth performance and body parameters of Ictaluruspunctatus
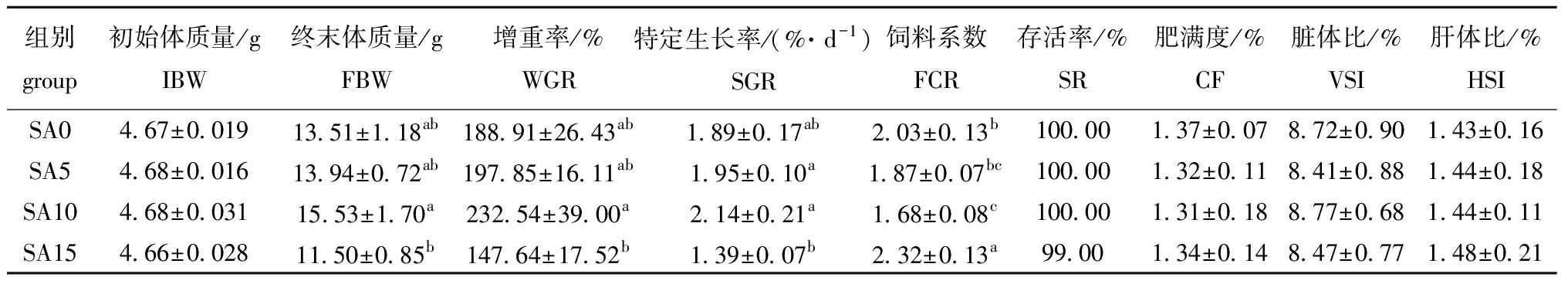
组别group初始体质量/gIBW终末体质量/gFBW增重率/%WGR特定生长率/(%·d-1)SGR饲料系数FCR存活率/%SR肥满度/%CF脏体比/%VSI肝体比/%HSISA04.67±0.01913.51±1.18ab188.91±26.43ab1.89±0.17ab2.03±0.13b100.001.37±0.078.72±0.901.43±0.16SA54.68±0.01613.94±0.72ab197.85±16.11ab1.95±0.10a1.87±0.07bc100.001.32±0.118.41±0.881.44±0.18SA104.68±0.03115.53±1.70a232.54±39.00a2.14±0.21a1.68±0.08c100.001.31±0.188.77±0.681.44±0.11SA154.66±0.02811.50±0.85b147.64±17.52b1.39±0.07b2.32±0.13a99.001.34±0.148.47±0.771.48±0.21
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
2.2 饲料中添加黄芩后斑点叉尾鮰血清生化指标的变化
从表4可见,饲料中添加5、10 g/kg黄芩显著降低了斑点叉尾鮰血清的ALT与AST活性及TCHO含量,提升了LZM与ACP活性(P<0.05)。此外,与对照组相比,10 g/kg黄芩组的TP含量显著提升,而5 g/kg黄芩组的TG含量显著降低(P<0.05),AKP活性在各组间无显著性差异(P>0.05)。
表4 饲料中添加黄芩后斑点叉尾鮰血清生化指标的变化
Tab.4 Effects of dietary Scutellariabaicalensis on serum biochemical indices of Ictaluruspunctatus
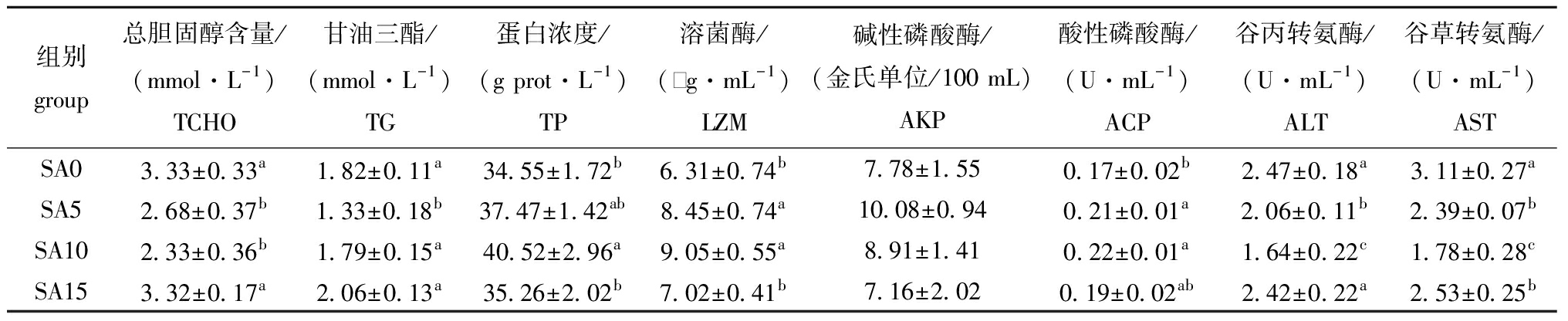
组别group总胆固醇含量/(mmol·L-1)TCHO甘油三酯/(mmol·L-1)TG蛋白浓度/(g prot·L-1)TP溶菌酶/(‰g·mL-1)LZM碱性磷酸酶/(金氏单位/100 mL)AKP酸性磷酸酶/(U·mL-1)ACP谷丙转氨酶/(U·mL-1)ALT谷草转氨酶/(U·mL-1)ASTSA03.33±0.33a1.82±0.11a34.55±1.72b6.31±0.74b7.78±1.550.17±0.02b2.47±0.18a3.11±0.27aSA52.68±0.37b1.33±0.18b37.47±1.42ab8.45±0.74a10.08±0.940.21±0.01a2.06±0.11b2.39±0.07bSA102.33±0.36b1.79±0.15a40.52±2.96a9.05±0.55a8.91±1.410.22±0.01a1.64±0.22c1.78±0.28cSA153.32±0.17a2.06±0.13a35.26±2.02b7.02±0.41b7.16±2.020.19±0.02ab2.42±0.22a2.53±0.25b
2.3 饲料中添加黄芩后斑点叉尾鮰肝脏抗氧化性能的变化
从表5可见,与对照组相比,黄芩添加量为5、10 g/kg时,斑点叉尾鮰肝脏T-AOC、CAT和SOD指标均显著提高,MDA含量显著降低(P<0.05)。
表5 饲料中添加黄芩后斑点叉尾鮰肝脏抗氧化性能的变化
Tab.5 Effects of dietary Scutellariabaicalensis on liver antioxidant indices of Ictaluruspunctatus
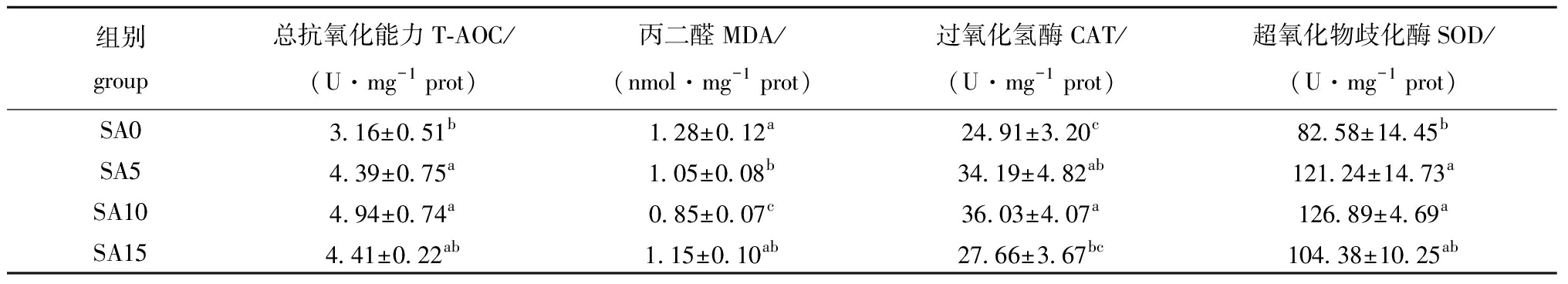
组别group总抗氧化能力T-AOC/(U·mg-1 prot)丙二醛MDA/(nmol·mg-1 prot)过氧化氢酶CAT/(U·mg-1 prot)超氧化物歧化酶SOD/(U·mg-1 prot)SA03.16±0.51b1.28±0.12a24.91±3.20c82.58±14.45bSA54.39±0.75a1.05±0.08b34.19±4.82ab121.24±14.73aSA104.94±0.74a0.85±0.07c36.03±4.07a126.89±4.69aSA154.41±0.22ab1.15±0.10ab27.66±3.67bc104.38±10.25ab
2.4 饲料中添加黄芩后斑点叉尾鮰肝脏组织形态的变化
从图1可见,对照组部分肝脏细胞核被脂滴推至细胞一侧,饲料中添加5、10 g/kg黄芩降低了肝脏的空泡率。

图1 斑点叉尾鮰肝脏组织切片
Fig.1 Histological sections of liver in Ictaluruspunctatus
2.5 饲料中添加黄芩后斑点叉尾鮰全鱼营养组成的变化
从表6可见,各组斑点叉尾鮰鱼体在粗蛋白质、粗脂肪、水分和粗灰分含量方面未表现出显著性差异(P>0.05)。
表6 饲料中添加黄芩后斑点叉尾鮰全鱼营养组成的变化
Tab.6 Effects of dietary Scutellariabaicalensis on body nutritional composition of Ictaluruspunctatus %
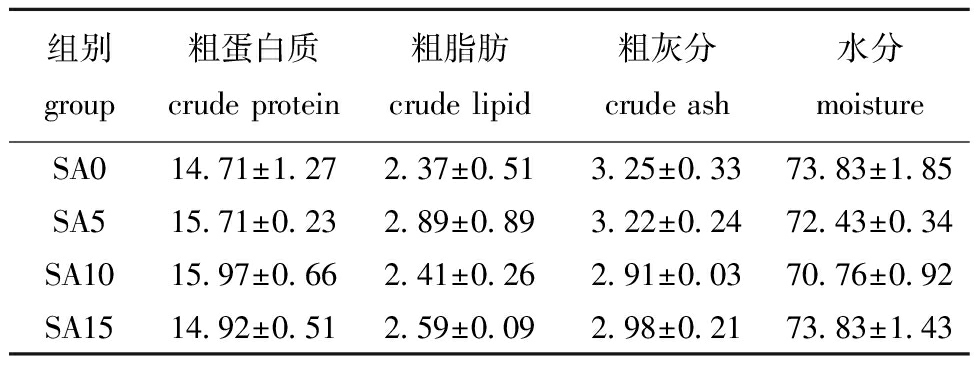
组别group粗蛋白质crude protein粗脂肪crude lipid粗灰分crude ash水分moistureSA014.71±1.272.37±0.513.25±0.3373.83±1.85SA515.71±0.232.89±0.893.22±0.2472.43±0.34SA1015.97±0.662.41±0.262.91±0.0370.76±0.92SA1514.92±0.512.59±0.092.98±0.2173.83±1.43
3 讨论
3.1 饲料中添加黄芩对斑点叉尾鮰生长性能的影响
黄芩具有提高水产动物生长性能的作用。Cho等[7]发现,在饲粮中添加2%的黄芩提取物可显著提高牙鲆的特定生长率,刘红柏等[8]在饲料中添加10 g/kg黄芩提高了10%的鲤增重率。Xia等[9]报道,饲料中添加1%、2%和3%浓度的黄芩地上部分提取物均可提高珍珠龙胆石斑鱼的生长性能,其原因可能是提高了石斑鱼体内生长激素受体和胰岛素样生长因子Ⅰ和Ⅱ基因的表达及肠道消化酶的活性。在褐篮子鱼[10]和凡纳滨对虾[11]研究中,饲料中添加1%的黄芩均显著提高了其生产性能。此外,季延滨等[15]发现,黄芩对牙鲆具有一定诱食活性。本研究中,饲料中黄芩添加量为10 g/kg时,显著降低了斑点叉尾鮰的饲料系数,并有提高增重率的趋势,与上述报道结果一致。
Dandi等[16]认为,当饲料中苦味添加剂含量过高时会降低饲料适口性进而影响鱼类生长。Skibola等[17]研究表明,过量的黄酮类物质会因促进机体内氧化还原反应的进行而产生大量的自由基与羟基,对机体产生损害。曹福余[18]在饲料中添加200 mg/kg黄芩素,可导致鲤增重率降低,饲料系数提高。由于黄芩味苦,其主要活性物质为以黄芩素为主的黄酮类物质,故黄芩添加过量会对生长产生抑制作用,这可能是本研究中黄芩添加量达到15 g/kg时,斑点叉尾鮰生长性能下降的重要原因。
3.2 饲料中添加黄芩对斑点叉尾鮰非特异性免疫能力与抗氧化能力的影响
鱼类机体的非特异性免疫力和抗氧化能力可以直接影响鱼类的抗病力。LZM是鱼类重要的非特异性免疫因子,通过溶解细菌细胞壁来杀菌。AKP与ACP可通过将病原体表面分子去磷酸化从而增强机体对病原体的识别与吞噬。CAT与SOD均可去除机体中的过氧化物与自由基,是机体抗氧化的主要活性物质[19]。MDA是体内脂质过氧化反应终产物,其水平通常反映了脂质过氧化和细胞膜脂受氧化损伤的强度,可以用来评估生物体内的过氧化程度[20]。本试验中通过测定肝脏和血清的上述指标评判饲料中添加黄芩对斑点叉尾鮰的非特异性免疫能力与抗氧化能力的影响。
Yin等[6]的研究表明,黄芩可以通过提升罗非鱼体内的吞噬细胞活力与溶菌酶活性进而提升其非特异性免疫能力。在珍珠龙胆石斑鱼的饲料中添加黄芩可以提升肝脏和头肾的CAT和LZM活性[9]。在罗非鱼的饲料中添加10 g/kg的黄芩可以提升其SOD、LZM和ACP的活性及血白细胞氧呼吸爆发活性[21]。本研究中,黄芩添加量为5、10 g/kg时,对斑点叉尾鮰非特异性免疫能力和肝脏抗氧化能力也有显著的提升作用,其原因与黄芩中含有的黄芩多糖和黄酮类物质有关,这些活性物质已被证明具有抗氧化、抗菌和提升非特异性免疫力等功能[22-23]。已有研究表明,在饲料中添加黄芩素(黄芩中一种黄酮类物质)可以提升草鱼血清SOD与CAT活性,降低MDA含量[24]。以添加黄芩苷(黄芩中一种黄酮类物质)的饲料饲喂罗非鱼,可以提升肝脏SOD的活性与T-AOC和GSH的活力[25]。饲料中添加黄芩多糖可以提升鲫血清中ALP和CAT的活性,降低MDA含量[26]。
3.3 饲料中添加黄芩对斑点叉尾鮰肝脏健康的影响
AST和ALT作为参与氨基酸代谢的关键转氨酶,主要在肝细胞内表达,是衡量肝脏健康状态的重要指标,肝脏的空泡化是肝脏脂肪过量化沉积的结果,会严重影响肝脏的功能[27]。
喻运珍等[28]发现,黄芩苷可以降低草鱼血清中ALT与AST活性。在饲料中添加黄芩素可以显著减轻农药毒死蜱对鲤肝脏组织结构的损伤[29]。此外,黄芩苷能减轻对乙酰氨基酚诱导的小鼠肝损伤,促进肝细胞的增殖,增加小鼠肝脏肝细胞生长因子(hepatocyte growth factor,HGF)、表皮生长因子(epidermal Growth Factor,EGF)和细胞周期蛋白D1(Cyclin D1)的表达,从而加快肝脏的修复[30]。本研究中,黄芩添加量为5、10 g/kg时,血清ALT与AST水平降低,肝脏切片中的空泡化程度减轻,表明黄芩对斑点叉尾鮰肝脏具有一定的保护作用。
4 结论
1)在饲料中添加黄芩后,一定程度上可提高斑点叉尾鮰的增重率和特定生长率,但能显著降低其饲料系数。说明黄芩有利于斑点叉尾鮰生长。
2)在饲料中添加黄芩能显著提高斑点叉尾鮰的血清LZM、ACP和TP水平及降低血清TCHO、ALT和AST水平。表明黄芩可提升斑点叉尾鮰的非特异性免疫能力。
3)在饲料中添加黄芩能显著提高斑点叉尾鮰肝脏的T-AOC、CAT和SOD水平,降低肝脏MDA的水平和肝脏空泡化率。表明黄芩可改善斑点叉尾鮰的肝脏抗氧化能力。
4)在饲料中添加黄芩能降低斑点叉尾鮰的肝脏空泡化率与血清ALT和AST的水平。表明黄芩可改善斑点叉尾鮰的肝脏健康。
5)本试验条件下,斑点叉尾鮰饲料中黄芩的适宜添加量为10 g/kg。
[1] 王孟华,曲玮,梁敬钰.黄芩的研究进展[J].海峡药学,2013,25(9):6-13.WANG M H,QU W,LIANG J Y.Advances in studies of Scutellaria baicalensis Georgi[J].Strait Pharmaceutical Journal,2013,25(9):6-13.(in Chinese)
[2] 刘晓龙,李春燕,陈奇剑,等.黄芩主要活性成分和药理作用研究进展[J].新乡医学院学报,2023,40(10):979-985,990.LIU X L,LI C Y,CHEN Q J,et al.Research progress on the main active ingredients and pharmacological effects of Scutellariae radix[J].Journal of Xinxiang Medical University,2023,40(10):979-985,990.(in Chinese)
[3] LIU W C,PI S H,KIM I H.Effects of Scutellaria baicalensis and Lonicera japonica extract mixture supplementation on growth performance,nutrient digestibility,blood profiles and meat quality in finishing pigs[J].Italian Journal of Animal Science,2016,15(3):446-452.
[4] 马得莹,单安山,李群道.中草药添加剂对蛋雏鸡生长性能和免疫功能的影响[J].动物营养学报,2004,16(2):36-40.MA D Y,SHAN A S,LI Q D.Effects of Chinese medical herbs onchickens growth and immunization[J].Acta Zoonutrimenta Sinica,2004,16(2):36-40.(in Chinese)
[5] 田慧丽,张菊,李义,等.黄芩提取物对肉鸭生长性能、屠宰性能和免疫器官指数的影响[J].家禽科学,2023,45(6):37-42.TIAN H L,ZHANG J,LI Y,et al.Effects of Scutellaria baicalensis extract on growth performance,slaughter performance and immune organ indexes in meat-type ducks[J].China Poultry Science,2023,45(6):37-42.(in Chinese)
[6] YIN G J,JENEY G,RACZ T,et al.Effect of two Chinese herbs (Astragalus radix and Scutellaria radix) on non-specific immune response of tilapia,Oreochromis niloticus[J].Aquaculture,2006,253(1/2/3/4):39-47.
[7] CHO S H,JEON G H,KIM H S,et al.Effects of dietary Scutellaria baicalensis extract on growth,feed utilization and challenge test of olive flounder (Paralichthys olivaceus)[J].Asian-Australasian Journal of Animal Sciences,2013,26(1):90-96.
[8] 刘红柏,张颖,杨雨辉,等.5种中草药作为饲料添加剂对鲤肠内细菌及生长的影响[J].大连水产学院学报,2004,19(1):16-20.LIU H B,ZHANG Y,YANG Y H,et al.Effects of five Chinese herb medicines as additive in feed on the growth and intestinal microflora in common carp (Cyprinus carpio)[J].Journal of Dalian Fisheries College,2004,19(1):16-20.(in Chinese)
[9] XIA Y T,WU Q Y,CHENG E H C,et al.The inclusion of extract from aerial part of Scutellaria baicalensis in feeding of pearl gentian grouper (Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂) promotes growth and immunity[J].Fish &Shellfish Immunology,2022,127:521-529.
[10] XIA Y T,CHENG E H C,WANG H Y,et al.The extract from aerial part of Scutellaria baicalensis regulates gut microbiota in rabbit fish:replacement of antibiotic fighting against pathogenic bacteria[J].Aquaculture,2023,565:739140.
[11] MAURUS G,HO T H,LEE P T.Effects of dietary Scutellaria baicalensis extract on growth performance,immune-related genes expression,and resistance against Vibrio parahaemolyticus in white shrimp (Litopenaeus vannamei)[J].Research in Veterinary Science,2023,159:160-170.
[12] 麻艳群,董升辉,司楠,等.黄芪对斑点叉尾鮰生长和肌肉成分的影响[J].饲料研究,2022,45(8):54-56.MA Y Q,DONG S H,SI N,et al.Effect of Astragalus on growth performance and muscle components of Ictalurus punctatus[J].Feed Research,2022,45(8):54-56.(in Chinese)
[13] ZHANG F L,HAO Q,ZHANG Q S,et al.Influences of dietary Eucommia ulmoides leaf extract on the hepatic lipid metabolism,inflammation response,intestinal antioxidant capacity,intestinal microbiota,and disease resistance of the channel catfish (Ictalurus punctatus)[J].Fish &Shellfish Immunology,2022,123:75-84.
[14] ZHENG Z L,TAN J Y W,LIU H Y,et al.Evaluation of Oregano essential oil (Origanum heracleoticum L.) on growth,antioxidant effect and resistance against Aeromonas hydrophila in channel catfish (Ictalurus punctatus)[J].Aquaculture,2009,292(3/4):214-218.
[15] 季延滨,孙学亮,邢克智,等.12种中草药对牙鲆幼鱼的诱食效果的研究[J].中国水产,2012(5):62-65.JI Y B,SUN X L,XING K Z,et al.Study on the attractive effect of 12 Chinese herbal medicines on juvenile Paralichthys olivaceus[J].China Fisheries,2012(5):62-65.(in Chinese)
[16] DANDI S O,ABARIKE E D,AMPOFO-YEBOAH A.Bitter leaf Vernonia amygdalina extract enhances growth,hematology,heat stress response,and resistance to Aeromonas hydrophila in Nile tilapia[J].North American Journal of Aquaculture,2022,84(4):432-441.
[17] SKIBOLA C F,SMITH M T.Potential health impacts of excessive flavonoid intake[J].Free Radical Biology &Medicine,2000,29(3/4):375-383.
[18] 曹福余.黄芩素对鲤健康状况的影响研究[D].杨凌:西北农林科技大学,2009.CAO F Y.Effects of bacailein on the health condition in Cyprinus carpio[D].Yangling:Northwest A &F University,2009.(in Chinese)
[19] SIM Y J,CHO S H,KIM K W,et al.Effect of substituting fish meal with various by-product meals of swine-origin in diet on olive flounder (Paralichthys olivaceus)[J].Aquaculture Reports,2023,33:101844.
[20] GAWE S,WARDAS M,NIEDWOROK E,et al.Malondialdehyde (MDA) as a lipid peroxidation marker[J].Wiadomosci Lekarskie,2004,57(9/10):453-455.
S,WARDAS M,NIEDWOROK E,et al.Malondialdehyde (MDA) as a lipid peroxidation marker[J].Wiadomosci Lekarskie,2004,57(9/10):453-455.
[21] DING Z H,HONG J M,GUO W L,et al.The screen herbal immunopotentiator and research on its effect on the innate immune system and disease resistance of Nile tilapia (Oreochromis niloticus) against Streptococcus agalactiae[J].Aquaculture,2021,541:736778.
[22] DU Y B,HAN Y,ZHANG R,et al.Dietary baicalein improves growth performance,antioxidant activity,and intestinal flora of koi carp (Cyprinus carpio)[J].Aquaculture Reports,2022,27:101421.
[23] 李倩,王双星,苟潇.黄芩多糖的功能性研究及其在动物生产中的应用进展[J].饲料研究,2023,46(14):180-184.LI Q,WANG S X,GOU X.Functional studies on polysaccharide of Scutellaria baicalensis and its application in animal production[J].Feed Research,2023,46(14):180-184.(in Chinese)
[24] 徐禛,杨航,梁高杨,等.黄芩素对草鱼生长性能、血清抗氧化指标和肌肉品质的影响[J].水产学报,2019,43(11):2383-2393.XU Z,YANG H,LIANG G Y,et al.Effects of dietary baicalein on growth,serum anti-oxidation indicators and flesh quality of Ctenopharyngodon idella[J].Journal of Fisheries of China,2019,43(11):2383-2393.(in Chinese)
[25] 李尧.黄芩苷对氧化应激诱导罗非鱼肝损伤的保护作用[D].南京:南京农业大学,2019.LI Y.Protective effects of baicalin on oxidative stress-induced liver injury in tilapia(Oreochromis niloticus)[D].Nanjing:Nanjing Agricultural University,2019.(in Chinese)
[26] SEMRI M.黄芩多糖对鲫鱼感染嗜水气单胞菌的防治效果研究[D].南京:南京农业大学,2021.SEMRI M.Study on the prevention and control effect of Scutellaria polysaccharide on Aeromonas hydrophila infection of crucian carp [D].Nanjing:Nanjing Agricultural University,2021.(in Chinese)
[27] 王梦华,李国立,黄文庆,等.饲料中添加复合植物提取物对大口黑鲈生长性能、血清生化指标和肝脏、肠道健康的影响[J].水产学报,2022,46(10):1892-1901.WANG M H,LI G L,HUANG W Q,et al.Effects of plant extract compound on growth performance,serum biochemical indices,liver and intestinal health of largemouth bass(Micropterus salmoides)[J].Journal of Fisheries of China,2022,46(10):1892-1901.(in Chinese)
[28] 喻运珍,王小玲.黄芩甙对草鱼肝功能及免疫机能的影响[J].水利渔业,2006,27(3):97-98.YU Y Z,WANG X L.Effects of baicalin on liver function and immune function of grass carp[J].Reservoir Fisheries,2006,27(3):97-98.(in Chinese)
[29] LIU J,ZHANG W Y,LI X J,et al.New insights into baicalein’s effect on chlorpyrifos-induced liver injury in carp:involving macrophage polarization and pyroptosis[J].Journal of Agricultural and Food Chemistry,2023,71(9):4132-4143.
[30] 张娟.黄芩苷激活m-TOR信号通路促进对乙酰氨基酚肝损伤的修复[D].宜春:宜春学院,2023.ZHANG J.Baicalin activates m-TOR signaling pathway to promote the repair of acetaminophen liver injury [D].Yichun:Yichun University,2023.(in Chinese)