贝类是中国水产养殖业的重要组成之一,自1993年以来,其养殖产量占全国海水养殖总产量的比重始终大于50%,且呈逐年递增态势[1]。据《中国渔业统计年鉴》,2023年中国海水贝类产量为1 713.90万t,较2022年1 638.02万t同比增长4.63%,占全国水产品总产量的24%[2-3]。此外,双壳贝类的养殖,既减少了有机碳在营养级间的传递,延缓了碳的周转率,又增加了碳的封存量,因此成为一种相对碳汇过程,其生态系统服务价值已得到了广泛认可[4-6]。在全球气候变化和人类活动对环境影响日益加剧情况下,贝类资源养护与可持续发展高度契合水产养殖绿色高质量发展的内涵与方向[7]。
生物种群动态、生长情况及年龄组成是渔业管理中必不可少的数据。特别是高准确率的种群年龄组成,是研究生物生活史、生长情况和资源管理的基础。如了解生物的性成熟年龄有助于进行人工育种,而明确上市年龄便于制定捕捞和售卖计划。多数贝类的寿命在1年以上,少数如鹦鹉螺(Nautilus spp)[8]、砗磲(Tridacnidae spp)等贝类的寿命可达数十年。某些贝类在漫长的生命史中记录了周围环境变化情况并反映在壳微观结构上,其中,分布广泛且寿命长达数百年的北极蛤(Arctica islandica)更是有着环境档案的美称[9]。了解长寿贝类的准确年龄对于破译过往年代的气候变化,开展跨年代研究具有重要作用。
目前,国内对鱼类的年龄鉴定研究报道颇多[10-11],而有关贝类的相关报道较少且选择鉴定方法单一[12-13],这对贝类的年龄鉴定、加工与养殖、人工繁育与资源保护都产生了一定的影响。本文综合国内外相关研究成果,总结了几种常用的贝类年龄鉴定方法,旨在为贝类资源评估和渔业资源管理提供科学依据。
1 贝类年龄鉴定技术发展历程
贝类的壳是贝类重要的矿化部位,其形态多样,是贝类分类的主要依据之一。贝壳由内外棱柱层和中间颗粒层组成,其中含有文石晶体和无定形碳酸钙[14]。许多学者认为,贝壳结构能够记录贝类生长过程中的环境和生理变化,这种变化通常以贝壳外、内部生长线和生长增量等形式体现[15-16],也是当前贝类年龄鉴定的主要依据所在。此外,腹足类和头足类还可利用厣和内骨骼鉴定动物年龄[17]。基于以上材料开发应用的年龄鉴定方法主要有生长线计数法、贝壳切片法、染色法、醋酸酯剥离复制法等。
目前,国外对于贝类的年龄鉴定已有许多报道,鉴定方法也逐渐完善(图1)。在相关的研究中,1912年,Lefevre[18]率先采用贝壳表面生长线法估算贝类的年龄,这种直观的方法也一直沿用至今[19]。但随着贝类年龄增加,生长速度逐渐减慢,贝壳表面生长线间距逐渐缩小,在一些高龄贝类的贝壳表面,生长线出现积叠现象,给计数统计带来困难,进而导致判读结果的准确性受限。因此,国内外许多研究者开始通过贝类生长性状或贝壳内部的生长线来鉴定年龄,以使统计结果更加精确。20世纪40—50年代,Harding[20]和Cassie[21]分别引入和改进了生长性状频率分布法在贝类中的应用;1964年,Barker[22]首先通过切片法观察贝壳微结构,在贝类年龄鉴定方法上取得了新的进展,该方法一直沿用至今,如凌高等[12]和龚世园等[13]通过贝壳切片法分别鉴定了背瘤丽蚌(Lamprotula leai)与绢丝丽蚌(Lamprotula fibrosa)的年龄;20世纪60年代末,为了更清晰地对贝壳上的生长线进行观察,House等[23]和Rhoads等[24]将醋酸酯剥离复制法用于贝壳切片的再处理;1980年,Kristensen[25]利用头足类耳石上的生长线鉴定了黵乌贼(Gonatus fabricii)的准确年龄,Bell[26]紧随其后,通过腹足类幼贝耳石鉴定其年龄;1987年,Margosian等[27]将同位素法用于偏顶蛤(Modiolus modiolus)年龄鉴定;1998年,Checa等[28]提出腹足类厣部周期性形成的纹路可用于年龄鉴定;2008年,Masu等[29]改进醋酸酯剥离复制法使其适用于小型贝类;2014年,Sugiura等[30]用染色法鉴定出魁蚶(Scapharca broughtonii)的准确年龄。目前已有多种贝类年龄鉴定方法,技术特点各有不同,适用范围也有所差异,故当前还缺少一种普适且精准的方法以降低年龄鉴定时的操作难度。
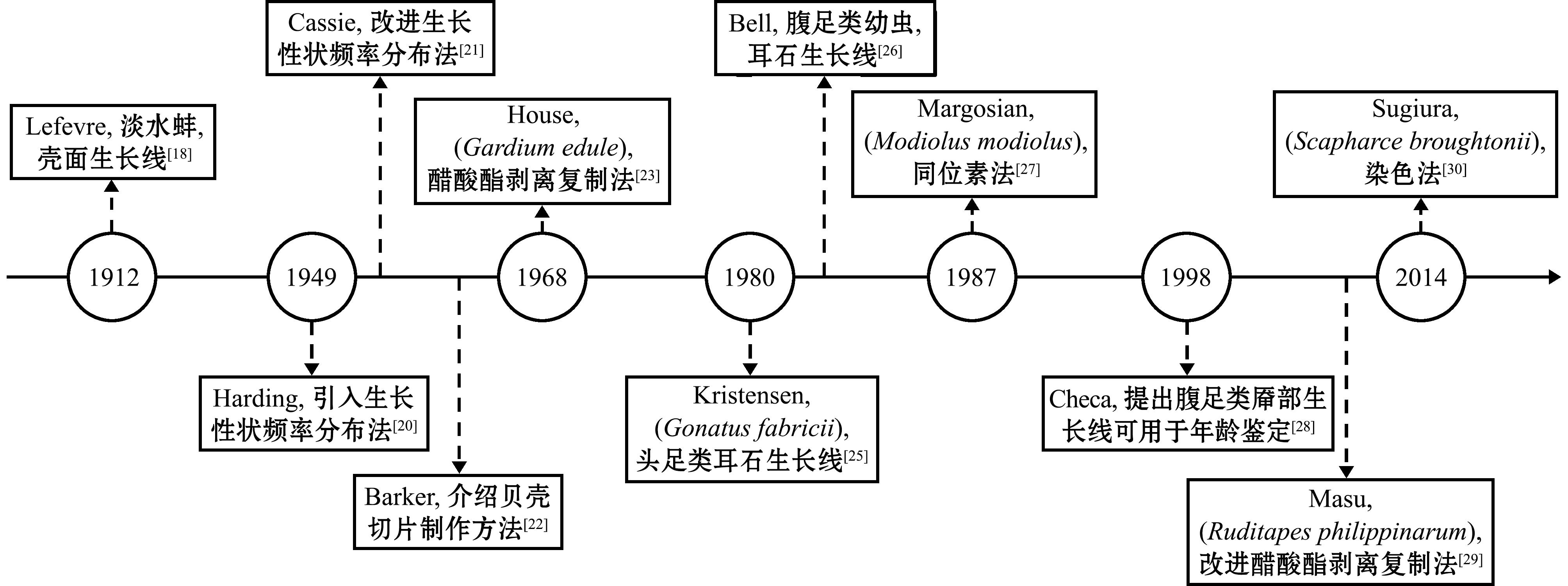
图1 贝类年龄鉴定技术发展关键历程
Fig.1 Key development process of age determination technology in shellfish
2 贝类年龄鉴定一般技术原理
生长线是多种贝类年龄鉴定技术的重要依据,在一些贝类的钙化结构(如贝壳、耳石、厣等)上会周期性形成生长纹路,而相邻两条生长线间的距离即为该周期内贝类的生长增量[19]。根据形成周期不同,生长线可大致分为两类:一是微生长线,不同贝类的微生长线形成周期存在差异,但一般较短,可反映贝类的日龄。贝类的微生长线一般纵向贯穿整个壳结构,在贝壳表面和横截面上均能观察到(图2);二是生长环,一般形成周期为1年,在珍珠扇贝(Cyprogenia stegaria)和厚实珍珠贝(Lexingtonia dolabelloides)中均有发现[31],不同贝类中生长环的形成原因可能不同,如菲律宾蛤仔(Ruditapes philippinarum)的生长环是由微生长线积叠形成的独特半透明区域,在壳面的外在表现为凹陷(图3)[32]。微生长线和生长环等贝壳微结构是评估贝类年龄的主要依据,但在部分贝类生长过程中因温度、食物和繁殖等因素影响,会产生与生长线类似的伪环。目前,常用的年龄鉴定技术会通过不同处理策略排除其他因素的干扰,从而更清晰、准确地对生长线进行观察和统计。
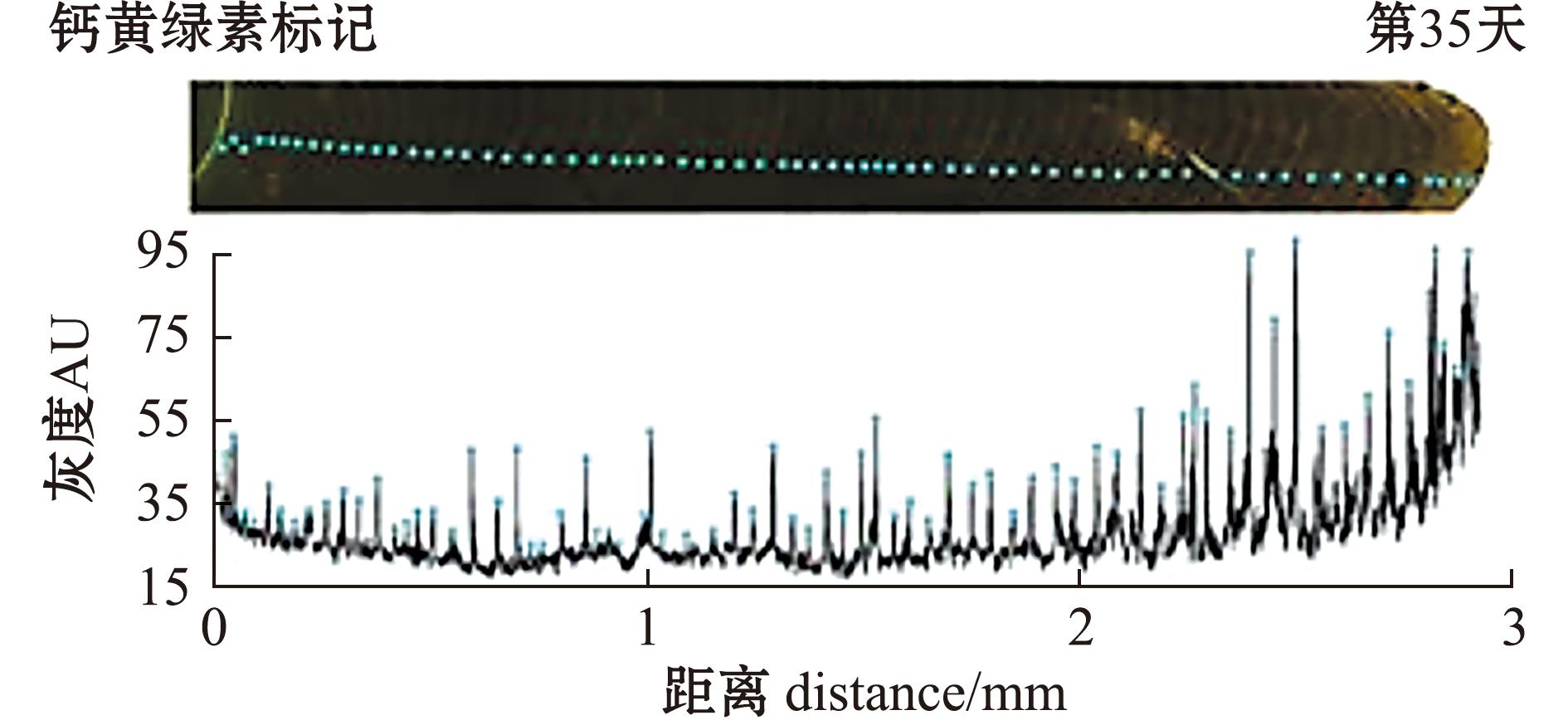
根据钙黄绿素荧光标记位置,沿着生长轴统计了35 d内生长线形成数量,测量灰度水平(AU),并确定了每个灰色峰(蓝色圆圈)作为两条相邻生长线间的距离,反映了每一个生长增量。
According to the position of calcein fluorescent labeling,the number of growth lines formed within 35 days is counted along the growth axis,the gray level (AU) is measured,and each gray peak (blue circle) is determined as the distance between two adjacent growth lines,reflecting each growth increment.
图2 菲律宾蛤仔贝壳局部放大[19]
Fig.2 Local enlargement of Ruditapes philippinarum shell[19]

显示外层半透明区(箭头)和不透明区交替,每个半透明区域的外端被定义为生长环。
The outer translucent area (arrow) and the opaque area are alternately displayed,and the outer end of each translucent area is defined as a growth ring.
图3 菲律宾蛤仔左壳横截面[32]
Fig.3 Cross section of left shell of Ruditapes philippinarum[32]
3 典型贝类年龄鉴定方法
3.1 生长线直接计数法
3.1.1 壳面生长线 该方法就是通过肉眼或显微镜观察,对贝壳表面的微生长线进行计数(图4),且需要多人多次计数后取平均值,确保结果的准确性。计数过程中的观察方法有很多,如可用砂纸打磨贝壳外表面,将角质层打磨掉,露出棱柱层或珍珠层,然后计数棱柱层或珍珠层上生长轮线;还可将贝壳放置于透射光下,观察交替呈现的暗带和亮带来鉴定年龄[33]。此方法最典型的应用为头足纲的鹦鹉螺(Nautiloidea pomprlius),鹦鹉螺贝壳外部在生长过程中形成了红褐色火焰条状的螺纹,这些螺纹之间有许多宽窄不一的“隔”,每个“隔”上都存在波状生长线[8,34],经过观测,鹦鹉螺的生长线每两天增加一次,其宽度则是每日生长速率的两倍[35]。

每个黑点表示一条壳面生长线。
Each black spot represents a shell growth line.
图4 23日龄的海扇贝幼虫壳面生长线[36]
Fig.4 Shell growth line of 23-day-old Placopecten magellanicus larvae[36]
该方法操作简单,无须复杂处理过程,但某些贝类因自身壳色较暗或微生长线在生长过程中受到环境等因素影响,微生长线模糊或中断,难以直接识别,可能会对其数量判读造成一定程度误差。
3.1.2 厣生长线 多数腹足类在内唇处具有钙质或有机质的厣,能够保护壳内柔软的身体组织,厣上有同心圆或螺旋状的纹路,这些纹路在某些腹足类可用于鉴定年龄[34]。在新腹足目中,同心圆式纹路已被证明包含两组生长线,其腹侧和背侧表面均为生长线[28]。背表面生长线是随动物的生长,在厣边缘逐渐形成的有机物质层,已用于沟槽美洲香螺(Busycotypus canaliculatus)[37]和北蛾螺(Buccinum undatum)[38]等经济贝类的年龄鉴定。腹面生长线也被应用于姬虾夷法螺(Neptunea arthritica)[39]和娥螺(Buccianops globulosus)[40](图5)等多种腹足类年龄鉴定。需要注意的是,根据厣部生长线鉴定结果进行判定可能存在较大误差[37],Vasconcelos等[41]分别使用根干骨螺(Hexaplex trunculus)厣的背部生长线和腹生长线进行年龄鉴定,发现两者的结果有较大差异,因此计算厣上的生长线时只能粗略地估计年龄。

图5 娥螺厣的腹面生长线[34]
Fig.5 Ventral growth line of Busycotypus globulosus operculum[34]
3.1.3 耳石生长线 耳石是在腹足类神经系统内发现的成对碳酸钙小球(<0.5 mm),一般呈半透明状,其表面有突出的生长线,属于感觉器官,可辅助保持平衡[34,37](图6(a)、(b))。Fisher等[37]比较了沟槽美洲香螺厣和耳石两种年龄鉴定方法,发现耳石上具有清晰的生长线,其结果也更加准确。耳石已被证实在腹足类浮游幼虫阶段便存在,跟随记录了贝类的个体发育过程,其上生长线具有年周期性,可用于腹足类的年龄鉴定[42]。目前已在沟槽美洲香螺[37]、玉螺(Polinices pulchellus)[43]等多种贝类中得到应用。
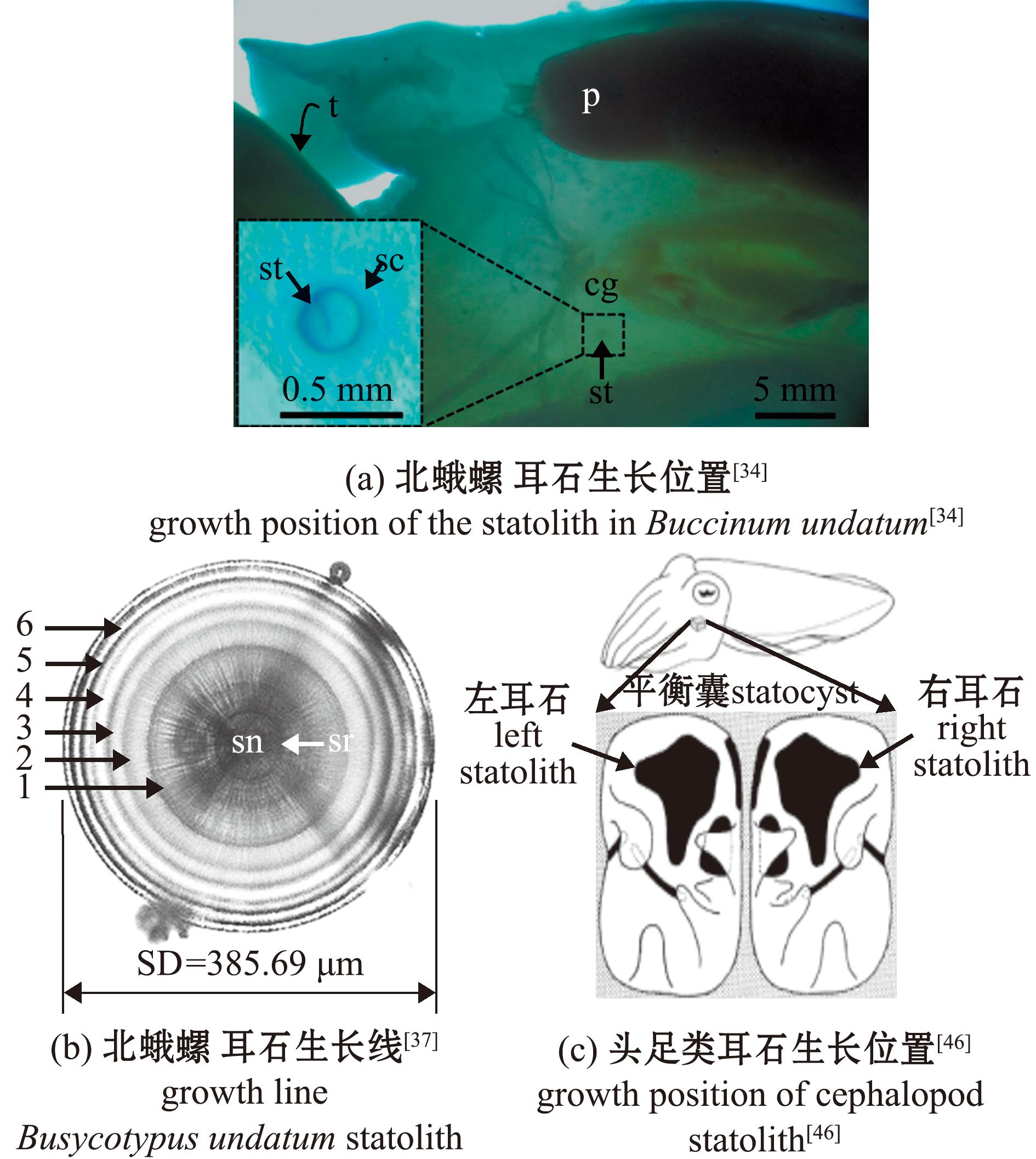
cg—脑神经节;p—吻;st—耳石;sc—平衡囊。
cg,cerebral ganglion;p,proboscis;st,statolith;sc,statocyst.
图6 耳石生长位置及生长线
Fig.6 Growth location and growth lines of statoliths
在头足类中,耳石是位于平衡囊中发挥平衡和加速度感应作用的一对硬组织[44](图6(c)),目前,基于耳石表面生长线的年龄鉴定方法是头足类中最常用的方法之一[45],与腹足类耳石不同的是,一般认为,头足类耳石上的生长线形成具有日周期性[46]。早在1997年,Arkhipkin[47]就利用显微镜统计耳石生长线数量鉴定了不同规格芽翼鱿(Pterygioteuthis gemmata)的年龄。
3.1.4 角质颚与内壳生长线 在头足类中,除了耳石生长线外,还可通过角质颚或内壳上的生长线进行年龄鉴定[45]。角质颚存在于现存所有头足类中,早在1965年,便有学者发现角质颚上存在周期性生长增量[48],随后其被用于头足类的年龄估计。众多研究表明,角质颚上生长线的形成具有日周期性[49],对于角质颚生长线的观察多数是通过制作切片进行的,而通过直接观察生长线鉴定年龄的方法只适用于处于生长早期或角质颚半透明的头足类[50]。该方法目前已用于真蛸(Octopus vulgaris)[51-52]年龄鉴定。
头足类的内壳分为内层、中间层和外层3个部分,虽然3层均能反映年龄和生长信息,但不同种类可用于评估年龄的壳层有所不同[45,50]。在多数情况下,中间层的生长增量更宽更清晰,因此,直接计数法所用部位也大多为中间层,其余两层一般通过切片观察[50]。
3.2 硬组织切片法
3.2.1 切片观察法 切片观察法是目前最为常用的贝类年龄鉴定方法,其适用于绝大多数贝类[53-54]。图7为贝类切割示意图。在相关贝类切片研究过程中,双壳类及腹足类贝壳切片的制作主要涉及5个步骤:(1)贝壳洗净烘干后采用1%稀次氯酸钠去除表膜;(2)采用环氧树脂包裹固定,借助环氧树脂胶固化后抗剪和抗压等特性来保护贝壳;(3)利用低速切割机沿贝类最大生长轴(即壳顶到壳生长边缘的最长距离)垂直切割,使切痕与生长线垂直;(4)将切割好的贝壳切面朝向载玻片并用热塑性树脂固定在载玻片上,以便后续操作和观察;(5)使用不同目数的砂纸对贝壳连续抛光,最后成品应为190~400 μm的薄片[19,55]。将贝壳切片置于显微镜下观察,切片的每条生长线与角质层都有一个交点。该方法已广泛用于双壳贝类的年龄鉴定,如Loria[56]使用钙黄绿素浸泡标记研究海扇贝微生长线的形成周期,通过贝壳切片比较标记前后微生长线数量变化,发现其形成周期为1条/d;Sugiura[31]采用该方法验证了菲律宾蛤仔的内部生长环形成周期为1年,夏季开始发育,夏末或冬季完成发育;在其之后,Mahé[19]采用同样的方法发现菲律宾蛤仔贝壳表面微生长形成周期为2条/d,表明这两种方法联用可评估菲律宾蛤仔的准确年龄。Ambrose等[57]在帽贝(Patella vulgata)的贝壳中发现了每年沉积的生长环,并证实了贝壳珍珠层中可见线条的年生长周期性。除此之外,这种方法在鸟蛤(Cerastoderma edule)[55]、近江牡蛎(Crassostrea ariakensis)[58]等贝类中均有应用。对于头足类耳石,其外部形态(蛸类除外)通常由背区、侧区、吻区和翼区4个主要部分组成[46],不同气候年间、不同种类、不同性别的耳石的形态表征参数通常具有明显差异。因此,耳石切片与上述贝壳切片制作流程的不同之处在于研磨平面选择。打磨平面的选择与头足类品种有关,在耳石吻区和背区生长线清晰的种类应从翼区、侧区分别向右、向左打磨至核心,如鱼钩乌贼(Ancistrocheirus lesueurii)[59];而耳石侧区清晰的种类应由背区、吻区分别向背面、腹面打磨至核心,如好望角枪乌贼(Loligo reynaudi)[60];当处于耳石前后表面平滑的幼体时期应由前后打磨至核心。
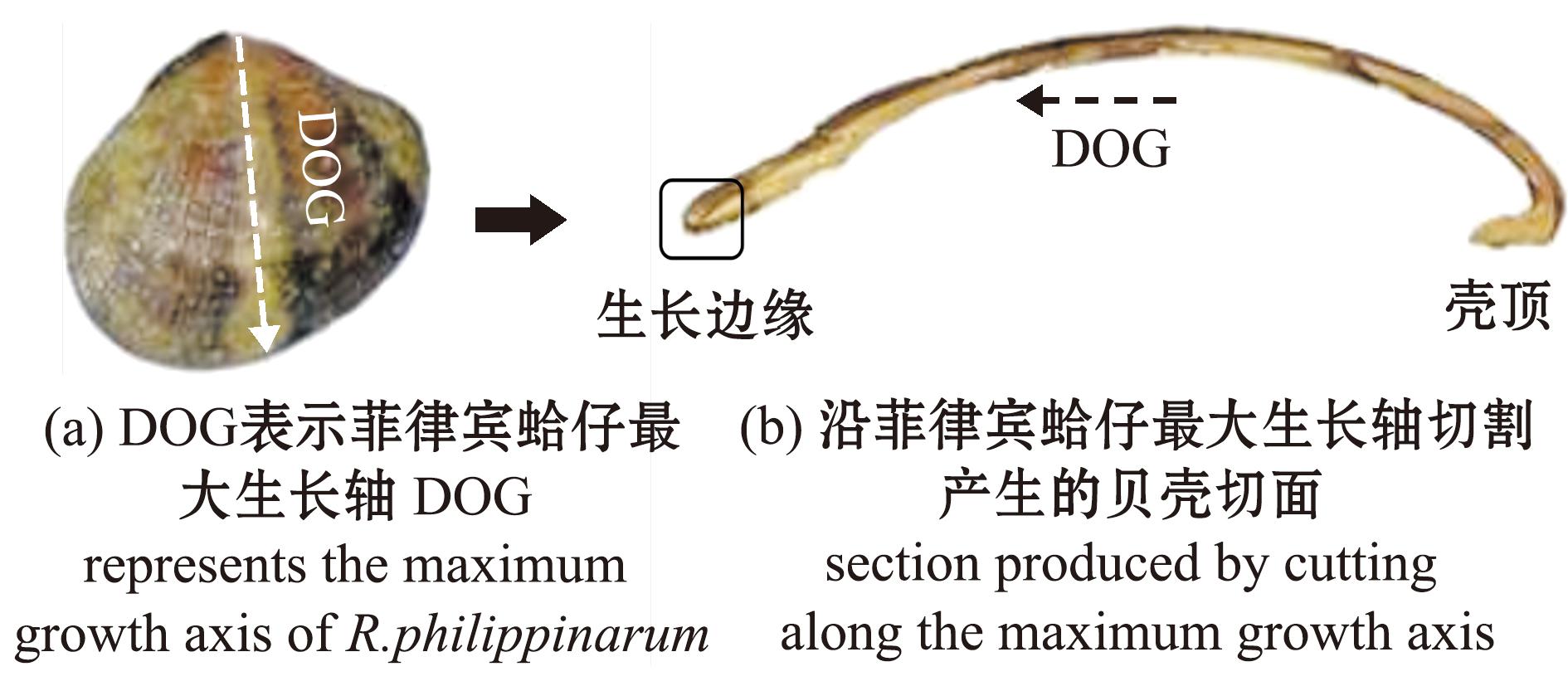
图7 菲律宾蛤仔贝壳切割示意图[19]
Fig.7 Shell cutting schematic diagram of shells in Ruditapes philippinarum[19]
在各种贝类年龄鉴定方法中,切片观察法操作复杂且难度较高,需要专门的训练才能获得可比较和可重复的结果。但贝壳内部的生长线相较易磨损的外部生长线更加完备和清晰,便于统计的同时,可以真实的反映贝类年龄。
3.2.2 染色观察法 染色观察法是使用染剂对贝壳进行染色,以突出显示生长线,便于计数和统计。Sugiura[30]为了更简单可靠地检测魁蚶的年龄,在贝壳切片基础上,使用红色水基标记笔涂抹切片横截面部分,之后立即用自来水冲洗并用纸巾擦拭,以去除多余墨水,最后在光源下观察用水性墨水染色的壳体横截面,根据其染色程度检测生长轮纹并进行年龄鉴定。结果显示,当在反射光下观察时,不透明区域与半透明区域(即生长线)具有清晰的差异,不透明区域被染色,而生长线未被染色(图8)。Burgess等[61]比较了贝壳切片和直接使用钙黄绿素对扇贝(Pecten novaezelandiae)整个贝壳染色后生长线的显示效果,认为在该扇贝中钙黄绿素染色效果更直观,便于统计。而Miranda等[39]用250 mg/L四环素对香螺(Neptunea arthritica)厣染色2~3 d,可更清晰地观察到生长线。
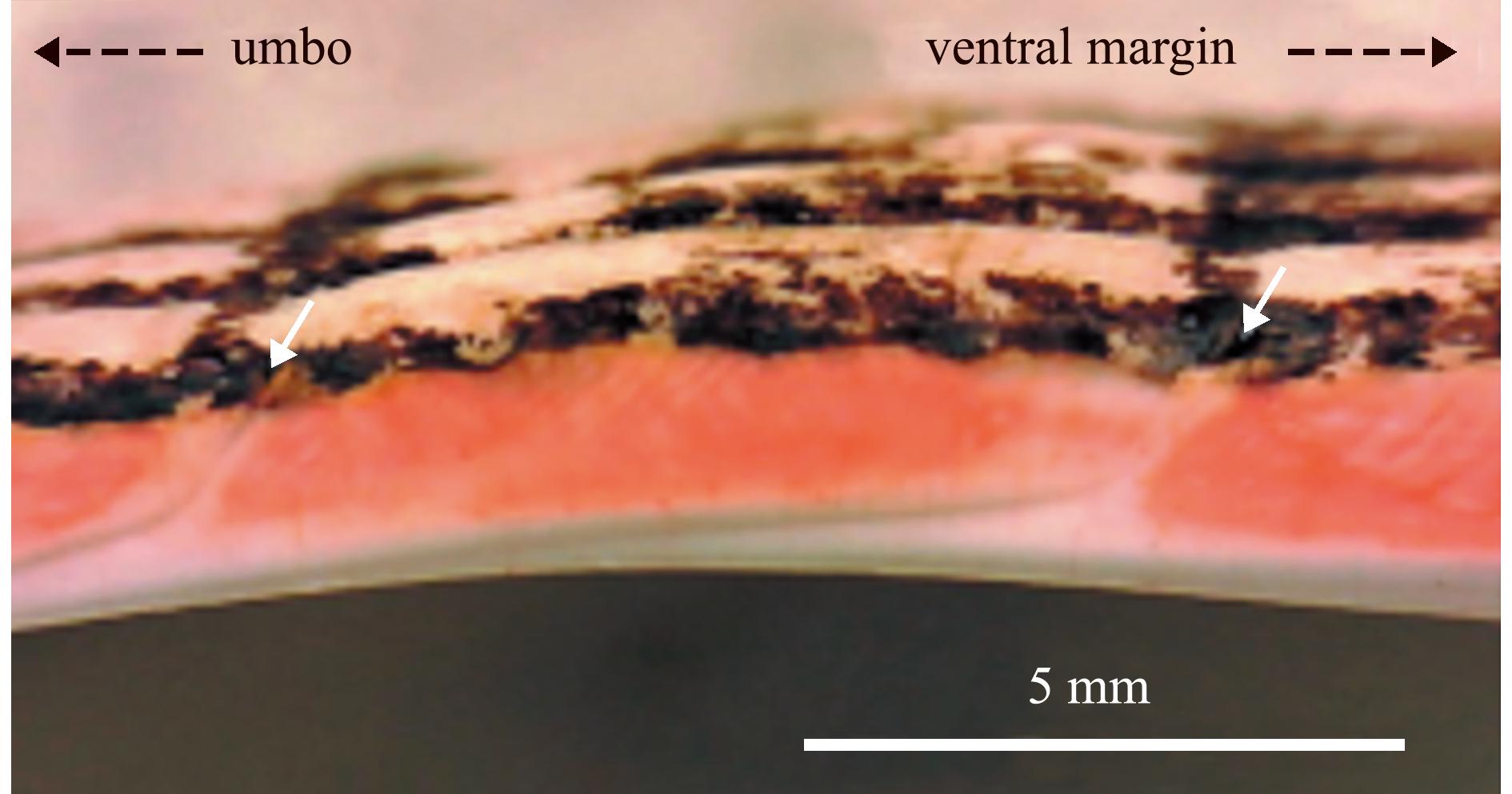
白色箭头处表示生长线。
The white arrow indicates the growth line.
图8 魁蚶贝壳切片红色水基标记笔染色[30]
Fig.8 Red water-based pen staining of Scapharca broughtonii shell sections[30]
3.2.3 醋酸酯剥离复制法 醋酸酯剥离复制法同样是在贝壳切片的基础上进行额外处理,制作一张带有贝壳钙化结构特征的醋酸酯片(图9),具体步骤为:(1)将磨平并抛光表面后的贝壳切片在1%的HCl溶液中浸泡,直到碳酸盐成分溶解,但保留了基体的有机部分,从而使截面壳体表面产生浮雕;(2)将蚀刻过的贝壳用丙酮或乙酸乙酯浸泡;(3)将一定厚度的醋酸片覆盖在蚀刻的外壳表面,直至药品全部挥发后,取下醋酸酯片,用显微镜观察[24,62]。该方法虽较繁琐但可排除贝壳中有机质的干扰,更简单直观地分辨和统计贝壳上生长线。Guy等[63]和Barroso等[64]等利用醋酸酯剥离复制法分别鉴定了大西洋舟螺(Crepidula fornicata)和纲目织纹螺(Nassarius reticulatus)的年龄,除此之外,该方法也已用于鸡帘蛤(Chamelea gallina)[65]、硬壳蛤(Mercenaria mercenaria)[24]和菲律宾蛤仔[29]等多种双壳贝类的年龄鉴定。
表1 部分贝类年龄研究情况
Tab.1 Research on the age of some shellfish
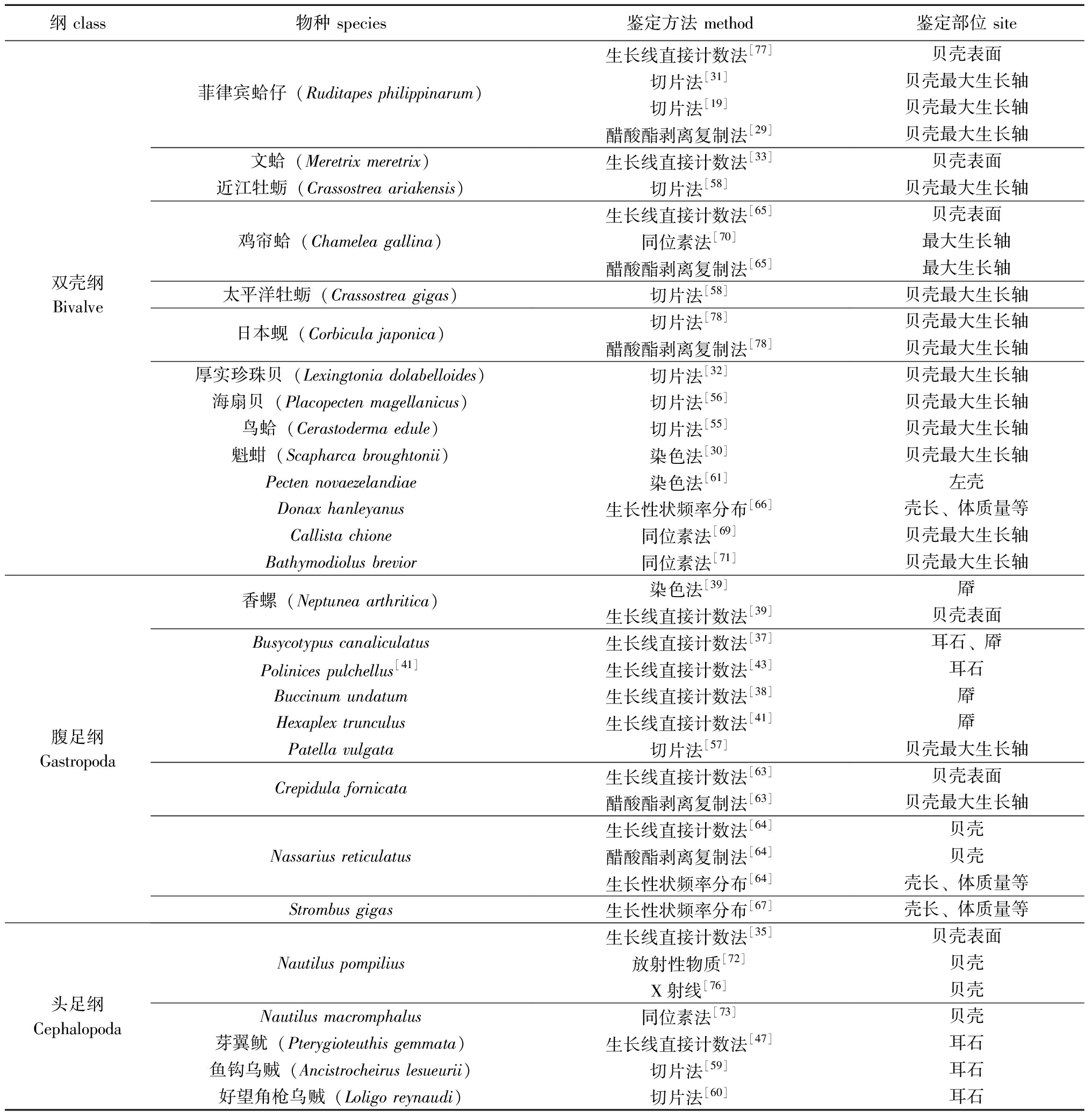
纲 class物种 species鉴定方法 method鉴定部位 site生长线直接计数法[77]贝壳表面菲律宾蛤仔(Ruditapes philippinarum)切片法[31]贝壳最大生长轴切片法[19]贝壳最大生长轴醋酸酯剥离复制法[29]贝壳最大生长轴文蛤(Meretrix meretrix)生长线直接计数法[33]贝壳表面近江牡蛎(Crassostrea ariakensis)切片法[58]贝壳最大生长轴生长线直接计数法[65]贝壳表面鸡帘蛤(Chamelea gallina)同位素法[70]最大生长轴醋酸酯剥离复制法[65]最大生长轴双壳纲Bivalve太平洋牡蛎(Crassostrea gigas)切片法[58]贝壳最大生长轴日本蚬(Corbicula japonica)切片法[78]贝壳最大生长轴醋酸酯剥离复制法[78]贝壳最大生长轴厚实珍珠贝(Lexingtonia dolabelloides)切片法[32]贝壳最大生长轴海扇贝(Placopecten magellanicus)切片法[56]贝壳最大生长轴鸟蛤(Cerastoderma edule)切片法[55]贝壳最大生长轴魁蚶(Scapharca broughtonii)染色法[30]贝壳最大生长轴Pecten novaezelandiae染色法[61]左壳Donax hanleyanus生长性状频率分布[66]壳长、体质量等Callista chione同位素法[69]贝壳最大生长轴Bathymodiolus brevior同位素法[71]贝壳最大生长轴香螺(Neptunea arthritica)染色法[39]厣生长线直接计数法[39]贝壳表面Busycotypus canaliculatus生长线直接计数法[37]耳石、厣Polinices pulchellus[41]生长线直接计数法[43]耳石Buccinum undatum生长线直接计数法[38]厣Hexaplex trunculus生长线直接计数法[41]厣腹足纲GastropodaPatella vulgata切片法[57]贝壳最大生长轴Crepidula fornicata生长线直接计数法[63]贝壳表面醋酸酯剥离复制法[63]贝壳最大生长轴生长线直接计数法[64]贝壳Nassarius reticulatus醋酸酯剥离复制法[64]贝壳生长性状频率分布[64]壳长、体质量等Strombus gigas生长性状频率分布[67]壳长、体质量等生长线直接计数法[35]贝壳表面Nautilus pompilius放射性物质[72]贝壳X射线[76]贝壳头足纲CephalopodaNautilus macromphalus同位素法[73]贝壳芽翼鱿(Pterygioteuthis gemmata)生长线直接计数法[47]耳石鱼钩乌贼(Ancistrocheirus lesueurii)切片法[59]耳石好望角枪乌贼(Loligo reynaudi)切片法[60]耳石
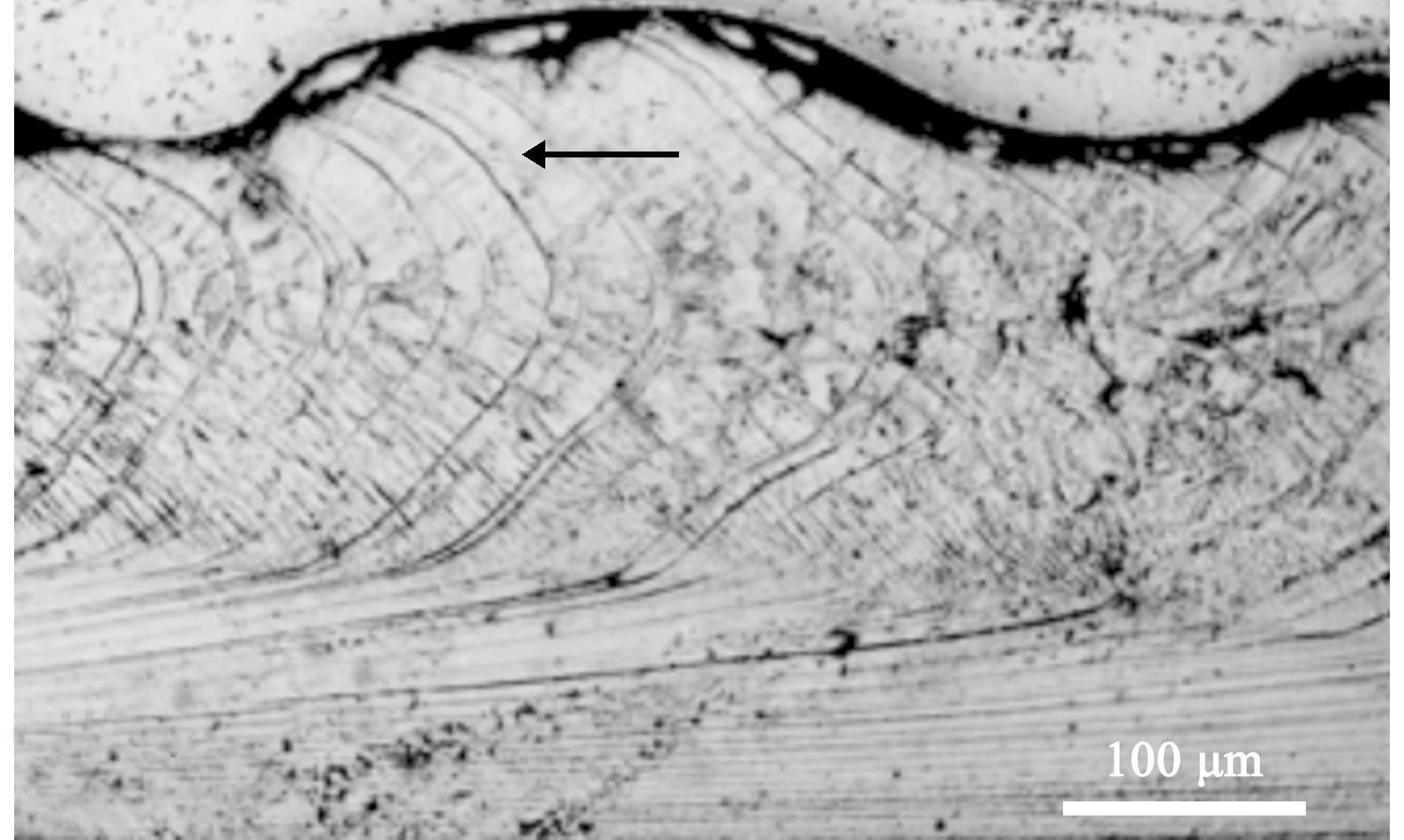
箭头处为生长线。
The arrow shows the growth line.
图9 鸡帘蛤醋酸酯剥离复制片[65]
Fig.9 Acetate peel replicas of shell sections of Chamelea gallina[65]
3.3 生长性状频率分布法
贝类生长性状频率分布法是研究贝类年龄和生长速度的常用方法,其原理是分析大批量的不同规格的同种贝类样本的生长性状,总结贝类生长速度和龄期之间存在的规律,进而从贝类体型上推测年龄。选定的指标可以是任何非主观的测量,如壳长、壳高、腹足类唇厚和壳质量等[34]。这种方法耗时长、样本需求量大,且易产生较大误差[62],其结果多用作其他年龄鉴定方法的佐证[66]。但相较于上述几种通过统计生长线数量来推断年龄的技术,在总结出生长与年龄规律后,该方法可根据体型快速估算贝类年龄,在市场流通和养殖生产等实际应用中具有很大优势。该方法目前已用于斧蛤(Donax hanleyanus)[66]、女王凤凰螺(Strombus gigas)[67]等多种贝类的年龄评估。
3.4 同位素法
同位素可用于追踪物质的运行和变化规律,常用于测定地块岩石的成因和“年龄”[68]。同位素在贝类中也能够发挥类似的作用,可以通过分析贝壳最大生长轴中的不同位置氧同位素的差异来推断贝类年龄。而在评价贝类碳酸盐与海水和温度的同位素平衡或不平衡条件时需要了解贝壳收集区海水的氧同位素组成和温度,通过比较生长轴和环境中氧同位素的变化趋势来了解不同部位生长的时间,进而推断贝类年龄[69-70]。如Keller等[69]、Schöne等[71]和Linzmeier等[72]通过氧同位素分析分别鉴定了光滑蛤蜊(Callista chione)、贻贝科(Bathymodiolus brevior)和鹦鹉螺的生长速度及年龄;Mancuso等[70]比较了环境与鸡帘蛤最大生长轴上的氧同位素,发现夏季时贝壳氧同位素含量较低,冬季较高,并根据此规律精确判断了3种不同规格鸡帘蛤的年龄。该方法利用海水环境中的同位素组成作为对照,能够在一定程度上排除环境因素的干扰,获取更精确的鉴定结果。
3.5 放射性物质及X射线法
有研究指出,鹦鹉螺在生长过程中会吸收海水中的放射性核素钋-210(210Po,半衰期为 22.3 a)但不会吸收铅-210(210Pb,半衰期为 138.4 d)[73],而210Pb和210Po同属于铀-238衰变链的成员,210Po是210Pb衰变产物[74]。因此,可以认为鹦鹉螺壳中检测到的210Po为210Pb衰变后产生。根据该原理,Cochran[73]提出鹦鹉螺壳中的210Pb与210Po的含量比例可以反映鹦鹉螺的生长速率,有望用于鹦鹉螺的年龄鉴定,并以此鉴定不同规格鹦鹉螺“隔”的形成周期。
X射线的出现提供了一种新的贝类年龄鉴定思路,目前,X射线已在哺乳动物骨龄鉴定中得到广泛应用,它通过比对特定区域骨结构和标准图谱中各年龄段图像特征来评估骨龄[75]。而在贝类中,Westermann[76]持续拍摄鹦鹉螺X射线照片以观察鹦鹉螺“隔”的形成周期和过程,并由此设计了鹦鹉螺年龄的计算公式。
4 问题与展望
4.1 重视生长线形成周期的验证
目前的贝类年龄鉴定技术主要关注双壳类贝壳、腹足类和头足类耳石等钙化结构上的微生长线和生长环等结构。简而言之,通过计数贝类的生长线并加上第一条生长线形成的时间,最终得到贝类的年龄估计值。因此,确定第一条生长线形成的时间和后续生长线形成周期的验证,在贝类年龄精确鉴定中尤为重要。第一条生长线的形成时间通常较短,需要从幼虫早期个体发育阶段开始追踪观察,而后续生长线的形成周期通常因物种类别、正常发育时期、生境差异而有所不同。此外,贝类生长过程中还会受到潮汐、温度、食物和繁殖等影响,产生伪生长线。这些情况使得生长线形成周期的验证难度加大,且易产生误差。因此,需要重视包括壳生长线形成周期在内的完整贝壳生长模式探究验证,这也是绝大多数贝类年龄鉴定方法的基础。一般推荐采用标记重捕法验证生长线形成周期,即利用钙黄绿素、茜素红、氯化锶等化学荧光素标记贝壳钙化结构,通过计算重捕时间、标记前后贝类的生长增量及生长线的数量变化得出确切的结论。
4.2 依据生物类群、几何形态和体型大小择优选择合适的年龄鉴定方法
双壳类是中国海水贝类养殖的主要类别,其中的扇贝科和帘蛤科类群更是具有极高的社会经济价值,目前有关其生长和年龄研究已有大量报道。多数双壳类壳面具有明显的生长线,特别是幼贝,其生长时间短,受到环境影响时间相对较短,壳面生长线暂未堆积,保存较为完好、清晰,建议通过壳面生长线直接计数法进行年龄鉴定。但对于一些壳色较深、壳表面磨损或有附着物的贝类,难以对壳面生长线准确计数。此时,通过制作切片或醋酸酯复制片等方法观察内部生长线可以得到更精确的年龄鉴定结果。而在大龄贝类中,因生长速度下降,在贝壳边缘生长线易发生堆积,难以准确计数,这种情况可通过同位素或放射性物质进行年龄鉴定。此外,一些双壳贝类(如扇贝、蛤仔)的韧带与贝类的生长表现出显著相关性,在脱水后具有相当的钙化特性,其内通常具有类似生长线的形态结构,或可作为潜在的年龄鉴定材料。
与双壳类相比,腹足类的贝壳呈螺旋状,不同螺层交界处的生长线堆积不易计数,通过贝壳生长线来鉴定腹足类的年龄相对困难。但是,腹足类的厣和耳石提供了新的年龄鉴定思路。在此提出两点建议:(1)在鉴定腹足类贝壳年龄时,使用厣部的生长线作为参考。尽管存在一定误差,但这种方法简单易行,并能快速提供年龄的参考范围;(2)考虑将耳石作为腹足类年龄鉴定的重要工具。耳石被称为腹足类的“生命记录仪”,通过分析其微结构、化学组成等特点,可以准确反映贝类的生长、年龄和种群来源。结合腹足类厣部和耳石的生长线,能够获得更全面和准确的贝类年龄信息,有助于提升贝类年龄鉴定的可靠性和精确度。
头足类的年龄鉴定主要依据耳石、角质颚和内壳上的生长线。然而,需要注意的是,角质颚的前端常常会受到侵蚀,导致部分生长线无法计算,从而使评估的年龄偏低。同样,内壳前端也可能有部分生长增量无法计数,因此需要使用其他方法进行校正。而耳石能够提供相对准确的年龄信息,此方法已被广泛接受。因此,建议在头足类的年龄鉴定中,继续采用耳石作为主要方法。同时,也应该意识到其他方法的局限性,并尽量通过观察多个年龄指标来获取更全面和准确的头足类年龄数据。
另外,贝类的种类繁多,形态各异,有些贝类体表上有突出的棱,对观察生长线和制作贝壳切片带来了不便。对于具有特殊结构的贝类,可以通过同位素或放射性物质来获得准确有效的年龄估值。
4.3 推进贝类年龄鉴定方法标准化进程
当前贝类年龄鉴定缺乏统一的标准,导致在年龄鉴定的过程中,不同学者的研究效率低、结果误差大,可重复性不高。为了减少因参考标准不统一造成的误差,建议从以下两方面推进贝类年龄鉴定标准化进程。一是,生长线计数标准化。由于目前对贝类生长线的统计缺乏统一标准,科研人员在面对因环境、繁殖等因素产生的生长线断裂、伪生长线等情况时,往往难以精确区分并计数。针对典型贝类建立统一的生长信息标准化读取方法,可以有效避免因参考标准不统一而造成的误差。二是,典型类群年龄鉴定方法标准化。由于无统一的标准,不同研究者即使面对相近的研究物种,也需要耗费大量时间对鉴定方法细节进行调整。建议优先建立扇贝、牡蛎、蛤、蛏、鲍、螺等国内外大宗或高价值代表性贝类物种的年龄鉴定标准规程,并因地制宜进行示范推广。
[1] 卢昆,孙娟,Pierre Failler,等.中国海水贝类养殖生产阶段判别与现实应对[J].中国海洋经济,2020(2):1-18.
LU K,SUN J,FAILLER P,et al.Study on the production stage and development strategy of marine shellfish culture in China[J].Marine Economy in China,2020(2):1-18.(in Chinese)
[2] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2023中国渔业统计年鉴[M].北京:中国农业出版社,2023.
Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2023 China fishery statistical yearbook[M].Beijing: China Agriculture Press,2023.(in Chinese)
[3] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2022中国渔业统计年鉴[M].北京:中国农业出版社,2022.
Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2022 China fishery statistical yearbook[M].Beijing: China Agriculture Press,2022.(in Chinese)
[4] 彭道民,陈丕栋.基于灰色关联-TOPSIS法的中国沿海省份海水贝类养殖产业评价[J].中国渔业经济,2017,35(3):78-83.
PENG D M,CHEN P D.Evaluation of Chinese marine shellfish aquaculture industry in coastal provinces based on grey relationship and TOPSIS[J].Chinese Fisheries Economics,2017,35(3):78-83.(in Chinese)
[5] 张麋鸣,颜金培,叶旺旺,等.福建省贝藻类养殖碳汇及其潜力评估[J].应用海洋学学报,2022,41(1):53-59.
ZHANG M M,YAN J P,YE W W,et al.Carbon sequestration and its potentiality of marine shellfish and seaweed cultures in Fujian Province,China[J].Journal of Applied Oceanography,2022,41(1):53-59.(in Chinese)
[6] 焦念志.海洋固碳与储碳:并论微型生物在其中的重要作用[J].中国科学:地球科学,2012,42(10):1473-1486.
JIAO N Z.Carbon fixation and sequestration in the ocean,with special reference to the microbial carbon pump[J].Scientia Sinica (Terrae),2012,42(10):1473-1486.(in Chinese)
[7] 余向东,刘立明,罗刚.循生态之道得鱼水和谐:我国开展水生生物增殖放流行动综述[J].中国水产,2022(3):56-64.
YU X D,LIU L M,LUO G.Harmony between fish and water by ecological way—a summary of aquatic organisms’ proliferation and release in China[J].China Fisheries,2022(3):56-64.(in Chinese)
[8] LANDMAN N H,DRUFFEL E R M,COCHRAN J K,et al.Bomb-produced radiocarbon in the shell of the chambered Nautilus:rate of growth and age at maturity[J]. Earth and Planetary Science Letters,1988,89(1):28-34.
[9] SCHÖNE B R.Arctica islandica (Bivalvia):a unique paleoenvironmental archive of the northern North Atlantic Ocean[J].Global and Planetary Change,2013,111:199-225.
[10] 张书玉,王继隆,李培伦,等.黄河中上游拟硬刺高原鳅年龄鉴定与生长模型筛选[J].北方农业学报,2023,51(4):105-111.
ZHANG S Y,WANG J L,LI P L,et al.Age identification and growth model selection of Triplophysa pseudoscleroptera in the middle and upper reaches of the Yellow River[J].Journal of Northern Agriculture,2023,51(4):105-111.(in Chinese)
[11] 康中杰,宋大德,李纲,等.基于耳石不同切面的小黄鱼年龄鉴定及其生长方程年龄反演比较[J].海洋渔业,2022,44(5):543-554.
KANG Z J,SONG D D,LI G,et al.Age identification for Larimichthys polyactis based on different sections of sagittal otolith and comparison with result of age backward inferring from growth equation[J].Marine Fisheries,2022,44(5):543-554.(in Chinese)
[12] 凌高,吴小平,欧阳珊,等.背瘤丽蚌(Lamprotula leai Gray.1835)的年龄与生长[J].南昌大学学报(理科版),2005,29(5):497-499,507.
LING G,WU X P,OUYANG S,et al.The age and growth of Lamprotulaleagi Gray1835[J].Journal of Nanchang University (Natural Science Edition),2005,29(5):497-499,507.(in Chinese)
[13] 龚世园,刘军,张训蒲,等.绢丝丽蚌年龄与生长的研究[J].水生生物学报,2003,27(5):521-526.
GONG S Y,LIU J,ZHANG X P,et al.Studies on the growth of Lamprotula fibrosa[J].Acta Hydrobiologica Sinica,2003,27(5):521-526.(in Chinese)
[14] AUZOUX-BORDENAVE S,BADOU A C,GAUME B,et al.Ultrastructure,chemistry and mineralogy of the growing shell of the European abalone Haliotis tuberculata[J].Journal of Structural Biology,2010,171(3):277-290.
[15] LORRAIN A,GILLIKIN D P,PAULET Y M,et al.Strong kinetic effects on Sr/Ca ratios in the calcitic bivalve Pecten maximus[J].Geology,2005,33(12):965.
[16] YOSHIMURA T,NAKASHIMA R,SUZUKI A,et al.Oxygen and carbon isotope records of cultured freshwater pearl mussel Hyriopsis sp.shell from Lake Kasumigaura,Japan[J].Journal of Paleolimnology,2010,43(3):437-448.
[17] ARKHIPKIN A I,SHCHERBICH Z N.Thirty years’ progress in age determination of squid using statoliths[J].Journal of the Marine Biological Association of the United Kingdom,2011,92:1389-1398.
[18] LEFEVRE G,CURTIS W C.Studies on the reproduction and artificial propagation of fresh-water mussels[M].US Government Printing Office,1912.
[19] MAH K,BELLAMY E,D’AMICOF,et al.In situ fast marking study of Manila clams (Ruditapes philippinarum)[J].International Journal of Fisheries and Aquatic Studies,2021,9(1):47-51.
K,BELLAMY E,D’AMICOF,et al.In situ fast marking study of Manila clams (Ruditapes philippinarum)[J].International Journal of Fisheries and Aquatic Studies,2021,9(1):47-51.
[20] HARDING J P.The use of probability paper for the graphical analysis of polymodal frequency distributions[J].Journal of the Marine Biological Association of the United Kingdom,1949,28(1):141-153.
[21] CASSIE R M.Some uses of probability paper in the analysis of size frequency distributions[J].Marine and Freshwater Research,1954,5(3):513-522.
[22] BARKER. R. M.Microtextural variation in Pelecypod shells[J].Malacologia,1964(2):69-86.
[23] HOUSE M R,FARROW G E.Daily growth banding in the shell of the cockle,Cardium edule[J].Nature,1968,219:1384-1386.
[24] RHOADS D C,PANNELLA G.The use of molluscan shell growth patterns in ecology and paleoecology[J].Lethaia,1970,3(2):143-161.
[25] KRISTENSEN T.Periodical growth rings in cephalopod statoliths[J].Dana,1980,1:39-51.
[26] BELL J L.Statoliths as age indicators in gastropod larvae—application to measurement of field growth-rates[C]//Pacific Science.2840 KOLOWALU ST,HONOLULU,HI 96822:UNIV HAWAII PRESS,1984,38(4):357-357.
[27] MARGOSIAN A,TAN F C,CAI D,et al.Seawater temperature records from stable isotopic profiles in the shell of Modiolus modiolus[J].Estuarine,Coastal and Shelf Science,1987,25(1):81-89.
[28] CHECA A G,JIM NEZ-JIM
NEZ-JIM NEZ A P.Constructional morphology,origin,and evolution of the gastropod operculum[J].Paleobiology,1998,24(1):109-132.
NEZ A P.Constructional morphology,origin,and evolution of the gastropod operculum[J].Paleobiology,1998,24(1):109-132.
[29] MASU T,WATANABE S,AOKIS,et al.Establishment of shell growth analysis technique of juvenile Manila clam Ruditapes philippinarum:semidiurnal shell increment formation[J].Fisheries Science,2008,74(1):41-47.
[30] SUGIURA D,KATAYAMA S,SASAS J,et al.Age and growth of the ark shell Scapharca broughtonii(Bivalvia,Arcidae) in Japanese waters[J].Journal of Shellfish Research,2014,33(1):315-324.
[31] 华丹,RICHARD J N,JESS J.内部切片法测定淡水贝类的年龄[J].水产学报,2001,25(5):413-418.
HUA D,RICHARD J.N,JESS J.Age determination of freshwater mussels using the method of thin section[J].Journal of Fisheries of China,2001,25(5):413-418.(in Chinese)
[32] SUGIURA D,KIKUYA N.Validation of the age estimation method using the shell section of the Manila clam Ruditapes philippinarum in Mutsu Bay,northern Japan[J].Aquaculture Science,2018,65(3):193-202.
[33] 张建中,李复雪.文蛤年龄的研究[J].水产学报,1988,12(3):251-258.
ZHANG J Z,LI F X.Determination of age of the Asian hard clam,Meretrix meretrix(linnaeus)[J].Journal of Fisheries of China,1988,12(3):251-258.(in Chinese)
[34] HOLLYMAN P R,LAPTIKHOVSKY V V,RICHARDSON C A.Techniques for estimating the age and growth of molluscs:Gastropoda[J].Journal of Shellfish Research,2018,37(4):773-782.
[35] BARBIN V.Fluctuation in shell composition in Nautilus (Cephalopoda,Mollusca):evidence from cathodoluminescence[J].Lethaia,1992,25(4):391-400.
[36] HURLEY G V,TREMBLAY M J,COUTURIER C.Age estimation of sea scallop larvae (Placopecten magellanicus) from daily growth lines on shells[J].Journal of Northwest Atlantic Fishery Science,1987,7:123-129.
[37] FISHER R A,RUDDERS D B.Population and reproductive biology of the channeled whelk,Busycotypus canaliculatus,in the US mid-Atlantic[J].Journal of Shellfish Research,2017,36(2):427-444.
[38] HEUDE-BERTHELIN C,H GRON-MAC
GRON-MAC L,LEGRAND V,et al.Growth and reproduction of the common whelk Buccinum undatum in West Cotentin (Channel),France[J].Aquatic Living Resources,2011,24(3):317-327.
L,LEGRAND V,et al.Growth and reproduction of the common whelk Buccinum undatum in West Cotentin (Channel),France[J].Aquatic Living Resources,2011,24(3):317-327.
[39] MIRANDA R M,FUJINAGA K,NAKAO S.Age and growth of Neptunea arthritica estimated from growth marks in the operculum[J].Marine Biology Research,2008,4(3):224-235.
[40] AVACA M S,NARVARTE M,MART N P.Age,growth and mortality in Buccinanops globulosus (Gastropoda:Nassariidae) from Golfo Nuevo (Argentina)[J].Marine Biology Research,2013,9(2):208-219.
N P.Age,growth and mortality in Buccinanops globulosus (Gastropoda:Nassariidae) from Golfo Nuevo (Argentina)[J].Marine Biology Research,2013,9(2):208-219.
[41] VASCONCELOS P,GHARSALLAH I H,MOURA P,et al.Appraisal of the usefulness of operculum growth marks for ageing Hexaplex trunculus(Gastropoda:Muricidae):comparison between surface striae and adventitious layers[J].Marine Biology Research,2012,8(2):141-153.
[42] GALANTE-OLIVEIRA S,MARÇAL R,ESPADILHA F,et al.Detection of periodic Sr Ca-1 cycles along gastropod statoliths allows the accurate estimation of age[J].Marine Biology,2015,162(7):1473-1483.
[43] RICHARDSON C A,KINGSLEY-SMITH P R,SEED R,et al.Age and growth of the naticid gastropod Polinices pulchellus (Gastropoda:Naticidae) based on length frequency analysis and statolith growth rings[J].Marine Biology,2005,148(2):319-326.
[44] ARKHIPKIN A I,BIZIKOV V A.Role of the statolith in functioning of the acceleration receptor system in squids and sepioids[J].Journal of Zoology,2000,250(1):31-55.
[45] 陈新军,刘必林,钟俊生.头足类年龄与生长特性的研究方法进展[J].大连海洋大学学报,2006,21(4):371-377.
CHEN X J,LIU B L,ZHONG J S.Advances in determination of age and growth of cephalopods[J].Journal of Dalian Ocean University,2006,21(4):371-377.(in Chinese)
[46] 马金,刘必林,陈新军,等.利用耳石鉴定头足类年龄与生长研究进展[J].海洋渔业,2009,31(3):316-324.
MA J,LIU B L,CHEN X J,et al.Advances on using statolith to study age and growth of cephalopod[J].Marine Fisheries,2009,31(3):316-324.(in Chinese)
[47] ARKHIPKIN A I.Age of the micronektonic squid Pterygioteuthis gemmata (Cephalopoda:Pyroteuthidae) from the central-east Atlantic based on statolith growth increments[J].Journal of Molluscan Studies,1997,63(2):287-290.
[48] CLARKE M R.“Growth rings” in the beaks of the squid Moroteuthis ingens (Oegopsida:Onychoteuthidae)[J].Malacologia,1965,3:287-307.
[49] B RCENAS G V,PERALES-RAYA C,BARTOLOM
RCENAS G V,PERALES-RAYA C,BARTOLOM A,et al.Age validation in Octopus maya by counting increments in the beak rostrum sagittal sections of known age individuals[J].Fisheries Research,2014,152:93-97.
A,et al.Age validation in Octopus maya by counting increments in the beak rostrum sagittal sections of known age individuals[J].Fisheries Research,2014,152:93-97.
[50] ARKHIPKIN A I,BIZIKOV V A,DOUBLEDAY Z A,et al.Techniques for estimating the age and growth of molluscs:Cephalopoda[J].Journal of Shellfish Research,2018,37(4):783-792.
[51] PERALES-RAYA C,ALMANSA E,BARTOLOM A,et al.Age validation in Octopus vulgaris beaks across the full ontogenetic range:beaks as recorders of life events in octopuses[J].Journal of Shellfish Research,2014,33(2):481-493.
A,et al.Age validation in Octopus vulgaris beaks across the full ontogenetic range:beaks as recorders of life events in octopuses[J].Journal of Shellfish Research,2014,33(2):481-493.
[52] FRANCO-SANTOS R M,PERALES-RAYA C,ALMANSA E,et al.Beak microstructure analysis as a tool to identify potential rearing stress for Octopus vulgaris paralarvae[J].Aquaculture Research,2016,47(9):3001-3015.
[53] MIRZAEI M R,HWAI A T S,KHALIL M.Temporal variation in shell growth rate of cockle Anadara granosain relation with its reproductive cycle[J].Journal of Shellfish Research,2017,36(1):69-78.
[54] HOLLYMAN P,LUCKENBACH M,RICHARDSON C A.Nondaily deposition of striae in the bay scallop Argopecten irradians(Concentricus) in the laboratory[J].Journal of Shellfish Research,2013,32(2):361-368.
[55] MAH K,BELLAMY E,LARTAUD F,et al.Calcein and manganese experiments for marking the shell of the common cockle (Cerastoderma edule):tidal rhythm validation of increments formation[J].Aquatic Living Resources,2010,23(3):239-245.
K,BELLAMY E,LARTAUD F,et al.Calcein and manganese experiments for marking the shell of the common cockle (Cerastoderma edule):tidal rhythm validation of increments formation[J].Aquatic Living Resources,2010,23(3):239-245.
[56] LORIA P L,HUATO-SOBERANIS L.Efficacy of calcein and Coomassie Blue dyeing of shell growing-edges and micro growth-bands:ageing juvenile of Pinctada mazatlanica (Pterioida:Pteriidae)[J].Revista De Biologia Tropical,2014,62(3):957-968.
[57] AMBROSE W G Jr,LOCKE V W L,BIGELOW G F,et al.Deposition of annual growth lines in the apex of the common limpet (Patella vulgata) from Shetland Islands,UK and Norway:evidence from field marking and shell mineral content of annual line deposition[J].Environmental Archaeology,2016,21(1):79-87.
[58] HARDING J M,MANN R.Age and growth of wild suminoe (Crassostrea ariakensis,fugita 1913) and Pacific (C.gigas,Thunberg 1793) oysters from Laizhou Bay,China[J].Journal of Shellfish Research,2006,25(1):73-82.
[59] ARKHIPKIN A I.Age and growth of the mesopelagic squid Ancistrocheirus lesueurii (Oegopsida:Ancistrocheiridae) from the central-east Atlantic based on statolith microstructure[J].Marine Biology,1997,129(1):103-111.
[60] LIPINSKI M R,DURHOLTZ M D,UNDERHILL L G.Field validation of age readings from the statoliths of chokka squid (Loligo vulgaris reynaudii d’Orbigny,1845) and an assessment of associated errors[J].ICES Journal of Marine Science,1998,55(2):240-257.
[61] BURGESS S,TUCK I,WILLIAMS J.Microstriae identification and growth rates in New Zealand scallop (Pecten novaezelandiae) juveniles[C].20th International Pecten Workshop 2015.2015.
[62] BARGIONE G,VASAPOLLO C,DONATO F,et al.Age and growth of striped venus clam Chamelea gallina (linnaeus,1758) in the mid-western Adriatic sea:a comparison of three laboratory techniques[J].Frontiers in Marine Science,2020,7:582703.
[63] GUY C S,REID N,ROBERTS D.Ageing slipper limpet (Crepidula fornicata) shells from Belfast Lough[J].Irish Naturalists’ Journal,2013,32:45-48.
[64] BARROSO C M,MOREIRA M H,RICHARDSON C A.Age and growth of Nassarius reticulatus in the Ria de Aveiro,north-west Portugal[J].Journal of the Marine Biological Association of the United Kingdom,2005,85(1):151-156.
[65] GASPAR M B,PEREIRA A M,VASCONCELOS P,et al.Age and growth of Chamelea gallina from the Algarve coast (southern Portugal):influence of seawater temperature and gametogenic cycle on growth rate[J].Journal of Molluscan Studies,2004,70(4):371-377.
[66] HERRMANN M,LEPORE M L,LAUDIEN J,et al.Growth estimations of the Argentinean wedge clam Donax hanleyanus:a comparison between length-frequency distribution and size-increment analysis[J].Journal of Experimental Marine Biology and Ecology,2009,379(1/2):8-15.
[67] BAQUEIRO C RDENAS E,ALDANA ARANDA D.Growth parameters and density variation of a queen conch,Strombus gigas (Neotaenioglossa:Strombidae),population from Xel-Ha Park,a marine protected area[J].Revista De Biologia Tropical,2014,62(1):45-57.
RDENAS E,ALDANA ARANDA D.Growth parameters and density variation of a queen conch,Strombus gigas (Neotaenioglossa:Strombidae),population from Xel-Ha Park,a marine protected area[J].Revista De Biologia Tropical,2014,62(1):45-57.
[68] 迟乃杰,单伟,张晨西,等.胶西北花山岩体岩石成因与地质意义:来自地球化学、年代学与Sr-Nd同位素的约束[J].山东国土资源,2023,39(10):1-11.
CHI N J,SHAN W,ZHANG C X,et al.Petrogenesis and geological significance of Huashan pluton in northwestern Jiaodong:constraints from geochemistry,chronology and Sr-Nd isotopes[J].Shandong Land and Resources,2023,39(10):1-11.(in Chinese)
[69] KELLER N,DEL PIERO D,LONGINELLI A.Isotopic composition,growth rates and biological behaviour of Chamelea gallina and Callista chione from the Bay of Trieste (Italy)[J].Marine Biology,2002,140(1):9-15.
[70] MANCUSO A,STAGIONI M,PRADA F,et al.Environmental influence on calcification of the bivalve Chamelea gallina along a latitudinal gradient in the Adriatic Sea[J].Scientific Reports,2019,9(1):11198.
[71] SCHÖNE B R,GIERE O.Growth increments and stable isotope variation in shells of the deep-sea hydrothermal vent bivalve mollusk Bathymodiolus brevior from the North Fiji Basin,Pacific Ocean[J].Deep Sea Research Part I:Oceanographic Research Papers,2005,52(10):1896-1910.
[72] LINZMEIER B J,KOZDON R,PETERS S E,et al.Oxygen isotope variability within Nautilus shell growth bands[J].PLoS One,2016,11(4):e0153890.
[73] COCHRAN J K,LANDMAN N H.Radiometric determination of the growth rate of Nautilus in nature[J].Nature,1984,308:725-727.
[74] 苏锴骏,王希龙,霍梦慧,等.环境样品中210Po和210Pb的测量方法进展[J].中国辐射卫生,2022,31(2):245-249,254.
SU K J,WANG X L,HUO M H,et al.Research progress in measurement methods for 210Po and 210Pb in environmental samples[J].Chinese Journal of Radiological Health,2022,31(2):245-249,254.(in Chinese)
[75] 王嘉庆,梅礼晔,张俊华.基于深度学习的手骨X射线图像骨龄评估[J].计算机工程,2021,47(1):291-297.
WANG J Q,MEI L Y,ZHANG J H.Bone age assessment for X-ray images of hand bone based on deep learning[J].Computer Engineering,2021,47(1):291-297.(in Chinese)
[76] WESTERMANN B,BECK-SCHILDW CHTER I,BEUERLEIN K,et al.Shell growth and chamber formation of aquarium-reared Nautilus pompilius (Mollusca,Cephalopoda) by X-ray analysis[J].Journal of Experimental Zoology Part A,Comparative Experimental Biology,2004,301(12):930-937.
CHTER I,BEUERLEIN K,et al.Shell growth and chamber formation of aquarium-reared Nautilus pompilius (Mollusca,Cephalopoda) by X-ray analysis[J].Journal of Experimental Zoology Part A,Comparative Experimental Biology,2004,301(12):930-937.
[77] 李明云,薛学朗,丁雪燕,等.象山港菲律宾蛤仔年龄与生长的研究[J].浙江水产学院学报,1987,6(2):111-120,4.
LI M Y,XUE X L,DING X Y,et al.A study on age and growth of clam at Wangten area in Xiangsan harbour[J].Journal of Zhejiang Ocean University (Natural Science Edition),1987,6(2):111-120,4.(in Chinese)
[78] OSHIMA K,SUZUKI N,NAKAMURA M,et al.Shell growth and age determination of the brackish water bivalve Corbicula japonica in Lake Shinji,Japan[J].Fisheries Science,2004,70(4):601-610.