江西省水资源由内陆池塘、水库山塘和大水面组成,生态环境良好,淡水养殖产量位居全国第四位,是中国淡水养殖产品的主要供给地[1]。淡水鱼池塘养殖是高密度养殖,养殖水体呈现富营养化程度高、TN和TP含量高、水生药物残留高等特点[2]。水质的恶化会引起病原微生物的快速繁殖,养殖鱼类因应激导致抗病能力下降[3],故如何改善养殖环境已成为池塘养殖的研究热点。作为地球生物化学循环的主要驱动力,细菌也是水产养殖生态系统的重要组成部分[4],其群落结构和多样性在疾病防治、水质调节和维持生态系统稳定过程中起着重要作用,对水生动物的健康和生存具有较大的影响[5]。通过分析环境微生物群落的种群结构和多样性,研究其动态变化,可以为优化群落结构、调节群落功能和发现新的重要微生物功能群提供可靠的依据[6]。
Illumina MiSeq高通量测序技术直接从DNA水平分析细菌的种群组成,可比传统的研究方法更完整、准确地显示细菌的多样性信息[7]。近年来,随着高通量测序技术的发展和应用,对不同养殖模式水体中微生物多样性的研究越来越多[5,8-9],在空间水平上对养殖池塘细菌多样性的研究报道较少。本研究中通过应用Illumina MiSeq高通量测序技术对江西省鄱阳湖周边多种鱼类养殖池塘水体进行16S rRNA测序,以期补充江西省淡水池塘养殖水体中细菌多样性的资料,为相关养殖池塘维持良好的细菌生态环境提供有益参考。
江西省位于长江中下游南岸,属亚热带省份。夏季气温较高,是江西省水产养殖生产的主要季节。本研究于2022年6月对江西省鄱阳湖周边、中部地区(115°20′21″~117°57′32″E,27°16′38″~29°48′42″ N)多种经济鱼类养殖池塘进行样品采集,采样范围包括九江市(JJ01~12)、南昌市(NC01~ 12)、上饶市(SR01~13)、宜春市(YC01~03)、抚州市(FZ01~03)、吉安市(JA01、02)等6个地级市,共45个养殖池塘。每个点位设3个平行,共采集135份有效样品。池塘分布情况见图1,具体养殖品种如表1所示。
表1 采样池塘信息
Tab.1 Information of sampling ponds
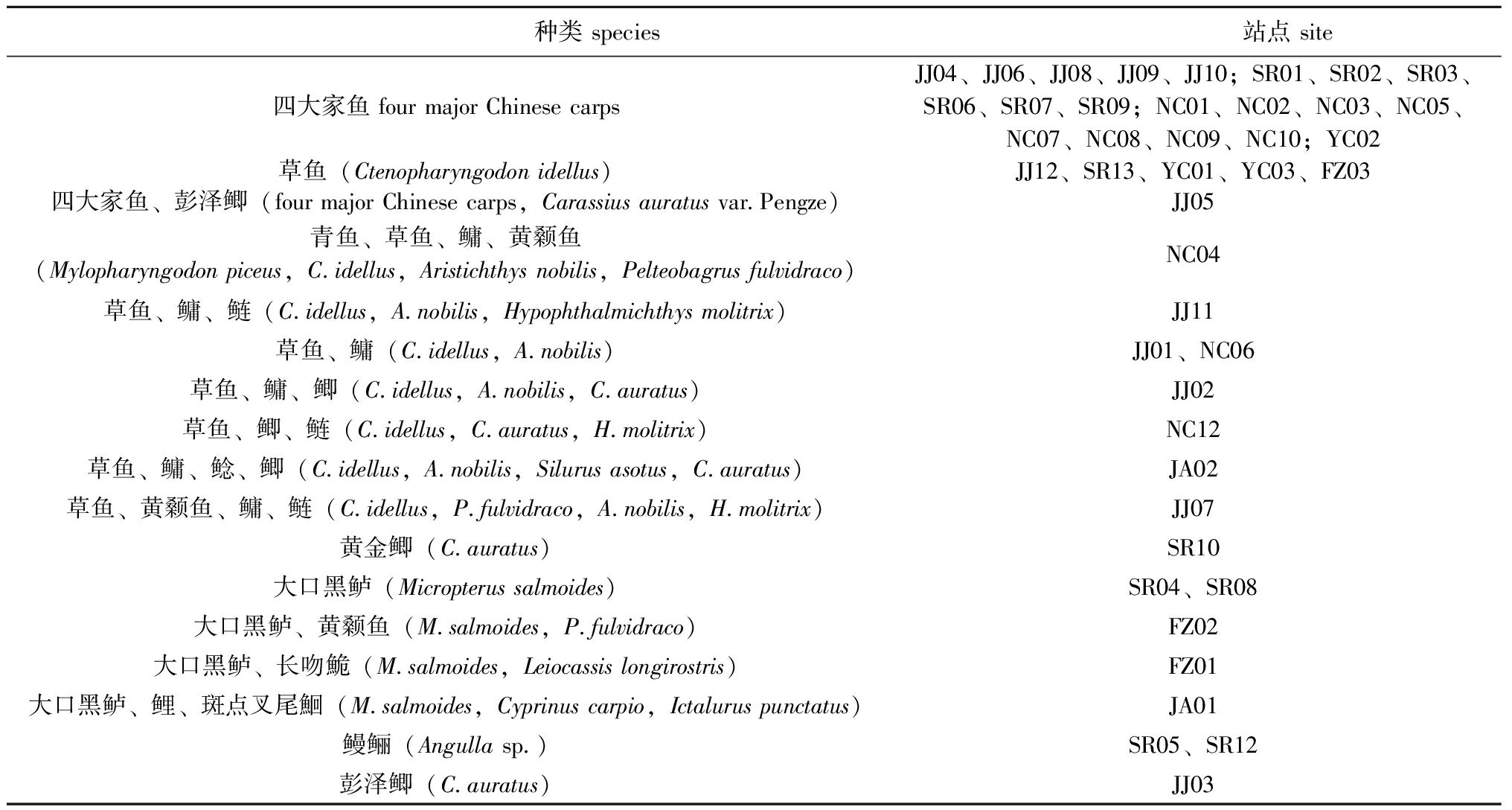
种类 species 站点 site 四大家鱼 four major Chinese carpsJJ04、JJ06、JJ08、JJ09、JJ10;SR01、SR02、SR03、SR06、SR07、SR09;NC01、NC02、NC03、NC05、NC07、NC08、NC09、NC10;YC02草鱼(Ctenopharyngodon idellus)JJ12、SR13、YC01、YC03、FZ03四大家鱼、彭泽鲫(four major Chinese carps,Carassius auratus var.Pengze)JJ05青鱼、草鱼、鳙、黄颡鱼(Mylopharyngodon piceus,C.idellus,Aristichthys nobilis,Pelteobagrus fulvidraco)NC04草鱼、鳙、鲢(C.idellus,A.nobilis,Hypophthalmichthys molitrix)JJ11草鱼、鳙(C.idellus,A.nobilis)JJ01、NC06草鱼、鳙、鲫(C.idellus,A.nobilis,C.auratus)JJ02草鱼、鲫、鲢(C.idellus,C.auratus,H.molitrix)NC12草鱼、鳙、鲶、鲫(C.idellus,A.nobilis,Silurus asotus,C.auratus)JA02草鱼、黄颡鱼、鳙、鲢(C.idellus,P.fulvidraco,A.nobilis,H.molitrix)JJ07黄金鲫(C.auratus)SR10大口黑鲈(Micropterus salmoides)SR04、SR08大口黑鲈、黄颡鱼(M.salmoides,P.fulvidraco)FZ02大口黑鲈、长吻鮠(M.salmoides,Leiocassis longirostris)FZ01大口黑鲈、鲤、斑点叉尾鮰(M.salmoides,Cyprinus carpio,Ictalurus punctatus)JA01鳗鲡(Angulla sp.)SR05、SR12彭泽鲫(C.auratus)JJ03
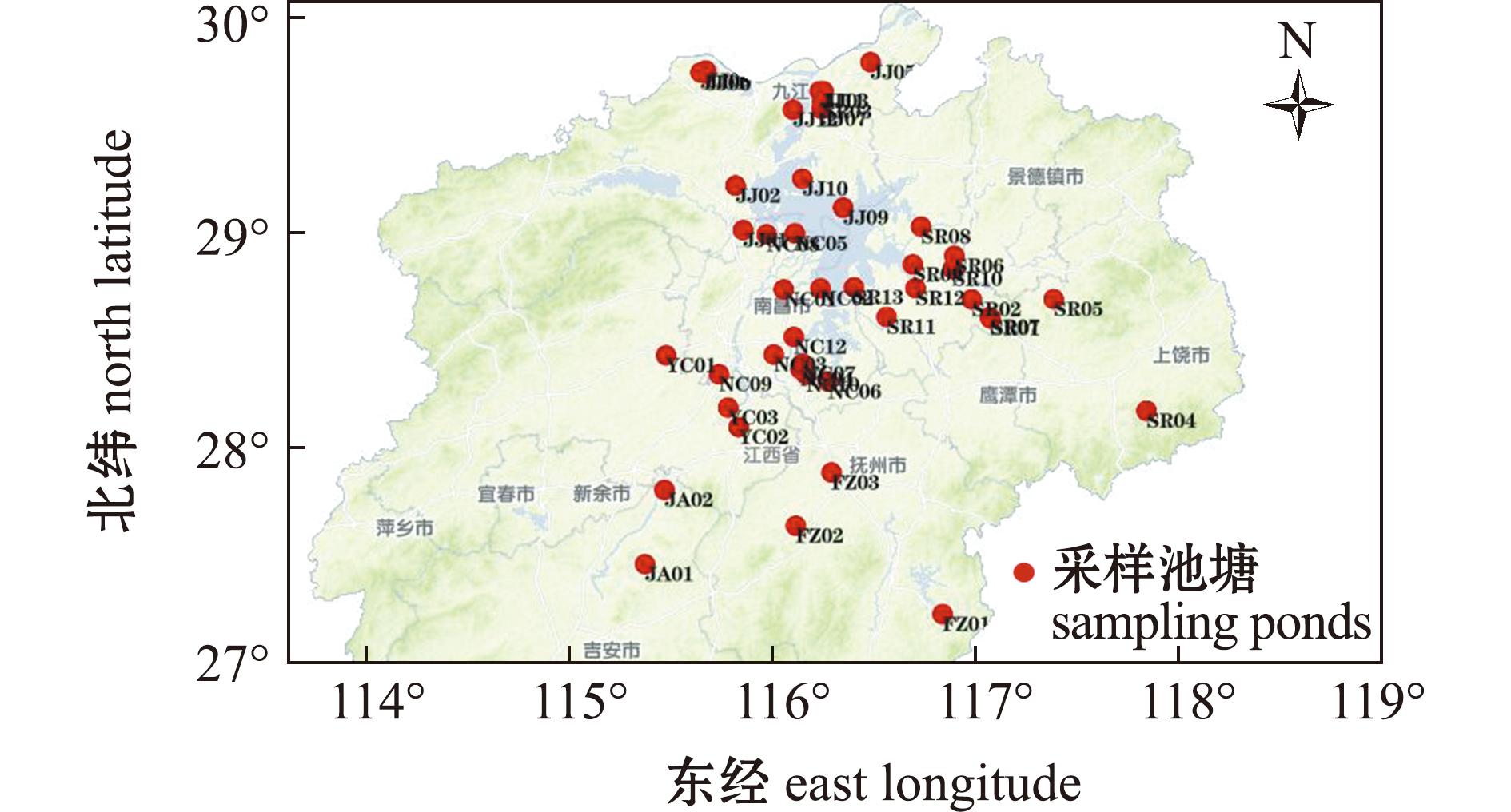
图1 采样池塘分布图
Fig.1 Distribution of sampling ponds
1.2.1 样品采集与处理 在每个站点随机采集养殖水体样本,用透明采水器在池塘中心和每个池塘四角水面下0.5 m处取水样1 L。混合均匀后,取1 L水样置于杀菌消毒后的采样瓶中,所有水样均重复采样3次,低温带回实验室以备后续试验。水样沉积后,取上清液通过0.22 μm聚醚砜膜真空过滤,过滤后的膜存于5 mL离心管中液氮快速冷冻3~5 min,然后转移到-80 ℃超低温冰箱中保存直至DNA提取。
1.2.2 菌群16S rRNA测序分析 宏基因快速提取试剂盒由上海生物工程技术公司提供,按照试剂盒说明书进行水样宏基因组提取操作。根据细菌16S rRNA保守序列设计引物:正向引物为338F5′ACTCCTACGGGAGGCAG-CA 3′,反向引物为806R5′GGACTACHVGGGT-WTCTAAT 3′,然后进行PCR扩增,扩增后凝胶电泳检测,PCR扩增产物切胶回收,随后定量并质检、测序。Miseq高通量测序由美吉生物医药科技有限公司(上海)完成。
1.2.3 水体理化指标测定 在样本采集过程完成后,使用多参数水质检测仪对各养殖池塘的水温(WT)、酸碱度(pH)、溶解氧(DO)、总悬浮固体(TSS)进行现场测定。采用透明采水器采集表层水、中层水,现场混合后注入无菌水袋收集器(5 L)。采集后的水样冷藏保存于车载冰箱中,并在48 h内完成实验室分析。水样整个测定过程,参照GB 3838—2002《地表水环境质量标准》[10],氨氮![]() 总氮(TN)、总磷(TP)和高锰酸盐指数(CODMn)分别采用国家标准GB 11894—89、GB 7479—87、GB 11893—89、GB 11892—89规定的方法测定。
总氮(TN)、总磷(TP)和高锰酸盐指数(CODMn)分别采用国家标准GB 11894—89、GB 7479—87、GB 11893—89、GB 11892—89规定的方法测定。
试验数据均采用平均值±标准差(mean±S.D.)表示。将Illumina MiSeq测序得到的下机数据(RawData)进行处理得到Tags序列,选取Silvar数据库对比分析,检测并去除其中的嵌合体序列,得到优化序列。使用Qiime软件对OTUs列表进行差异性分析,生成不同分类水平(门、科、属)上的物种丰度表和物种分布图。以OTU为单位,利用Mothur软件进行α多样性指数的统计分析。使用SPSS软件进行空间上不同区域细菌多样性的单因素方差分析(one-way ANOVA)、细菌α多样性指数与环境参数之间的Pearson相关分析及箱型图的绘制,显著性差异设为0.05。
135个样品测序所得有效结果显示,平均每个样品获得6 913 723条原始序列,双端序列质控拼接后获得6 080 244条优化序列,优化序列碱基数目为2 517 985 078 bp,序列平均长度为414 bp,高质量数据占87.94%。所有样本均按最小序列数随机抽平以进行后续分析。以Coverage指数值为纵坐标绘制曲线,根据曲线是否达到平缓来判断本次测序数据量是否足够。Coverage曲线在达到一定数量后增长明显减缓,而在测序数量>2 000后达到平台期(图2),表明测序数据量足够大,可以较完整地反映样品中绝大多数的微生物信息,即测序数据量合理且足够覆盖所有类群。各样本Coverage指数(覆盖率)均大于98%,表明本研究样本库覆盖率高。因此,测序结果代表了样品中细菌的真实情况,得到的序列可用于后续分析。

图2 Coverage指数稀释性曲线
Fig.2 Coverage exponential dilution curve
α指数可用来比较分析不同站点间细菌群落的多样性与均匀度,对样品进行抽样处理,在97%相似度下进行多样性指数分析(表2)。本研究中各站位Shannon指数、Simpson指数、ACE指数、Chao1指数均取3个平行样本的平均值。结果表明,各站位OTU数量为204~1 301。各区域多样性指数箱型图如图3所示。Shannon指数为2.45~4.27,本研究区域内平均值为3.31。Simpson指数为0.03~0.23,平均值为0.10。Ace指数为146.52~564.34,均值为350.73。Chao1指数为140.07~573.17,平均值为353.23。其中,站点SR01(养殖四大家鱼)的Shannon指数、Simpson指数、Ace指数、Chao 1指数均为本研究最高值,这表明SR01的微生物群落丰富度高,且微生物多样性分布均匀;而NC06(草鱼、鳙混养)、SR12(工厂化养殖鳗鲡)等站点在细菌多样性层面表现较差。
表2 水体细菌的α多样性指数
Tab.2 Bacterial diversity indices in aquaculture water

Shannon indexSimpson indexAce indexChao1 index单养模式 monoculture(N=10)3.22±0.380.10±0.06310.63±85.82B309.28±83.75B混养模式 polyculture(N=35)3.33±0.400.10±0.06362.18±62.22A365.79±61.68A总计 total3.31±0.40.1±0.06350.73±71.14353.23±70.9
注:不同字母表示同一指标在不同养殖模式下有显著性差异(P<0.05)。
Note:Different letters indicate that the same index is significantly different under different farming modes (P<0.05).

。表示适度离群值;*表示极限离群值。
。 indicates mild outliers;* indicates extreme outliers.
图3 各区域多样性指数箱图
Fig.3 Box chart of diversity indices by region
从表2中可见,混养池塘的Shannon指数和Simpson指数均大于单养池塘,同时,混养组的Ace指数与Chao1指数也显著高于单养组(P<0.05)。使用单因素方差分析对本研究中江西省6个地级市(九江、南昌、上饶、抚州、吉安、宜春)区域采样池塘细菌的Shannon指数、Simpson指数、Ace指数、Chao1指数进行比较,研究结果表明,各细菌群落多样性指数在空间上不存在显著性差异(P>0.05)。
基于门水平分析研究范围内养殖池塘细菌群落结构组成。本研究中,放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、蓝细菌门(Cyanobacteria)平均相对丰度分别为47.12%、27.41%、7.89%和7.04%,未注释到的细菌类群仅占0.13%。将相对丰度>10%的菌门定义为该站点的优势菌门,放线菌门(相对丰度为19.80%~68.86%)在各站位均占据优势地位;变形菌门在除SR06(养殖四大家鱼)以外站点均占据优势地位(相对丰度为14.61%~59.97%)。此外,蓝细菌门、拟杆菌门也是多个站点的优势菌门,如蓝细菌门相对丰度在SR06高达36.38%、拟杆菌门相对丰度在FZ03(主养草鱼池塘)高达31.85%;厚壁菌门(Firmicutes)是JJ03(主养彭泽鲫)的优势菌门之一(相对丰度为11.24%)。此外,各站点内主要菌门(相对丰度>1%)还包括Patescibacteria(1.87%)、绿弯菌门(Chloroflexi,1.73%)、疣微菌门(Verrucomicrobiota,1.55%)和厚壁菌门(Firmicutes,1.22%)(图4)。
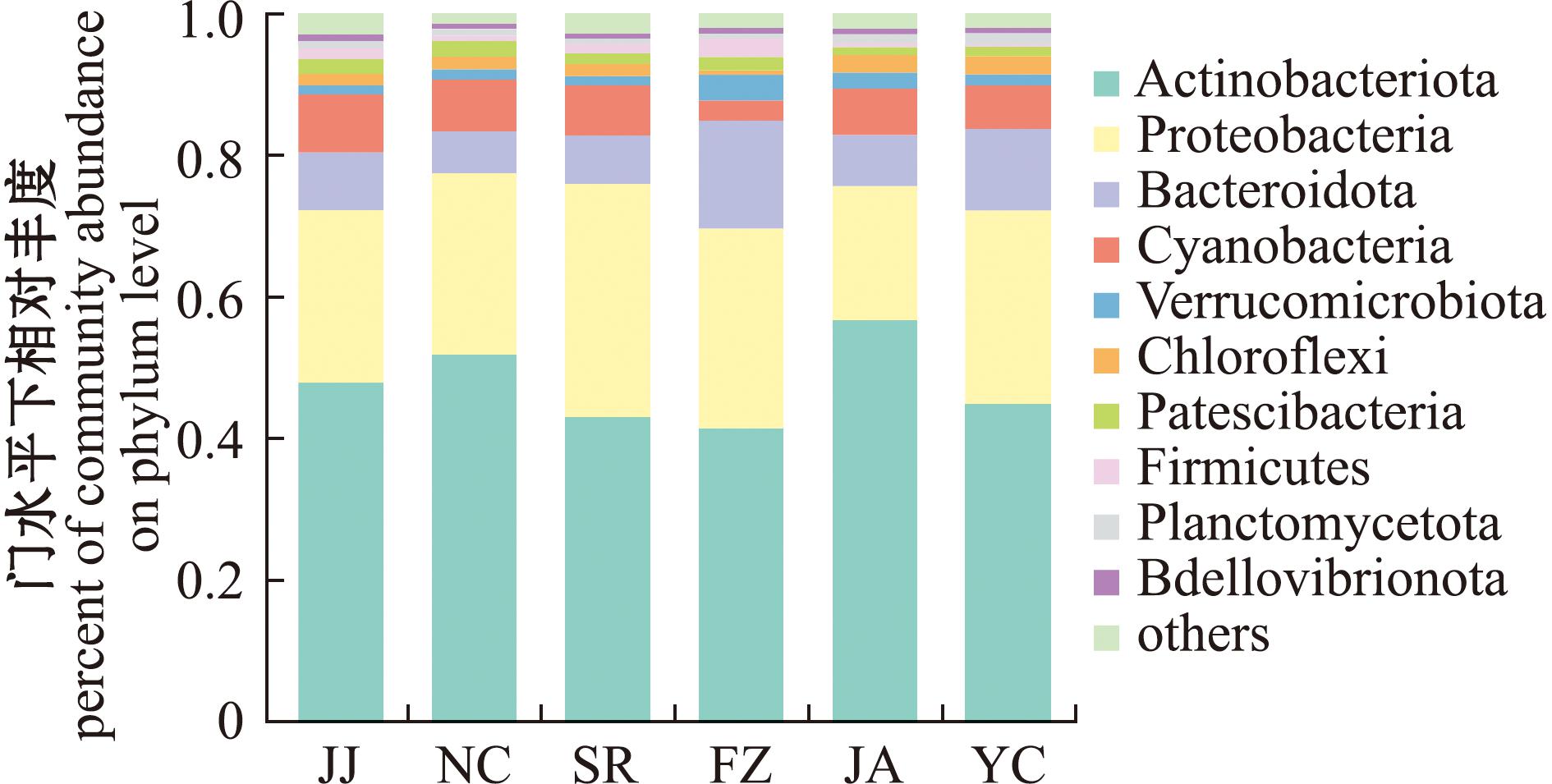
图4 门水平下各区域细菌相对丰度
Fig.4 Relative abundance of bacteria in each region on phylum level
不同区域细菌门类组成情况如图4,各组间细菌群落门类组成相似。放线菌门在九江组(47.65%)、南昌组(51.66%)、上饶组(42.86%)、抚州组(41.33%)、吉安组(56.64%)、宜春组(44.72%)均为优势门类;变形菌门在九江组(24.43%)、南昌组(25.64%)、上饶组(32.93%)、抚州组(28.24%)、吉安组(18.89%)、宜春组(27.33%)呈现优势;同时,拟杆菌门是抚州组(15.17%)、宜春组(11.60%)的优势门类,但在南昌组(6.05%)、上饶组(6.92%)、吉安组(7.21%)未构成优势;蓝细菌门在各组间的波动范围在2.82%~8.20%之间。
从科水平细菌柱状堆积图(图5)分析,各站点细菌群落结构存在更高的差异性与多样性,放线菌门的鱼孢菌科(Sporichthyaceae)、Ilumatobacteraceae、分枝杆菌科(Mycobacteriaceae)、蓝细菌门的Cyanobiaceae、变形菌门的丛毛单胞菌科(Comamonadaceae)、根瘤菌科(Rhizobiales_Incertae_Sedis)和伯克氏菌科(Burkholderiaceae)是本研究中的优势类群,在各点位中优势状况各异。FZ03(草鱼)具有相对独特的群落结构,其Sporichthyaceae相对丰度较低,而norank_o_PeM15与噬几丁质菌科(Chitinophagaceae)为该站点相对丰度最高的菌科。SR01(四大家鱼)和SR12(鳗鲡)同样存在相似的状况,其Sporichthyaceae相对丰度仅为3.74%、3.41%,Ilumatobacteraceae、Rhizobiales_Incertae_Sedis分别为SR01和SR12的优势类群。

图5 科水平下各站点细菌相对丰度
Fig.5 Relative abundance of bacteria in each sampling plot in family level
江西各区域养殖水体细菌门类中,HgcI_Clade、CL500-29_marine_group、Cyanobium_PCC-6307、Mycobacterium及unclassified_f_Comamonadaceae等是本研究的主要菌属。其中,九江组的主要种群为HgcI_Clade(20.17%),CL500-29_marine_group(11.87%)次之;南昌组的主要种群为HgcI_Clade(23.65%)和CL500-29_marine_group(11.40%);上饶组的主要种群为HgcI_Clade(16.92%);HgcI_Clade(23.65%)、norank_f_norank_o_PeM15(10.29%)是抚州组的主要种群;吉安组的主要种群为HgcI_Clade(23.95%)、CL500-29_marine_group(15.18%);宜春组的主要种群为HgcI_Clade(24.79%)。
从表3可见,各池塘水温在20.4~31.2 ℃,平均值为29.85 ℃;pH为6.26~9.66,平均值为![]() 平均值分别为6.59、0.96、2.93 mg/L;TP为0.02~1.47 mg/L,平均值为0.27 mg/L;TSS、CODMn分别为1.00~158.00、1.11~30.12 mg/L,平均值分别为41.84、7.79 mg/L。
平均值分别为6.59、0.96、2.93 mg/L;TP为0.02~1.47 mg/L,平均值为0.27 mg/L;TSS、CODMn分别为1.00~158.00、1.11~30.12 mg/L,平均值分别为41.84、7.79 mg/L。
表3 环境因子平均值及其与α多样性指数的相关性
Tab.3 Mean value of environmental factors and the Pearson correlation with α diversity indices
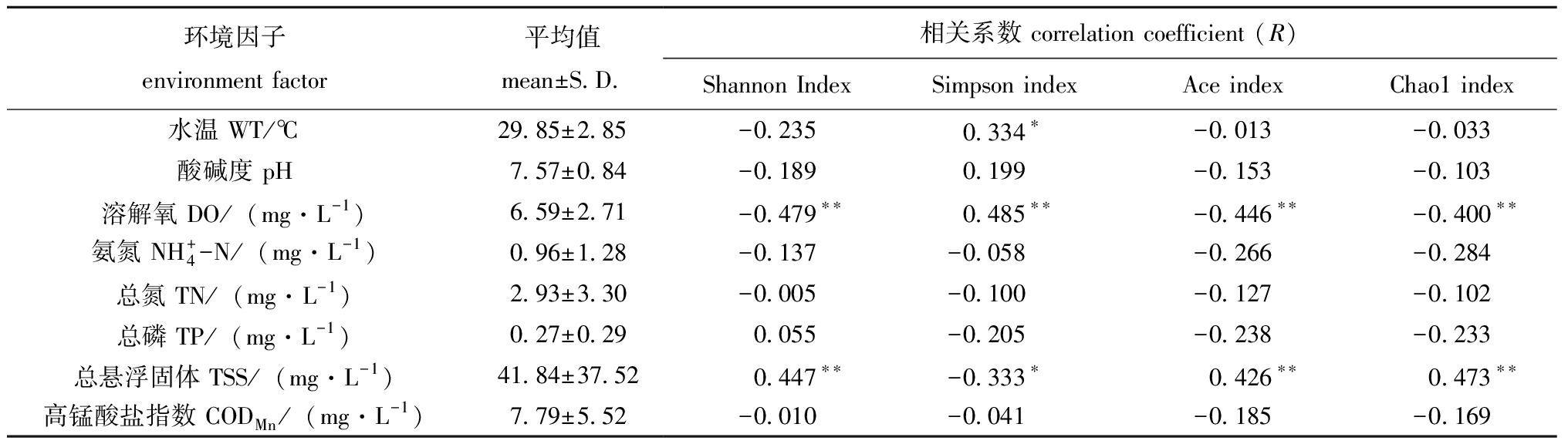
环境因子environment factor平均值mean±S.D.相关系数 correlation coefficient (R)Shannon Index Simpson index Ace indexChao1 index水温 WT/℃29.85±2.85-0.2350.334∗-0.013-0.033酸碱度 pH7.57±0.84-0.1890.199-0.153-0.103溶解氧 DO/(mg·L-1)6.59±2.71-0.479∗∗0.485∗∗-0.446∗∗-0.400∗∗氨氮 NH+4-N/(mg·L-1)0.96±1.28-0.137-0.058-0.266-0.284总氮 TN/(mg·L-1)2.93±3.30-0.005-0.100-0.127-0.102总磷 TP/(mg·L-1)0.27±0.290.055-0.205-0.238-0.233总悬浮固体 TSS/(mg·L-1)41.84±37.520.447∗∗-0.333∗0.426∗∗0.473∗∗高锰酸盐指数 CODMn/(mg·L-1)7.79±5.52-0.010-0.041-0.185-0.169
注:*表示显著相关(P<0.05);**表示极显著相关(P<0.01)。
Note:* indicates significant correlation (P<0.05);** indicates very significant correlation (P<0.01).
在进行Pearson相关分析之前,对选取的环境数据进行共线性检验,结果表明,各环境因子间的VIF值为1.16~2.59(VIF在0~10范围内则表示共线性不显著)。各养殖池塘α多样性指标与环境因子的Pearson相关性分析结果如表3所示。其中,水温与Simpson指数呈显著正相关(P<0.05);溶解氧与Shannon指数、Ace指数、Chao1指数呈极显著负相关(P<0.01),与Simpson指数呈极显著正相关(P<0.01);总悬浮固体与Shannon指数、Ace指数、Chao1指数呈极显著正相关(P<0.01),与Simpson指数呈显著负相关(P<0.05)。由此可以得出,DO、TSS是影响江西养殖水体的主要环境因子。
本研究中相对丰度前20的菌属与环境因子的Spearman相关分析结果如图6所示。其中,主要菌属HgcI_Clade与WT呈极显著正相关(P<0.01),与TN呈极显著负相关(P<0.01);CL500-29_marine_group与WT、pH、TSS呈显著或极显著正相关(P<0.05或P<0.01),与TP和CODMn呈显著或极显著负相关(P<0.05或P<0.01);Cyanobium_PCC-6307与TN、TP、TSS、CODMn呈极显著负相关(P<0.01);分枝杆菌属(Mycobacterium)与![]() 呈极显著正相关(P<0.01或P<0.01);丛毛单胞菌科未分类属(unclassified_f_Comamonadaceae)与WT、TN呈极显著负相关(P<0.01或P<0.01)。此外,Alsobacter与TN、TP呈极显著正相关(P<0.001);Limnohabitans与WT间呈极显著负相关(P<0.001)。
呈极显著正相关(P<0.01或P<0.01);丛毛单胞菌科未分类属(unclassified_f_Comamonadaceae)与WT、TN呈极显著负相关(P<0.01或P<0.01)。此外,Alsobacter与TN、TP呈极显著正相关(P<0.001);Limnohabitans与WT间呈极显著负相关(P<0.001)。
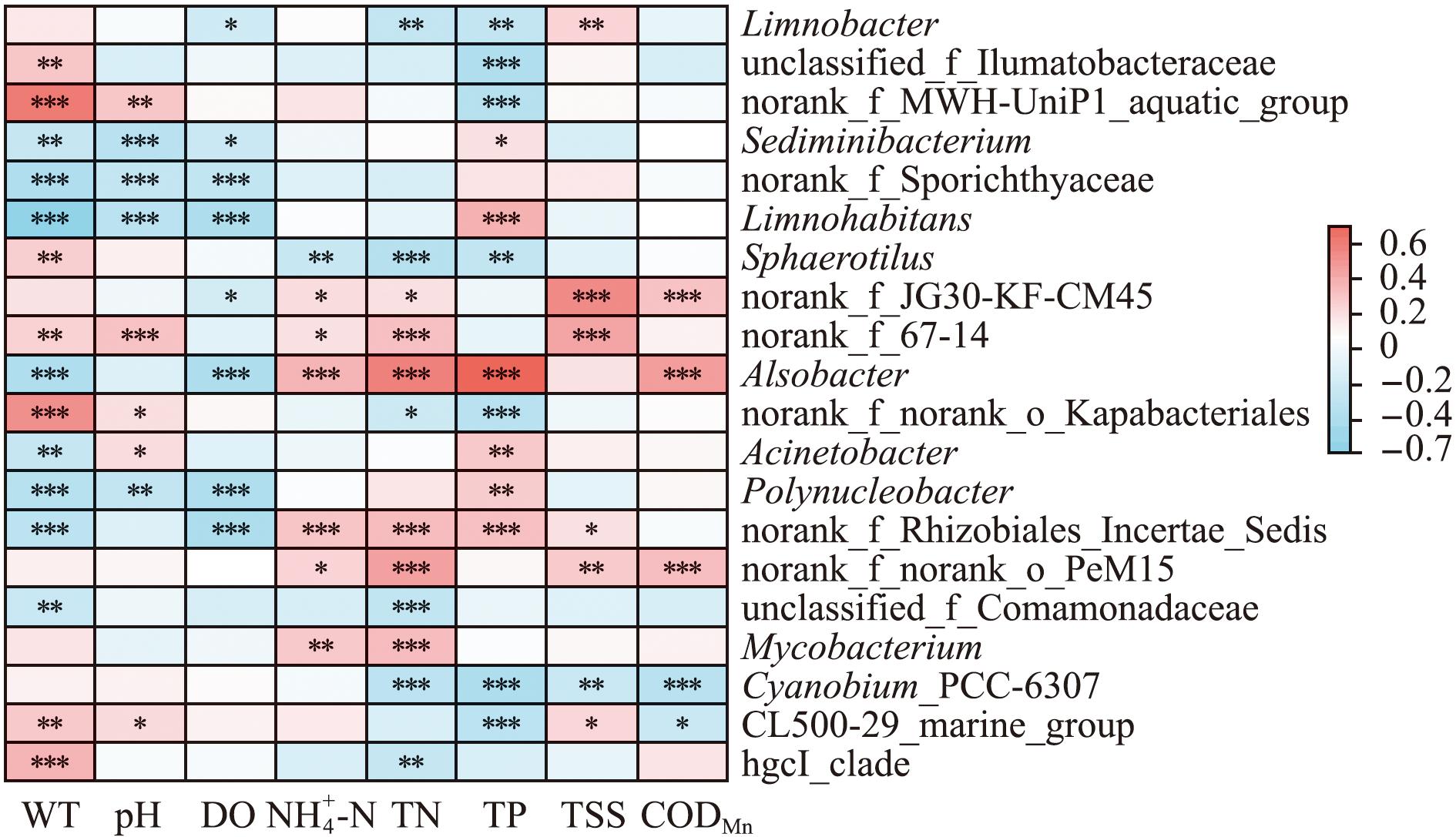
*,**,***分别表示在0.05、0.01、0.001水平上显著相关。
*,**,***denotes significantly correlated at the level of 0.05,0.01,and 0.001,respectively.
图6 属水平优势菌属与环境因子的Spearman相关分析
Fig.6 Spearman correlation analysis of dominant bacterial genus and environmental factors
本研究中采用Illumina MiSeq高通量测序技术对江西省鄱阳湖周边及中部地区多个养殖水体的细菌多样性进行了分析,获得了6 080 244个优化序列,测序数据量合理,基本覆盖所有分类群。研究发现,研究范围内优势细菌群落由放线菌门、变形菌门、蓝细菌门、拟杆菌门和厚壁菌门等门类组成,这与前人对研究范围内自然水体(赣江南昌段、鄱阳湖流域湖口、南昌市湖泊)浮游细菌群落的研究结果基本一致[11-13],表明研究范围内养殖水体细菌群落由典型的淡水细菌门类组成[14],同时,单因素方差分析结果表明,本研究中细菌群落多样性在空间上不存在显著性差异,这可能是由于江西省内有许多河流纵横交错,与山塘、水库、池塘等具有较强的连通性,自然水体和养殖水体之间的联系增加了细菌的传播速度[15],因此,本研究区域内、研究区域与自然水体间生态系统组成具有高相似性。
变形菌门包含绝大多数反硝化功能菌群,与拟杆菌门参与脱氮除磷过程,对有机物的降解具有重要的作用[16]。厚壁菌门则参与废水中废物厌氧处理的过程,水体中厚壁菌门的相对丰度越高,污染程度越严重[17],因此可以指示水体是否面临污染胁迫。国内研究表明,上海市某草鱼混养池塘厚壁菌门相对丰度高达23.42%[18];茅尾海海域、小东江流域厚壁菌门相对丰度分别为17.34%、9.41%[19-20],而本研究中厚壁菌门平均相对丰度为1.22%,处于较低水平。以上结果表明,本研究区域内的养殖池塘受污染程度小。CL500-29_marine_group、HgcI_Clade、分枝杆菌属在几乎所有站点都占据强烈的优势地位,区域内各组间菌属组成高度重合。同时,本研究中也发现一定占比的丛毛单胞菌(Comamonadaceae)、Sediminibacterium属等,表型特征为严格好氧或兼性厌氧。丛毛单胞菌作为反硝化菌,能有效净化养殖池塘的水质[21];而Sediminibacterium能够在好氧条件下降解和去除有机碳,在环境污染的处理中具有较大的潜力[22]。本研究池塘的细菌群落结构具有简单的优势菌群组成,通过调控优势菌群来管理养殖水体的细菌群落结构,有利于生态健康高效养殖[23]。
α多样性指数可以反映细菌群落的丰富度和多样性,Chao1指数越高,细菌群落丰富度越高,Shannon指数越高,细菌群落的多样性越好。本研究中各采样点Chao1指数为140.07~573.17、Shannon指数均值为2.45~4.27,混养模式多样性指数值高于单养模式。这与肖述文等[18]对草鱼混养池塘细菌多样性的研究、侯婷婷等[24]对健康青石斑鱼养殖水体细菌多样性的研究结果相类似。近年来,混养模式被广泛应用,该模式通过调节不同生态位的鱼类比例,充分利用生态系统内的空间和资源,从而提高了营养物质的利用率与养殖效益[25]。在本研究中,混养池塘菌群丰富度与多样性高于单养池塘,这也印证了袁新程等[26]研究得出混养模式相比较单养模式,其养殖水体水质更为稳定的结论。细菌在元素循环、污染物降解和水体自净化中起着关键作用,养殖环境中细菌群落多样性高,更有利于水体稳定,减少疾病暴发[9,27]。因此,研究区域内养殖水体可通过适当增氧[28]、提高循环率[29]、增加养殖鱼类种类[30]等措施提高养殖水体细菌多样性,实现高效养殖。
池塘养殖是中国最普遍的传统养殖方式之一,但高密度养殖模式易造成尾水中营养盐超标,有机负荷过高,若排入自然水体,则对水体生态环境造成严重污染,进而影响水产养殖业的持续健康发展。pH是反映水环境生态平衡的综合指标,是水体物理化学反应的重要条件[31],CODMn含量高低与养殖池塘中的有机营养成分含量密切相关,可以准确反映养殖池塘中溶解的有机质、有机碎屑和浮游生物尸体等情况[32]。本研究中,营养盐指标![]() 及pH、CODMn等多种理化指标与HgcI_Clade、CL500-29_marine_group、分枝杆菌属、Rhizobiales_Incertae_Sedis等优势菌属具有显著的相关关系,表明多种环境因素均具有改变水体微生物群落结构的潜能。Pearson分析结果表明,水体的TSS、DO与细菌α多样性相关性最强。悬浮物是微生物的隐蔽载体,为其提供生存空间与营养能源。在营养浓度低的养殖环境中,随营养水平的逐渐升高,微生物由于营养物质等生存条件的改变多样性会增加,反之则形成“多样性反转”[33]。本研究中,TSS平均值为41.84 mg/L,88.89%的养殖池塘符合淡水养殖尾水Ⅱ级排放标准(≤100 mg/L),TSS浓度与细菌α多样性呈正相关关系,这表明研究池塘水体营养负荷低、养殖生态系统健康。DO浓度会影响水体中细菌群落结构,因为缺乏抗氧化酶的需氧菌生长发育时需要氧气,而厌氧细菌则在缺氧或低氧时能通过厌氧呼吸、发酵等途径生存[34]。本研究中,DO与细菌α多样性呈显著负相关关系,这表明研究池塘大多未达到最适宜的氧气水平,其中,有40%的研究池塘中未达到地表水质量标准Ⅲ类水要求(≥5.0 mg/L),与上述结果互相印证。因此,养殖池塘需维持适宜的DO浓度,调节细菌群落的结构,以实现水体生态系统的正常功能。
及pH、CODMn等多种理化指标与HgcI_Clade、CL500-29_marine_group、分枝杆菌属、Rhizobiales_Incertae_Sedis等优势菌属具有显著的相关关系,表明多种环境因素均具有改变水体微生物群落结构的潜能。Pearson分析结果表明,水体的TSS、DO与细菌α多样性相关性最强。悬浮物是微生物的隐蔽载体,为其提供生存空间与营养能源。在营养浓度低的养殖环境中,随营养水平的逐渐升高,微生物由于营养物质等生存条件的改变多样性会增加,反之则形成“多样性反转”[33]。本研究中,TSS平均值为41.84 mg/L,88.89%的养殖池塘符合淡水养殖尾水Ⅱ级排放标准(≤100 mg/L),TSS浓度与细菌α多样性呈正相关关系,这表明研究池塘水体营养负荷低、养殖生态系统健康。DO浓度会影响水体中细菌群落结构,因为缺乏抗氧化酶的需氧菌生长发育时需要氧气,而厌氧细菌则在缺氧或低氧时能通过厌氧呼吸、发酵等途径生存[34]。本研究中,DO与细菌α多样性呈显著负相关关系,这表明研究池塘大多未达到最适宜的氧气水平,其中,有40%的研究池塘中未达到地表水质量标准Ⅲ类水要求(≥5.0 mg/L),与上述结果互相印证。因此,养殖池塘需维持适宜的DO浓度,调节细菌群落的结构,以实现水体生态系统的正常功能。
1)江西养殖水体具有丰富的细菌群落组成,主要门类为放线菌门、变形菌门、拟杆菌门等,优势类群为HgcI_Clade、CL500-29_marine_group、Cyanobium_PCC-6307等。
2)空间上,各组细菌群落多样性不存在显著性差异。而不同养殖模式间,混养池塘4种多样性指数均表现出较高的细菌多样性与丰富度。
3)江西养殖水体细菌多样性的主要环境影响因子为DO、TSS。
[1] 刘尊雷,张寒野,袁兴伟,等.基于遥感影像的江西省水体资源和水产养殖结构空间异质性分析[J].自然资源学报,2018,33(10):1833-1846.
LIU Z L,ZHANG H Y,YUAN X W,et al.Spatial heterogeneity of water resource and aquaculture structure in Jiangxi Province based on remote sensing image[J].Journal of Natural Resources,2018,33(10):1833-1846.(in Chinese)
[2] 陈亮东,江达均,关歆,等.华南地区尾水治理设施养殖场水质综合评价[J].淡水渔业,2023,53(4):106-112.
CHEN L D,JIANG D J,GUAN X,et al.Comprehensive water quality evaluation of the aquaculture wastewater treatment system in South China[J].Freshwater Fisheries,2023,53(4):106-112.(in Chinese)
[3] 刘梅,原居林,倪蒙,等.“三池两坝” 多级组合工艺对内陆池塘养殖尾水的处理[J].环境工程技术学报,2021,11(1):97-106.
LIU M,YUAN J L,NI M,et al.Treatment of inland pond aquaculture tail water by multi-stage combined process of “three ponds and two dams”[J].Journal of Environmental Engineering Technology,2021,11(1):97-106.(in Chinese)
[4] 高娜,杨坤,方婷,等.龟鳖废水处理系统中细菌群落组成及动态变化[J].淡水渔业,2022,52(1):96-102.
GAO N,YANG K,FANG T,et al.Microbial community structure and dynamics in turtle wastewater treatment system[J].Freshwater Fisheries,2022,52(1):96-102.(in Chinese)
[5] 杨天燕,孟玮,高攀,等.基于高通量测序的鱼菜共生池塘与普通池塘微生物群落结构比较[J].水生生物学报,2019,43(5):1104-1113.
YANG T Y,MENG W,GAO P,et al.Bacterial community structure in aquaponics pond and common pond based on high-throughput sequencing technology[J].Acta Hydrobiologica Sinica,2019,43(5):1104-1113.(in Chinese)
[6] 刘开朗,王加启,卜登攀,等.环境微生物群落结构与功能多样性研究方法[J].生态学报,2010,30(4):1074-1080.
LIU K L,WANG J Q,BU D P,et al.Current progress in approaches to the study of structure and function diversities of environmental microbial communities[J].Acta Ecologica Sinica,2010,30(4):1074-1080.(in Chinese)
[7] LIU L,LI T Y,WEI X H,et al.Effects of a nutrient additive on the density of functional bacteria and the microbial community structure of bioorganic fertilizer[J].Bioresource Technology,2014,172:328-334.
[8] CAPORASO J G,LAUBER C L,WALTERS W A,et al.Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J].The ISME Journal,2012,6(8):1621-1624.
[9] 王振毅,张俊彬.金钱鱼循环水养殖系统水体细菌的多样性[J].湖南农业大学学报(自然科学版),2018,44(4):418-423.
WANG Z Y,ZHANG J B.The bacterial diversity in spotted scat rearing water generated by recirculating aquaculture system[J].Journal of Hunan Agricultural University (Natural Sciences Edition),2018,44(4):418-423.(in Chinese)
[10] 国家环境保护总局,国家质量监督检验检疫总局.地表水环境质量标准:GB 3838—2002[S].北京:中国环境科学出版社,2002.
State Environmental Protection Administration of the People’s Republic of China,General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China.Environmental quality standards for surface water:GB 3838—2002[S].Beijing:China Environmental Science Press,2002.(in Chinese)
[11] 王鹏,陈波,李传琼,等.赣江南昌段丰水期细菌群落特征[J].中国环境科学,2016,36(8):2453-2462.
WANG P,CHEN B,LI C Q,et al.Bacterial communities in Nanchang section of the Ganjiang River in wet seaon[J].China Environmental Science,2016,36(8):2453-2462.(in Chinese)
[12] 褚奇奇,徐广昌,黄晶,等.鄱阳湖流域河湖口微生物多样性研究[J].江西农业学报,2022,34(11):138-142,148.
CHU Q Q,XU G C,HUANG J,et al.Study on microbial diversity in estuary of Poyang Lake basin[J].Acta Agriculturae Jiangxi,2022,34(11):138-142,148.(in Chinese)
[13] 高鹏飞,王鹏,黄祎,等.南昌市湖泊丰水期浮游细菌群落结构及影响因素[J].环境科学,2023,44(3):1475-1483.
GAO P F,WANG P,HUANG Y,et al.Bacterioplankton communities and assembly mechanisms in wet season of lakes,Nanchang[J].Environmental Science,2023,44(3):1475-1483.(in Chinese)
[14] 任丽娟,何聃,邢鹏,等.湖泊水体细菌多样性及其生态功能研究进展[J].生物多样性,2013,21(4):422-433.
REN L J,HE D,XING P,et al.Bacterial diversity and ecological function in lake water bodies[J].Biodiversity Science,2013,21(4):422-433.(in Chinese)
[15] MARTINY JB,BOHANNAN B J M,BROWN J H,et al.Microbial biogeography:putting microorganisms on the map[J].Nature Reviews Microbiology,2006,4(2):102-112.
[16] YANG C,ZHANG W,LIU R H,et al.Phylogenetic diversity and metabolic potential of activated sludge microbial communities in full-scale wastewater treatment plants[J].Environmental Science &Technology,2011,45(17):7408-7415.
[17] 吴晓冰,叶飞,姜毅,等.长江干流浮游细菌群落结构及影响因素[J].长江流域资源与环境,2019,28(7):1652-1662.
WU X B,YE F,JIANG Y,et al.Bacterioplankton community structure in the mainstream of Yangtze River and driving factors[J].Resources and Environment in the Yangtze Basin,2019,28(7):1652-1662.(in Chinese)
[18] 肖述文,刘兴国,陆诗敏,等.草鱼单养和混养池塘的水质与生物组成特征[J].水生态学杂志,2023,44(6):79-87.
XIAO S W,LIU X G,LU S M,et al.Water quality and bio-composition in a monoculture and polyculture grass carp pond[J].Journal of Hydroecology,2023,44(6):79-87.(in Chinese)
[19] 廖能健,赵华显,杨恕,等.广西北部湾茅尾海夏冬季浮游细菌群落结构及其影响因子[J].生态学报,2023,43(19):8109-8121.
LIAO N J,ZHAO H X,YANG S,et al.Community structure and influencing factors of planktonic bacteria across summer and winter in the Maowei Sea of Beibu Gulf,Guangxi[J].Acta Ecologica Sinica,2023,43(19):8109-8121.(in Chinese)
[20] 江超,李玉娟,张之怡,等.资兴小东江流域细菌多样性分析[J].湘南学院学报,2022,43(5):19-23.
JIANG C,LI Y J,ZHANG Z Y,et al.Analysis of bacterial diversity in Xiao Dong Jiang River Basin in Zixing[J].Journal of Xiangnan University,2022,43(5):19-23.(in Chinese)
[21] 张弘杰,徐慧敏,过梓栩,等.水产养殖不同物种对水体和沉积物中细菌群落的影响[J].生态学报,2022,42(8):3254-3266.
ZHANG H J,XU H M,GUO Z X,et al.Effects of different aquacultural species on planktonic and sedimental bacterial communities[J].Acta Ecologica Sinica,2022,42(8):3254-3266.(in Chinese)
[22] 宋雅丽.橘红海生杆菌SYL130T的多相分类学鉴定[D].武汉:华中农业大学,2018.
SONG Y L.The polyphasic taxonomic studies of Sediminibacterium roseum SYL130T[D].Wuhan:Huazhong Agricultural University,2018.(in Chinese)
[23] 彭飞,周彦锋,王晨赫,等.2019年春季淮河中下游水体微生物的空间异质性[J].大连海洋大学学报,2022,37(5):830-840.
PENG F,ZHOU Y F,WANG C H,et al.Spatial differences in water microorganisms in middle and lower reaches of the Huaihe River in spring 2019[J].Journal of Dalian Ocean University,2022,37(5):830-840.(in Chinese)
[24] 侯婷婷,钟志平,刘缨,等.青石斑鱼海水循环水养殖水体的细菌群落特征[J].微生物学报,2016,56(2):253-263.
HOU T T,ZHONG Z P,LIU Y,et al.Bacterial community characterization of rearing water of marine recirculating aquaculture systems for yellow grouper (Epinephelus awoara)[J].Acta Microbiologica Sinica,2016,56(2):253-263.(in Chinese)
[25] 刘璐,李学梅,吴兴兵,等.青鱼-鳙生态混养池塘的氮磷收支研究[J].淡水渔业,2021,51(6):63-69.
LIU L,LI X M,WU X B,et al.Nitrogen and phosphorus budgets of Mylopharyngodon piceus and Aristichthys nobilis ecological polyculture pond[J].Freshwater Fisheries,2021,51(6):63-69.(in Chinese)
[26] 袁新程,谢永德,施永海,等.草鱼3种池塘养殖模式水质因子及养殖效益的比较分析[J].渔业现代化,2021,48(6):28-35.
YUAN X C,XIE Y D,SHI Y H,et al.Comparative analysis of water quality factors and cultural benefit in three aquaculture modes of Ctenopharyngodon idella[J].Fishery Modernization,2021,48(6):28-35.(in Chinese)
[27] 杨艳,王浩,李凯航,等.长江三峡上游水域细菌群落结构与功能预测[J].微生物学报,2022,62(4):1401-1415.
YANG Y,WANG H,LI K H,et al.Community structure and function predication of bacterial communities in the upper reaches of the Three Gorges of the Yangtze River[J].Acta Microbiologica Sinica,2022,62(4):1401-1415.(in Chinese)
[28] HUMAYOUN S B,BANO N,HOLLIBAUGH JT.Depth distribution of microbial diversity in Mono Lake,a meromictic soda lake in California[J].Applied and Environmental Microbiology,2003,69(2):1030-1042.
[29] 李卢国,骆云慧,徐善良.循环水养殖黑鲷(Acanthopagrus schlegelii)水体中循环率对水质因子和细菌群落多样性的影响[J].海洋与湖沼,2020,51(2):318-327.
LI L G,LUO Y H,XU S L.Effects of flow rate on water quality factors and microbial community in recirculating aquaculture system for Acanthopagrus schlegelii[J].Oceanologia et Limnologia Sinica,2020,51(2):318-327.(in Chinese)
[30] 李革雷,陈昌福,高宇,等.3种养殖模式水体中细菌多样性研究[J].华中农业大学学报,2012,31(3):381-390.
LI G L,CHEN C F,GAO Y,et al.Biodiversity of aquatic microbial communities in three aquacultural systems[J].Journal of Huazhong Agricultural University,2012,31(3):381-390.(in Chinese)
[31] 杨坤,胡星明,卢文轩.巢湖流域水产养殖尾水水质分析与评价[J].生物学杂志,2023,40(1):85-90.
YANG K,HU X M,LU W X.Analysis and evaluation of water quality of aquaculture tail water of Chaohu Lake Basin[J].Journal of Biology,2023,40(1):85-90.(in Chinese)
[32] 刘海春,刘志国,董学洪.罗氏沼虾养殖池塘水质变化规律研究[J].江苏农业科学,2011,39(6):397-399.
LIU H C,LIU Z G,DONG X H.Study on the change law of water quality in Macrobrachium rosenbergii culture pond[J].Jiangsu Agricultural Sciences,2011,39(6):397-399.(in Chinese)
[33] 刘晶晶,曾江宁,陈全震,等.象山港网箱养殖区水体和沉积物的细菌生态分布[J].生态学报,2010,20(2):377-388.
LIU J J,ZENG J N,CHEN Q Z,et al.The bacterial ecological distribution in water and sediment of cage culture area in Xiangshangang Bay[J].Acta Ecologica Sinica,2010,20(2):377-388.(in Chinese)
[34] WU J,YANG H,PANCOST R D,et al.Variations in dissolved O2 in a Chinese lake drive changes in microbial communities and impact sedimentary GDGT distributions[J].Chemical Geology,2021,579:120348.