尼罗罗非鱼(Oreochromis niloticus)属慈鲷科,亚热带鱼类,该鱼因产量大、成熟期短、易饲养等特点逐渐成为中国主要水产养殖品种[1]。然而,随着罗非鱼养殖规模的扩大,病害发生也日渐频繁,严重影响了罗非鱼养殖产业的发展。因此研究罗非鱼的抗病免疫能力具有重要的现实意义,有助于罗非鱼养殖业的健康可持续发展。S100蛋白是脊椎动物中广泛表达的Ca2+结合蛋白家族,该蛋白家族包含25个成员,具有高度的序列和结构相似度,且参与细胞凋亡、增殖和炎症等生理过程[2]。在哺乳动物研究中发现,S100P蛋白表达变化与多种肿瘤发生有着密切联系,尤其与胰腺癌[3]、结直肠癌[4]及胃癌[5]等癌症发生过程具有紧密关联,研究中还发现,该蛋白表达水平随着肿瘤的发生而逐渐升高。S100P可以与Ca2+周期结合蛋白(CacyBP/SIP)、晚期糖基化终末产物(PAGE)、S100P结合蛋白(S100PBPR)结合,随后与Ca2+结合后参加细胞的信号转导,导致细胞异常增生,促进肿瘤生成[6]。此外,S100P能够调节人体多种免疫相关分子的表达,如促炎性因子IL-6、TNF-α、IL-1β及趋化因子CXCL8等,从而增强炎症反应和免疫细胞的吞噬作用[7]。S100P还可作为抗原呈递细胞(APC)的活化分子,激活和诱导细胞免疫应答,增强T细胞及自然杀伤细胞(NK细胞)的杀伤活性[8]。而异常激活的S100P可通过抑制IL-12的生成抑制T细胞细胞毒性,同时也可能通过阻碍树突状细胞的成熟而损害免疫细胞的部分功能[9]。目前有关S100P的研究主要集中在哺乳动物,鱼类中S100P的功能研究尚未见报道。本研究中通过PCR扩增获得罗非鱼OnS100P基因的蛋白编码区,研究其序列特征及该基因的组织分布,以及在Poly (I∶C)刺激后的表达模式,随后构建了OnS100P的原核表达载体,并转入大肠杆菌(E.coli) BL21中,经诱导表达和条件优化,制备OnS100P重组蛋白(rOnS100P),利用该蛋白孵育头肾淋巴细胞后检测炎症因子的表达,以期更进一步探究S100P基因在罗非鱼免疫调控中的作用。
1 材料与方法
1.1 材料
试验用罗非鱼购自广东省湛江市某养殖场。
载体和试剂:pGEX-4T-1载体、pMDTM 19-T克隆载体、Ex Taq DNA聚合酶、限制性核酸内切酶BamH Ⅰ和Xho Ⅰ、T4DNA连接酶等(以上均购自TaKaRa公司);感受态细胞(DH5α)、BL21(DE3)、质粒提取试剂盒、胶回收试剂盒、TransZol Up Plus RNA Kit试剂盒、逆转录试剂盒、实时荧光定量试剂盒、SDS-PAGE凝胶制备试剂盒(购自陕西中晖赫彩生物医药科技有限公司);PBS缓冲液、小鼠抗GST-tag单克隆抗体、HRP标记山羊抗小鼠IgG(H+L)及蛋白提取纯化试剂盒等(购自上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 引物设计与合成 根据NCBI网站公布的罗非鱼转录组数据得到罗非鱼OnS100P基因的序列信息,设计该基因正、反向以及荧光定量引物(表1)。
表1 试验用引物
Tab.1 Primers used in the assay
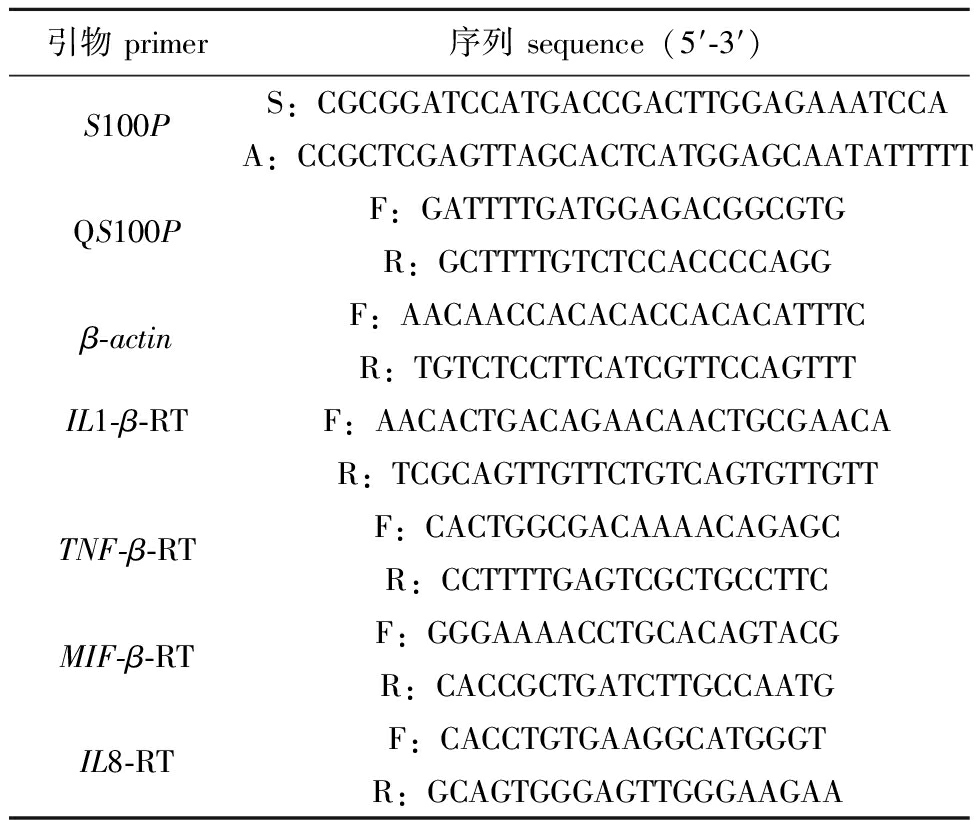
引物 primer序列 sequence(5′-3′)S100PS:CGCGGATCCATGACCGACTTGGAGAAATCCAA:CCGCTCGAGTTAGCACTCATGGAGCAATATTTTTQS100PF:GATTTTGATGGAGACGGCGTGR:GCTTTTGTCTCCACCCCAGGβ-actinF:AACAACCACACACCACACATTTCR:TGTCTCCTTCATCGTTCCAGTTTIL1-β-RTF:AACACTGACAGAACAACTGCGAACAR:TCGCAGTTGTTCTGTCAGTGTTGTTTNF-β-RTF:CACTGGCGACAAAACAGAGCR:CCTTTTGAGTCGCTGCCTTCMIF-β-RTF:GGGAAAACCTGCACAGTACGR:CACCGCTGATCTTGCCAATGIL8-RTF:CACCTGTGAAGGCATGGGTR:GCAGTGGGAGTTGGGAAGAA
1.2.2组织RNA提取及cDNA反转录 根据TransZol Up Plus RNA Kit 试剂盒说明书提取总 RNA。提取完成后取1 μL RNA采用琼脂糖凝胶电泳(浓度为1.2%)检测其完整性。
根据反转录试剂盒说明书,在42 ℃下反应15 min,85 ℃下作用5 s,将罗非鱼总RNA反转录为cDNA,置于-20 ℃冰箱保存待用。
1.2.3 OnS100P组织表达分析 在无菌条件下,取尼罗罗非鱼肝脏、肠道、血液、头肾、肌肉和鳃等8个组织,方法同“1.2.2节”。以β-actin为内参基因,通过RT-qPCR法利用荧光定量引物QS100P-F,QS100P-R(表1)检测各个组织中OnS100P基因的表达情况。对每份样品的OnS100P和β-actin的表达量进行检测,所有数值均为平均值±标准差(mean±S.D.);n=3,设定脑的表达量为1,采用 2 -ΔΔCt 法计算相对基因表达量。
1.2.4 Poly (I∶C)刺激后OnS100P表达分析 选取饲养中的罗非鱼,肌肉注射0.1 mL浓度为1 mg/mL[10]的Poly (I∶C),分别在Poly (I∶C)刺激0、6、12、24、48 h后采集头肾、肠道和脑3个组织样品,置于RNA later中,冻存于-80 ℃超低温冰箱备用,后续按照“1.2.2节”方法,进行RNA提取及cDNA合成。随后进行RT-qPCR检测,对每个样本的OnS100P和β-actin表达量进行检测,每个样本设置3个重复。
1.2.5 OnS100P原核表达载体构建 按照Ex Taq DNA聚合酶说明书进行OnS100P基因的克隆,在PCR管中分别加入Ex Taq DNA聚合酶、无菌水、上下游引物及cDNA模板,设置PCR体系为20 μL,扩增OnS100P基因的蛋白编码区。
将扩增得到的目的基因片段纯化后与pMDTM 19-T载体相连,连接目的产物命名为pMDTM 19-OnS100P。参考全式金基因生物有限公司感受态细胞使用说明书,将连接过夜的pMDTM 19-OnS100P转入DH5α感受态细胞中,经过无抗性的LB培养基培养1 h后涂布在含有氨苄青霉素的平板上,置于37 ℃培养箱中培养过夜,随后挑取合适的阳性克隆菌斑进行PCR检测,鉴定成功后将pMDTM 19-OnS100P重组质粒阳性克隆送往广州生工公司进行测序。将重组克隆载体pMDTM 19-OnS100P和pGEX-4T-1同时使用BamH Ⅰ、Xho Ⅰ进行双酶切,分别进行纯化,纯化后命名为BamH Ⅰ-OnS100P-Xho Ⅰ和BamH Ⅰ-pGEX-4T-1-Xho Ⅰ。随后将这两个双酶切纯化产物,利用T4DNA连接酶在4 ℃条件下连接过夜,连接成功的产物命名为pGEX-4T-OnS100P。然后再按照上述感受态细胞转化步骤,将pGEX-4T-OnS100P连接产物转至 BL21,挑取阳性克隆送往广州生工公司进行测序。将测序结果正确的BL21感受态细胞保种备用。
1.2.6 重组蛋白诱导表达条件优化 将“1.2.5节”中获得的E.coli BL21接种于氨苄青霉素抗性的LB液体培养基,37 ℃下以200 r/min振荡培养过夜。次日按照1%的比例接种至新鲜的同种培养基中,37 ℃下培养直至OD600 nm值为0.4~0.6,加入IPTG(1 mL∶10 μL)振荡培养5~6 h,取两管各1 mL作为对照组,其中,IPTG浓度梯度设置为1、0.8、0.5、0.3、0.2 mmol/L。随后以6 000 r/min离心15 min,采用磷酸盐缓冲液(PBS)清洗,并用移液枪轻轻吹匀,洗涤得到悬浮菌体;重复上述步骤两次,然后加入30 mL PBS缓冲液吹匀,使用超声波破碎仪粉碎菌体,随后离心收取上清。吸取上清50 μL并加入Protein Loading Buffer(1∶5)10 μL并吹匀,用于检测目的蛋白及分析蛋白表达量。
1.2.7 重组蛋白的纯化及Western blot鉴定 取重组质粒菌液氨苄青霉素的LB液体培养基进行扩培,随后在37 ℃、0.5 mmol/L IPTG的条件下诱导6 h,使用PBS清洗重悬菌体,采用超声破碎仪破碎菌体。将破碎后的液体移至低温离心机离心30 min,收集上清液。取2 mL GST标签纯化蛋白介质(BeyoGoldTM GST-tag Purification Resin)加入亲和层析柱空柱管中,随后加入上述收集的上清液,置于冰盒振荡孵育12 h。将孵育后产物加入纯化柱中,反复操作两次。再使用2 mL洗脱液洗脱,收集流出液。经SDS-PAGE电泳检测,得到的产物符合纯化融合蛋白OnS100P的预期条带大小。
按照前期研究方法[11]通过Western blotting鉴定纯化后的OnS100P重组蛋白,其中一抗为小鼠抗GST标签的单克隆抗体(1∶10 000),二抗为HRP标记的山羊抗小鼠ⅠgG(H+L)(1∶1 000),最后通过ECL超敏发光液显影并观察结果。
1.2.8 rOnS100P对头肾淋巴细胞中炎症因子转录的调节作用分析 从健康尼罗罗非鱼(约200 g)摘取头肾组织,根据郑琦等[12]方法分离得到罗非鱼头肾淋巴细胞,使用4 mL培养基(DMEM+P/S+肝素)重悬头肾淋巴细胞,将淋巴细胞浓度调整为1×107 cells/mL后接种于6孔板中,每孔加入1 mL细胞悬液。在试验组孔中加入重组蛋白OnS100P蛋白孵育,参照本课题组之前的研究[13],采用的孵育浓度为10 ng/mL,对照组加入等体积的PBS溶液。24 h后收集样品,使用RT-qPCR检测 rOnS100P孵育对炎症因子转录水平的影响。β-actin为内参基因,所用荧光定量PCR引物见表1,每个样品设置3个复孔。
2 结果与分析
2.1 OnS100P序列分析
OnS100P基因编码区片段长度为288 bp,可编码96个氨基酸。序列比对结果表明,OnS100P氨基酸序列与斑马丽鱼(Maylandia zebra)S100P氨基酸序列一致性最高(96.77%),与布氏新亮丽鲷(Neolamprologus brichardi)、尖吻鲈(lates calcarifer)、白沙鳉(Cyprinodon tularosa)、花斑剑尾鱼(Xiphophorus maculatus)、金钱鱼(Scatophagus argus)、鳜(Siniperca chuatsi)、龟壳攀鲈(Anabas testudineus)等鱼类的序列一致性分别最高为95.7%,最低为66.67%。但这些物种的S100P氨基酸序列均包含一个典型的S100保守结构域,进化上非常保守(图1)。通过N-J法构建系统进化树发现,尼罗罗非鱼S100P氨基酸与斑马丽鱼和布氏新亮丽鲷S100P氨基酸聚为一支且与斑马丽鱼亲缘关系最近(图2)。
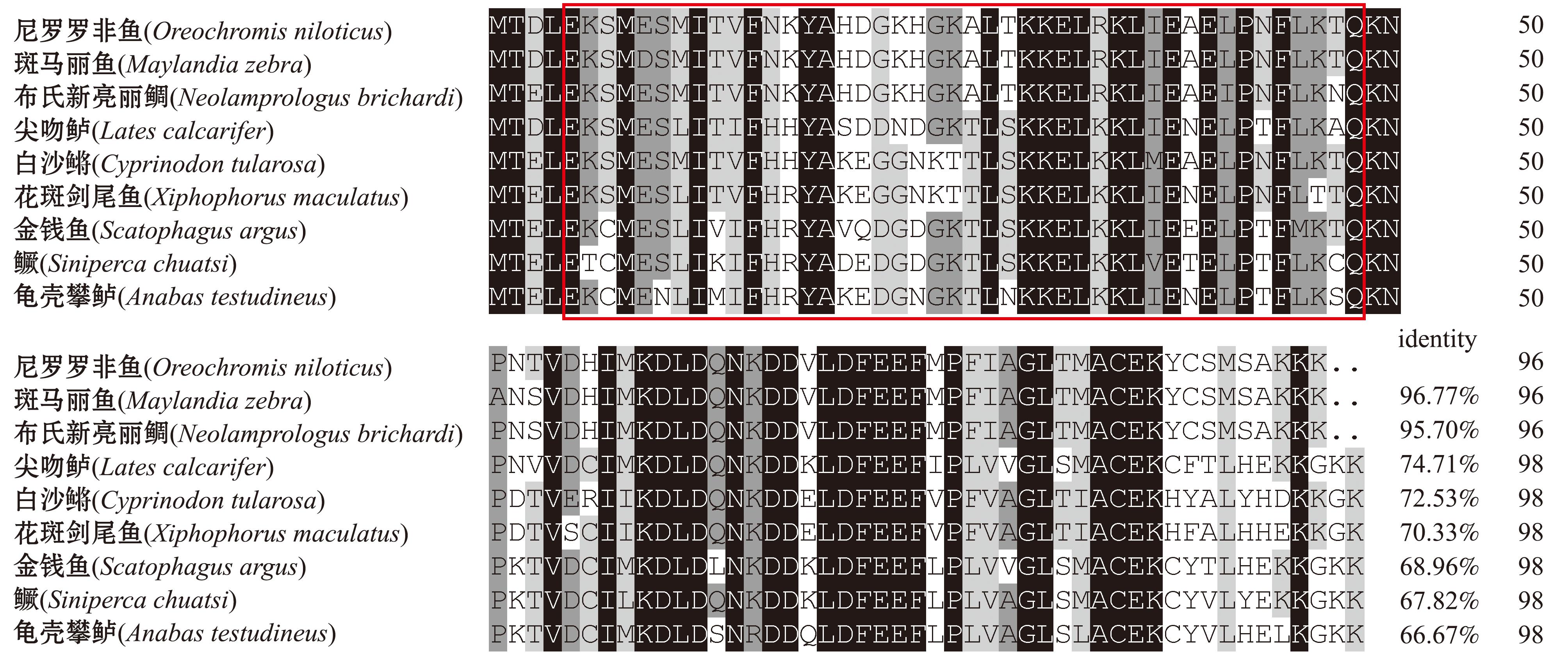
图1 尼罗罗非鱼与其他物种S100P的氨基酸序列比对
Fig.1 Alignment of amino acid sequences of OnS100P and S100P from Nile tilapia and the other species

图2 基于氨基酸序列构建的OnS100P与已知S100P蛋白的系统发育分析
Fig.2 Phylogenetic analysis of S100P with known S100P proteins constructed based on amino acid sequences
2.2 OnS100P组织表达结果分析
通过qPCR研究OnS100P在罗非鱼各个组织中的表达模式。结果表明,OnS100P基因广泛分布于尼罗罗非鱼所有组织中,其中,在鳃和肌肉这两个组织中表达量最高,在脑组织中表达量最低(图3)。
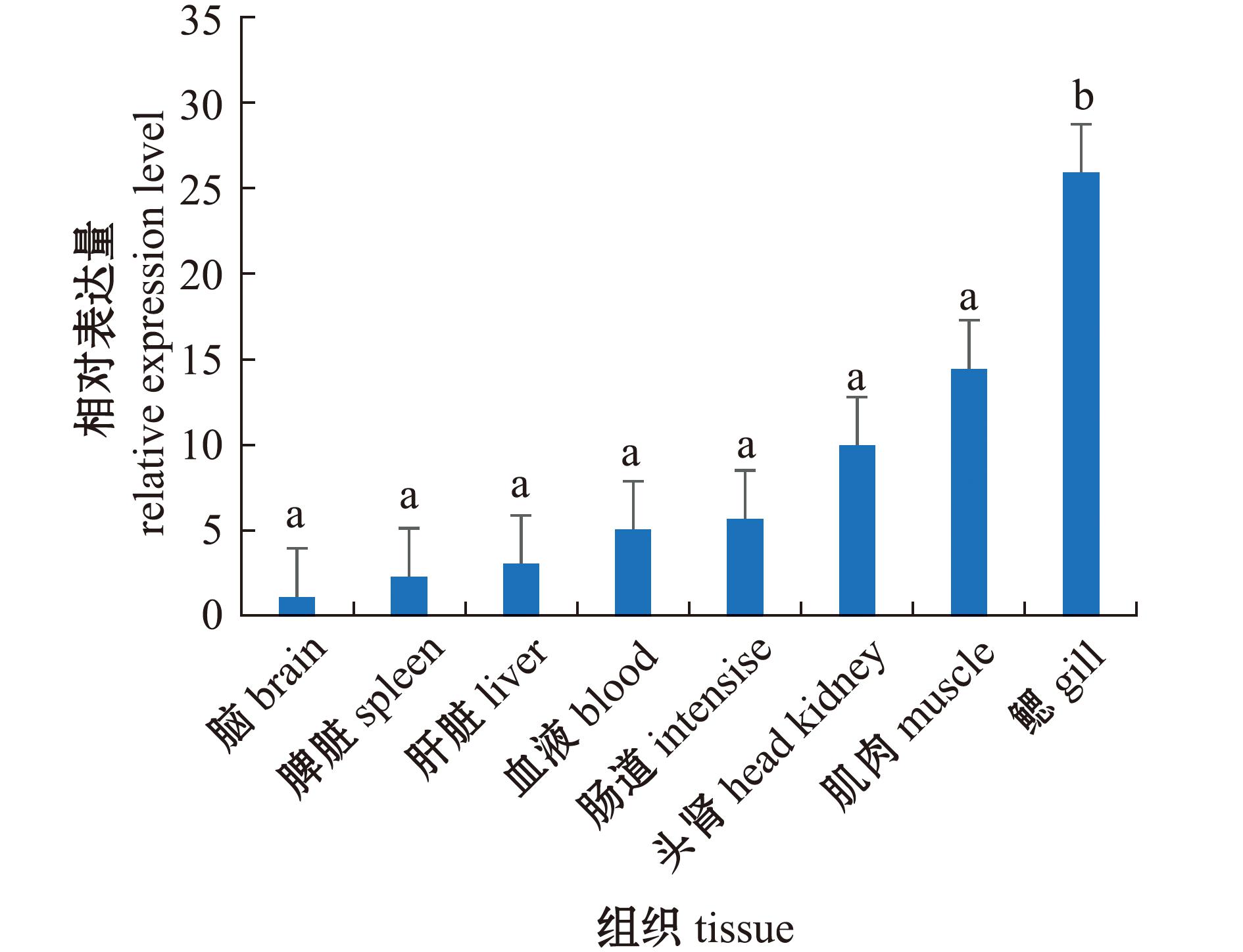
图3 尼罗罗非鱼S100P基因组织分布
Fig.3 Tissue distribution of S100P gene in Nile tilapia
2.3 Poly (I∶C)感染后OnS100P基因在不同组织中的表达变化
Poly (I∶C)刺激鱼体后,OnS100P基因在头肾、脑和肠道组织中的相对表达量随着刺激时间的延长发生了显著的变化。刺激6 h后,OnS100P基因在头肾和脑组织中的表达量显著下调,刺激24 h后该基因表达量显著上调并达到最大。在肠道组织中,OnS100P基因表达量在刺激6 h后开始显著上调,直至24 h后达到峰值(图4)。
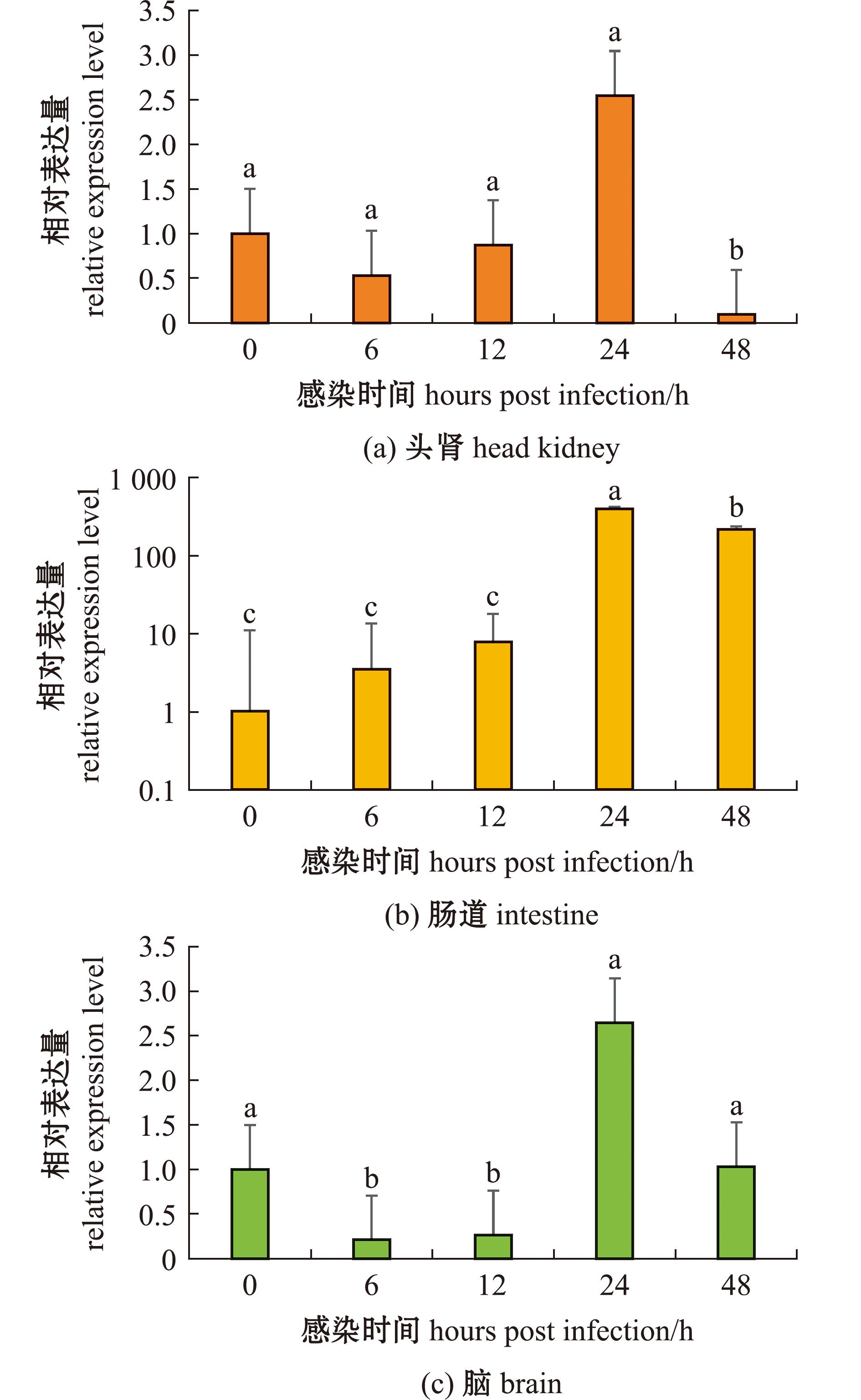
图4 Poly(I∶C)刺激后尼罗罗非鱼头肾、脑、肠道组织中OnS100P基因的表达模式
Fig.4 Expression profiles of OnS100P gene in head kidney,brain and intestine after Poly(I∶C) stimulation in Nile tilapia
2.4 OnS100P重组蛋白制备
利用表1中的引物扩增OnS100P进行检测,目的条带大小与S100P的开放阅读框大小一致,均为288 bp,表明OnS100P基因扩增成功。重组质粒转入大肠杆菌DH5α经培养基培养后,进行菌落PCR检测,条带大小与预测一致,测序结果也表明OnS100P重组质粒构建成功。
将未诱导和诱导OnS100P样品经蛋白电泳检测,结果表明,OnS100P重组蛋白成功表达,目的蛋白大小为37 000(图5),p-GEX4T空载质粒的表达蛋白为26 000,符合OnS100P预测蛋白大小。

M—蛋白marker;1—OnS100P未诱导组;2—OnS100P诱导组;3—pGEX-4T 对照组。
M—protein marker;1—non-induced OnS100P;2—induced OnS100P;3—pGEX-4T control.
图5 OnS100P重组蛋白诱导表达
Fig.5 Induction for the expression of OnS100P recombinant protein
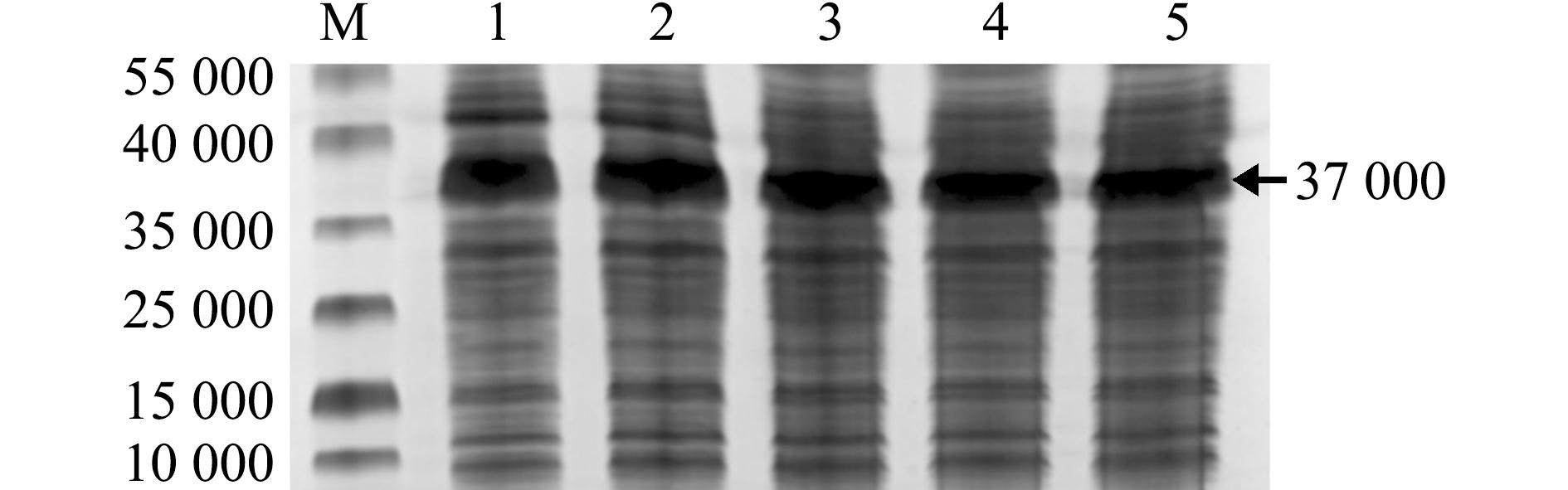
M—蛋白marker;1~5—1、0.8、0.5、0.3和0.2 mmol/L的IPTG浓度诱导。
M—protein marker;1-5—recombinant bacteria induced by IPTG at a dose of 1,0.8,0.5,0.3 and 0.2 mmol/L.
图6 OnS100P重组蛋白IPTG浓度优化
Fig.6 Optimization of the IPTG concentration for OnS100P recombinant protein
为获得大量OnS100P重组蛋白,本研究中设计5个不同的IPTG浓度(1、0.8、0.5、0.3、0.2 mmol/L)刺激OnS100P BL21细胞进行原核表达。结果表明,在37 ℃、0.5 mmol/L IPTG条件下,OnS100P重组蛋白表达量最高。
2.5 重组蛋白的纯化及Western blot 鉴定
将重组蛋白OnS100P纯化后利用SDS-PAGE检测,纯化后的目的条带较为明显(图7)。
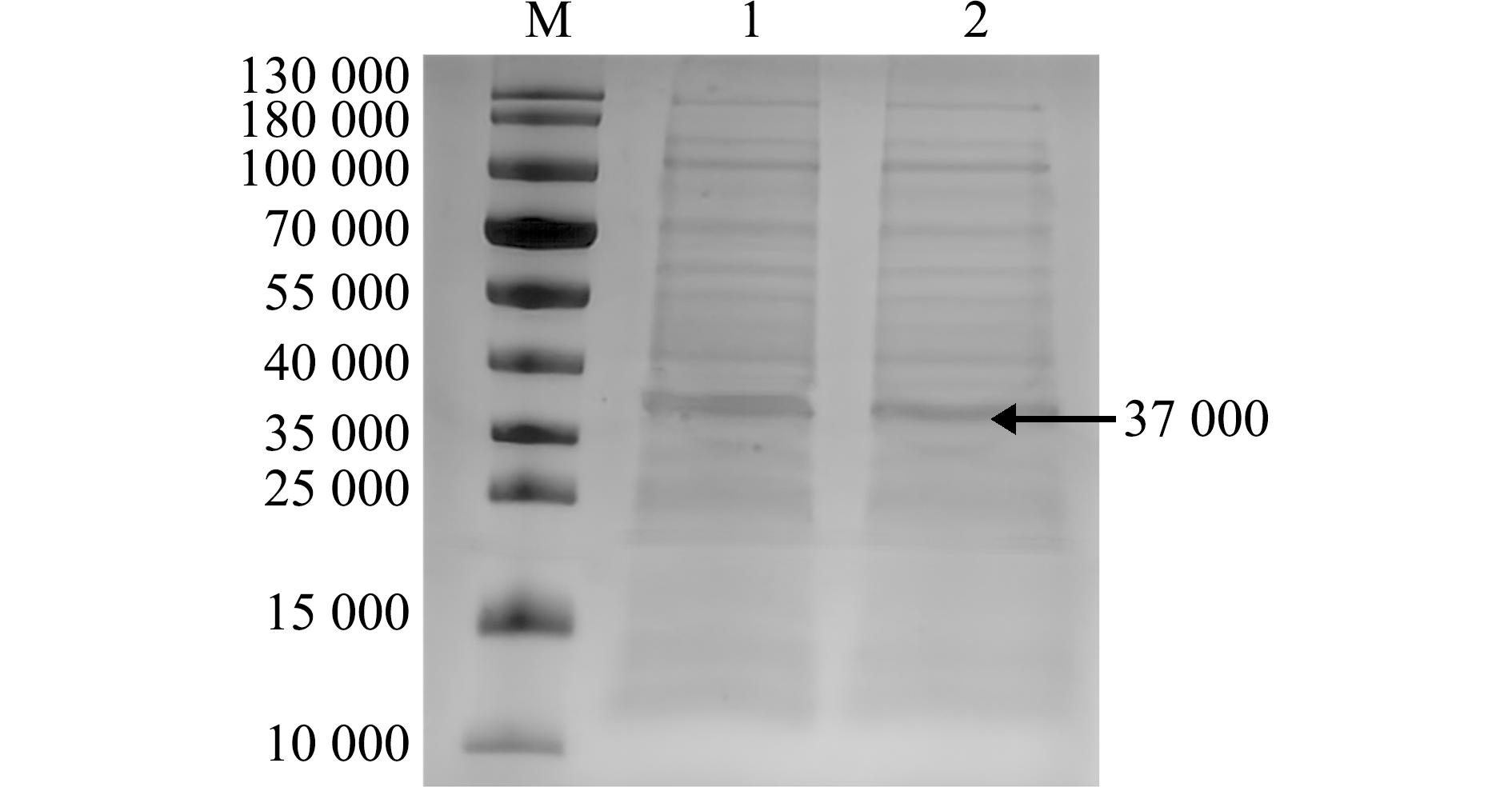
M—蛋白marker;1、2—纯化后的OnS100P蛋白。
M— protein marker;1、2,purification of OnS100P protein.
图7 OnS100P重组蛋白的纯化
Fig.7 Purification of OnS100P recombinant protein
Western blot鉴定纯化后的OnS100P样品(图8)。在相对分子质量约为37 000处有明显的条带,与OnS100P重组蛋白预测条带大小一致。
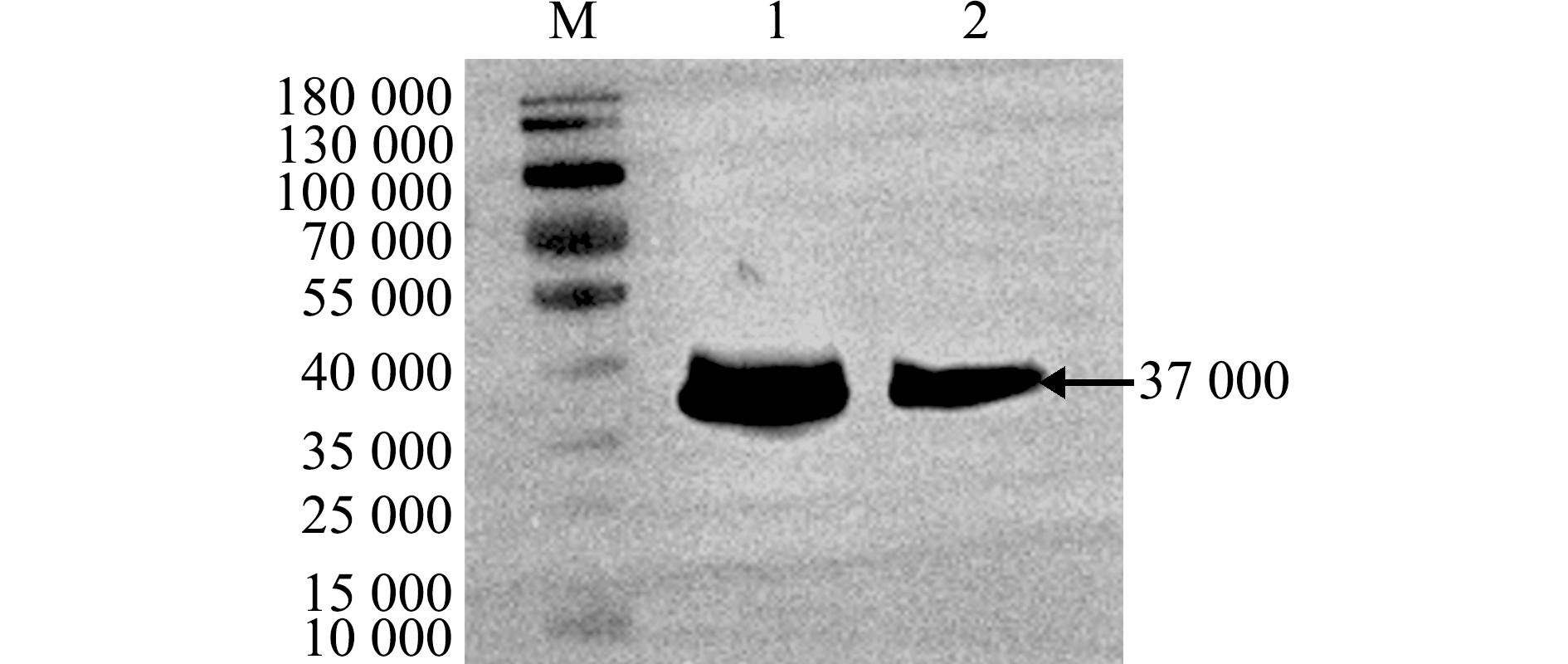
M—蛋白Marker;1、2—纯化后的OnS100P蛋白。
M—protein marker;1,2,purified of OnS100P protein.
图8 纯化rOnS100P的Western blotting鉴定
Fig.8 Western blotting of purified rOnS100P protein
2.6 rOnS100P对头肾淋巴细胞炎症相关因子的调控
利用rOnS100P孵育头肾淋巴细胞后,利用RT-qPCR检测白细胞介素8(Interleukin-8,IL8)、巨噬细胞迁移抑制因子(MIF)、肿瘤坏死因子β(tumor necrosis factor-β,TNF-β)、白细胞介素1β(interleukin1-β,IL1-β)的表达变化。结果显示:10 ng/mL的重组蛋白OnS100P孵育24 h后,头肾淋巴细胞中IL8、MIF、TNF-β、IL1-β的相对表达量均显著上调(图9)。
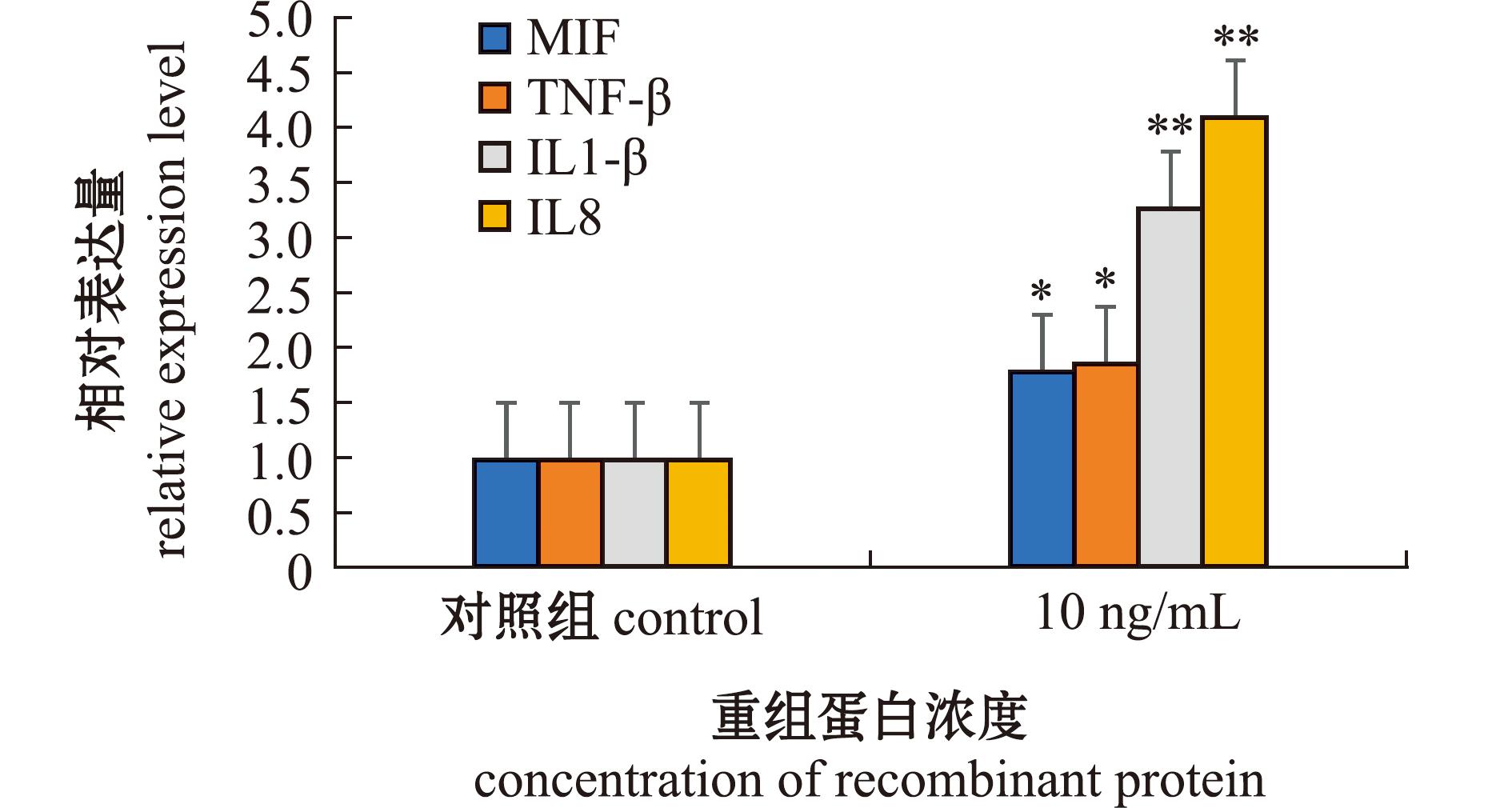
*表示差异显著 (P<0.05);**表示差异极显著(P<0.01)。
*,the difference is extremely significant(P<0.05);**,the difference is very significant(P<0.01).
图9 rOnS100P对头肾淋巴细胞炎症相关因子表达的影响
Fig.9 The impacts of rOnS100P on the inflammatory factors expression in head kidney-derived lymphocytes
3 讨论
3.1 OnS100P蛋白序列特征分析
S100蛋白通常以钙结合方式形成异二聚体复合物,广泛参与多种恶性肿瘤的不同生物学过程[14],在不同类型的癌症过程中,S100蛋白表达特征具有特异性[15]。S100P蛋白作为Ca2+结合蛋白S100家族成员,与人类癌症发生密切相关[16]。S100蛋白家族由25个成员组成,仅存在于脊椎动物中,并且这些蛋白在信号传递过程中经历钙诱导的结构变化[32]。这是由于S100P蛋白拥有独特的EF双螺旋手型结构,S100P蛋白通过EF双螺旋手型结构与二价金属离子相结合,而其中Ca2+、Mg2+对其空间结构影响最大,与Ca2+、Mg2+相结合后,S100P蛋白结构出现明显变化,疏水区打开,对S100P与细胞膜之间的结合构成刺激,继而与相应的靶细胞相互作用,实现其生物学特性[17]。S100P基因参与了细胞增殖、凋亡、迁移和侵袭等生物学过程[18],但目前尚未见鱼类S100P研究的相关报道。本研究中克隆了罗非鱼OnS100P,并对该基因的序列特征进行了分析,克隆得到的尼罗罗非鱼OnS100P基因ORF全长为288 bp,共为96个氨基酸,包含一个典型的S100保守结构域,这表明OnS100P基因在进化上保守,且OnS100P基因可能与其他物种该基因所行使的功能类似。构建系统进化树发现,OnS100P与斑马丽鱼聚为一支,二者可能来源于同一祖先。随后将OnS100P推导的氨基酸与NCBI上已公布的其他鱼类S100P氨基酸进行同源性比较,发现其一致性为66.67%~96.77%。迄今为止,S100蛋白仅从脊椎动物中分离出来,而对于线虫、昆虫和原生动物等非脊椎动物真核生物进行基因组的分析则未发现存在S100基因序列。这表明S100蛋白在EF-hand 蛋白中形成了一个系统发育的年轻群体。尽管S100家族的进化历史较短,但因其多样性广泛而受到较多关注[33]。综上所述,S100P在进化上高度保守。
3.2 OnS100P基因组织表达分析
本研究中OnS100P基因广泛分布于尼罗罗非鱼的肝脏、肠道、血液、头肾、肌肉、鳃等所有检测组织中,其中在鳃组织中表达水平最高,其次是肌肉和头肾组织。有研究表明,在平滑肌中起到骨骼肌钙蛋白作用的物质是钙调蛋白,由于S100也是钙调蛋白,因此推测S100P基因可能通过参与调控胞内外Ca2+离子浓度调节鱼体肌肉生理活动 [19]。此外,Valenzuela等[20]指出,鱼类骨骼肌是一个免疫活跃的器官,可能在对抗病原体方面发挥重要作用。鱼类成肌细胞可以表达免疫相关的基因,肌肉组织在体内病原体攻击期间可被免疫细胞浸润[21]。鳃是鱼类进行离子交换、酸碱调节及氨废弃物排泄的重要器官,同时是鱼体重要的黏膜免疫组织,鳃表面被黏膜和丰富的黏液所覆盖,可以阻挡外界的刺激。鳃黏膜组织中免疫细胞丰富,在鱼类抵御病原体微生物侵袭和感染过程构成了免疫反应最重要的屏障之一[22],结果表明,罗非鱼S100P可能在鱼体的抗病免疫中发挥了关键作用。
3.3 Poly(I∶C)刺激鱼体后OnS100P基因的表达变化
头肾是硬骨鱼类重要的造血器官,在免疫细胞增殖分化等方面发挥着重要作用[23];肠道作为鱼类的黏膜免疫器官,在刺激鱼体发生免疫反应时,能通过检测肠道微生物变化等方式进一步了解鱼类免疫反应机制;而罗非鱼链球菌病的主要致病菌无乳链球菌(Streptococcus agalactiae),其主要感染器官是脑组织,一旦突破脑-肠轴的血脑屏障,就可以直接感染脑部组织,造成脑膜炎[24]。由此选择头肾组织、脑、肠道3个组织经Poly(I∶C)刺激后检测OnS100P的表达情况,结果显示表达量均显著上调。有证据表明,S100作为一个显著的多功能基因家族,参与调控多种重要的生物过程,如炎症反应、感染时保护细胞内外环境、细胞增殖与分化、肿瘤生长与转移等[2]。S100蛋白在感染和炎症发生过程中与TLR-4、RAGE(糖基化终末产物的受体)、硫酸肝素蛋白多糖等受体相互作用的细胞外效应,与肿瘤、感染性疾病、自身免疫疾病及抗病原感染等炎症的发生机制有关[25]。细胞外S100蛋白也可以参与组织发育、再生或修复的调控,这对于阐明其在组织损伤、细胞凋亡或组织修复的病理过程中的作用至关重要[13]。在人体多种癌症方面研究中,S100P表达模式均与恶性表型相关。通过RAGE受体,S100P已被证明可以介导肿瘤生长、耐药和转移等病理发生过程。同时由于S100P在成人癌细胞中的特异性表达,表明S100P是区分癌细胞和正常细胞的重要标志物,并且多项研究证实了阻断癌细胞S100P/RAGE的有益作用[34-35]。因此能否在鱼类疾病发生时将S100P表达作为疾病发生时的重要检测指标,并且是否能通过阻断S100P/RAGE互相作用达到有效遏制鱼类疾病发生的效果,还需要进一步试验来揭示OnS100P参与鱼类疾病发生时的作用机制。
3.4 制备OnS100P重组蛋白孵育头肾淋巴细胞
本研究中成功构建了S100P的原核表达质粒pGEX-4T-OnS100P,同时成功表达出相对分子质量为37 090的罗非鱼重组蛋白OnS100P(rOnS100P)。本研究中设置在37 ℃下不同的IPTG浓度进行条件优化,其中在温度为37 ℃、IPTG浓度为0.5 mmol/L条件下的重组蛋白表达量最高,与尼罗罗非鱼Galectin-4基因[26]、青海湖裸鲤IL-8基因[27]等的研究结果类似。利用重组蛋白孵育尼罗罗非鱼头肾淋巴细胞后,炎症因子IL8、MIF、TNF-β、IL1-β表达量显著上调。TNF-β和IL-8主要来源于巨噬细胞和T细胞,其主要靶细胞分别为中性粒细胞和吞噬细胞、肿瘤细胞,可以促进中性粒细胞和T细胞趋化,以及诱导吞噬作用和其他细胞因子[28]。MIF(巨噬细胞游走抑制因子)是先天免疫的重要调节因子,细菌抗原介导了白细胞释放MIF到血液循环的过程,MIF在循环过程中能够与其他免疫细胞上的CD74结合并相互作用,从而造成急性免疫反应[29]。白细胞介素 1β (IL1-β) 主要由促炎细胞产生和分泌,是多种自身免疫性炎症反应及多种细胞活动包括细胞增殖、分化和凋亡的重要因素之一[30],IL1-β与IL1-α、IL18可协同调节下游免疫反应,且IL1-β在几乎所有组织的细胞防御和组织修复中发挥着重要作用,与疼痛、炎症和自身免疫密切相关[31]。由此可见,淋巴细胞的活性受到OnS100P调控炎症相关因子表达的影响,表明OnS100P可能参与鱼体免疫应答过程。
4 结论
1)本研究中成功克隆了尼罗罗非鱼S100P基因,且该基因编码蛋白有S100P保守结构域,表明S100P在进化上高度保守。
2)尼罗罗非鱼S100P基因广泛表达于各组织,其中鳃组织表达量最高,其次为肌肉、头肾、肠道、血液。
3)Poly(I∶C)刺激后,OnS100P在多个组织中的表达量显著上调,表明该基因可能参与了鱼体免疫反应过程。
4)重组蛋白OnS100P(rOnS100P)孵育尼罗罗非鱼头肾淋巴细胞能诱导IL8、MIF、TNF-β、IL1-β的表达,表明OnS100P能通过调节炎症相关因子表达参与鱼体抗病免疫反应。
[1] 黄子威,汪志文,黎源,等.罗非鱼SRA4基因重组表达、亚细胞定位及组织分布[J].广东海洋大学学报,2021,41(5):19-27.
HUANG Z W,WANG Z W,LI Y,et al.Molecular cloning,subcellular localization and expression characterization of SRA4 gene in Nile tilapia(Oreochromis niloticus)[J].Journal of Guangdong Ocean University,2021,41(5):19-27.(in Chinese)
[2] 李东海,王宝强,闫秀英.SOX10、CD57、S100在神经系统肿瘤中表达的临床意义及研究进展[J].现代肿瘤医学,2020,28(6):1045-1048.
LI D H,WANG B Q,YAN X Y.Clinical significance and research progress of SOX10,CD57 and S100 expression in nervous system tumors[J].Journal of Modern Oncology,2020,28(6):1045-1048.(in Chinese)
[3] AHMED A A,GREENHALF W,PALMER D H,et al.The potent G-quadruplex-binding compound QN-302 downregulates S100P gene expression in cells and in an in vivo model of pancreatic cancer[J].Molecules,2023,28(6):2452.
[4] SCHMIDF,DAHLMANN M,RÖHRICH H,et al.Calcium-binding protein S100P is a new target gene of MACC1,drives colorectal cancer metastasis and serves as a prognostic biomarker[J].British Journal of Cancer,2022,127(4):675-685.
[5] HOU J Z,LI Y.Relationship between the expression of S100P in gastric cancer tissue and clinical pathology[J].American Journal of Clinical and Experimental Medicine,2021,9(3):55.
[6] 江泽,宋振川,李胜水,等.人结直肠癌组织中S100P蛋白的表达及临床意义[J].临床误诊误治,2012,25(11):52-54.
JIANG Z,SONG Z C,LI S S,et al.Expression and clinical significance of S100P-protein in human tissues of colorectal carcinoma[J].Clinical Misdiagnosis &Mistherapy,2012,25(11):52-54.(in Chinese)
[7] FUENTES M K,NIGAVEKAR S S,ARUMUGAM T,et al.RAGE activation by S100P in colon cancer stimulates growth,migration,and cell signaling pathways[J].Diseases of the Colon and Rectum,2007,50(8):1230-1240.
[8] HAO W W,ZHANG Y Y,DOU J W,et al.S100P as a potential biomarker for immunosuppressive microenvironment in pancreatic cancer:a bioinformatics analysis and in vitro study[J].BMC Cancer,2023,23(1):997.
[9] PETEROVA E,BURES J,MORAVKOVA P,et al.Tissue mRNA for S100A4,S100A6,S100A8,S100A9,S100A11 and S100P proteins in colorectal neoplasia:a pilot study[J].Molecules,2021,26(2):402.
[10] 巫祎琴,陈福暖,张志强,等.尼罗罗非鱼跨膜Bax抑制剂母体6基因Tmbim 6的克隆、表达及功能鉴定[J].大连海洋大学学报,2023,38(2):275-283.
WU Y Q,CHEN F N,ZHANG Z Q,et al.Molecular cloning,expression and functions of Tmbim 6 gene in Nile tilapia (Oreochromis niloticus)[J].Journal of Dalian Ocean University,2023,38(2):275-283.(in Chinese)
[11] 杨林,蔡佳,简纪常,等.草鱼NEDD4结合蛋白基因1原核表达条件的优化及纯化[J].广东海洋大学学报,2013,33(4):38-42.
YANG L,CAI J,JIAN J C,et al.Purification and optimization of prokaryotic expression of NEDD4 binding protein 1 in grass carp (Ctenopharyngodon idellus) [J].Journal of Guangdong Ocean University,2023,38(2):275-283.(in Chinese)
[12] 郑琦,陈一锦,黄瑜,等.尼罗罗非鱼非特异性细胞毒性细胞(NCC)分离条件的优化[J].广东海洋大学学报,2017,37(3):123-126.
ZHENG Q,CHEN Y J,HUANG Y,et al.On optimizing the isolation conditions of non-specific cytotoxic cell(NCC) of Oreochromis niloticus[J].Journal of Guangdong Ocean University, 2017,37(3):123-126.(in Chinese)
[13] CHEN J X,HUANG Y,WANG B,et al.Characterization of S100A12 from Nile tilapia (Oreochromis niloticus) and its roles on inflammatory responses[J].Fish &Shellfish Immunology,2022,131:401-407.
[14] 高露,梁超,周家伟,等.S100P对肺癌细胞增殖和凋亡的影响及其机制[J].山西医科大学学报,2023,54(4):409-415.
GAO L,LIANG C,ZHOU J W,et al.Effect of S100P on proliferation and apoptosis of lung cancer cells and its mechanism[J].Journal of Shanxi Medical University,2023,54(4):409-415.(in Chinese)
[15] BRESNICK A R,WEBER D J,ZIMMER D B.S100 proteins in cancer[J].Nature Reviews Cancer,2015,15(2):96-109.
[16] GÖRMÜ U.A promising novel biomarker for embryogenesis and carcinogenesis:S100P protein[J].International Journal of Medical Biochemistry,2018:30-34.
U.A promising novel biomarker for embryogenesis and carcinogenesis:S100P protein[J].International Journal of Medical Biochemistry,2018:30-34.
[17] 李晓燕,张启芳.S100P在肿瘤中的表达及其意义[J].医药前沿,2019,9(7):7-8.
LI X Y,ZHANG Q F.Expression of S100P in tumors and its significance[J].Journal of Frontiers of Medicine,2019,9(7):7-8.(in Chinese)
[18] 许康,白丽.基于生物信息学分析S100P基因在乳腺癌中的表达及临床意义[J].大理大学学报,2022,7(10):68-74.
XU K,BAI L.Analysis of S100P gene expression and clinical significance in breast cancer based on bioinformatics[J].Journal of Dali University,2022,7(10):68-74.(in Chinese)
[19] 陈明,李爱媛.钙调蛋白结合蛋白、类肌钙蛋白和脊椎动物平滑肌收缩的调节[J].生理科学进展,1994, 25(4):314-318.
CHEN M,LI A Y.Regulation of calmodulin binding proteins, troponin-like proteins, and smooth muscle contraction in vertebrates[J].Progress in Physiological Sciences, 1994,25(4):314-318.(in Chinese)
[20] VALENZUELA C A,ZULOAGA R,POBLETE-MORALES M,et al.Fish skeletal muscle tissue is an important focus of immune reactions during pathogen infection[J].Developmental and Comparative Immunology,2017,73:1-9.
[21] POOLEY N J,TACCHI L,SECOMBES C J,et al.Inflammatory responses in primary muscle cell cultures in Atlantic salmon (Salmo salar)[J].BMC Genomics,2013,14:747.
[22] 罗晓春,李安兴,谢明权.斜带石斑鱼黏膜免疫系统结构的研究[J].水生生物学报,2005,29(2):193-198.
LUO X C,LI A X,XIE M Q.Studies on the morphology of grouper (Epinephelus coioides) mucosal immune system[J].Acta Hydrobiologica Sinica,2005,29(2):193-198.(in Chinese)
[23] 殷海成,黄进,贾峰,等.大豆β-伴球蛋白对黄河鲤头肾TLR2/NF-κBp65及其炎性因子基因表达的影响[J].大连海洋大学学报,2020,35(2):223-228.
YIN H C,HUANG J,JIA F,et al.Effects of β-conglycinin on expression of TLR2/NF-κB p65 and inflammatory-related genes in head kidney of juvenile common carp Cyprinus carpio haematopterus[J].Journal of Dalian Ocean University,2020,35(2):223-228.(in Chinese)
[24] WANG Z,GUO C,XU Y,et al.Two novel functions of hyaluronidase from Streptococcus agalactiae are enhanced intracellular survival and inhibition of proinflammatory cytokine expression[J].Infection &Immunity, 2014, 82(6):2615.DOI:10.1128/IAI.00022-14.
[25] XIA C,BRAUNSTEIN Z,TOOMEY A C,et al.S100 proteins as an important regulator of macrophage inflammation[J].Frontiers in Immunology,2018,8:1908.
[26] 张志强,刘鑫潮,牛金中,等.尼罗罗非鱼Galectin-4基因的原核表达及诱导条件优化[J].广东海洋大学学报,2020,40(5):118-123.
ZHANG Z Q,LIU X C,NIU J Z,et al.Prokaryotic expression and optimization of Galectin4-gene from Nile tilapia(Oreochromis niloticus)[J].Journal of Guangdong Ocean University,2020,40(5):118-123.(in Chinese)
[27] 马德昭,田菲,吴其中,等.青海湖裸鲤IL-8的原核表达及诱导条件优化[J].基因组学与应用生物学,2020,39(8):3439-3445.
MA D Z,TIAN F,WU Q Z,et al.Construction of prokaryotic expression system and optimization of expression conditions of IL-8 in Gymnocypris przewalskii[J].Genomics and Applied Biology,2020,39(8):3439-3445.(in Chinese)
[28] JAILLON S,PONZETTA A,DI MITRI D,et al.Neutrophil diversity and plasticity in tumour progression and therapy[J].Nature Reviews Cancer,2020,20(9):485-503.
[29] 赵然,姚伟娟.巨噬细胞迁移抑制因子的功能及临床研究进展[J].生理科学进展,2014,45(2):93-99.
ZHAO R,YAO W J.The functions and clinical studies of macrophage migration inhibitory factor[J].Progress in Physiological Sciences,2014,45(2):93-99.(in Chinese)
[30] PETRASEK J,BALA S S,CSAK T,et al.IL-1 receptor antagonist ameliorates inflammasome-dependent alcoholic steatohepatitis in mice[J].The Journal of Clinical Investigation,2012,122(10):3476-3489.
[31] YANG W X,BAI X Y,LUAN X H,et al.Delicate regulation of IL-1β-mediated inflammation by cyclophilin A[J].Cell Reports,2022,38(11):110513.
[32] RINTALA-DEMPSEY A C,REZVANPOUR A,SHAW G S. S100-annexin complexes--structural insights[J].FEBS J,2008,275(20):4956-4966.
[33] MARENHOLZ I, HEIZMANN CW, FRITZ G. S100 proteins in mouse and man: from evolution to function and pathology (including an update of the nomenclature)[J]. Biochem Biophys Res Commun,2004,322(4):1111-1122.
[34] ARUMUGAM T, LOGSDON C D. S100P: a novel therapeutic target for cancer[J]. Amino Acids,2011,41(4):893-899.
[35] TóTHOVá V, GIBADULINOVá A. S100P, a peculiar member of S100 family of calcium-binding proteins implicated in cancer[J]. Acta Virol,2013,57(2):238-246.