生态冰温休眠是活鱼长途运输的关键核心技术,范秀萍等[1]研究温度对石斑鱼(♀Epinephelus fuscogutatus×♂E.laceolatus)代谢和鱼肉品质的影响发现,石斑鱼随温度升高存活率下降,低温下水质恶化速度减慢;吴云辉等[2]研究温度对黑鲷(Sparus macrocephlus)无水保活的影响发现,0 ℃无水保活36 h存活率可达100%。水体盐度与淡水鱼的生长及肌肉品质有关,对鱼体渗透压调节、耗氧率、能量收支平衡、饲料消化利用、生长性能、氨氮排泄和存活等多方面产生影响,过高盐度对免疫调节、生长等具有消极作用[3-4];Dawood等[5]研究盐度和温度胁迫对鲤鳃、肠、肝的氧化应激发现,在盐度分别为15、20时,鱼鳃超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(hydrogen peroxidase,CAT)及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性均显著下降,丙二醛(malondialdehyde,MDA)含量显著上升,表明高盐度下鱼体产生氧化应激反应,对其组织造成损伤;吕宏波等[6]发现,盐度为8时可促进尼罗罗非鱼(Oreochromis niloticus)生长并提高肌肉品质,高盐度则对其生长与肉质有副作用;刘发春[7]通过在不同盐度下养殖草鱼苗发现,盐度对肌肉灰分无显著影响,但盐度大于10时,肌肉水分和粗蛋白含量分别显著高于和低于其他盐度组,脂肪含量显著下降,胶原蛋白含量增加,肌纤维耐折力提高,肌纤维直径减小[8]。
草鱼(Ctenopharyngodon idellus)属于硬骨鱼纲、鲤形目、鲤科、雅罗鱼亚科、草鱼属,是中国“四大家鱼”之一[9]。2022年中国草鱼总产量为590.48万t,居中国淡水养殖水产品总量第一[10]。
温度、盐度作为鱼类活运的关键控制点,目前在草鱼保活运输中研究尚少,不理想的水体环境将使鱼体产生应激反应。对草鱼运输过程中基础数据的研究,有助于草鱼等大宗鱼类活运规范的建立,随着广东省“脆肉鲩”的成功养殖,对草鱼运输工艺的探索将为“脆肉鲩”的长途保活运输提供数据基础。
1 材料与方法
1.1 材料
草鱼购于广州市莲湖水产养殖场,体质量为(1 200±100)g,体长为(43±2)cm,无体表伤,充氧有水运输至实验室。试验用鱼置于提前曝气水中(25 ℃)暂养2 h以缓解应激,期间持续供氧。
谷丙转氨酶、谷草转氨酶、碱性磷酸酶、超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、丙二醛和葡萄糖检测试剂盒购自南京建成生物工程有限公司;鱼皮质醇 ELISA 试剂盒购自北京莱伯沃德科技有限公司;氨氮标准物质、纳氏试剂购自北京金智研生物科技有限公司;海水晶购自江西盐通科技有限公司。
1.2 方法
1.2.1 草鱼半休眠及临界温度的确定 实验室自制梯度降温装置(图1),试验用鱼到达实验室后静养2~3 h后可开展试验,将9尾草鱼放入预先曝气24 h的清水中,水中溶解氧大于8.5 mg/L,pH为7.5±0.2,暂养密度为1∶20。以袁圆玥等[11]的降温方式进行降温试验(T>25 ℃时,以3 ℃/h降温;10 ℃
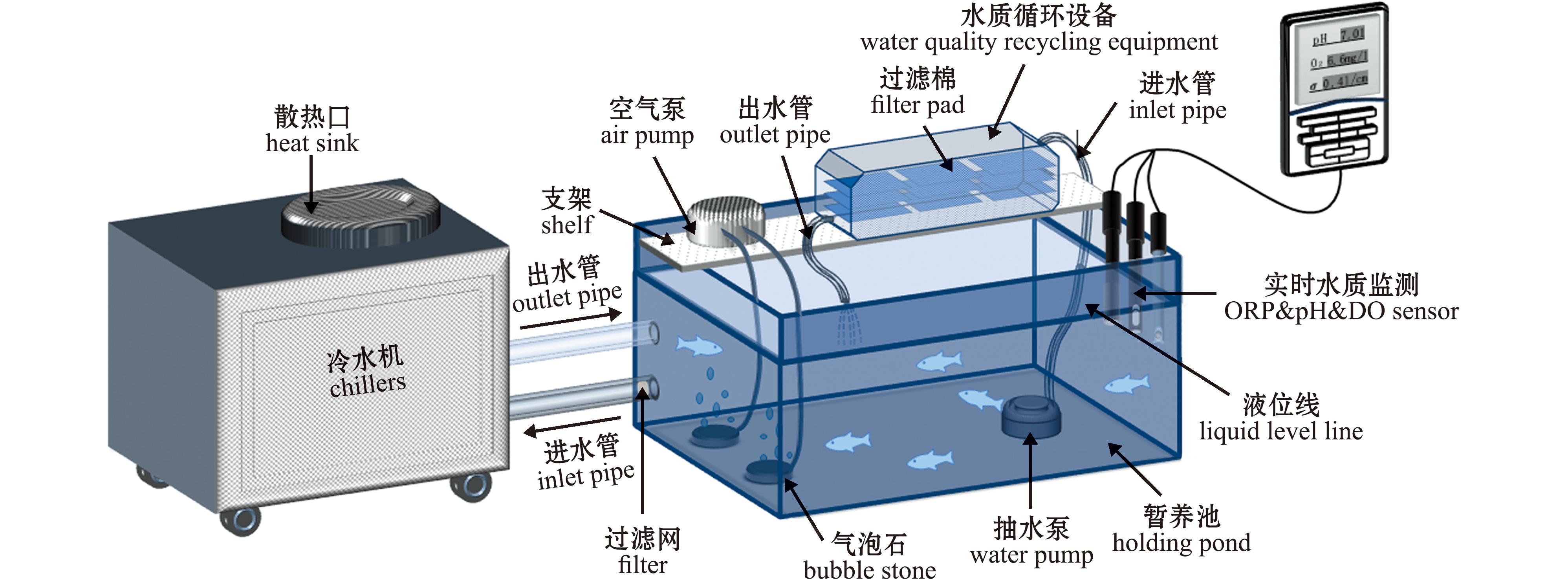
图1 梯度降温示意图
Fig.1 Schematic diagram of gradient cooling
1.2.2 温度试验 草鱼置于溶解氧>8.5 mg/L,pH为7.5±0.2的清水中,暂养密度为1∶20,梯度降温至24、20、18、16、14、12 ℃,每个温度记录6尾鱼,以室温(25 ℃)暂养0 h为对照组,每4 h观察草鱼存活状态及存活时长,基于Kaplan-Meier估计函数计算草鱼存活率。每12 h采集水样以测量水质氨氮质量浓度,参考《水质氨氮的测定纳氏试剂分光光度法》(HJ535—2009)[13]。采集不同温度下保活48 h草鱼血液,一次性无菌针管从尾部静脉取血,全血不加抗凝剂,待血液凝固分层后,4 ℃下以4 000 r/min离心10 min,取上层血清于-80 ℃超低温冰箱中保存。
1.2.3 盐度试验 草鱼置于溶解氧>8.5 mg/L,pH为7.5±0.2的水中,暂养密度为1∶20,分别设置盐度为0.5、1、2、3、4、5,以16 ℃清水保活48 h的草鱼为对照组,记录存活时长,存活率计算同“1.2.2节”,在0.5、1、2、3盐度下分别采集6尾草鱼保活48 h的血液,血液处理、鱼体活动现象观察及水质采集同“1.2.2节”。
1.2.4 血液学指标测定 分别采用α-酮戊二酸法测定谷丙转氨酶(glutamine aminotransferase,ALT)和谷草转氨酶(glutamic transaminase,AST)含量、比色法测定碱性磷酸酶(alkaline phosphatase,AKP)、Elisa酶联免疫法测定皮质醇(cortisol,COR)、葡萄糖氧化法测定血糖(glucose,GLU)含量,WST-1氧化法测定超氧化物歧化酶(SOD)活性、紫外-可见分光光度法测定谷胱甘肽过氧化物酶(GSH-Px)活性、钼酸铵法测定过氧化氢酶(CAT)活性、硫代巴比妥酸法测定丙二醛(MDA)含量。
1.3 数据处理
采用R软件(4.3.0版)multcompView软件包进行多重比较,分析温度、盐度对水质氨氮总质量浓度、草鱼血清生化指标和抗氧化能力的影响,通过ggplot 2软件包进行可视化分析,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 草鱼半休眠温度及临界温度的确定
草鱼在不同温度的活动现象见表1,其呼吸频率随温度降低逐渐减小。当温度高于26 ℃时,呼吸急促,出现浮头或撞壁等应激行为,呼吸频率超过58 次/min;24~20 ℃内鱼体应激敏感,鳃盖张合规律,鱼体正常游动;温度降至18 ℃时呼吸频率明显降低,对光照刺激不明显;降至16 ℃时,应激反应迟钝,静止在水底,鳃盖张合幅度小;继续降至8 ℃,鳃盖半闭合,张合不规律,将鱼体放回室温水中5~8 min可复苏;降至6 ℃时,出现裂鳃。根据袁仲瑾等[12]和蔡晓芳等[14]关于鱼体临界温度的判断方法,以呼吸极不规律、观察不到鳃盖张合甚至出现裂鳃时的温度作为临界温度,6~8 ℃为临界温度;根据秦旭[14]关于半休眠温度的判断方法(鱼体状态为安静躺在水下,应激迟缓),认为16 ℃是草鱼半休眠温度。
表1 不同温度下草鱼的呼吸频率和活动现象
Tab.1 Respiratory rate and activity phenomena of Ctenopharyngodon idellus at different temperatures

温度/℃temperature呼吸频率次/minrespiratory frequency活动现象activity phenomenon3068±3j猛烈撞壁,跳出水面2864±2i快速游动,常浮头2659±2h活跃,鳃盖张合明显,应激敏感2456±3h活跃,鳃盖张合明显,应激敏感2248±1g呼吸均匀,鳃盖张合规律2047±2g呼吸均匀,鳃盖张合规律1844±1f部分在水底静止,对敲击箱体产生的振动刺激敏感1632±3e全部沉在水底,呼吸均匀,对刺激反应迟钝1430±1d有上浮或箱体打圈游动现象,鳃盖张合幅度较小1228±3d眼珠有红血丝1023±1c微弱撞壁,部分鱼出现仰翻819±1b鳃盖张合不规律,放回室温水中5 min内可复苏615±2a部分裂鳃,判定死亡
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
2.2 温度、盐度对草鱼存活的影响
由草鱼梯度降温试验得知,当水体温度高于26 ℃或低于10 ℃引起鱼体不良应激反应,因此在12~24 ℃下研究温度对草鱼静态保活过程中各生理生化指标和水质氨氮质量浓度的影响。图2为温度、盐度对草鱼存活率的影响,从图2(a)可见,草鱼的存活时长随温度升高呈先增加后减少的趋势,在16 ℃下83.3%的草鱼存活超过70 h,而在12、14和24 ℃下仅有66.7%的草鱼存活时长超过48 h;从图2(b)可知,在盐度1条件下,83.3%的草鱼存活超过78 h,而盐度4~5条件下仅约33.3%的草鱼存活时长超过48 h。
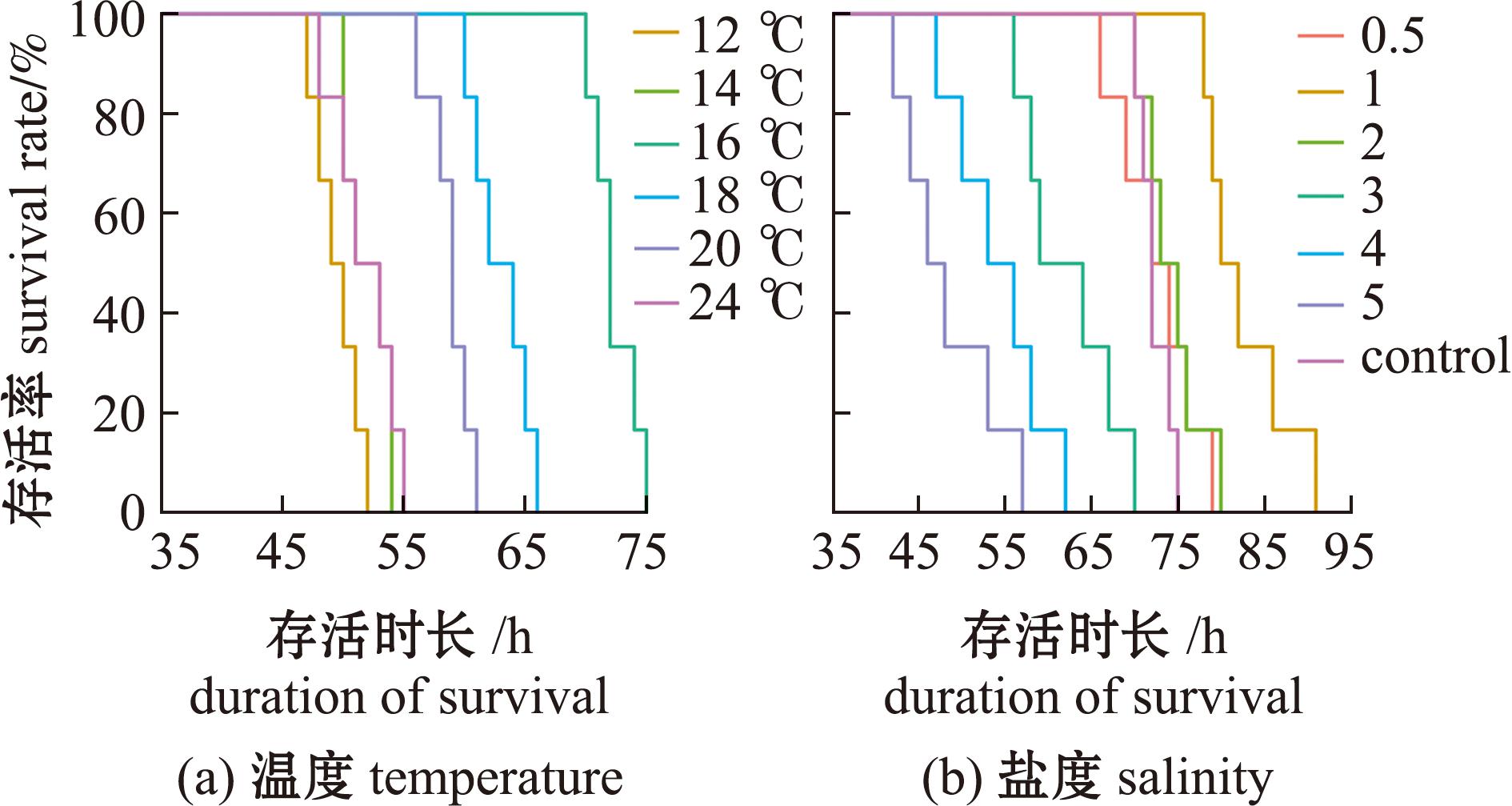
图2 温度、盐度对草鱼存活率的影响
Fig.2 Effect of temperature and salinity on the survival rate of Ctenopharyngodon idellus
2.3 温度、盐度对水质总氨氮质量浓度的影响
从图3(a)可知,12、14、16 ℃下保活48 h后氨氮质量浓度分别为(8.2±0.6)、(8.3±0.3)、(8.7±0.5)mg/L,组间无显著性差异(P>0.05),24 ℃下氨氮质量浓度为(23.7±0.4)mg/L,显著高于低温下氨氮质量浓度。从图3(b)可知,16 ℃下盐度5水体中保活48 h后氨氮质量浓度为(15.8±0.4)mg/L,为对照组的2倍,且盐度为5下保活超过24 h后氨氮质量浓度显著升高。
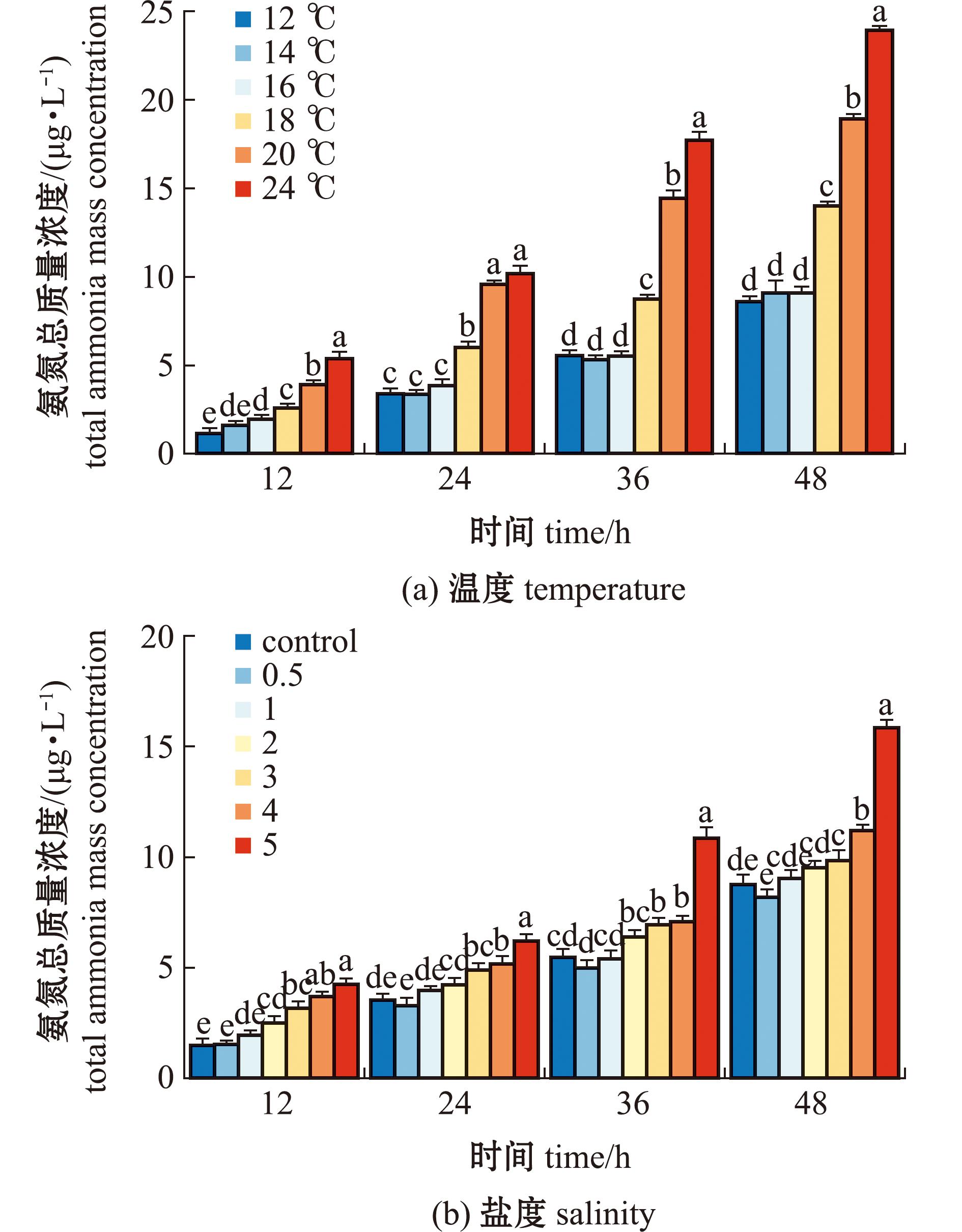
标有不同字母者表示同一温度下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters in the same temperature are significant differences in different groups at the 0.05 probability level,and the means with the same letters are not significant differences.
图3 温度、盐度对水质氨氮总质量浓度的影响
Fig.3 Effect of temperature and salinity on total mass concentration of ammonia nitrogen in water quality
2.4 温度、盐度对草鱼血清生化指标的影响
从表2可见,保活48 h后ALT、AST、AKP含量随温度升高呈先降低后增加的趋势,24 ℃保活48 h后AST、ALT达最大值(227.9±3.3)、(69.6±2.6)U/L,分别为16 ℃的2.2倍、3.1倍,这与范秀萍等[1]研究温度对石斑鱼代谢的结果一致,温度越高,AST和ALT含量越显著高于对照组。24 ℃下AKP大量溶出导致其含量升高,表明该温度对鱼体非特异性免疫能力有显著性影响。COR含量随温度升高呈先降低后增加的趋势,在16 ℃下保活48 h COR含量最低为(445.7±6.8)ng/L,24 ℃下COR达最大值(513.0±6.8)ng/L,12 ℃和24 ℃的COR含量无显著性差异(P>0.05),GLU含量受COR影响,变化趋势基本一致[15],16 ℃下GLU达最小值(2.8±0.2)mmol/L,24 ℃下GLU含量为对照组的1.5倍,显著高于16 ℃。根据草鱼在不同盐度下存活状态及总氨氮质量浓度可知,当盐度>3时草鱼存活率随盐度增加逐渐降低,故选择盐度≤3来研究盐度对草鱼的影响。从表3可见,盐度≤2时,血清生化指标含量无显著性变化(P>0.05),当盐度为3时,AST、ALT、AKP、COR及GLU含量均达最大值,分别为(158.0±5.1) U/L、(41.7±2.0) U/L、(35.4±1.9) U/L、(586.5±6.4)ng/L及(3.8±0.2)mmol/L,均显著高于对照组(P<0.05)。
表2 温度对草鱼血清生化指标含量的影响
Tab.2 Effects of temperature on serum biochemical parameters of Ctenopharyngodon idellus
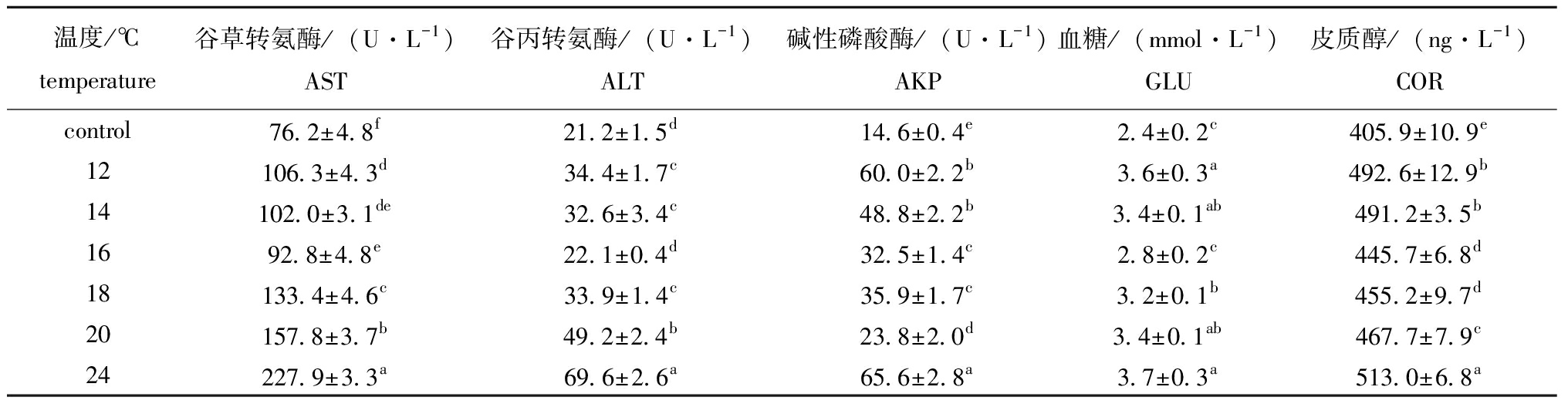
温度/℃temperature谷草转氨酶/(U·L-1)AST谷丙转氨酶/(U·L-1)ALT碱性磷酸酶/(U·L-1)AKP血糖/(mmol·L-1)GLU皮质醇/(ng·L-1)CORcontrol76.2±4.8f21.2±1.5d14.6±0.4e2.4±0.2c405.9±10.9e12106.3±4.3d34.4±1.7c60.0±2.2b3.6±0.3a492.6±12.9b14102.0±3.1de32.6±3.4c48.8±2.2b3.4±0.1ab491.2±3.5b1692.8±4.8e22.1±0.4d32.5±1.4c2.8±0.2c445.7±6.8d18133.4±4.6c33.9±1.4c35.9±1.7c3.2±0.1b455.2±9.7d20157.8±3.7b49.2±2.4b23.8±2.0d3.4±0.1ab467.7±7.9c24227.9±3.3a69.6±2.6a65.6±2.8a3.7±0.3a513.0±6.8a
表3 盐度对草鱼血清生化指标含量的影响
Tab.3 Effect of salinity on serum biochemical parameters of Ctenopharyngodon idellus
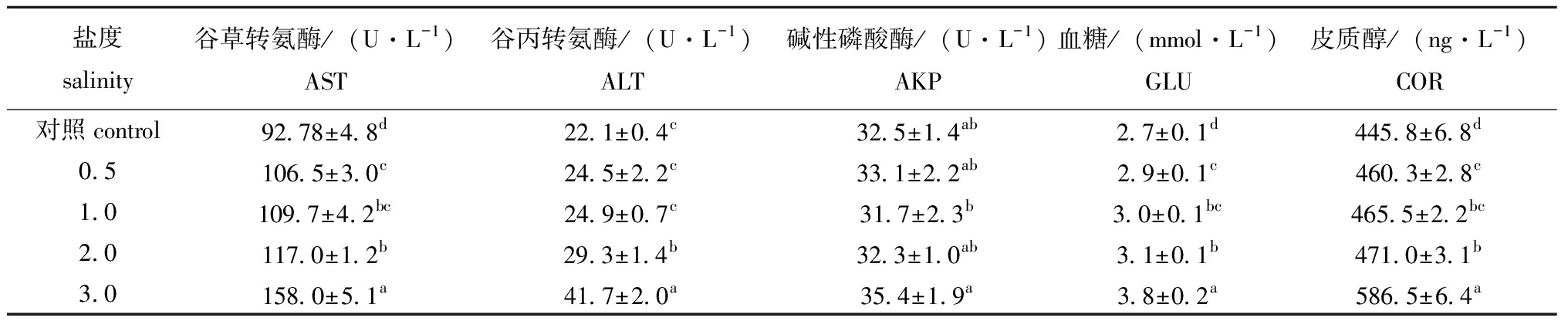
盐度salinity谷草转氨酶/(U·L-1)AST谷丙转氨酶/(U·L-1)ALT碱性磷酸酶/(U·L-1)AKP血糖/(mmol·L-1)GLU皮质醇/(ng·L-1)COR对照control92.78±4.8d22.1±0.4c32.5±1.4ab2.7±0.1d445.8±6.8d0.5106.5±3.0c24.5±2.2c33.1±2.2ab2.9±0.1c460.3±2.8c1.0109.7±4.2bc24.9±0.7c31.7±2.3b3.0±0.1bc465.5±2.2bc2.0117.0±1.2b29.3±1.4b32.3±1.0ab3.1±0.1b471.0±3.1b3.0158.0±5.1a41.7±2.0a35.4±1.9a3.8±0.2a586.5±6.4a
2.5 温度、盐度对草鱼抗氧化能力的影响
从表4可见,SOD、CAT、GSH-Px 3种抗氧化酶活性随温度升高呈先增加后降低的趋势,在16 ℃下保活48 h后SOD、GSH-Px和CAT活性均达最大值(189.0±5.1)U/mL、(242.0±3.4)U/mg、(6.7±0.3)U/mL,分别是对照组的1.6倍、1.4倍和3.4倍。MDA含量则随温度升高呈先降低后增加的趋势,12、14、24 ℃下MDA含量为对照组的2.8倍、2.1倍和2.4倍,表明鱼体产生大量活性氧自由基(reactive oxygen species,ROS),氧化应激强烈,损害肝脏导致抗氧化物酶活性下降,体内多余自由基无法被及时清除。16 ℃下保活48 h抗氧化物酶活性高于对照组说明该温度引起鱼体应激,在低温环境下,抗氧化物酶活性较高,对自由基的清除能力较强,抗逆性较强,故MDA含量低。从表5可见,随盐度增加GSH-Px含量呈先增加后降低的趋势,盐度为3时,3种酶活性显著下降且低于对照组(P<0.05),盐度低于3时,保活48 h后MDA含量为(9.4±0.4)nmol/mg,显著高于其他组(P<0.05),表明盐度为3时产生氧化应激强烈,可能对其肝脏组织造成一定损伤,而盐度为2时保活48 h后抗氧化酶活性高,MDA含量最低,表明长时间在盐度2条件下保活效果优于更高盐度环境。
表4 温度对草鱼抗氧化物酶系及脂质过氧化产物的影响
Tab.4 Effect of temperature on antioxidant enzyme system and lipid peroxidation products of Ctenopharyngodon idellus
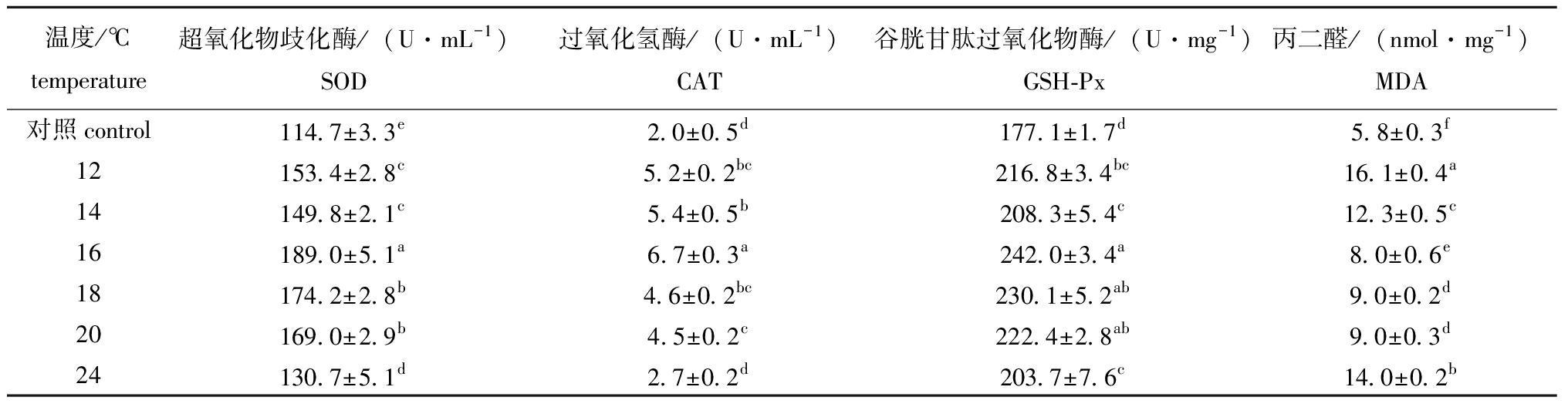
温度/℃temperature超氧化物歧化酶/(U·mL-1)SOD 过氧化氢酶/(U·mL-1)CAT 谷胱甘肽过氧化物酶/(U·mg-1)GSH-Px丙二醛/(nmol·mg-1)MDA 对照control114.7±3.3e2.0±0.5d177.1±1.7d5.8±0.3f12153.4±2.8c5.2±0.2bc216.8±3.4bc16.1±0.4a14149.8±2.1c5.4±0.5b208.3±5.4c12.3±0.5c16189.0±5.1a6.7±0.3a242.0±3.4a8.0±0.6e18174.2±2.8b4.6±0.2bc230.1±5.2ab9.0±0.2d20169.0±2.9b4.5±0.2c222.4±2.8ab9.0±0.3d24130.7±5.1d2.7±0.2d203.7±7.6c14.0±0.2b
表5 盐度对草鱼抗氧化物酶系及脂质过氧化产物的影响
Tab.5 Effect of salinity on antioxidant enzyme system and lipid peroxidation products of Ctenopharyngodon idellus

盐度salinity超氧化物歧化酶/(U·mL-1)SOD过氧化氢酶/(U·mL-1)CAT 谷胱甘肽过氧化物酶/(U·mg-1)GSH-Px丙二醛/(nmol·mg-1)MDA 对照control183.9±2.4b6.5±0.4b231.1±10.3d8.0±0.6b0.5189.0±5.1ab6.7±0.3b242.0±3.4c8.1±0.2b1.0189.7±3.2ab7.8±0.5a262.7±4.4b7.5±0.2b2.0195.4±1.8a8.5±0.4a290.5±3.4a6.4±0.3c3.0151.1±1.8c5.1±0.3c207.3±5.0e9.4±0.4a
2.6 盐度、温度血清生化指标及抗氧化指标热图相关性分析
图4是对2个水质因素和9项血液指标的皮尔森分析及曼特尔检验,以颜色梯度表示两两生化指标的相关性,蓝色表示正相关,红色表示负相关,颜色越深,相关性越强。此外,连接应激指标与生化指标线段的颜色和宽度分别代表统计学显著性和曼特尔检验r统计量[16]。从图4(a)可见,温度影响下ALT和AST、COR和GLU正相关(r>0.9);抗氧化指标SOD、GSH-Px和CAT正相关(r>0.8)。抗氧化物酶可及时清除过量ROS以减弱氧化应激反应,而MDA是氧化应激的终产物之一,故MDA与抗氧化酶呈负相关。温度与COR、GLU和GSH-Px之间存在显著相关性(0.5<r<0.8,P<0.01)。
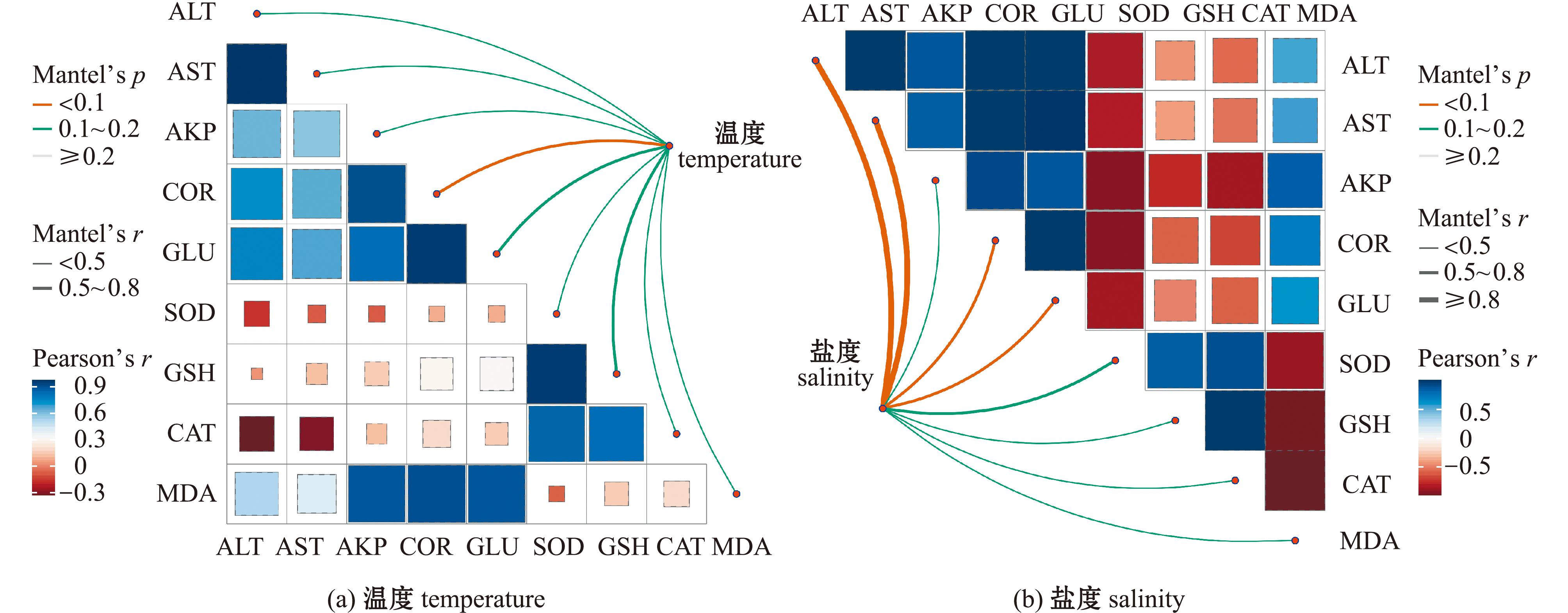
图4 生理生化指标和应激因素之间的皮尔森相关性分析和曼特尔检验
Fig.4 Pearson’s correlation analysis and Mantle’s test between physiological and biochemical indices and stress factors
COR是反映鱼体应激程度的重要指标,应激刺激垂体分泌促肾上腺皮质激素,引起皮质类固醇的分泌,进而影响血糖含量。GSH-Px作为抗氧化酶之一,主要参与抗氧化应激反应以清除自由基。从图4(b)可见,盐度影响下的5项血清生化指标均呈正相关(r>0.9),3种抗氧化物酶活性彼此之间高度正相关,抗氧化酶活性与MDA高度负相关,SOD与AST、ALT、AKP、COR、GLU存在负相关性,当血清生化指标中各种酶活升高,表明鱼体受到强烈应激,破坏鱼体肝脏、肾脏等多个器官,保活48 h后,肝脏受损,释放的抗氧化物酶含量显著降低,呈负相关性。盐度与ALT、AST、COR、GLU、SOD间存在显著正相关(0.5<r<0.8或r≥0.8,P<0.01)。综上,ALT与AST,COR与GLU、SOD、GSH-Px及CAT呈高度正相关,SOD、GSH-Px、CAT与MDA呈高度负相关。
3 讨论
3.1 温度、盐度对草鱼存活及水质的影响
水质在鱼类活运中具有重要意义,温度、盐度等均是关键指标[17]。临界温度是进行鱼类有水运输的极限温度,低于该温度鱼体死亡[18]。随温度升高,鱼体所受低温胁迫减弱,但高温下,鱼体代谢加速,不利于维持水体洁净,保活相同时长,总氨氮质量浓度随温度升高显著增加,这与黄盖鲽(Pleuronectes yokohama)、梭鲈(Sander lucioperca)的排氨率随温度降低而降低的研究一致[2-20],表明低温可有效降低鱼体新陈代谢,减缓水体中氨氮的富集速度,但当氨氮质量浓度超过9.0 mg/L时,肌肉细胞即表现出毒性[21]。增加水体盐浓度,提高水体离子浓度,使悬浮有机微粒及胶体变成絮状物沉降到池底,既减少溶解氧消耗又可净化水体,但盐度过高,将导致氧饱和度降低,影响渗透调节[22],导致存活率下降。盐度影响鱼体内渗透压平衡,改变体内外离子浓度,高盐度环境下溶菌酶活性降低,当盐度超过最适浓度后,损伤肝脏,进而影响鱼体免疫能力[23]。本试验中当盐度大于4时,保活48 h后水质变黄变浑浊,这与氨氮质量浓度升高有关,在该盐度下鱼鳞脱落,鱼体出现应激,刺激鱼体代谢,破坏渗透压平衡。试验表明,在淡水鱼的活运过程中,适当盐度可提高其存活时长,有利于保证水体洁净度,实现高效长途有水运输,但过量升高盐度,不利于鱼类保活。
3.2 温度、盐度对草鱼生理应激的影响
鱼类保活运输中,鱼体受多重胁迫产生应激反应,破坏体内稳态,多项血液学指标变化可间接反映鱼体生理状态。ALT和AST是鱼体内两种重要的转氨酶,主要参与蛋白质代谢和能量转化,在无明显应激时,两指标含量较低且稳定,当应激导致肝脏受损时,组织细胞膜通透性增大,组织内ALT和AST透过细胞膜进入血液中,引起血清中酶活性升高,可作为肝脏损伤标志物[24]。AKP是重要的非特异性磷酸酶,与酸性磷酸酶(acid phosphatase,ACP)相互作用,可催化几乎所有磷酸单酯水解反应,在消解病原体、细胞吞噬、蛋白质磷酸集团转移、钙磷吸收转化中发挥重要作用。出现应激时,ROS过量产生增加溶酶体膜通透性并促进溶酶体蛋白水解酶向胞浆释放[25],可反映鱼体非特异性免疫能力[12]。COR是反映鱼体应激程度的重要指标,应激刺激垂体分泌促肾上腺皮质激素,引起皮质类固醇的分泌,进而影响血糖含量。GSH-Px作为抗氧化酶之一,主要参与抗氧化应激。COR影响鱼体新陈代谢及免疫,是衡量鱼体应激程度的重要生物标志物[26],皮质醇水平与食物摄入量、转化效率、能量消耗和生长性能呈负相关[27]。
本试验中,当温度从12 ℃升至16 ℃,血清生化指标含量降低表明低温环境对鱼体的肝脏损伤严重,随温度升高低温胁迫减弱,16 ℃保活48 h后各生化指标含量均降至最小值,表明16 ℃下鱼体应激弱于其他温度组,相比对照组,在不同温度下保活48 h后,草鱼血清生化指标均显著升高,在16~20 ℃下保活48 h后,5项血清生化指标与对照组差异均较小,表明该温度范围下未对鱼体组织造成显著损伤,但18、20 ℃下鱼体应激敏感,代谢速度快,该温度下不适合长途运输,因此,16 ℃的低温更适合草鱼保活运输。盐度3条件下保活48 h鱼体明显应激,神经刺激释放皮质醇,肝脏及心肌组织释放酶类进入血液,导致各项生化指标含量升高。盐度为0.5~2,血清生化指标无显著变化,表明草鱼可适应盐度≤2的水体环境,但继续增加盐度将影响鱼体的免疫能力,这与邓平平等[28]发现长江刀鲚幼鱼ACP和AKP含量在低盐度下无显著变化,高盐度下则显著升高结论相似,均说明鱼类可特异性适应低盐度环境,但高浓度下产生盐度胁迫。
3.3 温度、盐度对草鱼氧化应激的影响
肝脏是鱼体内最大的腺体器官,具有代谢、营养吸收、免疫和抗氧化等多种功能,温度变化引起鱼体的应激反应,对肝脏造成损伤,影响鱼体的抗氧化能力。ROS的产生和抗氧化系统之间失衡导致DNA羟化、蛋白质变性、脂质过氧化,最终细胞凋亡,体内ROS加速脂质过氧化反应,生成MDA等物质[29],MDA因其细胞毒性、神经毒性导致血管硬化,使得组织细胞膜受损,肝脏抗氧化能力降低,是判断脂质过氧化和组织损伤的常规指标之一。SOD、CAT及GSH-Px是重要的抗氧化物酶系[30],其酶活性可反映鱼体内的氧化应激程度,SOD可催化O2-分解成O2和H2O2以消除超氧化物[31],H2O2被CAT、GSH-Px部分消除[32]。本试验中,12、14 ℃下鱼体肝脏受损,抗氧化物酶的释放量减少,24 ℃下鱼体代谢快,水质污染加速;在盐度3条件下保活48 h后鱼体因内外渗透压不平衡,导致肝脏抗氧化能力减弱,鱼体的抗氧化物酶活性均显著下降而MDA含量显著上升,表明在该盐度下随着保活时间延长,氧化应激增强,ROS增加,对鱼体肝脏损伤加重。
4 结论
1)本研究中通过梯度降温得到草鱼的半休眠温度为16 ℃,其临界低温为6~8 ℃。
2)通过分析不同温度下保活相同时长的草鱼血液学指标得出,当温度低于14 ℃即产生低温应激,水体温度超过24 ℃后鱼体代谢加快,应激敏感。因此,草鱼有水保活运输时应小于24 ℃,建议在16 ℃下开展有水保活运输。
3)草鱼作为淡水鱼,在暂养冷驯及保活过程中,盐度作为主要影响因素,合适的盐度可提高保活效率,当盐度为1~2时可保证水体清洁,有效延长保活时间,提高运输效率。
本试验均为实验室静态保活试验,结合产业实际,今后亟需开展动态试验,模拟实际运输情况,考虑运输过程中的复杂因素干扰,提高运输效率。
[1] 范秀萍,秦小明,章超桦,等.温度对有水保活石斑鱼代谢与鱼肉品质的影响[J].农业工程学报,2018,34(14):241-248.
FAN X P,QIN X M,ZHANG C H,et al.Effects of temperature on metabolism function and muscle quality of grouper during process of keeping alive with water[J].Transactions of the Chinese Society of Agricultural Engineering,2018,34(14):241-248.(in Chinese)
[2] 吴云辉,邱松林,蔡真珍,等.温度对黑鲷无水保活工艺的影响[J].热带生物学报,2016,7(3):314-317.
WU Y H,QIU S L,CAI Z Z,et al.Effects of temperatures on waterless storage of live black seabream[J].Journal of Tropical Biology,2016,7(3):314-317.(in Chinese)
[3] 张硕,陈岱,刘家林,等.pH、盐度和温度对海蜇耗氧率和排氨率的影响[J].水产学报,2023,47(4):53-63.
ZHANG S,CHEN D,LIU J L,et al.Effect of pH,salinity and temperature on the oxygen consumption rate and ammonia excretion rate of Rhopilema esculenta[J].Journal of Fisheries of China,2023,47(4):53-63.(in Chinese)
[4] BU X Y,ZHU J H,LIU S B,et al.Growth,osmotic response and transcriptome response of the euryhaline teleost,Oreochromis mossambicus fed different myo-inositol levels under long-term salinity stress[J].Aquaculture,2021,534:736294.
[5] DAWOOD M A O,ALKAFAFY M,SEWILAM H.The antioxidant responses of gills,intestines and livers and blood immunity of common carp (Cyprinus carpio) exposed to salinity and temperature stressors[J].Fish Physiology and Biochemistry,2022,48(2):397-408.
[6] 吕宏波,张志勇,张美玲,等.水体盐度与饲料脂肪含量对尼罗罗非鱼生长、营养组成和肉质的影响[J].水产学报,2020,44(7):1156-1172.
LÜ H B,ZHANG Z Y,ZHANG M L,et al.Influences of water salinity and dietary fat content on growth,nutrient composition and fillet quality of Nile tilapia (Oreochromis niloticus)[J].Journal of Fisheries of China,2020,44(7):1156-1172.(in Chinese)
[7] 刘发春.盐度对草鱼肌肉品质的影响[J].黑龙江水产,2022,41(5):29-31.
LIU F C.Effect of salinity on muscle quality of Ctenopharyngodon idella[J].Northern Chinese Fisheries,2022,41(5):29-31.(in Chinese)
[8] 林雅云,吴玉波,姜丹莉,等.不同麻醉方法对降低草鱼捕捉应激的作用[J].水生生物学报,2016,40(1):189-193.
LIN Y Y,WU Y B,JIANG D L,et al.The roles of different anesthesia methods in reducing handling stress of grass carp(Ctenopharyngodon idella)[J].Acta Hydrobiologica Sinica,2016,40(1):189-193.(in Chinese)
[9] 伍芳芳,林婉玲,李来好,等.草鱼脆化过程中肌肉品质变化[J].南方水产科学,2014,10(4):70-77.
WU F F,LIN W L,LI L H,et al.Quality change of grass carp(Ctenopharyngodon idellus)muscle during crisping process[J].South China Fisheries Science,2014,10(4):70-77.(in Chinese)
[10] 农业农村部渔业渔政管理局, 全国水产技术推广总站,中国水产学会.2023中国渔业统计年鉴[M].北京:中国农业出版社,2023.
Fisheries and Fisheries Administration Bureau of the Ministry of Agriculture and Rural, Affairs,National Fisheries Echnology Extension Center China Society of Fisheries.2023 China fishery statistical yearbook [M].Beijing: China Agriculture Press, 2023.(in Chinese)
[11] 袁圆玥,岑剑伟,李来好,等.二氧化碳麻醉对罗非鱼生理及品质的影响[J].南方水产科学,2022,18(4):147-155.
YUAN Y Y,CEN J W,LI L H,et al.Effect of carbon dioxide anesthesia on physiology and quality of tilapia[J].South China Fisheries Science,2022,18(4):147-155.(in Chinese)
[12] 袁仲瑾,岑剑伟,李来好,等.低温暂养对珍珠龙胆石斑鱼存活、非特异性免疫及抗氧化指标的影响[J].南方水产科学,2022,18(6):118-126.
YUAN Z J,CEN J W,LI LH,et al.Effect of low-temperature acclimation on survival,non-specific immune and antioxidant indexes of Epinephelus fuscoguttatus♀×E.lanceolatus♂[J].South China Fisheries Science,2022,18(6):118-126.(in Chinese)
[13] 生态环境部.水质氨氮的测定纳氏试剂分光光度法:HJ 535—2009[S].北京:中国环境科学出版社,2010.
Ministry of Environmental Protection of the People’s Republic of China.Waterquality-determinatiion of ammonia nitrogen-Nesslers reagent spectrophotometry:HJ535-2009[S].Beijing:China Environmental Science Press,2010.(in Chinese)
[14] 秦旭.彭泽鲫的低温休眠保活运输技术研究[D].南昌:南昌大学,2018.
QIN X.Study on the low temperature dormancy and survival transportation technology of pengze crucian carp (Carassius auratus var.Pengze)[D].Nanchang:Nanchang University,2018.(in Chinese)
[15] JIANG D L,WU Y B,HUANG D,et al.Effect of blood glucose level on acute stress response of grass carp Ctenopharyngodon idella[J].Fish Physiologyand Biochemistry,2017,43(5):1433-1442.
[16] TIAN L,WANG L.A meta-analysis of microbial community structures and associated metabolic potential of municipal wastewater treatment plants in global scope[J].Environmental Pollution,2020,263:114598.
[17] 陈旭,左涛,周胜杰,等.尖吻鲈幼鱼运输密度和时长对运输水质及其复苏率和抗氧化能力的影响[J].南方水产科学,2021,17(2):122-128.
CHEN X,ZUO T,ZHOU S J,et al.Effects of transport density and duration on transport water quality,resuscitation rate and antioxidant ability in juvenile Latescal carifer[J].South China Fisheries Science,2021,17(2):122-128.(in Chinese)
[18] 蔡晓芳,张晓林,周建频,等.大黄鱼生态冰温保活技术的初步研究[J].渔业现代化,2019,46(4):69-72,80.
CAI X F,ZHANG X L,ZHOU J P,et al.Preliminary study on ecological ice-temperature keep-alive technology of Larimichthy scrocea[J].Fishery Modernization,2019,46(4):69-72,80.(in Chinese)
[19] 付监贵,张振早,李彩娟,等.温度对不同体质量梭鲈幼鱼耗氧率、排氨率及窒息点的影响[J].水产养殖,2018,39(10):18-22.
FU J G,ZHANG Z Z,LI C J,et al.Effect of temperature on oxygen consumption rate,ammonia excretion rate and suffocation point of Sander lucioperca juvenile[J].Journal of Aquaculture,2018,39(10):18-22.(in Chinese)
[20] 崔前进,尚胜男,蔡忠璐,等.盐度、温度和体质量对钝吻黄盖鲽幼鱼排氨率和耗氧率的影响[J].上海海洋大学学报,2018,27(1):64-72.
CUI Q J,SHANG S N,CAI Z L,et al.Influence of salinity,temperature and body weight on oxygen consumption and ammonia excretion of Pleuronectes yokohama juvenile[J].Journal of Shanghai Ocean University,2018,27(1):64-72.(in Chinese)
[21] ZHAO C C,XU J T,XU X L,et al.Organ-specific responses to total ammonia nitrogen stress on juvenile grass carp (Ctenopharyngodon idellus)[J].Environmental Science and Pollution Research International,2019,26(11):10826-10834.
[22] DAWOOD M A O,METWALLY A E S,EL-SHARAWY M E,et al.The influences of ferulic acid on the growth performance,haemato-immunological responses,and immune-related genes of Nile tilapia (Oreochromis niloticus) exposed to heat stress[J].Aquaculture,2020,525:735320.
[23] SHAHJAHA N M,KHATUN M S,MUN M M,et al.Nuclear and cellular abnormalities of erythrocytes in response to thermal stress in common carp Cyprinus carpio[J].Frontiers in Physiology,2020,11:543.
[24] 庞旭.基于温度变化的鱼类生理生态(热耐受、代谢及游泳)响应研究[D].重庆:重庆大学,2014.
PANG X.Research on the fish eco-physiological (thermal tolerance,metabolism and swimming) response based on temperature changes[D].Chongqing:Chongqing University,2014.(in Chinese)
[25] GUO J S,WU P H,CAO J L,et al.The PFOS disturbed immunomodulatory functions via nuclear Factor-κB signaling in liver of zebrafish (Danio rerio)[J].Fish &Shellfish Immunology,2019,91:87-98.
[26] 葛海燕.皮质醇和壳聚糖对黄颡鱼免疫机能及生长的影响[D].武汉:华中农业大学,2007.
GE H Y.Effect of cortisol and chitosan on immune function and growth of yellow catfish[D].Wuhan:Huazhong Agricultural University,2007.(in Chinese)
[27] 胡静,叶乐,吴开畅,等.急性盐度胁迫对克氏双锯鱼幼鱼血清皮质醇浓度和Na+-K+-ATP酶活性的影响[J].南方水产科学,2016,12(2):116-120.
HU J,YE L,WU K C,et al.Effect of acute salinity stress on serum cortisol and activity of Na+-K+-ATPase of juvenile Amphiprion clarkii[J].South China Fisheries Science,2016,12(2):116-120.(in Chinese)
[28] 邓平平,施永海,汪洋,等.盐度对长江刀鲚幼鱼非特异性免疫酶和消化酶活力的影响[J].大连海洋大学学报,2016,31(5):533-537.
DENG P P,SHI Y H,WANG Y,et al.Effects of salinity on activities of non-specific immune and digestive enzymes in juvenile estuarine tapertail anchovy Coilia nasus[J].Journal of Dalian Ocean University,2016,31(5):533-537.(in Chinese)
[29] HOSEINIFAR S H,YOUSEFI S,VAN DOAN H,et al.Oxidative stress and antioxidant defense in fish:the implications of probiotic,prebiotic,and synbiotics[J].Reviews in Fisheries Science &Aquaculture,2021,29(2):198-217.
[30] 李豫,黄建盛,陈有铭,等.低温胁迫对军曹鱼幼鱼鳃组织抗氧化能力、细胞凋亡和组织结构的影响[J].南方水产科学,2023,19(3):68-77.
LI Y,HUANG J S,CHEN Y M,et al.Effect of low temperature stress on antioxidant stress,apoptosis and histological structure of gills in cobia(Rachycentron canadum)[J].South China Fisheries Science,2023,19(3):68-77.(in Chinese)
[31] LI H T,JIANG W D,LIU Y,et al.The metabolites of glutamine prevent hydroxyl radical-induced apoptosis through inhibiting mitochondria and calcium ion involved pathways in fish erythrocytes[J].Free Radical Biology& Medicine,2016,92:126-140.
[32] DONG M,LIANG Y M,RAMALINGAM R,et al.Proteomic characterization of the interactions between fish serum proteins and waterborne bacteria reveals the suppression of anti-oxidative defense as a serum-mediated antimicrobial mechanism[J].Fish &Shellfish Immunology,2017,62:96-106.