自工业革命以来,由于燃烧化石燃料、砍伐森林及工业化进程的加速,在过去的200多年里,大气中CO2水平增加了近40%,空气-海洋间气体交换导致海水pH下降[1-2],这种现象称为海水酸化。海水酸化的过程是复杂、漫长的,但其本质是附加的CO2和H2O反应形成 H2CO3,释放出H+,提高了海水的酸性[3-4]。根据联合国相关机构预测,到21世纪末,海水pH将降低0.3~0.5个单位,到24世纪初,大气中增加的CO2将会使海水pH降低0.7个单位[5]。尽管部分水生生物有一定的酸碱平衡调节能力[6],但大气中CO2含量升高引起海水pH降低,会导致多细胞海洋生物遭受细胞外液、机体外环境pH降低的叠加影响,对海洋生物造成一定损伤,尤其会给钙质动物带来更严重的危害。钙质动物是指体表有一层几丁质外壳的动物,如甲壳类。甲壳类动物需要从海水中获得碳酸钙作为合成自身外壳的原材料,而海水酸化导致海水的pH降低,从而使海水中碳酸根离子浓度降低,海洋中的碳酸盐不断溶解。碳酸盐减少会阻碍甲壳类动物形成外壳,影响甲壳类的生命活动[6]。
目前,国内外学者在海水酸化对甲壳类动物影响的研究中发现,岩瓷蟹(Petrolisthes cinctipes)胚胎在pH 7.6的酸化海水环境中暴露9 d,胚胎心率下降37%,体积增长速度、存活率和最终的孵化成功率均会受到影响[7];蜘蛛蟹(Hyas araneus)在CO2浓度升高的环境下,幼虫发育时间延长,生长速率及对温度的适应性降低[8];脊尾白虾(Exopalaemon carinicauda)在1 000 μL/L CO2条件胁迫下超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等抗氧化酶活性受到诱导,而在1 900 μL/L CO2条件胁迫下抗氧化酶活性被抑制[9];美洲螯龙虾(Homarus americanus)在CO2浓度增加时,耗氧率下降,且导致了氧化应激和DNA的损伤[10];挪威龙虾(Nephrops norvegicus)在海水酸化条件下体内血细胞数量减少,血细胞的吞噬能力下降[11];日本对虾(Marsupenaeus japonicus)在酸化环境中将处于较强的应激状态,生物代谢紊乱,机体免疫保护能力受到抑制,血清中的SOD活性降低[12]。
口虾蛄(Oratosquilla oratoria)广泛分布于中国沿海,现已成为中国近海渔业生产的重要种类之一[13]。目前尚未发现有关于海水酸化对口虾蛄影响方面的报道。本研究在实验室条件下,通过模拟海水酸化条件,探究了海水酸化对口虾蛄摄食、生长及呼吸代谢的影响,以期为海水酸化背景下科学养护口虾蛄资源提供科学参考。
1 材料与方法
1.1 材料
试验用口虾蛄购自大连市新长兴水产品市场,为健康、无损伤的个体,初始体质量为(10.90±0.33)g,初始体长为(10.21~11.50)cm。在实验室内暂养10 d,以适应实验室的环境条件。饲养海水为大连市黑石礁海区自然海水,经沉淀、砂滤处理后使用。自然海水pH为8.10±0.05,自然水温为(17.50±1.50) ℃,盐度为30±1。每天换水1次,换水量为总量的1/2,水体中DO≥5 mg/L。
1.2 方法
1.2.1 CO2气体的制备 调节海水pH用的CO2购于大连浚枫气体化学品有限公司,纯度为99.99%。
1.2.2 酸化海水制备 利用PVC输气管连接CO2气瓶、空气泵,经散气盘(Φ25 cm)向沉淀、砂滤后的自然海水中同时连续充入CO2气体和正常空气,以气体调节器(R82IN-40,上海敦阳流体设备有限公司)、流量计(LMF-1,陕西唐仪测控科技有限公司)控制CO2气体流量,分别制备pH 7.90、pH 7.70、pH 7.50的酸化海水。使用便携式pH计(MT4-FE28-METER,北京海富达科技有限公司)24 h监测pH变化,确保pH维持在设定水平。使用多功能水质分析仪(Quanta,哈希公司)监测水体水温、盐度、溶解氧(DO)。参照文献[14]中的方法测定各组养殖用海水总碱度,并计算CO2浓度[ρ(CO2)](表1)。试验过程中保持水体中DO≥5 mg/L。
表1 试验过程中各组海水参数
Tab.1 Seawater parameters in each group during the experiment
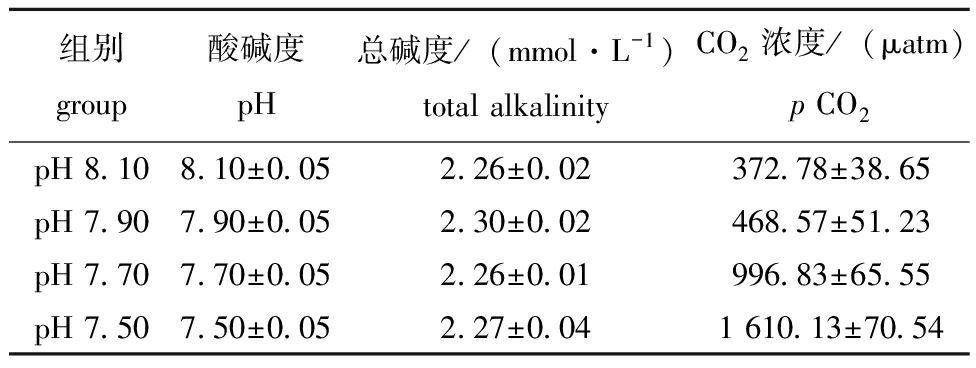
组别group酸碱度pH总碱度/(mmol·L-1)total alkalinityCO2浓度/(μatm)p CO2pH 8.108.10±0.052.26±0.02372.78±38.65pH 7.907.90±0.052.30±0.02468.57±51.23pH 7.707.70±0.052.26±0.01996.83±65.55pH 7.507.50±0.052.27±0.041 610.13±70.54
1.2.3 试验设计 以自然海水作为对照组养殖用水,以酸化海水作为处理组养殖用水。每组135尾口虾蛄,饲养于3个圆柱体水槽(PVC材质,高1.0 m,直径1.0 m)中,即每个水槽放养45尾,不铺设底质。试验开始前,将口虾蛄饲养于自然海水中,处理组所用海水pH每天降低0.05~0.10 个单位,于同一天达到各自设定数值,测定各组口虾蛄的体质量,开始正式试验。以菲律宾蛤仔(Ruditapes philippinarum)软体部为饵料,每天早晚各投喂1次,每次投喂量约为口虾蛄体质量的2%,保证饵料充足。每次投喂前,将上次剩余的饵料取出,并称重记录。每天换水1次,换水量为总量的1/2。各组所用水为相应pH海水,且处理组按照“1.2.2节”操作方法保持相应pH不变。
1.2.4 生长性能的测定 试验期间,每天记录口虾蛄的死亡情况,每7 d测定一次各组口虾蛄的体质量,并在每个水槽中随机取1 尾口虾蛄,将腹部的肌肉剥离,测定口虾蛄腹部的肌肉质量。计算口虾蛄的存活率(SR,%)、体质量增长率(WGR,%)、特定生长率(SGR,%/d)和机体含肉率(BMR,%),计算公式为
存活率(RSR)=N/N0×100%,
(1)
体质量增长率(RWGR)=[(W1-
W0)/W0]×100%,
(2)
特定生长率(RSGR)=[(lnW1-
lnW0)/t]×100%,
(3)
机体含肉率(RBMR)=(W2/W1)×100%。
(4)
式中:N0为试验初始口虾蛄尾数减去试验期间取样解剖和测定呼吸代谢用口虾蛄尾数(ind.);N为试验结束时口虾蛄尾数(ind.);W0为每个养殖阶段(7 d,下同)口虾蛄的初始体质量(g);W1为每个养殖阶段口虾蛄的终末体质量(g);W2为每个养殖阶段终末时口虾蛄腹部肌肉质量(g);t为每个养殖阶段的天数(d)。
1.2.5 摄食量的计算 统计每个养殖水槽中每7 d的饵料投入量、剩余量,计算出各组口虾蛄的日摄食量[F,g/(d·ind.)]。计算公式为
F=(Wf-Wt)/(t×N1)。
(5)
式中:Wf为每个养殖阶段投喂饵料的总质量(g),Wt为每个养殖阶段残留饵料的总质量(g),t为每个养殖阶段的天数(d),N1为该养殖阶段口虾蛄的尾数(ind.)。
1.2.6 呼吸代谢试验 采用密闭静水法测定口虾蛄的耗氧率和排氨率。分别在试验的0、7、21、35、49 d时,每组随机取6 尾口虾蛄,雌、雄各3 尾,停食12 h,然后分别置入装有相应pH海水的3个呼吸瓶(容积为11 L)中,即每个呼吸瓶中雌、雄各1尾,同时在另外3个呼吸瓶中只装有相应pH海水,作为空白对照。从呼吸瓶向外留置一根虹吸管。试验过程中,外端虹吸管用止水夹夹紧,呼吸瓶口用塑料保鲜膜封口。分别在试验开始前、24 h后利用虹吸管取出呼吸瓶内海水,采用碘量法、次溴酸盐氧化法分别测定海水中溶解氧质量浓度、氨氮质量浓度。试验结束后,将口虾蛄机体置于恒温干燥箱(DGG-9123A,上海森信实验仪器有限公司)45 ℃条件下烘干至恒重,称量机体干质量,计算口虾蛄的耗氧率[RR,mg/(g·h)]、排氨率[ER,mg/(g·h)]、氧氮比(O∶N),计算公式为
RRR=V(C1-C2)/(m×t),
(6)
RER=V(D2-D1)/(m×t),
(7)
O∶N=(RRR/16)/(RER/14)。
(8)
式中:V为呼吸瓶容积(L),C1为试验组试验开始前与24 h时海水中溶解氧质量浓度的差值(Δmg/L),C2为空白对照组试验开始前与24 h时海水中溶解氧质量浓度的差值(Δmg/L),m为口虾蛄机体干质量(g),t为试验时间(h),D1、D2分别为试验前后海水中氨氮质量浓度(mg/L)。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示。采用SPSS 26软件对试验数据进行图表制作、整理和统计,对试验数据进行单因素方差分析(one-way ANOVA)、Duncan多重比较,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 海水酸化对口虾蛄存活、生长的影响
从图1可见,49 d试验结束时,pH 8.10组(对照组)、pH 7.90组、pH 7.70组、pH 7.50组的存活率分别为98.41%±0.72%、98.10%±0.68%、97.74%±0.80%、95.31%±1.25%,pH 7.50组显著低于对照组(P<0.05)。从表2可见,试验期间,pH 7.90、pH 7.70、pH 7.50组口虾蛄的体质量增长率分别为15.04%~20.34%,13.07%~18.06%、12.00%~16.70%,而对照组的体质量增长率为17.60%~22.05%。口虾蛄的体质量增长率总体表现为随pH的降低呈逐渐降低趋势,在试验21~28 d,口虾蛄的体质量增长率达最大值。从14 d开始,pH 7.50组的体质量增长率与其他3组有显著性差异(P<0.05)。从表3可见,口虾蛄的特定生长率随pH的降低呈逐渐降低趋势。在14、21、35、49 d时pH 7.50组口虾蛄的特定生长率与其他3组有显著性差异(P<0.05)。随着时间的延长,各组口虾蛄特定生长率总体表现为下降趋势。从表4可见,口虾蛄的机体含肉率总体表现为随pH的降低而降低。从21 d开始,pH 7.50组口虾蛄机体含肉率与其他3组有显著性差异(P<0.05)。随着时间的延长,各组口虾蛄机体含肉率均呈上升趋势。

标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图1 不同pH条件下口虾蛄存活率
Fig.1 Survival rate of Oratosquilla oratoria at different pH values
表2 不同pH条件下口虾蛄的体质量增长率
Tab.2 Body weight growth rate of Oratosquilla oratoria at different pH values %
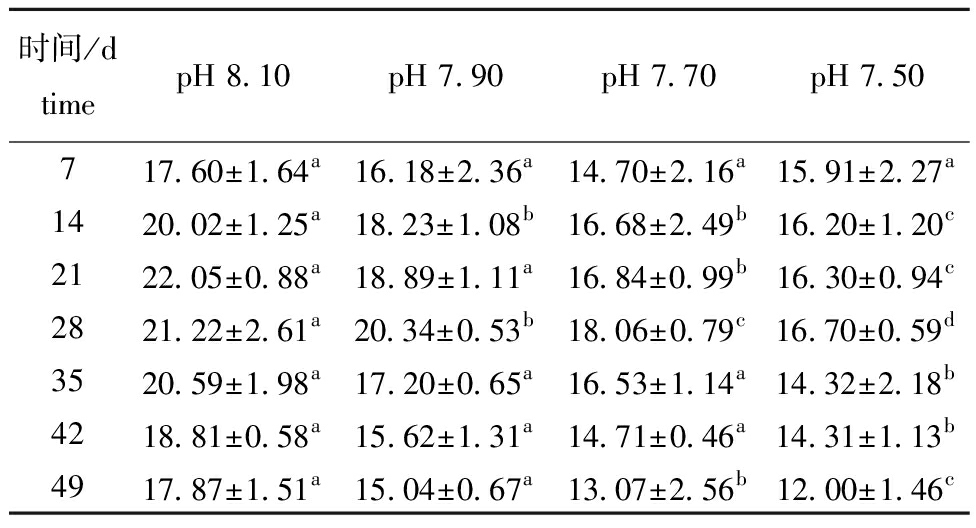
时间/dtimepH 8.10pH 7.90pH 7.70pH 7.50717.60±1.64a16.18±2.36a14.70±2.16a15.91±2.27a1420.02±1.25a18.23±1.08b16.68±2.49b16.20±1.20c2122.05±0.88a18.89±1.11a16.84±0.99b16.30±0.94c2821.22±2.61a20.34±0.53b18.06±0.79c16.70±0.59d3520.59±1.98a17.20±0.65a16.53±1.14a14.32±2.18b4218.81±0.58a15.62±1.31a14.71±0.46a14.31±1.13b4917.87±1.51a15.04±0.67a13.07±2.56b12.00±1.46c
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
表3 不同pH条件下口虾蛄的特定生长率
Tab.3 Specific growth rate of Oratosquilla oratoria at different pH values %
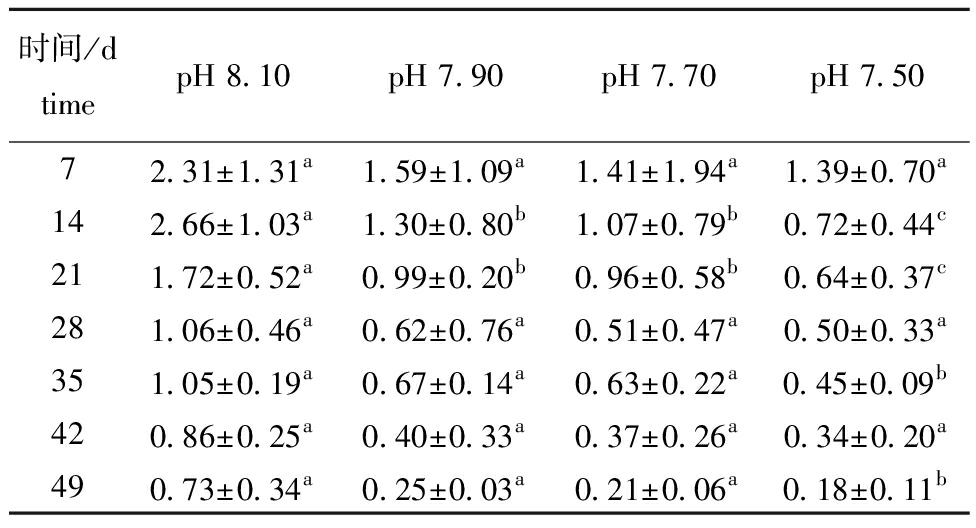
时间/dtimepH 8.10pH 7.90pH 7.70pH 7.5072.31±1.31a1.59±1.09a1.41±1.94a1.39±0.70a142.66±1.03a1.30±0.80b1.07±0.79b0.72±0.44c211.72±0.52a0.99±0.20b0.96±0.58b0.64±0.37c281.06±0.46a0.62±0.76a0.51±0.47a0.50±0.33a351.05±0.19a0.67±0.14a0.63±0.22a0.45±0.09b420.86±0.25a0.40±0.33a0.37±0.26a0.34±0.20a490.73±0.34a0.25±0.03a0.21±0.06a0.18±0.11b
表4 不同pH条件下口虾蛄的机体含肉率
Tab.4 Muscle index of Oratosquilla oratoria at different pH values %
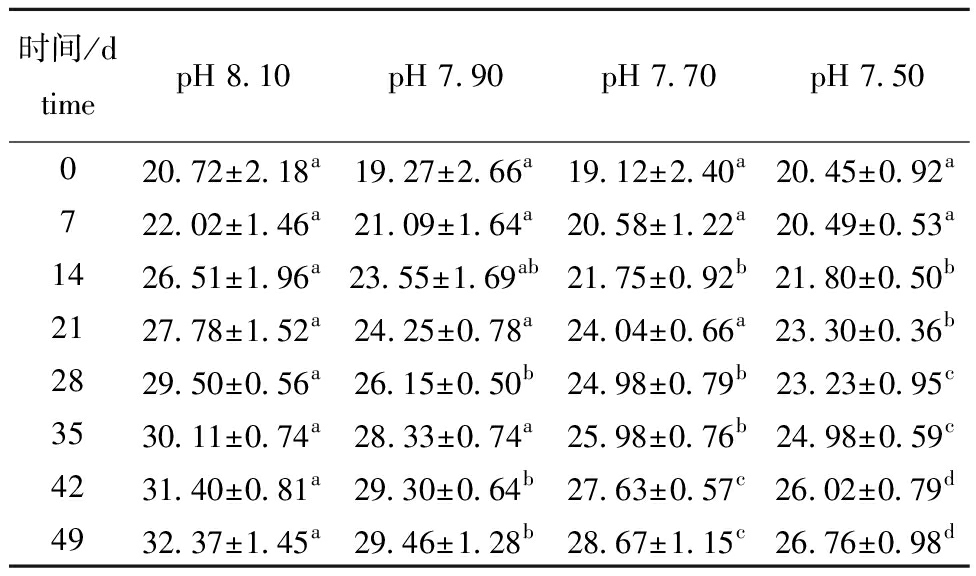
时间/dtimepH 8.10pH 7.90pH 7.70pH 7.50020.72±2.18a19.27±2.66a19.12±2.40a20.45±0.92a722.02±1.46a21.09±1.64a20.58±1.22a20.49±0.53a1426.51±1.96a23.55±1.69ab21.75±0.92b21.80±0.50b2127.78±1.52a24.25±0.78a24.04±0.66a23.30±0.36b2829.50±0.56a26.15±0.50b24.98±0.79b23.23±0.95c3530.11±0.74a28.33±0.74a25.98±0.76b24.98±0.59c4231.40±0.81a29.30±0.64b27.63±0.57c26.02±0.79d4932.37±1.45a29.46±1.28b28.67±1.15c26.76±0.98d
2.2 海水酸化对口虾蛄摄食的影响
从表5可见,口虾蛄日摄食量随着pH的下降而增加,且表现为随着时间的延长,各组日摄食量呈逐渐上升趋势。试验过程中,pH 7.70、pH 7.50组与对照组有显著性差异(P<0.05)。pH 7.90组在8~14 d、15~21 d、29~35 d、43~49 d时与对照组有显著性差异(P<0.05)。
表5 不同pH条件下口虾蛄的日摄食量
Tab.5 Daily food intake of Oratosquilla Oratoria at different pH values g/(d·ind.)
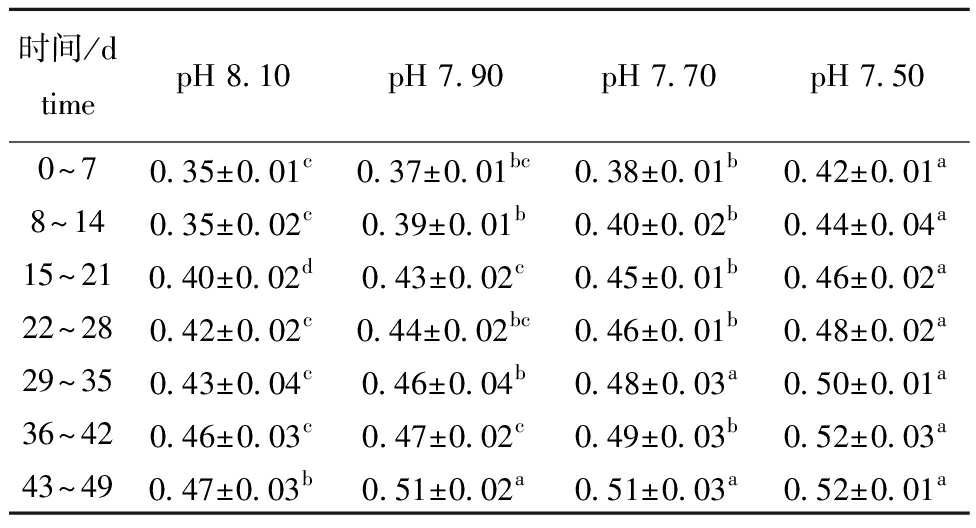
时间/dtimepH 8.10pH 7.90pH 7.70pH 7.500~70.35±0.01c0.37±0.01bc0.38±0.01b0.42±0.01a8~140.35±0.02c0.39±0.01b0.40±0.02b0.44±0.04a15~210.40±0.02d0.43±0.02c0.45±0.01b0.46±0.02a22~280.42±0.02c0.44±0.02bc0.46±0.01b0.48±0.02a29~350.43±0.04c0.46±0.04b0.48±0.03a0.50±0.01a36~420.46±0.03c0.47±0.02c0.49±0.03b0.52±0.03a43~490.47±0.03b0.51±0.02a0.51±0.03a0.52±0.01a
2.3 海水酸化对口虾蛄呼吸代谢的影响
2.3.1 海水酸化对口虾蛄耗氧率的影响 从图2、图3可见,随着pH的降低,口虾蛄的耗氧率呈现上升趋势。试验期间,pH 7.50组与对照组有显著性差异(P<0.05);21 d时pH 7.70组与对照组有显著性差异(P<0.05)。试验期间,对照组、pH 7.90组、pH 7.70组、pH 7.50组口虾蛄的平均耗氧率分别为(12.79±1.42)、(13.58±1.55)、(17.16±1.85)、(25.88±2.45) mg/(g·h),其中,pH 7.70组、pH 7.50组与对照组有显著性差异(P<0.05)。

标有不同字母者表示同一时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters in same time are significant differences in different groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图2 不同pH条件下口虾蛄的耗氧率
Fig.2 Effects of different pH values on average oxygen consumption of Oratosquilla oratoria
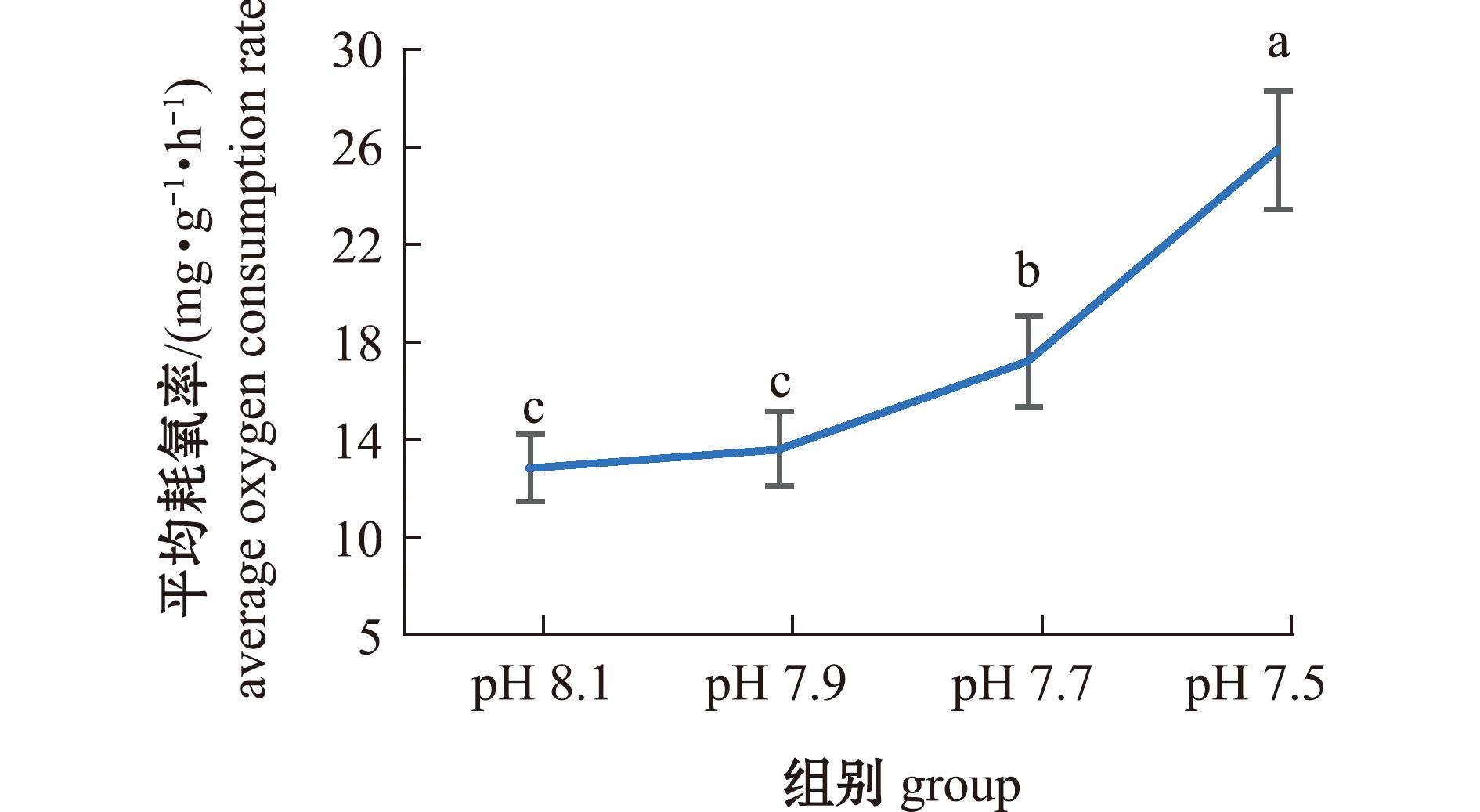
图3 不同pH条件下口虾蛄的平均耗氧率
Fig.3 Effects of different pH values on average oxygen consumption rate of Oratosquilla oratoria
2.3.2 海水酸化对口虾蛄排氨率的影响 从图4、图5可见,口虾蛄排氨率随pH降低呈逐渐上升趋势。在7、21、49 d时,pH 7.70、pH 7.50组与对照组间有显著性差异(P<0.05),35 d时3个处理组与对照组间均有显著性差异(P<0.05)。试验期间,对照组、pH 7.90、pH 7.70、pH 7.50组平均排氨率分别为(0.633±0.074)、(0.746±0.028)、(0.857±0.034)、(1.054±0.080)mg/(g·h),处理组与对照组间均有显著性差异(P<0.05)。
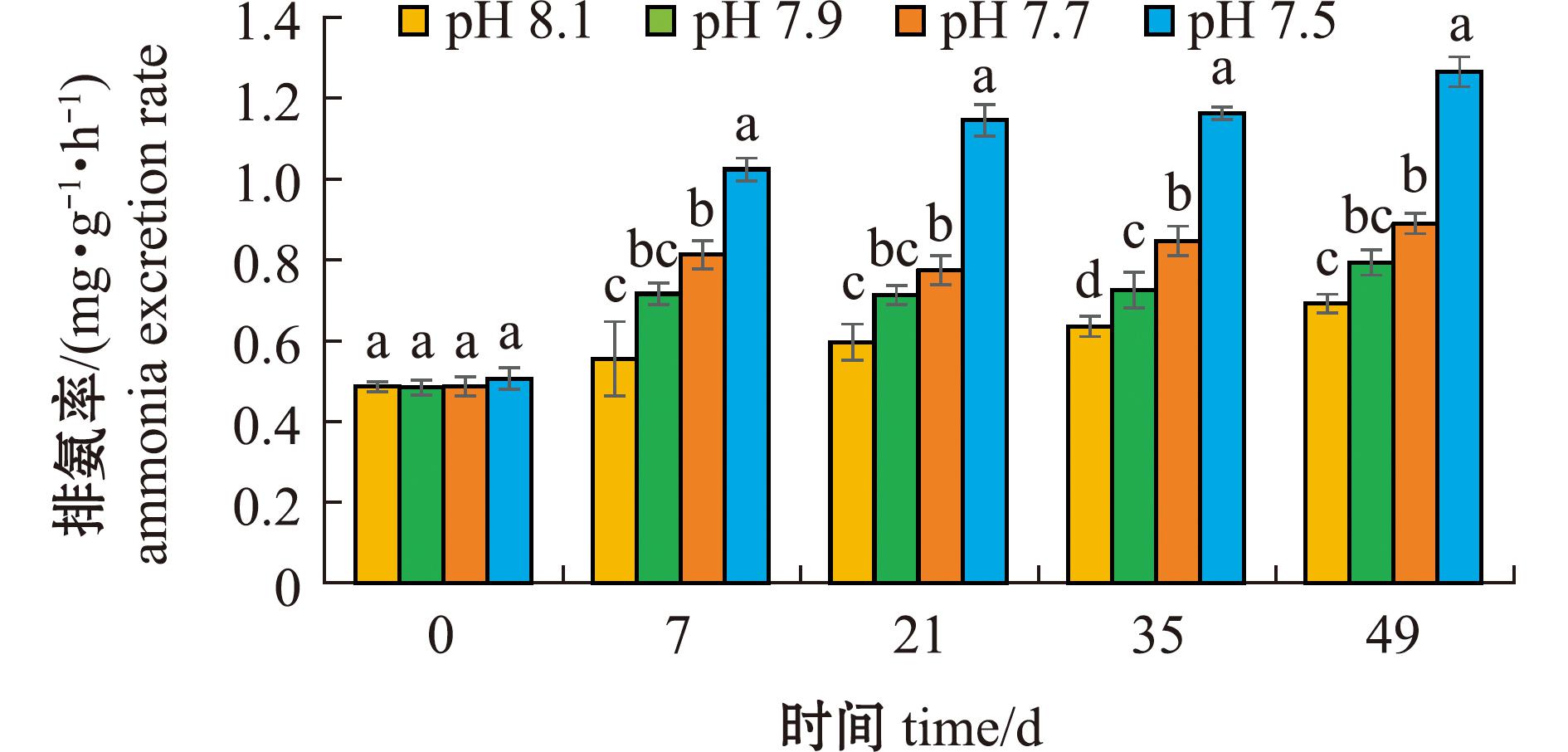
图4 不同pH条件下口虾蛄在不同时间的排氨率
Fig.4 Effects of different pH values on ammonia excretion rate of Oratosquilla oratoria at different time

图5 不同pH条件下口虾蛄的平均排氨率
Fig.5 Effects of different pH values on the average ammonia excretion rate of Oratosquilla oratoria
2.3.3 海水酸化对口虾蛄O∶N值的影响 从表6可见,随着pH的降低,O∶N值呈先降低后升高的趋势,pH 7.50组的O∶N值达最大值(21.48±0.82),其与对照组、pH 7.90组、pH 7.70组均有显著性差异(P<0.05)。
表6 不同pH条件下口虾蛄O∶N值的影响
Tab.6 Effects of different pH values on O∶N ratio of Oratosquilla oratoria
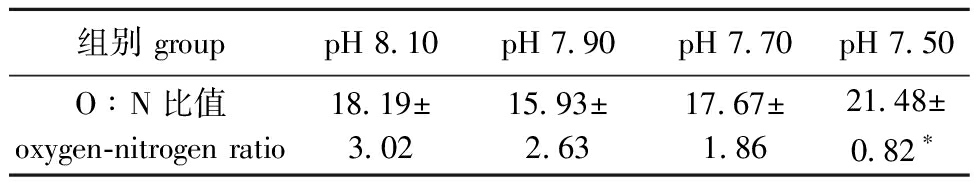
组别 grouppH 8.10pH 7.90pH 7.70pH 7.50O∶N比值oxygen-nitrogen ratio18.19±3.0215.93±2.6317.67±1.8621.48±0.82∗
注:*表示与对照组有显著性差异(P<0.05)。
Note:* means significant difference compared with the control (P<0.05).
3 讨论
3.1 海水酸化对口虾蛄生长的影响
海水pH是海洋生态系统中的关键因子,其细微变化都可能对海洋理化环境产生深刻影响[15]。存活率、体质量增长率、特定生长率、机体含肉率等存活、生长相关指标能够反映出生活环境相对于生物体的适宜程度。本研究中,在低pH条件下,口虾蛄的上述各项指标均随pH的降低而降低,表明海水酸化对口虾蛄的存活、生长产生了负面影响。这与对堪察加拟石蟹(Paralithodes camtschaticus )[16]、美洲螯龙虾[10]、挪威龙虾[11]和日本对虾[12]的研究结果相似。原因是在海水酸化的环境下,口虾蛄处于应激状态,生物代谢出现紊乱,机体免疫功能受损,或者生物分配给免疫功能的能量变少,导致存活率降低[15,17]。虽然海水酸化对口虾蛄的体质量增长率、特定生长率有负面影响,但pH 7.70、pH 7.50条件下口虾蛄的摄食量显著高于对照组,且口虾蛄的摄食量随pH的降低而增加。这与瘦尾胸刺水蚤(Centropages tenuiremis)[18]、日角猛水蚤(Tisbe sp.)[19]、日本虎斑猛水蚤(Tigriopus japonicus)[19]在低pH环境下摄食量增加的研究结果相似。
当外界pH变化时,甲壳动物会通过体内外离子交换来维持体内酸碱平衡[20],但这无疑需要长期消耗额外的能量以维持酸碱平衡调节机制,导致其他正常的生理功能下降,且生物维持体内离子平衡的代谢成本较高[21]。南极磷虾(Euphausia superba)在海洋酸化条件下可通过增加摄食率和提高分解代谢速率来产生能量,用以调节和缓解由于酸化导致的体内外酸碱失衡[22]。美洲螯龙虾在CO2浓度增加时,发生了氧化应激和DNA损伤,线粒体氧化应激触发细胞质信号通路,线粒体的数量倍增,以此满足生存于高浓度CO2环境下的能量需求,最终导致用于生长的能量减少[10]。另外,在研究海水酸化对光棘球海胆(Mesocentrotus nudus)[23]、大西洋鳕(Gadus morhua)[24]和海湾豹蟾鱼(Opsanus beta)[25]影响时发现,酸化环境会破坏肠道黏膜,进而影响了对食物的消化吸收功能。因此推测,口虾蛄在酸化环境下摄食量显著增加,但体质量增长率、特定生长率下降,有可能与口虾蛄通过增加对食物的摄入量来补偿抵御酸化胁迫所需的额外能量,进而维持生命活动,或者与消化系统受到损伤从而降低了吸收效率有关,这还有待进一步研究。
3.2 海水酸化对口虾蛄呼吸代谢的影响
耗氧率和排氨率是反映生物代谢的重要指标,Bao等[26]研究表明,生物所处环境的改变,食物状况及温度等都会影响生物体的耗氧率和排氨率。面对海水酸化胁迫,海洋生物通过将能量转移至关键的生理过程,以完成酸碱补偿,实现机体内的离子稳态,因此增加了应对海水酸化胁迫的能量消耗。本研究中发现,随着海水pH的降低,口虾蛄耗氧率和排氨率均呈上升趋势。目前,海水酸化对海洋动物代谢影响相关研究发现,随着海水pH降低,青蛤(Cyclina sinensis)的耗氧率和排氨率均呈上升趋势[27],波罗的海蛤蜊(Macoma balthica)则出现代谢率增加[28];南极鸭嘴蛤(Laternula elliptica)在pH 7.78时的耗氧率升高了2.3倍[29]。这可能是海水酸化影响了生物细胞内的离子浓度,生物体需提高自身代谢速率维持体内的离子平衡[30],以保证存活状态。美洲螯龙虾后期幼体在CO2浓度增加时,耗氧率下降,但头胸部与腹部的长度比值增大[10],岩瓷蟹幼体在pH 7.60时同样出现头胸部与腹部的长度比值增大现象[31]。上述生物在海水酸化条件下出现不同反应,主要与生物的发育阶段有关。口虾蛄、青蛤、波罗的海蛤蜊、南极鸭嘴蛤均为成体,而美洲螯龙虾、岩瓷蟹均处于变态幼体期,相比成体,其抵抗逆境能力较弱,因此美洲螯龙虾耗氧率出现下降趋势。然而,甲壳类的头胸部是呼吸、消化等器官所在的部位,幼体的头胸部与腹部的长度比值增大,能够维持足够的呼吸等代谢功能,这应该是应对海水酸化胁迫采取的一种自身保护策略[10]。
在动物界,摄取食物获取的能量主要用于生长、呼吸、繁殖和排泄等生理过程。氧氮比(O∶N)被广泛用于评估水生动物代谢能量供应底物(脂质、蛋白质和碳水化合物)状况[32]。当O∶N值小于7 时,能量完全由蛋白质氧化供应;当O∶N值低于24 时,能量主要由蛋白质供应;当O∶N值高于24 时,能量主要由脂肪供应[33]。研究表明,甲壳类动物会改变自身能量供应方式来应对环境变化。中华小长臂虾(Palaemonetes sinensis)在pH 8时,O∶N值小于7,由蛋白质供能;当pH 10 时,O∶N值高于24,转变为由脂肪供能[34]。企鹅珍珠贝(Pteria penguin)在盐度34 时,以脂肪和碳水化合物的分解代谢为主,在低盐度和高盐度下,蛋白质代谢比例较大[35]。在本研究中,pH 7.90、pH 7.70组口虾蛄的平均O∶N值虽然低于对照组,但无显著性差异,而pH 7.50组口虾蛄O∶N值显著升高,这与Enzor等[36]对低pH环境下鱼类呼吸急剧增加相一致。推测应该是pH 7.90、pH 7.70组的环境对口虾蛄产生一定胁迫作用,口虾蛄呼吸活动增强、排泄增加,为维持体内离子平衡状态,排泄增幅更大;pH 7.50组的环境条件对口虾蛄产生了较严重的胁迫作用,导致呼吸急促,而为能将更多的能量用于维持生存,口虾蛄用于排泄的能量相对减少,导致O∶N值显著升高。在本研究中,口虾蛄的O∶N值为15.93~21.48,可见在pH分别为7.90、7.70、7.50时,口虾蛄的代谢底物以蛋白质为主。
4 结论
1)口虾蛄对海水酸化有一定的耐受力,但适应范围有限。低pH环境(pH 7.50~7.90)对口虾蛄生存、摄食和生长产生不利影响,并可提高口虾蛄耗氧率、排氨率;口虾蛄代谢底物以蛋白质为主。
2)相比其他常见的水产动物,口虾蛄是生存能力较强的种类,但在酸化海水环境中表现出异常状态。本研究结果为大气中CO2浓度增加且引起海水酸化背景下如何科学制定养护口虾蛄资源的方案提供了数据参考。
[1] 许友卿,唐旎,丁兆坤.海水酸化对水生动物主要抗氧化酶的影响及机理[J].水产科学,2016,35(4):453-458.
XU Y Q,TANG N,DING Z K.Effect and mechanism of ocean acidification on main antioxidant enzyme activity in aquatic animals[J].Fisheries Science,2016,35(4):453-458.(in Chinese)
[2] 张达娟,毕相东,张树林,等.海水酸化和铁离子对中肋骨条藻光化学活性的影响[J].大连海洋大学学报,2022,37(2):244-250.
ZHANG D J,BI X D,ZHANG S L,et al.Effects of ocean acidification and Fe ion on photochemical activity of alga Skeletonema costatum[J].Journal of Dalian Ocean University,2022,37(2):244-250.(in Chinese)
[3] FABRY V J,SEIBEL B A,FEELY R A,et al.Impacts of ocean acidification on marine fauna and ecosystem processes[J].ICES Journal of Marine Science,2008,65(3):414-432.
[4] BAAG S,MANDAL S.Combined effects of ocean warming and acidification on marine fish and shellfish:a molecule to ecosystem perspective[J].The Science of the Total Environment,2022,802:149807.
[5] KWIATKOWSKI L,TORRES O, BOPP L, et al. Twenty-first century ocean warming, acidification, deoxygenation, and upper ocean nutrient decline from CMIP6 model projections[J].Biogeosciences,2020,17(13):3439-3470.
[6] 李天骄.海洋酸化对日本囊对虾摄食、潜沙、游动行为的影响以及耐低pH性状的遗传参数评估[D].厦门:厦门大学,2020.
LI T J.Effects of ocean acidification on feeding,sand diving and swimming behavior of Marspenaeus japonicus and evaluation of genetic parameters for low pH tolerance[D].Xiamen:Xiamen University,2020.(in Chinese)
[7] CHRISTOPHER LONG W,SWINEY K M,FOY R J.Effects of ocean acidification on the embryos and larvae of red king crab,Paralithodes camtschaticus[J].Marine Pollution Bulletin,2013,69(1/2):38-47.
[8] WALTHER K,ANGER K,PÖRTNER H O.Effects of ocean acidification and warming on the larval development of the spider crab Hyas araneus from different latitudes (54° vs.79°N)[J].Marine Ecology Progress Series,2010,417:159-170.
[9] 李晨辉,王梦杰,彭艳青,等.海洋酸化对脊尾白虾抗氧化酶活性的影响[J].淮海工学院学报(自然科学版),2018,27(4):78-83.
LI C H,WANG M J,PENG Y Q,et al.Effect of ocean acidification on activities of antioxidant enzyme in Exopalaemon carinicauda[J].Journal of Huaihai Institute of Technology (Natural Science Edition),2018,27(4):78-83.(in Chinese)
[10] MENU-COUREY K,NOISETTE F,PIEDALUE S,et al.Energy metabolism and survival of the juvenile recruits of the American lobster (Homarus americanus) exposed to a gradient of elevated seawater pCO2[J].Marine Environmental Research,2019,143:111-123.
[11] HERNROTH B,SKÖLD H N,WIKLANDER K,et al.Simulated climate change causes immune suppression and protein damage in the crustacean Nephrops norvegicus[J].Fish &Shellfish Immunology,2012,33(5):1095-1101.
[12] 赵先银,李健,李吉涛,等.pH胁迫对日本对虾非特异性免疫因子及RNA/DNA比值的影响[J].渔业科学进展,2011,32(1):60-66.
ZHAO X Y,LI J,LI J T,et al.Effects of pH stress on non-specific immune factors and RNA/DNA ratio of Marsupenaeus japonicus[J].Progress in Fishery Sciences,2011,32(1):60-66.(in Chinese)
[13] 隋宥珍,刘连为,徐开达,等.基于线粒体Cytb基因的口虾蛄种群遗传结构研究[J].大连海洋大学学报,2019,34(3):355-361.
SUI Y Z,LIU L W,XU K D,et al.Population genetic structure of mantis shrimp Oratosquilla oratoria based on the partial mitochondrial DNA cytochrome b gene[J].Journal of Dalian Ocean University,2019,34(3):355-361.(in Chinese)
[14] 尹文露,崔东遥,李莹莹,等.中间球海胆丙酮酸激酶(PK)基因克隆及其对海水酸化的响应[J].大连海洋大学学报,2020,35(3):360-367,9-10.
YIN W L,CUI D Y,LI Y Y,et al.Cloning and response of pyruvate kinase(PK) gene to seawater acidification in sea urchin Strongylocentrotus intermedius[J].Journal of Dalian Ocean University,2020,35(3):360-367,9-10.(in Chinese)
[15] BURNS W C G.Anthropogenic carbon dioxide emissions and ocean acidification:the potential impacts on ocean biodiversity[M]//ASKINS R A,DREYER G D,VISGILIO G R,et al.Saving Biological Diversity.Boston,MA:Springer,2008:187-202.
[16] LONG W C,SWINEY K M,HARRIS C,et al.Effects of ocean acidification on juvenile red king crab (Paralithodes camtschaticus) and Tanner crab (Chionoecetes bairdi) growth,condition,calcification,and survival[J].PLoS One,2013,8(4):e60959.
[17] CAMACHO C,MAULVAULT A L,SANTOS M T,et al.Mercury in juvenile Solea senegalensis:linking bioaccumulation,seafood safety,and neuro-oxidative responses under climate change-related stressors[J].Applied Sciences,2020,10(6):1993.
[18] LI W,GAO K S.A marine secondary producer respires and feeds more in a high CO2 ocean[J].Marine Pollution Bulletin,2012,64(4):699-703.
[19] 孙艳桃,慕芳红,韦晓慧,等.海水酸化对日角猛水蚤和日本虎斑猛水蚤摄食率的影响[J].海洋湖沼通报,2014(3):105-111.
SUN Y T,MU F H,WEI X H,et al.Effect of seawater acidification on ingestion rates of Tisbe sp. and Tigriopus japonicus[J].Transactions of Oceanology and Limnology,2014(3):105-111.(in Chinese)
[20] WHITELEY N M.Physiological and ecological responses of crustaceans to ocean acidification[J].Marine Ecology Progress Series,2011,430:257-271.
[21] LEONG P,MANAHAN D.Metabolic importance of Na+/K+-ATPase activity during sea urchin development[J].The Journal of Experimental Biology,1997,200(Pt 22):2881-2892.
[22] SABA G K,SCHOFIELD O,TORRES J J,et al.Increased feeding and nutrient excretion of adult Antarctic krill,Euphausia superba,exposed to enhanced carbon dioxide (CO2)[J].PLoS One,2012,7(12):e52224.
[23] 李莹莹,崔东遥,程操,等.光棘球海胆TGFBR2基因的克隆及其对海水酸化的响应[J].基因组学与应用生物学,2020,39(12):5507-5519.
LI Y Y,CUI D Y,CHENG C,et al.Cloning and characterization of TGFBR2 gene in the sea urchin Mesocentrotus nudus and its response to seawater acidification[J].Genomics and Applied Biology,2020,39(12):5507-5519.(in Chinese)
[24] HU M Y,MICHAEL K,KREISS C M,et al.Temperature modulates the effects of ocean acidification on intestinal ion transport in Atlantic cod,Gadus morhua[J].Frontiers in Physiology,2016,7:198.
[25] HEUER R M,ESBAUGH A J,GROSELL M.Ocean acidification leads to counterproductive intestinal base loss in the gulf toadfish (Opsanus beta)[J].Physiological and Biochemical Zoology:PBZ,2012,85(5):450-459.
[26] BAO J,LI X D,YU H,et al.Respiratory metabolism responses of Chinese mitten crab,Eriocheir sinensis and Chinese grass shrimp,Palaemonetes sinensis,subjected to environmental hypoxia stress[J].Frontiers in Physiology,2018,9:1559.
[27] 高山,梁健,李永仁,等.海水酸化对青蛤耗氧率和排氨率的影响[J].水产科学,2017,36(6):758-762.
GAO S,LIANG J,LI Y R,et al.Effect of ocean acidification on respiration rate and excretion rate in clam Cyclina sinensis[J].Fisheries Science,2017,36(6):758-762.(in Chinese)
[28] JAKUBOWSKA M,NORMANT-SAREMBA M.The effect of CO2-induced seawater acidification on the behaviour and metabolic rate of the Baltic clam Macoma balthica[J].Annales Zoologici Fennici,2015,52(5/6):353-367.
[29] CUMMINGS V,HEWITT J,VAN ROOYEN A,et al.Ocean acidification at high latitudes:potential effects on functioning of the Antarctic bivalve Laternula elliptica[J].PLoS One,2011,6(1):e16069.
[30] THOMSEN J,MELZNER F.Moderate seawater acidification does not elicit long-term metabolic depression in the blue mussel Mytilus edulis[J].Marine Biology,2010,157(12):2667-2676.
[31] CARTER H A,CEBALLOS-OSUNA L,MILLER N A,et al.Impact of ocean acidification on metabolism and energetics during early life stages of the intertidal porcelain crab Petrolisthes cinctipes[J].The Journal of Experimental Biology,2013,216(Pt 8):1412-1422.
[32] TSENG Y C,HWANG P P.Some insights into energy metabolism for osmoregulation in fish[J].Comparative Biochemistry and Physiology Toxicology &Pharmacology:CBP,2008,148(4):419-429.
[33] MAYZAUD P,CONOVER R J.O∶N atomic ratio as a tool to describe zooplankton metabolism[J].Marine Ecology Progress Series,1988,45:289-302.
[34] 姜宏波,包杰,姜春玖,等.pH对中华小长臂虾存活及呼吸代谢的影响[J].动物学杂志,2017,52(2):322-330.
JIANG H B,BAO J,JIANG C J,et al.Effects of pH on survival and respiratory metabolism of Chinese grass shrimp(Palaemonetes sinensis)[J].Chinese Journal of Zoology,2017,52(2):322-330.(in Chinese)
[35] 成书营,黄桂菊,潘俐玲,等.盐度对企鹅珍珠贝耗氧率和排氨率的影响[J].广东农业科学,2012,39(16):135-137.
CHENG S Y,HUANG G J,PAN L L,et al.Effects of salinity on oxygen consumption and ammonia-N excretion rates in winged pearl oyster,Pteria penguin[J].Guangdong Agricultural Sciences,2012,39(16):135-137.(in Chinese)
[36] ENZOR L A,PLACE S P.Is warmer better?Decreased oxidative damage in notothenioid fish after long-term acclimation to multiple stressors[J].The Journal of Experimental Biology,2014,217(Pt 18):3301-3310.