入海河口是海陆物质交汇、能量流动和海洋生物迁徙的重要通道,在涵养水源、调节气候和维持生物多样性等方面发挥着重要功能。海洋潮流和陆地径流共同作用下的滨海湿地和咸淡水交汇区即为河口,是海洋生物产卵、孵育和栖息的重要场所,具有较高的初级生产力和物种多样性,因此,河口生态系统被认为是全球最具有生产力的生态系统之一,由于其具有较高的开放性,所以更加脆弱敏感,随着人类活动的加剧,河口生态系统的生态环境问题日益显著。鱼类在维持河口生态平衡中具有重要作用,不同类型的鱼类共同构成了河口生态系统的物种多样性,从而增加了系统的稳定性和抗干扰能力。然而,近年来,过度捕捞、海洋污染和气候变化等因素对河口生态系统和鱼类种群造成了较严重威胁,鱼类多样性显著衰退,因此要加强鱼类多样性调查,为科学评估提供可靠依据。
传统的鱼类多样性检测方法主要通过直接捕获样本及视觉或声学观察,其中,直接捕获样本通过底拖网、地笼网及流刺网等方式,然而,这些方式不仅会破坏海床和底栖群落,且采样效率低,成本高,检验过程较依赖经验丰富的分类学专家,受到限制较多。视觉或声学观察相对环保,不会损伤鱼类,但河口生态系统理化条件复杂,水质浑浊,严重影响其观察的效率和准确性[1]。
环境DNA宏条形码技术是指可从环境样品(如水、土壤和空气等)中直接提取到的DNA片段的总和,是来自动物、植物等不同物种DNA的混合物,既包含生物体经由皮肤、尿液、粪便和黏液等释放到环境中表皮细胞中的胞内DNA,也包括细胞死亡后裂解释放到环境中的胞外DNA[2],通过对其进行保存、提取、扩增、测序和分类,进而确定目标生物在研究区域内的分布状况[3]。与传统底拖网等调查方法相比,环境DNA宏条形码技术具有简单高效、灵敏度高、覆盖面积大和环境友好等特点[4],已有多项研究表明,环境DNA调查结果的检出率普遍高于传统调查方法[5-7]。环境DNA宏条形码技术非常适合用于河口等生态系统鱼类多样性的研究,是调查和评估鱼类多样性的一个潜在的强大工具。
随着环境DNA宏条形码技术的迅速发展,越来越多的科研工作者开始重视该技术。目前,国内运用环境DNA宏条形码技术进行河口鱼类多样性的研究非常有限,关于渤海和北黄海河口的鱼类多样性调查更是知之甚少,因此,开展渤海和黄海北部河口及邻近水域鱼类群落结构的研究具有重要的生态意义。本研究中对两处海域的鱼类群落结构、多样性特征和空间变化等进行了研究,以期为黄渤海渔业资源的保护和可持续利用提供科学依据。
1 材料与方法
1.1 研究区域
渤海与北黄海是两处相邻海域,渤海被山东半岛、辽东半岛和华北平原环绕,仅东部以渤海海峡与黄海相通,是一个半封闭的大陆架浅海,北黄海位于中国大陆与朝鲜半岛之间,是一个相对开放的海域。本次调查于2021年8月进行,调查区域位于121°18′~124°19′E,39°10′~40°54′N(图1)。根据黄渤海海域地理特征,两个海域各选取6个河口进行样品采集。其中S1~S6位于渤海海域,分别是复州河(FZH,S1)、万家河(WJH,S2)、浮渡河(FDH,S3)、大清河(DQH,S4)、大辽河(DLH,S5)和双台河(STH,S6);S7~S12位于黄海海域,分别是登沙河(DSH,S7)、碧流河(BLH,S8)、赞子河(ZZH,S9)、英那河(YNH,S10)、大洋河(DYH,S11)和鸭绿江(YLJ,S12)。
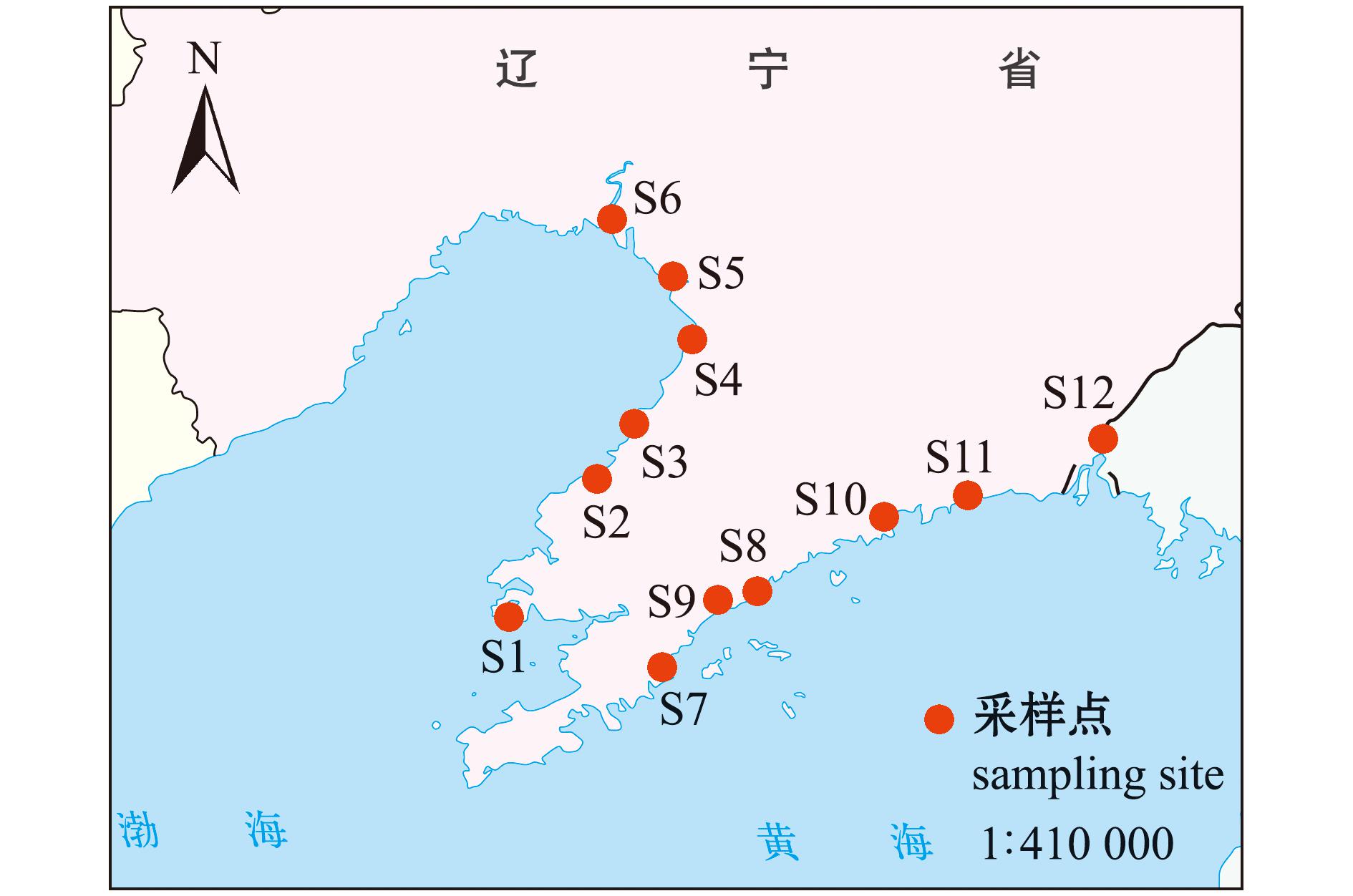
本图基于自然资源部标准地图服务网站GS(2019)3266号标准地图为底图,底图边界无修改。
The figure is based on the standard map GS(2019)3266 in the Standard Map Service website of Ministry of Natural Resources of the People’s Republic of China,with no modifications of the boundaries in the standard map.
图1 辽东半岛重要河口采样点位图
Fig.1 Important estuarine sampling sites of Liaodong Peninsula
1.2 方法
1.2.1 环境DNA样本的采集 每个河口设置1个采样点位,每个点位设置采集3次,每次采集5 L表层水于无菌采样瓶中(采样深度为海面下0.5 m水层),共计36个水样,具体采样点位信息见图1。试验前重复使用的采样瓶浸泡在漂白剂中≥5 min,用蒸馏水冲洗3次,并晾干。在采样点,采集瓶再次用水样冲洗3次,除去残留的漂白剂,确保清洗后丢弃的水样未与待取水样混合。为避免样品污染,取样时采样人员只从外部接触采样瓶,不得接触采样瓶及瓶盖内部,操作全程佩戴一次性无菌手套。水样采集后选用冰袋或4 ℃下短暂保存,并在12 h内送往实验室,运输中仔细保管样品,以确保样品无破损、无污染,避免强光照射及强烈振荡。实验室无菌操作下使用0.22 μm无菌滤膜(广东环凯微生物科技有限公司)真空抽滤,为避免交叉污染,每个点位水样过滤后,过滤装置均会进行次氯酸钠(浓度≥1.5%)消毒、纯净水反复清洗、水样润洗等,滤膜保存至-80 ℃冰箱中,直至DNA提取。
1.2.2 环境DNA提取、PCR扩增及高通量测序 为避免试验过程中人为操作对样品造成的潜在污染,环境DNA提取实验室和PCR实验室须在物理空间上相互独立,不应有空气直接相通,且PCR实验室配备紫外线超净工作台,DNA提取和PCR扩增试验不在同一天进行。试验操作前,采用1.5%的漂白剂擦拭桌面,用75%乙醇消毒双手(均为体积分数),采用1.5%的漂白剂消毒试验仪器,所有试验耗材须进行高压蒸气灭菌。
使用PowerWater® DNA Isolation Kit(MOBIO,USA)分离试剂盒按说明书步骤在无菌操作台中进行环境DNA提取。提取完成后,使用NanoDrop(Thermo Fisher Scientific,Carlsbad,CA,USA)测定DNA的浓度及质量,浓度需低于80 ng/μL,过高浓度需使用缓冲液稀释。
使用鱼类通用引物CO1(MlCOIintF:5′GGWACWGGWTGAACWGTWTAYCCYCC 3′;JghHCO2198:5′TAIACYTCIGGRTGICCRAARAAYCA 3′)[8]对eDNA模板进行PCR扩增,扩增长度约314 bp。PCR扩增体系(20 μL)的模板DNA(10 ng/μL)为2.5 μL,正、反向引物(10 μmol/L)各0.8 μL,dNTPs为2 μL,5×反应缓冲液为4 μL,聚合酶为0.4 μL,ddH2O为9.5 μL。PCR反应程序:95 ℃下预变性5 min;95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸45 s,共进行27个循环;最后在72 ℃下再延伸10 min。每次PCR反应使用ddH2O为模板作PCR阴性对照。进行PCR扩增时,每个样本进行3次重复,并将同一样本的产物混合。
PCR产物使用20 g/L浓度的琼脂糖凝胶电泳检测,电泳完成后,要求PCR扩增产物有目的条带,且条带清晰单一,所有阴性对照均无显著条带,表明从采样、过滤、DNA提取至PCR扩增均无外源DNA污染。36个样本均获得可检测的PCR产物,然后使用AxyPrep DNA Gel Extraction Kit(AXYGEN公司)凝胶回收试剂盒对PCR产物进行纯化处理,并利用Qubit测定纯化产物浓度,纯化产物DNA浓度要求大于2.5 ng/μL,切胶回收。PCR产物委托上海凌恩生物科技有限公司进行测序。每个样品的PCR产物单独建库,然后使用Illumina NovaSeq 6000测序平台(Illumina公司)进行第二代高通量测序。
1.2.3 生物信息学分析 二代测序得到的序列首先需根据barcode得到所有样品的有效序列,然后对reads的质量进行质控,过滤掉所有长度小于50 bp的序列;接着根据序列片段之间的重叠关系,将成对的片段拼接成一条序列;最后按照barcode和引物序列拆分得到每个样本的优质序列,并在过程中根据正反barcode和引物方向校正序列方向及去除嵌合体。再利用Usearch(v11.0.667)[9]优化各样本序列获得分类操作单元(operational taxonomic unit,OTU),并按序列一致性≥97%进行OTU聚类分析。为保证数据完整性,以NCBI(https://www.ncbi.nlm.nih.gov/)和MitoFish(http://mitofish.aori.u-tokyo.ac.jp/download.html)数据库为数据来源,搜索并下载黄渤海海域历史记录中的所有鱼类,建立本地数据库。将OTU数目阈值小于10的序列自动忽略,导出通过blastn(identity>97%,E value<10-5)比对后的OTU,将各采样点中未匹配到物种的OTU删除,再将比对至同一物种的OTU进行合并。
鱼类有效学名、分类地位等参照FishBase(FishBase :A Global Information System on Fishes)、《黄渤海鱼类图志》[10]、《中国海洋生物名录》[11]、《中国内陆鱼类与分布》[12]等。
1.2.4 α多样性分析 统计各样本不同分类水平各自含有的分类单元的数量,并在种水平上对优势物种做进一步分析。使用 QIIME 2软件进行α多样性分析,α多样性指数表征物种在生境内的多样性,其中Chao1指数[13]表征丰富度,Shannon指数(H′)[14-15]和Simpson指数(D)[14,16]表征多样性,Pielou指数(J)[17]表征均匀度,采用McNaughton优势度指数(Y)确定渤海与北黄海的优势物种指数计算公式为
Chao1=Sobs+n1(n1-1)/2(n2+1),
(1)
H′=-∑pi logpi,
(2)
D=1-∑[n(n-1)/N(N-1)],
(3)
J=H′/ln(S),
(4)
Yi=ni/N×fi。
(5)
式中:Sobs为观察到的物种数量,n1为仅被观察到一次的物种数量,n2为被观察到两次的物种数量;pi为第i个物种的相对丰度,也就是该物种在整个群落中的相对比例,pi=ni/N,ni为第i种鱼类的个体数,N为所获鱼类的总个体数;n为每种物种的个体数;S为物种的总数;Yi为第i种鱼类的优势度指数(Yi>0.02的物种即为优势种);fi为第i种鱼类的出现频率。
1.3 数据处理
基于各采样点物种序列丰度,利用R语言pheatmap包绘制物种组成图。并使R语言VennDiagram包绘制物种韦恩图,分析渤海与北黄海的共有鱼类和独有鱼类。使用R语言的vegan包绘制NMDS(非度量多维尺度分析),并进行空间变化分析。
2 结果与分析
2.1 环境DNA测序
渤海和北黄海的12个采样点位(36个样本)中的下机数据经筛选、过滤和拼接处理后,共获得鱼类高质量序列为586 229条,按97%一致性聚类,有效拼接序列数目最少的是赞子河点,共11 346条,最多的是英那河,共124 374条。为了便于后续分析,对所有样品进行重抽样,图2为此次测序所得的OTU数与序列数绘制的鱼类物种稀释曲线,从图2可见,随着随机抽样测序深度的不断增加,仅能发现极少量的新特征,这表明测序量足以反映样本多样性,能够进行后续数据分析。
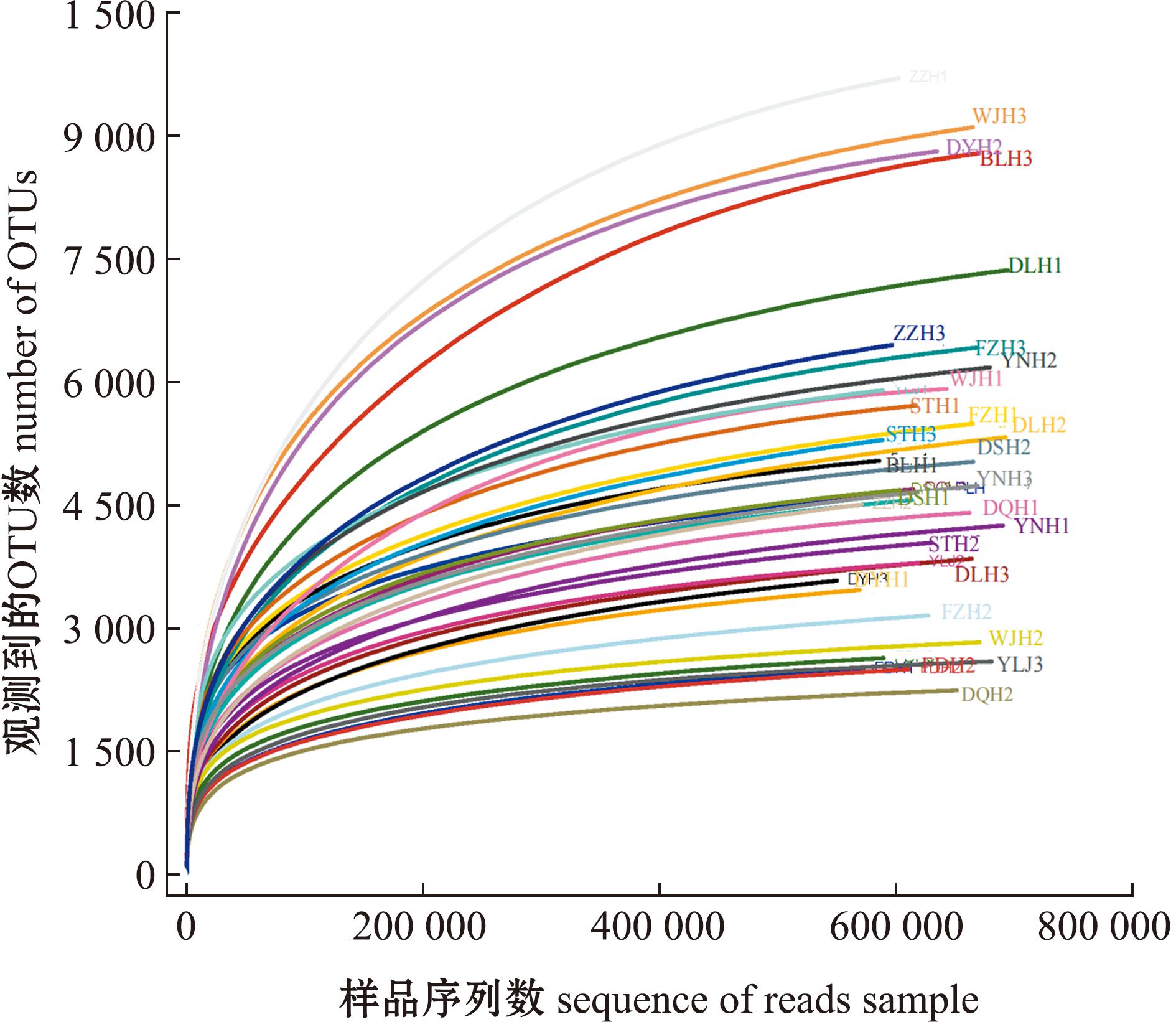
图2 渤海与北黄海重要河口鱼类物种稀释曲线
Fig.2 Rarefaction curves of fish species in important estuaries of the Bohai Sea and the Northern Yellow Sea
2.2 物种组成及鱼类生物多样性分析
将OTU序列与数据库比对后共获得110种鱼类,隶属于2纲23目56科86属。渤海获得鱼类有效序列338 334条,检测出2纲19目41科57属74种,其中大辽河河口鱼类物种数最多,为32种,浮渡河河口最少,为15种;北黄海获得鱼类有效序列247 895条,共检测出2纲19目42科59属76种,其中,鸭绿江河口物种数最多,为34种;鱼类物种数最少的是赞子河和大洋河,均为22种。各河口鱼类检出情况见图3,环境DNA宏条形码技术在渤海检测到的鱼类主要为蝌蚪宽杜父鱼(16.4%)和玉筋鱼(14.5%),在北黄海检测到鱼类主要为蝌蚪宽杜父鱼(29.2%)和细尾异头狮鱼(18.9%)。从图4可知,两个海域共有鱼类40种。
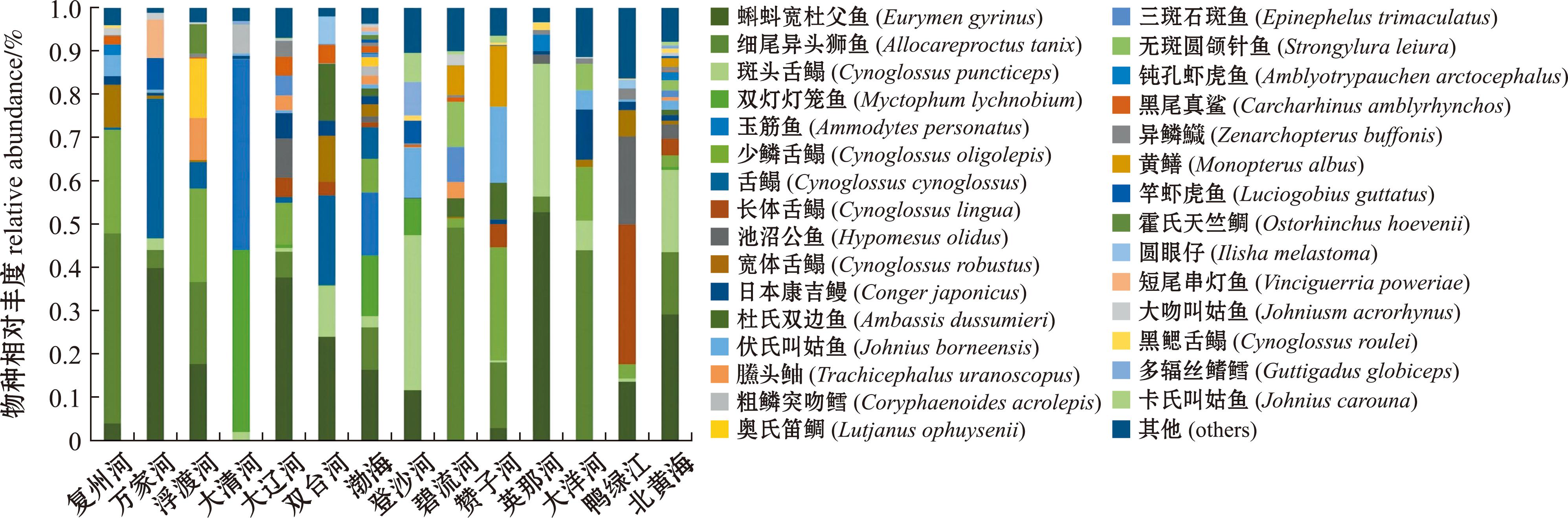
图3 基于环境DNA技术检测到的渤海与北黄海各河口鱼类物种组成
Fig.3 Species composition of fish in various estuaries of the Bohai Sea and the Northern Yellow Sea detected by environmental DNA metabarcoding

图4 渤海与北黄海共有和独有鱼类的Venn图
Fig.4 Venn diagram of shared and unique fish species in the Bohai Sea and the Northern Yellow Sea
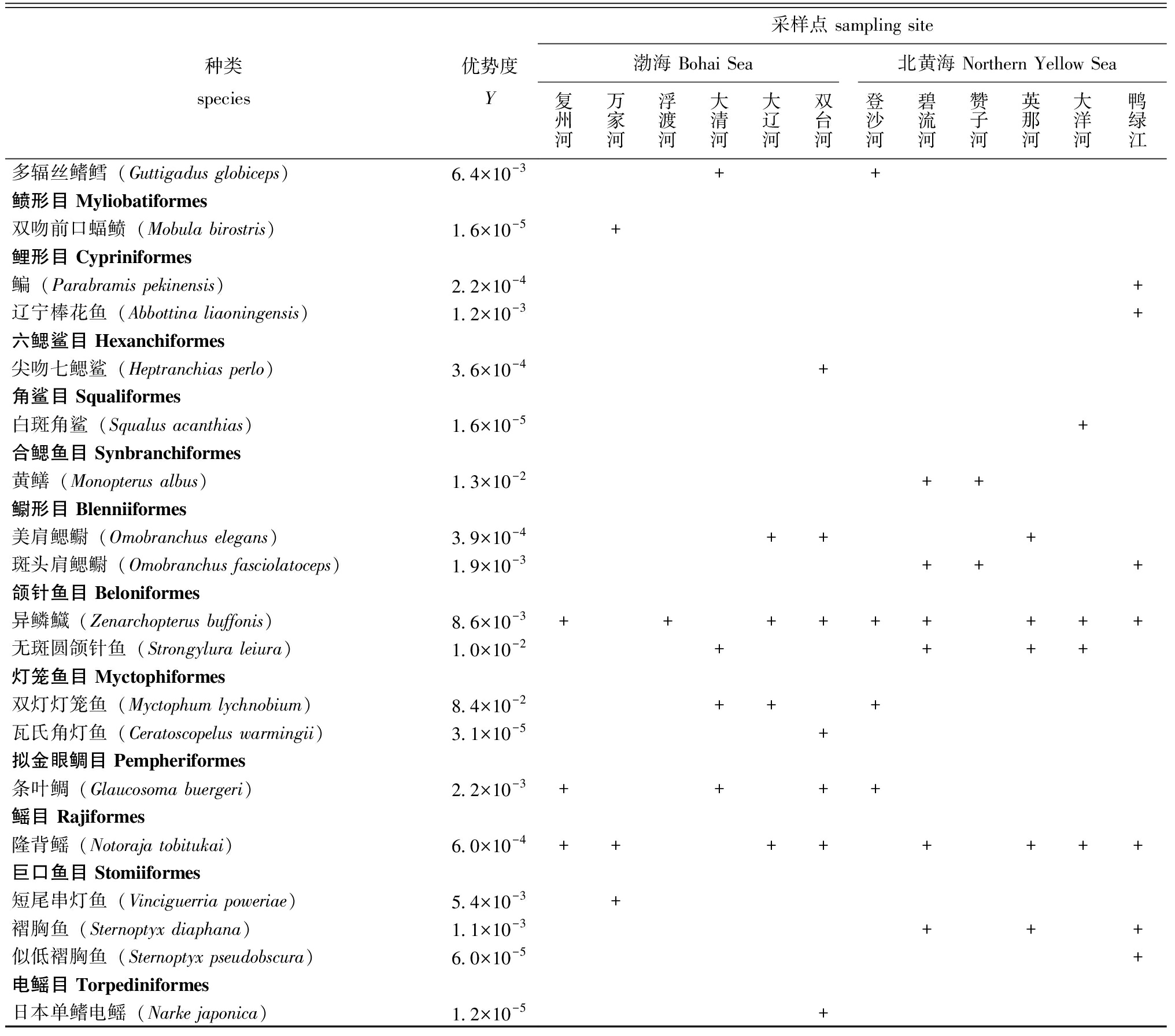
渤海和北黄海聚类获得的OTU均鉴定到种水平,不同目水平下鱼类物种数占比不同。渤海共有19目,前5目分别为鲈形目(45%)、鲽形目(15%)、真鲨目(7%)、鳕形目(4%)和鳗鲡目(4%),优势种为蝌蚪宽杜父鱼(Y=0.164)、玉筋鱼(Y=0.145)、双灯灯笼鱼(Y=0.140)、细尾异头狮鱼(Y=0.097)、少鳞舌鳎(Y=0.078)、舌鳎(Y=0.073)、宽体舌鳎(Y=0.027)、斑头舌鳎(Y=0.026)、粗鳞突吻鳕(Y=0.022)、奥氏笛鲷(Y=0.021)。北黄海共有19目,前5目为鲈形目(42%)、鲽形目(12%)、真鲨目(9%)、鲉形目(5%)和鳕形目(5%),优势种为蝌蚪宽杜父鱼(Y=0.292)、斑头舌鳎(Y=0.189)、细尾异头狮鱼(Y=0.144)、长体舌鳎(Y=0.038)、池沼公鱼(Y=0.033)、少鳞舌鳎(Y=0.026)、无斑圆颌针鱼(Y=0.024)和伏氏叫姑鱼(Y=0.021)(表1)。
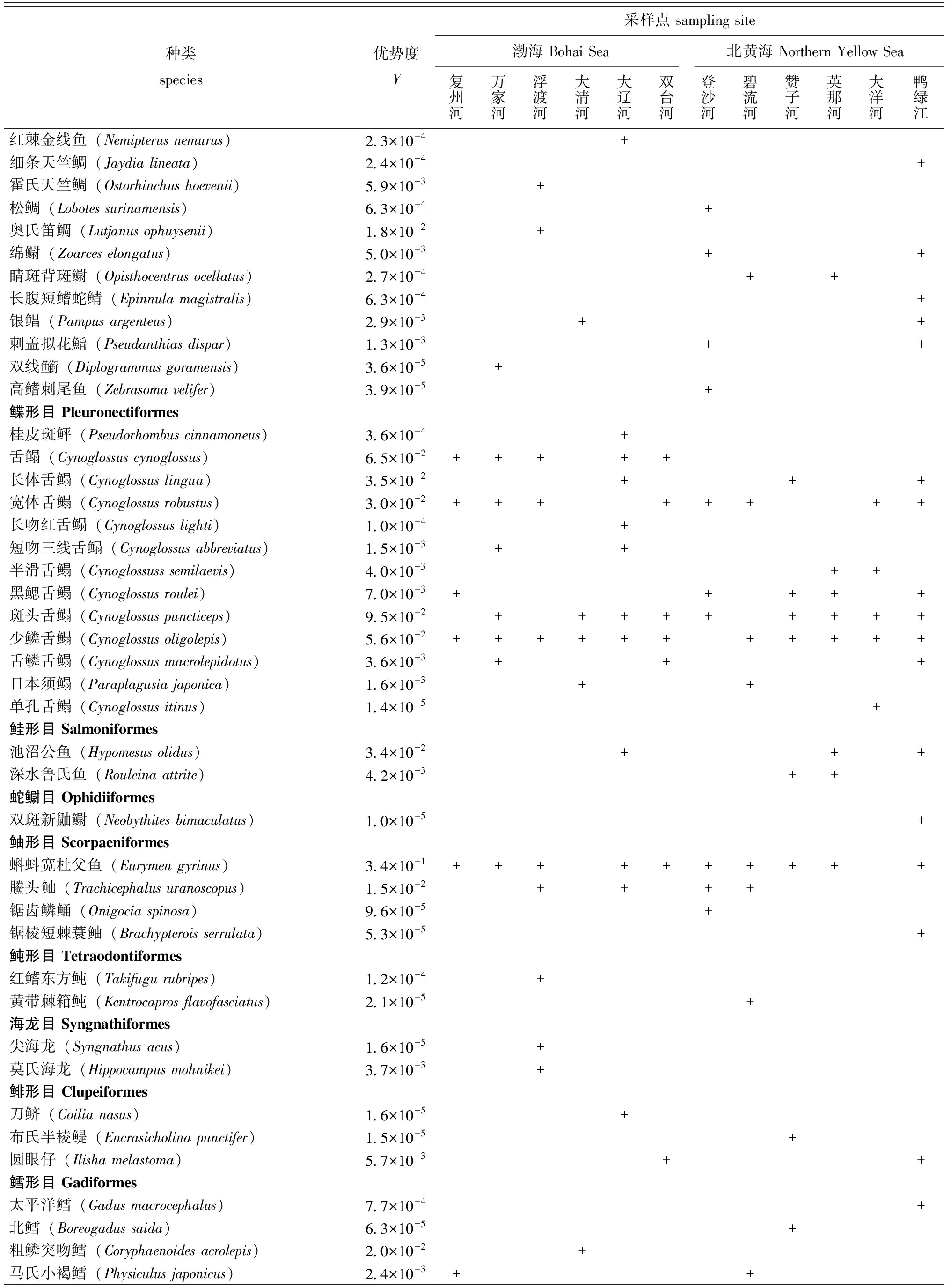
表1 基于环境DNA技术在渤海与北黄海重要河口的鱼类物种、物种优势度及检出情况
Tab.1 List of fish species,species dominance and detection in important estuaries of the Bohai Sea and the Northern Yellow Sea by environmental DNA metabarcoding

种类species优势度Y采样点 sampling site渤海 Bohai Sea北黄海 Northern Yellow Sea复州河万家河浮渡河大清河大辽河双台河登沙河碧流河赞子河英那河大洋河鸭绿江鳗鲡目 Anguilliformes日本康吉鳗(Conger japonicus)2.6×10-2++++++++++星康吉鳗(Conger myriaster)1.5×10-4+白斑裸胸鳝(Gymnothorax prionodon)1.7×10-5+真鲨目 Carcharhiniformes黑尾真鲨(Carcharhinus amblyrhynchos)1.5×10-2++++++虎纹猫鲨(Scyliorhinus torazame)1.9×10-5+丁字双髻鲨(Eusphyra blochii)7.5×10-4++++黑鳃盾尾鲨(Parmaturus melanobranchus)2.8×10-4+黑梢真鲨(Carcharhinus limbatus)2.6×10-4++沙拉真鲨(Carcharhinus sorrah)8.7×10-5+++++中华光尾鲨(Apristurus sinensis)1.4×10-5+寡线斜锯牙鲨(Rhizoprionodon oligolinx)1.0×10-5+沙条(Cephaloscyllium umbratile)1.0×10-5+鲈形目 Perciformes大弹涂鱼(Boleophthalmus pectinirostris)1.7×10-3+鲯鳅(Coryphaena hippurus)2.3×10-4+小黄鱼(Larimichthys polyactis)9.7×10-4++矛尾虾虎鱼(Chaeturichthys stigmatias)4.2×10-3+++++小头栉孔虾虎鱼(Paratrypauchen microcephalus)3.5×10-3+竿虾虎鱼(Luciogobius guttatus)1.1×10-2++++++++++暗缟虾虎鱼(Tridentiger obscurus)2.5×10-3+长颌大口虾虎鱼(Chaenogobius annularis)5.4×10-3++裸项蜂巢虾虎鱼(Favonigobius gymnauchen)2.1×10-5+钝孔虾虎鱼(Amblyotrypauchen arctocephalus)9.8×10-3+++鳗虾虎鱼(Taenioides anguillaris)1.4×10-3+++舌虾虎鱼(Glossogobius giuris)4.6×10-4+孔虾虎鱼(Trypauchen vagina)3.9×10-4+双带缟虾虎鱼(Tridentiger bifasciatus)9.6×10-5+杨氏吸虾虎鱼(Bryaninops yongei)1.0×10-5+黄带黄爪虾虎鱼(Sicyopus zosterophorus)5.5×10-4++花鲈(Lateolabrax japonicus)5.1×10-4++皮氏叫姑鱼(Johnius belangerii)1.5×10-3+++++++杜氏叫姑鱼(Johnius dussumieri)3.0×10-3++++尖头黄姑鱼(Chrysochir aureus)5.5×10-5+伏氏叫姑鱼(Johnius borneensis)1.5×10-2++++++++++杜氏双边鱼(Ambassis dussumieri)1.5×10-2+++++大吻叫姑鱼(Johniusm acrorhynus)5.1×10-3++++++++卡氏叫姑鱼(Johnius carouna)4.1×10-3++++++++丁氏叫姑鱼(Johnius distinctus)4.1×10-4+++斑鳍白姑鱼(Pentapodus caninus)1.7×10-5+狮鼻鲳鲹(Trachinotus blochii)3.7×10-5+狮子鱼(Apistus carinatus)5.8×10-5+网纹狮子鱼(Liparis chefucensis)1.6×10-5+细纹狮子鱼(Liparis tanakae)1.0×10-3++++美狮子鱼(Liparis pulchellus)1.2×10-4+玉筋鱼(Ammodytes personatus)1.3×10-1+细尾异头狮鱼(Allocareproctus tanix)1.8×10-1++++++++须鸡冠鳚(Alectrias cirratus)2.3×10-3++石斑(Epinephelus coeruleopunctatus)1.7×10-2++三斑石斑鱼(Epinephelus trimaculatus)1.0×10-5+
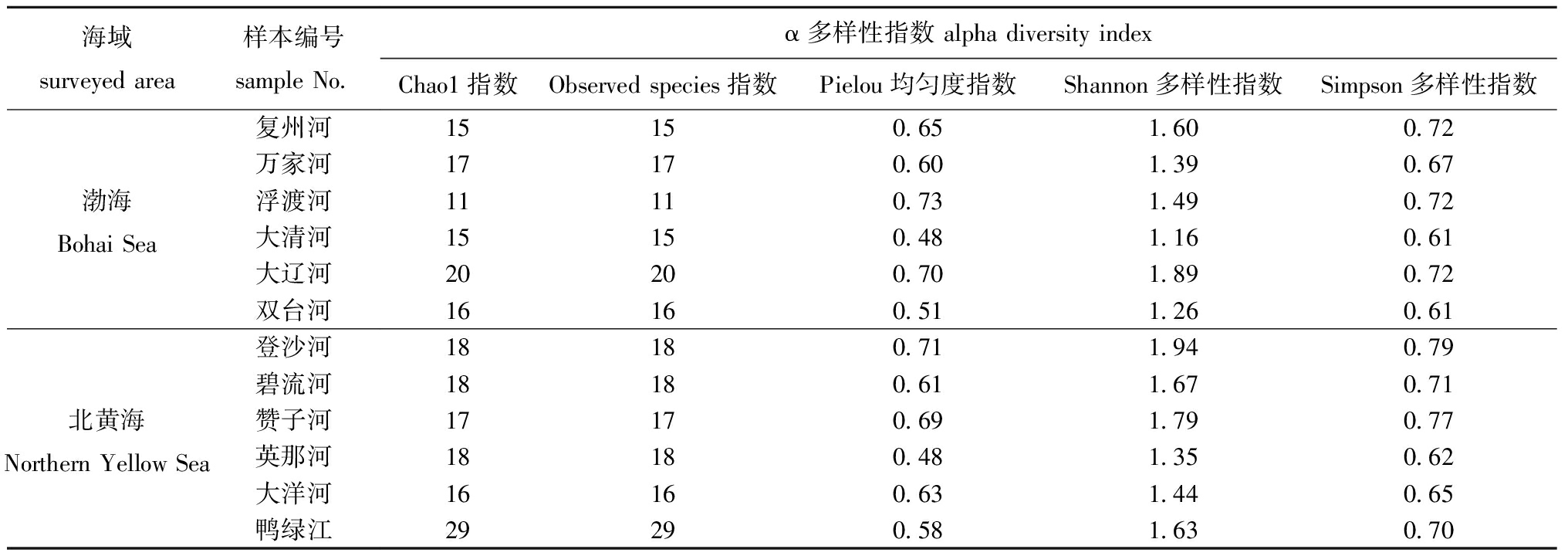
对不同采样点的鱼类群落相对丰度的α多样性指数进行计算(表2),其中,Chao1指数为11~29,Observed species指数为11~29,两个指数的分布趋势一致,其中,渤海的浮渡河河口指数值最低,最高值出现在北黄海的鸭绿江河口;Pielou均匀度指数为0.48~0.73,其中,渤海的大清河和北黄海的英那河河口指数值最低,最高值出现在渤海的浮渡河;Shannon多样性指数范围为1.16~1.94,其中,渤海的大清河河口指数值最低,最高值出现在北黄海的登沙河河口;Simpson多样性指数为0.61~0.79,其中渤海的大清河和双台河河口指数值最低,最高值出现在北黄海的登沙河河口,Shannon多样性指数和Simpson多样性指数趋势基本一致。综上所述,各个点位的鱼类物种α多样性指数存在差异,大辽河和登沙河河口具有较高的Shannon和Simpson多样性指数,鸭绿江河口具有较高的Chao1和Observed species指数。
续表1 基于环境DNA技术在渤海与北黄海重要河口的鱼类物种、物种优势度及检出情况
Cont.Tab.1 List of fish species,species dominance and detection in important estuaries of the Bohai Sea and the Northern Yellow Sea by environmental DNA metabarcoding
种类species优势度Y采样点 sampling site渤海 Bohai Sea北黄海 Northern Yellow Sea复州河万家河浮渡河大清河大辽河双台河登沙河碧流河赞子河英那河大洋河鸭绿江红棘金线鱼(Nemipterus nemurus)2.3×10-4+细条天竺鲷(Jaydia lineata)2.4×10-4+霍氏天竺鲷(Ostorhinchus hoevenii)5.9×10-3+松鲷(Lobotes surinamensis)6.3×10-4+奥氏笛鲷(Lutjanus ophuysenii)1.8×10-2+绵鳚(Zoarces elongatus)5.0×10-3++睛斑背斑鳚(Opisthocentrus ocellatus)2.7×10-4++长腹短鳍蛇鲭(Epinnula magistralis)6.3×10-4+银鲳(Pampus argenteus)2.9×10-3++刺盖拟花鮨(Pseudanthias dispar)1.3×10-3++双线鱼銜(Diplogrammus goramensis)3.6×10-5+高鳍刺尾鱼(Zebrasoma velifer)3.9×10-5+鲽形目 Pleuronectiformes桂皮斑鲆(Pseudorhombus cinnamoneus)3.6×10-4+舌鳎(Cynoglossus cynoglossus)6.5×10-2+++++长体舌鳎(Cynoglossus lingua)3.5×10-2+++宽体舌鳎(Cynoglossus robustus)3.0×10-2++++++++长吻红舌鳎(Cynoglossus lighti)1.0×10-4+短吻三线舌鳎(Cynoglossus abbreviatus)1.5×10-3++半滑舌鳎(Cynoglossuss semilaevis)4.0×10-3++黑鳃舌鳎(Cynoglossus roulei)7.0×10-3+++++斑头舌鳎(Cynoglossus puncticeps)9.5×10-2+++++++++少鳞舌鳎(Cynoglossus oligolepis)5.6×10-2+++++++++++舌鳞舌鳎(Cynoglossus macrolepidotus)3.6×10-3+++日本须鳎(Paraplagusia japonica)1.6×10-3++单孔舌鳎(Cynoglossus itinus)1.4×10-5+鲑形目 Salmoniformes池沼公鱼(Hypomesus olidus)3.4×10-2+++深水鲁氏鱼(Rouleina attrite)4.2×10-3++蛇鳚目 Ophidiiformes双斑新鼬鳚(Neobythites bimaculatus)1.0×10-5+鲉形目 Scorpaeniformes蝌蚪宽杜父鱼(Eurymen gyrinus)3.4×10-1++++++++++鰧头鲉(Trachicephalus uranoscopus)1.5×10-2++++锯齿鳞鲬(Onigocia spinosa)9.6×10-5+锯棱短棘蓑鲉(Brachypterois serrulata)5.3×10-5+鲀形目 Tetraodontiformes红鳍东方鲀(Takifugu rubripes)1.2×10-4+黄带棘箱鲀(Kentrocapros flavofasciatus)2.1×10-5+海龙目 Syngnathiformes尖海龙(Syngnathus acus)1.6×10-5+莫氏海龙(Hippocampus mohnikei)3.7×10-3+鲱形目 Clupeiformes刀鲚(Coilia nasus)1.6×10-5+布氏半棱鳀(Encrasicholina punctifer)1.5×10-5+圆眼仔(Ilisha melastoma)5.7×10-3++鳕形目 Gadiformes太平洋鳕(Gadus macrocephalus)7.7×10-4+北鳕(Boreogadus saida)6.3×10-5+粗鳞突吻鳕(Coryphaenoides acrolepis)2.0×10-2+马氏小褐鳕(Physiculus japonicus)2.4×10-3++
续表1 基于环境DNA技术在渤海与北黄海重要河口的鱼类物种、物种优势度及检出情况
Cont.Tab.1 List of fish species,species dominance and detection in important estuaries of the Bohai Sea and the Northern Yellow Sea by environmental DNA metabarcoding
种类species优势度Y采样点 sampling site渤海 Bohai Sea北黄海 Northern Yellow Sea复州河万家河浮渡河大清河大辽河双台河登沙河碧流河赞子河英那河大洋河鸭绿江多辐丝鳍鳕(Guttigadus globiceps)6.4×10-3++鲼形目 Myliobatiformes双吻前口蝠鲼(Mobula birostris)1.6×10-5+鲤形目 Cypriniformes鳊(Parabramis pekinensis)2.2×10-4+辽宁棒花鱼(Abbottina liaoningensis)1.2×10-3+六鳃鲨目 Hexanchiformes尖吻七鳃鲨(Heptranchias perlo)3.6×10-4+角鲨目 Squaliformes白斑角鲨(Squalus acanthias)1.6×10-5+合鳃鱼目 Synbranchiformes黄鳝(Monopterus albus)1.3×10-2++鳚形目 Blenniiformes美肩鳃鳚(Omobranchus elegans)3.9×10-4+++斑头肩鳃鳚(Omobranchus fasciolatoceps)1.9×10-3+++颌针鱼目 Beloniformes异鳞鱵(Zenarchopterus buffonis)8.6×10-3+++++++++无斑圆颌针鱼(Strongylura leiura)1.0×10-2++++灯笼鱼目 Myctophiformes双灯灯笼鱼(Myctophum lychnobium)8.4×10-2+++瓦氏角灯鱼(Ceratoscopelus warmingii)3.1×10-5+拟金眼鲷目 Pempheriformes条叶鲷(Glaucosoma buergeri)2.2×10-3++++鳐目 Rajiformes隆背鳐(Notoraja tobitukai)6.0×10-4++++++++巨口鱼目 Stomiiformes短尾串灯鱼(Vinciguerria poweriae)5.4×10-3+褶胸鱼(Sternoptyx diaphana)1.1×10-3+++似低褶胸鱼(Sternoptyx pseudobscura)6.0×10-5+电鳐目 Torpediniformes日本单鳍电鳐(Narke japonica)1.2×10-5+
注:Y>2×10-2的鱼类物种为优势种。
Note:fish species with Y>2×10-2 are defined as dominant species.
表2 渤海与北黄海重要河口鱼类的α多样性指数
Tab.2 Alpha diversity indices of important estuarine fishes in the Bohai Sea and the Northern Yellow Sea
海域surveyed area样本编号sample No.α多样性指数 alpha diversity indexChao1指数Observed species指数Pielou均匀度指数Shannon多样性指数Simpson多样性指数复州河15150.651.600.72万家河17170.601.390.67渤海Bohai Sea浮渡河11110.731.490.72大清河15150.481.160.61大辽河20200.701.890.72双台河16160.511.260.61登沙河18180.711.940.79碧流河18180.611.670.71北黄海Northern Yellow Sea赞子河17170.691.790.77英那河18180.481.350.62大洋河16160.631.440.65鸭绿江29290.581.630.70
2.3 鱼类物种组成空间差异
基于Bray-curtis距离的NMDS分析评估了渤海与北黄海的鱼类群落组成差异,从可视化结果上可知(图5),北黄海站点之间的相似性高于渤海站点之间的相似性。通过ANOSIM检验发现,渤海与北黄海之间存在显著性差异(P=0.001),其组间差异大于组内差异。

图5 渤海与北黄海鱼类组成相似性分析
Fig.5 Similarity analysis of fish composition between the Bohai Sea and the Northern Yellow Sea
3 讨论
3.1 基于eDNA技术的渤海与北黄海重要河口鱼类组成分析
河口是连接陆地与海洋生态系统的纽带,具有强烈的海陆相互作用和独特的物理化学特征,是许多生物的庇护所,近年来,随着人类活动增加,河口生态系统的压力不断增大,生态问题频现[18]。尽管每年的休渔期对该海域生态系统提供了一定保障,但渔业资源与生物多样性水平下降的问题仍然存在。以往渤海与北黄海的渔业资源调查主要为底拖网、地笼网等方式,调查费用高、所需时间久、目标生物捕获率低、物种鉴定困难,且对环境破坏性大。本研究中使用eDNA技术对渤海与北黄海进行鱼类多样性研究,具有环境友好、灵敏度高、省时省力、对调查对象无损伤等优点,与传统方法相比,能够全面地揭示鱼类多样性,且能发现并描述偶见种类。
本研究在12个河口(36个样本)中共检测出2纲23目56科86属110种海水鱼类(表1),渤海检测出 2纲19目41科57属74种,北黄海检测出2纲19目42科59属76种,其中大部分种类在渤海与北黄海传统渔业资源调查结果中均有记录。早期鱼类资源调查中,渤海的优势种为细纹狮子鱼、皮氏叫姑鱼、鳀、矛尾虾虎鱼等[19-21],北黄海的优势种为细条天竺鲷、半滑舌鳎、银鲳、小黄鱼等[22-24],这些物种在本研究中也有检出。本研究中发现,黄渤海海域的一些低营养级、小型鱼类如玉筋鱼等逐渐占据主导地位,这可能与近岸海域过度捕捞有关。传统优势种成长周期长,抗干扰能力弱,繁殖能力低,很容易受到人类活动和环境因素的影响。与此相反,小型经济种类生长迅速,遭到威胁后能在短时间内迅速恢复种群数量和规模,因此小型经济种类更易占据主导地位[25]。与传统渔业资源调查不同的是,本研究中也检测出一些未曾报道或者报道较少的鱼类,如蝌蚪宽杜父鱼、宽体舌鳎、舌鳎、长体舌鳎和少鳞舌鳎等。其中一些鱼类在进行形态学鉴定时可能会存在一定的偏差,比如根据左侧上下唇有无须状突起,将舌鳎亚科分为须鳎属和舌鳎属,且同在舌鳎属的舌鳎与窄体舌鳎,形态学上主要通过体型宽窄来进行区分,但长期生活在同一环境中可能会造成须状突起、体型等特征趋于一致[26-27],增加了形态学鉴定的难度,因此,仅根据形态学对物种进行区分具有一定的局限性。
3.2 基于eDNA技术的渤海与北黄海鱼类空间分布及多样性分析
本研究中,NMDS的胁迫系数大于0.2,可能是因为部分鱼类的序列丰度在总的序列丰度中占比较大,导致胁迫系数较大[28]。渤海与北黄海的河口中检测到的鱼类组成存在部分重叠,有以下两点原因:一是部分采样河口邻近渤海与黄海的水质交换处,导致河口的鱼类构成较为相似;二是采样点位均位于辽东半岛,地理位置相近,趋于同一纬度,因此鱼类物种存在部分重叠。
表2列举了反映鱼类群落alpha多样性的各个指数值,该指数数值大小很大程度是由群落自身特点所决定的。指数包括丰富度、多样性和均匀度,其中Chao1与Observed species指数可表征物种丰富度。本研究中的Chao1与Observed species指数趋势一致,其中渤海和北黄海的指数分别为10~17、9~19,位于北黄海的鸭绿江河口数值最大,表明相比于其他河口鸭绿江河口的鱼类物种丰富度更高。但与Zhong等[29]在鸭绿江口进行的鱼类多样性调查获得的46种鱼相比,本研究中获得鱼类数目较少的原因可能是研究范围较小、研究点位设置较少,后期研究中可以扩大河口的研究区域,多设置一些采样点位。
Shannon和Simpson指数表征多样性,Pielou表征均匀度。在渤海与北黄海的各河口中,Shannon多样性指数和Simpson多样性指数趋势基本对应。不同的多样性指数衡量鱼类多样性的侧重点不同,样品群落丰富度的高低并不代表群落多样性的高低;如浮渡河河口的丰富度指数较低但多样性指数较高,这可能与样品中大部分鱼类物种丰度过高有关。渤海的多样性指数相较于北黄海偏低可能与渤海特殊的地理位置有关,渤海是一个半封闭的内海,海水的交换能力弱于黄海[30],污染物易于沉积,不利于鱼类的栖息繁殖。目前,对于渤海与北黄海海域鱼类多样性的调查十分有限。渤海仔稚鱼的调查结果显示,Shannon多样性指数为0.61~2.34,Pielou均匀度指数为0.27~0.99[19],本研究调查结果与前期研究较为符合。
3.3 环境DNA技术在鱼类多样性调查的业务化应用展望
本研究中利用鱼类环境DNA技术,获取了辽东半岛12个重要河口的鱼类多样性,鱼类是海洋生态系统中的关键物种,对生态系统的功能和稳定性具有重要影响。通过监测和评估鱼类多样性,可以了解海洋生态系统的整体健康情况,以及可能存在的问题和威胁。eDNA技术是近年来国际生态学领域最重要的革命性技术之一,不仅应用于渔业资源调查,在生态环境修复和自然资源保护中也具有极大的应用潜力。相比于传统鱼类多样性调查方法(如底拖网、网捕等),环境DNA宏条形码调查在灵敏性、非破坏性和成本效益方面具有显著优势[31-33],证明环境DNA技术在鱼类多样性调查中具备大范围业务化应用前景。然而,环境DNA技术本身也存在局限性,环境DNA技术不能提供关于物种丰度或生物量的直接信息[34],水流速度、温度和pH等环境因素可能会影响环境DNA的检测效果[35],且eDNA技术操作流程包括样品采集、DNA提取、PCR扩增、DNA文库构建、高通量测序、生物信息学分析等环节,专业性强、流程繁琐、不确定因素较多,eDNA样本很容易受到外界DNA的污染,需要非常严格的实验室操作和样本处理流程来防止污染[36],建立一套统一的操作规范及标准化流程,有助于提高eDNA技术监测结果的可靠性和可重复性。目前,学界已有针对 eDNA采样与分析流程优化的研究,在采样方式、引物选择、数据库建设和质量控制等方面开展验证[37]。本研究中,鱼类序列比对需在NCBI、MitoFish等数据库进行,其对黄渤海部分特有物种鉴定可能存在差异,建立渤海和黄海甚至全国鱼类本地化条形码数据库是目前亟需完成的任务,这样可以提高物种鉴定注释效率,完善不同条形码基因针对不同生物类群的有效性和适用性,实现海洋生物eDNA监测的高通量、标准化、流程化和个性化,丰富中国本土eDNA基础数据,提高鱼类环境DNA调查的准确性和可靠性。
4 结论
1)本研究中基于环境DNA宏条形码技术在渤海与北黄海共检测出110种鱼类,其中渤海共发现鱼类74种,隶属于2纲19目41科57属;北黄海中共检测出鱼类76种,隶属于2纲19目42科59属,鲈形目在两处海域中占比均为最大。
2)渤海与北黄海多样性指数变化趋势相似,但渤海的多样性指数低于北黄海,表明北黄海具有较丰富的鱼类多样性。
3)相较于传统的底拖网调查,环境DNA宏条形码调查在灵敏性、覆盖面积、非破坏性和成本效益方面具有显著优势,环境DNA宏条形码技术可对渔业资源调查结果进行补充、发现新见物种等,在鱼类多样性调查中具备大范围业务化应用前景。
[1] 蒋佩文,李敏,张帅,等.基于环境DNA宏条码和底拖网的珠江河口鱼类多样性[J].水生生物学报,2022,46(11):1701-1711.
JIANG P W,LI M,ZHANG S,et al.Investigating the fish diversity in Pearl River Estuary based on environmental DNA matebarcoding and bottom trawling[J].Acta Hydrobiologica Sinica,2022,46(11):1701-1711.(in Chinese)
[2] REE S H C,MADDISON B C,MIDDLEDITCH D J,et al.REVIEW:the detection of aquatic animal species using environmental DNA——a review of eDNA as a survey tool in ecology[J].Journal of Applied Ecology,2014,51(5):1450-1459.
[3] DEINER K,WALSER J C,M CHLER E,et al.Choice of capture and extraction methods affect detection of freshwater biodiversity from environmental DNA[J].Biological Conservation,2015,183:53-63.
CHLER E,et al.Choice of capture and extraction methods affect detection of freshwater biodiversity from environmental DNA[J].Biological Conservation,2015,183:53-63.
[4] HERING D,BORJA A,JONES J I,et al.Implementation options for DNA-based identification into ecological status assessment under the European Water Framework Directive[J].Water Research,2018,138:192-205.
[5] YAMAMOTO S,MASUDA R,SATO Y,et al.Environmental DNA metabarcoding reveals local fish communities in a species-rich coastal sea[J].Scientific Reports,2017,7:40368.
[6] 凌岚馨,范共,胡云,等.环境DNA技术与传统捕捞揭示崇明岛内河鱼类多样性[J].上海海洋大学学报,2022,31(6):1434-1444.
LING L X,FAN G,HU Y,et al.Integrating environmental DNA technology and traditional fish survey to reveal the diversity of fishes in the rivers on the Chongming Island[J].Journal of Shanghai Ocean University,2022,31(6):1434-1444.(in Chinese)
[7] 言柯程,李建超,田永军,等.基于环境DNA metabarcoding和底拖网调查的南黄海西部鱼类多样性比较[J].中国海洋大学学报(自然科学版),2023,53(5):71-81.
YAN K C,LI J C,TIAN Y J,et al.Comparison of fish biodiversity in western South Yellow Sea based on environmental DNA metabarcoding and trawl survey[J].Periodical of Ocean University of China(Natural Science Edition),2023,53(5):71-81.(in Chinese)
[8] LERAY M,YANG J Y,MEYER C P,et al.A new versatile primer set targeting a short fragment of the mitochondrial COI region for metabarcoding metazoan diversity:application for characterizing coral reef fish gut contents[J].Frontiers in Zoology,2013,10:34.
[9] EDGAR R C.Search and clustering orders of magnitude faster than BLAST[J].Bioinformatics,2010,26(19):2460-2461.
[10] 刘静,陈咏霞,马琳.黄渤海鱼类图志[M].北京:科学出版社,2015.
LIU J,CHEN Y X,MA L.Fishes of the Bohai Sea and Yellow Sea[M].Beijing:Science Press,2015.(in Chinese)
[11] 刘瑞玉.中国科学院海洋研究所编辑.中国海洋生物名录[M].北京:科学出版社,2008.
LIU R Y.Checklist of marine biota of China Seas[M].Beijing:Science Press,2008.(in Chinese)
[12] 张春光,赵亚辉.中国内陆鱼类物种与分布[M].北京:科学出版社,2016.
ZHANG C G,ZHAO Y H.Species diversity and distribution of inland fishes in China[M].Beijing:Science Press,2016.(in Chinese)
[13] CAUSEYB D.Parametric estimation of the number of classes in a population[J].Journal of Applied Statistics,2002,29(6):925-934.
[14] SHANNON C E.A mathematical theory of communication[J].The Bell System Technical Journal,1948,27(3):379-423.
[15] PIELOU E C.Shannon’s formula as a measure of specific diversity:itsuse and misuse[J].The American Naturalist,1966,100(914):463-465.
[16] SIMPSON E H.Measurement of diversity[J].Nature,1949,163:688.
[17] PIELOU E C.The measurement of diversity in different types of biological collections[J].Journal of Theoretical Biology,1966,13:131-144.
[18] 董卫卫,林桂兰.河口区生态环境问题及生态修复对策探讨[J].环境保护科学,2023,49(5):91-99.
DONG W W,LIN G L.Discussion on ecological environment problems and ecological restoration countermeasures in estuary area[J].Environmental Protection Science,2023,49(5):91-99.(in Chinese)
[19] 卞晓东,万瑞景,金显仕,等.渤海莱州湾硬骨鱼类早期资源群落结构及演变[J].水产学报,2022,46(1):51-72.
BIAN X D,WAN R J,JIN X S,et al.Early life resources assemblage structure and succession to the marine Osteichthyes in the Laizhou Bay of Bohai Sea[J].Journal of Fisheries of China,2022,46(1):51-72.(in Chinese)
[20] 单秀娟,金显仕,李忠义,等.渤海鱼类群落结构及其主要增殖放流鱼类的资源量变化[J].渔业科学进展,2012,33(6):1-9.
SHAN X J,JIN X S,LI Z Y,et al.Fish community structure and stock dynamics of main releasing fish species in the Bohai Sea[J].Progress in Fishery Sciences,2012,33(6):1-9.(in Chinese)
[21] 李忠义,吴强,单秀娟,等.渤海鱼类群落结构的年际变化[J].中国水产科学,2017,24(2):403-413.
LI Z Y,WU Q,SHAN X J,et al.Interannual variations in fish community structure in the Bohai Sea[J].Journal of Fishery Sciences of China,2017,24(2):403-413.(in Chinese)
[22] 冯昭信,李久奇.黄、渤海鱼类资源之现状与管理意见[J].海洋科学,1990,14(3):60-63.
FENG Z X,LI J Q.Present situation and management opinions of fish resources in the Yellow Sea and Bohai Sea[J].Marine Sciences,1990,14(3):60-63.(in Chinese)
[23] 刘静,宁平.黄海鱼类组成、区系特征及历史变迁[J].生物多样性,2011,19(6):764-769.
LIU J,NING P.Species composition and faunal characteristics of fishes in the Yellow Sea[J].Biodiversity Science,2011,19(6):764-769.(in Chinese)
[24] 张法忠.黄、渤海的软骨鱼类种类及利用价值[J].特产研究,2003,25(3):53-56.
ZHANG F Z.The varieties and use value of the chondrichthyes in the Yellow Sea and the Bohai Sea[J].Special Wild Economic Animal and Plant Research,2003,25(3):53-56.(in Chinese)
[25] 孙典荣, 林昭进. 北部湾主要经济鱼类资源变动分析及保护对策探讨[J].热带海洋学报, 2004, 23(2): 62-68.
SUN D R,LIN Z J.Variations of major commercial fish stocks and strategies for fishery management in Beibu Gulf[J].Journal of Tropical Oceanography,2004, 23(2): 62-68.(in Chinese)
[26] NELSON J S,GRANDE T C,WILSON M V H.Fishes of the World[M]. Wiley-Interscience,2016.
[27] 柳淑芳,刘进贤,庄志猛,等.舌鳎亚科鱼类单系起源和同种异名的线粒体DNA证据[J].生物多样性,2010,18(3):275-282.
LIU S F,LIU J X,ZHUANG Z M,et al.Monophyletic origin and synonymic phenomena in the sub-family Cynoglossinae inferred from mitochondrial DNA sequences[J].Biodiversity Science,2010,18(3):275-282.(in Chinese)
[28] 陆延,牛威震,程爱勇,等.舟山岛北部海域鱼类群落结构及其生物多样性[J].大连海洋大学学报,2022,37(6):1022-1031.
LU Y,NIU W Z,CHENG A Y,et al.Community structure and biodiversity of fish in the north sea area of Zhoushan Island[J].Journal of Dalian Ocean University,2022,37(6):1022-1031.(in Chinese)
[29] ZHONG W J,ZHANG J Y,WANG Z H,et al.Holistic impact evaluation of human activities on the coastal fish biodiversity in the Chinese coastal environment[J].Environmental Science &Technology,2022,56(10):6574-6583.
[30] 冀承振,黎舸,于博,等.渤海海峡水交换多时间尺度变化特征研究[J].海洋与湖沼,2019,50(1):24-30.
JI C Z,LI G,YU B,et al.The multi-time scale variations of water exchange across the Bohai strait[J].Oceanologia et Limnologia Sinica,2019,50(1):24-30.(in Chinese)
[31] FICETOLA G F,MIAUD C,POMPANON F,et al.Species detection using environmental DNA from water samples[J].Biology Letters,2008,4(4):423-425.
[32] KELLY R P,PORT J A,YAMAHARA K M,et al.Using environmental DNA to census marine fishes in a large mesocosm[J].PLoS One,2014,9(1):e86175.
[33] THOMSEN P F,KIELGAST J,IVERSEN L L,et al.Detection of a diverse marine fish fauna using environmental DNA from seawater samples[J].PLoS One,2012,7(8):e41732.
[34] BARNESM A,TURNERC R.The ecology of environmental DNA and implications for conservation genetics[J].Conservation Genetics,2016,17(1):1-17.
[35] JANES F,WILCOXT M,MCKELVEYK S,et al.Distance,flow and PCR inhibition:eDNA dynamics in two headwater streams[J].Molecular Ecology Resources,2015,15(1):216-227.
[36] GOLDBERG C S,TURNER C R,DEINER K,et al.Critical considerations for the application of environmental DNA methods to detect aquatic species[J].Methods in Ecology and Evolution,2016,7(11):1299-1307.
[37] SHU L,LUDWIG A,PENG Z G.Standards for methods utilizing environmental DNA for detection of fish species[J].Genes,2020,11(3):296.