菲律宾蛤仔(Ruditapes philippinarum)是中国单种产量最高的养殖贝类,年产量超过400万t,占世界总产量的90%[1]。近年来,随着蛤仔养殖密度增加及海水水质恶化,蛤仔病害频发,加之存在蛤仔种质资源退化、良种覆盖率低、南苗北养等问题,养殖蛤仔成活率下降,给蛤仔养殖业造成了一定的经济损失[2]。
水产养殖病害防控的传统方法是通过施加抗生素、使用化学消毒剂或照射紫外线等杀灭水环境微生物,这些方法无选择性,不能从根本上解决水产养殖病害问题,且抗生素、消毒剂的大量使用会引发一定生态问题[3]。为保证水产养殖业的持续健康发展,水产益生菌作为化学制剂的替代品,已被广泛应用于水产养殖生产中,其具有无毒、无抗药性、高丰度和低成本等优点[4]。在养殖水环境中,一方面,益生菌可以维持水体微生态平衡,抑制和防止有害菌滋生,降低水产动物患病风险[5];另一方面,益生菌在水产动物肠道的定植能够增强水产动物对饲料的消化吸收能力,并通过占位效应阻止致病菌侵袭,提高养殖动物成活率[6-7]。目前,国内外应用于水产养殖的益生菌包括芽孢杆菌属(Bacillus sp.)、乳球菌属(Lactococcus sp.)、乳杆菌属(Lactococcus sp.)、片球菌属(Pediococcus sp.)、肠球菌属(Enterococcus sp.)和链球菌属(Streptococcus sp.)等[8]。
为实现蛤仔益生菌的靶向定制,本研究中从健康蛤仔肠道分离可培养细菌,通过体外产酶试验、安全性评价、养殖试验筛选出具有益生作用的益生菌,丰富了蛤仔益生菌菌种资源,为蛤仔益生菌研发提供了有益参考。
1 材料与方法
1.1 材料
肠道可培养细菌分离试验用菲律宾蛤仔于2022年11月采集自辽宁省庄河市石城乡上品堂养殖基地,随机挑选10只用于试验,平均体质量为(14.51±1.18)g,平均壳长为(3.74±0.15)cm。
1.2 方法
1.2.1 菲律宾蛤仔肠道可培养细菌分离 试验用菲律宾蛤仔样品,在超净工作台上用体积分数为75%的乙醇擦拭蛤仔外壳进行表面消毒,使用灭菌解剖刀解剖蛤仔,取出肠道组织,用无菌海水冲洗肠道内容物3次,再将肠道组织用无菌海水匀浆,制成蛤仔肠道组织悬浊液。用无菌海水对蛤仔肠道组织悬浊液进行梯度稀释,稀释倍数分别为10、102、103、104、105、106、107倍。对稀释至10-4、10-5、10-6、10-7的匀浆液,分别取0.1 mL均匀涂布到2216E固体培养基上,设置3组平行,25 ℃下倒置恒温培养72 h后观察,挑取颜色、形态不同的菌落进行平板划线,分离纯化,得到单一菌落,编号并保种。
1.2.2 溶血试验 细菌溶血试验检测参照郝凯[9]的方法,取待测菌株在2216E琼脂平板上活化,将活化好的菌株接种至LB[含2.5%(w/v)的NaCl,下同]液体培养基中,25 ℃下以120 r/min恒温摇床震荡培养24 h后,取菌液2.5 μL点种于哥伦比亚血琼脂平板(青岛高科技工业园海博生物技术有限公司)上,25 ℃下倒置培养24 h,通过观察菌落周围形成的溶血环判断溶血类型。
1.2.3 产酶菌株筛选 采用点种法测定菌株的产酶能力,选择性培养基的配置采用蔡红丹[10]的方法上并稍加修改,取2.5 μL新鲜菌液分别点种于淀粉酶选择培养基、蛋白酶选择培养基、脂肪酶(Tween 80)选择培养基,25 ℃下培养72 h,淀粉酶选择培养基使用体积分数为1%的卢戈氏碘液染色,观察菌落周围水解圈,记录淀粉酶水解圈直径与菌落直径;蛋白酶选择培养基则观察菌落周围有无透明水解圈,记录蛋白酶水解圈直径与菌落直径;脂酶选择培养基则观察菌落周围有无晕圈,记录晕圈直径与菌落直径。
1.2.4 菌株形态观察及分子学鉴定 从2216E琼脂平板上挑取单菌落,接种至2216E液体培养基中,恒温摇床培养过夜(25 ℃、120 r/min),取30 μL菌液用革兰氏试剂盒(北京索莱宝科技有限公司)染色,油镜下观察细菌形态及染色情况,判断其为革兰氏阳性还是革兰氏阴性。
参考闫法军[11]水煮法提取细菌基因组DNA,采用通用引物27F(5′AGAGTTTGATCCTGGCTCAG 3′)和1 492R(5′GGTTACCTTGTTACGACTT 3′)进行PCR扩增,30 μL反应体系包含:模板DNA 2 μL、正向引物 27F(10 μmol/L)3 μL、反向引物 1 492R(10 μmol/L)3 μL、2×EasyTaq PCR superMix15 μL、ddH2O 7 μL。反应程序为95 ℃下预变性2 min,95 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸90 s,共进行35次循环,最后在72 ℃下再延伸5 min,20 ℃下保存。PCR扩增产物经15 g/L的琼脂糖凝胶电泳检测,凝胶成像仪观察是否有明亮条带,将扩增成功的PCR产物送至华大基因进行测序。将测序结果提交GenBank进行Blast比对分析,并选取同源性较高的序列,采用MEGA 7.0软件及邻接法(Neighbor-Joining)基于泊松模型计算遗传距离构建种系型系统发育树,鉴定产酶细菌种属。
1.2.5 生长曲线及吸光度值与菌落形成单位标准曲线测定 取产酶菌株的-80 ℃冻存菌液,冰上解冻后用接种环挑取适量,以平板划线的方式接种至2216E琼脂平板,25 ℃倒置培养至单菌落长出。挑取单菌落接种至1 mL的LB液体培养基中,25 ℃、120 r/min摇床培养18 h,取100 μL菌液接种至900 μL LB液体培养基,25 ℃、120 r/min摇床培养18 h,得新鲜菌液。将新鲜菌液加入50 mL的LB液体培养基制成菌悬液。将菌悬液按10%接种量接种至LB液体培养基,25 ℃、120 r/min摇床培养,每隔6 h取样一次,每次取样5 mL,以空白培养液作为对照校正零点,使用分光光度计测定其在600 nm波长下的吸光度。若吸光度值超过0.8,需稀释样品使其数值低于0.8。以取样时间为横坐标,以OD600 nm值为纵坐标,绘制生长曲线。
根据马培培等[12]的研究,菌悬液的吸光度与细菌数量之间存在线性关系。为了快速准确定量菌液,采用平板计数法绘制吸光度值-菌体数标准曲线。取对数生长期菌悬液,梯度稀释后测定其在600 nm波长下的吸光度,并将稀释后的菌液涂布到LB琼脂平板上,每组设置3个重复,25 ℃下培养24 h后,选取菌落数为30~300的平板进行计数并计算菌落形成单位(CFU),再以同一菌液的OD600 nm值为横坐标、CFU为纵坐标绘制标准曲线并得到回归方程式。
1.2.6 菌株耐酸、耐胆盐试验 为了测定菌株C26对酸的耐受性,取对数生长期菌液,稀释至1×109 CFU/mL,按1%的接种量分别接种至pH为3.5、4.5、5.5、6.5的LB液体培养基中(使用浓度为0.1 mol/L HCl溶液和0.1 mol/L NaOH溶液调节培养基的pH值),25 ℃下以120 r/min摇床培养24 h,分别在0、2、4、8、24 h测定菌液的OD600 nm值,设置3组重复。
为了测定菌株C26对胆盐的耐受性,取对数生长期菌液,稀释至1×109 CFU/mL,按1%的接种量接种至分别添加质量浓度为0、0.1、0.3、0.5 g/100 mL牛胆盐(购自金克隆生物技术有限公司)的LB(pH 8.0)液体培养基中(使用浓度为0.1 mol/L NaOH溶液和0.1 mol/L HCl溶液调节培养基pH),25 ℃下以120 r/min摇床培养24 h,分别在0、2、4、8、24 h测定菌液的OD600 nm值,设置3组重复。
1.2.7 攻毒试验 从山东昌邑养殖池塘内采集健康蛤仔幼贝(壳长为0.3~0.5 cm)用于攻毒试验,先在实验室暂养7 d,养殖过程中水温恒定在(21±2) ℃,每日投喂3次小球藻,每2 d全量换水。取4个8 L塑料桶,消毒清洗后分别放入4 L灭菌过滤海水及100只蛤仔幼贝。将4桶幼贝随机分为2组,每组2桶,1组为投喂日常饵料的对照组(control-1、control-2),1组为添加潜在益生菌的攻毒试验组(记为C26-1、C26-2)。根据菌株细胞浓度标准曲线定量移取菌液置于无菌离心管中,以6 000 r/min离心5 min后去上清,重悬于适量无菌海水中制备成菌悬液,将适量菌悬液加入试验组使水体菌株终浓度为5×107 CFU/mL。攻毒试验过程中水温恒定保持在(21±2) ℃,每日投喂3次小球藻,每2 d全量换水,每次换水时对攻毒试验组重新添加菌液至终浓度为5×107 CFU/mL。每日观察记录幼贝的死亡情况,攻毒试验周期为5 d。
1.2.8 抗生素敏感性测定 采用纸片琼脂扩散法(K-B法)检测潜在益生菌对抗菌药物的敏感度。本试验中选购8种抗生素进行药敏试验,分别是四环素、卡那霉素、头孢氨苄、青霉素、红霉素、氯霉素、复方新诺明和诺氟沙星(杭州滨和微生物试剂有限公司)。用灭菌棉签蘸取浓度为1×108 CFU/mL的菌液少许均匀涂布于2216E琼脂平板,将药敏纸片贴于表面,35 ℃下培养24 h后测定抑菌圈直径大小,设置3次重复并计算平均值,根据药敏纸片说明书判定其敏感性。
1.2.9 蛤仔幼贝养殖试验 从山东昌邑采集健康蛤仔幼贝(体质量为0.4~0.5 g,壳长为1.25~1.27 cm)用于养殖试验,在实验室暂养7 d,水温为(21±2)℃,每日投喂小球藻3次,每2 d全量换水一次。取6个4 L塑料桶,消毒清洗后分别放入2 L灭菌过滤海水及50只蛤仔幼贝。分别称量每桶蛤仔的总质量,并用游标卡尺测量单只蛤仔的壳长、壳宽和壳高。将6桶幼贝随机分为2组,每组3桶,1组为投喂日常饵料的对照组,1组为添加潜在益生菌的养殖试验组。定量移取菌液至无菌离心管中,以6 000 r/min离心5 min后弃上清,将菌体重悬于适量无菌海水制备菌悬液,取适量菌悬液加入试验组使水体菌株终浓度为1×107 CFU/mL。养殖试验过程中水温恒定保持为(21±2)℃,每日投喂小球藻3次,每2 d全量换水一次,每次换水时对养殖试验组添加新鲜菌液至终浓度为1×107 CFU/mL。至60 d养殖试验结束后,再次称量每桶蛤仔的总质量,并测量单只蛤仔的壳长、壳宽和壳高。根据以下公式分别计算蛤仔幼贝增重率(%)和日增长率(μm/d):
增重率=(终末质量-初始质量)/初始质量×
100%,
(1)
日增壳长=(终末壳长-初始壳长)/养殖
时间×1 000,
(2)
日增壳宽=(终末壳宽-初始壳宽)/养殖
时间×1 000,
(3)
日增壳高=(终末壳高-初始壳高)/养殖
时间×1 000。
(4)
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS软件进行单因素方差分析(one-way ANOVA),采用单因素方差分析法进行组间差异性比较,显著性差异设为0.05。
2 结果与分析
2.1 蛤仔肠道可培养细菌的分离及产酶菌筛选
在本研究中,从健康蛤仔肠道中共分离获得21株可培养细菌,分离试验结束后,对其进行溶血试验,结果表明,21株细菌均不产生β-溶血环,表明其均不具备溶血性。
分别检测21株细菌产淀粉酶、蛋白酶和脂肪酶的能力,从表1可见,受试的21株细菌中有8株产淀粉酶,7株产蛋白酶,8株产脂肪酶,6株未检测出产酶能力。其中,菌株C26同时具备产淀粉酶、蛋白酶和脂肪酶的能力,其产酶水解圈直径(R)与菌落平均直径(r)的比值(R/r)分别为1.91±0.25(淀粉酶)、1.93±0.05(蛋白酶)和1.48±0.03(脂肪酶)。因此,以菌株C26为研究对象,进行后续蛤仔安全试验和养殖试验,检测其作为蛤仔益生菌的潜力。
表1 蛤仔肠道细菌产酶能力
Tab.1 Enzyme-producing capacity of the intestinal bacteria in Ruditapes philippinarum

菌株编号strain code产淀粉酶能力ability to produce amylase产蛋白酶能力ability to produce protease产脂肪酶能力ability to produce lipaseC2---C3+++-++C4---C6---C7+++-++C8+++--C9-++++C11++--C13---C15+++--C16-+++-C17++--C18---C19-++++C21-++++C22---C24++++-C25--+++C26++++++C27-++-C30--++
注:R为产酶菌水解圈直径,r为菌落直径。+++表示2≤R/r<3;++表示1≤R/r<2;-表示无活性。
Note:R is the diameter of the hydrolysis circle generated by enzyme-producing bacterium and r is the diameter of bacterial colony.+++ means 2≤R/r<3;++ means 1≤R/r<2;- means negative.
2.2 菌株C26鉴定结果
结合形态观察和分子鉴定对菌株C26进行初步鉴定。菌株C26在2216E固体培养基上的菌落为圆形,边缘整齐,中部微微凸起,表面光滑,呈不透明浅黄色。取对数生长期细胞进行革兰氏染色,显微视野下,菌株C26细胞为红色,呈杆状、短杆状,经鉴定其为革兰氏阴性杆菌(图1)。

图1 菌株C26显微镜下的形态
Fig.1 Microscopic morphology of strain C26
对筛选得到C26菌株进行16S rDNA序列测序,在GenBank数据库(www.ncbi.nlm.nih.gov)中进行序列比对,利用MEGA 7.0软件制作系统发育树(图2)。结果表明:菌株C26与假交替单胞菌属(Pseudoalteromonas)同源性较高,在98%覆盖度下一致性最高,为99.44%,包括P.sp.BSi20396(EU330365.1)、P.sp.BSi20139(DQ492721.1)、P.sp.AC-144(AJ519790.1)等,在99%覆盖度下与P.sp.LP621(EU849123.1)一致性为99.24%。

图2 基于16S rDNA扩增序列构建的菌株C26系统发育树
Fig.2 Phylogenetic tree of strain C26 constructed by 16S rDNA amplification sequence
选取11株假交替单胞菌属不同种的细菌,包括同源性最高的P.sp.BSi20396、P. sp.BSi20139、P. sp.AC-144及在99%覆盖度下同源性最高P.sp.LP621与菌株C26构建系统发育分析,如图2所示,只能鉴定菌株C26为假交替单胞菌属,无法鉴定到种。结合菌株C26的菌落形态、显微形态以及序列比对分析,将潜在益生菌C26初步鉴定为假交替单胞菌属。
2.3 菌株C26生长曲线测定及菌液OD600 nm与CFU之间的标准曲线绘制
从图3可见,菌株C26生长延迟期较长,至24 h才进入对数生长期,至36 h进入稳定期,对数生长期菌液OD600 nm值为1.0~2.5。
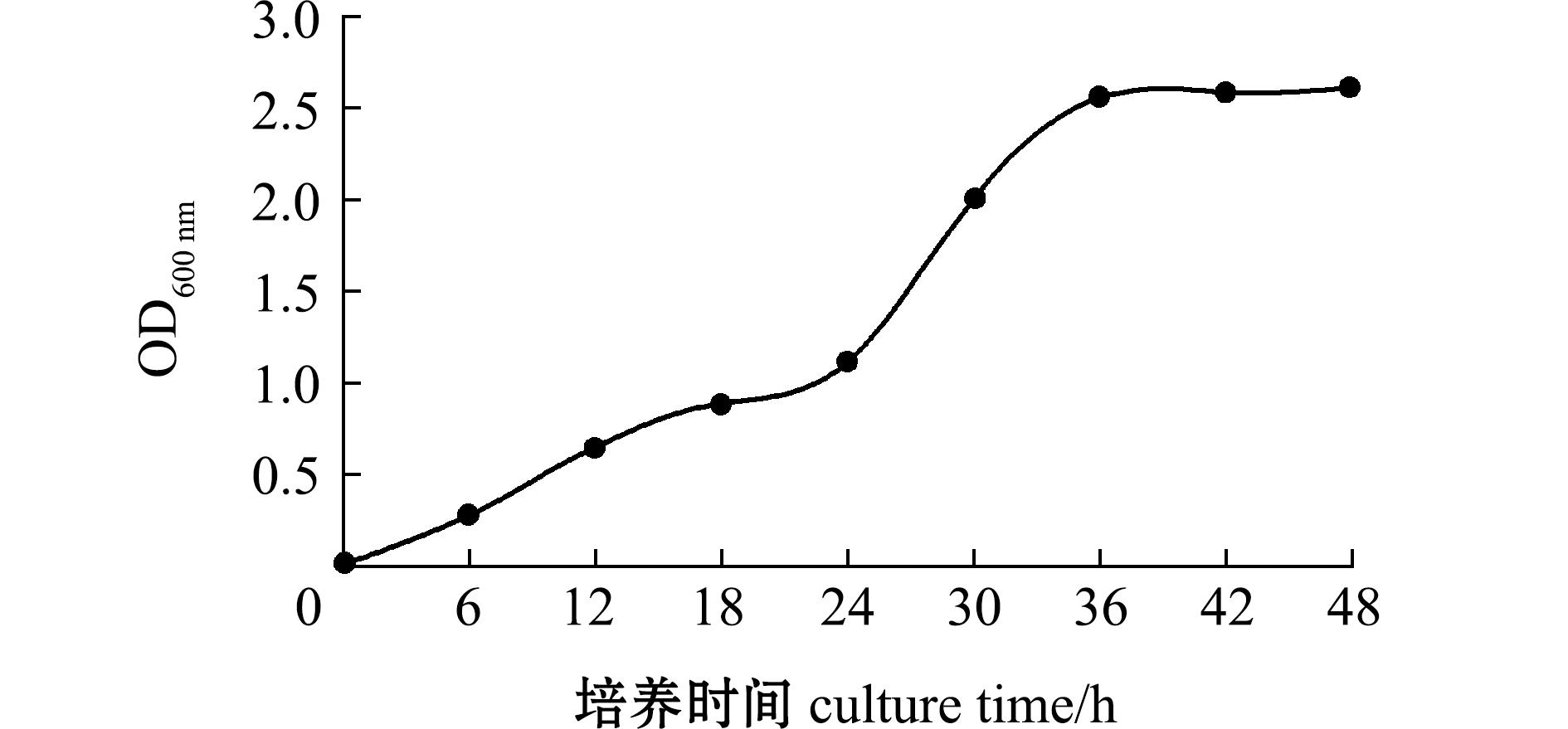
图3 菌株C26生长曲线(25 ℃)
Fig.3 Growth curve of strain C26 (25 ℃)
从图4可见,取不同浓度菌株C26在LB液体培养基中的菌液(对数生长期),用空白培养基稀释后测定其OD600 nm,并将同批稀释菌液涂布到LB琼脂平板,24 h后观察记录菌落数量并计算菌落形成单位CFU。以同一稀释菌液的OD600 nm为横坐标,CFU为纵坐标绘制标准曲线,得到回归方程式y= 1×109x -9×106(R2=0.9974),用于后续计算C26菌液浓度。
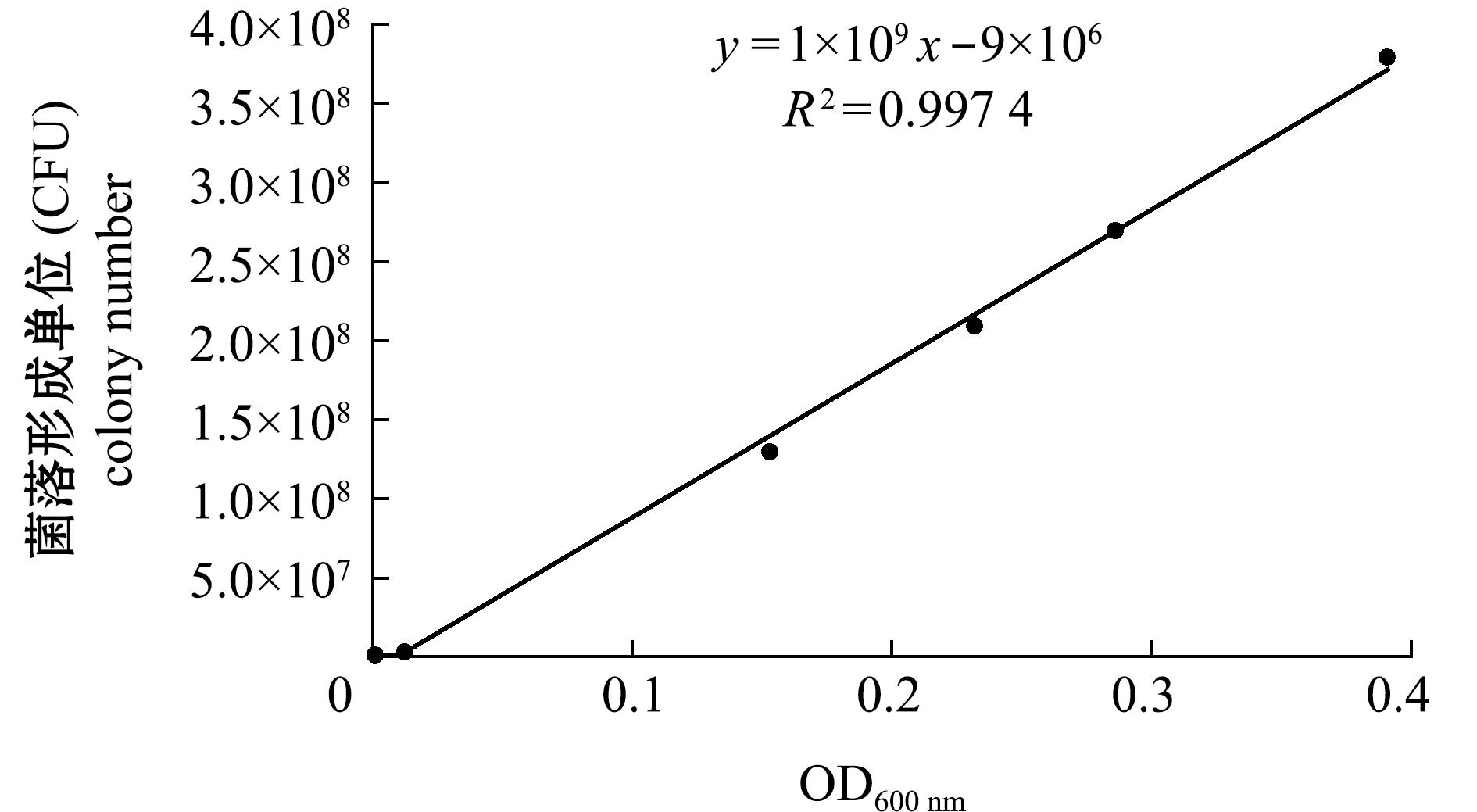
图4 菌株C26菌液OD600 nm与菌落形成单位(CFU)之间的标准曲线
Fig.4 Standard curve derived from the OD600 nm value and colony forming unit (CFU) of C26 liquid culture
2.4 菌株C26耐酸、耐胆盐试验
为了检验菌株C26对动物肠道环境的耐受性,对其分别进行耐酸和耐胆盐试验。从图5可见,在24 h培养周期内,在pH为6.5、5.5的培养基中培养的C26生长良好,菌液OD600 nm呈上升趋势,至8 h稳定。培养8、24 h时,在pH为6.5的培养基中C26菌液OD600 nm均达到1.0左右,在pH为5.5的培养基中C26菌液OD600 nm均达到0.9~1.0。而在pH为3.5、4.5的培养基中,C26生长受到抑制,24 h培养周期内菌液OD600 nm维持在初始值,未见增长。结果表明,菌株C26在pH不低于5.5的酸性环境中生长良好,在pH低于4.5时生长受到抑制。
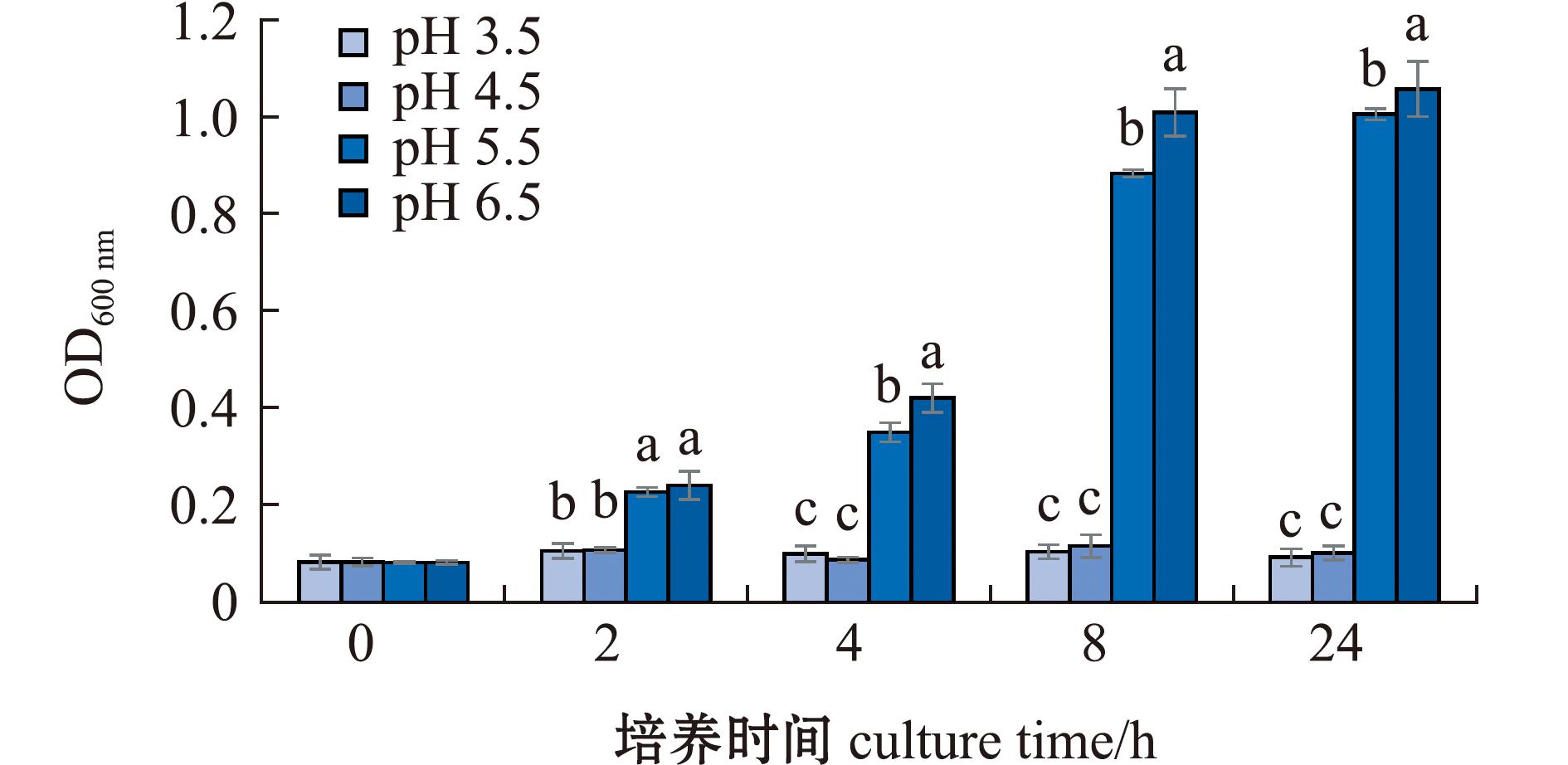
标有不同字母者表示同一时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters in the same time are significant differences in different groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图5 不同pH条件下菌株C26的生长状况
Fig.5 Growth of the strain C26 in media with different pH
从图6可见,24 h培养周期内,空白对照组(不含胆盐)菌液OD600 nm整体呈上升趋势,在培养4 h后显著增长,至8、24 h时OD600 nm值分别达到0.48±0.10和0.73±0.05。在含质量浓度为0.1 g/100 mL胆盐的培养基中,菌液OD600 nm呈现增长(2 h)、下降(4 h)、再增长(8 h,24 h)的变化趋势,2、4 h时OD600 nm值分别为0.16±0.02和0.12±0.02,至8 h时OD600 nm值达到0.39±0.06,24 h时OD600 nm值为0.48±0.05,其峰值显著低于空白对照组峰值(P<0.05)。在含0.3 g/100 mL和0.5 g/100 mL胆盐的培养基中,菌液OD600 nm也呈现增长(2 h)、下降(4 h)、再增长(8 h,24 h)的变化趋势,24 h时OD600 nm峰值分别为0.16±0.04(含0.3 g/100 mL胆盐)、0.13±0.04(含0.5 g/100 mL胆盐),显著低于空白对照组和含低浓度胆盐组。结果表明,胆盐在0.1 g/100 mL浓度即可抑制菌株C26的生长,在高于0.3 g/100 mL的浓度可显著抑制菌株C26的生长。
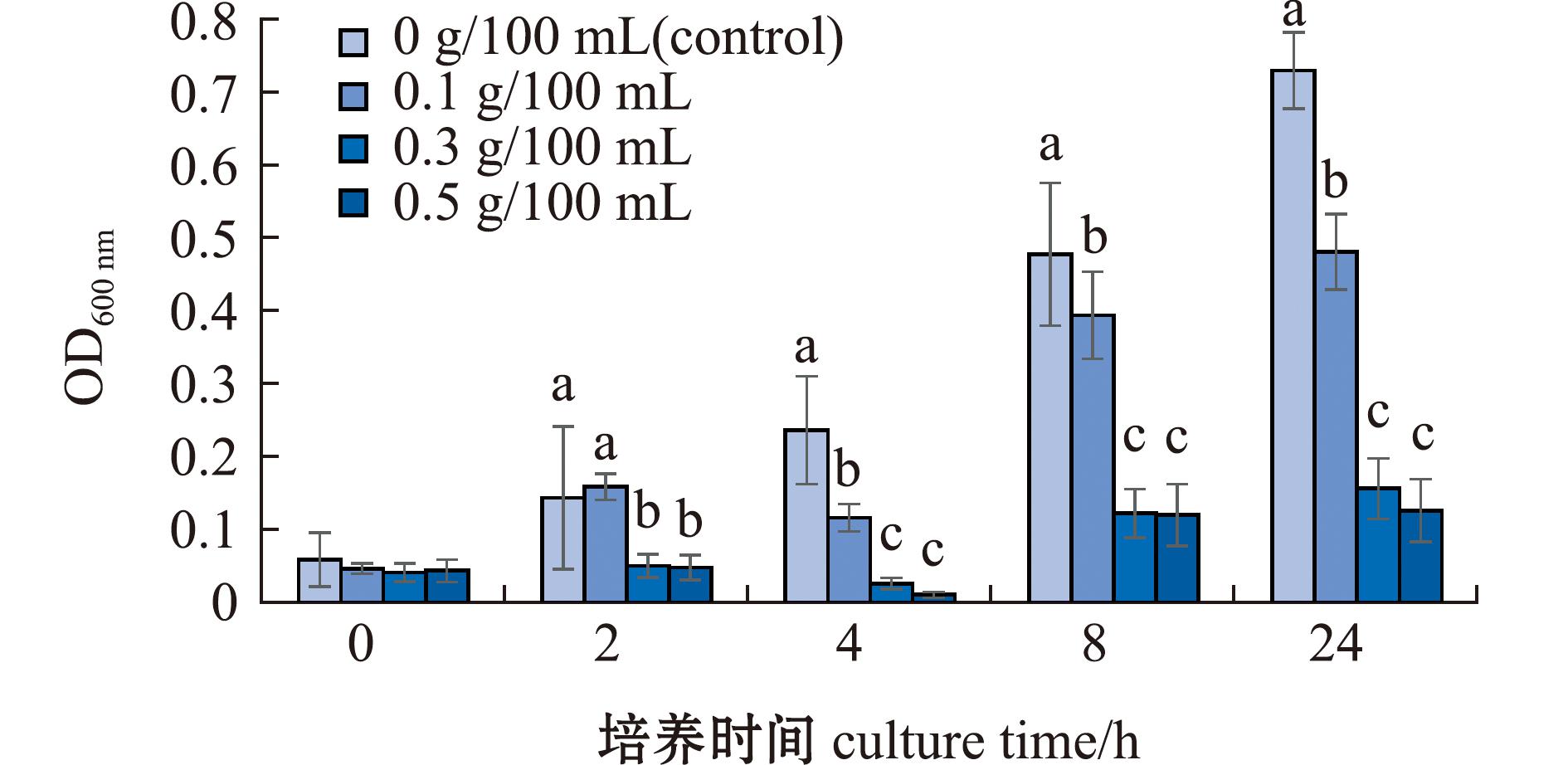
图6 不同胆盐质量浓度下菌株C26的生长状况
Fig.6 Growth of the strain C26 in media containing different concentrations of bile salt
2.5 菌株C26对蛤仔幼贝安全性试验
为检验菌株C26对蛤仔的安全性,选取蛤仔幼贝为试验对象,采用菌液浸浴法进行攻毒试验,试验周期为5 d。取C26对数生长期菌液,按细胞终浓度为5×107 CFU/mL的剂量添加到攻毒试验组,每2 d换水一次,每次换水时重新添加新鲜菌液,试验周期内共添加3次(0、2、4 d)。攻毒试验结果如表2所示,两组试验组蛤仔幼贝的5 d存活率均为93%,而两组对照组蛤仔幼贝的5 d存活率分别为96%和95%,试验组幼贝存活率略低于对照组,但均高于90%,据此推断菌株C26在5×107 CFU/mL的浸浴浓度下对蛤仔幼贝安全无毒,可作为潜在益生菌进行后续试验。
表2 菌株C26攻毒试验结果
Tab.2 Bacterial challenge test results of strain C26
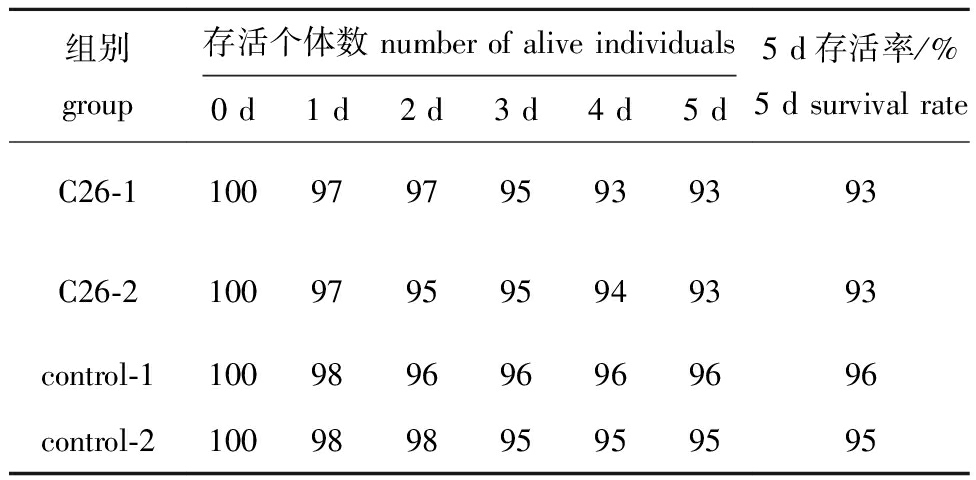
组别group存活个体数 number of alive individuals0 d1 d2 d3 d4 d5 d5 d存活率/%5 d survival rateC26-1100979795939393C26-2100979595949393control-1100989696969696control-2100989895959595
2.6 菌株C26抗生素敏感性试验
为检测菌株C26的抗生素敏感性,选取四环素类、β-内酰胺类、大环内酯类、氨基糖苷类、磺胺类、喹诺酮类和氯霉素类等7大类,共计8种抗生素,分别测定菌株C26对此类抗生素的敏感性。结果表明,菌株C26对四环素、卡那霉素和头孢氨苄耐受,对红霉素和青霉素中度敏感,而对复方新诺明、诺氟沙星和氯霉素敏感(表3)。
表3 菌株C26抗生素敏感性试验
Tab.3 Antibiotic susceptibility test results of strain C26
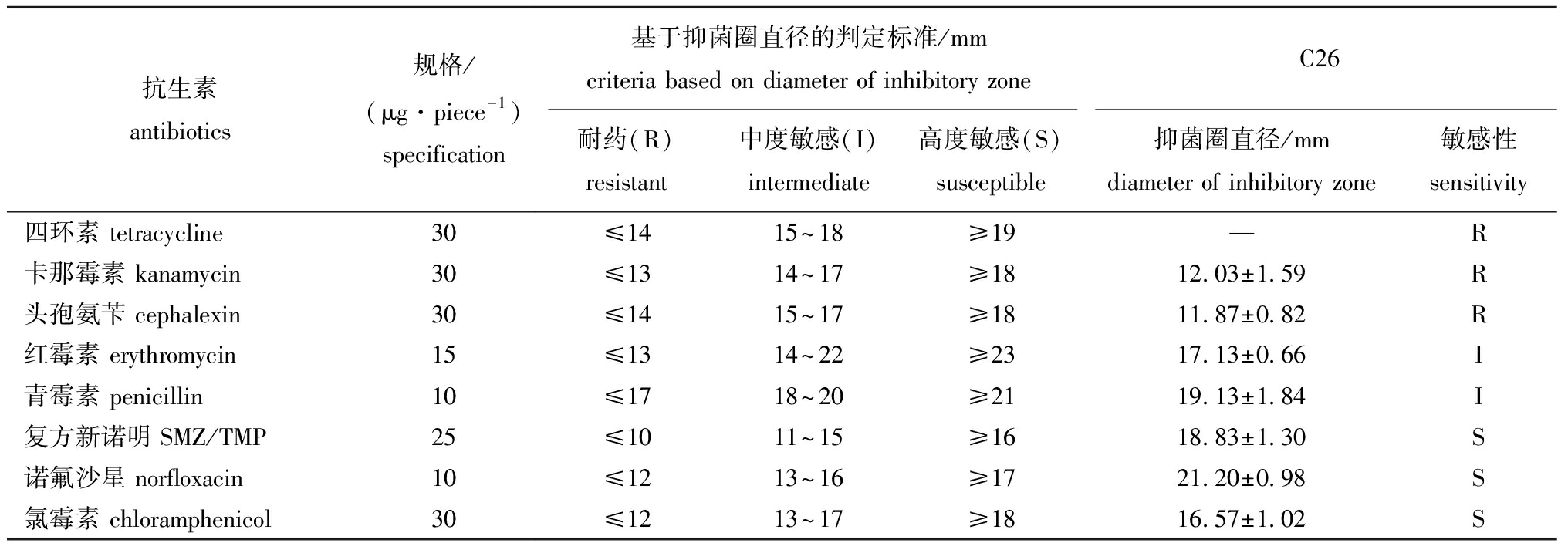
抗生素antibiotics规格/(μg·piece-1)specification基于抑菌圈直径的判定标准/mmcriteria based on diameter of inhibitory zoneC26耐药(R)resistant中度敏感(I)intermediate高度敏感(S)susceptible抑菌圈直径/mmdiameter of inhibitory zone敏感性sensitivity四环素 tetracycline30 ≤1415~18≥19—R卡那霉素 kanamycin30≤1314~17≥1812.03±1.59R头孢氨苄 cephalexin30≤1415~17≥1811.87±0.82R红霉素 erythromycin15≤1314~22≥2317.13±0.66I青霉素 penicillin10≤1718~20≥2119.13±1.84I复方新诺明 SMZ/TMP25≤1011~15≥1618.83±1.30S诺氟沙星 norfloxacin10≤1213~16≥1721.20±0.98S氯霉素 chloramphenicol30≤1213~17≥1816.57±1.02S
注:S—敏感;I—中介;R—耐药。
Note:S—sensitivity;I—intermediary;R—resistance.
2.7 菌株C26显著提高蛤仔幼贝增重率
从图7可见,对照组蛤仔幼贝初始总质量为(22.40±0.33)g,试验周期结束时总质量为(24.00±0.40)g,平均增重率为7.10%±0.71%。试验组蛤仔幼贝初始总质量为(23.38±0.20)g,经60 d浸浴试验后总质量为(25.57±0.09)g,平均增重率为9.37%±0.53%。试验组蛤仔幼贝增重率显著高于对照组(P<0.05)。此外,对照组蛤仔幼贝日增壳长、日增壳高和日增壳宽分别为(14.68±1.02)、(11.96±1.01)、(10.47±0.45)μm/d,试验组蛤仔幼贝日增壳长、日增壳高和日增壳宽分别为(15.01±0.47)、(11.99±0.94)、(11.10±0.50)μm/d。与对照组相比,试验组蛤仔壳规格日增值无差异性显著(P>0.05)。结果表明,菌株C26浸浴处理能显著提高蛤仔幼贝增重率。
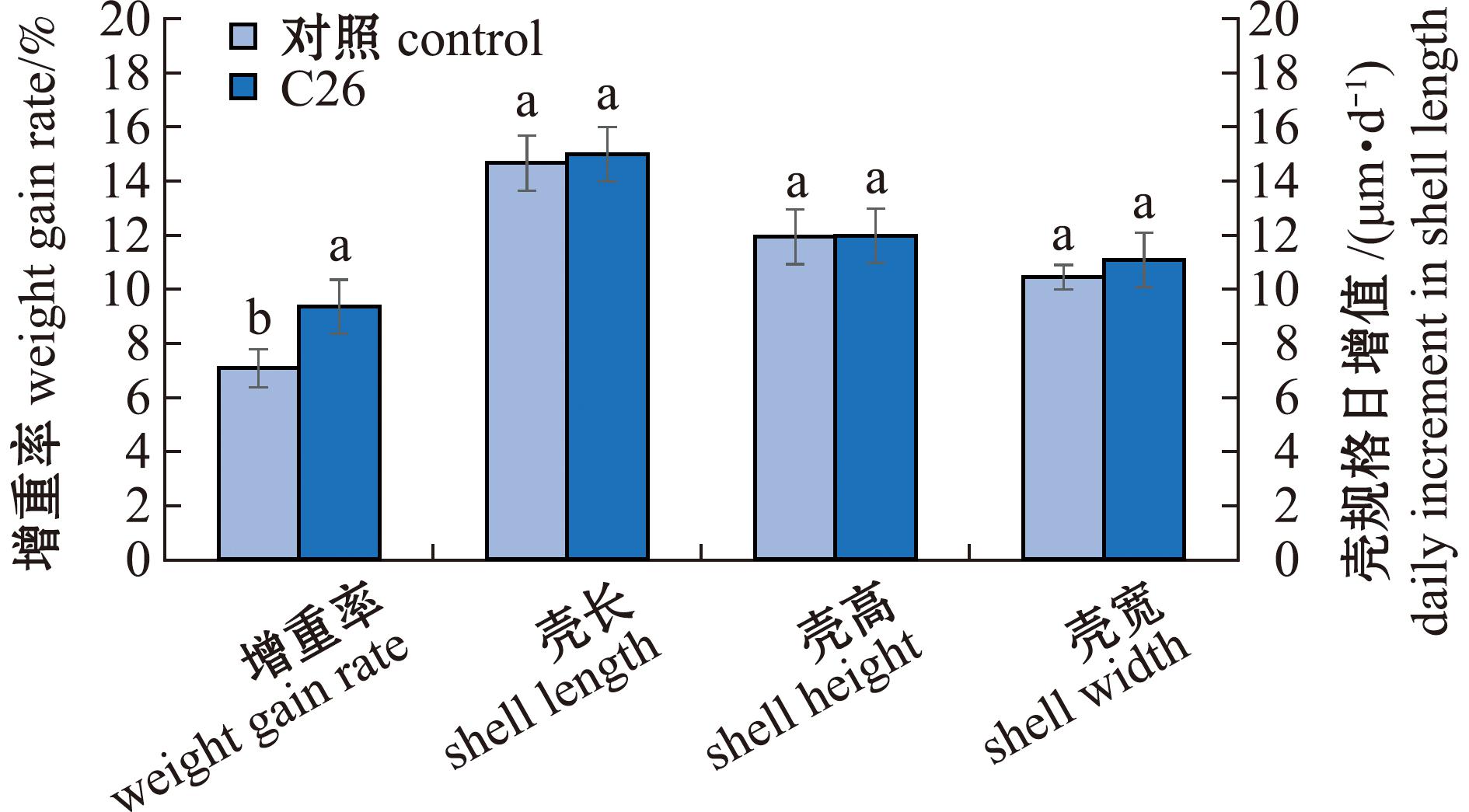
图7 菌株C26对蛤仔幼贝生长的影响
Fig.7 Effect of strain C26 on the growth performance of early juvenile Ruditapes philippinarum larvae
3 讨论
3.1 海水养殖益生菌的种类和作用机理
益生菌是一种通过定殖在宿主体内,改变宿主或其周围环境微生物群落组成的一类对宿主有益的活性微生物。在20世纪80年代中期,Kozasa[13]首次将益生菌应用于水产养殖中,并成功降低了日本鳗鲡(Anguillidae)的死亡率,为水产益生菌的应用奠定了基础。2008年,《农业农村部公告》第1126号公布的《饲料添加剂品种目录(2008)》中共计15种益生菌可用于水产养殖,2013年,《农业农村部公告》第2045号公布该目录新增16种益生菌,共计批准31种益生菌可作为水产养殖的微生物饲料添加剂[8,14]。目前在水产养殖过程中应用较多的益生菌属主要包括芽孢杆菌属(Bacillus sp.)、乳酸菌属(Lactobacillus sp.)、肠球菌属(Enterococcus sp.)、酵母菌属(Saccharomyces sp.)、假交替单胞菌属(Pseudoalteromonas sp.)、片球菌属(Pediococcus sp.)、光合细菌(photosynthetic bacteria)、硝化细菌(nitrobacteria bacteria)和假单胞菌属(Pseudomonas sp.)等[8]。水产益生菌通过调节肠道菌群[15]、增强免疫力[16]、改善水质[17]及提供营养物质和消化酶[18-19]等多种机制,为水产动物的健康生长提供了有力支持。本研究中从健康菲律宾蛤仔肠道分离获得一株具备产淀粉酶、蛋白酶和脂肪酶能力的细菌,基于16S rRNA基因序列的鉴定提示其为假交替单胞菌属(Pseudoalteromonas)细菌,其对蛤仔幼虫安全无毒且能显著促进蛤仔幼虫增重率,为潜在蛤仔益生菌,有可能丰富海水养殖益生菌菌种资源。
3.2 来源于水产动物肠道组织的海水养殖益生菌
一般认为,源自养殖动物本身的益生菌具有安全、易定植、更易发挥益生作用等特点,因此,附着于健康水产养殖动物肠道组织、能产生消化酶的细菌成为水产益生菌的重要来源。刘姣等[20]将从刺参(Stichopus japonicus)肠道组织分离获得的产酶潜在益生菌,添加至基础饵料用于饲喂幼参,结果表明,幼参存活率提高、免疫力增强。Kaktcham等[21]从罗非鱼(Oreochromis mossambicus)和鲤肠道内成功分离并筛选出具有特殊代谢能力的菌株,并通过抑菌试验,发现筛选出的菌株对部分革兰氏阳性致病菌和革兰氏阴性致病菌具有显著的抑制作用。Kong等[22]从黑鱼(Channa argus)肠道中成功分离出乳酸菌,能有效对抗氧化和炎症反应,还表现出抗病特性,可促进鱼的生长性能及增强免疫。Iehata等[23]从日本大鲍(Haliotis gigantea)肠道中分离的片球菌可改善鲍鱼的肠道菌群、增加海藻酸盐裂解酶活性。姜海峰等[24]从皱纹盘鲍(Haliotis discus Hannai)肠道组织分离出2株具有产酶活力和致病菌拮抗能力的希瓦氏菌属(Shewanella)菌株WA64和WA65,幼鲍饲喂试验结果表明,WA64和WA65联合投喂能显著提高幼鲍存活率和增重率。赵学伟等[25]从虾夷扇贝(Patinopecten yessoensis)肠道组织分离筛选出一株能同时产生淀粉酶、蛋白酶和纤维素酶的埃氏假交替单胞菌(Pseudoalteromonas espejiana)W115菌株,将其作为饵料添加剂投喂扇贝幼虫,养殖试验结果表明,该菌株能显著提高幼贝的存活率和生长率。本研究中,从分离自健康蛤仔肠道组织的21株可培养细菌筛选出一株消化酶产生菌,初步鉴定其属于假交替单胞菌属,蛤仔幼虫养殖试验表明其有显著促生长作用,与前期研究结果一致。
3.3 海水养殖中的假交替单胞菌
假交替单胞菌属是1995年由Gauthier等[26]通过16S rRNA系统进化分析从交替单胞菌属中分离并建立的一类新的海洋细菌属,因其能产生多种具有抗菌、除藻、降解纤维素和果胶等作用的生物活性物质,受到国内外研究者的广泛关注[27-28]。此外,有研究表明,从植物体内分离出的假交替单胞菌属细菌对植物具有促生作用[29]。据报道,多种假交替单胞菌对弧菌具有广泛的抗菌作用[30-31],Gustilatov等[32]发现,假交替单胞菌1Ub可以降低副溶血性弧菌(Vibrio parahaemolyticus)的密度,保护凡纳滨对虾(Litopenaeus vannamei)肝胰腺免受副溶血性弧菌造成的损害;金黄色假交替单胞菌(Pseudoalteromonas flavipulchra)JG1可以合成一种蛋白质 PfaP 和一系列对鳗弧菌(Vibrio anguillarum)具有抑制活性的小分子化合物[33];杀鱼假交替单胞菌(Pseudoalteromonas piscicida)被发现对创伤弧菌(Vibrio vulnificus)、霍乱弧菌(Vibrio cholerae)、海藻希瓦氏菌(Shewanella algae)及金黄色葡萄球菌(Staphylococcus aureus)等多种致病菌均有一定抑制作用[34]。该属细菌用于水产养殖也被证明可提高不同水产动物的抗病能力和生长性能[35-36]。Offret等[37]将鲍在含有假交替单胞菌的海水悬浮液中提前浸泡一段时间,发现能显著提高鲍被弧菌感染后的存活率;Leyton等[38]报道,假交替单胞菌可提高黄尾鰤(Seriola lalandi)幼鱼的存活率,并可促进其生长;Wang等[39]报道,假交替单胞菌可降低凡纳滨对虾肠中的弧菌数,以及显著降低其累积死亡率;Pardede等[40]也证实了假交替单胞菌可显著提高凡纳滨对虾的特定生长率和最终质量;赵学伟等[25]向3个时期虾夷扇贝幼体的饲料中添加了浓度为1×104 cells/mL的埃氏假交替单胞菌W115,相较于对照组幼贝的存活率和特定生长率均有大幅提升;Wang等[41]将含有假交替单胞菌D11的固态发酵(SSF)饲料饲喂幼年海参,结果表明,处理组海参的增重率和特定生长率与对照组相比均有显著升高。本研究结果进一步拓展了假交替单胞菌属细菌作为潜在益生菌在海水养殖中的应用范围,阐明了其在蛤仔养殖中的应用前景。
4 结论
1)从健康菲律宾蛤仔肠道中分离筛选获得1株能够产生淀粉酶、蛋白酶和脂肪酶的细菌C26,经鉴定该菌株为假交替单胞菌属细菌。
2)菌株C26耐酸、耐胆盐试验结果表明,菌株C26在强酸和高浓度胆盐条件下,活菌数量未减少且仍呈上升趋势,表明菌株C26具有较强的酸性耐受性和胆盐耐受性。
3)菲律宾蛤仔幼贝在菌株C26浸浴浓度高达5×107 CFU/mL的条件下,5 d存活率仍高于90%,表明菌株C26对蛤仔幼贝安全无毒。
4)为期60 d的养殖试验结束后,菌株C26处理组的增重率为9.37%±0.53%,相较于空白对照组7.10%±0.71%的增重率有显著提高(P<0.05),表明菌株C26对蛤仔幼贝的生长具有促进作用。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会编制.中国渔业统计年鉴2023[M].北京:中国农业出版社,2023.
Fishery and Fishery Administration of the Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center,China Society of Fisheries.Chinese Fishery Statistics Yearbook 2023[M].Beijing:China Agriculture Press,2023.(in Chinese)
[2] 林位琅,连晨阳,陈志,等.福建菲律宾蛤仔产业发展报告[J].中国水产,2022(11):50-53.
LIN W L, LIAN C Y, CHEN Z,et al.Fujian Philippine clam industry development report[J].China Fisheries,2022(11):50-53.(in Chinese)
[3] 李十盛,高会,赵富强,等.水产养殖环境中抗生素抗性基因的研究进展[J].中国环境科学,2021,41(11):5314-5325.
LI S S,GAO H,ZHAO F Q,et al.Research progress on the occurrence and influencing factors of antibiotic resistance genes in aquaculture environment[J].China Environmental Science,2021,41(11):5314-5325.(in Chinese)
[4] 刘伟强,靳育琦,董寒旭,等.益生菌在水产养殖病害防控中的应用[J].动物医学进展,2023,44(8):112-116.
LIU W Q,JIN Y Q,DONG H X,et al.Application of probiotics in aquatic disease control[J].Progress in Veterinary Medicine,2023,44(8):112-116.(in Chinese)
[5] KNIPE H,TEMPERTON B,LANGE A K,et al.Probiotics and competitive exclusion of pathogens in shrimp aquaculture[J].Reviews in Aquaculture,2021,13(1):324-352.
[6] SARAVANAN K,SIVARAMAKRISHNAN T,PRAVEENRAJ J,et al.Effects of single and multi-strain probiotics on the growth,hemato-immunological,enzymatic activity,gut morphology and disease resistance in rohu,Labeo rohita[J].Aquaculture,2021,540:736749.
[7] DU Y,XU W L,WU T,et al.Enhancement of growth,survival,immunity and disease resistance in Litopenaeus vannamei,by the probiotic,Lactobacillus plantarum Ep-M17[J].Fish &Shellfish Immunology,2022,129:36-51.
[8] 农业农村部.中华人民共和国农业部公告第2045号[J].中国饲料,2014(2):1-4.
Ministry of Agriculture and Rural Affairs.Announcement No.2045th of People’s Republic of China (PRC) Ministry of Agriculture and Rural Affairs[J].China Feed,2014(2):1-4.(in Chinese)
[9] 郝凯.南美白对虾专用益生菌研究[D].杨凌:西北农林科技大学,2013.
HAO K.The study of special probiotics to Penaeus vannamei[D].Yangling:Northwest A &F University,2013.(in Chinese)
[10] 蔡红丹.石斑鱼肠道益生菌的筛选、鉴定及其益生效果研究[D].大庆:黑龙江八一农垦大学,2021.
CAI H D.Screening,identification and biotic effect of probiotics in the intestinal tract of grouper (Epinephelus coioides)[D].Daqing:Heilongjiang Bayi Agricultural University,2021.(in Chinese)
[11] 闫法军.刺参养殖池塘有机物降解微生物的分离筛选及其特性研究[D].青岛:中国海洋大学,2010.
YAN F J.Studies on screening and characterization of microorganisms with high organic-pollutants-degrading capability from sea cucumber (Apostichopus japonicus Selenka) culture ponds[D].Qingdao:Ocean University of China,2010.(in Chinese)
[12] 马培培,苏梦茹,李鑫鑫,等.大肠埃希菌细菌计数分光光度计法的建立及应用[J].动物医学进展,2020,41(5):29-33.
MA P P,SU M R,LI X X,et al.Establishment and application Escherichia coli counting method based on spectrophotometer[J].Progress in Veterinary Medicine,2020,41(5):29-33.(in Chinese)
[13] KOZASA M.Toyocerin (Bacillus toyoi) as growth promotor for animal feeding[J].Microbiol Aliment Nutr,1986,4:121-135.
[14] 赵勇,段为旦,王友成,等.益生菌在水产可持续养殖中的研究进展及展望[J/OL].水产学报,2023:1-10.(2023-10-27).https://kns.cnki.net/kcms/detail/31.1283.S.20231026.1717.004.html.
ZHAO Y,DUAN W D,WANG Y C,et al.Research progress and prospect of probiotics in sustainable aquaculture[J/OL].Journal of Fisheries of China,2023:1-10.(2023-10-27).https://kns.cnki.net/kcms/detail/31.1283.S.20231026.1717.004.html.(in Chinese)
[15] VAN DOAN H,HOSEINIFAR S H,RINGØE,et al.Host-associated probiotics:a key factor in sustainable aquaculture[J].Reviews in Fisheries Science &Aquaculture,2020,28(1):16-42.
[16] 产启霞,王福强,憨素连,等.复合益生菌对大菱鲆(Scophthalmus maximus)幼鱼免疫及抗病力的影响[J].饲料工业,2021,42(20):36-40.
CHAN Q X,WANG F Q,HAN S L,et al.Effects of compound probiotics on immunity and resistance to disease of juvenile turbot(Scophthalmus maximus)[J].Feed Industry,2021,42(20):36-40.(in Chinese)
[17] DAS A,NAKHRO K,CHOWDHURY S,et al.Effects of potential probiotic Bacillus amyloliquifaciens FPTB16 on systemic and cutaneous mucosal immune responses and disease resistance of catla (Catla catla)[J].Fish &Shellfish Immunology,2013,35(5):1547-1553.
[18] WANG G Y,JIANG Y X,JIANG J H,et al.Effects of feed supplemented with probiotics on the culture of sea cucumber Apostichopus japonicus[J].Aquaculture Nutrition,2021,27(6):2703-2711.
[19] AMOAH K,HUANG Q C,TAN B P,et al.Dietary supplementation of probiotic Bacillus coagulans ATCC 7050,improves the growth performance,intestinal morphology,microflora,immune response,and disease confrontation of Pacific white shrimp,Litopenaeus vannamei[J].Fish &Shellfish Immunology,2019,87:796-808.
[20] 刘姣,韩华,孙飞雪,等.饵料中添加芽孢杆菌BC26对刺参幼参消化酶、免疫反应和抗病力的影响[J].大连海洋大学学报,2013,28(6):568-572.
LIU J,HAN H,SUN F X,et al.Effects of dietary live Bacillus sp.BC26 on digestive enzyme activity,immune response and disease resistance against Vibrio splendidus infection in juvenile sea cucumber Apostichopus japonicus[J].Journal of Dalian Ocean University,2013,28(6):568-572.(in Chinese)
[21] KAKTCHAM P M,TEMGOUA J B,NGOUFACK ZAMBOU F,et al.Quantitative analyses of the bacterial microbiota of rearing environment,tilapia and common carp cultured in earthen ponds and inhibitory activity of its lactic acid bacteria on fish spoilage and pathogenic bacteria[J].World Journal of Microbiology and Biotechnology,2017,33(2):32.
[22] KONG Y D,GAO C S,DU X Y,et al.Effects of single or conjoint administration of lactic acid bacteria as potential probiotics on growth,immune response and disease resistance of snakehead fish (Channa argus)[J].Fish &Shellfish Immunology,2020,102:412-421.
[23] IEHATA S,INAGAKI T,OKUNISHI S,et al.Improved gut environment of abalone Haliotis gigantea through Pediococcus sp.Ab1 treatment[J].Aquaculture,2010,305(1/2/3/4):59-65.
[24] 姜海峰,刘小林,常亚青,等.皱纹盘鲍(Haliotis discus Hannai)肠道潜在益生菌的筛选及对幼鲍生长的影响[J].海洋与湖沼,2013,44(2):482-487.
JIANG H F,LIU X L,CHANG Y Q,et al.Selection of potential probiotics from abalone intestional and their effects on growth of juvenile small abalone Haliotis discus Hannai[J].Oceanologia et Limnologia Sinica,2013,44(2):482-487.(in Chinese)
[25] 赵学伟,李明,梁峻,等.1株虾夷扇贝苗种培育用益生菌的筛选及其对幼体存活和生长的影响[J].大连海洋大学学报,2017,32(5):514-519.
ZHAO X W,LI M,LIANG J,et al.Selection of one probiotic strain for larviculture and its effects on larval survival and growth of Yesso scallop Patinopecten yessoensis[J].Journal of Dalian Ocean University,2017,32(5):514-519.(in Chinese)
[26] GAUTHIER G,GAUTHIER M,CHRISTEN R.Phylogenetic analysis of the genera Alteromonas,Shewanella,and Moritella using genes coding for small-subunit rRNA sequences and division of the genus Alteromonas into two genera,Alteromonas (emended) and Pseudoalteromonas gen.nov.,and proposal of twelve new species combinations[J].International Journal of Systematic Bacteriology,1995,45(4):755-761.
[27] OFFRET C,DESRIAC F,LE CHEVALIER P,et al.Spotlight on antimicrobial metabolites from the marine bacteria Pseudoalteromonas:chemodiversity and ecological significance[J].Marine Drugs,2016,14(7):129.
[28] 唐杨.假交替单胞菌胞外产物的特性分析及其抑菌蛋白的克隆与表达[D].上海:上海海洋大学,2017.
TANG Y.Analysis of extracellular product characteristics of Pseudoalteromonas and cloning and expression of its antibacterial protein[D].Shanghai:Shanghai Ocean University,2017.(in Chinese)
[29] 石佳,徐爽,王博,等.盐地碱蓬叶片可培养细菌的分离及促生菌的筛选鉴定[J].大连海洋大学学报,2022,37(2):235-243.
SHI J,XU S,WANG B,et al.Isolating culturable endophytic bacteria from sea grass Suaeda salsa leaves and screening the potential plant growth promoting bacterium[J].Journal of Dalian Ocean University,2022,37(2):235-243.(in Chinese)
[30] VYNNE N G,MÅNSSON M,NIELSEN K F,et al.Bioactivity,chemical profiling,and 16S rRNA-based phylogeny of Pseudoalteromonas strains collected on a global research cruise[J].Marine Biotechnology,2011,13(6):1062-1073.
[31] SORIEUL L,WABETE N,ANSQUER D,et al.Survival improvement conferred by the Pseudoalteromonas sp.NC201 probiotic in Litopenaeus stylirostris exposed to Vibrio nigripulchritudo infection and salinity stress[J].Aquaculture,2018,495:888-898.
[32] GUSTILATOV M,WIDANARNI W,EKASARI J,et al.Biofloc system supplemented by Pseudoalteromonas piscicida 1Ub protects the Pacific white shrimp Penaeus vannamei from Vibrio parahaemolyticus infection[J].Aquaculture and Fisheries,2023
[33] YU M,WANG J F,TANG K H,et al.Purification and characterization of antibacterial compounds of Pseudoalteromonas flavipulchra JG1[J].Microbiology,2012,158(Pt 3):835-842.
[34] RICHARDS G P,WATSON M A,NEEDLEMAN D S,et al.Mechanisms for Pseudoalteromonas piscicida-induced killing of vibrios and other bacterial pathogens[J].Applied and Environmental Microbiology,2017,83(11):e00175-e00117.
[35] KESARCODI-WATSON A,MINER P,NICOLAS J L,et al.Protective effect of four potential probiotics against pathogen-challenge of the larvae of three bivalves:Pacific oyster (Crassostrea gigas),flat oyster (Ostrea edulis) and scallop (Pecten maximus)[J].Aquaculture,2012,344:29-34.
[36] MAEDA M,NOGAMI K,KANEMATSU M,et al.The concept of biological control methods in aquaculture[C]//HAGIWARA A,SNELL TW,LUBZENS E,et al.Live Food in Aquaculture.Dordrecht:Springer,1997:285-290.
[37] OFFRET C,ROCHARD V,LAGUERRE H,et al.Protective efficacy of a Pseudoalteromonas strain in European abalone,Haliotis tuberculata,infected with Vibrio harveyi orm4[J].Probiotics and Antimicrobial Proteins,2019,11(1):239-247.
[38] LEYTON Y,SAYES C,MEJIAS C,et al.Increased larval survival of Seriola lalandi using Pseudoalteromonas sp.as probiotics[J].Revista De Biología Marina y Oceanografía,2017,52(1):95-101.
[39] WANG H L,WANG C D,TANG Y,et al.Pseudoalteromonas probiotics as potential biocontrol agents improve the survival of Penaeus vannamei challenged with acute hepatopancreatic necrosis disease (AHPND)-causing Vibrio parahaemolyticus[J].Aquaculture,2018,494:30-36.
[40] PARDEDE M A,WIDANARNI W,SUKENDA S,et al.Evaluation of dietary microencapsulated synbiotics Pseudoalteromonas piscicida 1UB,Bacillus NP5,and mannan-oligosaccharides to prevent Vibrio parahaemolyticus infection in Pacific white shrimp Penaeus vannamei[J].Aquaculture International,2024,32(2):2077-2091.
[41] WANG J H,GUO H,ZHANG T R,et al.Growth performance and digestion improvement of juvenile sea cucumber Apostichopus japonicus fed by solid-state fermentation diet[J].Aquaculture Nutrition,2017,23(6):1312-1318.