香港牡蛎(Crassostrea hongkongensis)是中国南方重要的海水养殖贝类,主要栖息于中国华南与越南沿海的潮间带及河口地区。近年来,香港牡蛎出现的大规模死亡现象严重威胁养殖产业的健康发展,并造成了极大的经济损失。研究发现,香港牡蛎大规模死亡现象可出现在夏季和秋冬季节,受到水温、盐度、饵料浓度及病原微生物等多种因子影响,但总体和水温及盐度的变化密切相关[1-3]。河口地区的水域环境受人类活动和气候影响较大,在季节交替之际变化快速且复杂,影响香港牡蛎的生存和生理状态[4]。因此,监测河口地区水体理化因子变化及香港牡蛎的生理状态,有助于深入了解环境变化对牡蛎的影响,减少其大规模死亡并促进该产业发展。
河口位于咸淡水交界处,盐度、浮游微藻和细菌群落结构的变化是河口地区环境的重要特征。研究发现,香港牡蛎对低盐环境的耐受性较强,但在高盐环境中会出现较高的死亡率[5]。通过对牡蛎肠道内容物研究发现,硅藻是牡蛎重要的食物来源,而饵料藻浓度的变化会影响到牡蛎的成活率[6]。同时,牡蛎作为在水中营固着生存的软体动物,时刻受到水体中细菌的影响。牡蛎的大规模死亡通常会伴随着细菌群落出现剧烈的变化,而弧菌作为条件致病菌会直接导致牡蛎的细胞凋亡和组织坏死[7]。此外,盐度作为重要的水质指标会影响水中饵料藻和微生物的组成和丰度,进一步影响香港牡蛎的生长和发育。河口底栖硅藻的分布特征与盐度和营养物梯度密切相关,而氨氧化细菌等菌群多样性会随盐度增加而降低[8],因此,河口地区的牡蛎常常面临着复杂的生存压力。季节交替造成的气候变化通常会对水产养殖业带来风险,甚至导致养殖生物生长发育障碍、暴发疾病甚至死亡。在河口地区,夏季降水会使盐度频繁变化,同时降水导致的径流输入改变和水层交换会使多项水质指标出现剧烈变化。研究发现,这些变化会影响香港牡蛎的生理活动,不利于其生长和生存。
盐度、浮游微藻和细菌群落结构等环境因子的变化对牡蛎的能量代谢和氧化应激水平产生了一定影响。研究发现,盐度胁迫会改变牡蛎代谢并增加能量消耗[9],糖原作为牡蛎体内重要的供能物质被大量消耗[10]。而当饵料藻类丰度较少时,牡蛎需要延长摄食时间和滤水量来保证摄食量,这同样会加剧牡蛎的能量消耗[11]。除能量代谢方面的影响外,环境胁迫还会造成牡蛎的氧化损伤。盐度和温度胁迫分别导致香港牡蛎和美洲牡蛎(Crassostrea virginica)鳃组织细胞内产生大量的活性氧(ROS)和自由基,破坏细胞内的正常代谢活动并进一步导致细胞死亡[12-13]。与非生物的环境胁迫一样,来自生物的病原胁迫同样会造成氧化损伤。溶藻弧菌(Vibrio alginolyticus)刺激导致香港牡蛎血淋巴细胞中的超氧化物和过氧化氢水平上升并诱导细胞凋亡[14]。在面对这些氧化损伤时,牡蛎通过激活抗氧化防御系统,如增强过氧化氢酶(CAT)和超氧化物歧化酶(SOD)的活性来减少氧化损伤。因此,能量代谢和氧化应激过程是评价牡蛎健康水平的重要手段[15]。
本研究中于2023年9—10月针对广西北海香港牡蛎主要养殖区——大风江河口及上游水域的环境因子进行了调研,检测了水质理化因子、浮游微藻、细菌丰度及香港牡蛎能量储备和氧化应激等相关指标,以期为香港牡蛎病害防控预警预报体系的构建提供数据支持。
1 材料与方法
1.1 材料
调研于2023年9—10月,在广西北海大风江河口及上游水域采集海水样品和养殖的香港牡蛎。第一次调查(9月11日)于河口水域(A点,108°52′49″ E,21°38′26″ N)进行样品采集(9A组),第二次(10月17日)于河口相同水域和上游水域(B点,108°51′30″ E,21°46′22″ N)进行样品采集(分别为10A组和10B组)。A、B两点均为香港牡蛎的主养区,但在秋冬季节时A点牡蛎易发生死亡,因此养殖主要区域会由A点向B点转移。A、B两点养殖牡蛎的规格相近,为不同群体。
1.2 方法
1.2.1 样品的采集 在采样点附近随机选取3处香港牡蛎养殖水域采集表层水样,随后取1 L海水加入10 mL Lugol’s溶液,用于浮游微藻计数分析;将0.1%碳酸镁悬浊液加入1 L海水,采用0.7 μm GF/F滤膜过滤后进行叶绿素含量分析;采用0.22 μm滤膜过滤1 L海水,采用过滤后的海水进行水质分析,滤膜保存于干冰环境用于细菌丰度分析;每组样品设置3个平行。每组样品随机采集9只二龄香港牡蛎,平均体质量为(157.8±36.3)g,取鳃和闭壳肌组织样品后将一部分组织直接冻存,另一部分使用TRIzol试剂保存,用于牡蛎健康指标分析。试验过程中操作人员严格遵守动物试验伦理规范,并按照大连海洋大学伦理委员会制定的规章制度执行。
1.2.2 水质指标分析 采用YSI多参数水质测定仪(美国)对每次调查水域的表层海水温度、水中溶解氧(DO)含量、水体pH和盐度进行原位监测。对水样中铵盐![]() 亚硝酸盐
亚硝酸盐![]() 硝酸盐
硝酸盐![]() 磷酸盐
磷酸盐![]() 和硅酸盐
和硅酸盐![]() 浓度采用相应的国标方法(GB 17378.4—2007《海洋监测规范》)进行分析。
浓度采用相应的国标方法(GB 17378.4—2007《海洋监测规范》)进行分析。
1.2.3 浮游微藻分析与鉴定 在4 ℃条件下,采用10 mL 90%丙酮溶液浸泡GF/F滤膜24 h,采用分光光度法分析叶绿素a(Chl-a)浓度[16]。将加入Lugol’s溶液后的水样静置24 h后,采用光学显微镜和血球计数板对浮游微藻进行种类鉴定和计数。
1.2.4 细菌丰度分析 分别利用EZNATM Water DNA Kit和EZNATM Soil DNA Kit(OMEGA Bio-Tek,美国)提取表层海水样品和香港牡蛎鳃组织样品DNA。采用NanoDrop 2000(丹麦)检测提取的DNA质量合格后用于荧光定量PCR(RT-qPCR)分析。建立细菌总数和弧菌的绝对定量PCR标准曲线,构建待测基因的标准质粒,测序验证后测定标准质粒浓度,计算拷贝数后梯度稀释标准质粒,作为模板进行RT-qPCR检测。细菌丰度分析所用引物见表1,引物由生工生物工程(上海)股份有限公司合成。
表1 引物信息
Tab.1 Primer information
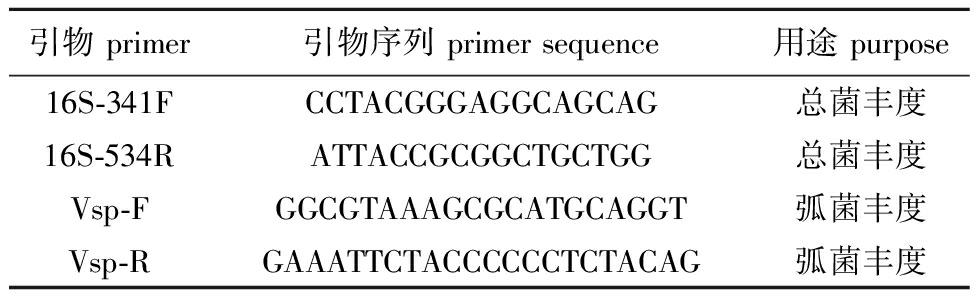
引物 primer引物序列 primer sequence用途 purpose16S-341FCCTACGGGAGGCAGCAG总菌丰度16S-534RATTACCGCGGCTGCTGG总菌丰度Vsp-FGGCGTAAAGCGCATGCAGGT弧菌丰度Vsp-RGAAATTCTACCCCCCTCTACAG弧菌丰度
1.2.5 糖原和葡萄糖含量分析 按照检测试剂盒说明书,在装有磷酸盐缓冲溶液(PBS)的试管中加入香港牡蛎闭壳肌组织0.1 g,使用匀浆机并在4 ℃条件下制成组织匀浆(10%质量体积比)。将组织匀浆于4 ℃下以2 500 r/min离心10 min后分离上清液。使用上清液,采用索莱宝生化检测试剂盒(编号BC0345)测定组织中糖原含量,采用南京建成生化检测试剂盒(编号F006-1-1)测定组织中葡萄糖含量。
1.2.6 氧化应激相关指标分析 按照检测试剂盒说明书,在装有磷酸盐缓冲溶液(PBS)的试管中加入香港牡蛎鳃组织0.1 g,使用匀浆机在4 ℃条件下制成组织匀浆(10%质量体积比)。将组织匀浆在4 ℃下以2 500 r/min离心10 min后小心分离上清液。使用上清液,利用南京建成生化检测试剂盒(试剂盒编号:A003-1-2、A015-1-2、A001-3-2、A007-1-1)分别测定丙二醛(MDA)含量、总抗氧化能力(T-AOC)、总超氧化物歧化酶(SOD)酶活性和过氧化氢酶(CAT)酶活性。
1.3 数据处理
试验结果均以平均值±标准差(mean±S.D.)表示,每个试验均设置3个平行。利用SPSS 26软件进行单因素方差分析和多重比较,显著性水平设为0.05。
2 结果与分析
2.1 水体理化因子变化
从表2可见,9A组表层水温为28.1 ℃,10A和10B的表层水温分别为25.7、26.0 ℃,在相同采样点9月水温比10月高约2 ℃,但在相同月份采样点10A和采样点10B间水温相差较小。溶解氧的测定结果显示,9A组监测的DO浓度为4.54 mg/L,在所有水样中含量最低,10A和10B组表层水样中的DO浓度分别为6.66、6.49 mg/L。海水盐度测定的结果显示,9A、10A和10B组的盐度相差较大,分别为20.89、25.50和8.05。水体pH测定结果显示,9A和10A组水体pH较为接近,检测结果分别为7.62和7.61,均略高于10B组的7.14(表2)。
表2 表层水体的理化因子变化
Tab.2 Water physical and chemical factors in surface water column
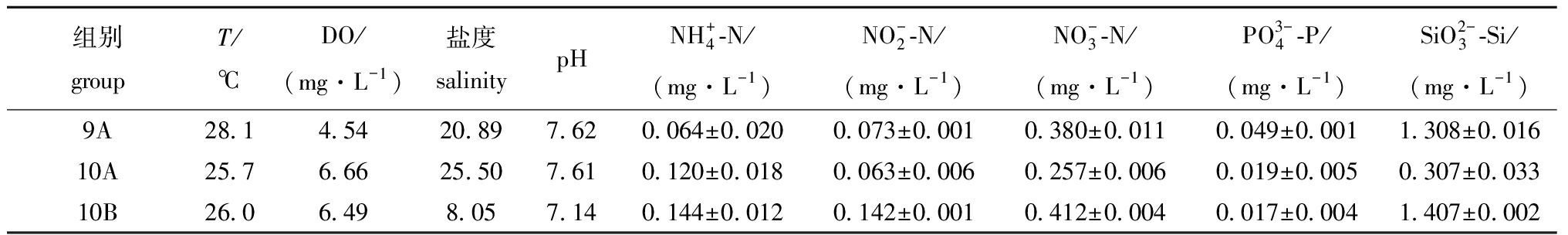
组别groupT/℃DO/(mg·L-1)盐度salinitypHNH+4-N/(mg·L-1)NO-2-N/(mg·L-1)NO-3-N/(mg·L-1)PO3-4-P/(mg·L-1)SiO2-3-Si/(mg·L-1)9A28.14.5420.897.620.064±0.0200.073±0.0010.380±0.0110.049±0.0011.308±0.01610A25.76.6625.507.610.120±0.0180.063±0.0060.257±0.0060.019±0.0050.307±0.03310B26.06.498.057.140.144±0.0120.142±0.0010.412±0.0040.017±0.0041.407±0.002
2.2 Chl-a浓度与浮游微藻变化
利用分光光度法分析各采样点水样中叶绿素a(Chl-a)浓度,发现10月份两处不同采样点的水质样品10A和10B的表层水中Chl-a浓度分别为2.795、2.673 μg/L,且二者间无显著性差异。但9月份A点采集的水样9A中Chl-a浓度为0.906 μg/L(P<0.05),显著低于10A和10B(表3)。进一步使用光学显微镜和血球计数板对浮游微藻,尤其是硅藻和甲藻进行种类鉴定和计数发现,9A水样中硅藻丰度为1.3×107 cells/L,优势种为中肋骨条藻(Skeletonema costatum);甲藻丰度为7.1×106 cells/L,优势种为海洋原甲藻(Prorocentrum micans)。10A和10B水样中的硅藻丰度分别约为4.3×105 cells/L和8.1×105 cells/L,优势种分别为角毛藻(Chaetoceros sp.)和中肋骨条藻,但未见明显优势甲藻(图1)。
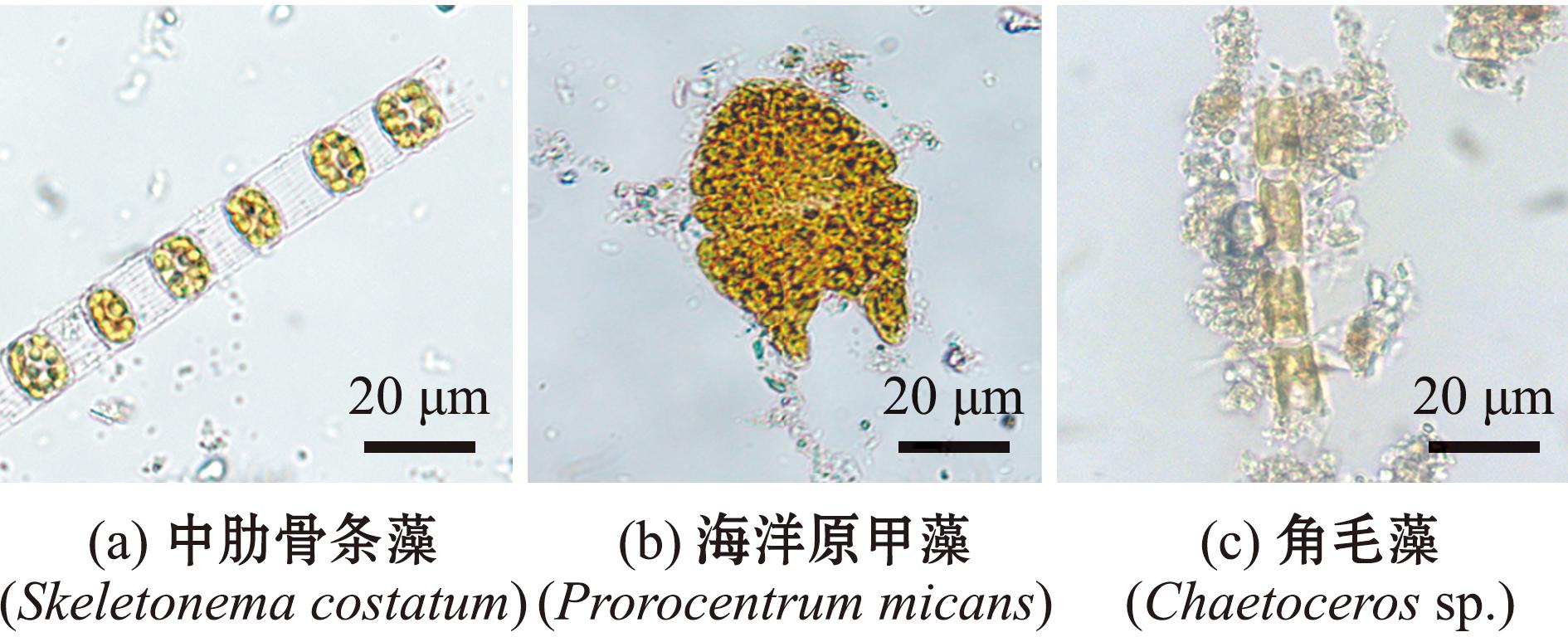
图1 表层水体中的饵料藻与甲藻鉴定
Fig.1 Identification of food algae and dinoflagellates in surface water column
表3 表层水体Chl-a浓度和浮游微藻丰度变化
Tab.3 Variation in Chl-a concentration and planktonic microalgae abundance in surface water column

组别groupChl-a/(μg·L-1)硅藻/(cells·L-1)diatom甲藻/(cells·L-1)dinoflagellate9A0.906±0.1961.3×1077.6×10610A2.795±0.5644.3×105未见10B2.673±0.2058.1×105未见
2.3 病原微生物变化
在相关试验中,通过对水体中浮游细菌丰度的分析发现(表4),9A组水体总细菌丰度为7.22×108 cells/L,显著高于10A(4.97×107 cells/L)和10B组(5.98×107 cells/L)水平(P<0.05),10A和10B组间无显著性差异(P>0.05)。9A组水体弧菌丰度为1.49×107 cells/L,显著高于10A(1.40×104 cells/L)和10B(2.90×103 cells/L)水平(P<0.05),10A和10B组间存在显著性差异。对香港牡蛎鳃组织中细菌丰度进行分析发现,9A鳃组织中总细菌丰度为5.61×107 cells/g,显著高于10A(2.35×107 cells/g)和10B组(8.72×106 cells/g)水平(P<0.05),且10A和10B组间存在显著性差异(P>0.05)。与此类似,9A组香港牡蛎鳃组织中弧菌丰度为2.60×105 cells/g,显著高于10A(3.16×104 cells/g)和10B组(4.20×104 cells/g)水平(P<0.05),10A和10B组间无显著性差异(P>0.05)。
表4 表层水体和香港牡蛎鳃中总细菌丰度和弧菌丰度的变化
Tab.4 Abundance variation in total bacteria and Vibrio in the surface water and the gill of Crassostrea hongkongensis

组别group海水总细菌丰度/(cells·L-1) total bacterial abundance in seawater海水弧菌丰度/(cells·L-1)Vibrio abundance in seawater鳃中总细菌丰度/(cells·g-1)total bacterial abundance in gill鳃中弧菌丰度/(cells·g-1)Vibrio abundance in gill9A(7.22±0.65)×108a(1.49±0.67)×107a(5.61±1.42)×107a(2.60±1.18)×105a10A(4.97±1.23)×107b(1.40±0.15)×104b(2.35±0.34)×107b(3.16±0.85)×104b10B(5.98±0.20)×107 b(2.90±0.26)×103c(8.72±1.63)×106c(4.20±2.33)×104b
注:标有不同字母者表示不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters are significant differences in different groups at the 0.05 probability level,and the means with the same letter are not significant differences.
2.4 闭壳肌糖原和葡萄糖含量变化
从表5可见,10A组香港牡蛎闭壳肌糖原含量为2.491 mg/g,在3组中处于最低水平,显著低于9A(6.175 mg/g)和10B组(5.027 mg/g)水平(P<0.05),9A和10B组间无显著性差异(P>0.05)。类似地,10A组香港牡蛎闭壳肌葡萄糖含量为1.938 μmol/g,在3组中处于最低水平,显著低于9A(2.587 μmol/g)和10B组(3.46 μmol/g)水平(P<0.05),且9A组闭壳肌葡萄糖含量显著低于10B组水平(P<0.05)。
表5 香港牡蛎闭壳肌中能量储备和鳃中氧化应激相关指标的变化
Tab.5 Variation of the parameters related to energy reserve in the adductor muscle and oxidative stress indices in gill of Crassostrea hongkongensis
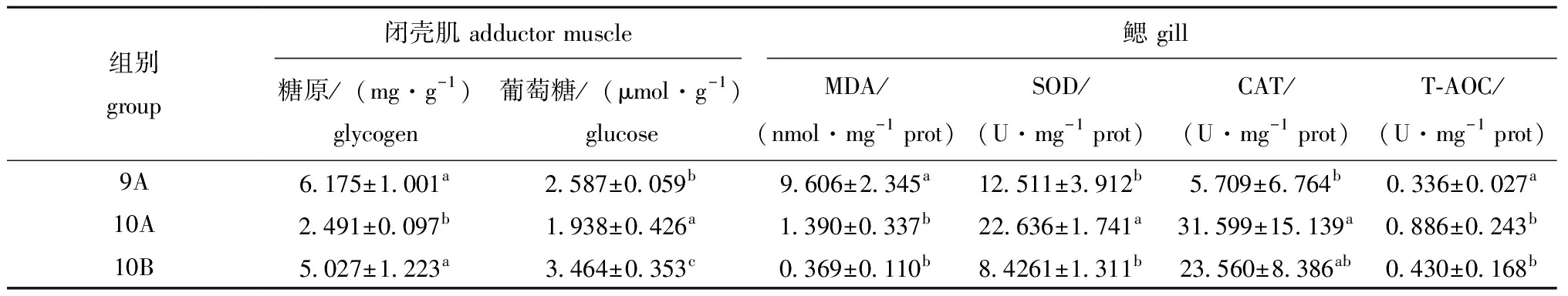
组别group闭壳肌 adductor muscle鳃 gill糖原/(mg·g-1) glycogen 葡萄糖/(μmol·g-1) glucoseMDA/(nmol·mg-1 prot)SOD/(U·mg-1 prot)CAT/(U·mg-1 prot)T-AOC/(U·mg-1 prot)9A6.175±1.001a2.587±0.059b9.606±2.345a12.511±3.912b5.709±6.764b0.336±0.027a10A2.491±0.097b1.938±0.426a1.390±0.337b22.636±1.741a31.599±15.139a0.886±0.243b10B5.027±1.223a3.464±0.353c0.369±0.110b8.4261±1.311b23.560±8.386ab0.430±0.168b
2.5 氧化应激相关指标的变化
从表5可见,9A组香港牡蛎鳃中MDA含量为9.606 nmol/mg prot,显著高于香港牡蛎10A组(1.390 nmol/mg prot)和10B组(0.369 nmol/mg prot)水平(P<0.05),10A和10B组间无显著性差异(P>0.05)。10A组香港牡蛎鳃中SOD酶和CAT酶活性及T-AOC能力均在3组中最高,分别为22.636 U/mg prot、31.599 U/mg prot和0.886 U/mg prot,显著高于9A和10B组水平,且9A和10B组间各指标无显著性差异(P>0.05)。
3 讨论
3.1 河口地区水质变化的季节特征
河口位于河海水交界处,丰富的地表径流会携带大量营养物质并形成较高的水体基础生产力,这有利于水产养殖生物的生长。因此在河口地区发展水产养殖产业往往能够取得较高的经济效益。但河口地带同样存在环境变化快的特点,盐度和温度的变化常常迅速且剧烈,这对水产养殖生物的健康形成了严峻的挑战。这种复杂的水质环境变化是导致养殖香港牡蛎出现大规模死亡的主要原因,特别是由于季节交替所导致的气候特征转变会进一步加剧温度和降水的变化,从而影响香港牡蛎的生理稳态并威胁其生长和生存。9—10月处于夏秋时节交替之际,对香港牡蛎容易造成环境胁迫。因此本试验选择在9—10月对广西北海大风江河口及上游水域的多项理化因子变化进行了调研检测,包括表层水体的温度、DO、盐度和营养盐等。结果发现,在时间上,9月和10月河口A点的水体理化因子存在明显的季节变化特征。首先,10月河口A点的表层水温相比9月出现下降,而水体DO浓度明显上升。这与前期的研究结果类似,水温升高常导致水体DO浓度下降,这在夏季高温期较为常见[17]。其次,由于秋季降水减少导致地表径流量的减少,10月河口A点的盐度相比9月有所上升,同时基于河水径流带来的藻类繁殖所需的营养盐水平出现下降。在空间上,B点处于A点上游,更加远离海岸,河水与海水的混合程度更低,导致B点盐度更低,而营养盐水平更高。但两地在温度和DO浓度方面的差异不大。本研究中基于以上结果构建了广西北海大风江牡蛎养殖水域时间和空间维度的环境变化特征,并进一步解析了环境胁迫对香港牡蛎能量储备和氧化应激的影响。
3.2 河口地区养殖香港牡蛎的健康状况
9月河口A点多项水质环境指标显示,香港牡蛎处于较为复杂的环境胁迫中。首先,9月河口A点水温较高,DO浓度较低。温度和DO浓度压力会导致牡蛎耗氧率和排氨率等代谢速率上升,加剧能量的消耗[18-19],但同时9月较高的水温促进了藻类的快速生长。研究发现,藻类丰度在合适的范围内会随温度上升呈指数增长[20]。并且9月丰富的降水和地表径流提高了水体中硅酸盐浓度,进一步有利于饵料藻的繁殖,促使9月A点水体的藻类丰度在3组中均处于最高水平。丰富的饵料在一定程度上维持了牡蛎闭壳肌中糖原和葡萄糖的含量,保障了环境胁迫下能量消耗的增加。同时,9月较高的水温导致细菌的大量繁殖,已有研究发现,海水中微生物数量与温度呈现明显的正相关[21],且海水中弧菌丰度随夏季水温上升明显增加[22]。本研究中,9月A点海水中细菌和弧菌丰度在3组中最高,同时由于牡蛎的滤食特性,9月A点牡蛎鳃中的细菌和弧菌丰度在3组中也处于最高水平。弧菌对于牡蛎而言是重要的条件致病菌,会导致香港牡蛎的大规模死亡。因此,9月河口水域的香港牡蛎可能同时遭受来自生物和非生物的胁迫。环境和病原胁迫常引发机体出现氧化应激,其相关指标能够有效反映机体的抗氧化能力和应激状态。MDA是脂质过氧化的反应终产物,其含量可反映机体的氧化应激状态,并间接反映细胞的受损伤程度[23]。9月A点香港牡蛎鳃中MDA含量在3组中最高,这种较为严重的氧化应激状态与该时期牡蛎处于复杂胁迫的推论相符。SOD和CAT活性,以及T-AOC能力能够反映机体的抗氧化水平,对减轻氧化应激起着重要的作用,但超过生物承受能力的环境胁迫会影响抗氧化水平[24]。9月A点牡蛎鳃中SOD和CAT活性,以及T-AOC能力处于较低水平,进一步说明9月河口水域养殖牡蛎处于较为严重的胁迫状态。因此,9月河口水域环境对养殖香港牡蛎形成了复杂的生物和非生物胁迫,并导致其处于较为严重的氧化应激状态,健康水平较低。
10月河口A点水质环境指标有所改善,香港牡蛎氧化应激状态减弱,但可能会受到新的环境胁迫影响。10月河口水环境与9月相比,水温下降,DO浓度上升,水体细菌丰度和种群结构发生变化,牡蛎鳃中的细菌和弧菌丰度下降。以上生物和非生物胁迫的降低减轻了牡蛎的氧化应激状态,促使10月A点牡蛎鳃中MDA含量明显下降。然而,夏秋季节交替带来了新的环境胁迫问题。首先,10月降水和径流减少导致盐度上升形成高盐胁迫。研究认为,香港牡蛎具有较广的盐度适应性,但其对低盐的适应性要强于高盐环境,最适盐度为13~20。高盐环境会诱导香港牡蛎激活抗氧化系统抵抗氧化损伤[13]。在10月A点牡蛎鳃组织中,SOD和CAT活性,以及T-AOC能力均较9月A点上升,说明牡蛎仍然处于环境胁迫导致的氧化应激状态,但程度较9月有所下降。其次,降水和径流的减少降低了对水体中营养盐的补充,温度降低也会影响饵料藻类的生长与繁殖速度。这导致10月A点水体中硅藻丰度大幅下降,限制了牡蛎的能量来源。除了饵料藻丰度下降对能量来源的影响外,为抵抗盐度胁迫带来的氧化损伤,抗氧化系统的维持也会消耗大量能量。这导致闭壳肌中糖原和葡萄糖的大量消耗,最终造成10月A点香港牡蛎糖原储存水平明显下降。糖原作为动物能量储存的主要形式之一,其含量被认为与牡蛎抵抗环境胁迫的能力相关。因此,10月河口水域养殖香港牡蛎主要面临高盐度的胁迫,虽然胁迫程度较9月有所降低,但饵料藻缺乏使得其抵抗胁迫的能力有所减弱。
10月河口上游B点水域环境最大的特征在于盐度较低,与同期A点相比差异较大。同时,营养盐浓度和饵料藻丰度较高,使得10月上游B点牡蛎处于较好的健康状态。研究发现,与高盐度相比,低盐度水环境中的香港牡蛎具有更高的生长速度和存活率[3]。这与高盐度下香港牡蛎需要更多的能量维持渗透压平衡有关。通过核磁共振的代谢组学发现,高盐度环境中的香港牡蛎会出现能量饥饿,而随着盐度的降低,牡蛎则能够积累更多的能量相关化合物[13]。牛磺酸、丙氨酸、甘氨酸和脯氨酸等游离氨基酸对于香港牡蛎维持渗透压具有重要作用,其含量随盐度变化产生显著变化[25]。而在高盐度下增加这些游离氨基酸的含量则需要一系列的代谢活动,这会加剧对体内能量的消耗。因此,香港牡蛎在低盐度环境下,指示代谢强度的耗氧率和排氨率均有所下降[26]。研究发现,弧菌作为香港牡蛎主要的条件性致病菌,其最佳生长的盐度为20~35[27]。而本研究中10月河口上游B点水域的盐度远小于此范围,因此,水体中弧菌数量显著低于同时期A点,与已有研究相符。这也减轻了该点香港牡蛎的免疫压力,进一步降低了对能量的消耗。同时B点相较A点位于河口上游,营养盐浓度受海水稀释程度小,在相同的温度条件下拥有更高的硅藻丰度,且研究发现B点优势藻种骨条藻的营养水平要高于A点优势藻种角毛藻[28]。因此,10月河口上游B点牡蛎在较低能量消耗水平和更多优质饵料来源的双重因素作用下,其闭壳肌中糖原和葡萄糖含量显著高于同时期A点牡蛎。能量储存和代谢水平与牡蛎的环境胁迫抗性密切相关,能量储存不足等因素易造成牡蛎抗胁迫能力减弱,导致损伤或死亡[29]。所以,相较A点牡蛎更高的糖原含量也使得B点牡蛎能够更有效地抵抗氧化损伤并处于较低的氧化应激状态。因此,10月上游B点水域养殖香港牡蛎与同期A点相比,具有更加健康的生理状态。
综上所述,大风江河口水域养殖香港牡蛎在9月面临着高温、高细菌和弧菌丰度等多重环境压力,呈现出较高的氧化应激状态;相同水域的香港牡蛎在10月主要面临高盐度的单一环境压力,健康状态有所改善,但饵料藻类丰度的降低导致其糖原含量下降,应对环境变化的抵抗力较弱;而10月大风江上游水域盐度低、饵料藻丰度高,养殖香港牡蛎处于相对较为健康的状态。本研究结果有助于进一步了解盐度、浮游微藻和细菌群落结构等水域环境变化对养殖香港牡蛎健康状况的影响,可为预防香港牡蛎的大规模死亡发生提供理论依据和参考。
4 结论
1)由9月进入10月,大风江河口水域温度和细菌丰度下降,溶氧和盐度上升,养殖香港牡蛎健康水平有所提高。
2)大风江河口上游水域在10月因具有较低的盐度和弧菌丰度、较高的饵料藻水平,使得该水域养殖香港牡蛎的健康水平高于同时期河口水域。
3)季节交替引起的气候变化容易影响河口水域水质,易造成养殖香港牡蛎的胁迫,故应注意加强该时间段的养殖管理。
[1] ZHANG Y H,SU J Q,LI J,et al.Survival and growth of reciprocal crosses between two stocks of the Hong Kong oyster Crassostrea hongkongensis (Lam &Morton,2003) in Southern China[J].Aquaculture Research,2017,48(5):2344-2354.
[2] IBRAHIM S,YANG C Y,YUE C Y,et al.Whole transcriptome analysis reveals the global molecular responses of mRNAs,lncRNAs,miRNAs,circRNAs,and their ceRNA networks to salinity stress in Hong Kong oysters,Crassostrea hongkongensis[J].Marine Biotechnology,2023,25(4):624-641.
[3] ZHANG Z Y,LI A,SHE Z C,et al.Adaptive divergence and underlying mechanisms in response to salinity gradients between two Crassostrea oysters revealed by phenotypic and transcriptomic analyses[J].Evolutionary Applications,2022,16(2):234-249.
[4] 於锋.广西茅尾海香港巨牡蛎(Crassostrea hongkongensi)遗传结构及其性腺发育研究[D].海口:海南大学,2016.
YU F.Studies on the population genetic structure and gonad development of the oyster (Crassostrea hongkongensis) in Maowei Sea,Guangxi,China[D].Haikou:Hainan University,2016.(in Chinese)
[5] HUO Z M,WANG Z P,LIANG J,et al.Effects of salinity on embryonic development,survival,and growth of Crassostrea hongkongensis[J].Journal of Ocean University of China,2014,13(4):666-670.
[6] KASIM M,MUKAI H.Contribution of benthic and epiphytic diatoms to clam and oyster production in the Akkeshi-ko Estuary[J].Journal of Oceanography,2006,62(3):267-281.
[7] CLERISSI C,DE LORGERIL J,PETTON B,et al.Microbiota composition and evenness predict survival rate of oysters confronted to Pacific oyster mortality syndrome[J].Frontiers in Microbiology,2020,11:311.
[8] BERNHARD A E,DONN T,GIBLIN A E,et al.Loss of diversity of ammonia-oxidizing bacteria correlates with increasing salinity in an estuary system[J].Environmental Microbiology,2005,7(9):1289-1297.
[9] 霍恩泽,张雯雯,李加琦,等.盐度骤降对近江牡蛎和长牡蛎能量收支的影响[J].渔业科学进展,2021,42(2):132-138.
HUO E Z,ZHANG W W,LI J Q,et al.Effects of acute salinity changes on energy budgets of oysters Crassostrea ariakensis and Crassostrea gigas[J].Progress in Fishery Sciences,2021,42(2):132-138.(in Chinese)
[10] YANG C Y,SIERP M T,ABBOTT C A,et al.Responses to thermal and salinity stress in wild and farmed Pacific oysters Crassostrea gigas[J].Comparative Biochemistry and Physiology Part A,Molecular &Integrative Physiology,2016,201:22-29.
[11] EPIFANIO C E,EWART J.Maximum ration of four algal diets for the oyster Crassostrea virginica Gmelin[J].Aquaculture,1977,11(1):13-29.
[12] RAHMAN M S,RAHMAN M S.Effects of elevated temperature on prooxidant-antioxidant homeostasis and redox status in the American oyster:signaling pathways of cellular apoptosis during heat stress[J].Environmental Research,2021,196:110428.
[13] XIE Z,SHI J H,SHI Y T,et al.Physiological responses to salinity change and diel-cycling hypoxia in gills of Hong Kong oyster Crassostrea hongkongensis[J].Aquaculture,2023,570:739443.
[14] MAO F,LIU K N,WONG N K,et al.Virulence of Vibrio alginolyticus accentuates apoptosis and immune rigor in the oyster Crassostrea hongkongensis[J].Frontiers in Immunology,2021,12:746017.
[15] XING Z,GAO L,LIU R Y,et al.The oxidative stress of the Pacific oyster Crassostrea gigas under high-temperature stress[J].Aquaculture,2023,577:739998.
[16] LORENZEN C J.Determination of chlorophyll and pheo-pigments:spectrophotometric equations1[J].Limnology and Oceanography,1967,12(2):343-346.
[17] 廉伟,温海深,毛玉泽,等.长牡蛎夏季死亡与养殖环境及自身体质关系的初步研究[J].渔业科学进展,2010,31(4):92-100.
LIAN W,WEN H S,MAO Y Z,et al.Study on the relationship between Pacific oyster Crassotrea gigas summer mortality with culture environment and organism condition[J].Progress in Fishery Sciences,2010,31(4):92-100.(in Chinese)
[18] 廖文崇,朱长波,张汉华,等.水温对香港巨牡蛎摄食和代谢的影响[J].广东农业科学,2011,38(1):7-11.
LIAO W C,ZHU C B,ZHANG H H,et al.Effect of water temperature on the feeding and metabolic physiology of Crassostrea hongkongensis[J].Guangdong Agricultural Sciences,2011,38(1):7-11.(in Chinese)
[19] 马元,张兴志,何苹萍,等.低氧胁迫对香港牡蛎摄食和代谢的影响[J].广东海洋大学学报,2022,42(3):127-133.
MA Y,ZHANG X Z,HE P P,et al.Effects of hypoxia stress on ingestion and metabolism of Crassostrea hongkongensis[J].Journal of Guangdong Ocean University,2022,42(3):127-133.(in Chinese)
[20] 王志宝,赵奎峰,梁黎明,等.温度、盐度和硅酸钠浓度对中肋骨条藻生长的影响[J].烟台大学学报(自然科学与工程版),2018,31(3):275-282.
WANG Z B,ZHAO K F,LIANG L M,et al.Effects of temperature,salinity and silicate density on growth of Skeletonema costatum[J].Journal of Yantai University (Natural Science and Engineering Edition),2018,31(3):275-282.(in Chinese)
[21] 林雪洁,高磊,于子超,等.一株虾夷扇贝病原:科氏希瓦氏菌的分离鉴定及其致病性[J].大连海洋大学学报,2022,37(6):933-940.
LIN X J,GAO L,YU Z C,et al.Isolation,identification and pathogenicity of Shewanella colwelliana,a pathogen of Yesso scallop Patinopecten yessoensis[J].Journal of Dalian Ocean University,2022,37(6):933-940.(in Chinese)
[22] GAO L,YU Z C,LIU C,et al.Characteristics and particularities of bacterial community variation in the offshore shellfish farming waters of the North Yellow Sea[J].Frontiers in Marine Science,2022,9:997817.
[23] 王佳雯,卢洁,姚托,等.环境因子和免疫刺激对香港牡蛎免疫指标的影响[J].南方水产科学,2021,17(4):18-26.
WANG J W,LU J,YAO T,et al.Effects of environmental factors and external stimulus on immune indexes of Crassostrea hongkongensis[J].South China Fisheries Science,2021,17(4):18-26.(in Chinese)
[24] 胡益鸣,李琪,刘士凯,等.温度和盐度急性胁迫对岩牡蛎存活及免疫指标的影响[J].中国水产科学,2020,27(3):286-294.
HU Y M,LI Q,LIU S K,et al.Effects of acute temperature and salinity stress on the survival and immune indexes of Iwagaki oysters,Crassostrea nippona[J].Journal of Fishery Sciences of China,2020,27(3):286-294.(in Chinese)
[25] CAO C,WANG W X.Copper-induced metabolic variation of oysters overwhelmed by salinity effects[J].Chemosphere,2017,174:331-341.
[26] SONG X Y,LÜ W G,IBRAHIM S,et al.Identification of free amino acids (FAA) that are important as major intracellular osmolytes in the estuarine Hong Kong oyster,Crassostrea hongkongensis[J].Aquaculture Reports,2023,28:101464.
[27] VEZZULLI L,PEZZATI E,STAUDER M,et al.Aquatic ecology of the oyster pathogens Vibrio splendidus and Vibrio aestuarianus[J].Environmental Microbiology,2015,17(4):1065-1080.
[28] 曹淑莉,向葆卿.8种海洋饵料微藻蛋白质含量及氨基酸组成比例的比较研究[J].海洋学报,1993,15(4):98-103.
CAO S L,XIANG B Q.Comparative study on protein content and amino acid composition ratio of eight kinds of marine bait microalgae[J].Acta Oceanologica Sinica,1993,15(4):98-103.(in Chinese)
[29] ZHANG H,WANG H,CHEN H,et al.The transcriptional response of the Pacific oyster Crassostrea gigas under simultaneous bacterial and heat stresses[J].Developmental and Comparative Immunology,2019,94:1-10.