枪乌贼科(Loliginidae)隶属于软体动物门(Mollusca)头足纲(Cephalopoda)鞘亚纲(Coleoidea)枪形目(Teuthoidea)闭眼亚目(Myopsida)[1],广泛分布于近岸海洋生态系统中[1-2],是世界沿海地区重要的渔业资源之一,也是世界头足类主要开发对象之一[1-3]。根据联合国粮农组织(Food and Agriculture Organization,FAO)统计数据(图1)[3-4],1986—2020年,枪乌贼科物种的产量年间波动较大,年产量维持在15~20万t,其中,巴塔哥尼亚枪乌贼(D.gahi)、乳光枪乌贼(D.opalescens)和皮氏枪乌贼(D.pealeii)的累计产量占枪乌贼科物种总产量的80%以上[3]。其中,巴塔哥尼亚枪乌贼是西南大西洋拖网渔业的重要捕捞对象之一,主要作业渔场在马尔维纳斯群岛(福克兰群岛)的南部和东部海域,年产量维持在7.3万t(2016—2020年)[3,5];乳光枪乌贼是加利福尼亚中部和南部沿岸生态系统中上层群落的关键物种[6];皮氏枪乌贼是美国东部大陆架水域重要的鱿鱼渔业,作业渔场主要集中在中部水域[7]。因此,枪乌贼科物种是沿岸生态系统的重要优势种之一。

图1 1950—2020年全球重要经济型枪乌贼科物种的产量(FAO,2020)
Fig.1 Annual catch of globally economically important Loliginidae species from 1950 to 2020 (FAO,2020)
近岸海洋生态系统主要由不同属性的水团组成,且其物理特性受季节性季风影响明显,其中主要包括区域暖流、沿岸流、涡流,以及由地形引起的上升流等海流系统[8]。通常,季风、区域主流是影响水团变化的动力学因素,海表面热通量和淡水流量则是影响水团温度和盐度特性变化的重要热力学因素[9]。海洋浮游生物的分布与区域流系的理化特征密切相关[10],而区域初级生产力则影响枪乌贼科物种早期的生长与分布[11],并且受近岸捕捞强度和环境因素变化的影响明显[9,12]。枪乌贼科物种分布范围较广,种群结构复杂,世代更新较快,新陈代谢率较高,灵活性和可塑性生活史特征使其在近岸生物群落中能够快速繁衍,而这主要与其生理机能对环境因素的高度敏感性密不可分[2,11]。此外,枪乌贼科物种处于中间营养级,在生态食物网中起到承上启下的作用[13-14]。虽然近些年来,近岸生态系统因高渔业压力和气候变化而衰退,但枪乌贼科物种往往能够适应不断变化的环境,并可能因其灵活的生活史策略而成为区域优势种[9]。在全球变暖趋势下,快速的生长速率、加速的生活史和种群的快速更替可能会导致枪乌贼科种群扩张[15]。作为具有高可塑性生长和高洄游性的短生命周期物种,它们比许多其他近岸物种更能适应环境平衡的变化[16]。
本文中,选取全球十种典型沿岸枪乌贼科物种作为分析对象[5-7,16-27](表1),整理这些物种在种群结构、洄游、生长、繁殖和摄食等方面的共性特征,并同时归纳环境因素对共性生物特征的影响及差异,以期为掌握这一科属头足类的生活史特征和中国近海枪乌贼科物种的研究提供科学参考。
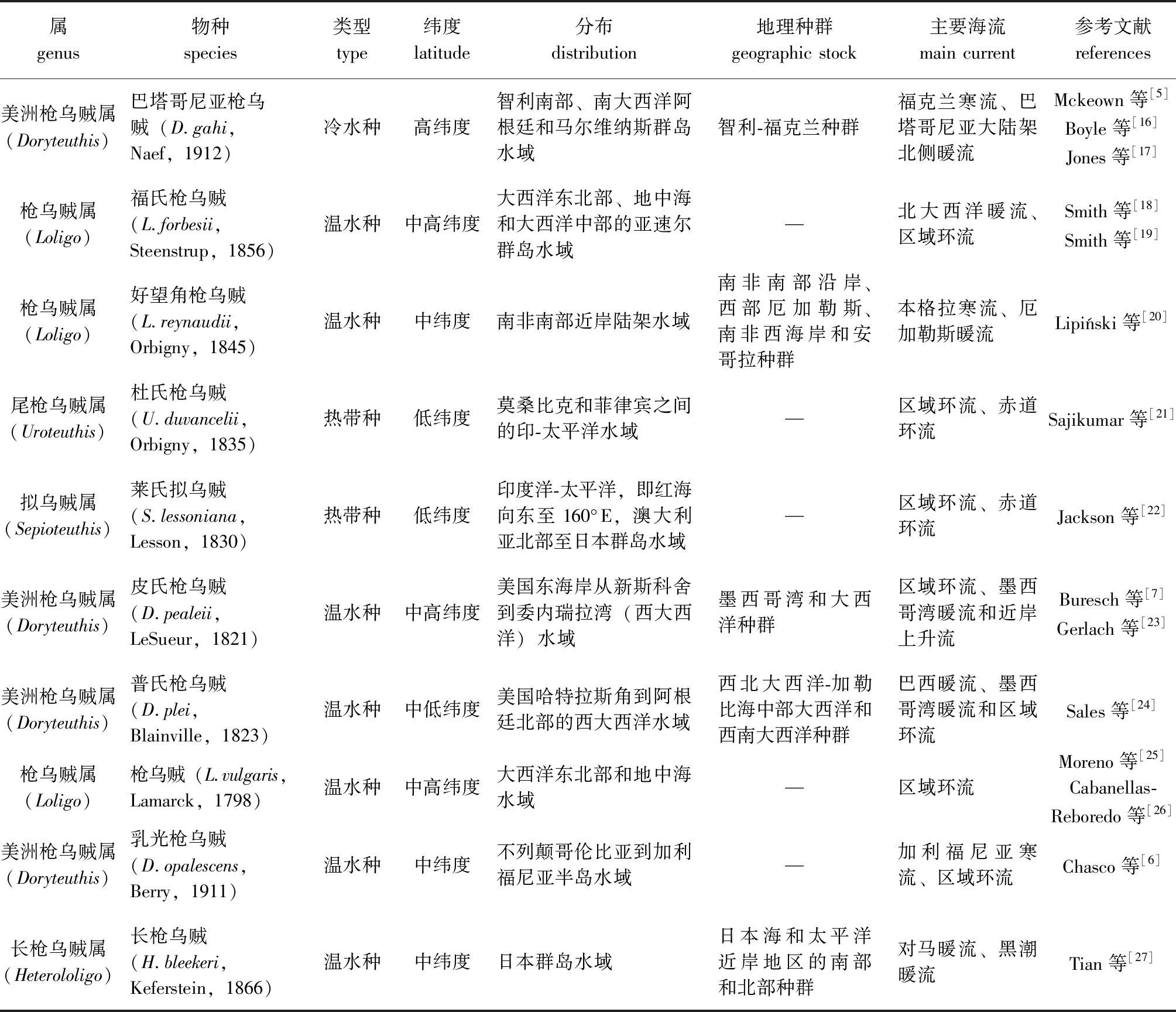
表1 全球重要经济型枪乌贼科物种的分布信息
Tab.1 Distribution information of globally economically important Loliginidae species
注:—表示不明确,下同。
Note:— means unclear,et sequentia.
属genus物种species类型type纬度latitude分布distribution地理种群geographic stock主要海流main current参考文献references美洲枪乌贼属(Doryteuthis)巴塔哥尼亚枪乌贼(D.gahi,Naef,1912)冷水种高纬度智利南部、南大西洋阿根廷和马尔维纳斯群岛水域智利-福克兰种群福克兰寒流、巴塔哥尼亚大陆架北侧暖流Mckeown等[5]Boyle等[16]Jones等[17]枪乌贼属(Loligo)福氏枪乌贼(L.forbesii,Steenstrup,1856)温水种中高纬度大西洋东北部、地中海和大西洋中部的亚速尔群岛水域—北大西洋暖流、区域环流Smith等[18]Smith等[19]枪乌贼属(Loligo) 好望角枪乌贼(L.reynaudii,Orbigny,1845)温水种中纬度南非南部近岸陆架水域南非南部沿岸、西部厄加勒斯、南非西海岸和安哥拉种群本格拉寒流、厄加勒斯暖流Lipiński等[20]尾枪乌贼属(Uroteuthis)杜氏枪乌贼(U.duvancelii,Orbigny,1835)热带种低纬度莫桑比克和菲律宾之间的印-太平洋水域—区域环流、赤道环流Sajikumar等[21]拟乌贼属(Sepioteuthis)莱氏拟乌贼(S.lessoniana,Lesson,1830)热带种低纬度印度洋-太平洋,即红海向东至 160°E,澳大利亚北部至日本群岛水域—区域环流、赤道环流Jackson等[22]美洲枪乌贼属(Doryteuthis)皮氏枪乌贼(D.pealeii,LeSueur,1821)温水种中高纬度美国东海岸从新斯科舍到委内瑞拉湾(西大西洋)水域墨西哥湾和大西洋种群区域环流、墨西哥湾暖流和近岸上升流Buresch等[7]Gerlach等[23]美洲枪乌贼属(Doryteuthis)普氏枪乌贼(D.plei,Blainville,1823)温水种中低纬度美国哈特拉斯角到阿根廷北部的西大西洋水域西北大西洋-加勒比海中部大西洋和西南大西洋种群巴西暖流、墨西哥湾暖流和区域环流Sales等[24]枪乌贼属(Loligo)枪乌贼(L.vulgaris,Lamarck,1798)温水种中高纬度大西洋东北部和地中海水域—区域环流Moreno等[25]Cabanellas-Reboredo等[26]美洲枪乌贼属(Doryteuthis)乳光枪乌贼(D.opalescens,Berry,1911)温水种中纬度不列颠哥伦比亚到加利福尼亚半岛水域—加利福尼亚寒流、区域环流Chasco等[6]长枪乌贼属(Heterololigo)长枪乌贼(H.bleekeri,Keferstein,1866)温水种中纬度日本群岛水域日本海和太平洋近岸地区的南部和北部种群对马暖流、黑潮暖流Tian等[27]
1 种群结构及洄游分布
1.1 种群结构特征
枪乌贼科物种分布范围较广,且在近岸生态系统中具有较多的栖息场所,而各栖息地之间生物和非生物因素的差异影响种群结构[2]。在特定地理区域内,不同地理种群间的遗传信息具有同质性,种群之间不存在遗传分化,但其生活史特征存在差异,这表明近岸枪乌贼科物种具有较高水平的基因流动性。如南非南部近岸的好望角枪乌贼存在3个地理种群,其种群间形态的差异源于浮游幼体不同的栖息环境,表明这3个地理种群间遗传信息无差异[18]。此外,墨西哥湾和美国东部近岸的皮氏枪乌贼地理种群需要进行长距离的地理洄游以保持遗传信息的多样性[7]。因此,近岸枪乌贼科物种中,地理种群间不存在遗传信息的分化[28]。
1.2 洄游特征
近岸枪乌贼科物种表现出近岸-大陆架(陡坡)-近岸的洄游模式,并且在浅海近岸进行产卵和育肥,随后进入较深的大陆架(陡坡)进行索饵[2,11]。通常,孵化后的雌、雄个体分开洄游,雌性比雄性洄游至更深海域摄食,当雄性初次性成熟后,雌、雄个体会在浅水索饵区域进行初次交配,随后共同洄游到近岸产卵场进行繁殖活动[29]。在近岸海洋环境中,枪乌贼科物种的洄游路线与近岸地貌、岛礁分布、水团属性和初级生产力密切相关,其中,水团流系的温度和盐度是触发个体开始洄游的关键因素,叶绿素浓度影响浮游幼体在育肥场的分布,并且不同海流的方向和强度受季风影响显著,这些因素可能导致不同种群洄游分布和生活史特征存在差异[8-9]。此外,浮游幼体密度(浮力)和个体垂直移动也会影响个体早期在育肥场的停留时间和洄游范围[2]。如南非南部近岸生态系统中,厄加勒斯暖流的季节和年间动态变化会直接影响好望角枪乌贼在索饵场的停留时间和空间位置,并且中部上升流所携带营养物质的分布也会影响浮游幼体的分布和成活率[30]。基于复杂的近岸海洋环境及水文特征等多方面的因素,导致近岸枪乌贼科物种的种群结构组成复杂,大多数物种种群间的洄游路线仍不明确[2,30]。
1.3 洄游特性与环境因素的关系
在全球变暖和海洋酸化的长期影响下,近岸枪乌贼科物种的栖息地存在缩小的风险,浮游幼体的生境逐渐趋于向栖息海域的高纬度进行扩张,这会潜在地改变当地生态系统内物种之间营养的相互作用[6,31]。此外,浮游幼体体型的缩小会影响个体的洄游距离,并导致早期幼体生长和摄食环境的变化,进而影响整个种群的生长和补充量[11]。因此,在全球气候变化背景下,近岸枪乌贼科物种浮游幼体的分布变动影响其种群结构[2,31]。
2 年龄与生长
2.1 早期生长发育
头足类早期生长发育会影响整个种群结构、资源补充量及渔获量,是决定个体生存率的关键生活史阶段[2,32-33]。枪乌贼科物种的胚胎发育期一般为1~3个月[21,33-41](表2),此时胚胎仍附着在产卵场底部[2]。在胚胎发育过程中,内部的营养来源和代谢过程均依赖于卵黄囊,其中,外部卵黄囊在孵化前耗尽,内部卵黄囊在孵化后维持短期营养供应[36]。此外,非生物因素(温度等)影响卵黄摄取率和使用率之间的平衡机制,影响孵化后幼体的生物特征[37]。枪乌贼科物种的胚胎发育时间主要取决于卵的大小和环境温度,且卵鞘远端卵的发育速度比基端卵快(2~4 d)[32]。通常,胚胎发育时间与卵的大小呈正相关,而与环境水温呈负相关[37-38]。如中高纬度冷水种(巴塔哥尼亚枪乌贼等)与栖息在低纬度的热带暖温水种相比(莱氏拟乌贼等),胚胎发育时间较长,孵化出的幼体较大,这有利于提高幼体对不利生存环境的抵抗能力,并降低了个体受到捕食的风险[34]。在同一枪乌贼科不同种群内,冷水期孵化的幼体体型一般大于暖水期,并且孵化时间也较长[40]。因此,卵黄囊的属性与功能,以及温度等环境因素均会对胚胎发育时间和幼体大小产生影响。
表2 全球重要经济型枪乌贼科物种的胚胎发育信息
Tab.2 Embryonic development information of globally economically important Loliginidae species
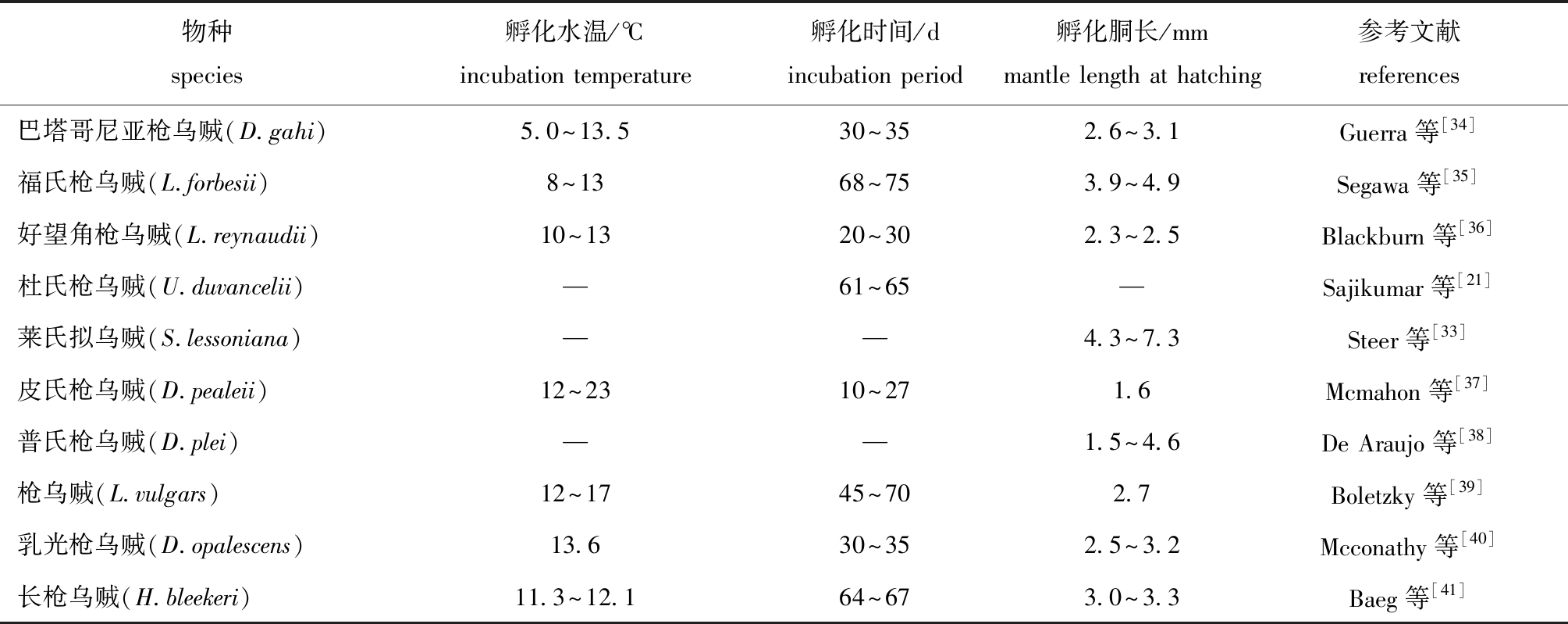
物种species孵化水温/℃incubation temperature孵化时间/dincubation period孵化胴长/mmmantle length at hatching参考文献references巴塔哥尼亚枪乌贼(D.gahi)5.0~13.530~352.6~3.1Guerra等[34]福氏枪乌贼(L.forbesii)8~1368~753.9~4.9Segawa等[35]好望角枪乌贼(L.reynaudii)10~1320~302.3~2.5Blackburn等[36]杜氏枪乌贼(U.duvancelii)—61~65—Sajikumar等[21]莱氏拟乌贼(S.lessoniana)——4.3~7.3Steer等[33]皮氏枪乌贼(D.pealeii)12~2310~271.6Mcmahon等[37]普氏枪乌贼(D.plei)——1.5~4.6De Araujo等[38]枪乌贼(L.vulgars)12~1745~702.7Boletzky等[39]乳光枪乌贼(D.opalescens)13.630~352.5~3.2Mcconathy等[40]长枪乌贼(H.bleekeri)11.3~12.164~673.0~3.3Baeg等[41]
孵化后的枪乌贼科物种进入浮游幼体阶段,并且随海流进行移动[11]。在浮游幼体生长阶段,生长很大程度上依赖于从内源性(内卵黄)到完全外源性(摄食)的关键过渡[2]。浮游幼体将经历一段“零净生长期”,此时内卵黄主要维持个体代谢过程,并未转化为体细胞等组织生长,而这段时期的长短取决于内卵黄的利用率[35-39]。当内卵黄耗尽,浮游幼体通过摄食恢复到原来孵化体质量时,即开始指数生长期[33-34,36]。因此,在枪乌贼科物种生活史早期阶段,浮游幼体需要获得足够的饵料,以克服内卵黄利用期内营养不足的困难。
2.2 生命周期及生长特征
1)生命周期。在整个生活史阶段,枪乌贼科物种栖息在较高纬度的冷温性物种生命周期最长约为18个月,处于中纬度的暖温性物种生命周期约为12个月,而栖息在低纬度的热带和亚热带物种生命周期约为6个月,且生活周期较长的物种渐近胴长较大,这与生活史早期阶段栖息环境的异质性和食物可获性有关(表3)[42]。枪乌贼科物种的生长经历了缓慢且被动的浮游幼体漂浮阶段、快速且主动的幼-成体生长阶段及缓慢的渐近生长阶段[11]。在福氏枪乌贼生活史早期阶段,海水温度和食物来源对生长影响显著,低温延缓了其生长与成熟的速度,食物短缺加剧了其被捕食风险,这使得冷水种需孵化出较大的幼体以降低死亡率[43]。在枪乌贼科物种生活史早期阶段,幼体的大小决定了个体补充过程中的体型,体型较大的幼体可以比体型较小的幼体更快摆脱生长脆弱窗口期,而母体效应、温度和卵鞘内微环境等环境效应将共同作用于幼体生长,并影响成体生长和年龄[2,44]。如莱氏拟乌贼的生长表现出:在赤道水域生活时,寿命短,体型小;而在亚热带水域生活时,寿命长,体型大[22]。此外,巴塔哥尼亚枪乌贼物种体质量(W)与胴长(L)关系(W=aLb)中的b值均小于3(表3),表明种群为负异速生长,这可能与个体生长过程中栖息环境要素的尺度变化及饵料丰度有关[28]。因此,枪乌贼科物种生活史早期阶段的幼体效应将决定个体的渐近生长。
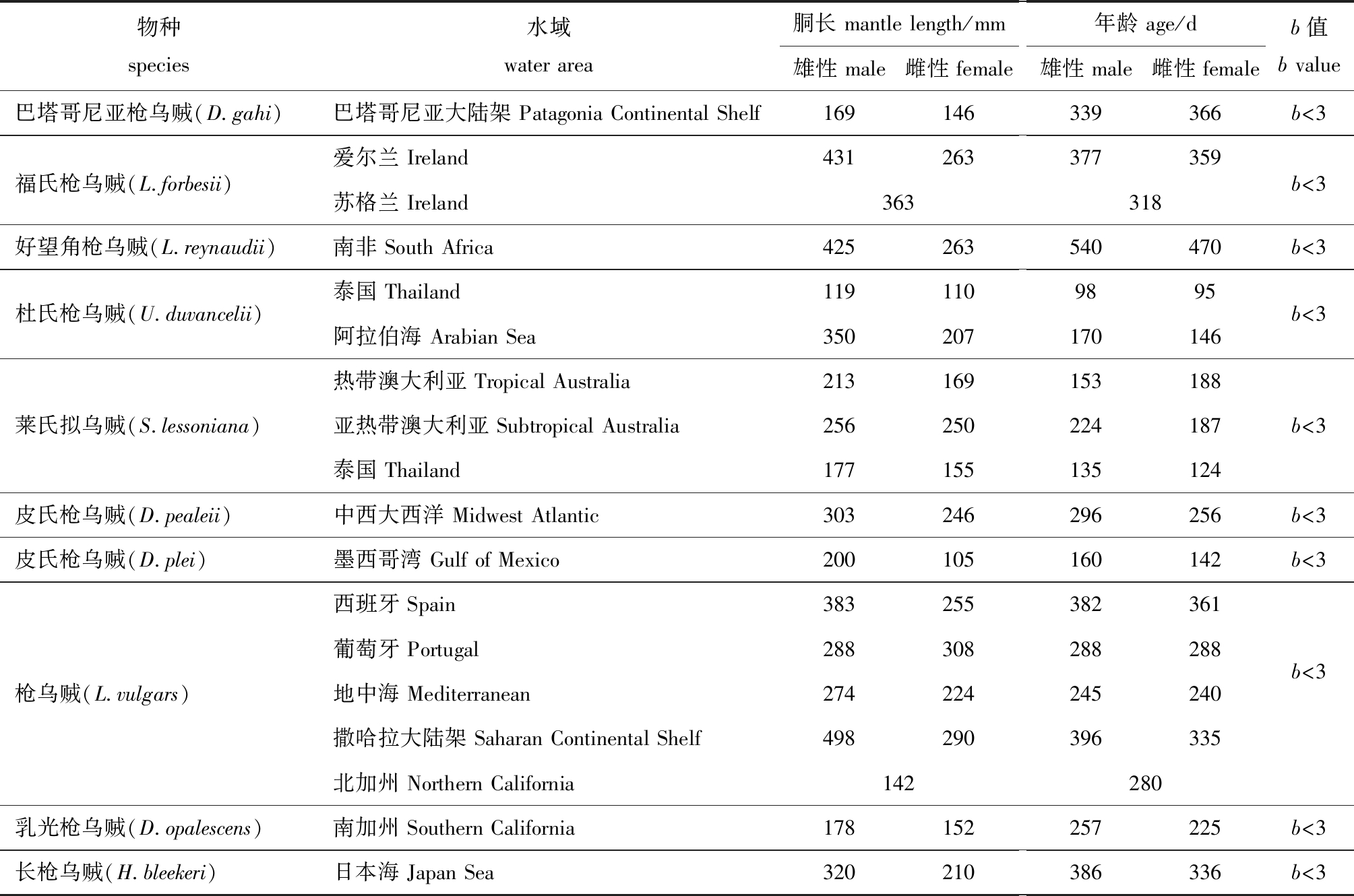
表3 全球重要经济型枪乌贼科物种的年龄和生长信息[42]
Tab.3 Age and growth information of globally economically important Loliginidae species[42]
注:表格中数值参考Jackson[42],为极大值。
Note:The values in the table refer to Jackson[42],which are maximum values.
物种species水域water area胴长 mantle length/mm雄性 male雌性 female年龄 age/d雄性 male雌性 femaleb值b value巴塔哥尼亚枪乌贼(D.gahi)巴塔哥尼亚大陆架 Patagonia Continental Shelf169 146339 366b<3福氏枪乌贼(L.forbesii)爱尔兰 Ireland431 263377 359b<3苏格兰 Ireland363318好望角枪乌贼(L.reynaudii)南非 South Africa425 263540 470b<3杜氏枪乌贼(U.duvancelii)泰国 Thailand阿拉伯海 Arabian Sea119 350110 20798 17095146b<3莱氏拟乌贼(S.lessoniana)热带澳大利亚 Tropical Australia亚热带澳大利亚 Subtropical Australia泰国 Thailand213256 177169 250155 153 224 135188187 124b<3皮氏枪乌贼(D.pealeii)中西大西洋 Midwest Atlantic303 246296 256b<3皮氏枪乌贼(D.plei)墨西哥湾 Gulf of Mexico200 105160 142b<3枪乌贼(L.vulgars)西班牙 Spain葡萄牙 Portugal地中海 Mediterranean撒哈拉大陆架 Saharan Continental Shelf383 288274498 255 308224 290382288 245 396361 288240 335b<3北加州 Northern California142280乳光枪乌贼(D.opalescens)南加州 Southern California178 152257 225b<3长枪乌贼(H.bleekeri)日本海 Japan Sea320 210386 336b<3
2)生长特征。枪乌贼科物种的繁殖产卵期较长,全年产卵孵化,这使得种群存在季节产卵群体,从而也提高了种群补充的成功率[28]。种群内各产卵群体的生长特征受季节性变化影响显著,且生长速度的差异与年间季节性的饵料丰度和栖息水温等因素的相互作用有关[11,28]。多数冷温性枪乌贼科物种中,冬-春季(冷水期)孵化的个体在相同年龄时比夏-秋季(暖水期)孵化个体体型更大[45]。这与孵化群体时的幼体体型有关,由于早期低温环境限制幼体的生长和发育,延长了该时期个体的发育过程,致使成体体型较大[44]。暖水期个体孵化后的适宜水温,使其在早期优越的生长环境中快速发育成熟,在进入低温且缺乏饵料的季节前达到最小性成熟体型[15,32]。然而,栖息在热带(赤道)的莱氏拟乌贼物种表现则有所不同,暖水期孵化的个体生长速度更快,体型更大,这与孵化后适宜水温的作用有关[22,46]。因此,枪乌贼科物种暖水期和冷水期孵化群体的生长策略是为了适应栖息环境的季节变化而做出的生长响应,且热带海域栖息水温对个体生长影响明显。
枪乌贼科物种中,雌、雄个体的生长并不同步[2,17]。通常而言,在相同年龄下,雄性比雌性生长得更快、体型更大、成熟得更早[2,11,17]。性成熟的雄性个体将能量更多用于体细胞的生长,以在交配竞争中获得优势,而雌性则需要将更多的能量用于卵细胞的发育和交配行为[28,47]。然而,栖息在热带的小枪乌贼属中,雌性生长得更快,体型更大,这与个体在不足6个月的生命历程中完成繁殖交配的生殖策略有关[21]。因此,枪乌贼科物种中性别间的生长差异受个体繁殖策略影响,且栖息环境要素的变化影响个体的成熟速度。
2.3 雄性生长的特化特征
枪乌贼科物种中,雄性个体的生长情况存在一定的分化模式,并且在性腺成熟时存在大、小两种体型个体[17,20,45]。如长枪乌贼小个体在达到最小性成熟后则不再生长,而大个体在达到一定体型时才会停止生长,这可能与种群遗传基因的稳定调控有一定关系[48-49]。同时也需要注意,大多数物种体型的差异主要因环境异质性所导致,也存在中间型个体同时采用大、小个体的繁殖策略[50]。因此,枪乌贼科物种雄性个体生长差异与不同的繁殖策略和孵化时的栖息环境有关,而这种由环境因素导致的个体生长差异是否能将遗传信息稳定传递给后代仍需进一步研究。
研究表明,巴塔哥尼亚枪乌贼秋季产卵群体中存在“超级”雄性大个体(superbull,胴长>250 mm),其个体表现为更强的胴体,以及聚集且发达的鳍部,这能够有效地增强个体游泳能力,并促使其有能力进行长距离、高效的洄游[17,28]。该物种由春季和秋季产卵群体组成,而秋季产卵群体的“超级”雄性大个体存在的一种解释是为了保持与春季产卵群体间潜在的时间关联,并会渗透到随后的产卵群体中进行繁殖行为[28]。此外,“超级”雄性大个体也是维持智利和马尔维纳斯群岛之间在时间和空间上地理连通性的纽带[28]。目前,枪乌贼科物种中仅巴塔哥尼亚枪乌贼中存在“超级”雄性大个体,虽然福氏枪乌贼和枪乌贼也存在雄性大个体,但在种群和生态水平上可能并未表现出类似巴塔哥尼亚枪乌贼的连通性[28]。因此,“超级”雄性大个体的存在提高了个体的交配成功率,是个体应对环境变化、生活史策略及遗传信息多重影响作用的选择响应。
2.4 生长特性与环境因素的关系
近岸枪乌贼科物种的早期生活特征决定种群的动态结构和补充量,种群的早期生长受环境因素变化的影响显著[2,11]。海水温度被认为是决定卵鞘分布、胚胎发育和幼体生长的关键环境因素之一[51]。在适宜的水温下,巴塔哥尼亚枪乌贼胚胎的发育时间和孵化时的体型随温度的升高而减少,浮游幼体的生长速度则随温度的升高而增加[52]。进一步研究发现,在该物种胚胎发育阶段,卵黄囊营养的利用率和新陈代谢受环境温度和含氧量的影响,水温升高会加速个体的孵化速度,使得卵黄囊的营养物质未被完全消耗,导致浮游幼体的成活率降低[52-53]。同时,水温的升高增加了耗氧率,且分解代谢活性的升高也加速了卵囊内氧的消耗,从而加剧了胚胎发育末期的代谢抑制[52]。因此,海水温度的变化对枪乌贼科物种的早期胚胎发育和新陈代谢尤为重要,温度的升高会影响浮游幼体的成活率及胚胎应对热转移等环境压力源的能力。
随着全球变暖和CO2含量升高,海水温度升高、海水酸化和异常气候事件频发等现象日益明显[51]。近岸枪乌贼科物种作为生态系统结构和功能的重要生物,气候变化对个体早期生长发育的影响愈加明显[31,54]。研究表明,在海洋酸化和升温条件下,皮氏枪乌贼胚胎发育延长和较低的胚胎耐热极限会对夏季产卵群体早期的存活率产生负面影响[54]。这两种应激源(酸化和升温)在巴塔哥尼亚枪乌贼孵化期内相互抵消的效果最明显,在孵化期内,变暖会增加氧气消耗量,从而影响该物种的发育速度,而酸化会导致发育延迟和潜在的代谢抑制[52-53]。随着温度升高,巴塔哥尼亚枪乌贼卵代谢酶的活性增加,卵囊内的氧气水平预计将更快地耗尽,个体可能通过增加卵表面积和减小卵壁厚度增加整个胚胎发育过程中的氧通量[52]。因此,在全球气候变化的背景下,海洋环境要素的变化会对近岸枪乌贼科物种早期的生长发育产生长期影响。
近岸枪乌贼科物种的种群动态和生活史特征具有高度可塑性,这是物种对生物和非生物因素综合响应的结果[44,52]。Forsythe[55]认为,在乳光枪乌贼个体早期快速生长阶段(<100 d),温度的小幅上升会使个体生长速度加快,并能显著缩短达到成年体型所需的时间。根据上述理论,在暖水期孵化的莱氏拟乌贼浮游幼体,适度的高温对应着相对较高的生长速率,以便迅速达到临界体型;相反,冷水期幼体生长速度较慢,孵化时应以较大的体型来补偿生长速度[11,46]。在温度升高的情况下,种群从生长速度中如需获益,则必须首先抵消因孵化出更小的幼体而带来的损失,并且相同物种在中低纬度的种群比在高纬度的种群生长更快(如莱氏拟乌贼),这种由环境异质性所引起生长策略的变化是枪乌贼科物种生活史特征可塑性的一种表现[44-55]。然而,在温度持续升高的情况下,由于个体代谢成本持续增加,生长潜力逐渐降低,枪乌贼科物种成体的生长速度可能会在某一时刻(通常为拐点)开始下降[2,52,55]。此外,研究表明,在拉尼娜期间,加州近岸海域的上升流较强,导致浮游生物量等初级生产力增加,因此,尽管温度较低,丰富充足的饵料仍能够维持乳光枪乌贼的胴体生长使其保持较快的生长速度,此时饵料生物的可获性和丰度是影响其生长的关键因素[56]。因此,在适宜枪乌贼科物种个体生长的温度范围内,温度的升高加快了幼体的生长速度,且不同孵化群体在应对温度的变化时会采取不同的生长策略。
3 繁殖
3.1 繁殖行为
枪乌贼科物种的繁殖交配行为较为复杂[11]。在好望角枪乌贼交配前期,性成熟的雌、雄个体共同洄游至浅海产卵区并盘旋在产卵场上方,从黎明至黄昏,聚集密度不断增加[57]。普氏枪乌贼雄性个体根据自身体型特征,分别采用Consort(大个体)和Sneaker(小个体)型繁殖策略,雌、雄交配时,Consort以胴体平行姿势与雌性交配,将精荚储存在雌性输卵管开口内或周围,然后保护雌性直到产卵[58]。长枪乌贼交配期间,Consort个体间会通过激烈的身体竞争获取交配权,Sneaker个体则会尝试通过快速的头对头交配来进行额外的交配,将精荚储存在雌性口球下方的储精囊周围[49]。进一步研究发现,长枪乌贼精荚的转移或储存条件也会影响雄性的受精成功率[48],成熟的卵子首先在输卵口接触Consort个体的精荚,随后在口球处同时接受Sneaker个体的精荚进行受精,而前者的受精成功率较高[50]。这是因为长枪乌贼Consort个体将精荚附着在输卵管内壁,使得其有效的内部受精成功率更高[50]。普氏枪乌贼中存在介于Consort和Sneaker之间的中型个体,该类型个体同时具有两种交配行为,这取决于雄性当前的生殖环境[59]。当生殖环境中仅存在雄性大个体或具有较高竞争能力的雄性小个体时,则采用Consort型繁殖模式,反之则采用Sneaker模式[48,59]。因此,枪乌贼科物种雄性交配行为包括真正的替代策略(由潜在的遗传多态性导致的两种或两种以上的离散行为)和条件策略(由生物和生态条件的变化而不是由离散的遗传差异影响产生的多种策略)[60]。雄性根据其相对于竞争对手的条件(体型)或生态因素(如竞争对手密度、雌性密度和捕食风险)改变交配策略[60]。与此同时,雌性储精囊的位置和形态也会影响交配成功率[59]。
此外,枪乌贼还是视觉高度敏感的海洋生物,其通过动态的身体模式进行交流与求偶(色素、亮斑和化学元素等)[61]。当莱氏拟乌贼雌性的胴长边缘表现出深色条纹时,则表示接受交配;若伴随喷射行为则表示拒绝[48]。因此,枪乌贼科物种雄性个体会根据自身形态特征和交配信号综合选择交配方式。
枪乌贼科物种雌、雄交配结束后,雌性将卵鞘附着在海洋硬底或者软底中[1]。作为间歇性产卵者,雌性第一次排卵量最大,随后逐次递减[61-62]。由于每次产卵的卵鞘数量较多,往往会在底层形成卵团(卵簇)现象,并且雌性更偏好选择将新卵鞘附着在卵团周围[63]。雄性个体的交配竞争可能引起卵鞘中受精卵的多重父系现象,这导致枪乌贼科物种受精卵胚胎发育存在非同步性[64]。由于枪乌贼科物种,雌性产卵后无护卵行为,多数卵鞘存在被底栖生物捕食的风险,并且底质的环境因素(浑浊度、氧气和水流的流通性)也影响着受精卵的存活和发育[63-64]。
3.2 精荚与卵子特征
1)精荚。枪乌贼科物种在繁殖交配过程中,交配群体的结构、产卵地点、雄性交配行为、精荚转移、存储位置,以及雄性保护配偶强度等相关行为的差异,决定了雄性之间的竞争机制,这进一步影响精荚竞争力、优先级及存储条件,最终导致不同体型个体间的精荚形态存在差异[48,55]。通常,产生水滴状精荚的Sneaker个体是将精荚附着在雌性口球处下方的储精囊,而产生细条状精荚的Consort个体是将精荚附着在雌性输卵管的开口处[49]。雌性储精囊不同位置的精荚形态反映了雄性精荚竞争的水平[50,65]。精荚竞争水平决定精荚数量,而精荚质量更多地取决于精荚的储存和受精方式,雄性根据他们面临的精荚竞争风险水平调整射精量[65]。精荚竞争理论表明,Sneaker个体会比Consort个体产生相对更多的精荚,从而弥补Sneaker个体在交配位置上不占优势的缺点,这种现象在大多数枪乌贼科物种中均有所发现[50]。但长枪乌贼Consort个体在单次射精过程中所携带的精荚是Sneaker个体的5倍,并且Consort个体的精荚比Sneaker个体短约50%[50]。长枪乌贼、好望角枪乌贼和剑尖枪乌贼Sneaker个体的精荚表现出对CO2的聚集性,并且调节精荚的能量代谢从而产生活力更持久的精荚以提高受精能力[65]。Sneaker个体精荚的这种聚集能力,既是通过亲缘选择来对抗精荚竞争风险,也是对受精环境的一种适应表现[66]。因此,枪乌贼科物种雄性精荚的形态差异受精荚竞争水平的影响,最优化的交配策略最终也可能导致类群的不同进化轨迹[48,66]。
2)卵子。枪乌贼科物种存在聚集性产卵现象,雌性的产卵过程不仅受到其自身遗传信息的调控,还与海底卵团密度和环境要素有关[60]。枪乌贼科物种在产卵期,卵巢发育成熟后通过排卵过程将卵子分批排出,部分种群的排卵量达到其潜在繁殖力的78%(乳光枪乌贼)[62]。枪乌贼科物种通常在浅水海域产卵,并且雄性成熟胴长小于雌性,而不同栖息纬度的物种,其产卵温度、卵鞘长度、怀卵量及卵直径等特征存在差异[21,29,33,60,67-72](表4)。与栖息低纬度的热带枪乌贼(杜氏枪乌贼)相比,高纬度的巴塔哥尼亚枪乌贼的卵鞘较短,内含成熟卵子较少,但卵较大(直径为2.1~3.1 mm),且卵巢中卵黄卵母细胞的比例较高,这些特征可能是个体对冷水产卵和发育的适应[21,29]。在枪乌贼科种群内部,群体在冷水期排出的卵较大,而在暖水期排出的卵较小;而针对枪乌贼这个物种而言,暖水期排出的卵较大[33]。在整个枪乌贼科物种中,莱氏拟乌贼的卵径最大(5.6~5.8 mm),卵越大表明胚胎所需要的发育时间越长,且卵的大小也决定了幼体的体型和生长特性[70]。通常,性腺质量存在明显的季节性差异,且雌性潜在繁殖力随着胴长的增加而增加[72]。因此,枪乌贼科物种产卵温度的范围较窄,栖息在高纬度的物种所排出的卵粒大、数量少,而中低纬度物种的繁殖力较高,这些特征与不同物种适应栖息环境和交配行为做出的适应性进化有关。
表4 全球重要经济型枪乌贼科物种的产卵特征信息
Tab.4 Spawning characteristics information of globally economically important Loliginidae species
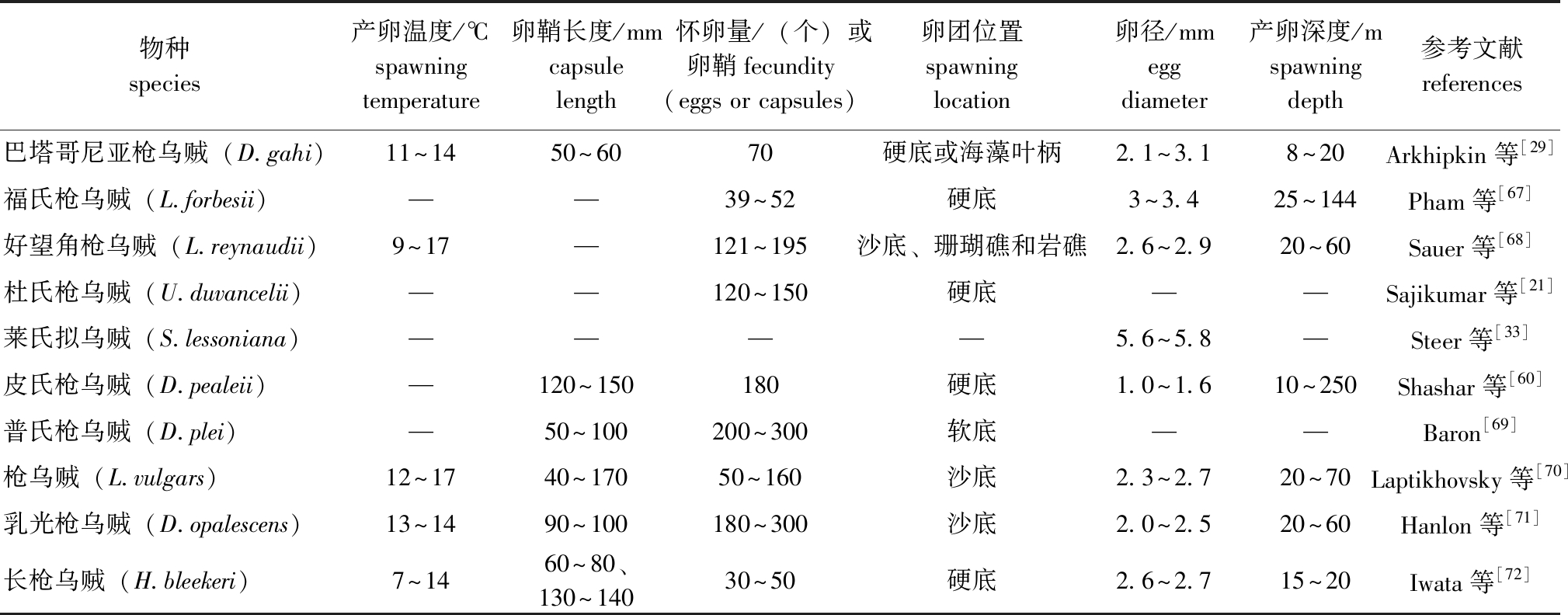
物种species产卵温度/℃spawning temperature卵鞘长度/mmcapsule length 怀卵量/(个)或卵鞘fecundity(eggs or capsules)卵团位置spawning location卵径/mmegg diameter产卵深度/mspawning depth参考文献references巴塔哥尼亚枪乌贼(D.gahi)11~1450~6070硬底或海藻叶柄2.1~3.18~20Arkhipkin等[29]福氏枪乌贼(L.forbesii)——39~52硬底3~3.425~144Pham等[67]好望角枪乌贼(L.reynaudii)9~17—121~195沙底、珊瑚礁和岩礁2.6~2.920~60Sauer等[68]杜氏枪乌贼(U.duvancelii)——120~150硬底——Sajikumar等[21]莱氏拟乌贼(S.lessoniana)————5.6~5.8—Steer等[33]皮氏枪乌贼(D.pealeii)—120~150180硬底1.0~1.610~250Shashar等[60]普氏枪乌贼(D.plei)—50~100200~300软底——Baron[69]枪乌贼(L.vulgars)12~1740~17050~160沙底2.3~2.720~70Laptikhovsky等[70]乳光枪乌贼(D.opalescens)13~1490~100180~300沙底2.0~2.520~60Hanlon等[71]长枪乌贼(H.bleekeri)7~1460~80、130~14030~50硬底2.6~2.715~20Iwata等[72]
3.3 繁殖特性与环境因素关系
在枪乌贼科物种整个繁殖交配过程中,个体形态的表型可塑性、精荚竞争水平和卵子形态等繁殖特性不仅受自身遗传基因的调控,还与栖息海域非生物因素的变化有关[51]。近岸产卵的种群,产卵底质、深度、温度、盐度及溶解氧水平是影响产卵成功的关键,适宜的环境能够最大限度地减少对卵鞘的破坏[70]。研究发现,乳光枪乌贼的卵鞘内部pH(7.34)和含氧量(1.9 μmol/L)较低,在全球气候变化引起海洋升温的背景下,这将使得卵鞘的耐受性达到生理极限,并影响胚胎发育[54]。长枪乌贼Sneaker个体的精荚在CO2趋化作用下形成射精聚集,这种精荚合作机制提高了该形态精荚的受精成功率[72]。
通常,枪乌贼科物种卵的大小与水温呈负相关关系,这使得大多数物种的繁殖策略表现为卵小且繁殖力相对较高或卵大且繁殖力相对较低[21,33]。栖息在冷水环境中的物种,其生殖策略在适宜温度范围内将转向更大的卵和更低的繁殖力,卵内积累更多的卵黄营养,可为幼体的生长提供充足营养[48]。这种表型可塑性部分归因于变温生物在较低温度下对新陈代谢的需求较低,这使得它们能够将更多的能量投入到单个卵子中[73]。而栖息在暖水环境中的种群,较高的海水温度提高了雌性个体的繁殖力(性腺指数GSI也较高),而此时成熟体型和卵子将变小[73]。不同栖息环境下,雌性个体繁殖特征的差异可能是一种环境诱导的表型可塑性,并且通过基因组重新排列将遗传信息稳定地传递给下一代[2]。在此过程中,温度对卵黄成分和积累模式的影响,改变了胚胎发育所需营养来源的数量[73],最终该繁殖过程能够保留适应性和生殖性能更好的基因型[73]。枪乌贼冬季产卵群体的卵比夏季群体小,这与胚胎的耐受性存在差异有关,这种策略倾向于在自然死亡中存活的后代数量更高,而不是在较冷的时期有更高的个体适应能力[74]。因此,海水温度的变化对枪乌贼科物种的繁殖策略具有很强的可塑性。
4 摄食
4.1 摄食关系
在全球近岸生态系统中,枪乌贼科物种被认为是食物网中能量转移的营养载体,也是连接不同空间生态系统的瞬时“生物泵”[13]。作为食物网中的关键物种,生活史不同阶段下摄食方式、种类及数量存在差异,这使得物种的营养级水平发生变化[75]。在胚胎发育阶段,枪乌贼科物种的营养物质来自卵黄,栖息在冷水中物种的卵黄营养较丰富,这提高了幼体在不利生存条件下的成活率[11]。在幼体生长阶段,由于个体自身摄食器官尚未发育完全,多数枪乌贼科物种以甲壳类、桡足类和磷虾类等小型浮游动物为食,此时个体的摄食种类和数量较少,这也与此时个体的新陈代谢水平有关[13,76]。随着个体生长发育完全,枪乌贼科物种逐渐以鱼类的幼体和同科(或属)的小型枪乌贼为食,并且同类相食的频率和摄食种类会根据枪乌贼科的物种、体型和季节而变化,此时摄食种类的体型和数量逐渐增加,这也得益于个体主动摄食能力的提高[77]。在福氏枪乌贼和皮氏枪乌贼整个生活史过程中,鱼类在其食物组成中所占比例较大,这可能与物种栖息环境生态食物网的结构有关[78]。此外,枪乌贼科物种也被鱼类、海鸟和鲸等海洋哺乳动物所捕食,从而维持生态系统能量守恒的动态平衡[13,76]。因此,在枪乌贼科物种的整个生活史阶段,随着个体发育完全,个体摄食种类由低营养级向高营养级转变,其营养生态位逐渐升高,并且鱼类幼鱼是其重要的饵料生物。
4.2 摄食特性与环境因素的关系
枪乌贼科物种的生命周期较短,需要摄食充足的食物维持较高代谢速率[32]。在较高温度下,个体对生态系统的能量需求比在低温时要多,这可能会影响生态系统内物种间的营养关系[13,78]。在东北大西洋,随着全球变暖现象日益明显,福氏枪乌贼种群有向北分布的趋势,而北部冷水区域饵料生物较少、初级生产力较低,这会影响到枪乌贼个体营养水平和生长发育[31,77]。此外,CO2浓度的升高使得夜光尾枪乌贼个体的运动能力和摄食行为发生变化[32],以及乳光枪乌贼游泳速度下降和莱氏拟乌贼摄食潜伏期的增加[79]。因此,在气候变化背景下,枪乌贼科物种的摄食需求量增加,并且影响物种的摄食行为和食物组成。
5 存在问题及展望
在近岸生态系统中,枪乌贼科物种的生活史特征具有重要的生物和生态指示作用。在枪乌贼科物种生活史早期阶段,浮游幼体需要获得足够的饵料,以克服内卵黄利用期内的营养不足。在适宜个体生长的温度范围内,温度的升高加快了幼体的生长速度,并且不同孵化群体在应对环境的变化时采取不同的生长策略。此外,栖息在高纬度的枪乌贼科物种所排出的卵粒大、数量少,而中低纬度物种的繁殖力较高,这与不同物种适应栖息环境和交配行为做出的适应性进化有关。在全球气候变化背景下,枪乌贼科物种生活史的高度可塑性使得种群对环境的适应性更具有优势,但这种可塑性的潜在机制仍需进一步探究。因此,结合未来气候变化背景,建议从以下几方面对中国近岸枪乌贼科物种的生活史特征进行深入研究。
1)开展种群结构及洄游路线研究。由于近岸枪乌贼科物种的种群结构复杂,群体间的洄游路径及其环境因素的影响并不清晰。因此,建议在今后的研究中设置合理的资源调查站点,结合形态学和分子生物学进行该科物种的种群鉴定,并采用生物地球化学技术(如平衡石微量元素、氧同位素等)和海洋物理动态模型进行洄游路线的推测和验证(如基于个体生物模型、粒子示踪法等)。
2)开展生长敏感性研究。枪乌贼科物种种群冷暖期生长策略的选择决定个体生长轨迹,但不同纬度物种生长和繁殖能量投入的机制并不清晰。因此,建议在今后的研究中应明确该科物种种群结构,选取影响个体各阶段生长发育的关键指标,结合全球气候变化模态,对栖息不同纬度物种的生长敏感性进行分析,并根据动态生长模型预测个体生长轨迹和速度,科学地预测和模拟未来个体生长情况。
3)开展繁殖策略及响应机制研究。枪乌贼科物种的繁殖策略决定了种群补充量的能力和规模,其繁殖策略的可塑性能否在遗传基因中进行稳定表达仍不清晰。因此,建议在今后的研究中明确该科物种的精荚竞争水平和繁殖力指标,结合组织切片和分子生物学等手段分析并解释雌、雄性物种繁殖策略差异的内在因素,通过动态模型对种群的补充量进行预测,为资源评估与管理工作提供科学参考。
4)开展生态特性及响应策略研究。枪乌贼科物种是近岸生态食物网中关键的营养载体,其饵料生物量和捕食者的分布及丰度影响生态系统的稳定性。因此,建议在今后的研究中,根据近岸生态系统生物群落组成的动态变化分析该科物种在不同生长阶段的摄食生态位及影响因素,通过Ecopath等动态生态模型对物种丰度进行预测,以监测近岸生态系统结构和功能的稳定性。
[1] 陈新军,刘必林,方舟.头足纲[M].北京:海洋出版社,2019.CHEN X J,LIU B L,FANG Z.Cephalopoda[M].Beijing:Ocean Press,2019.(in Chinese)
[2] PECL G T,JACKSON G D.The potential impacts of climate change on inshore squid:biology,ecology and fisheries[J].Reviews in Fish Biology and Fisheries,2008,18(4):373-385.
[3] Fisheries Department, Food and Agriculture Organization of the United Nations,.The state of world fisheries and aquaculture[M].Rome:Food and Agriculture Organization of the United Nations,2021.
[4] FAO.The yearbook of fishery and aquaculture statistics[R]. Rome:The Organization of Fishery and Aquaculture,2021.
[5] MCKEOWN N J,ARKHIPKIN A I,SHAW P W.Genetic analysis reveals historical and contemporary population dynamics in the longfin squid Doryteuthis gahi:implications for cephalopod management and conservation[J].ICES Journal of Marine Science,2019,76(4):1019-1027.
[6] CHASCO B E,HUNSICKER M E,JACOBSON K C,et al.Evidence of temperature-driven shifts in market squid Doryteuthis opalescens densities and distribution in the California Current ecosystem[J].Marine and Coastal Fisheries,2022,14(1):1-13.
[7] BURESCH K C,GERLACH G,HANLON R T.Multiple genetic stocks of longfin squid Loligo pealeii in the NW Atlantic:stocks segregate inshore in summer,but aggregate offshore in winter[J].Marine Ecology Progress Series,2006,310:263-270.
[8] GAYLARD S,WAYCOTT M,LAVERY P.Review of coast and marine ecosystems in temperate Australia demonstrates a wealth of ecosystem services[J].Frontiers in Marine Science,2020,7:453.
[9] PANG Y M,TIAN Y J,FU C H,et al.Variability of coastal cephalopods in overexploited China Seas under climate change with implications on fisheries management[J].Fisheries Research,2018,208:22-33.
[10] MA S Y,TIAN Y J,FU C,et al.Climate-induced nonlinearity in pelagic communities and non-stationary relationships with physical drivers in the Kuroshio ecosystem[J].Fish and Fisheries. 2021,22(1):1-17.
[11] JEREB P,ROPER C F E.Cephalopods of the Indian Ocean:a review.Part I.inshore squids (Loliginidae) collected during the international Indian Ocean expedition[J].Proceedings of the Biological Society of Washington,2006,119(1):91-136.
[12] LI Y R,MA S Y,FU C,et al.Seasonal differences in the relationship between biodiversity and ecosystem functioning in an overexploited shelf sea ecosystem[J].Diversity and Distributions,2022,28:1706-1720.
[13] ARKHIPKIN A I.Squid as nutrient vectors linking Southwest Atlantic marine ecosystems[J].Deep Sea Research Part Ⅱ:Topical Studies in Oceanography,2013,95:7-20.
[14] LISHCHENKO F,PERALES-RAYA C,BARRETT C,et al.A review of recent studies on the life history and ecology of European cephalopods with emphasis on species with the greatest commercial fishery and culture potential[J].Fisheries Research,2021,236:105847.
[15] JACKSON G D.Advances in defining the life histories of myopsid squid[J].Marine and Freshwater Research,2004,55(4):357.
[16] BOYLE P R,BOLETZKY S V.Cephalopod populations:definition and dynamics[J].Philosophical Transactions of the Royal Society of London Series B:Biological Sciences,1996,351(1343):985-1002.
[17] JONES J B,PIERCE G J,SABORIDO-REY F,et al.Size-dependent change in body shape and its possible ecological role in the patagonian squid (Doryteuthis gahi) in the Southwest Atlantic[J].Marine Biology,2019,166(5):1-17.
[18] SMITH J M,PIERCE G J,ZUUR A F,et al.Patterns of investment in reproductive and somatic tissues in the loliginid squid Loligo forbesii and Loligo vulgaris in Iberian and Azorean waters[J].Hydrobiologia,2011,670(1):201-221.
[19] SMITH J M,MACLEOD C D,VALAVANIS V,et al.Habitat and distribution of post-recruit life stages of the squid Loligo forbesii[J].Deep Sea Research Part Ⅱ:Topical Studies in Oceanography,2013,95:145-159.
[20] ![]() M R,VAN DER VYVER J,SHAW P,et al.Life cycle of chokka-squid Loligo reynaudii in South African waters[J].African Journal of Marine Science,2016,38(4):589-593.
M R,VAN DER VYVER J,SHAW P,et al.Life cycle of chokka-squid Loligo reynaudii in South African waters[J].African Journal of Marine Science,2016,38(4):589-593.
[21] SAJIKUMAR K K,SASIKUMAR G,JAYASANKAR J,et al.Dynamics of growth and spawning in the Indian squid Uroteuthis duvaucelii (Cephalopoda:Loliginidae) from the tropical Arabian Sea[J].Regional Studies in Marine Science.2022,52:102324.
[22] JACKSON G,MOLTSCHANIWSKYJ N.Spatial and temporal variation in growth rates and maturity in the Indo-Pacific squid Sepioteuthis lessoniana (Cephalopoda:Loliginidae)[J].Marine Biology,2002,140(4):747-754.
[23] GERLACH G,BURESCH K C,HANLON R T.Population structure of the squid Doryteuthis pealeii on the eastern coast of the USA:comment on Shaw et al.(2010)[J].Marine Ecology Progress Series,2012,450:281-283.
[24] SALES J B D, RODRIGUES L F D, FERREIRA Y D, et al.Divergence of cryptic species of Doryteuthis plei Blainville,1823 (Loliginidae,Cephalopoda) in the Western Atlantic Ocean is associated with the formation of the Caribbean Sea[J].Molecular Phylogenetics and Evolution,2017,106:44-54.
[25] MORENO A,PEREIRA J,ARVANITIDIS C,et al.Biological variation of Loligo vulgaris (Cephalopoda:Loliginidae) in the eastern Atlantic and Mediterranean[J].Bulletin of Marine Science,2002,71(1):515-534.
[26] CABANELLAS-REBOREDO M,AL S J,PALMER M,et al.Movement patterns of the European squid Loligo vulgaris during the inshore spawning season[J].Marine Ecology Progress Series,2012,466:133-144.
S J,PALMER M,et al.Movement patterns of the European squid Loligo vulgaris during the inshore spawning season[J].Marine Ecology Progress Series,2012,466:133-144.
[27] TIAN Y J,NASHIDA K,SAKAJI H.Synchrony in the abundance trend of spear squid Loligo bleekeri in the Japan Sea and the Pacific Ocean with special reference to the latitudinal differences in response to the climate regime shift[J].ICES Journal of Marine Science,2013,70(5):968-979.
[28] JONES J B,PIERCE G J,BRICKLE P,et al.‘Superbull’ males:what role do they play and what drives their appearance within the Doryteuthis gahi Patagonian Shelf population?[J].Marine and Freshwater Research,2019,70(12):1805.
[29] ARKHIPKIN A I,MIDDLETON D A J.Sexual segregation in ontogenetic migrations by the squid Loligo gahi around the Falkland Islands[J].Bulletin of Marine Science,2002,71(1):109-127.
[30] MARTINS R S,ROBERTS M J,LETT C,et al.Modelling transport of chokka squid (Loligo reynaudii) paralarvae off South Africa:reviewing,testing and extending the ‘Westward Transport Hypothesis’[J].Fisheries Oceanography,2014,23(2):116-131.
[31] SCHICKELE A,FRANCOUR P,RAYBAUD V.European cephalopods distribution under climate-change scenarios[J].Scientific Reports,2021,11:3930.
[32] CERIOLA L,JACKSON G D.Growth,hatch size and maturation in a southern population of the loliginid squid Loliolus noctiluca[J].Journal of the Marine Biological Association of the United Kingdom,2010,90(4):755-767.
[33] STEER M A,MOLTSCHANIWSKYJ N A,JORDAN A R.Embryonic development of southern calamary (Sepioteuthis australis) within the constraints of an aggregated egg mass[J].Marine and Freshwater Research,2003,54(3):217.
[34] GUERRA  ,ROCHA F,GONZ
,ROCHA F,GONZ LEZ
LEZ  F,et al.Embryonic stages of the patagonian squid Loligo gahi (Mollusca:Cephalopoda)[J].Veliger,2001,44:109-115.
F,et al.Embryonic stages of the patagonian squid Loligo gahi (Mollusca:Cephalopoda)[J].Veliger,2001,44:109-115.
[35] SEGAWA S,YANG W T,MARTHY H,et al.Illustrated embryonic stages of the eastern Atlantic squid loligo-forbesi[J].Veliger,1988,30:230-243.
[36] BLACKBURN S,SAUER ![]() M.The embryonic development of the chokka squid Loligo vulgaris reynaudii d’orbigny,1845[J].Veliger,1998,41:249-258.
M.The embryonic development of the chokka squid Loligo vulgaris reynaudii d’orbigny,1845[J].Veliger,1998,41:249-258.
[37] MCMAHON J J,SUMMERS W C.Temperature effects on the developmental rate of squid (Loligo pealei) embryos[J].The Biological Bulletin,1971,141(3):561-567.
[38] DE ARAUJO C C,GASALLA M A.Distribution patterns of loliginid squid paralarvae in relation to the oceanographic features off the South Brazil Bight (22°-25°S)[J].Fisheries Oceanography,2018,27(1):63-75.
[39] BOLETZKY S V,HANLON R T.A review of the laboratory maintenance,rearing and culture of cephalopod molluscs[J].Memoirs of the National Museum of Victoria,1983,44:147-187.
[40] MCCONATHY D A,HANLON R T,HIXON R E.Chromatophore arrangement of hatching loliginid squids (Cephalopoda, Myopsida)[J].Malacologia,1980,19(2):279-288.
[41] BAEG G,SAKURAI Y,SHIMAZAKI K.Embryonic stages of Loligo bleekeri keferstein (Mollusca:Cephalopoda)[J].Veliger,1992,35(3):234-241.
[42] JACKSON G D.Research into the life history of Loligo opalescens:where to from here?[J].California Cooperative Oceanic Fisheries Investigations Reports,1998,39:101-107.
[43] CHALLIER L,ROYER J,PIERCE G J,et al.Environmental and stock effects on recruitment variability in the English Channel squid Loligo forbesi[J].Aquatic Living Resources,2005,18(4):353-360.
[44] PECL G T,STEER M A,HODGSON K E.The role of hatchling size in generating the intrinsic size-at-age variability of cephalopods:extending the Forsythe Hypothesis[J].Marine and Freshwater Research,2004,55(4):387.
[45] ROCHA F,GUERRA A.Age and growth of two sympatric squid Loligo vulgaris and Loligo forbesi,in Galician waters (north-west Spain)[J].Journal of the Marine Biological Association of the United Kingdom,1999,79(4):697-707.
[46] THOMAS R,MOLTSCHANIWSKYJ N.Ontogenetic changes in size and shape of statoliths:implications for age and growth of the short-lived tropical squid Sepioteuthis lessoniana(Cephalopoda:Loliginidae)[J].Fishery Bulletin,1999,97(3):636-645.
[47] VILA Y,SILVA L,TORRES M A,et al.Fishery,distribution pattern and biological aspects of the common European squid Loligo vulgaris in the Gulf of Cadiz[J].Fisheries Research,2010,106(2):222-228.
[48] HIROHASHI N,SATO N,IWATA Y,et al.Context-dependent behavioural plasticity compromises disruptive selection of sperm traits in squid[J].PLoS One,2021,16(8):e0256745.
[49] IWATA Y,SATO N,HIROHASHI N,et al.Sperm competition risk affects ejaculate strategy in terms of sperm number but not sperm size in squid[J].Journal of Evolutionary Biology,2021,34(9):1352-1361.
[50] IWATA Y,SAKURAI Y,SHAW P.Dimorphic sperm-transfer strategies and alternative mating tactics in loliginid squid[J].Journal of Molluscan Studies,2015,81(1):147-151.
[51] ZAKROFF C,MOONEY T A,BERUMEN M L.Dose-dependence and small-scale variability in responses to ocean acidification during squid,Doryteuthis pealeii,development[J].Marine Biology,2019,166(5):1-24.
[52] PIMENTEL M S,TRÜBENBACH K,FALEIRO F,et al.Impact of ocean warming on the early ontogeny of cephalopods:a metabolic approach[J].Marine Biology,2012,159(9):2051-2059.
[53] VIDAL E A G, DIMARCO F, WORMUTH J H, et al.Influence of temperature and food availability on survival,growth and yolk utilization in hatchling squid[J].Bulletin of Marine Science,2002,71(2):915-931.
[54] LONG M H,MOONEY T A,ZAKROFF C.Extreme low oxygen and decreased pH conditions naturally occur within developing squid egg capsules[J].Marine Ecology Progress Series,2016,550:111-119.
[55] FORSYTHE J W.Accounting for the effect of temperature on squid growth in nature:from hypothesis to practice[J].Marine and Freshwater Research,2004,55(4):331.
[56] JACKSON G D,DOMEIER M L.The effects of an extraordinary El Ni o/La Ni
o/La Ni a event on the size and growth of the squid Loligo opalescens off Southern California[J].Marine Biology,2003,142(5):925-935.
a event on the size and growth of the squid Loligo opalescens off Southern California[J].Marine Biology,2003,142(5):925-935.
[57] DOWNEY N J,ROBERTS M J,BAIRD D.An investigation of the spawning behaviour of the chokka squid Loligo reynaudii and the potential effects of temperature using acoustic telemetry[J].ICES Journal of Marine Science,2010,67(2):231-243.
[58] APOST LICO L H,MARIAN J E A R.From sneaky to bully:reappraisal of male squid dimorphism indicates ontogenetic mating tactics and striking ejaculate transition[J].Biological Journal of the Linnean Society,2018,123(3):603-614.
LICO L H,MARIAN J E A R.From sneaky to bully:reappraisal of male squid dimorphism indicates ontogenetic mating tactics and striking ejaculate transition[J].Biological Journal of the Linnean Society,2018,123(3):603-614.
[59] APOST LICO L H,MARIAN J E A R.Behavior of “intermediate” males of the dimorphic squid Doryteuthis pleii supports an ontogenetic expression of alternative phenotypes[J].Frontiers in Physiology,2019,10:1180.
LICO L H,MARIAN J E A R.Behavior of “intermediate” males of the dimorphic squid Doryteuthis pleii supports an ontogenetic expression of alternative phenotypes[J].Frontiers in Physiology,2019,10:1180.
[60] SHASHAR N,HANLON R T.Spawning behavior dynamics at communal egg beds in the squid Doryteuthis (Loligo) pealeii[J].Journal of Experimental Marine Biology and Ecology,2013,447:65-74.
[61] ROCHA F,GUERRA A.Signs of an extended and intermittent terminal spawning in the squids Loligo vulgaris Lamarck and Loligo forbesi Steenstrup (Cephalopoda:Loliginidae)[J].Journal of Experimental Marine Biology and Ecology,1996,207(1/2):177-189.
[62] MACEWICZ B J,HUNTER J R,LO N C H,et al.Fecundity,egg deposition,and mortality of market squid (Loligo opalescens)[J].Fishery Bulletin,2004,102(2):306-327.
[63] ZEIDBERG L D,HAMNER W, MOOREHEAD K, et al.Egg masses of Loligo opalescens (Cephalopoda:Myopsida) in Monterey Bay,California following the El Ni o event of 1997-1998[J].Bulletin of Marine Science,2004,74(1):129-141.
o event of 1997-1998[J].Bulletin of Marine Science,2004,74(1):129-141.
[64] MATHER J.Mating games squid play:reproductive behaviour and sexual skin displays in Caribbean reef squid Sepioteuthis sepioidea[J].Marine and Freshwater Behaviour and Physiology,2016,49(6):359-373.
[65] IWATA Y,SAUER W H H,SATO N,et al.Spermatophore dimorphism in the chokka squid Loligo reynaudii associated with alternative mating tactics[J].Journal of Molluscan Studies,2018,84(2):157-162.
[66] HIROHASHI N,IIDA T,SATO N,et al.Complex adaptive traits between mating behaviour and post-copulatory sperm behaviour in squids[J].Reviews in Fish Biology and Fisheries,2016,26(3):601-607.
[67] PHAM C K,CARREIRA G P,PORTEIRO F M,et al.First description of spawning in a deep water loliginid squid,Loligo Forbesi (Cephalopoda:Myopsida)[J].Journal of the Marine Biological Association of the United Kingdom,2009,89(1):171-177.
[68] SAUER W H H,MELO Y C,DE WET W.Fecundity of the chokka squid Loligo vulgaris reynaudii on the southeastern coast of South Africa[J].Marine Biology,1999,135(2):315-319.
[69] BARON P J.First description and survey of the egg masses of Loligo gahi and Loligo sanpaulensis from the Patagonian coastal waters[J].Journal of Shellfish Research,2001,20(1):289-285.
[70] LAPTIKHOVSKY V,COOKE G,BARRETT C,et al.Identification of benthic egg masses and spawning grounds in commercial squid in the English Channel and Celtic Sea:Loligo vulgaris vs L.forbesii[J].Fisheries Research,2021,241:106004.
[71] HANLON R T,KANGAS N,FORSYTHE J W.Egg-capsule deposition and how behavioral interactions influence spawning rate in the squid Loligo opalescens in Monterey Bay,California[J].Marine Biology,2004,145(5):923-930.
[72] IWATA Y,MUNEHARA H,SAKURAI Y.Dependance of paternity rates on alternative reproductive behaviors in the squid Loligo bleekeri[J].Marine Ecology Progress Series,2005,298:219-228.
[73] LAPTIKHOVSKY V.Latitudinal and bathymetric trends in egg size variation:a new look at Thorson’s and Rass’s rules[J].Marine Ecology,2006,27(1):7-14.
[74] BOAVIDA-PORTUGAL J,MORENO A,GORDO L,et al.Environmentally adjusted reproductive strategies in females of the commercially exploited common squid Loligo vulgaris[J].Fisheries Research,2010,106(2):193-198.
[75] ROSAS-LUIS R,S NCHEZ P,PORTELA J M,et al.Feeding habits and trophic interactions of Doryteuthis gahi,Illex argentinus and Onykia ingens in the marine ecosystem off the Patagonian Shelf[J].Fisheries Research,2014,152:37-44.
NCHEZ P,PORTELA J M,et al.Feeding habits and trophic interactions of Doryteuthis gahi,Illex argentinus and Onykia ingens in the marine ecosystem off the Patagonian Shelf[J].Fisheries Research,2014,152:37-44.
[76] STAUDINGER M D,JUANES F.Size-dependent susceptibility of longfin inshore squid (Loligo pealeii) to attack and capture by two predators[J].Journal of Experimental Marine Biology and Ecology,2010,393(1/2):106-113.
[77] ISLAM R,HAJISAMAE S,PRADIT S,et al.Feeding habits of two sympatric loliginid squids,Uroteuthis (Photololigo) chinensis (Gray,1849) and Uroteuthis (Photololigo) duvaucelii (d’Orbigny,1835),in the lower part of the South China Sea[J].Molluscan Research,2018,38:155-162.
[78] MARTINS R S,PEREZJ A A.The ecology of loliginid squid in shallow waters around Santa Catarina Island,southern Brazil[J].Bulletin of Marine Science,2007,80(1):125-145.
[79] SPADY B L,MUNDAY P L,WATSON S A.Predatory strategies and behaviours in cephalopods are altered by elevated CO2[J].Global Change Biology,2018,24(6):2585-2596.