2022年中国水产品总产量达到6 865万t,连续20年位居世界第一[1]。水产品营养丰富,是生产高品质蛋白产品的优质原料。肌原纤维蛋白(myofibrillar proteins,MPs)在水产动物肌肉中的含量高达50%以上,其结构和功能性质决定了水产动物原料的加工特性[2]。水产动物MPs易受温度、pH和盐度等化学因素及蛋白分子结构内部稳定性的影响,在贮藏加工过程中易发生变性导致蛋白的理化和功能特性改变,从而影响产品品质[3]。因此,通过调控水产动物MPs变性程度,改善其功能特性,对于生产高品质水产蛋白食品,提高水产品经济价值具有重要意义。
蛋白功能特性可分为溶解性、乳化性、风味吸附性、凝胶性、成膜性和起泡性,因一级结构的差异,水产动物MPs功能特性与禽畜类MPs存在显著差异[4]。蛋白改性技术分为物理改性和生化改性[5],已有报道从物理和生化改性等方面对肌肉蛋白结构和功能特性进行了论述,但尚缺少关于水产动物MPs结构功能特性的系统描述,以及改性技术在水产动物MPs功能优化方面的综述[6]。本文系统综述了水产动物MPs结构特点、功能特性和改性方法,探讨了改性技术研究中存在的问题及未来研究方向,以期为开发高品质水产蛋白食品提供科学参考。
1 水产动物MPs结构
鱼类MPs呈长筒状,总体结构以1条肌球蛋白组成的粗丝为中心,6条肌动蛋白组成的细丝包围在四周,呈六角形形态,横切面由粗丝和细丝交叉穿错形成有序排列,纵切面呈现明暗交替的横纹分布[7]。与畜禽类相比,水产动物MPs具有更加均匀光滑的微观结构,其纤维组成偏细(图1),这一结构特点导致水产动物与畜禽类MPs功能性的差异。

图1 不同种类动物MPs扫描电镜图
Fig.1 Electron microscopic scanning of myofibrillar protein in different species of animals
水产动物种类繁多,其MPs含量具有较大区别,如淡水鱼MPs含量普遍高于沙丁鱼等中上层海水鱼类,低于鳕等深海鱼类[8];贝类含有较多的水溶性蛋白和呈味物质,MPs含量偏低[9];鱿鱼MPs含量则显著高于罗非鱼和带鱼[10]。
2 水产动物MPs功能特性
蛋白一级结构决定其高级结构,而高级结构的差异或变化导致蛋白功能特性的多样性。水产动物MPs主要功能特性、作用机制及影响因素见表1。
表1 水产动物MPs功能特性、作用机制及影响因素
Tab.1 Property,mechanism and influencing factors of main function of myofibrillar proteins from aquatic animals

性质 property作用机制 action mechanism影响因素 influencing factor文献来源 reference溶解性solubility亲水基团与水作用蛋白分子带电情况周逸等[15]乳化性emulsibility在界面吸附包裹油滴,形成蛋白膜表面活性剂、界面张力Zhang等[17]风味吸附性flavor adsorption蛋白暴露结合位点风味化合物种类、分子量大小聂若彤等[18]凝胶性gel characteristics蛋白分子聚集,形成凝胶网络结构氢键(主要作用力)、加热时间王卉楠等[19]
2.1 溶解性
溶解性作为蛋白的重要物理特性,也是评价水产动物MPs最常用的功能特性之一。水产动物MPs的提取和溶解是加工重组食品的关键物理化学反应过程,主要取决于疏水和亲水氨基酸在蛋白表面的分布,以及蛋白-水相的相互作用。盐含量的添加会减少MPs分子之间的静电相互作用,增加MPs的溶解性,肌球蛋白丝可在高盐浓度体系下解聚成肌球蛋白单体溶解至溶液中,在低离子强度时重新聚集成细丝且不可溶[15]。不同种类的盐会影响水产动物MPs的溶解度[16]。在接近蛋白等电点时,由于MPs倾向于形成聚集体,此时MPs的提取率和溶解性较低,随着pH的变化,MPs的溶解性增加。基于溶解性变化原理,MPs提取方法可分为盐提法、酸提法和碱提法(表2)。
表2 水产动物MPs提取方法
Tab.2 Extraction methods of myofibrillar proteins from aquatic animals

提取方法extraction method缓冲液buffer solution试验原料experimental material提取离心参数extraction of centrifugal parameter0.01 mol/L磷酸盐缓冲液;0.1 mol/L KCl、 0.02 mol/L Tris秘鲁鱿鱼[15]4 ℃下以10 000 r/min离心10 min盐提法salt extraction0.05 mol/L磷酸盐缓冲液;0.6 mol/L NaCl、0.02 mol/L Tris鲈[20]4 ℃下以10 000 r/min离心15 min0.05 mol/L KCl、 0.02 mol/L Tris;0.6 mol/L KCl南美白对虾[21]两次离心参数略有不同,首次以10 000 r/min离心15 min,第二次以9 000 r/min离心10 min碱提法 alkali extraction2 mol/L NaOH鲇[19]4 ℃下以10 000 r/min离心20 min2 mol/L NaOH鸢乌贼[22]调整pH至11后以10 000 r/min离心20 min酸提法 acid extraction2 mol/L HCl鸢乌贼[22]调整pH至3后以10 000 r/min离心20 min
2.2 乳化性
乳液由两个不混溶相组成,其中一个相以细小颗粒形态分散在另一个连续相中,可作为运输传递体系用于封装、保护和释放稳定性差的功能性成分,例如脂溶性营养物质利用鱼油传递体系被人体消化吸收[23]。MPs具有亲水性和亲脂性并可改变油-水界面张力,从而具有一定的乳化特性(图2)。在乳化过程中,MPs对油-水界面的油滴进行吸附包裹,形成MPs膜从而降低分散相和连续相之间的界面张力;乳液体系形成后MPs可在油-水界面将亲水基团和疏水基团定向分配至水相和油相[24]。水产动物MPs乳化特性易受pH、温度和离子强度的影响,蛋白的解聚会导致疏水氨基酸残基暴露和构象柔韧性增加,从而增加油-水界面活性和蛋白的吸附能力[25]。如虾头蛋白乳液pH在7~9时可引发蛋白二级结构改变,从而具有更稳定的乳化能力[26];鲈MPs在加热过程中,由于受热蛋白结构展开,向油-水界面和气-液界面扩散,但随着温度的持续升高破坏了蛋白在界面的吸附作用,因此,MPs乳化能力随温度的升高呈先增加后降低的趋势[27];大菱鲆MPs随NaCl浓度的升高,盐和蛋白间的相互作用增强,蛋白迅速向油-水移动形成蛋白膜,MPs乳化液稳定性显著提升[28]。
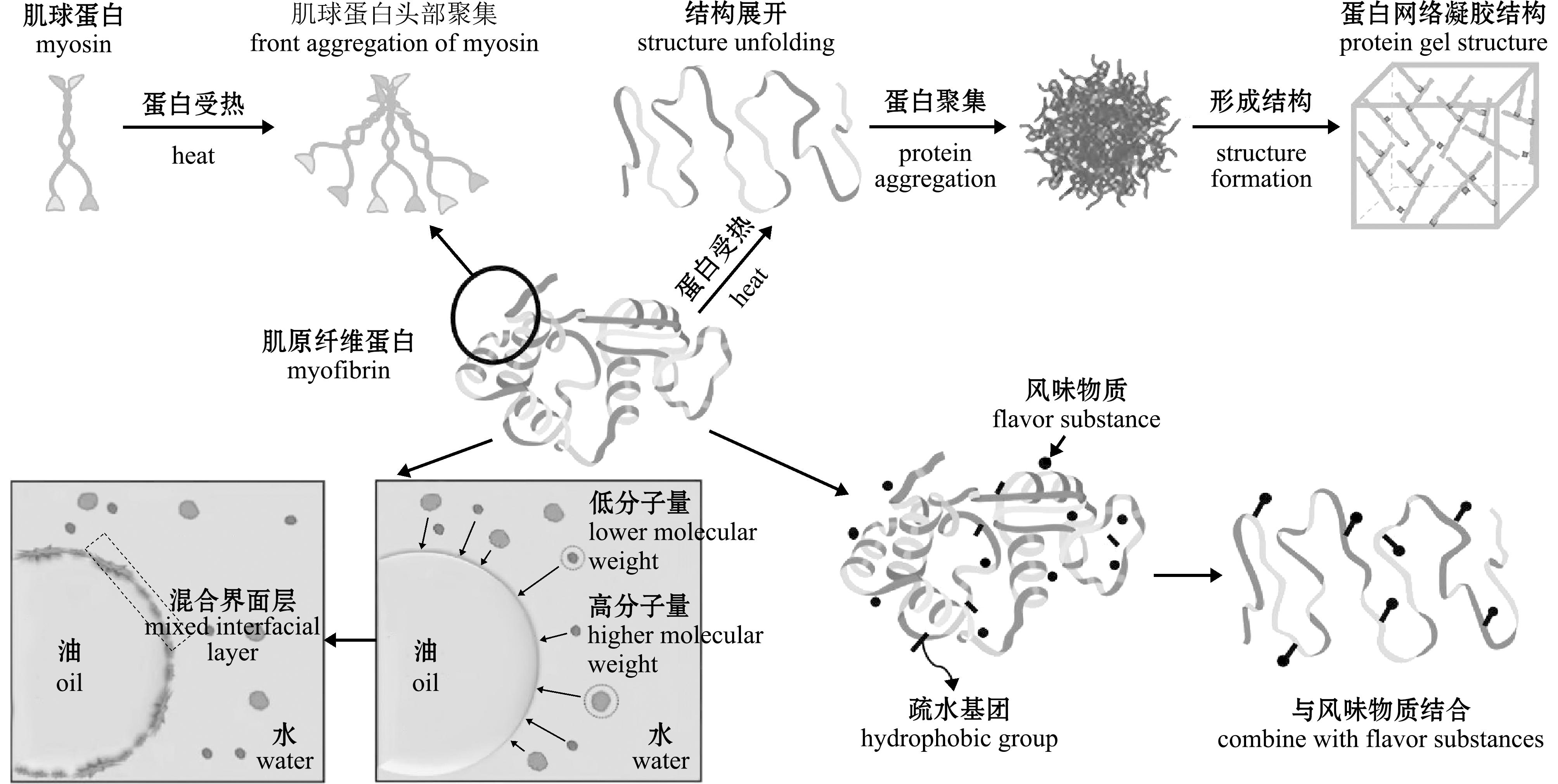
图2 水产动物MPs乳化性、风味吸附性及凝胶网络形成机理 [17-19]
Fig.2 Mechanism of emulsification,flavor adsorption and gel net work formation of myofibrillar proteins from aquatic animals
2.3 吸附性
水产动物MPs通过结合或吸附挥发性风味化合物影响食品的感官品质特性[29]。在贮藏加工过程中,水产动物蛋白极易产生结构的展开或折叠,蛋白二级结构由α-螺旋转变为β-折叠,伴随结构变化导致蛋白表面暴露出多种结合位点,并依据结合位点的强弱结合不同类型的风味配体,最终形成多种风味蛋白(图2)。MPs结构组成和质量浓度是影响其风味吸附性的影响因素,这是由于不同蛋白与醛类等风味物质的结合能力不同,且随着MPs浓度的增加,蛋白与风味物质的结合能力显著提升[30]。Wang等[31]采用分子对接和动力学模拟技术验证了MPs可通过氢键、范德华力和疏水相互作用与风味物质结合,作用位点在色氨酸、赖氨酸和甘氨酸等氨基酸残基上。此外,挥发性风味物质的种类、分子结构及外源物的添加也会导致MPs风味吸附性出现差异[32]。
2.4 凝胶性
蛋白的凝胶性与鱼糜类制品的品质密切相关,凝胶化是MPs在热诱导下经蛋白-水、蛋白-蛋白和蛋白-脂肪相互作用建立网络凝胶结构的过程[33]。MPs凝胶形成过程中,肌球蛋白受热后构象发生变化,其尾部螺旋结构解开,借助分子内和分子间的作用力使肌球蛋白相互聚集,当达到一定温度时蛋白变性展开,由于α-螺旋含量降低,β-折叠和无规则卷曲含量升高,分子内部暴露出更多的疏水基团,展开的蛋白重新聚集,尤其是肌球蛋白头部的聚集情况较为显著,最终形成蛋白网络凝胶结构(图2)[17-19]。MPs的凝胶性取决于蛋白的组成成分、浓度及蛋白分子作用力,如二硫键、疏水键、氢键和范德华力等。水产动物MPs凝胶性易受原料的影响,如水产动物蛋白凝胶性要优于植物蛋白,白肉鱼凝胶性强于脂肪含量较高的红肉鱼[34]。pH和盐浓度也会影响MPs结构的展开和变化,形成不同类型的凝胶类网络,可用于制备不同质构等级的鱼糜制品[35]。此外,受热变性后MPs分子间的交联和变化不会因温度冷却而产生二次变化,具有一定的稳定性,利于凝胶类产品加工及贮藏。
3 水产动物MPs改性方法
3.1 物理改性
蛋白的物理改性是指通过加热、机械处理、电场或磁场等作用方式,对蛋白二级和三级结构进行优化或破坏,不涉及蛋白一级结构的改变,可控的热处理及非热加工是常见的水产动物MPs物理改性方法(表3)。
表3 不同改性方法对水产动物MPs的影响
Tab.3 Effects of different modified methods on myofibrillar proteins from aquatic animals
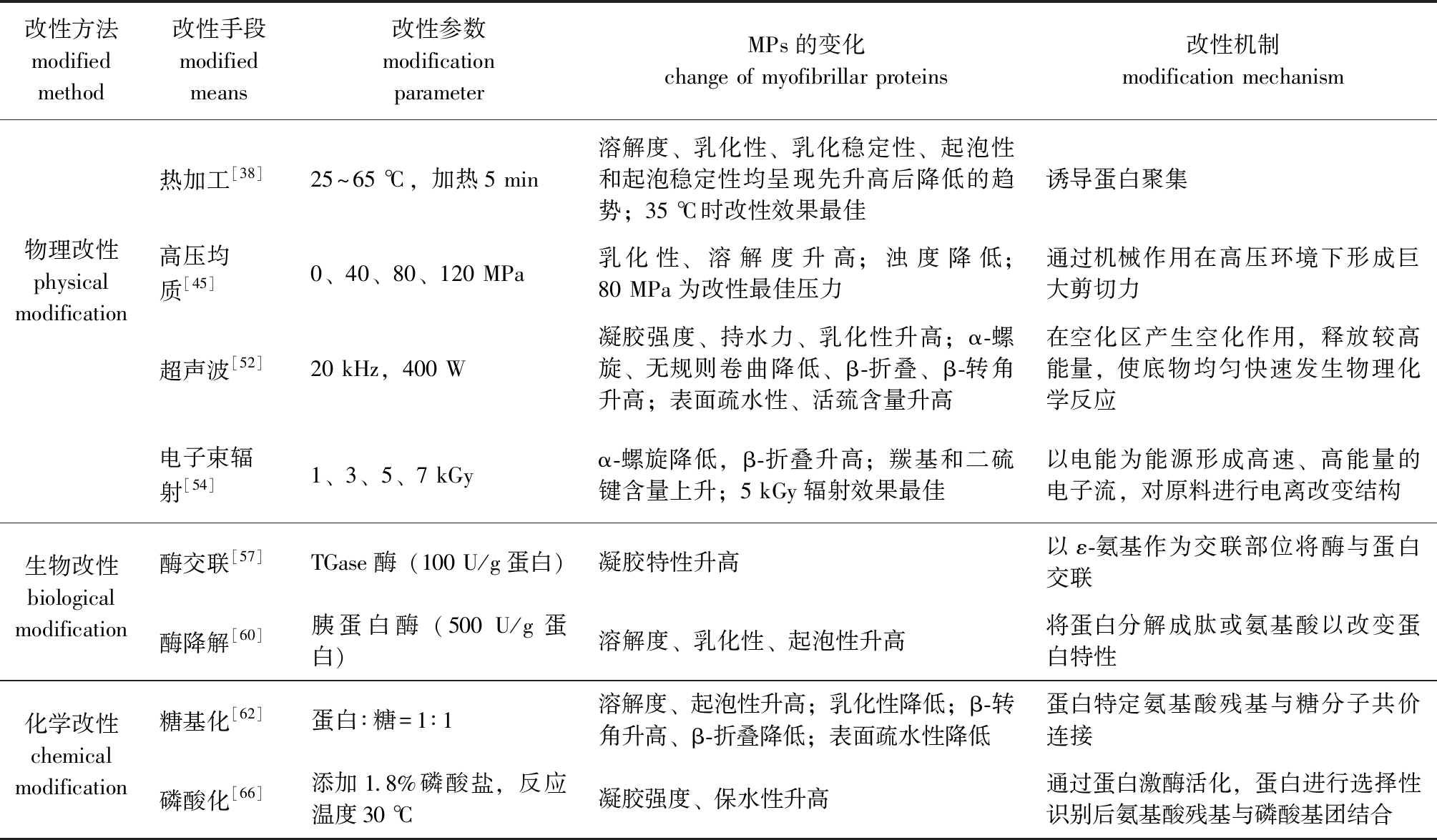
改性方法modified method改性手段modified means改性参数modification parameterMPs的变化change of myofibrillar proteins改性机制modification mechanism物理改性physical modification热加工[38]25~65 ℃,加热5 min溶解度、乳化性、乳化稳定性、起泡性和起泡稳定性均呈现先升高后降低的趋势;35 ℃时改性效果最佳诱导蛋白聚集高压均质[45]0、40、80、120 MPa乳化性、溶解度升高;浊度降低;80 MPa为改性最佳压力通过机械作用在高压环境下形成巨大剪切力超声波[52]20 kHz,400 W凝胶强度、持水力、乳化性升高;α-螺旋、无规则卷曲降低、β-折叠、β-转角升高;表面疏水性、活巯含量升高在空化区产生空化作用,释放较高能量,使底物均匀快速发生物理化学反应电子束辐射[54]1、3、5、7 kGyα-螺旋降低,β-折叠升高;羰基和二硫键含量上升;5 kGy辐射效果最佳以电能为能源形成高速、高能量的电子流,对原料进行电离改变结构生物改性biological modification酶交联[57]TGase酶(100 U/g蛋白)凝胶特性升高以ε-氨基作为交联部位将酶与蛋白交联酶降解[60]胰蛋白酶(500 U/g蛋白)溶解度、乳化性、起泡性升高将蛋白分解成肽或氨基酸以改变蛋白特性化学改性chemical modification糖基化[62]蛋白∶糖=1∶1溶解度、起泡性升高;乳化性降低;β-转角升高、β-折叠降低;表面疏水性降低蛋白特定氨基酸残基与糖分子共价连接磷酸化[66]添加1.8%磷酸盐,反应温度30 ℃凝胶强度、保水性升高通过蛋白激酶活化,蛋白进行选择性识别后氨基酸残基与磷酸基团结合
3.1.1 热处理 热处理操作简单,可实现性高,常见的热处理包括传统加热、高压加热、低压耦合加热、微波加热和射频加热[36]。热处理是诱导MPs凝胶化的主要方法,但过度热处理会影响蛋白内部水分迁移,使紧密的蛋白凝胶结构变得较为松散。
在传统加热下,维持MPs分子结构的共价键被破坏,导致蛋白结构展开或折叠,功能特性发生改变。流变学检测发现,当温度上升至40 ℃时,草鱼MPs凝胶弹性最佳,这是由于温度升高导致蛋白中氢键不断展开,暴露表面活性位点,增加了分子间相互作用力,从而促进了蛋白凝胶的形成[37];陈琼希[38]研究表明,随着加热温度的升高,鱼肉蛋白溶解度和乳化性均呈现先增大后减小的趋势,在35 ℃时达到最优状态。高压热处理可使蛋白氢键和疏水键含量得到显著提升,促进了MPs网络凝胶结构的形成[39]。在低压耦合热处理中,Zhou等[40]选择100 MPa与二段加热处理相结合作为改性条件,结果发现,低压耦合热处理后蛋白β-折叠含量升高,暴露出了更多的酪氨酸残基,从而蛋白通过疏水相互作用形成较小孔隙和较多水孔的蜂窝状网络凝胶结构,使MPs具有更高的凝胶强度。随着加热时间的延长,MPs与腥味物质的吸附能力呈先增高后降低的趋势,这是由于蛋白加热后结构展开暴露疏水基团等作用位点,使MPs与腥味物质的相互作用增强,但疏水基团的过度暴露也会提高蛋白之间的相互作用,减少风味物质的结合位点,使结合能力下降[41]。
微波和射频技术作为能耗低、效率高的新热处理手段受到广泛关注。在微波辐射下,MPs中的极性基团不断吸收能量产生大量活性自由基,导致MPs中α-螺旋转变为β-折叠和β-转角,诱导蛋白结构内部发生变化[42]。微波加热改变二硫键和非二硫键的交联程度对鱼糜特性进行改善。例如,当功率为15 W/g时凝胶效果更好,鱼糜凝胶更加致密均匀[43]。射频技术通过电磁波对蛋白极性分子进行重排,诱导MPs氢键含量升高,从而改善MPs凝胶强度与持水力[44]。
3.1.2 非热处理 常见的非热处理包括高压均质、超声和电子束辐射。
1)高压均质。通过高压作用下的剪切和空化作用对蛋白结构进行改性,使样品更加均匀地分散在体系中,可改善蛋白的凝胶特性、乳化特性及界面性质,操作简单,可实现性高,易于工业化生产,故受到广泛关注。高压条件对蛋白改性结果影响明显。如分别在0、40、80和120 MPa压力下均质处理牡蛎,可有效提高MPs乳化特性[45];在60 MPa高压均质下诱导鳙,其MPs结构发生折叠从而改善其凝胶性[46];高压均质处理栉孔扇贝[47]和蛤蜊[48],均可有效提高其蛋白乳化性和溶解性。但随着高压均质处理次数的增加,MPs结构被修饰为短且细的丝状,生成部分低聚体蛋白,当高压均质次数持续增大时,丝状蛋白结构在剧烈机械作用下形成大颗粒的不规则聚集物,使MPs功能特性减弱[49]。
2)超声。超声处理耗能较低且不会影响原料营养品质,是一种能产生强大剪切力并对分子进行压缩的机械波[50]。超声处理通过空化作用破坏蛋白结构,减小蛋白颗粒尺寸,引起蛋白改性从而提高蛋白乳化能力[51]。因水产动物MPs的乳化性能较低,该处理方式为乳化肉糜产品商业化生产提供了参考依据。如采用20 kHz、400 W条件对冷冻虾蛋白进行超声波处理后发现,蛋白粒径减小,α-螺旋转变为β-折叠,蛋白乳化能力和稳定性显著提升[52];高强度的超声处理可提高贻贝蛋白的功能特性,尤其是在20 kHz、600 W下超声处理20 min,可以观察到质地更加均匀的乳液[53]。
3)电子束辐射。该处理对产品感官特性影响较低,因其绿色环保并可延长产品货架期,以及在不影响食品感官的前提下可提高食品品质,在食品等领域受到广泛关注。电子束辐射以电作为能源,不借助放射性元素对蛋白构象进行改变,从而引起蛋白变性。电子束辐射引起鲈MPs中α-螺旋向β-折叠的结构转变,较低剂量的辐射处理将对鱼肉起到保鲜效果[54]。当电子束处理条件为5 kGy时,梅鱼MPs凝胶结构最佳[55];辐射参数为3~5 kGy时,泥蚶的质地得到显著改善[56]。
3.2 酶改性
酶改性包括酶交联和酶降解,酶交联主要采用谷氨酰胺转氨酶(transglutaminase,TGase)催化谷氨酸和赖氨酸之间的酰基转移反应,增强蛋白分子内或组间交联,形成稳定的蛋白网络结构。Liang等[57]以中华绒螯蟹为原料,采用TGase酶催化蛋白非二硫键共价键的形成,从而形成高分子量聚合物和部分肌球蛋白重链。在黄花鱼腌制液中添加不同浓度TGase酶,可促进肌球蛋白重链的交联,当添加量为1.0%时,可形成致密的膜结构[58]。TGase酶对水产品凝胶特性的提升具有显著改性作用。Chen等[59]使用TGase酶和明胶-卡拉胶混合物进行双重交联得到了热稳定性更优的凝胶。酶降解研究中,常选用胰蛋白酶、中性蛋白酶和复合酶对水产动物MPs进行改性。如选用胰蛋白酶对鲢改性20 min时,MPs的乳化稳定性最佳,这主要是由于酶解导致蛋白内部疏水基团被大量暴露在外,表面电荷也随着酶解的进行而增大,使MPs乳化性得到显著改善[60]。
3.3 化学改性
3.3.1 糖基化 糖基化改性指蛋白通过美拉德反应将氨基酸侧链与糖的羰基结合形成糖-蛋白复合物,多糖种类、分子量大小和糖基化时间对改性结果具有显著影响,不同糖基化位点及作用效果会对蛋白折叠产生影响,进而影响蛋白稳定性及其他功能特性[61]。荣婧等[62]选择葡聚糖、褐藻寡糖、葡萄糖和乳糖作为糖供体进行鸢乌贼MPs修饰,结果发现,糖-蛋白复合物展现的溶解性存在显著差异。这是由于糖供体与MPs结合,抑制肌球蛋白尾部形成不溶性细丝的能力,且蛋白内部氨基酸的暴露利于MPs亲水性的提升,溶解性间接升高,但不同糖供体将影响氨基酸暴露程度,因此,不同的糖-蛋白复合物呈现功能特性差异。小分子量的葡萄糖与鲢MPs形成的复合物与麦芽糊精相比,具备更优的溶解性,而麦芽糊精-蛋白复合物的热稳定性和乳化性更高[63]。随糖基化时间的延长,鲢蛋白β-折叠增多,形成更均匀的凝胶结构[64]。
3.3.2 磷酸化 MPs中丝氨酸、苏氨酸等氨基酸的特定氧原子或赖氨酸的氮原子与磷酸发生酯化反应,经磷酸化修饰后蛋白体系的电负性发生改变,使蛋白分子互相排斥解离,蛋白等电点降低使其结构及特性更加稳定,利于工业化生产。将磷酸根引入蛋白磷酸化改性后,可有效提高蛋白分子之间离子键的强度,改善MPs凝胶强度及其他特性。如南极磷虾蛋白磷酸化可有效提升其溶解性、乳化性和乳化稳定性,这是由于蛋白表面电荷的改变及蛋白内部疏水基团的暴露,降低了蛋白乳状液表面张力[65]。磷酸化修饰可提升虾蛄与鸡肉MPs的凝胶性,且虾蛄的凝胶保水性优于鸡肉[66]。
3.4 复合改性方法及应用
淀粉及纤维素等大分子物质作用于蛋白内部,可提升水产品的凝胶特性和风味。如以南极磷虾和南美白对虾为原料,添加羟丙基木薯淀粉能使虾肉凝胶特性得到显著提升[67];添加魔芋粉能显著改善鲤MPs的弹性且对白度不产生影响[68]。在分子对接研究中发现,蛋白与配体结合产生的相互作用力将影响蛋白构象发生变化进而影响MPs的特性,植物多酚中表没食子儿茶素没食子酸酯通过与鲢蛋白形成氢键和疏水作用影响蛋白二级和三级结构,使蛋白结构展开进而显著提高MPs的凝胶特性[69]。
物理改性方法操作简单,对蛋白营养特性影响较小。而糖基化等化学改性方法是通过改变蛋白内部功能基团使蛋白化学特性改变进而影响蛋白结构。多种改性方法的复合可以改善单一改性的缺陷,具有针对性强、改性效果更佳的特点。复合改性方法不仅可以获得结构更致密、性质更稳定的蛋白,还能改变传统加工方式,为生产新型个性化产品提供新思路。因此,可依据产品生产实际需求选择更有效的改性方法及合适的改性条件对MPs进行修饰。目前,复合的改性方法在水产动物MPs改性方面也开展了一些研究工作和应用(表4),多集中在凝胶特性改良方面。
表4 水产动物MPs的复合改性方法及应用
Tab.4 Method and application of aquatic animal myofibrillar proteins by combined modification
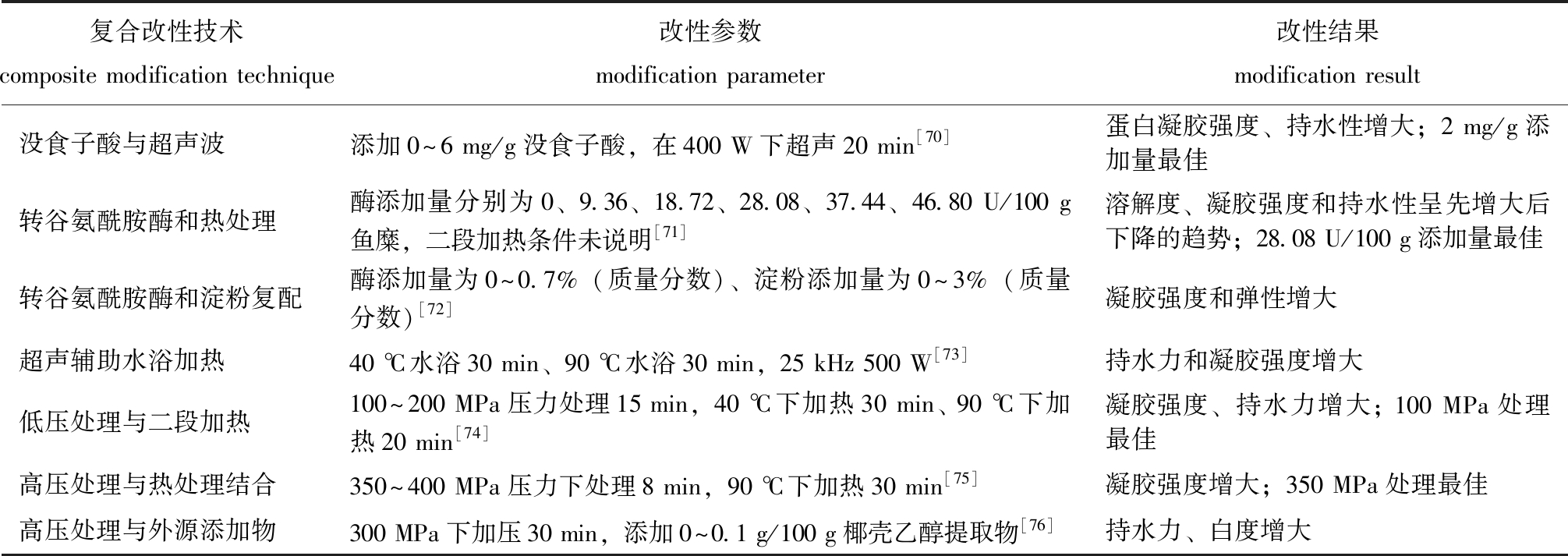
复合改性技术composite modification technique改性参数modification parameter改性结果modification result没食子酸与超声波添加0~6 mg/g没食子酸,在400 W下超声20 min[70]蛋白凝胶强度、持水性增大;2 mg/g添加量最佳转谷氨酰胺酶和热处理酶添加量分别为0、9.36、18.72、28.08、37.44、46.80 U/100 g鱼糜,二段加热条件未说明[71]溶解度、凝胶强度和持水性呈先增大后下降的趋势;28.08 U/100 g添加量最佳转谷氨酰胺酶和淀粉复配酶添加量为0~0.7%(质量分数)、淀粉添加量为0~3%(质量分数)[72]凝胶强度和弹性增大超声辅助水浴加热40 ℃水浴30 min、90 ℃水浴30 min,25 kHz 500 W[73]持水力和凝胶强度增大低压处理与二段加热100~200 MPa压力处理15 min,40 ℃下加热30 min、 90 ℃下加热20 min[74]凝胶强度、持水力增大; 100 MPa处理最佳高压处理与热处理结合350~400 MPa压力下处理8 min,90 ℃下加热30 min[75]凝胶强度增大;350 MPa处理最佳高压处理与外源添加物300 MPa下加压30 min,添加0~0.1 g/100 g椰壳乙醇提取物[76]持水力、白度增大
4 存在问题及展望
通过改性方法对水产动物MPs的结构进行修饰,可达到提升凝胶特性、乳化特性、溶解性和风味吸附性的效果,实现水产动物蛋白的高值化利用。然而,要实现水产动物蛋白改性方法在产品生产上的应用和市场化还有一定距离。首先,除传统加热外,其他改性方法仅集中在实验室或中试阶段,缺少工业化、规模化的应用,尤其是化学和酶学改性方法,研究对象多为单一的MPs,而复杂体系下食品基质对MPs改性的影响研究尚不够深入;其次,改性方法对蛋白营养品质及安全性的影响鲜有研究,改性后产品的感官品质、营养学和毒理学问题均未得到充分验证,同时也未预测消费者对改性产品的可接受性。针对上述存在问题,未来需要对改性方法及其对蛋白结构和营养特性的影响进行大量研究,包括以下几个方面。
4.1 开展MPs修饰位点测定方法及调控机制研究
利用傅里叶红外光谱技术、内源荧光光谱、原子力显微镜、核磁共振成像和扫描电镜等检测技术对水产动物(如鱼类、虾类)MPs蛋白构象及微观结构进行分析。但受试验条件、蛋白来源和蛋白浓度等因素影响,准确评估改性方法对MPs修饰的影响机制较为困难。因此,开发更加精确的方法来鉴定MPs中改性位点和结合类型,将有助于理解MPs的修饰机制,进而确定MPs结合位点的三维结构,为MPs改性设计空间位点、揭示MPs改性作用机制提供依据。此外,借助质谱解析等技术手段,确定蛋白发生修饰的变化位点并进行精准鉴定,可以确保改性手段对蛋白进行靶向精准修饰。
4.2 加大新型物理方法及其复合改性方法在水产动物MPs改性上的应用
采用更简单、更安全和更环保的新型物理技术,如微波、射频、低温等离子体、超微粉碎和脉冲电场等,将MPs溶解在水或低离子强度溶液中,并在不使用高盐溶液的情况下提高MPs功能特性,或采用3D打印等工程化食品加工技术开发新型产品。通过这些方法处理的MPs不含危害残留物,具有较高安全性;同时,其外观、感官品质、营养价值和消化特性也将得到显著提升,提高消费者的接受程度。
4.3 深入了解改性蛋白食品与其感官特征间可能存在的相关性
人体膳食中至关重要的蛋白是风味物质的最佳吸附载体,内外源因素使其改性后蛋白结构发生变化,在很大程度上影响着蛋白食品的品质,但仍需系统探究风味物质的调控机制。不同改性修饰手段对蛋白的结构和功能具有差异性调控作用,借助多变量或多种改性方法协同改性MPs,能够最大限度地保持食品原有的感官特征及营养特性,为深加工及精加工技术的发展提供理论依据。改性后蛋白食品良好风味的保持是目前的研究热点,借助电子鼻风味分析和口腔唾液模拟等数学模型预测消费者的可接受性,为改善水产品感官品质、构建更健康的产品提供了有益参考。
总之,MPs作为水产动物蛋白中的关键成分,具有非常重要的研究价值和应用前景,在未来的研究中应深入解释改性MPs结构与功能特性之间的关系,建立更加新颖精准的方法分析MPs改性修饰机制,为水产动物MPs的高值化利用和推广提供新思路、新方向。
[1] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2023中国渔业统计年鉴[M].北京:中国农业出版社,2023.Bureau of Fisheries,Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2023 China fishery statistical yearbook[M].Beijing: China Agriculture Press,2023.(in Chinese)
[2] GE G,HAN Y R,ZHENG J B,et al.Physicochemical characteristics and gel-forming properties of myofibrillar protein in an oxidative system affected by partial substitution of NaCl with KCl,MgCl2 or CaCl2[J].Food Chemistry,2020,309:125614.
[3] WANG Y D,ZHUANG Y,YAN H,et al.The influence of pH and monovalent/divalent cations on the structural and physicochemical properties of myofibrillar protein from silver carp[J].Food Chemistry,2023,404:134519.
[4] 王海蜂.超声波改性对鱼源肌原纤维蛋白功能特性的调控机制研究[D].杭州:浙江工商大学,2022.WANG H F.Study on the regulation mechanism of ultrasonic modification on the functional properties of myofibrillar protein extracted from fish[D].Hangzhou:Zhejiang Gongshang University,2022.(in Chinese)
[5] XU Y J,XU X L.Modification of myofibrillar protein functional properties prepared by various strategies:a comprehensive review[J].Comprehensive Reviews in Food Science and Food Safety,2021,20(1):458-500.
[6] LI Y L,XU Y J,XU X L,et al.Continuous cyclic wet heating glycation to prepare myofibrillar protein-glucose conjugates: a study on the structures, solubility and emulsifying properties[J].Food Chemistry, 2022,388: 1-11.
[7] 陈梅珍,陈旭,蔡茜茜,等.典型加工条件下鱼糜肌原纤维蛋白品质变化规律及调控方法研究进展[J].食品科学,2022,43(11):204-213.CHEN M Z,CHEN X,CAI X X,et al.Research advances in the quality changes and control methods of surimi myofibrillar protein under typical processing conditions[J].Food Science,2022,43(11):204-213.(in Chinese)
[8] 潘世玲.鲤、草、鲢、鳙加工冷冻生鱼糜的特性研究[D].北京:中国农业大学,2003:3-4.PAN S L.Processing characteristics of common carp,grass carp,silver carp and bighead carp for manufacturing frozen surimi[D].Beijing:China Agricultural University,2003:3-4.(in Chinese)
[9] 丁玉庭.鲢鳙鳊鲫鱼肉的蛋白质组成及分离研究[J].水产科学,1999,18(3):21-25.DING Y T.Studies on muscle protein compositions in several Chinese freshwater fishes[J].Fisheries Science,1999,18(3):21-25.(in Chinese)
[10] HE D,YI X Z,XIA G H,et al.Effects of fish oil on the gel properties and emulsifying stability of myofibrillar proteins:a comparative study of tilapia,hairtail and squid[J].LWT,2022,161:113373.
[11] HAN K Y,LI S S,YANG Y L,et al.Mechanisms of inulin addition affecting the properties of chicken myofibrillar protein gel[J].Food Hydrocolloids,2022,131:107843.
[12] LU W W,WU D,WANG L M,et al.Insoluble dietary fibers from Lentinus edodes stipes improve the gel properties of pork myofibrillar protein:a water distribution,microstructure and intermolecular interactions study[J].Food Chemistry,2023,411:135386.
[13] ZHANG X H,XIE W X,LIANG Q Q,et al.High inner phase emulsion of fish oil stabilized with rutin-grass carp (Ctenopharyngodon idella) myofibrillar protein:application as a fat substitute in surimi gel[J].Food Hydrocolloids,2023,145:109115.
[14] YU M M,FAN Y C,LI D Y,et al.Differences in texture and digestive properties of different parts in boiled abalone muscles[J].Food Chemistry,2023,404:134514.
[15] 周逸,金淼,徐亦及,等.秘鲁鱿鱼肌原纤维蛋白提取和加热条件对其凝胶特性的影响[J].食品科学,2013,34(14):126-130.ZHOU Y,JIN M,XU Y J,et al.Effects of extraction and heating conditions on gel characteristics of Dosidicus gigas myofibrillar protein[J].Food Science,2013,34(14):126-130.(in Chinese)
[16] TAN Y Q,GAO H R,CHANG S K C,et al.Comparative studies on the yield and characteristics of myofibrillar proteins from catfish heads and frames extracted by two methods for making surimi-like protein gel products[J].Food Chemistry,2019,272:133-140.
[17] ZHANG M,FAN L P,LIU Y F,et al.Effects of proteins on emulsion stability:the role of proteins at the oil-water interface[J].Food Chemistry,2022,397:133726.
[18] 聂若彤,魏相茹,张德权,等.肉制品中蛋白质、脂质及其相互作用吸附挥发性风味物质机理研究进展[J].肉类研究,2023,37(4):41-47.NIE R T,WEI X R,ZHANG D Q,et al.Mechanism of adsorption of volatile flavor compounds by proteins,lipids and their interaction in meat products:a review[J].Meat Research,2023,37(4):41-47.(in Chinese)
[19] 王卉楠,励建荣,李学鹏,等.鱼糜组分间相互作用对其凝胶特性影响的研究进展[J].中国食品学报,2022,22(9):365-375.WANG H N,LI J R,LI X P,et al.Research progress on the effect of component interactions on the gel properties of surimi[J].Journal of Chinese Institute of Food Science and Technology,2022,22(9):365-375.(in Chinese)
[20] 冯佳雯,郑云芳,张芳,等.超声处理对鲈鱼肌原纤维蛋白结构和功能特性的影响[J].食品工业科技,2022,43(17):95-103.FENG J W,ZHENG Y F,ZHANG F,et al.Effect of ultrasonic treatment on the structure and functional properties of myofibrillar protein in sea bass[J].Science and Technology of Food Industry,2022,43(17):95-103.(in Chinese)
[21] 吴海潇,张宾,史周荣,等.卡拉胶寡糖对冷冻南美白对虾的抗冻保水作用[J].食品科学,2017,38(7):260-265.WU H X,ZHANG B,SHI Z R,et al.Cryoprotective effects of carrageenan oligosaccharides on Pacific white shrimp(Litopenaeus vannamei) during frozen storage[J].Food Science,2017,38(7):260-265.(in Chinese)
[22] 仇超颖,荣婧,胡晓,等.单宁酸对鸢乌贼肌原纤维蛋白膜性能的影响[J].食品科学,2019,40(14):29-35.QIU C Y,RONG J,HU X,et al.Effect of tannic acid on the performance of squid (Symplectoteuthis oualaniensis) myofibrillar protein films[J].Food Science,2019,40(14):29-35.(in Chinese)
[23] TANG Y,JIANG H,WU H T,et al.Fabrication and physicochemical characterization of Pseudosciaena crocea roe protein-stabilized emulsions as a nutrient delivery system[J].Journal of Food Science,2019,84(6):1346-1352.
[24] KIESERLING H,PANKOW A,KEPPLER J K,et al.Conformational state and charge determine the interfacial film formation and film stability of β-lactoglobulin[J].Food Hydrocolloids,2021,114:106561.
[25] MA K K,GREIS M,LU J K,et al.Functional performance of plant proteins[J].Foods,2022,11(4):594.
[26] WU Y,LI Y F,WANG R H,et al.Characterization of a novel food grade emulsion stabilized by the by- product proteins extracted from the head of giant freshwater prawn (Macrobrachium rosenbergii)[J].Frontiers in Nutrition,2021,8:676500.
[27] 郑云芳,李晨,张芳,等.热处理对鲈鱼肌原纤维蛋白结构及功能特性的影响[J].福州大学学报(自然科学版),2022,50(1):139-146.ZHENG Y F,LI C,ZHANG F,et al.Study on the relationship between structure and function of myofibrillar protein in Lateolabrax japonicus based on thermal treatment[J].Journal of Fuzhou University (Natural Science Edition),2022,50(1):139-146.(in Chinese)
[28] 李德阳,侯雅文,黄颖,等.NaCl对大菱鲆肌原纤维蛋白特性的影响[J].食品科学,2018,39(16):61-67.LI D Y,HOU Y W,HUANG Y,et al.Effect of NaCl on properties of myofibrillar protein from turbot(Scophthalmus maximus)[J].Food Science,2018,39(16):61-67.(in Chinese)
[29] ZHANG J,KANG D C,ZHANG W G,et al.Recent advantage of interactions of protein-flavor in foods:perspective of theoretical models,protein properties and extrinsic factors[J].Trends in Food Science &Technology,2021,111:405-425.
[30] WANG H T,ZHU J M,ZHANG H W,et al.Understanding interactions among aldehyde compounds and porcine myofibrillar proteins by spectroscopy and molecular dynamics simulations[J].Journal of Molecular Liquids,2022,349:118190.
[31] WANG H T,GUAN H N,ZHANG H W,et al.Elucidation of interaction mechanisms between myofibrillar proteins and ethyl octanoate by SPME-GC-MS,molecular docking and dynamics simulation[J].LWT,2022,154:112787.
[32] XU Y X,LV Y N,YIN Y M,et al.Improvement of the gel properties and flavor adsorption capacity of fish myosin upon yeast β-glucan incorporation[J].Food Chemistry,2022,397:133766.
[33] TOM A S,PIRES C,BATISTA I,et al.Protein gels and emulsions from mixtures of Cape hake and pea proteins[J].Journal of the Science of Food and Agriculture,2015,95(2):289-298.
A S,PIRES C,BATISTA I,et al.Protein gels and emulsions from mixtures of Cape hake and pea proteins[J].Journal of the Science of Food and Agriculture,2015,95(2):289-298.
[34] LUO Y K,KUWAHARA R,KANENIWA M,et al.Comparison of gel properties of surimi from Alaska pollock and three freshwater fish species:effects of thermal processing and protein concentration[J].Journal of Food Science,2001,66(4):548-554.
[35] XUE C F,PEI Z S,WEN P,et al.Effects of pH and NaCl on the spatial structure and conformation of myofibrillar proteins and the emulsion gel system-insights from computational molecular dynamics on myosin of golden pompano[J].Gels,2023,9(4):270.
[36] ZINK J,WYROBNIK T,PRINZ T,et al.Physical,chemical and biochemical modifications of protein-based films and coatings:an extensive review[J].International Journal of Molecular Sciences,2016,17(9):1376.
[37] HUANG J J,ZENG S W,XIONG S B,et al.Steady,dynamic,and creep-recovery rheological properties of myofibrillar protein from grass carp muscle[J].Food Hydrocolloids,2016,61:48-56.
[38] 陈琼希.不同处理方式对鲢鱼鱼肉蛋白的影响研究[D].天津:天津科技大学,2012.CHEN Q X.Study on effects of different treatments on silver carp protein[D].Tianjin:Tianjin University of Science &Technology,2012.(in Chinese)
[39] VELAZQUEZ G,M NDEZ-MONTEALVO M G,WELTI-CHANES J,et al.Effect of high pressure processing and heat treatment on the gelation properties of blue crab meat proteins[J].LWT,2021,146:111389.
NDEZ-MONTEALVO M G,WELTI-CHANES J,et al.Effect of high pressure processing and heat treatment on the gelation properties of blue crab meat proteins[J].LWT,2021,146:111389.
[40] ZHOU A M,CHEN H Q,ZOU Y Q,et al.Insight into the mechanism of optimal low-level pressure coupled with heat treatment to improve the gel properties of Nemipterus virgatus surimi combined with water migration[J].Food Research International,2022,157:111230.
[41] 徐永霞,王瑞,李学鹏,等.热处理对鱼肌原纤维蛋白结构及腥味物质结合能力的影响[J].中国食品学报,2020,20(9):131-138.XU Y X,WANG R,LI X P,et al.Effects of heat treatment on the structure of myofibrillar protein and binding ability with fishy odor compounds[J].Journal of Chinese Institute of Food Science and Technology,2020,20(9):131-138.(in Chinese)
[42] 郭扬凯,陈丽丽,冯娇娇,等.微波加热对乳清分离蛋白功能特性的影响及机制研究[J].食品工业科技,2021,42(18):25-33.GUO Y K,CHEN L L,FENG J J,et al.Effect and mechanism of microwave heating on the functional properties of whey protein isolate[J].Science and Technology of Food Industry,2021,42(18):25-33.(in Chinese)
[43] FU X J,HAYAT K,LI Z H,et al.Effect of microwave heating on the low-salt gel from silver carp (Hypophthalmichthys molitrix) surimi[J].Food Hydrocolloids,2012,27(2):301-308.
[44] WANG L M,WANG X,MA J,et al.Effects of radio frequency heating on water distribution and structural properties of grass carp myofibrillar protein gel[J].Food Chemistry,2021,343:128557.
[45] WU F,SHI X J,ZOU H N,et al.Effects of high-pressure homogenization on physicochemical,rheological and emulsifying properties of myofibrillar protein[J].Journal of Food Engineering,2019,263:272-279.
[46] NIE X H,LIU H Z,YU N X,et al.Effect of high pressure homogenization on aggregation,conformation,and interfacial properties of bighead carp myofibrillar protein[J].Journal of Food Science,2021,86(12):5318-5328.
[47] WU D,WU C,WANG Z Y,et al.Effects of high pressure homogenize treatment on the physicochemical and emulsifying properties of proteins from scallop (Chlamys farreri)[J].Food Hydrocolloids,2019,94:537-545.
[48] SHI X J,ZOU H N,SUN S,et al.Application of high-pressure homogenization for improving the physicochemical,functional and rheological properties of myofibrillar protein[J].International Journal of Biological Macromolecules,2019,138:425-432.
[49] 李雨枫,薛思雯,陈星,等.高压均质处理次数对肌原纤维蛋白水溶液结构及理化特性的影响[J].食品科学,2019,40(15):127-134.LI Y F,XUE S W,CHEN X,et al.Changes in structure and physicochemical properties of myofibrillar proteins subjected to different cycles of high pressure homogenization treatment[J].Food Science,2019,40(15):127-134.(in Chinese)
[50] RASTOGI N K.Opportunities and challenges in application of ultrasound in food processing[J].Critical Reviews in Food Science and Nutrition,2011,51(8):705-722.
[51] YANG J,HUANG F H,HUANG Q D,et al.Physical and emulsifying properties of pea protein:influence of combined physical modification by flaxseed gum and ultrasonic treatment[J].Food Science and Human Wellness,2023,12(2):431-441.
[52] LI J,DAI Z C,CHEN Z H,et al.Improved gelling and emulsifying properties of myofibrillar protein from frozen shrimp (Litopenaeus vannamei) by high-intensity ultrasound[J].Food Hydrocolloids,2023,135:108188.
[53] ZOU H N,ZHAO N,SUN S,et al.High-intensity ultrasonication treatment improved physicochemical and functional properties of mussel sarcoplasmic proteins and enhanced the stability of oil-in-water emulsion[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects,2020,589:124463.
[54] 张晗,高星,宣仕芬,等.电子束辐照对鲈鱼肉肌原纤维蛋白生化特性及其构象的影响[J].食品科学,2019,40(13):81-86.ZHANG H,GAO X,XUAN S F,et al.Effect of electron beam irradiation on biochemical properties and structure of myofibrillar protein from Lateolabrax japonicus meat[J].Food Science,2019,40(13):81-86.(in Chinese)
[55] 邓思瑶,杨文鸽,徐大伦,等.电子束辐照对梅鱼鱼糜肌原纤维蛋白结构及凝胶特性的影响[J].现代食品科技,2017,33(1):139-144,172.DENG S Y,YANG W G,XU D L,et al.Effects of electron beam irradiation on the myofibrillar protein structure and gel properties of Collichthys lucidus surimi[J].Modern Food Science and Technology,2017,33(1):139-144,172.(in Chinese)
[56] LV M C,MEI K L,ZHANG H,et al.Effects of electron beam irradiation on the biochemical properties and structure of myofibrillar protein from Tegillarca granosa meat[J].Food Chemistry,2018,254:64-69.
[57] LIANG F,LIN L,HE T H,et al.Effect of transglutaminase on gel properties of surimi and precocious Chinese mitten crab (Eriocheir sinensis) meat[J].Food Hydrocolloids,2020,98:105261.
[58] HUANG L,SHI L F,REN Z Y,et al.Effect of transglutaminase concentration in curing solution on the physicochemical properties of salted large yellow croaker (Pseudosciaena crocea)[J].Food Chemistry:X,2022,14:100277.
[59] CHEN H R,WU D,MA W C,et al.Strong fish gelatin hydrogels double crosslinked by transglutaminase and carrageenan[J].Food Chemistry,2022,376:131873.
[60] 刘书来,周欢,何小庆,等.限制性酶解改性鲢鱼肌原纤维蛋白功能性质的研究[J].核农学报,2017,31(1):110-117.LIU S L,ZHOU H,HE X Q,et al.Functional properties of silver carp myofibril protein by limited enzymolysis[J].Journal of Nuclear Agricultural Sciences,2017,31(1):110-117.(in Chinese)
[61] SUN F Y,HUANG Q L,HU T,et al.Effects and mechanism of modified starches on the gel properties of myofibrillar protein from grass carp[J].International Journal of Biological Macromolecules,2014,64:17-24.
[62] 荣婧,仇超颖,胡晓,等.鸢乌贼肌原纤维蛋白糖基化产物功能特性研究[J].南方水产科学,2018,14(1):68-76.RONG J,QIU C Y,HU X,et al.Functional properties of glycosylated myofibrillar proteins from purple back flying squids(Symplectoteuthis oualaniensis)[J].South China Fisheries Science,2018,14(1):68-76.(in Chinese)
[63] LIU S L,ZHAO P C,ZHANG J J,et al.A comparative study of physicochemical and functional properties of silver carp myofibrillar protein glycated with glucose and maltodextrin[J].RSC Advances,2017,7(2):1008-1015.
[64] LIU S L,ZHAO P C,ZHANG J J,et al.Physicochemical and functional properties of silver carp (Hypophthalmichthys molitrix) myofibrillar protein glycated with konjac oligo-glucomannan[J].Food Hydrocolloids,2017,67:216-223.
[65] 戚亭,刘宝林,刘志东,等.磷酸化改性对南极磷虾蛋白功能特性的影响[J].食品安全质量检测学报,2018,9(8):1829-1833.QI T,LIU B L,LIU Z D,et al.Effects of phosphorylation modification on the functional properties of Antarctic krill protein[J].Journal of Food Safety &Quality,2018,9(8):1829-1833.(in Chinese)
[66] 王诗萌,张坤生,任云霞.鸡肉与虾蛄中肌原纤维蛋白磷酸化特性的比较[J].食品与发酵工业,2015,41(9):24-28.WANG S M,ZHANG K S,REN Y X.Contradistinction to the gelling properties of chicken and squilla by phosphorylation[J].Food and Fermentation Industries,2015,41(9):24-28.(in Chinese)
[67] 刘莹,傅宝尚,姜鹏飞,等.羟丙基木薯淀粉对南极磷虾混合虾糜3D打印特性及凝胶特性的影响[J].食品与发酵工业,2022,48(21):180-187.LIU Y,FU B S,JIANG P F,et al.Effects of hydroxypropyl cassava starch on 3D printing and gel properties of Antarctic krill mixed shrimp surimi[J].Food and Fermentation Industries,2022,48(21):180-187.(in Chinese)
[68] 杨振,孔保华,夏秀芳,等.魔芋粉对鲤鱼肌原纤维蛋白凝胶特性的影响[J].食品科学,2012,33(11):116-120.YANG Z,KONG B H,XIA X F,et al.Influence of konjac flour on gel properties of myofibrillar proteins from common carp[J].Food Science,2012,33(11):116-120.(in Chinese)
[69] 裘乐芸,邢倩,邓泽元,等.植物多酚与鲢鱼肌球蛋白相互作用及其对肌原纤维蛋白结构和凝胶形成的影响[J].中国食品学报,2021,21(5):48-56.QIU L Y,XING Q,DENG Z Y,et al.The interaction of plant polyphenols with silver carp myosin and its effects on the structure and gel formation of myofibrillar protein[J].Journal of Chinese Institute of Food Science and Technology,2021,21(5):48-56.(in Chinese)
[70] 李颖畅,师丹华,张馨元,等.超声波辅助没食子酸改善海鲈鱼肌原纤维蛋白的凝胶性能[J].食品科学,2022,43(11):82-91.LI Y C,SHI D H,ZHANG X Y,et al.Gallic acid combined with ultrasound treatment improves the gel properties of Lateolabrax japonicas myofibrillar protein[J].Food Science,2022,43(11):82-91.(in Chinese)
[71] 贾丹,刘茹,刘明菲,等.转谷氨酰胺酶对鳙鱼糜热诱导胶凝特性的影响[J].食品科学,2013,34(9):37-41.JIA D,LIU R,LIU M F,et al.Effect of transglutaminase on heat-induced gel properties of bighead carp (Aristichthys nobilis) surimi[J].Food Science,2013,34(9):37-41.(in Chinese)
[72] 夏秀芳,王博,伊东,等.转谷氨酰胺酶和淀粉复配对肌原纤维蛋白凝胶特性的影响[J].中国食品学报,2016,16(6):51-56.XIA X F,WANG B,YI D,et al.Effects of transglutaminase and potato starch compound on the gel properties of common carp myofibrillar protein[J].Journal of Chinese Institute of Food Science and Technology,2016,16(6):51-56.(in Chinese)
[73] HE X L,LV Y N,LI X P,et al.Improvement of gelation properties of silver carp surimi through ultrasound-assisted water bath heating[J].Ultrasonics Sonochemistry,2022,83:105942.
[74] CHEN H Q,ZHOU A M,BENJAKUL S,et al.The mechanism of low-level pressure coupled with heat treatment on water migration and gel properties of Nemipterus virgatus surimi[J].LWT,2021,150:112086.
[75] CHEN Y T,XU A Q,YANG R,et al.Chemical interactions and rheological properties of hairtail (Trichiurus haumela) surimi:effects of chopping and pressure[J].Food Bioscience,2020,38:100781.
[76] BUAMARD N,BENJAKUL S.Combination effect of high pressure treatment and ethanolic extract from coconut husk on gel properties of sardine surimi[J].LWT,2018,91:361-367.