20世纪50年代以来,全球塑料工业得到迅猛发展。目前,塑料制品的聚合物主要包括聚乙烯(polyethylene,PE)、聚对苯二甲酸乙二醇酯(polyethylene glycol terephthalate,PET)、聚丙烯(polypropylene,PP)、聚苯乙烯(polystyrene,PS)、聚氯乙烯(polyvinyl chloride,PVC)和聚酰胺(polyamide,PA)等。这些塑料产品广泛应用于工农业生产和日常生活中。然而,塑料产品给人类社会带来便利的同时,也带来了严重的环境污染问题[1]。由于对塑料垃圾处理不当,每年都有大量塑料废弃物以各种方式进入海洋[1],其中,较大粒径的塑料废弃物在海浪、光照和微生物等作用下,会逐渐破碎成小粒径的微塑料,这些微塑料仍保持着塑料的理化特性,在自然条件下难以降解,长期累积后会对海洋生物产生潜在的负面影响[2]。
目前,国内外学者已经在300多种海洋鱼类中检测出微塑料,其中约80%的鱼类为重要经济鱼类[3]。鱼类摄入微塑料的方式主要有两种:一是直接从水体中误食微塑料;二是因摄入受微塑料污染的食物而间接摄入并积累微塑料,即微塑料的食物链传递现象[4]。Cedervall等[5]通过室内喂养试验发现,塑料颗粒可通过摄食关系从藻类转移到浮游动物体内再转移到鱼类体内。Garcia等[6]利用稳定同位素技术,验证了微塑料丰度与加龙河鱼类营养位置的潜在关系。海洋生物体内的微塑料可能会被消化道上皮细胞吸收,穿过肠壁进入循环系统,对生物体内造成毒性危害[7]。此外,微塑料可作为载体将其他污染物(重金属和持久性有机污染物)转移到生物体内,对生物体产生复合毒性影响[8]。
吕泗渔场位于中国东海、黄海交界处,是多种经济鱼类的产卵场、育幼场和索饵场,也是江苏省近岸的重要渔场。近年来,受港口航运、陆源排放和渔业生产的影响,在东海和黄海沿海水域均发现了微塑料污染[6,9-10]。这将对该海域的水质和海洋生物生理健康造成负面影响,特别是一些经济鱼类[11-12]。目前,关于吕泗渔场经济鱼类体内微塑料污染的研究较为缺乏。本研究中,量化分析了吕泗渔场主要经济鱼类摄入微塑料的情况,比较了鱼类微塑料丰度种间差异,以期为吕泗渔场微塑料污染状况和风险评估提供有益参考。
1 材料与方法
1.1 调查船及采样站位
2018年9月在吕泗渔场近岸海域,根据海流方向的横断面设置了18个调查站点(32°23′~32°59′N,121°17′~122°11′E,图1)。调查船为单拖网渔船,功率为270 kW;调查网具为有翼单囊底拖网(长×宽×高为125.32 m×59.1 m×36.0 m,囊网目20 mm);每个站点平均拖速为3.64 kn,拖曳时间为25 min。共采集鱼类样品286尾,分属8科11种。所有样本采集后立即置于-20 ℃下保存。
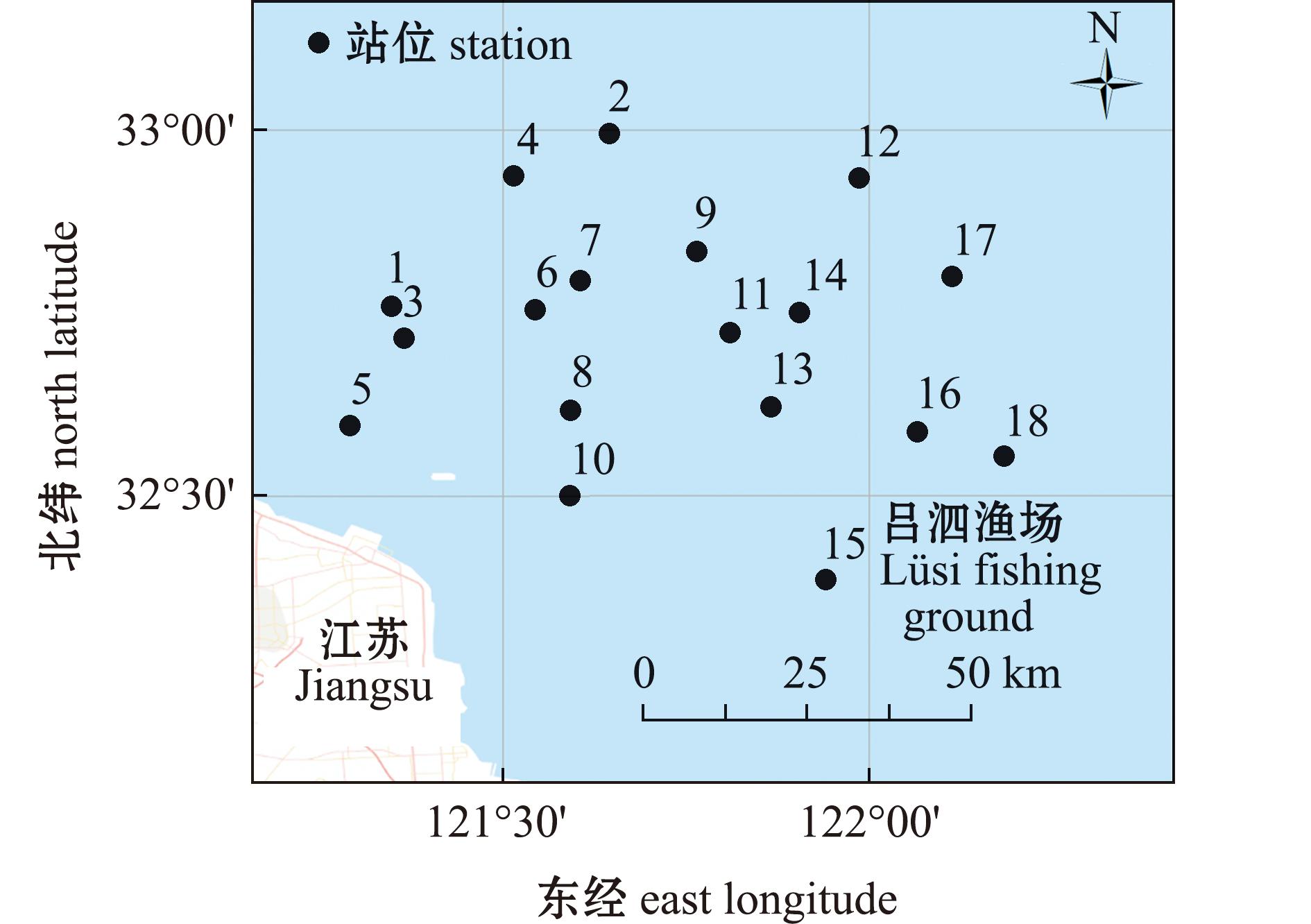
图1 调查海域站位
Fig.1 Survey locations in the sea area
1.2 方法
1.2.1 鱼类样品解剖与测定 将所有样品在超净工作台(SW-CJ-2FD,AIRTECH)上解冻。测量每尾鱼的体长和体质量。然后取第一背鳍下的白色肌肉组织,用蒸馏水清洗,置入离心管中,将肌肉样品在-55 ℃下冷冻干燥约24 h直至完全冷冻。用清洗干净的镊子和解剖刀取出胃部组织,用铝箔纸包裹,在-20 ℃下冷冻保存。
1.2.2 稳定同位素样品处理与分析 将所有鱼类按照体长划分体长组,组间距为10 cm,每个体长组随机挑选1~2个样品,共计57个样品,使用球磨机仪器(MM400)将干燥后的肌肉研磨成粉末,用于13C和15N稳定同位素分析。稳定同位素分析在上海海洋大学海洋科学学院稳定同位素分析实验室进行。计算公式为
δX=[(λ样品/λ标准物质)-1]×103。
(1)
式中:X为13C或15N;λ为13C/12C(δ13C)值或15N/14N(δ15N)值,它是相对于空气中的N2;λ样品为鱼类样品中稳定碳同位素或氮同位素相对量的比值;λ标准物质为标准物质中稳定碳同位素或氮同位素相对量的比值。δ13C标准物质为美国南卡罗来纳州白垩系皮狄组地层内的美洲似箭石,δ15N标准物质为空气中的氮气。δ13C、δ15N、C和N的分析准确度分别为0.1‰、0.2‰、4%和1%。根据δ15N值,营养位置(trophic position,TP)计算如下:
PTP=(δ15N样品-δ15N基线生物)/Δδ15N + 2。
(2)
式中:PTP为所计算生物的营养位置;δ15N样品为鱼类样品的氮稳定同位素比值;δ15N基线生物为基线生物的氮稳定同位素比值;Δδ15N是相邻营养位置间的富集度,本研究中选择浮游动物,平均值为3.4‰[13];常数2为基线生物即浮游动物的营养位置。
1.2.3 微塑料样品处理与分析 采用改进的碱性方法提取微塑料[14]。根据胃的体积,采用20~40 mL体积分数为20% 的KOH处理样本,以覆盖所有有机组织。将组织样本分别移入锥形瓶中,在60 ℃振荡培养箱中持续搅动(130 r/min)24 h,以提高消解效率。将消解溶液依次冷却,并通过玻璃纤维滤膜(孔径5 μm,直径47 mm,LONGJIN)真空过滤,滤膜保存于带盖的洁净培养皿中。
将滤膜进行体视显微镜观察,并使用ImageJ软件标记和计数滤膜上的塑料。记录形状(纤维、碎片或薄膜)和颜色[蓝色、红色、透明、其他颜色(绿色、棕色等)]。使用傅里叶变换红外光谱(FT-IR,Nicolet iN10,Thermo Fisher Scientific)和OMNIC软件分析鉴定聚合物类型。
为保证试验数据的可靠性,试验过程中尽量减少人员走动,试验人员穿棉质试验服,佩戴丁腈手套,所有试验操作均不使用塑料制品(滤膜除外),以降低在采样、处理和分析过程中污染样品的风险。为了防止污染,所有超净水均用混合纤维滤膜过滤后再使用,所有玻璃器皿在使用前均用过滤后的超净水清洗3次,避免二次污染。程序性空白对照试验和正式试验平行进行,空白对照组未发现微塑料。
1.2.4 生物放大分析 鱼类胃中微塑料的累积规律可用营养放大因子(trophic magnification factors,TMF)[14]表示,其计算公式为
FTMF=10b。
(3)
式中:FTMF为营养放大因子;b为斜率,可根据鱼类微塑料丰度(A)(对数)和营养位置PTP数量之间的线性回归进行计算。如果FTM≥1,表示微塑料丰度随着营养位置的增加而增加,即生物放大;如果FTM<1,则表示微塑料丰度随着营养位置的增加而减少(即生物稀释)。
鱼类中的微塑料丰度计算公式为
A=N/n。
(4)
式中:A为微塑料丰度(个/尾);N为微塑料数量;n为某种鱼类样品的数量(尾)。
1.3 数据处理
运用Shapiro-Wilk检验数据的正态性,所有数据均不符合正态分布时,使用R语言vegan工具包的非参数多元方差分析(Permanova)分析鱼类胃中微塑料丰度的种间差异,然后进行Tukey的HSD事后检验。同时,利用线性回归分析鱼类微塑料丰度与个体体长或体质量的相关性[15],以及鱼类胃中微塑料丰度与鱼体营养位置的相关性。
试验数据均以平均值±标准差(mean±S.D.)表示,所有数据均采用SPSS 26.0软件和R 4.0.3软件进行处理,显著性水平设为0.05。
2 结果与分析
2.1 鱼类胃中微塑料的数量与特征
286尾渔获物的胃中均检测出微塑料,共计851个,平均丰度为(2.46±1.42)个/尾,平均粒径为(2.18±0.43)mm。其中,棘头梅童鱼(Collichthys lucidus)摄入的微塑料丰度最高,平均丰度为(3.85±2.33)个/尾(表1,图2);星康吉鳗(Conger myriaster)摄入的微塑料粒径最大,平均粒径为(2.97±1.78)mm(图2(d))。傅里叶变换红外光谱仪检测显示,微塑料聚合物成分主要为PET、PE、PA和PP,其中PET的数量最多(83.9%),PP的数量最低(0.2%)(图2(c))。电子显微镜观测显示:微塑料形状包括纤维、碎片和薄膜等3种(图3),以纤维为主(95.0%),其次为颗粒(3.2%)和薄膜(1.8%)(图2(a));微塑料颜色以蓝色为主(82.3%),其次为透明(10.6%)、红色(6.3%)(图2(b))。
表1 不同鱼类体长、体质量及微塑料丰度
Tab.1 Body length,body weight,and microplastic abundance of different fish species

物种species个体数量/尾number体长(范围)/mmbody length (range)体质量(范围)/gbody weight (range)微塑料丰度/(个·尾-1)microplastic abundance带鱼(Trichiurus lepturus)2492±188(359~625)66.43±71.23(16.06~166.80)1.00±0.00星康吉鳗(Conger myriaster)2535±75(482~588)224.10±101.99(151.98~296.22)3.50±0.50银鲳(Pampus argenteus )6137±6(125~140)39.49±8.85(26.64~44.15)1.33±0.47龙头鱼(Harpadon nehereus)5170±30(148~191)14.86±12.24(6.20~23.51)1.40±0.49黄鲫(Setipinna taty)11124±16(105~150)12.81±6.33(9.03~25.77)2.27±1.76鳓(Ilisha elongata)8138±22(109~170)14.73±6.26(8.2~25.36)2.00±1.32鮸(Miichthys miiuy)27201±27(150~259)79.53±32.12(19.85~186.39)2.93±3.20刀鲚(Coilia nasus)42139±45(14~305)13.09±23.52(2.93~140.49)2.50±1.79凤鲚(Coilia mystus)21127±27(103~180)7.89±3.93(3.42~16.02)3.62±2.08棘头梅童鱼(Collichthys lucidus)8292±20(40~135)8.55±4.40(1.19~24.63)3.85±2.33小黄鱼(Larimichthys polyactis)80113±27(30~190)14.72±9.35(0.67~62.48)2.63±1.67总计或平均值 total or average2862.46±1.42
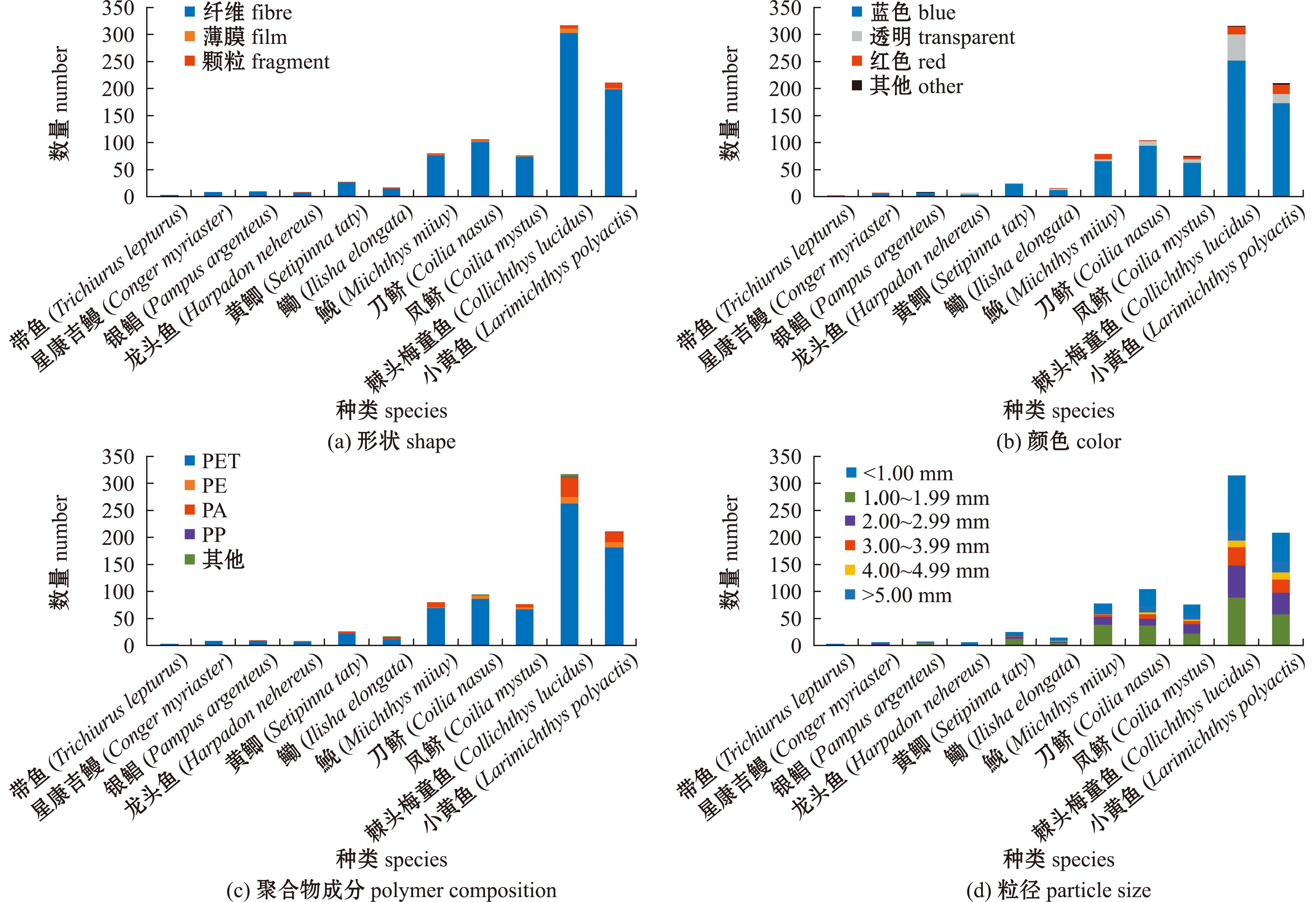
图2 不同鱼类微塑料的污染特征
Fig.2 Characteristics of microplastic pollution in different fish species
图3 显微镜下的微塑料形状
Fig.3 Shape of microplastics under a microscope
2.2 不同鱼类微塑料污染特征的差异性
利用Permanova对11种鱼类体内微塑料的形状、颜色、粒径和聚合物成分进行种间对比分析。结果显示:棘头梅童鱼的4个微塑料理化特征与刀鲚、银鲳均有显著性差异(P<0.05),与龙头鱼在形状、颜色和粒径方面也有显著性差异(P<0.05),与鮸和小黄鱼在形状、颜色和聚合物成分方面有显著性差异(P<0.05);其他鱼类物种间仅1~2个理化特征存在差异(图4)。
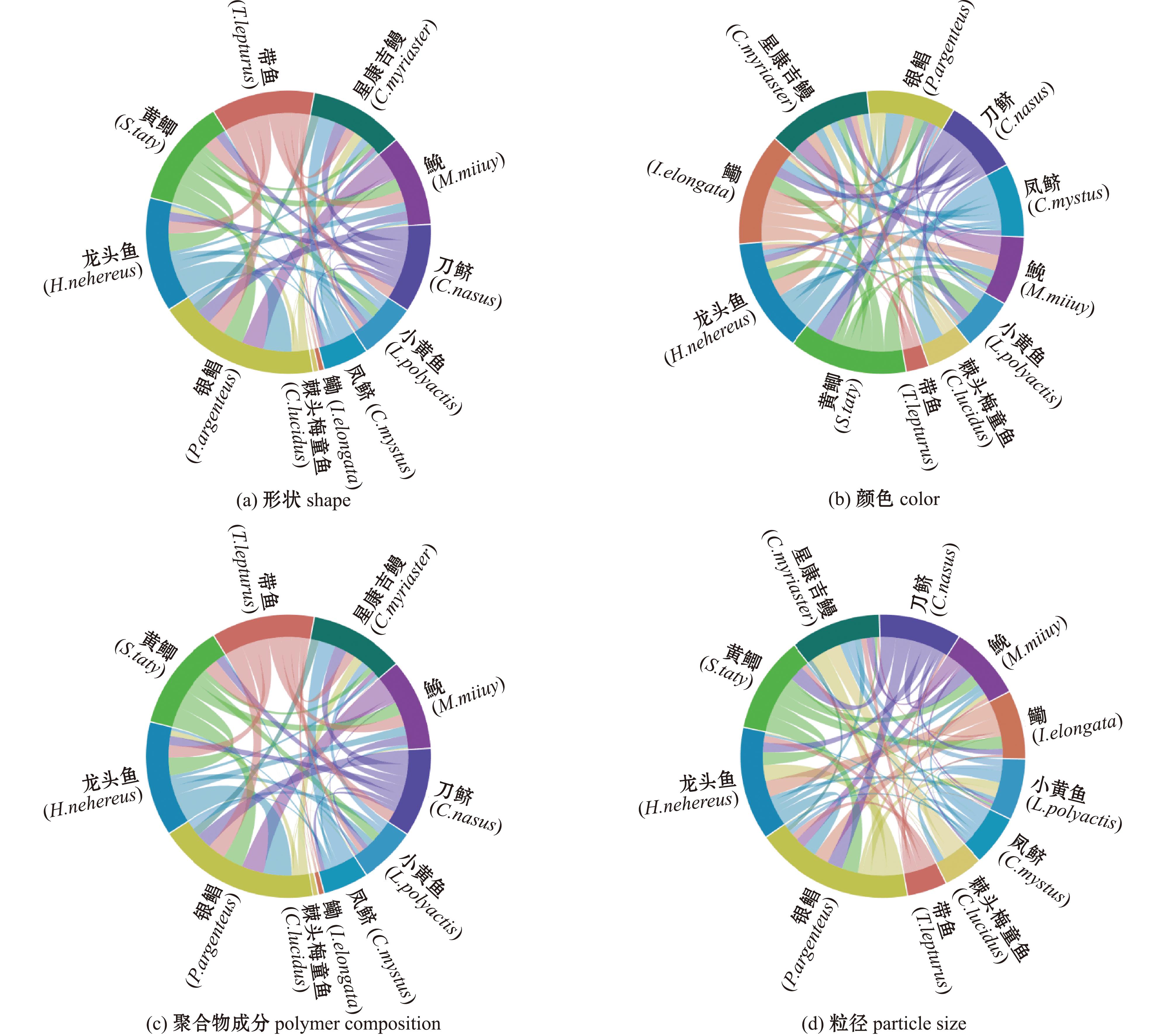
图4 不同鱼类微塑料差异性分析弦图
Fig.4 Chord diagram of differences in microplastics among different fish species
2.3 鱼体大小及其与微塑料丰度的关系
所有渔获物样本的体长范围为14~625 mm,其中,棘头梅童鱼体长最小(92 mm±20 mm),星康吉鳗体长最大(535 mm±75 mm);渔获物样本的体质量范围为0.67~296.22 g,其中,凤鲚体质量最小(7.89 g±3.93 g),星康吉鳗体质量最大(224.10 g±101.99 g)(表1)。线性回归分析显示,11种鱼类的体长和体质量与微塑料丰度之间均无显著相关性(P>0.05)(图5)。
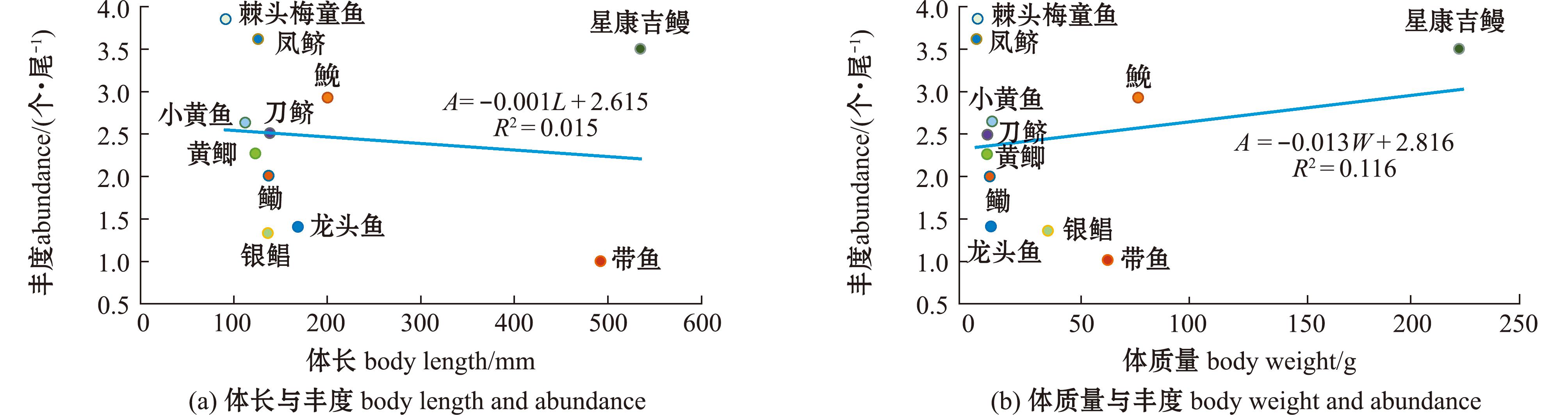
图5 不同鱼类体长、体质量与微塑料丰度的线性关系
Fig.5 Linear relationship between different fish body length/weight and microplastic abundance
2.4 稳定同位素值及其与微塑料丰度的关系
所有渔获物样本的δ13C总范围为-17.93‰~-15.64‰,其中,凤鲚δ13C最小,星康吉鳗δ13C最大;渔获物样本的δ15N总范围为9.50‰~13.15‰,其中,棘头梅童鱼δ15N最小,带鱼δ15N最大(表2)。线性回归分析显示,δ13C和δ15N与微塑料摄入量之间无显著性差异(P>0.05)(图6)。
表2 不同鱼类δ13C、δ15N值和营养位置
Tab.2 δ 13C and δ 15N values and trophic position in different fish species
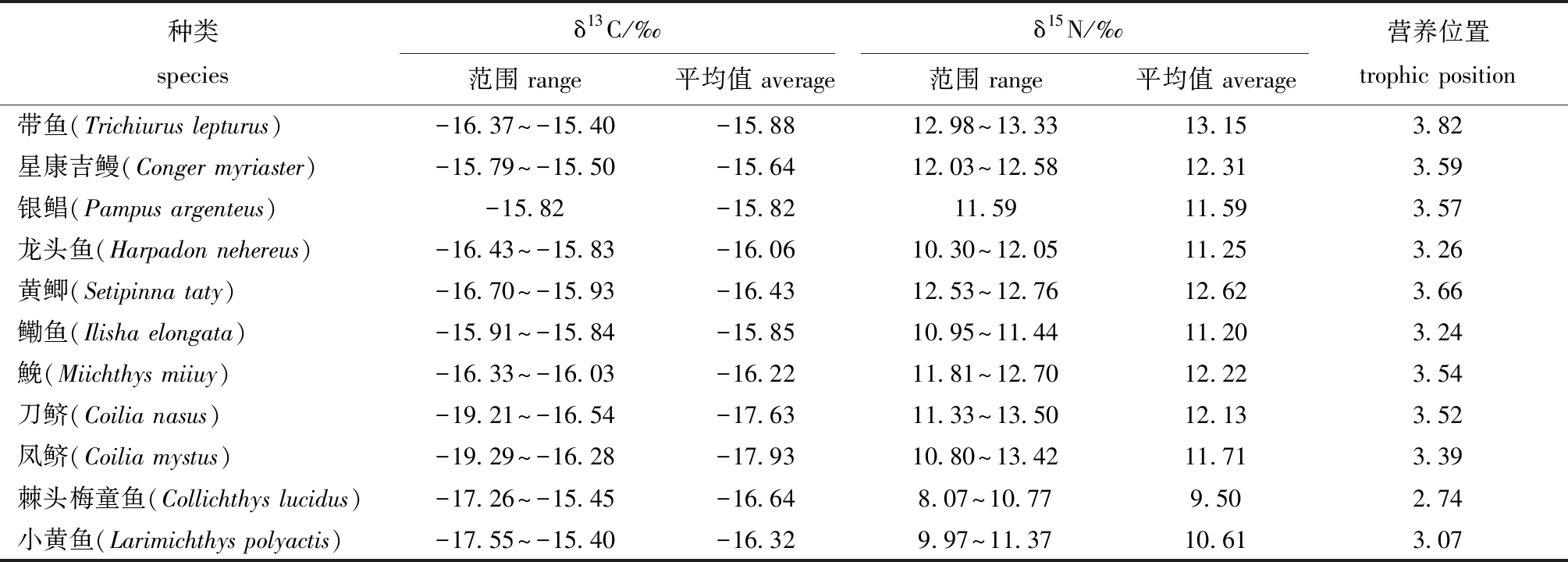
种类speciesδ13C/‰δ15N/‰范围 range平均值 average范围 range平均值 average营养位置trophic position带鱼(Trichiurus lepturus)-16.37~-15.40-15.8812.98~13.3313.153.82星康吉鳗(Conger myriaster)-15.79~-15.50-15.6412.03~12.5812.313.59银鲳(Pampus argenteus)-15.82-15.8211.5911.593.57龙头鱼(Harpadon nehereus)-16.43~-15.83-16.0610.30~12.0511.253.26黄鲫(Setipinna taty)-16.70~-15.93-16.4312.53~12.7612.623.66鳓鱼(Ilisha elongata)-15.91~-15.84-15.8510.95~11.4411.203.24鮸(Miichthys miiuy)-16.33~-16.03-16.2211.81~12.7012.223.54刀鲚(Coilia nasus)-19.21~-16.54-17.6311.33~13.5012.133.52凤鲚(Coilia mystus)-19.29~-16.28-17.9310.80~13.4211.713.39棘头梅童鱼(Collichthys lucidus)-17.26~-15.45-16.648.07~10.779.502.74小黄鱼(Larimichthys polyactis)-17.55~-15.40-16.329.97~11.3710.613.07
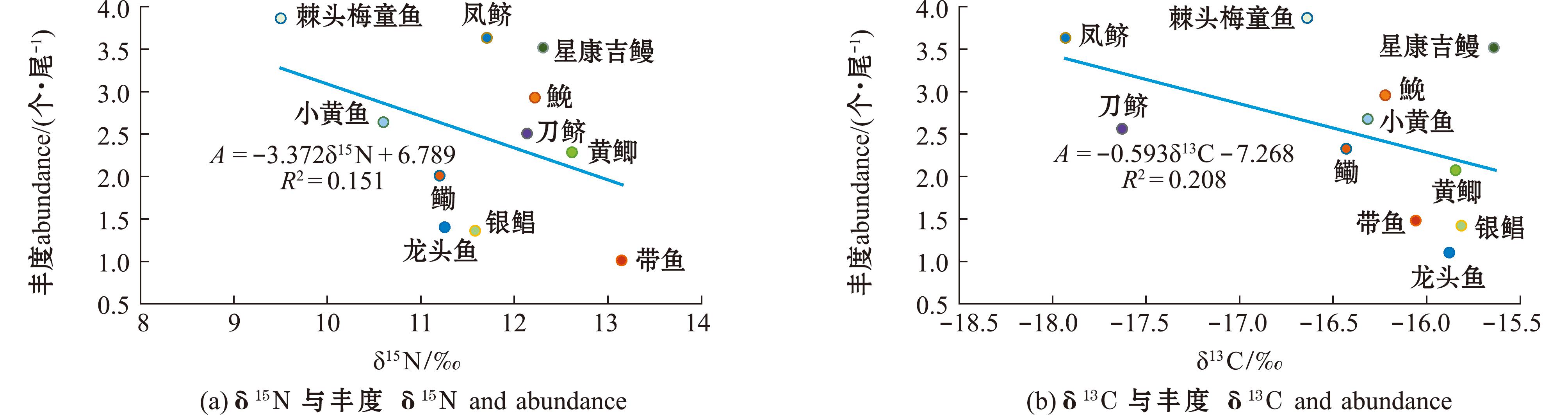
图6 不同鱼类稳定同位素与微塑料丰度的线性关系
Fig.6 Linear relationship between stable isotopes of different fishes and microplastics abundance
2.5 营养位置及生物放大效应
稳定同位素结果显示,11种鱼类营养位置范围为2.74~3.82,平均值为3.40,其中,棘头梅童鱼营养位置最低(2.74),带鱼营养位置最高(3.82),(表2)。线性回归分析表示,营养位置和微塑料丰度(对数)间的关系可用lg A=-0.302PTP+1.384表示,二者之间也无显著性差异(R2=0.198,P>0.05)(图7)。其中斜率为-0.302,因此,计算得到FTMF=10-0.302=0.499。
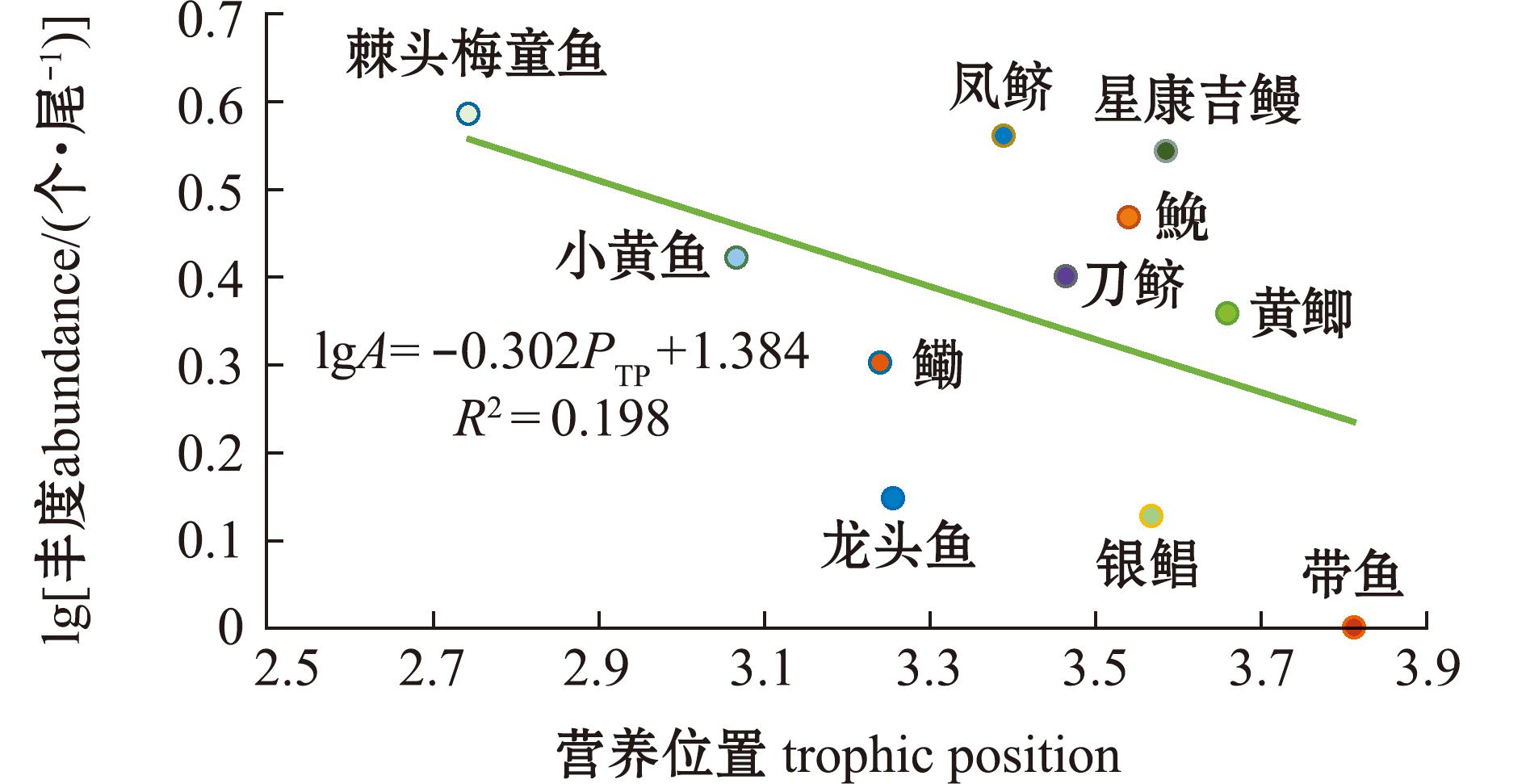
图7 不同鱼类营养位置与微塑料丰度的线性关系
Fig.7 Linear relationship between trophic position of different fishes and microplastics abundance
3 讨论
3.1 鱼类摄入微塑料的特征
当前塑料污染已成为全球性问题,在海洋藻类、浮游动物、双壳贝类、鱼类和海洋哺乳动物等多种生物体内均检出微塑料[16]。本研究表明,吕泗渔场近岸海域普遍存在微塑料污染,在所有鱼类体内均检测出微塑料(检出率为100%),这与其他研究报道结果相似(海州湾>99%[17],黄海为100%[11],中国台湾恒春半岛为95%[9])。然而,吕泗渔场每尾鱼摄入的微塑料丰度(平均2.46个/尾)相比其他研究偏少(海州湾平均4.16个/尾[17],中国台湾恒春半岛平均5.62个/尾[9]),这可能是因为不同研究的采样和实验室分析方法之间存在差异[6]。此外,许多其他因素,如物种生物学特征和食物链结构都会影响微塑料分析结果。
本研究中,微塑料的聚合物类型多为PET(83.9%),其次是PE、PA和PP。PET广泛应用于制造业和纺织业,是日常生活中塑料袋、塑料瓶、吸管和牛奶罐的主要原料[1]。PE和PP在日常生活中也被广泛生产和使用,二者主要用于制造薄膜、管材和日用品等[18]。本研究中鱼类胃中检测到的微塑料形状主要为纤维状(95.0%),这与国内外其他水域的相关研究结果相吻合,如海州湾(纤维状微塑料占98.0%)[17]。这可能是因为水环境中纤维状的微塑料更易黏附在有机食物(如蠕虫和饵料碎片)上,故易被鱼类摄入[19]。同时,环境中较高的纤维状微塑料丰度可能会使其更易被海洋生物摄入和累积,如黄海鱼类消化道内纤维状微塑料占67.0%,沉积物中纤维状微塑料占93.9%[20]。本研究中,微塑料的主要颜色是蓝色(82.3%),这与Chen等[10]的研究结果一致。这可能是因为鱼类选择性地摄入蓝色微塑料[21],如黄尾鲐(Xenocypris davidi)会将蓝色微塑料误认为颜色相似的桡足类而吞下。但是,也有鱼类对蓝色的物体偏好不显著甚至厌恶[22]。因此,有必要在实验室控制条件下探究鱼类摄食行为和微塑料颜色间的关系。
3.2 微塑料污染特征种间差异
已有研究发现,鱼类的体型、摄食习性和栖息水层会对其微塑料的摄入和积累造成影响[23]。本研究表明,棘头梅童鱼与银鲳、刀鲚所摄入的微塑料理化特征差异最为显著。推测可能是因为相对于其他鱼类,本研究中采集的棘头梅童鱼体型较小(表1),作为底层鱼类,棘头梅童鱼的食物来源主要是虾类、糠虾和磷虾等[24];而银鲳体型较大,主要分布在水体的中下层,食物来源包含箭虫、虾类、水母类、头足类及浮游动物等[25];刀鲚主要分布于水体的中上层,食物来源主要是鱼类和虾类[26]。银鲳和刀鲚与棘头梅童鱼在体型、摄食习性及栖息水层上差异明显,这些因素可能共同造成了微塑料污染特征的种间差异。此外,龙头鱼和鮸是近海大型中下层肉食性鱼类,主要摄食鱼类和虾类[27-28],二者与棘头梅童鱼在体型和摄食习性方面的差异也在种间微塑料污染特征的差异上得以体现。小黄鱼和棘头梅童鱼同属底层鱼类,但小黄鱼主要以磷虾、糠虾、端足类和桡足类等浮游甲壳动物为食[29],食物来源的差异可能导致了二者体内微塑料污染特征的差异。综上所述,对近海鱼类体内微塑料的污染研究需要综合考虑其自身体型大小、摄食习性和栖息水层的影响。
3.3 微塑料污染和鱼类所处营养位置的关系
本研究中,11种鱼类摄入的微塑料丰度与体长和体质量之间均无显著相关性,这与过去一些研究的结论相同[30],原因可能是鱼类胃中微塑料的浓度并不随着体长或体型的增加而增加。此外,鱼类营养位置与其摄入微塑料丰度之间也未发现显著相关性,这与其他一些研究结果相似[3,30],这可能是因为微塑料在鱼类胃中的滞留时间短暂,会在短时间内随代谢废物排出体外[30]。综上,尽管微塑料可以通过摄入作用在不同营养位置的生物之间转移,但是它与鱼类本身所处的营养位置并无显著相关性,不存在明显的生物放大或生物稀释现象[31]。
4 结论
1)微塑料在调查区域鱼类胃中普遍存在,纤维和蓝色微塑料是最常见的形状和颜色。
2)鱼类的体型、食性及栖息水层对其摄入微塑料的过程影响最为显著。
3)未发现微塑料从低营养位置鱼类向高营养位置鱼类传递的生物放大现象。
[1] DERRAIK J G B.The pollution of the marine environment by plastic debris:a review[J].Marine Pollution Bulletin,2002,44(9):842-852.
[2] THOMPSON R C,OLSEN Y,MITCHELL R P,et al.Lost at sea:where is all the plastic?[J].Science,2004,304(5672):838.
[3] MARKIC A,GAERTNER J C,GAERTNER-MAZOUNI N,et al.Plastic ingestion by marine fish in the wild[J].Critical Reviews in Environmental Science and Technology,2020,50(7):657-697.
[4] SANTILLO D,MILLER K,JOHNSTON P.Microplastics as contaminants in commercially important seafood species[J].Integrated Environmental Assessment and Management,2017,13(3):516-521.
[5] CEDERVALL T,HANSSON L A,LARD M,et al.Food chain transport of nanoparticles affects behaviour and fat metabolism in fish[J].PLoS One,2012,7(2):e32254.
[6] GARCIA F,DE CARVALHO A R,RIEM-GALLIANO L,et al.Stable isotope insights into microplastic contamination within freshwater food webs[J].Environmental Science &Technology,2021,55(2):1024-1035.
[7] BROWNE M A,DISSANAYAKE A,GALLOWAY T S,et al.Ingested microscopic plastic translocates to the circulatory system of the mussel,Mytilus edulis (L.)[J].Environmental Science &Technology,2008,42(13):5026-5031.
[8] XUAN L H,XIAO L,HUANG R X.The geno-toxicological impacts of microplastic (MP) exposure on health:mechanistic pathways and research trends from a Chinese perspective[J].Environmental Science Processes &Impacts,2023,25(1):26-36.
[9] HASEGAWA T,NAKAOKA M.Trophic transfer of microplastics from mysids to fish greatly exceeds direct ingestion from the water column[J].Environmental Pollution,2021,273:116468.
[10] CHEN K J,CHEN M C,CHEN T H.Plastic ingestion by fish in the coastal waters of the Hengchun Peninsula,Taiwan,China:associated with human activity but no evidence of biomagnification[J].Ecotoxicology and Environmental Safety,2021,213:112056.
[11] ZHANG S,WANG N,GONG S M,et al.The patterns of trophic transfer of microplastic ingestion by fish in the artificial reef area and adjacent waters of Haizhou Bay[J].Marine Pollution Bulletin,2022,177:113565.
[12] JABEEN K,SU L,LI J N,et al.Microplastics and mesoplastics in fish from coastal and fresh waters of China[J].Environmental Pollution,2017,221:141-149.
[13] POST D M.Using stable isotopes to estimate trophic position:models,methods,and assumptions[J].Ecology,2002,83(3):703-718.
[14] ALAVA J J.Modelling the bioaccumulation of MPs in a marine mammalian food web of the Northeastern Pacific [C]//World marine mammal conference 2019 (WMMC'19): together for science and conservation.Barcelona,Catalonia,Spain:Society for Marine Mammalogy (SMM) and the European Cetacean Society (ECS),2019.
[15] GALV N A.Neural plasticity of development and learning[J].Human Brain Mapping,2010,31(6):879-890.
N A.Neural plasticity of development and learning[J].Human Brain Mapping,2010,31(6):879-890.
[16] LI Z,GAO C M,YANG J L,et al.Distribution characteristics of microplastics in surface water and sediments of Haizhou Bay,Lianyungang[J].Environmental Science and Technology,2020,41(7):3212-3221.
[17] FENG Z H,ZHANG T,LI Y,et al.The accumulation of microplastics in fish from an important fish farm and mariculture area,Haizhou Bay,China[J].The Science of the Total Environment,2019,696:133948.
[18] 郭锋锋.湖泊环境大塑料及微塑料的表征与来源分析——以白马湖为例[D].昆明:云南师范大学,2020.GUO F F.Characterization and source analysis of macroplastic debris and microplastics in lake environment-a case study of Baima Lake[D].Kunming:Yunnan Normal University,2020.(in Chinese)
[19] PETERS C A,BRATTON S P.Urbanization is a major influence on microplastic ingestion by sunfish in the Brazos River Basin,Central Texas,USA[J].Environmental Pollution,2016,210:380-387.
[20] SUN X X,LI Q J,SHI Y Q,et al.Characteristics and retention of microplastics in the digestive tracts of fish from the Yellow Sea[J].Environmental Pollution,2019,249:878-885.
[21] MAK C W,CHING-FONG YEUNG K,CHAN K M.Acute toxic effects of polyethylene microplastic on adult zebrafish[J].Ecotoxicology and Environmental Safety,2019,182:109442.
[22] AVDESH A,MARTIN-IVERSON M T,MONDAL A,et al.Evaluation of color preference in zebrafish for learning and memory[J].Journal of Alzheimer’s Disease,2012,28(2):459-469.
[23] ZHANG F,XU J Y,ZHU L X,et al.Seasonal distributions of microplastics and estimation of the microplastic load ingested by wild caught fish in the East China Sea[J].Journal of Hazardous Materials,2021,419:126456.
[24] 王建锋,赵峰,宋超,等.长江口棘头梅童鱼食物组成和摄食习性的季节变化[J].应用生态学报,2016,27(1):291-298.WANG J F,ZHAO F,SONG C,et al.Diet composition and seasonal variation in feeding habits of Collichthy lucidus in Yangtze Estuary,China[J].Chinese Journal of Applied Ecology,2016,27(1):291-298.(in Chinese)
[25] 彭士明,施兆鸿,尹飞,等.利用碳氮稳定同位素技术分析东海银鲳食性[J].生态学杂志,2011,30(7):1565-1569.PENG S M,SHI Z H,YIN F,et al.Feeding habits of silver pomfret(Pampus argenteus) in East China Sea based on stable isotope techniques[J].Chinese Journal of Ecology,2011,30(7):1565-1569.(in Chinese)
[26] 李丹,于雯雯,徐军田,等.长江口刀鲚生物学特征与摄食生态学研究进展[J].水产养殖,2023,44(8):6-13.LI D,YU W W,XU J T,et al.Research progress in biological characteristics and feeding ecology of Coilia nasus in the Yangtze River Estuary[J].Journal of Aquaculture,2023,44(8):6-13.(in Chinese)
[27] 林显鹏,朱增军,李鹏飞.东海区龙头鱼摄食习性的研究[J].海洋渔业,2010,32(3):290-296.LIN X P,ZHU Z J,LI P F.Feeding habits of Harpadon nehereus in the East China Sea Region[J].Marine Fisheries,2010,32(3):290-296.(in Chinese)
[28] 王储庆,汤建华,熊瑛,等.江苏近海鮸胃含物初步分析[J].浙江海洋大学学报(自然科学版),2020,39(4):372-378.WANG C Q,TANG J H,XIONG Y,et al.Feeding habits of Miichthys miiuy in Jiangsu costal waters[J].Journal of Zhejiang Ocean University (Natural Science Edition),2020,39(4):372-378.(in Chinese)
[29] 王雅丽,王晶,周永东,等.基于Two-stage GAM的舟山渔场及邻近海域小黄鱼时空分布特征[J].中国水产科学,2022,29(4):633-641.WANG Y L,WANG J,ZHOU Y D,et al.Spatial and temporal distribution characteristics of Larimichthys polyactis in Zhoushan fishing ground and the adjacent waters based on Two-stage GAM[J].Journal of Fishery Sciences of China,2022,29(4):633-641.(in Chinese)
[30] GÜVEN ![]() B,et al.Microplastic litter composition of the Turkish territorial waters of the Mediterranean Sea,and its occurrence in the gastrointestinal tract of fish[J].Environmental Pollution,2017,223:286-294.
B,et al.Microplastic litter composition of the Turkish territorial waters of the Mediterranean Sea,and its occurrence in the gastrointestinal tract of fish[J].Environmental Pollution,2017,223:286-294.
[31] AKHBARIZADEH R,MOORE F,KESHAVARZI B.Investigating microplastics bioaccumulation and biomagnification in seafood from the Persian Gulf:a threat to human health?[J].Food Additives &Contaminants Part A:Chemistry,Analysis,Control,Exposure &Risk Assessment,2019,36(11):1696-1708.