浮游植物是海洋生态系统中最重要的初级生产者,也是海水养殖活动的重要支撑,其可为鱼、虾和贝等海洋生物提供饵料,尤其是滤食性贝类的主要食物来源,且对调节水体富营养化水平有重要作用[1]。浮游植物种类组成和丰度受水文条件、水环境状况等因素影响,对环境变化十分敏感,能灵敏迅速地反映水环境质量现状及变化趋势,故可作为水环境质量评价的重要指标[2-3]。研究贝类养殖区浮游植物群落特征及其与环境因子的相关性,对贝类养殖和海洋生态系统保护具有重要意义。
三倍体牡蛎具有生长快、个体大和繁殖季节死亡率低等优点[4-5]。近年来,三倍体长牡蛎(Crassostrea gigas)已成为中国北方牡蛎养殖的热点,三倍体福建牡蛎(C.angulata)在中国南方养殖也发展迅猛,2022年福建省三倍体牡蛎养殖面积和产量分别为17 028.56 hm2和104.02万t,分别占全省牡蛎养殖面积和产量的43.56%和41.17%[6]。福建省连江县是全国水产养殖第二大县,黄岐湾位于连江县黄岐半岛畚箕山与定海角之间,湾内和湾外海域均分布有三倍体福建牡蛎养殖区。
目前,对牡蛎、扇贝、贻贝和菲律宾蛤仔等贝类养殖区浮游植物的研究已有一些报道[7-11],但对三倍体牡蛎养殖区浮游植物群落特征未见相关报道。本研究中,对黄岐湾三倍体福建牡蛎养殖区开展为期10个月的调查,分析了浮游植物的群落特征及其与环境因子的关系,以期为三倍体牡蛎健康养殖和海洋环境保护提供科学依据。
1 材料与方法
1.1 研究区域和站位布设
黄岐湾三面环山,湾口向东南敞开,水域面积约200 km2,湾外西侧约12 km为鳌江口,西南侧约15 km为闽江口。在黄岐湾三倍体牡蛎养殖区布设6个调查站位,湾外(L1~L3站)和湾内(L4~L6站)各布设3个站位,并在邻近海域非养殖区布设1个对照点(L0站)(图1)。湾外和湾内养殖区牡蛎苗种为同一批三倍体福建牡蛎附壳苗,养殖方式为延绳式平挂串养。
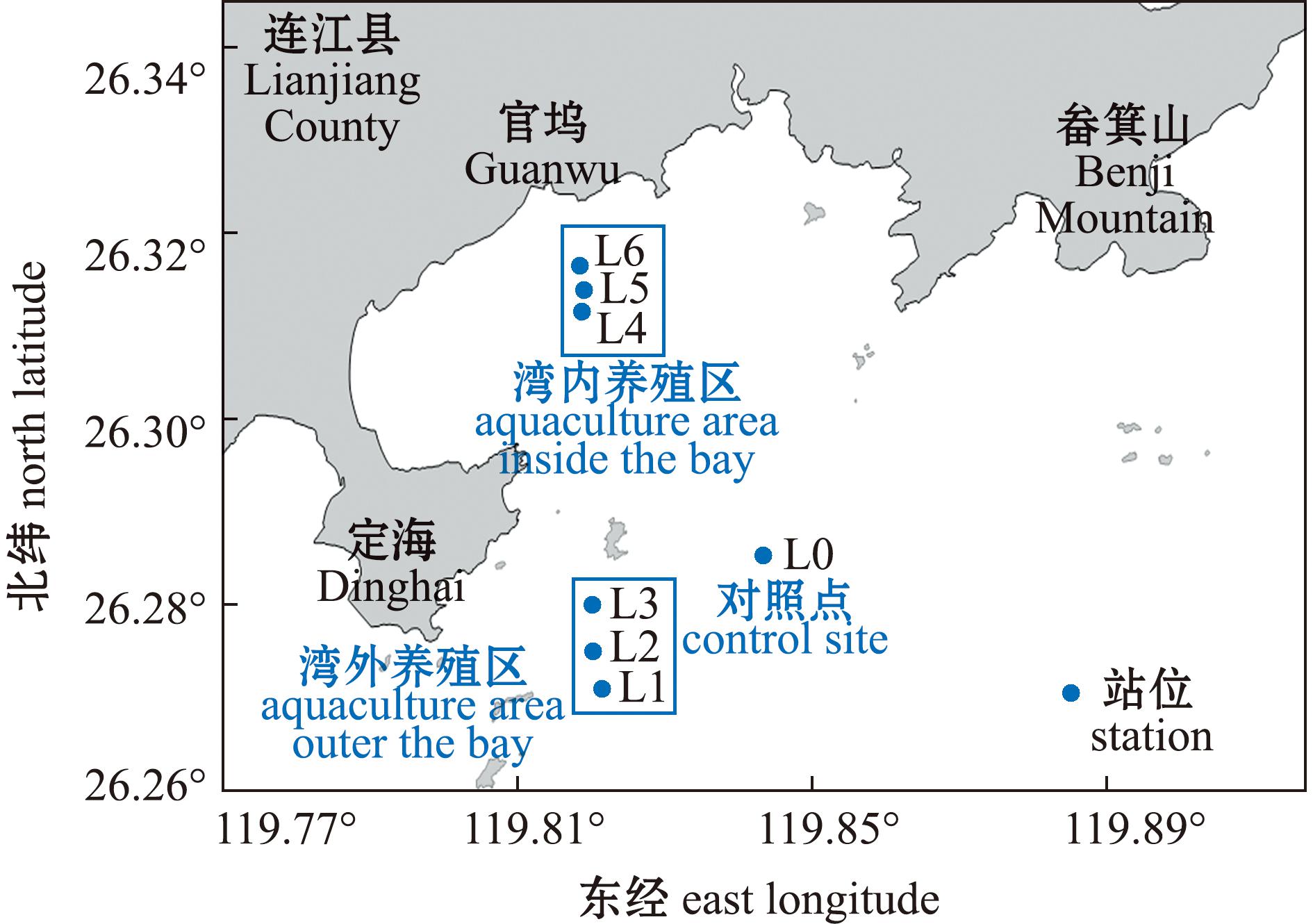
图1 黄岐湾三倍体牡蛎养殖区环境调查站位
Fig.1 Environmental survey station at triploid oyster farming areas in Huangqi Bay
1.2 方法
1.2.1 样品采集与分析 调查时间为2021年12月—2022年9月,每月初对三倍体牡蛎养殖区(L1~L6站)开展一次调查,对照点(L0站)于2022年9月调查一次。
使用有机玻璃采水器采集表层海水,水温、盐度、pH和溶解氧采用WTW Multi 3630多参数分析仪现场测定,悬浮物、化学需氧量、营养盐和浮游植物等样品运回实验室分析,各项目分析方法按照《海洋监测规范》(GB 17378—2007)或《近岸海域环境监测规范》(HJ 442—2020)等执行。
1.2.2 浮游植物群落特征指标评价 评价方法采用《海洋监测规范》(GB 17378—2007)第7部分附录B和孙军等[12]的污染生态评述方法。
丰富度(Margalef)(d)、多样性指数(Shannon-Wiener)(H′)、均匀度(Pielou)(J)和优势度(Y)计算公式分别为
d=(S-1)/log2N,
(1)
(2)
J=H′/log2S,
(3)
Y=(ni/N)×fi。
(4)
式中:S为样品中物种总数;ni为第i种的个体数;N为总个体数;Pi为第i种的个体数(ni)与总个体数(N)的比值;fi为出现率。当优势度(Y)≥0.02时,定义该种为优势种。
1.3 数据处理
采用SPSS 25软件对养殖区不同月份浮游植物丰度、多样性指数等数据进行单因素方差分析(one-way ANOVA),采用Duncan法进行组间多重比较,比较不同月份数据之间的差异性。海洋环境因子、浮游植物丰度、多样性指数等湾内和湾外组间差异分析采用独立样本T检验(α=0.05)。采用Canoco for Windows 4.5软件对浮游植物优势种与环境因子进行冗余分析(RDA),因浮游植物细胞密度与环境因子数量级差别较大,在进行RDA和相关性分析时,对浮游植物丰度进行lg(X+1)转换,采用Canodraw软件制作RDA双序图。采用Surfer 18软件制作调查站位图。
2 结果与分析
2.1 海洋环境因子的变化
2.1.1 养殖区海洋环境因子 调查期间,养殖区所有站位水温月平均值范围为11.1~28.2 ℃,平均值为19.4 ℃,2月水温最低,8月最高;盐度月平均值范围为26.1~33.3,平均值为29.7,其中6月受连续降雨影响,海水盐度较低,湾外盐度显著低于湾内(P<0.05);硝酸氮含量月平均值范围为0.024~0.496 mg/L,平均值为0.256 mg/L;亚硝酸氮含量月平均值范围为0.004~0.027 mg/L,平均值为0.012 mg/L;氨氮含量月平均值范围为0.012~0.060 mg/L,平均值为0.025 mg/L;活性磷酸盐含量月平均值范围为0.006~0.041 mg/L,平均值为0.024 mg/L;活性硅酸盐含量月平均值范围为0.367~1.15 mg/L,平均值为0.801 mg/L(表1)。总体而言,养殖区水质较好,营养盐较丰富,12—3月海水中营养盐含量较高,4月开始显著下降,湾外硝酸氮含量显著高于湾内(P<0.05),其余指标湾外与湾内组间无显著性差异(P>0.05)。
表1 2021年12月—2022年9月三倍体牡蛎养殖区海洋环境因子的变化
Tab.1 Changes in marine environmental factors in triploid oyster farming areas from December 2021 to September 2022
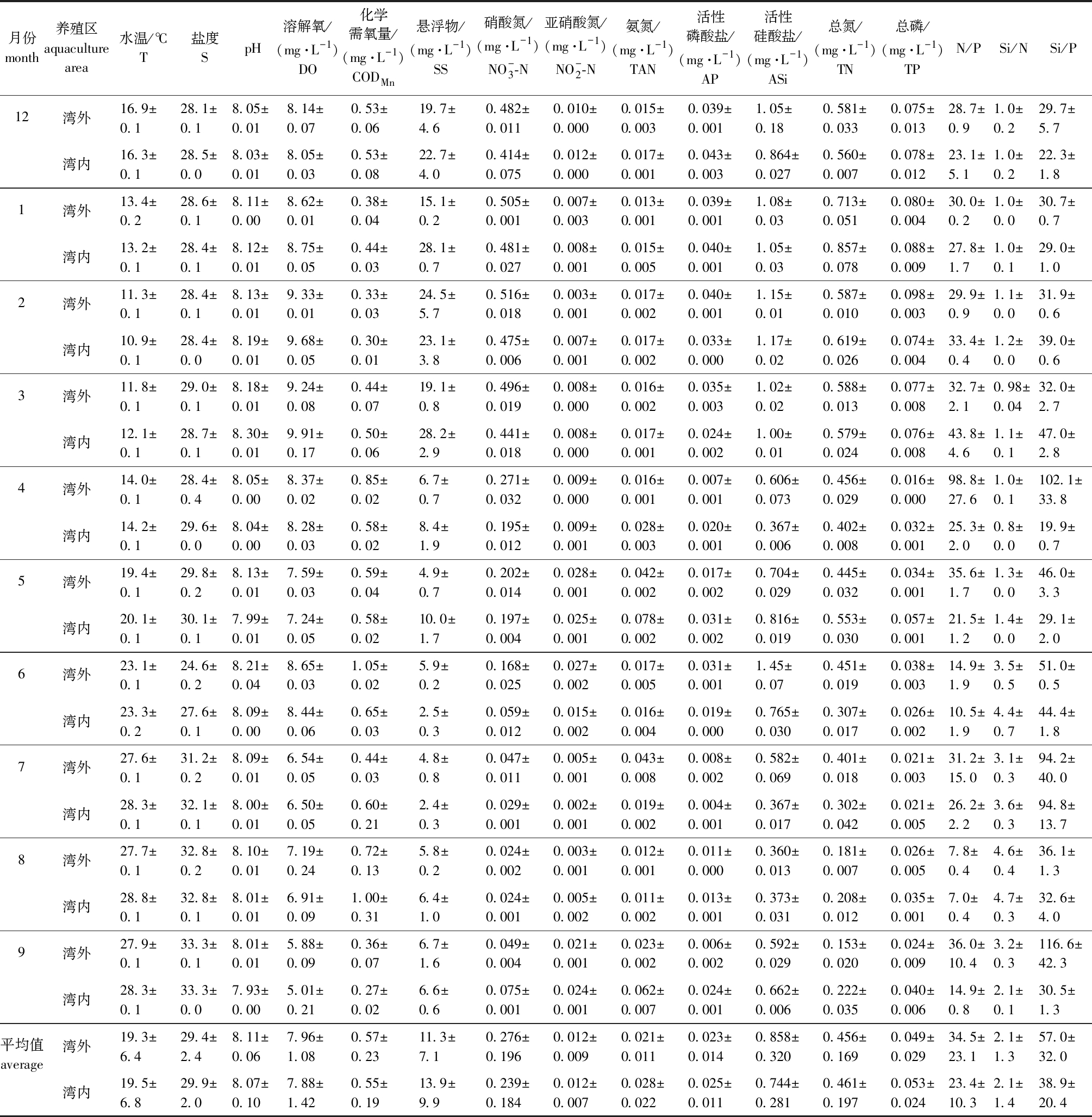
月份month养殖区aquaculture area水温/℃T盐度SpH溶解氧/(mg·L-1)DO化学需氧量/(mg·L-1)CODMn悬浮物/(mg·L-1)SS硝酸氮/(mg·L-1)NO-3-N亚硝酸氮/(mg·L-1) NO-2-N氨氮/(mg·L-1)TAN活性磷酸盐/(mg·L-1)AP活性硅酸盐/(mg·L-1)ASi总氮/(mg·L-1)TN总磷/(mg·L-1)TPN/PSi/NSi/P12湾外16.9±0.128.1±0.18.05±0.018.14±0.070.53±0.0619.7±4.60.482±0.0110.010±0.0000.015±0.0030.039±0.0011.05±0.180.581±0.0330.075±0.01328.7±0.91.0±0.229.7±5.7湾内16.3±0.128.5±0.08.03±0.018.05±0.030.53±0.0822.7±4.00.414±0.0750.012±0.0000.017±0.0010.043±0.0030.864±0.0270.560±0.0070.078±0.01223.1±5.11.0±0.222.3±1.81湾外13.4±0.228.6±0.18.11±0.008.62±0.010.38±0.0415.1±0.20.505±0.0010.007±0.0030.013±0.0010.039±0.0011.08±0.030.713±0.0510.080±0.00430.0±0.21.0±0.030.7±0.7湾内13.2±0.128.4±0.18.12±0.018.75±0.050.44±0.0328.1±0.70.481±0.0270.008±0.0010.015±0.0050.040±0.0011.05±0.030.857±0.0780.088±0.00927.8±1.71.0±0.129.0±1.02湾外11.3±0.128.4±0.18.13±0.019.33±0.010.33±0.0324.5±5.70.516±0.0180.003±0.0010.017±0.0020.040±0.0011.15±0.010.587±0.0100.098±0.00329.9±0.91.1±0.031.9±0.6湾内10.9±0.128.4±0.08.19±0.019.68±0.050.30±0.0123.1±3.80.475±0.0060.007±0.0010.017±0.0020.033±0.0001.17±0.020.619±0.0260.074±0.00433.4±0.41.2±0.039.0±0.63湾外11.8±0.129.0±0.18.18±0.019.24±0.080.44±0.0719.1±0.80.496±0.0190.008±0.0000.016±0.0020.035±0.0031.02±0.020.588±0.0130.077±0.00832.7±2.10.98±0.0432.0±2.7湾内12.1±0.128.7±0.18.30±0.019.91±0.170.50±0.0628.2±2.90.441±0.0180.008±0.0000.017±0.0010.024±0.0021.00±0.010.579±0.0240.076±0.00843.8±4.61.1±0.147.0±2.84湾外14.0±0.128.4±0.48.05±0.008.37±0.020.85±0.026.7±0.70.271±0.0320.009±0.0000.016±0.0010.007±0.0010.606±0.0730.456±0.0290.016±0.00098.8±27.61.0±0.1102.1±33.8湾内14.2±0.129.6±0.08.04±0.008.28±0.030.58±0.028.4±1.90.195±0.0120.009±0.0010.028±0.0030.020±0.0010.367±0.0060.402±0.0080.032±0.00125.3±2.00.8±0.019.9±0.75湾外19.4±0.129.8±0.28.13±0.017.59±0.030.59±0.044.9±0.70.202±0.0140.028±0.0010.042±0.0020.017±0.0020.704±0.0290.445±0.0320.034±0.00135.6±1.71.3±0.046.0±3.3湾内20.1±0.130.1±0.17.99±0.017.24±0.050.58±0.0210.0±1.70.197±0.0040.025±0.0010.078±0.0020.031±0.0020.816±0.0190.553±0.0300.057±0.00121.5±1.21.4±0.029.1±2.06湾外23.1±0.124.6±0.28.21±0.048.65±0.031.05±0.025.9±0.20.168±0.0250.027±0.0020.017±0.0050.031±0.0011.45±0.070.451±0.0190.038±0.00314.9±1.93.5±0.551.0±0.5湾内23.3±0.227.6±0.18.09±0.008.44±0.060.65±0.032.5±0.30.059±0.0120.015±0.0020.016±0.0040.019±0.0000.765±0.0300.307±0.0170.026±0.00210.5±1.94.4±0.744.4±1.87湾外27.6±0.131.2±0.28.09±0.016.54±0.050.44±0.034.8±0.80.047±0.0110.005±0.0010.043±0.0080.008±0.0020.582±0.0690.401±0.0180.021±0.00331.2±15.03.1±0.394.2±40.0湾内28.3±0.132.1±0.18.00±0.016.50±0.050.60±0.212.4±0.30.029±0.0010.002±0.0010.019±0.0020.004±0.0010.367±0.0170.302±0.0420.021±0.00526.2±2.23.6±0.394.8±13.78湾外27.7±0.132.8±0.28.10±0.017.19±0.240.72±0.135.8±0.20.024±0.0020.003±0.0010.012±0.0010.011±0.0000.360±0.0130.181±0.0070.026±0.0057.8±0.44.6±0.436.1±1.3湾内28.8±0.132.8±0.18.01±0.016.91±0.091.00±0.316.4±1.00.024±0.0010.005±0.0020.011±0.0020.013±0.0010.373±0.0310.208±0.0120.035±0.0017.0±0.44.7±0.332.6±4.09湾外27.9±0.133.3±0.18.01±0.015.88±0.090.36±0.076.7±1.60.049±0.0040.021±0.0010.023±0.0020.006±0.0020.592±0.0290.153±0.0200.024±0.00936.0±10.43.2±0.3116.6±42.3湾内28.3±0.133.3±0.07.93±0.005.01±0.210.27±0.026.6±0.60.075±0.0010.024±0.0010.062±0.0070.024±0.0010.662±0.0060.222±0.0350.040±0.00614.9±0.82.1±0.130.5±1.3平均值average湾外19.3±6.429.4±2.48.11±0.067.96±1.080.57±0.2311.3±7.10.276±0.1960.012±0.0090.021±0.0110.023±0.0140.858±0.3200.456±0.1690.049±0.02934.5±23.12.1±1.357.0±32.0湾内19.5±6.829.9±2.08.07±0.107.88±1.420.55±0.1913.9±9.90.239±0.1840.012±0.0070.028±0.0220.025±0.0110.744±0.2810.461±0.1970.053±0.02423.4±10.32.1±1.438.9±20.4
2.1.2 对照点海洋环境因子 2022年9月调查数据表明,对照点水温为27.7 ℃,盐度为33.4,pH为8.00,溶解氧含量为5.67 mg/L,硝酸氮、亚硝酸氮和氨氮含量分别为0.052、0.022、0.026 mg/L,均与湾外养殖区相近;活性磷酸盐、活性硅酸盐、总氮和总磷含量分别为0.024、0.634、0.202、0.038 mg/L,略高于湾外养殖区,与湾内养殖区接近(图2)。总体而言,对照点各项海洋环境因子与养殖区相比无明显差异。

图2 2022年9月养殖区和对照点营养盐含量的比较
Fig.2 Comparison of nutrient contents between farming areas and control site in September 2022
2.2 养殖区浮游植物的分布特征
2.2.1 浮游植物的生态类群 黄岐湾养殖区浮游植物大致可分为3大类群,即广温类群、暖水类群和暖温类群。其中,以广温类群最为常见且丰度占绝对优势,根据其对盐度的不同适应能力可再分为3个类群,即广温广盐种[如中肋骨条藻(Skeletonema costatum)、柔弱拟菱形藻(Pseudo-nitzschia delicatissima)、米氏凯伦藻(Karenia mikimotoi)、尖刺拟菱形藻(Pseudo-nitzschia pungens)等]、广温低盐种[如旋链角毛藻(Chaetoceros curvisetus)、具槽直链藻(Melosira sulcata)等]和广温高盐种[如细弱海链藻(Thalassiosira subtilis)、佛氏海毛藻(Thalassiothrix frauenfeldii)等]。暖水类群[如热带骨条藻(Skeletonema tropicum)、窄隙角毛藻(Chaetoceros affinis)]和暖温类群[如圆海链藻(Thalassiosira rotula)、柔弱根管藻(Rhizosolenia delicatula)]出现种类较少,丰度也较低。
养殖区浮游植物以广盐和低盐类群种类较多,此外,还出现了一些淡水种类,如裸藻(Euglena sp.)、变异直链藻(Melosira varians)等,其中,裸藻在各次调查中均有出现,在雨季(5月)湾内养殖区成为优势种;而红色中缢虫(Mesodinium rubrum)在各次调查也均有出现,在12、2、3月成为优势种,该种是一种具有自养特性的海洋纤毛虫,因具有光合作用能力,目前普遍认为其是浮游植物,为广温性种类[13]。
2.2.2 浮游植物种类组成与月变化 养殖区浮游植物种类较丰富,共鉴定出6门65属133种(包括变种和变型等)。其中,硅藻门种类数占优势,共46属101种,占总种类数的75.9%;甲藻门共15属28种,占总种类数的21.1%;蓝藻门、金藻门、裸藻门和原生动物门各1属1种,均占总种类数的0.75%。调查期间,各月浮游植物种类数为41~85种,其中,4月浮游植物种类数最少,8月种类数最丰富。
整个调查期间,浮游植物的优势种为中肋骨条藻和柔弱拟菱形藻,Y值分别为0.798和0.027。从表2可见:浮游植物优势种随调查月份不同有所变化,其中,中肋骨条藻在10次调查中均为优势种,柔弱拟菱形藻在水温较高的7—9月优势度较高,3、5月亦为优势种;2021年12月—2022年3月水温较低、风浪较大,暖温种(如圆海链藻)和底栖性硅藻(如具槽直链藻、菱形海线藻等)可成为优势种。湾外和湾内养殖区浮游植物均以广温种占绝对优势,湾外养殖区浮游植物优势种为中肋骨条藻(Y=0.827)、柔弱拟菱形藻(Y=0.021),其中,4月湾外海域发生中肋骨条藻赤潮,Y值高达0.977;湾内养殖区优势种为中肋骨条藻(Y=0.431)、柔弱拟菱形藻(Y=0.096)和旋链角毛藻(Y=0.021)。
表2 2021年12月—2022年9月三倍体牡蛎养殖区浮游植物优势种及其优势度
Tab.2 Dominant species and dominance of phytoplankton in triploid oyster farming areas from December 2021 to September 2022

注:—表示该物种在该月份未形成优势种。
Note:— indicates that the species are not dominant species in the respective month.
优势种dominant species优势度 dominance (Y)12月Dec.1月Jan.2月Feb.3月Mar.4月Apr.5月May6月June7月July8月Aug.9月Sep.中肋骨条藻(Skeletonema costatum)0.0520.2870.1360.3580.9770.6170.1920.4320.1840.397柔弱拟菱形藻(Pseudo-nitzschia delicatissima)———0.033—0.047—0.2860.3990.113旋链角毛藻(Chaetoceros curvisetus)—————0.0230.133—0.048—米氏凯伦藻(Karenia mikimotoi)——————0.388———圆海链藻(Thalassiosira rotula)0.1280.1480.059———0.022——0.021尖刺拟菱形藻(Pseudo-nitzschia pungens)——————0.049—0.076—裸甲藻(Gymnodinium sp.)———————0.0570.027—锥状斯氏藻(Scrippsiella trochoidea)———————0.030——布氏双尾藻(Ditylum brightwellii)—————0.0210.037———柔弱根管藻(Rhizosolenia delicatula)————————0.031—具槽直链藻(Melosira sulcata)0.1720.2820.3100.116——————裸藻(Euglena sp.)—————0.055————东海原甲藻(Prorocentrum donghaiense)—————0.0890.073———热带骨条藻(Skeletonema tropicum)————————0.0250.072红色中缢虫(Mesodinium rubrum)0.225—0.1050.034——————细弱海链藻(Thalassiosira subtilis)0.024—————————菱形海线藻(Thalassionema nitzschioides)—0.036—0.051——————直舟形藻(Navicula directa)—0.034————————奇异棍形藻(Bacillaria paradoxa)——0.022———————菱形海线藻小型变种(Thalassionema nitzschioides var.parva)——0.1300.045——————尤氏直链藻(Melosira juergensi)——0.0270.128——————菱形藻(Nitzschia sp.)———0.028——————丹麦细柱藻(Leptocylindrus danicus)————————0.0540.027舟形藻(Navicula sp.)—————————0.044新月细柱藻(Cylindrotheca closterium)—————————0.040北方娄氏藻(Lauderia borealis)0.021—————————
2.2.3 浮游植物丰度的时空分布 养殖区浮游植物丰度所有站位月平均值范围为1.80×104~4.14×106 cells/L,平均为5.33×105 cells/L;2021年12月—2022年3月浮游植物丰度较低,峰值出现在4月,5—8月浮游植物丰度较高(1.02×105~3.96×105 cells/L),9月丰度略有下降;1、4、6、7月湾外养殖区浮游植物丰度显著高于湾内(P<0.05),其余月份无显著性差异(P>0.05) (图3)。调查期间,湾外和湾内浮游植物丰度平均值分别为9.89×105、7.75×104cells/L,湾外显著高于湾内(P<0.05)。
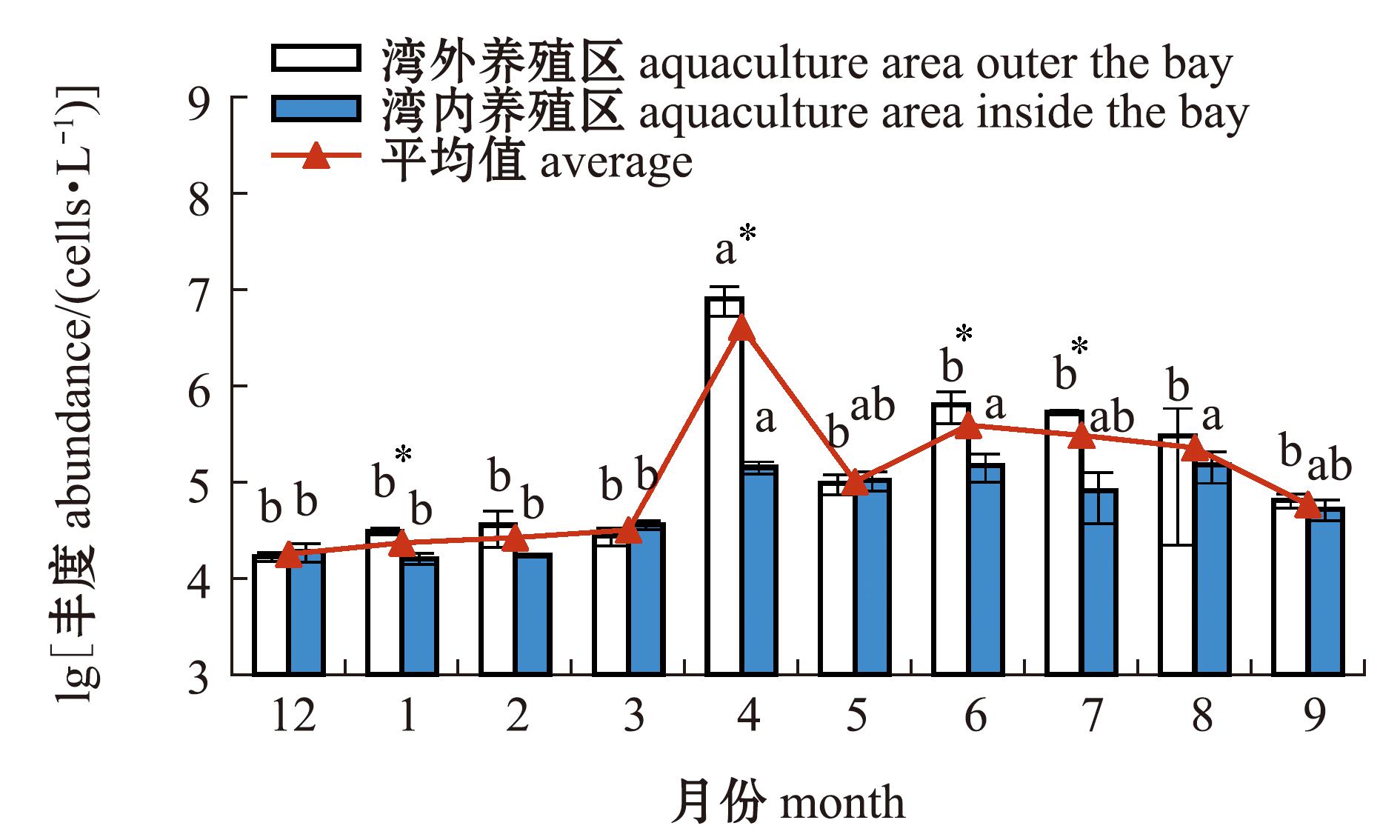
同一养殖区域标有不同字母者表示不同月份间存在显著性差异(P<0.05),标有相同字母者表示组间无显著差异(P>0.05);* 表示同一月份中湾外与湾内养殖区存在显著性差异(P<0.05)。
The means with different letters within the same aquaculture area are significantly different among different months at the 0.05 probability level,and the means with the same letter are not significant differences in the groups at the 0.05 probability level;* indicates there are significant differences between the outside bay and the inside bay within the same month (P<0.05).
图3 2021年12月—2022年9月三倍体牡蛎养殖区浮游植物丰度的变化
Fig.3 Changes in the abundance of phytoplankton in triploid oyster farming areas from December 2021 to September 2022
2.2.4 浮游植物多样性 养殖区浮游植物d指数所有站位月平均值范围为0.80~2.46,平均值为1.90;H′指数月平均值范围为0.50~3.54,平均值为2.69;J指数月平均值范围为0.12~0.69,平均值为0.54 (表3)。除4月赤潮期间浮游植物各项指数较低外,其余调查时间各项指数均在正常范围内,其中,12、1、3、8、9月H′的月平均值>3。总体而言,养殖区浮游植物多样性水平较好,群落结构较稳定。湾外养殖区浮游植物d、H′和J平均值分别为2.00、2.71、0.53,湾内养殖区浮游植物d、H′和J平均值分别为1.80、2.66、0.54,T检验结果显示,湾外与湾内养殖区各项指数组间无显著性差异(P>0.05)。
表3 2021年12月—2022年9月三倍体牡蛎养殖区浮游植物多样性
Tab.3 Diversity of phytoplankton in triploid oyster farming areas from December 2021 to September 2022
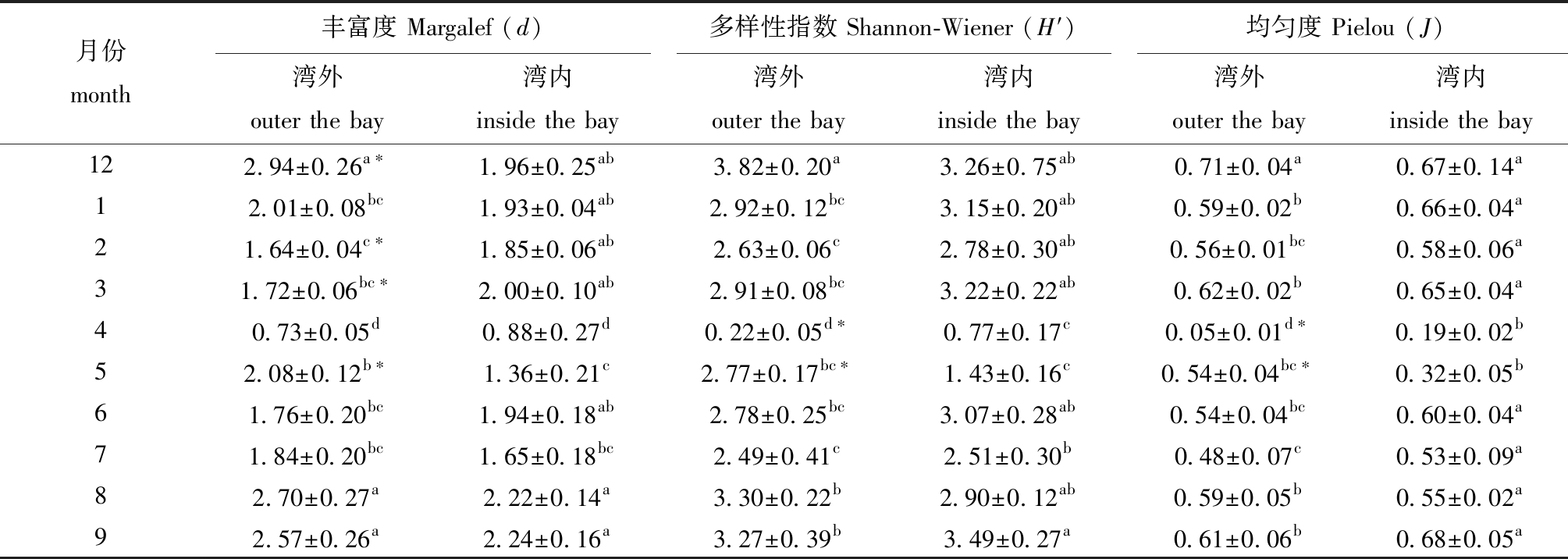
注:同列中标有不同字母表示不同月份间有显著性差异(P<0.05);* 表示同一月份下湾外与湾内养殖区有显著性差异(P<0.05)。
Note:The means with different letters within the same cocumn are significantly different among different months at the 0.05 probability level;* indicates that there are significant differences between the outside bay and the inside bay within the same month (P<0.05).
月份month丰富度 Margalef (d)多样性指数 Shannon-Wiener (H′)均匀度 Pielou (J)湾外outer the bay湾内inside the bay湾外outer the bay湾内inside the bay湾外outer the bay湾内inside the bay122.94±0.26a∗1.96±0.25ab3.82±0.20a3.26±0.75ab0.71±0.04a0.67±0.14a12.01±0.08bc1.93±0.04ab2.92±0.12bc3.15±0.20ab0.59±0.02b0.66±0.04a21.64±0.04c∗1.85±0.06ab2.63±0.06c2.78±0.30ab0.56±0.01bc0.58±0.06a31.72±0.06bc∗2.00±0.10ab2.91±0.08bc3.22±0.22ab0.62±0.02b0.65±0.04a40.73±0.05d0.88±0.27d0.22±0.05d∗0.77±0.17c0.05±0.01d∗0.19±0.02b52.08±0.12b∗1.36±0.21c2.77±0.17bc∗1.43±0.16c0.54±0.04bc∗0.32±0.05b61.76±0.20bc1.94±0.18ab2.78±0.25bc3.07±0.28ab0.54±0.04bc0.60±0.04a71.84±0.20bc1.65±0.18bc2.49±0.41c2.51±0.30b0.48±0.07c0.53±0.09a82.70±0.27a2.22±0.14a3.30±0.22b2.90±0.12ab0.59±0.05b0.55±0.02a92.57±0.26a2.24±0.16a3.27±0.39b3.49±0.27a0.61±0.06b0.68±0.05a
2.3 对照点浮游植物的分布特征及其与养殖区的比较
2022年9月对照点共鉴定出浮游植物52种,浮游植物丰度为8.86×104 cells/L,优势种为中肋骨条藻、热带骨条藻、柔弱拟菱形藻、新月细柱藻、丹麦细柱藻和脆根管藻(Rhizosolenia fragilissima)等。与养殖区相比,对照点浮游植物种类较丰富,丰度略高,种类组成相似,第一优势种均为中肋骨条藻(表4)。对照点浮游植物的d、H′、J值分别为3.10、3.24、0.57,其中,d值高于养殖区,其余指数与湾外养殖区较接近。
表4 2022年9月对照点和养殖区浮游植物的种类组成和丰度
Tab.4 Species composition and abundance of phytoplankton in control site and farming areas in September 2022

站位station站位平均种类数/种average species number at a station平均丰度/(cells·L-1)average abundance优势种及其丰度占比dominant species and their proportion in abundance对照点control site528.86×104中肋骨条藻(43.2%)、热带骨条藻(13.4%)、柔弱拟菱形藻(10.2%)、舟形藻(4.7%)、新月细柱藻(3.7%)、丹麦细柱藻(3.7%)和脆根管藻(3.2%)湾外养殖区aquaculture area outer the bay426.53×104中肋骨条藻(46.2%)、柔弱拟菱形藻(10.8%)、舟形藻(3.8%)、圆海链藻(3.7%)、热带骨条藻(3.1%)、脆根管藻(2.4%)、新月细柱藻(2.3%)和海生斑条藻(Grammatophora marina)(2.2%)湾内养殖区aquaculture area inside the bay365.28×104中肋骨条藻(31.7%)、热带骨条藻(12.2%)、柔弱拟菱形藻(11.8%)、新月细柱藻(6.2%)、舟形藻(5.2%)、窄隙角毛藻(3.7%)、细长列海链藻(Thalassiosira leptopus)(2.7%)和菱形海线藻(2.5%)
2.4 养殖区浮游植物优势种与环境因子的相关性
对养殖区浮游植物优势种(中肋骨条藻、柔弱拟菱形藻)及月调查第一优势种(米氏凯伦藻、具槽直链藻、红色中缢虫)进行DCA分析显示,梯度轴长度均小于3,因此,后续研究选择冗余分析(RDA)。RDA分析结果显示,第1排序轴和第2排序轴中,浮游植物优势种和海洋环境因子的相关性分别为0.949和0.865,在前2个排序轴中,浮游植物优势种和海洋环境因子的变化累计分别为59.2%和82.3%。Monte Carlo随机置换检验表明,所有典范特征轴与浮游植物优势种均极显著相关(P<0.01),表明排序结果可信,能够较好地反映浮游植物与海洋环境因子间的关系。
浮游植物优势种与海洋环境因子的RDA排序结果显示:![]() 和T为第1排序轴的主要影响因子,相关系数分别为0.862 4、0.856 5、0.832 2、0.772 4和-0.701 7,第1排序轴与T的负相关性最大,与TP的正相关性最大;第2排序轴的主要影响因子为S、CODMn、N/P、Si/N和ASi,相关系数分别为-0.490 9、0.423 0、-0.348 1、0.346 7和0.300 7,第2排序轴与S的负相关性最大,与CODMn的正相关性最大(图4)。这表明,影响浮游植物优势种丰度的主要海洋环境因子为TP、AP、S和CODMn。
和T为第1排序轴的主要影响因子,相关系数分别为0.862 4、0.856 5、0.832 2、0.772 4和-0.701 7,第1排序轴与T的负相关性最大,与TP的正相关性最大;第2排序轴的主要影响因子为S、CODMn、N/P、Si/N和ASi,相关系数分别为-0.490 9、0.423 0、-0.348 1、0.346 7和0.300 7,第2排序轴与S的负相关性最大,与CODMn的正相关性最大(图4)。这表明,影响浮游植物优势种丰度的主要海洋环境因子为TP、AP、S和CODMn。
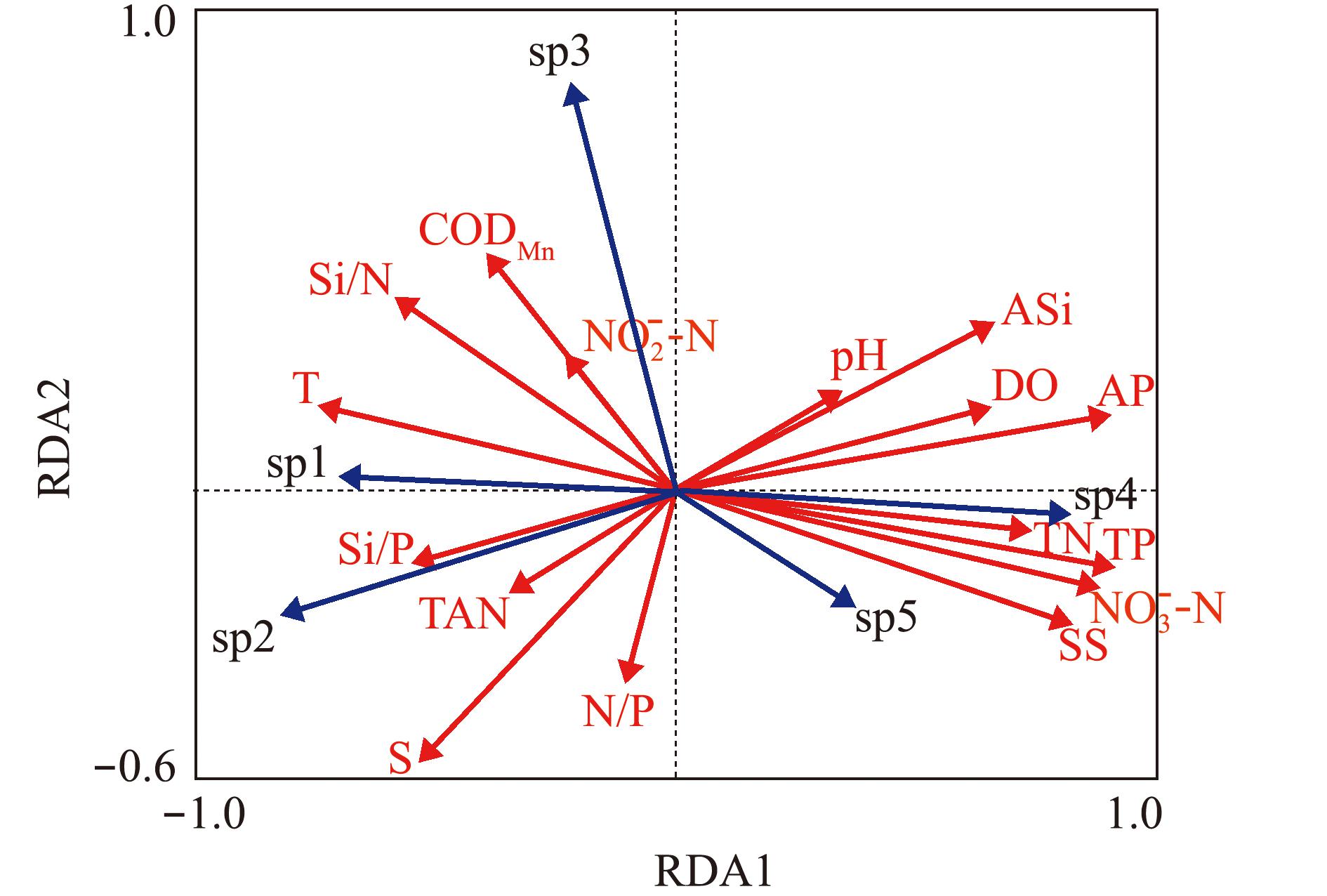
sp1—中肋骨条藻,sp2—柔弱拟菱形藻,sp3—米氏凯伦藻,sp4—具槽直链藻,sp5—红色中缢虫。
sp1—Skeletonema costatum,sp2—Pseudo-nitzschia delicatissima,sp3—Karenia mikimotoi,sp4—Melosira sulcata,sp5—Mesodinium rubrum.
图4 浮游植物与环境因子的RDA排序
Fig.4 Two-dimensional RDA ordination map of phytoplankton and environmental factors
优势种sp1(中肋骨条藻)、sp2(柔弱拟菱形藻),与T、Si/P、TAN、Si/N、S等呈正相关关系,与![]() 等呈负相关关系。其中,sp1与T、AP延长线的夹角最小,说明其受T和AP影响最大;sp2与Si/P的夹角最小,说明其受Si/P影响最大。sp3(米氏凯伦藻)与
等呈负相关关系。其中,sp1与T、AP延长线的夹角最小,说明其受T和AP影响最大;sp2与Si/P的夹角最小,说明其受Si/P影响最大。sp3(米氏凯伦藻)与![]() 等呈正相关关系,与N/P呈负相关关系。sp4(具槽直链藻)、sp5(红色中缢虫)与
等呈正相关关系,与N/P呈负相关关系。sp4(具槽直链藻)、sp5(红色中缢虫)与![]() 等呈正相关关系,与T、Si/N、Si/P等呈负相关关系。
等呈正相关关系,与T、Si/N、Si/P等呈负相关关系。
3 讨论
3.1 浮游植物种类组成、丰度变化及其与海洋环境因子的关系
水温是影响浮游植物生长繁殖的重要环境因子,对浮游植物种类组成及优势种的演替有着重要作用[14]。已有研究表明,硅藻最佳生长温度一般不超过25 ℃[15-16],水温过高时多数硅藻生长会受到限制[17]。本研究表明,黄岐湾位于亚热带,浮游植物中以广温类群种类最为丰富且丰度占绝对优势,广温种占总种类数的70%以上,丰度占比大于95%;暖水类群和暖温类群出现种类较少,丰度也较低;硅藻丰度占比达94.0%,主导着养殖区浮游植物丰度,其季节变化受水温影响显著,冬季丰度较低,春、夏季明显升高,7—9月水温达到28 ℃以上,硅藻生长受到限制,浮游植物丰度则呈下降趋势。RDA分析结果也表明,中肋骨条藻、柔弱拟菱形藻等优势种丰度与水温呈正相关关系,中肋骨条藻丰度受水温影响最大。
盐度的改变会通过渗透压对浮游植物产生胁迫作用[18],从而对浮游植物的种类组成和丰度产生重要影响。本研究表明,受闽江、鳌江等径流带来的冲淡水影响,黄岐湾牡蛎养殖区浮游植物以广盐种、低盐种为主,在雨季淡水种类甚至成为优势种。雨季由于入海径流带来的冲淡水和丰富营养盐,造成6月湾外与湾内养殖区水环境出现一定程度的差异,湾外养殖区受径流影响较大,表现为盐度低、营养盐高的特点,而湾内则与之相反。湾内外水环境因子的差异也导致浮游植物的种类组成和丰度出现显著差异,6月湾外养殖区浮游植物前3优势种为米氏凯伦藻(Y=0.426)、中肋骨条藻(Y=0.181)和旋链角毛藻(Y=0.130),湾内则为中肋骨条藻(Y=0.239)、米氏凯伦藻(Y=0.225)和东海原甲藻(Y=0.160);湾外和湾内养殖区浮游植物丰度差异显著,平均值分别为6.42×105、1.49×105 cells/L。RDA分析结果也表明,盐度是影响浮游植物优势种丰度的主要海洋环境因子。
浮游植物群落结构和演替规律还与氮、磷、硅等营养盐浓度及其比例密切相![]() 等[20]提出营养盐限制标准:当无机氮、活性磷酸盐和活性硅酸盐浓度分别低于1、0.1、2 μmol/L时,对浮游植物生长产生绝对限制;当N/P<10,Si/N>1时,存在氮相对限制;当N/P>22,Si/P>22时,存在磷相对限制;当Si/N<1,Si/P<10时,存在硅相对限制。本研究表明,黄岐湾养殖区营养盐含量较丰富,对浮游植物生长不存在绝对限制。调查期间,N/P、Si/N、Si/P值湾外养殖区范围分别为7.8~98.8、0.98~4.60、29.7~116.6,湾内养殖区范围分别为7.0~43.8、0.79~4.70、19.9~94.8(表1)。湾内与湾外养殖区均未出现硅相对限制,8月均出现氮相对限制,湾外养殖区2021年12月—2022年5、7、9月出现磷相对限制,湾内养殖区2021年12月—2022年3、7月出现磷相对限制。可以看出,黄岐湾养殖区主要为磷相对限制,尤其是湾外养殖区。RDA分析也表明,总磷、活性磷酸盐含量与浮游植物优势种丰度呈显著负相关,是影响优势种丰度的主要环境因子。在高氮低磷的珠江口海域,浮游植物生长也同样表现出对于磷的响应要优于氮[21]。黄岐湾位于闽江口、鳌江口附近,受闽江、鳌江影响较大,而闽江口海域具有磷限制潜在性富营养化特征[22-23]。说明在磷相对限制的河口海湾,磷含量和盐度是影响浮游植物优势种丰度的主要环境因子。
等[20]提出营养盐限制标准:当无机氮、活性磷酸盐和活性硅酸盐浓度分别低于1、0.1、2 μmol/L时,对浮游植物生长产生绝对限制;当N/P<10,Si/N>1时,存在氮相对限制;当N/P>22,Si/P>22时,存在磷相对限制;当Si/N<1,Si/P<10时,存在硅相对限制。本研究表明,黄岐湾养殖区营养盐含量较丰富,对浮游植物生长不存在绝对限制。调查期间,N/P、Si/N、Si/P值湾外养殖区范围分别为7.8~98.8、0.98~4.60、29.7~116.6,湾内养殖区范围分别为7.0~43.8、0.79~4.70、19.9~94.8(表1)。湾内与湾外养殖区均未出现硅相对限制,8月均出现氮相对限制,湾外养殖区2021年12月—2022年5、7、9月出现磷相对限制,湾内养殖区2021年12月—2022年3、7月出现磷相对限制。可以看出,黄岐湾养殖区主要为磷相对限制,尤其是湾外养殖区。RDA分析也表明,总磷、活性磷酸盐含量与浮游植物优势种丰度呈显著负相关,是影响优势种丰度的主要环境因子。在高氮低磷的珠江口海域,浮游植物生长也同样表现出对于磷的响应要优于氮[21]。黄岐湾位于闽江口、鳌江口附近,受闽江、鳌江影响较大,而闽江口海域具有磷限制潜在性富营养化特征[22-23]。说明在磷相对限制的河口海湾,磷含量和盐度是影响浮游植物优势种丰度的主要环境因子。
3.2 浮游植物优势种的主要影响因子
本次黄岐湾牡蛎养殖区浮游植物调查期间,中肋骨条藻的优势度高达0.798,其丰度年平均值在浮游植物总丰度中占比高达82.5%,且2021年12月—2022年9月均为优势种。中肋骨条藻如此高的优势度,首先与其广温广盐特性密切相关,由于其耐低盐且能承受盐度剧变,经常成为河口海湾优势种[24-25]。历史资料也表明,闽江口春、夏季浮游植物的第一优势种均为中肋骨条藻[26]。其次,中肋骨条藻的高优势度还与海水中营养盐结构密切相关,在氮、磷、硅3种营养盐中,黄岐湾海水中硅酸盐含量最丰富,未出现硅相对限制,而丰富的硅酸盐对中肋骨条藻生长繁殖具有明显的促进作用[27]。RDA分析结果也显示,中肋骨条藻丰度受水温、活性磷酸盐、Si/P、Si/N影响较大。第三,由于中肋骨条藻具有很强的光适应生理特征,在照度相对较低的大规模养殖区具有较强的生长竞争优势[27]。在柘林湾、枸杞岛海域等养殖区也出现了中肋骨条藻占绝对优势的情况[28,10]。在中肋骨条藻的高优势度是否还与牡蛎摄食有关的问题中,有学者认为,相比单细胞浮游植物种类,链状种类较难被贝类摄食[29-30],在群落中的优势度会逐渐提升。王兆慧等[31]研究也表明,在持续磷限制条件下,大量的贝类养殖能够提升小型链状硅藻的优势度,增加此类藻赤潮的发生风险。本研究中,对照点水环境条件与湾外养殖区相似,与对照点相比,湾外养殖区浮游植物小型链状硅藻丰度的占比未显著提升,中肋骨条藻和热带骨条藻是9月调查海域的主要优势种,在对照点、湾外、湾内养殖区,两种骨条藻合计占比分别为56.6%、49.3%、43.9%,对照点小型链状硅藻丰度的占比略高。从现有调查数据分析,中肋骨条藻的高优势度与牡蛎摄食无明显关系。但是由于对照点调查数据仅有一次,牡蛎摄食对浮游植物群落结构的影响还有待进一步研究。
柔弱拟菱形藻是黄岐湾牡蛎养殖区浮游植物的第二优势种,RDA分析结果显示,其丰度与Si/P值、氨氮、水温和盐度等环境因子呈正相关关系,受Si/P值影响最大,这与Li等[32]研究发现,硅藻偏爱较高Si/P值的结果一致。8月柔弱拟菱形藻、尖刺拟菱形藻分别为第一、第三优势种,原因可能还与N/P值有关,8月养殖区N/P值为7.4,较适宜拟菱形藻生长,这与李晓娇[33]研究发现,拟菱形藻适宜的N/P值较低,最适宜的N/P值为16的结果一致。
米氏凯伦藻在6月湾外养殖区成为第一优势种,在湾内其丰度较低,为第二优势种。已有研究表明,米氏凯伦藻赤潮通常发生在温度为20.5~25.0 ℃、盐度为24.3~32.3的海域,其生长最适温度为22.0~25.0 ℃,最适盐度为26.0~30.0[34]。6月黄岐湾海域牡蛎养殖区水温为23.0~23.5 ℃,盐度为24.4~27.7,水温、盐度均较适宜米氏凯伦藻生长。RDA分析结果显示,米氏凯伦藻丰度与亚硝酸氮、CODMn关系最密切,与其呈正相关关系,与N/P呈负相关关系,说明较低的N/P值有利于米氏凯伦藻生长,这与罗昊[35]的研究结果一致。而CODMn大致反映了水体中有机物的水平,浮游植物也是一种有机物,因此,CODMn与中肋骨条藻、柔弱拟菱形藻、米氏凯伦藻等优势种丰度均呈正相关关系。
具槽直链藻、红色中缢虫分别在2、12月成为养殖区第一优势种,二者均主要出现在冬季。RDA分析结果显示,具槽直链藻、红色中缢虫丰度与总氮、总磷、硝酸氮、悬浮物、活性磷酸盐等环境因子呈正相关关系,与水温、Si/N、Si/P等呈负相关关系。这两个种类均为广温性种类,它们在冬季丰度较高的原因,除了水温较适宜、海水中营养盐含量较丰富之外,应该主要与冬季风浪较大有关。具槽直链藻为底栖性硅藻,而大个体红色中缢虫主要分布于底部水层[36],冬季风浪较大,底泥受搅动使其悬浮于海水中,因此,其丰度与悬浮物含量呈正相关关系。
4 结论
1)黄岐湾海域三倍体牡蛎养殖期间共鉴定出浮游植物6门65属133种,其中,硅藻门101种,占总种类数的75.9%,其余依次为甲藻门、蓝藻门、金藻门、裸藻门和原生动物门。浮游植物以广温广盐类群最为常见且丰度占绝对优势,优势种为中肋骨条藻、柔弱拟菱形藻。中肋骨条藻的高优势度与其广温广盐特性、较强的光适应生理特征及海水中丰富的硅酸盐有关。
2)调查区域浮游植物丰度范围为1.80×104~4.14×106 cells/L,平均为5.33×105 cells/L,湾外养殖区丰度显著高于湾内。浮游植物d、H′、J指数平均值分别为1.90、2.69、0.54,其中12、 1、 3、 8、 9月H′>3,说明牡蛎养殖区浮游植物多样性水平较高,群落结构较稳定。
3) 冗余分析显示,影响浮游植物优势种丰度的主要环境因子是总磷、活性磷酸盐、盐度和化学需氧量,主要优势种中肋骨条藻受水温、活性磷酸盐影响最大,柔弱拟菱形藻受Si/P值影响最大。说明在磷相对限制的河口海湾,磷含量和盐度是影响浮游植物优势种丰度的主要环境因子。
[1] RACAULT M F,PLATT T,SATHYENDRANATH S,et al.Plankton indicators and ocean observing systems:support to the marine ecosystem state assessment[J].Journal of Plankton Research,2014,36(3):621-629.
[2] ROTT E,CANTONATI M,FÜREDER L,et al.Benthic algae in high altitude streams of the Alps-a neglected component of the aquatic biota[J].Hydrobiologia,2006,562(1):195-216.
[3] SIDIK M J,RASHED-UN-NABI M,HOQUE A.Distribution of phytoplankton community in relation to environmental parameters in cage culture area of Sepanggar Bay,Sabah,Malaysia[J].Estuarine,Coastal and Shelf Science,2008,80(2):251-260.
[4] 曾志南,林琪,吴建绍,等.僧帽牡蛎三倍体和二倍体的生长比较[J].中国水产科学,1999,6(4):59-61.ZENG Z N,LIN Q,WU J S,et al.Growth comparison of triploids and diploids of the oyster Saccostrea cucullata[J].Journal of Fishery Sciences of China,1999,6(4):59-61.(in Chinese)
[5] 武祥伟,张跃环,肖述,等.熊本牡蛎中国群体与美国群体杂交效应及杂交三倍体优势分析[J].中国水产科学,2019,26(3):465-472.WU X W,ZHANG Y H,XIAO S,et al.Heterosis and triploid advantage between Chinese and American populations of Kumamoto oysters(Crassostrea sikamea)[J].Journal of Fishery Sciences of China,2019,26(3):465-472.(in Chinese)
[6] 林国清,林位琅,林楠,等.福建三倍体牡蛎养殖业发展现状分析与对策建议[J].中国水产,2023(4):91-95.LIN G Q,LIN W L,LIN N,et al.Analysis on the development status of triploid oyster breeding in Fujian and countermeasures[J].China Fisheries,2023(4):91-95.(in Chinese)
[7] 张玲,李政菊,陈飞羽,等.大鹏澳牡蛎养殖对浮游植物种群结构的影响研究[J].海洋与湖沼,2015,46(3):549-555.ZHANG L,LI Z J,CHEN F Y,et al.Impact of oyster aquaculture on phytoplankton population structure in Dapeng cove[J].Oceanologia et Limnologia Sinica,2015,46(3):549-555.(in Chinese)
[8] 卢钰博,于潇,李希磊,等.养马岛扇贝养殖区浮游藻类的生态特征及其与环境因子的关系[J].渔业研究,2019,41(3):207-216.LU Y B,YU X,LI X L,et al.Ecological characteristics of planktonic algae and their relationship with environmental factors in scallop culture area of Yangma Island[J].Journal of Fisheries Research,2019,41(3):207-216.(in Chinese)
[9] KONG N,LIU Z Q,YU Z C,et al.Dynamics of phytoplankton community in scallop farming waters of the Bohai Sea and North Yellow Sea in China[J].BMC Ecology and Evolution,2022,22(1):48.
[10] 关莹莹,林军,焦俊鹏,等.高滤食压力下贻贝筏式养殖场及周边海域浮游植物群落特征[J].海洋环境科学,2022,41(4):543-553.GUAN Y Y,LIN J,JIAO J P,et al.The characteristics of phytoplankton community of mussel raft farms and surrounding waters under high filtration pressure[J].Marine Environmental Science,2022,41(4):543-553.(in Chinese)
[11] 陈雷,许传才,刘海映,等.葫芦岛贝类养殖区浮游生物的群落结构和时空分布[J].大连海洋大学学报,2013,28(2):199-205.CHEN L,XU C C,LIU H Y,et al.The community structure and spatial-temporal distribution of plankton in shellfish beds in coastal Huludao[J].Journal of Dalian Ocean University,2013,28(2):199-205.(in Chinese)
[12] 孙军,刘东艳,徐俊,等.1999年春季渤海中部及其邻近海域的网采浮游植物群落[J].生态学报,2004,24(9):2003-2016.SUN J,LIU D Y,XU J,et al.The net-phytoplankton community of the Central Bohai Sea and its adjacent waters in spring 1999[J].Acta Ecologica Sinica,2004,24(9):2003-2016.(in Chinese)
[13] 王璐,韩笑天,张洪亮,等.红色中缢虫的生物学特征及其爆发赤潮成因分析[J].海洋科学,2008,32(2):80-84.WANG L,HAN X T,ZHANG H L,et al.Biological characteristics of Mesodinium rubrum and analysis of causes of its blooms[J].Marine Sciences,2008,32(2):80-84.(in Chinese)
[14] DUPUIS A P,HANN B J.Warm spring and summer water temperatures in small eutrophic lakes of the Canadian PRAIRIES:potential implications for phytoplankton and zooplankton[J].Journal of Plankton Research,2009,31(5):489-502.
[15] COLES J F,JONES R C.Effect of temperature on photosynthesis-light response and growth of four phytoplankton species isolated from a tidal freshwater river[J].Journal of Phycology,2000,36(1):7-16.
[16] MITROVIC S M,HITCHCOCK J N,DAVIE A W,et al.Growth responses of Cyclotella meneghiniana (Bacillariophyceae) to various temperatures[J].Journal of Plankton Research,2010,32(8):1217-1221.
[17] 李希磊,杨俊丽,于潇,等.烟台四十里湾扇贝养殖区浮游植物群落调查[J].海洋科学,2018,42(8):30-37.LI X L,YANG J L,YU X,et al.Investigation of phytoplankton community in the scallop culture area of Sishili Bay in Yantai[J].Marine Sciences,2018,42(8):30-37.(in Chinese)
[18] STEFANIDOU N,GENITSARIS S,LOPEZ-BAUTISTA J,et al.Response of a coastal Baltic Sea diatom-dominated phytoplankton community to experimental heat shock and changing salinity[J].Oecologia,2019,191(2):461-474.
[19] BALODE M,PURINA I,BEÉCHEMIN C,et al.Effects of nutrient enrichment on the growth rates and community structure of summer phytoplankton from the Gulf of Riga,Baltic Sea[J].Journal of Plankton Research,1998,20(12):2251-2272.
[20] ![]() D,RABALAIS N N,TURNER R E,et al.Changes in nutrient structure of river-dominated coastal waters:stoichiometric nutrient balance and its consequences[J].Estuarine,Coastal and Shelf Science,1995,40(3):339-356.
D,RABALAIS N N,TURNER R E,et al.Changes in nutrient structure of river-dominated coastal waters:stoichiometric nutrient balance and its consequences[J].Estuarine,Coastal and Shelf Science,1995,40(3):339-356.
[21] 施玉珍,赵辉,王喜达,等.珠江口海域营养盐和叶绿素a的时空分布特征[J].广东海洋大学学报,2019,39(1):56-65.SHI Y Z,ZHAO H,WANG X D,et al.Distribution characteristics of nutritive salts and chlorophyll a in the Pearl River Estuary[J].Journal of Guangdong Ocean University,2019,39(1):56-65.(in Chinese)
[22] 林建杰.闽江口水环境主要理化因子时空分布特征研究[J].渔业研究,2021,43(6):549-561.LIN J J.Spatial and temporal distribution characteristics of main physicochemical factors in Min River Estuary[J].Journal of Fisheries Research,2021,43(6):549-561.(in Chinese)
[23] 叶翔,陈坚,暨卫东,等.闽江口营养盐生物地球化学过程研究[J].环境科学,2011,32(2):375-383.YE X,CHEN J,JI W D,et al.Research the biogeochemical processes of nutrients in Minjiang Estuary[J].Environmental Science,2011,32(2):375-383.(in Chinese)
[24] 赖廷和,邱绍芳.北海近岸水域浮游植物群落结构及数量周年变化特征[J].海洋通报,2005,24(5):27-32.LAI T H,QIU S F.Annual dynamic of the phytoplankton in the along shore seawaters of Beihai[J].Marine Science Bulletin,2005,24(5):27-32.(in Chinese)
[25] 何斌源,赖廷和,宁秋云,等.防城河口湾浮游植物群落结构及其与环境因子的关系[J].海洋环境科学,2021,40(5):766-775,804.HE B Y,LAI T H,NING Q Y,et al.Phytoplankton community structure and its relationship with environmental factors in Fangchenghe Estuary of Guangxi,China[J].Marine Environmental Science,2021,40(5):766-775,804.(in Chinese)
[26] 肖莹.闽江口海域浮游植物群落结构特征[J].福建水产,2013,35(4):258-263.XIAO Y.Study on the ecological characteristics of phytoplankton community in Minjiang Estuary[J].Journal of Fujian Fisheries,2013,35(4):258-263.(in Chinese)
[27] ![]() D,RABALAIS N N,TURNER R E.Stoichiometric nutrient balance and origin of coastal eutrophication[J].Marine Pollution Bulletin,1995,30(1):41-46.
D,RABALAIS N N,TURNER R E.Stoichiometric nutrient balance and origin of coastal eutrophication[J].Marine Pollution Bulletin,1995,30(1):41-46.
[28] 杜虹,黄长江,陈善文,等.2001—2002年粤东柘林湾浮游植物的生态学研究[J].海洋与湖沼,2003,34(6):604-617.DU H,HUANG C J,CHEN S W,et al.Ecological study on phytoplankton in Zhelin Bay,eastern Guangdong:2001-2002[J].Oceanologia et Limnologia Sinica,2003,34(6):604-617.(in Chinese)
[29] 张莉红,张学雷,李瑞香,等.桑沟湾扇贝养殖对甲藻数量的影响[J].海洋科学进展,2005,23(3):342-346.ZHANG L H,ZHANG X L,LI R X,et al.Impact of scallop culture on dinoflagellate abundance in the Sanggou Bay[J].Advances in Marine Science,2005,23(3):342-346.(in Chinese)
[30] 潘绘竹.黄渤海海域几种典型双壳贝类对浮游植物的摄食规律研究[D].广州:暨南大学,2020:55.PAN H Z.Study on feeding selectivity of different phytoplankton assemblages by several typical bivalve species in the Yellow Sea and Bohai Sea[D].Guangzhou:Jinan University,2020:55.(in Chinese)
[31] 王兆慧,张光涛.牡蛎对浮游植物群落下行控制作用的围隔实验研究[J].海洋科学,2020,44(9):47-53.WANG Z H,ZHANG G T.Top-down impacts of Crassostrea gigas on the phytoplankton community:mesocosm experiments in a eutrophic pond[J].Marine Sciences,2020,44(9):47-53.(in Chinese)
[32] LI J,GLIBERT P M,ZHOU M,et al.Relationships between nitrogen and phosphorus forms and ratios and the development of dinoflagellate blooms in the East China Sea[J].Marine Ecology Progress Series,2009,383:11-26.
[33] 李晓娇.氮磷营养盐对胶州湾浮游植物群落结构的影响[D].上海:上海海洋大学,2021:14.LI X J.Effects of nitrogen and phosphorus nutrients on phytoplankton community structure in Jiaozhou Bay[D].Shanghai:Shanghai Ocean University,2021:14.(in Chinese)
[34] 丁光茂,张树峰.2012年三沙湾米氏凯伦藻赤潮的生态特征及成因分析[J].海洋学报,2018,40(6):104-112.DING G M,ZHANG S F.Ecological characteristics and the causes of Karenia mikimotoi bloom in the Sansha Bay in 2012[J].Haiyang Xuebao,2018,40(6):104-112.(in Chinese)
[35] 罗昊.探究营养盐因子在甲藻生长、分子响应以及赤潮形成过程中的作用[D].厦门:厦门大学,2019:63.LUO H.Exploring the impacts of nutrients on cell growth、molecular response and bloom formation of Dinoflagellates[D].Xiamen:Xiamen University,2019:63.(in Chinese)
[36] MOURITSEN L T,RICHARDSON K.Vertical microscale patchiness in nano- and microplankton distributions in a stratified estuary[J].Journal of Plankton Research,2003,25(7):783-797.