厚壳贻贝(Mytilus coruscus)具有重要的经济价值[1-2],在中国东南沿海等地广泛分布,其营养丰富,有“海中鸡蛋”之美称。随着人类活动和环境变化,野生贻贝的产量大幅减少,而市场对于贻贝的需求量日渐增大,因此,对厚壳贻贝生长发育的研究具有重要意义。厚壳贻贝是典型的无脊椎动物,其生活史包含浮游生活阶段和附着生活阶段,附着变态是衔接上述两个阶段的过程,本课题组前期研究发现,细菌生物被膜及胞外产物是调控该过程的重要因素[3-5],但厚壳贻贝自身基因对其发育阶段的调控仍需深入探究。
前期试验证实,G蛋白偶联受体、Wnt信号通路和NF-κB基因等均有可能参与厚壳贻贝的附着变态过程[6-7]。细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)是丝裂原活化蛋白激酶 (MAPK,mitogen-activated protein kinase)家族的一员,也是目前研究最广泛和最透彻的一条经典通路[8]。ERK作为能够被G蛋白偶联受体激活的下游信号因子,在ERK和NF-κB信号通路的相互关联中起着中介作用,能促进IKK激活,使IκB磷酸化,并进一步激活NF-κB,使其靶基因转录[9]。
在脊椎动物中,ERK在卵母细胞减数分裂启动过程中发挥作用,如ERK参与调控小鼠(Mus musculus)卵泡的发育和卵母细胞的原核形成过程[10-11];参与非洲爪蟾(Xenopus laevis)卵母细胞减数分裂的过程[12-13]。在无脊椎动物中,ERK作为被发现的第一个MAPK信号转导途径,参与调控细胞生长、增殖、分化、凋亡和免疫反应[8,14-15]等多种生理过程。在无脊椎动物发育过程中,ERK基因也具有重要作用,如在石鳖(Chaetopleura)、青贝(Tectura)和蜗牛(Lymnaea)等软体动物胚胎发育过程中,ERK基因均呈现高表达现象[16];当ERK信号被抑制时,玻璃海鞘(Ciona intestinalis)胚胎母细胞丧失分化为脊索的潜能,而分化为神经前体[17],同时,ERK基因也是调控玻璃海鞘尾部退化的重要基因,该基因被敲降后玻璃海鞘的变态率降低[18]。但ERK基因在贝类附着变态过程中发挥的作用仍未知。
本研究中,通过RACE克隆技术获得了McERK全长,分析了其在外套膜、鳃等组织及眼点幼虫、稚贝等发育阶段的表达情况,并用电穿孔法转染McERK siRNA干扰McERK基因的表达,分析其在厚壳贻贝幼虫变态过程中的作用,以期为厚壳贻贝变态发育的研究提供数据支持。
1 材料与方法
1.1 材料
试验用厚壳贻贝成贝采自浙江省嵊泗县枸杞岛附近海域。采集后当天运回实验室,在黑暗条件下以5 只/mL的密度培养,壳长为(9.7±0.5)cm。实验室养殖条件为水温21 ℃,养殖用海水盐度为30,以实验室养殖的微藻为食。
1.2 方法
1.2.1 样本的采集 总RNA提取的样本来自养殖的成贝,选取活力旺盛、体型一致的厚壳贻贝进行解剖,获取外套膜、鳃、消化腺、性腺、足、血细胞、唇瓣和肠道,用液氮速冻后于-80 ℃超低温冰箱中保存,用于后续试验。
通过实验室人工受精的方式获取厚壳贻贝眼点幼虫,具体步骤参考Yang等[19]的方法。眼点幼虫的培养环境为18 ℃避光,养殖密度为5只/mL,每日定期投喂湛江等边金藻,直至幼虫生长到合适大小再进行后续试验。用于提取总RNA的样品中约含有200只幼虫。
1.2.2 总RNA提取和cDNA合成 使用TaKaRa公司(日本) RNAiso Plus 试剂进行厚壳贻贝总RNA的提取。分别提取外套膜、鳃、消化腺、性腺、足、血细胞、唇瓣和肠道组织,以及担轮幼虫、D型幼虫、壳顶幼虫、眼点幼虫和稚贝各发育阶段的总RNA,使用10 g/L琼脂糖凝胶检测所提取RNA的质量和浓度。通过反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser获取cDNA,用SMARTerTM RACE 5′/3′ Kit(Clontech,日本)合成RACE克隆的cDNA第一条链。
1.2.3 McERK基因全长克隆 参照实验室厚壳贻贝的转录组数据,根据McERK基因的CDS序列设计引物(McERK,表1),对已知的序列进行验证。根据正确的CDS序列设计3′ 和 5′ RACE扩增引物(表1),分别进行3′端和5′端扩增,将扩增得到的PCR产物进行电泳检测后切胶回收,回收得到的产物检测浓度后与pMD19-T载体连接,并转化至DH5α感受态细胞中,用含有Kana抗性的LB平板筛选含有目的序列的感受态细胞,将PCR验证得到的阳性克隆进行测序,获得所需序列信息。
表1 试验所用引物序列
Tab.1 Primer sequence used in the study

引物primer序列(5′-3′)sequence(5′-3′)用途usageERKF:CCGAGGACTCAAATACATAPCRR:CGGTTCTTCTGCGACAGGTTPCRMcERK3′RACE:GATCACGGTGGAACAGTCATTGGA3′RACE5′RACE:TGGTCATGGTCAGGGTCAGCAA5′RACEMcERK-RTF:CTCCGAGGACTCAAATACATACACTqRT-PCRR:GCTACATATTCTGTCAGGAAACCAGqRT-PCREF-1α-RTF:CACCACGAGTCTCTCCCTGAqRT-PCRR:GCTGTCACCACAGACCATTCCqRT-PCRMcERK siRNA GACCAGUUGAACCAUAUAUTTRNAiNC siRNAUUCUCCGAACGUGUCACGUTTRNAi
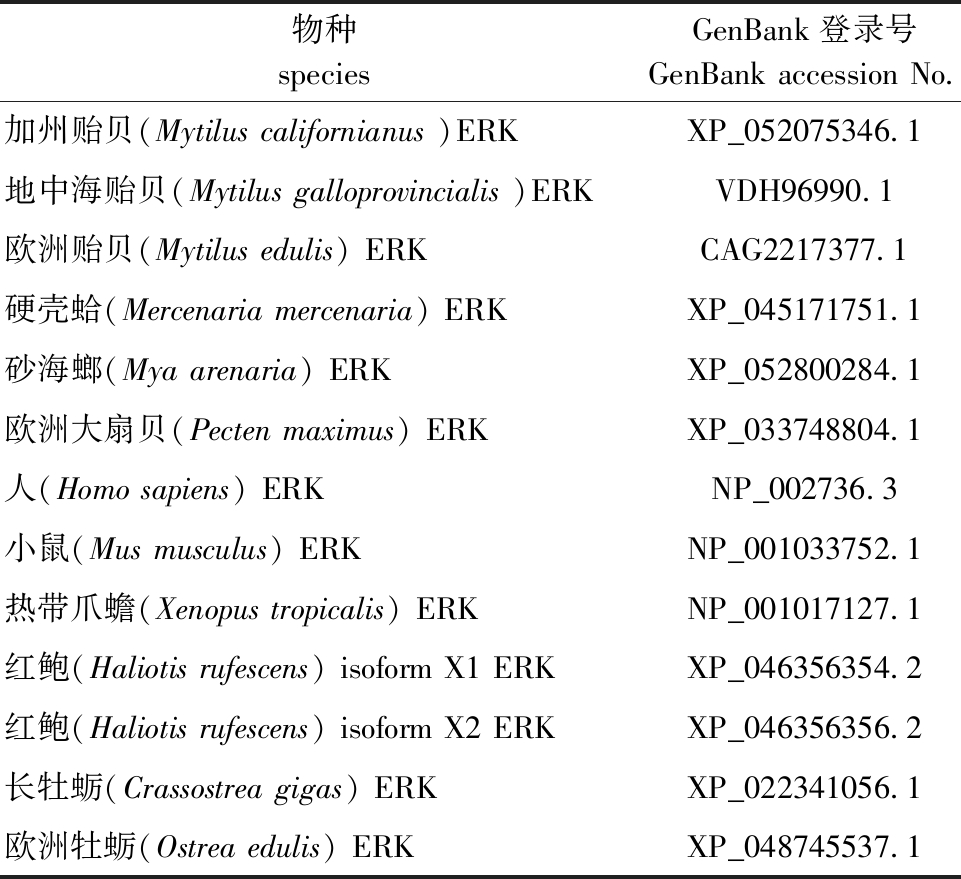
1.2.4 McERK基因序列分析 在NCBI数据库中选择Blask对获得的McERK基因全长进行亲缘性分析,用于对比分析的ERK信息见表2;使用ORF Finder在线网站进行McERK基因的开放阅读框和氨基酸序列分析;使用ProtParam在线预测McERK蛋白的相对质量和等电点;使用SMART在线网站预测McERK蛋白的结构域;通过DNAman V6对目的蛋白的氨基酸序列与其他物种的ERK氨基酸序列进行多重比对分析和标记,利用Mega11软件进行系统进化分析(Neighbor-Joining法,bootstra重复计算1 000次)。
表2 亲缘性和进化分析所用物种ERK信息
Tab.2 Species ERK information for affinity and evolutionary analysis
物种speciesGenBank登录号GenBank accession No.加州贻贝(Mytilus californianus )ERKXP_052075346.1地中海贻贝(Mytilus galloprovincialis )ERKVDH96990.1欧洲贻贝(Mytilus edulis) ERKCAG2217377.1硬壳蛤(Mercenaria mercenaria) ERKXP_045171751.1砂海螂(Mya arenaria) ERKXP_052800284.1欧洲大扇贝(Pecten maximus) ERKXP_033748804.1人(Homo sapiens) ERKNP_002736.3小鼠(Mus musculus) ERKNP_001033752.1热带爪蟾(Xenopus tropicalis) ERKNP_001017127.1红鲍(Haliotis rufescens) isoform X1 ERKXP_046356354.2红鲍(Haliotis rufescens) isoform X2 ERKXP_046356356.2长牡蛎(Crassostrea gigas) ERKXP_022341056.1欧洲牡蛎(Ostrea edulis) ERKXP_048745537.1
1.2.5 McERK基因的表达分析 使用Primer Premier 5.0软件设计引物McERK-RT,用于荧光定量试验,选择EF-1α-RT作为内参基因(表1),并以内参基因的表达量为基准计算相对表达量。PCR反应体系(共10 μL):模板cDNA 1 μL,McERK-RT-F、McERK-RT-R各0.3 μL,qMix 5 μL,ddH2O 3.4 μL。每组样品设置3组生物学重复和3次技术重复。用JMP10.0软件对不同样品中的基因表达量进行差异性分析,显著性水平设为0.05。
1.2.6 眼点幼虫RNA干扰后的变态诱导试验 利用肾上腺素(epinephrine,EPI)检测幼虫是否具有变态能力,参考Zhang等[20]的试验方法。将20只眼点幼虫暴露在20 mL灭菌过滤海水(AFSW)中,分别记录0、6、12、24、48、72、96 h时6个时间点幼虫的变态数量。以灭菌过滤海水暴露刺激为阴性对照,每组设置6个平行(n=120)。
由吉玛公司(GenePharma,上海)设计siRNA(Short interfering RNA)引物序列(表1)。采用电穿孔法进行RNA干扰试验,在显微镜下挑选活力好的幼虫,用AFSW漂洗干净后将150只幼虫分别置于只含有AFSW(空白对照)、含有0.8 μg/mL McERK siRNA的AFSW(试验组)、含有0.8 μg/mL 非目的基因siRNA的AFSW(阴性对照组)无菌无酶1.5 mL tube 管中孵育5 min,随后将幼虫和siRNA混合物转移到电击杯中,利用电穿孔仪进行电击。将电击后的幼虫在电极杯中静置10 min后转移到AFSW中,24 h后收集幼虫,验证McERK基因的表达量,所有的处理组均独立进行6次重复(n=900)。
参照Liang等[5]的方法,用鞭毛蛋白(Flagellin)诱导幼虫进行变态试验。试验共设置6组:空白对照组(AFSW)、鞭毛蛋白诱导对照组(Flagellin)、仅NC siRNA干扰的对照组(NC siRNA)、NC siRNA干扰后的鞭毛蛋白诱导组(NC siRNA+Flagellin)、仅ERK siRNA干扰的对照组(McERK siRNA)及ERK siRNA 干扰后的鞭毛蛋白诱导组(McERK siRNA+Flagellin)。AFSW空白对照组、鞭毛蛋白诱导对照组所使用的幼虫为经过电击处理且有正常变态能力的幼虫,每组设置6个平行,每个平行均含20只幼虫,幼虫培养在无菌的六孔板内,每隔6 h在倒置显微镜下观察幼虫的存活率及行为学变化,幼虫的行为包含变态、爬行、静止、游泳和死亡。共记录0、6、12、24、48、72、96 h时6个时间点。
2 结果与分析
2.1 厚壳贻贝McERK基因cDNA全长序列
克隆得到厚壳贻贝McERK基因的cDNA(GenBank登录号:OR797613)全长为1 236 bp,5′非编码区为111 bp,3′非编码区为279 bp,开放阅读框(ORF)为846 bp,可编码281 个氨基酸(图1)。根据McERK基因的氨基酸序列预测其蛋白相对分子质量为32 460,等电点为5.53。SMART在线预测结果发现,第1位~第167位氨基酸为S_TKc结构域(图1),该结构域具有丝氨酸/苏氨酸蛋白激酶的典型特征。

加粗表示起始密码子ATG和终止密码子TAG,黄色区域表示S_TKc结构域。
The start codon ATG and the stop codon TAG are font bolding,and the yellow area represents the S_TKc domain.
图1 McERK基因cDNA全长及氨基酸序列
Fig.1 cDNA full length and deduced amino acid sequences of McERK gene
2.2 厚壳贻贝McERK的系统进化分析
将厚壳贻贝与长牡蛎(Crassostrea gigas)、砂海螂(Mya arenaria)、加州贻贝(Mytilus californianus)等物种的ERK氨基酸序列进行比对,结果显示,与欧洲贻贝(Mytilus edulis)的一致性最高(73.39%)。厚壳贻贝与包含上述物种在内的多个物种进行多重序列比对发现,ERK具有保守的S_TKc结构域,其中,厚壳贻贝和加州贻贝的S_TKc结构域一致性为100%(图2)。系统进化分析显示,厚壳贻贝首先与加州贻贝、地中海贻贝(M.galloprovincialis)和欧洲贻贝聚为一支,再与长牡蛎和欧洲牡蛎(Ostrea edulis)聚为一支(图3),表明McERK符合传统进化关系。
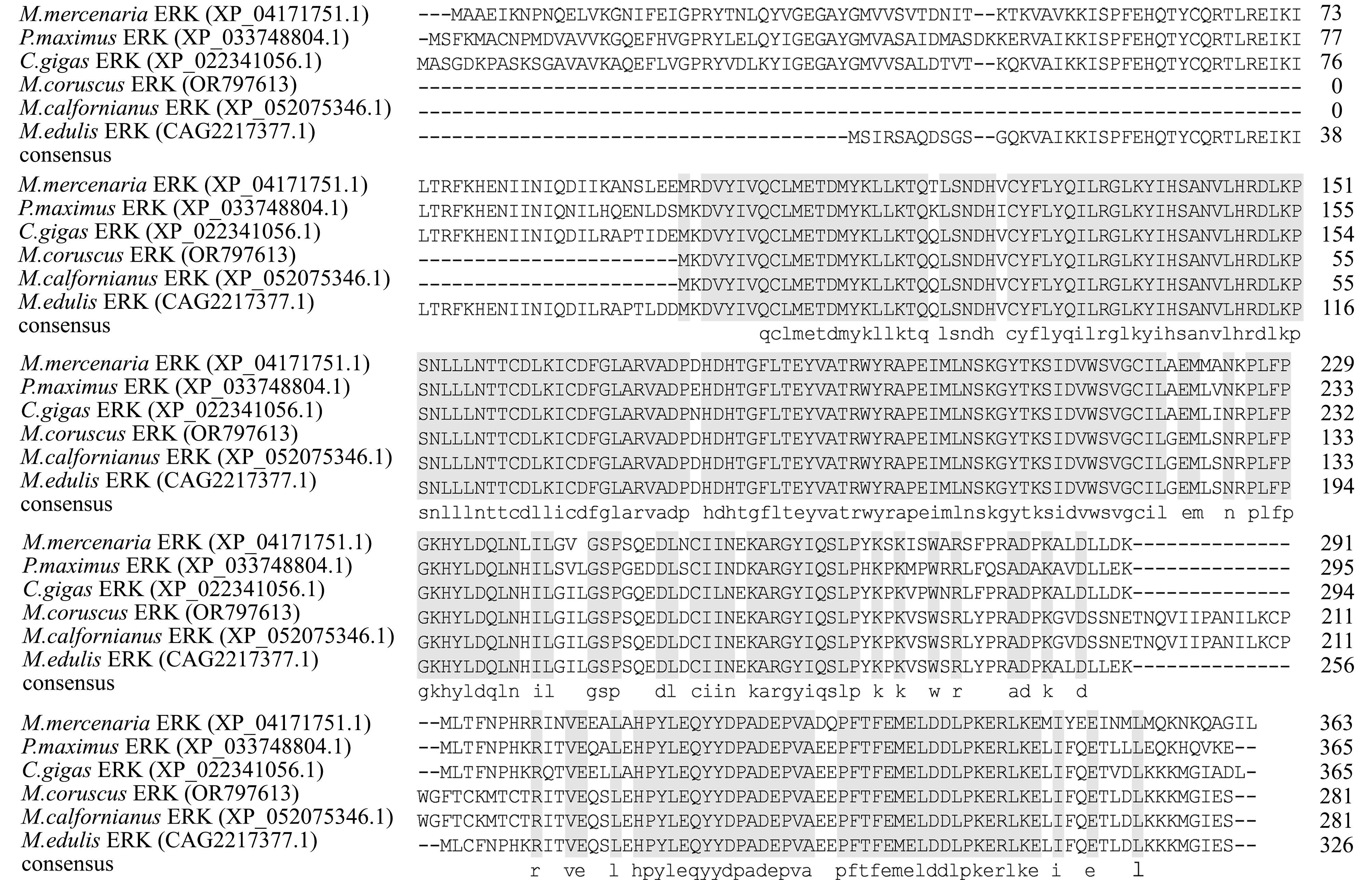
阴影的氨基酸序列具有100%的一致性。
The amino acid sequences of individual species in the shaded part have 100% homology.
图2 厚壳贻贝与其他物种ERK氨基酸的多重序列比对
Fig.2 Multiple sequence alignment of ERK amino acids between Mytilus coruscus and other species

图3 不同物种ERK氨基酸序列的系统进化树
Fig.3 Phylogenetic tree of amino acid sequences of ERK in different species
2.3 McERK基因在不同组织和发育阶段的表达分布
荧光定量PCR分析显示,McERK基因在厚壳贻贝成贝的各个组织广泛表达,其中,McERK基因在外套膜中表达量最高且显著高于其他组织(P<0.05),其他组织表达量由高到低依次为鳃、唇瓣、血淋巴、肠道、性腺、消化腺和足(图4)。
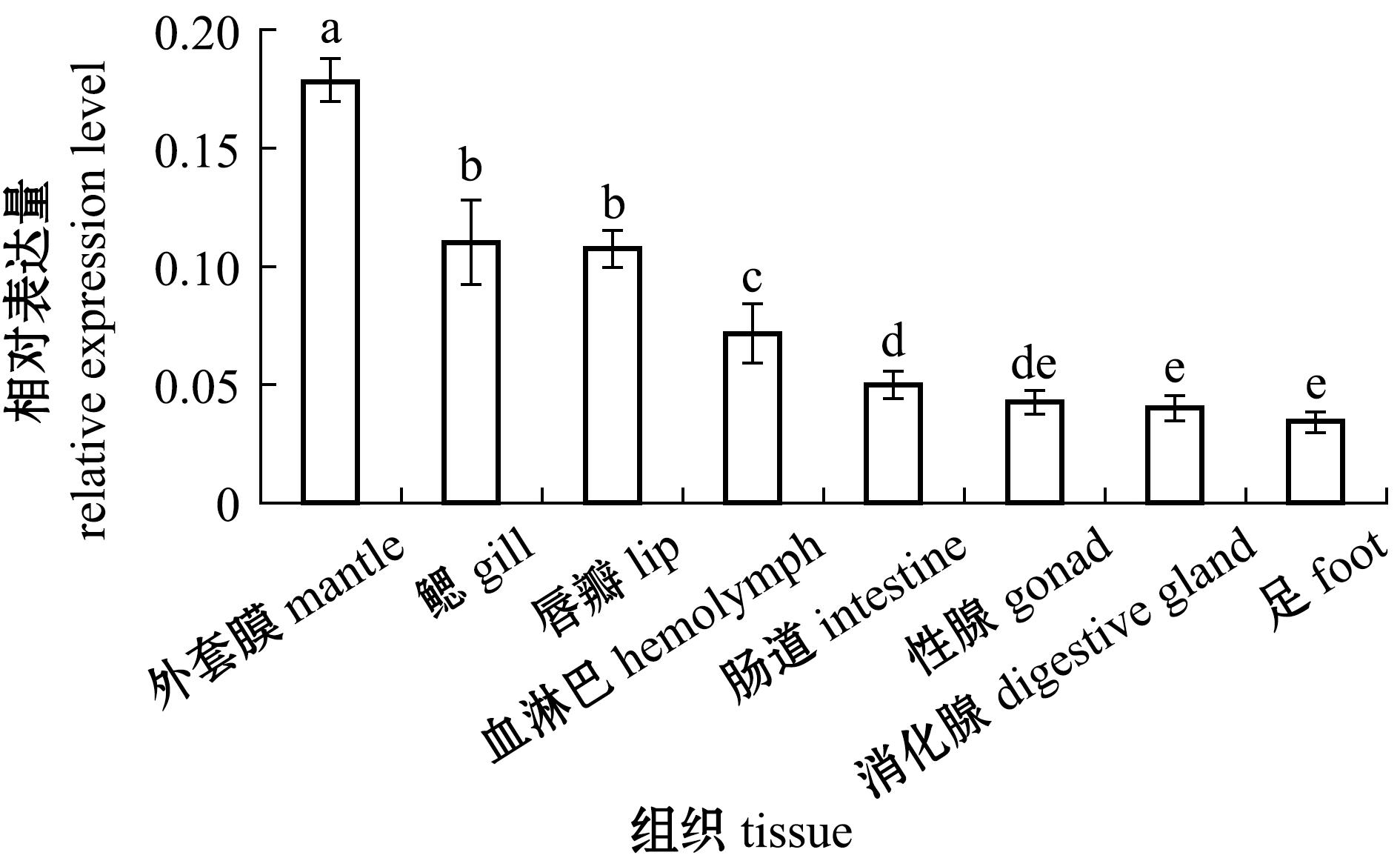
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significant differences in different groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图4 McERK mRNA在厚壳贻贝组织中的表达
Fig.4 Expression level of McERK mRNA in various tissues of Mytilus coruscus
对厚壳贻贝不同发育阶段的McERK基因表达分析发现,McERK基因在各个发育阶段也均有表达,其中,在眼点幼虫时期McERK表达量最高且显著高于其他发育阶段(P<0.05),其他发育阶段表达量由高到低依次为稚贝、担轮幼虫、壳顶幼虫和D型幼虫(图5)。
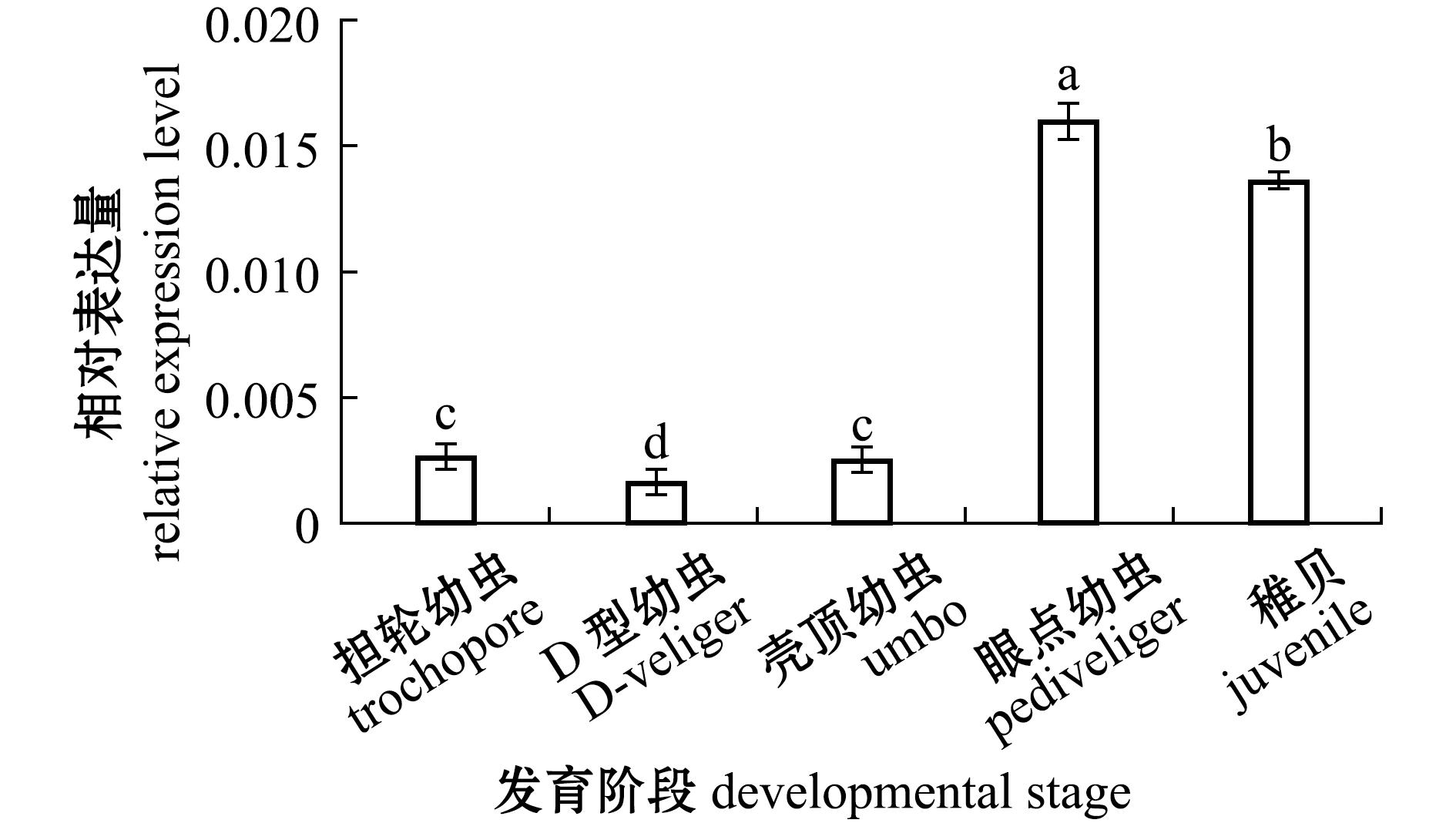
图5 McERK mRNA在厚壳贻贝不同发育阶段的表达
Fig.5 Expression levels of McERK mRNA at different developmental stages of Mytilus coruscus
2.4 鞭毛蛋白刺激对McERK基因表达的影响
McERK siRNA转染后,McERK mRNA的表达水平相较于未转染siRNA的空白对照组和转染了NC siRNA的阴性对照组表达量分别下降了46.3%和52.1%,且有显著性差异(P<0.05);鞭毛蛋白刺激存在时,未转染siRNA的空白对照组和转染了NC siRNA的阴性对照组McERK mRNA的表达水平均显著上升(P<0.05),而转染了McERK siRNA的幼虫体内McERK mRNA表达量未出现显著上调(P>0.05)(图6)。

图6 鞭毛蛋白刺激后厚壳贻贝幼虫McERK基因的表达
Fig.6 McERK gene expression level in Mytilus coruscus larvae after flagellin stimulation
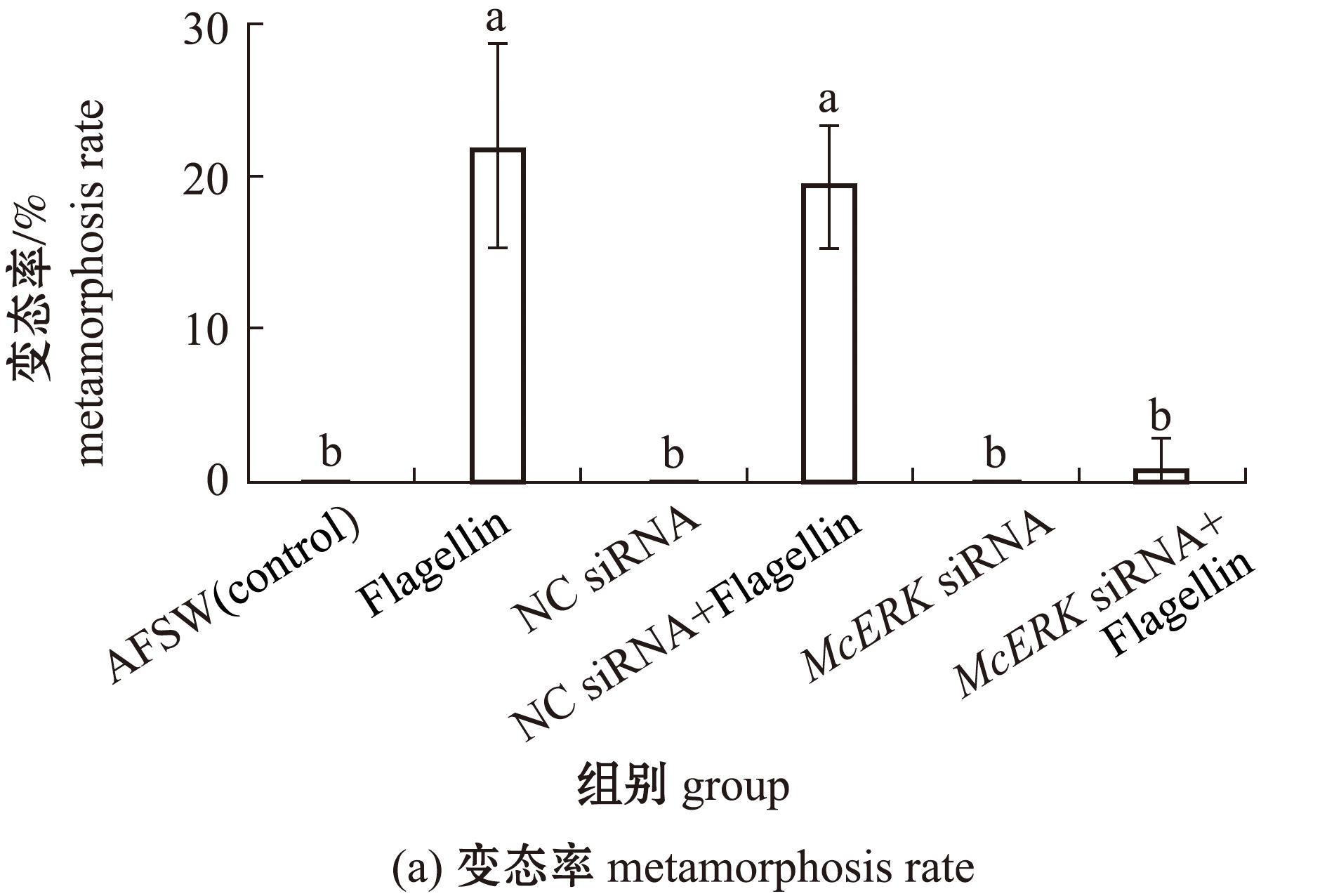
2.5 敲降McERK基因对幼虫变态率和行为的影响
鞭毛蛋白暴露刺激72 h后,眼点幼虫的变态率为21.76%;转染非目的基因siRNA(NC siRNA)后再用鞭毛蛋白进行暴露刺激,幼虫的变态率为17.83%,与鞭毛蛋白诱导组相比无显著性差异(P>0.05);McERK siRNA转染后再用鞭毛蛋白进行暴露刺激,幼虫的变态率仅为1.56%,该组幼虫变态率显著低于仅用鞭毛蛋白暴露刺激和转染非目的基因siRNA(NC siRNA)后再用鞭毛蛋白暴露刺激的两个处理组(P<0.05);转染非目的基因siRNA、McERK siRNA转染后暴露于AFSE和仅暴露于AFSW的幼虫无变态现象发生(图7(a))。
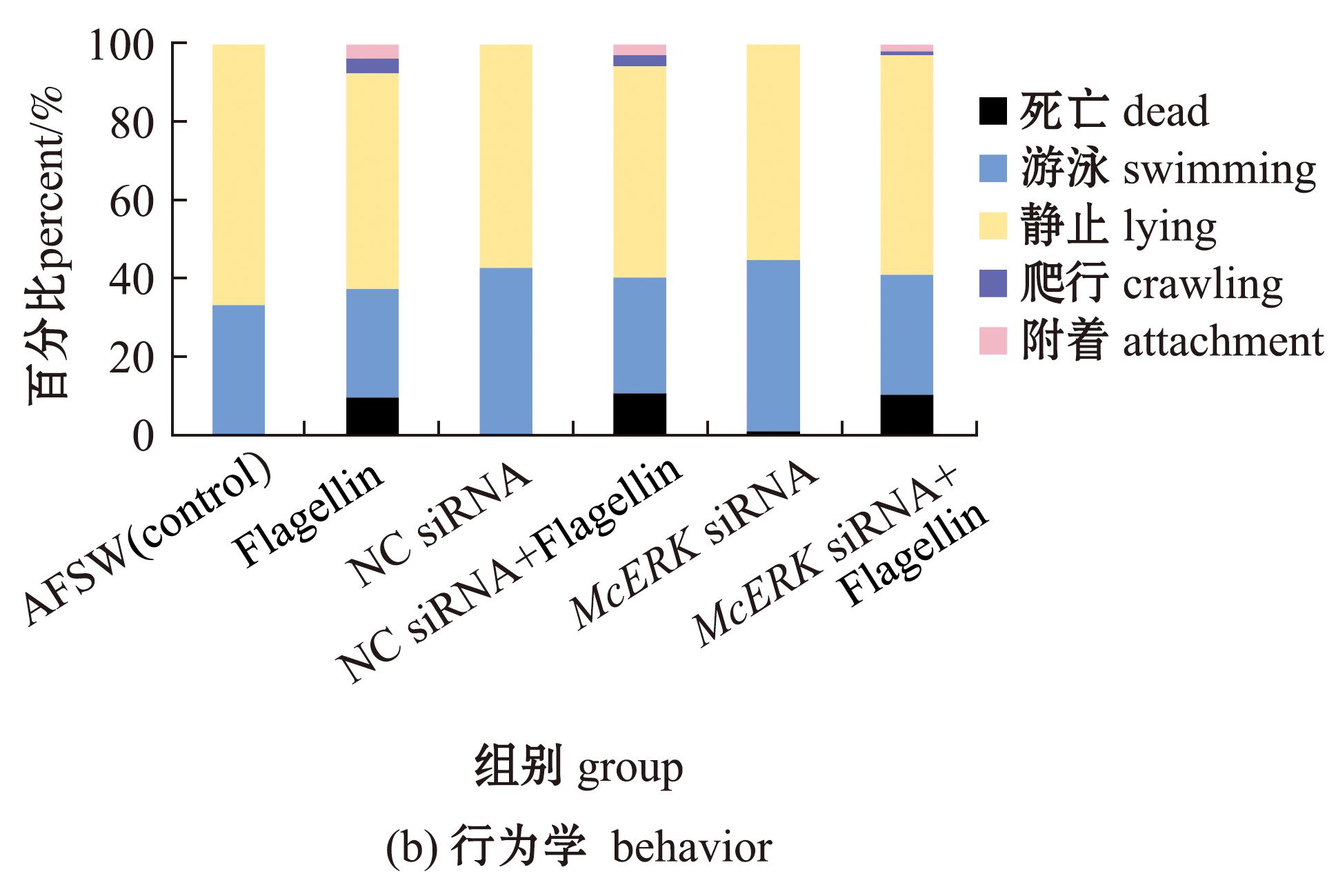
图7 siRNA干扰McERK基因后对幼虫变态率和行为学的影响
Fig.7 Larval metamorphosis rate and behavior after knocking down McERK by siRNA
用鞭毛蛋白连续暴露刺激72 h幼虫的存活率结果显示,McERK siRNA和非目的基因 siRNA(NC siRNA)转染不影响幼虫存活,且与空白对照组无显著性差异(P>0.05),而鞭毛蛋白刺激导致幼虫出现死亡现象(图7(b))。
3 讨论
3.1 厚壳贻贝McERK基因的序列及进化特征
ERK是一系列细胞活动的中心调节因子,具有典型的蛋白激酶结构和S_TKc结构域,符合丝氨酸/苏氨酸蛋白激酶的结构特点[21]。通过磷酸化底物对细胞的生命活动进行调节,在脊椎动物中,ERK已被证实能够诱导细胞增殖、控制器官发育[10,15-16];但在无脊椎动物尤其是海洋贝类中研究较少。因此,探究ERK基因是否在贝类变态发育过程及免疫过程中发挥作用,对于解析贝类发育和免疫机制具有重要意义。本研究中,通过RACE技术克隆得到了厚壳贻贝McERK基因cDNA全长,对其结构域预测发现,其具有S_TKc结构域,这也是丝氨酸/苏氨酸蛋白激酶典型的结构域[21],因此,McERK符合丝氨酸/苏氨酸蛋白激酶的结构特征。通过氨基酸序列比对发现,厚壳贻贝McERK与双壳贝类的欧洲贻贝、加州贻贝的ERK氨基酸序列具有较高的一致性,分别为73.39%和67.11%,结合系统进化树中McERK与其他双壳贝类最终聚为一支的结果,说明McERK属于ERK家族。
3.2 厚壳贻贝McERK基因的表达特征
ERK信号通路在脊椎动物和无脊椎动物的免疫应答中起着重要的调节作用。已有研究发现,在长牡蛎、凡纳滨对虾(Litopenaeus vannamei)、岩藻珠母贝(Pinctada maxima)的血细胞、鳃、消化腺和外套膜中,ERK基因高表达[22-23],血细胞、鳃和外套膜等是构成无脊椎动物免疫防线的重要组成部分[24-25],上述研究证明,ERK可能在海洋无脊椎动物的先天免疫过程中行使功能。本研究结果表明,McERK基因在外套膜中表达量最高,其次是鳃、唇瓣和血淋巴。外套膜是贝类免疫的第一道防线,鳃是贝类的重要免疫器官,两者都能与外界环境直接接触,易受到病原菌的侵害而产生免疫反应;淋巴细胞在免疫系统中扮演着重要角色,唇瓣作为接触外界环境的组织可能参与机体的免疫过程[26]。这揭示了McERK基因可能在厚壳贻贝机体免疫的过程中发挥作用,但该基因如何介导机体的免疫仍需要进一步探究。
本研究中,McERK基因在厚壳贻贝担轮幼虫到壳顶幼虫发育阶段中具有稳定的表达量,这表明该基因在厚壳贻贝前期发育阶段中起着一定的作用,McERK基因如何发挥作用仍需要进一步探究。眼点幼虫阶段是厚壳贻贝由浮游状态转变为附着状态的必要发育阶段,此阶段McERK基因表达量显著高于壳顶幼虫和稚贝阶段,由此推断,McERK基因参与幼虫的附着变态过程。
3.3 McERK基因对厚壳贻贝附着变态的影响
附着变态是海洋无脊椎动物发育的重要阶段,华美盘管虫(Hydroides elegans)[27]、长牡蛎[28]和玻璃海鞘[29]等都需要经历这一过程。厚壳贻贝变态完成重要的判断依据之一是鳃的出现和面盘退化,在这个过程中,既有细胞生长,也有细胞凋亡现象的发生[26]。已有证据表明,细胞凋亡参与家蚕(Bombyx mori)[30]、玻璃海鞘[8,18]等的变态发育,介导了文蛤(Meretrix meretrix)[31]、长牡蛎[32]面盘退化过程。在玻璃海鞘的尾细胞中,ERK的激活先于细胞凋亡,ERK的磷酸化传导了尾组织中死亡激活信号,促进了尾部细胞的凋亡[18]。结合McERK在厚壳贻贝中的时空表达结果分析,ERK介导了厚壳贻贝面盘退化过程中强烈的细胞凋亡现象。Davidso等[33]发现,海鞘(Boltenia villosa)幼虫变态过程的免疫反应,既协调幼虫组织的吸收,也参与幼虫组织凋亡和再生带来的异常应激过程。在厚壳贻贝中免疫反应和幼虫的变态也可能具有某种关联,为了进一步验证McERK基因是否参与厚壳贻贝幼虫的附着变态过程,本研究中选用鞭毛蛋白作为诱导剂进行RNA干扰试验[5]。
McERK基因被干扰后幼虫的变态率结果显示,McERK基因表达量降低后厚壳贻贝幼虫的变态率相比于鞭毛蛋白诱导组显著降低,表明McERK基因调控了幼虫的变态发育。磷脂类物质能够激活鞭毛蛋白的分泌和G蛋白偶联受体[34],G蛋白偶联受体已被证实参与调控厚壳贻贝的附着变态过程,G蛋白偶联受体的βγ亚基被阻断会下调Gαi偶联受体对ERK的激活[35]。本课题组前期研究已证实,磷脂类物质和鞭毛蛋白均促进了厚壳贻贝幼虫的附着变态[5,36],推测磷脂类物质和鞭毛蛋白可能通过激活G蛋白偶联受体继而激活ERK诱导幼虫变态,即McERK基因通过G蛋白偶联受体通路调控幼虫的附着变态过程。
4 结论
1)厚壳贻贝McERK蛋白具有S_TKc结构域,符合丝氨酸/苏氨酸蛋白激酶的结构特征。
2)McERK基因在厚壳贻贝各个发育阶段和各组织均有表达,在眼点幼虫阶段达到峰值,表明该基因对于幼虫的发育和组织的分化具有重要作用。
3)敲降McERK基因后幼虫的变态率降低,表明该基因参与调控厚壳贻贝的变态发育过程。
[1] 常亚青.贝类增养殖学[M].北京:中国农业出版社,2007.CHANG Y Q.Shellfish aquaculture[M].Beijing:China Agriculture Press,2007.(in Chinese)
[2] LIAO Z, WANG X C, LIU H H, et al.Molecular characterization of a novel antimicrobial peptide from Mytilus coruscus[J].Fish &Shellfish Immunology,2013,34(2):610-616.
[3] 梁箫,丁文扬,张驰,等.3种脂肪酸对生物被膜形成及厚壳贻贝幼虫附着变态的影响[J].大连海洋大学学报,2021,36(4):580-586.LIANG X,DING W Y,ZHANG C,et al.Effects of three fatty acids on biofilm formation and settlement and metamorphosis of hard shelled mussel Mytilus coruscus[J].Journal of Dalian Ocean University,2021,36(4):580-586.(in Chinese)
[4] 陈慧娥,贺康,贺楚晗,等.藻酸盐对海假交替单胞菌生物被膜形成及厚壳贻贝附着变态的影响[J].大连海洋大学学报,2022,37(4):620-626.CHEN H E,HE K,HE C H,et al.Effects of alginate on biofilm formation of Pseudoalteromonas marina and larval settlement and metamorphosis of the mussel Mytilus coruscus[J].Journal of Dalian Ocean University,2022,37(4):620-626.(in Chinese)
[5] LIANG X,ZHANG X K,PENG L H,et al.The flagellar gene regulates biofilm formation and mussel larval settlement and metamorphosis[J].International Journal of Molecular Sciences,2020,21(3):710.
[6] LIANG X,CHEN Y R,GAO W,et al.Effects on larval metamorphosis in the mussel Mytilus coruscus of compounds that act on downstream effectors of G-protein-coupled receptors[J].Journal of the Marine Biological Association of the United Kingdom,2018,98(2):333-339.
[7] 徐跃峰,李一峰,梁箫,等.厚壳贻贝Wnt4基因时空表达[J].水产学报,2016,40(10):1567-1575.XU Y F,LI Y F,LIANG X,et al.Temporal-spatial expression of Wnt4 gene in the mussel Mytilus coruscus[J].Journal of Fisheries of China,2016,40(10):1567-1575.(in Chinese)
[8] ROSSOMANDO A J,PAYNE D M,WEBER M J,et al.Evidence that pp42,a major tyrosine kinase target protein,is a mitogen-activated serine/threonine protein kinase[J].Proceedings of the National Academy of Sciences of the United States of America,1989,86(18):6940-6943.
[9] SAGA K,JIMBOW K.Immunohistochemical localization of activated EGF receptor in human eccrine and apocrine sweat glands[J].The Journal of Histochemistry and Cytochemistry,2001,49(5):597-602.
[10] VERLHAC M H,KUBIAK J Z,CLARKE H J,et al.Microtubule and chromatin behavior follow MAP kinase activity but not MPF activity during meiosis in mouse oocytes[J].Development,1994,120(4):1017-1025.
[11] GIROUX S,TREMBLAY M,BERNARD D,et al.Embryonic death of Mek1-deficient mice reveals a role for this kinase in angiogenesis in the labyrinthine region of the placenta[J].Current Biology,1999,9(7):369-372.
[12] FURUNO N,NISHIZAWA M,OKAZAKI K,et al.Suppression of DNA replication via Mos function during meiotic divisions in Xenopus oocytes[J].The EMBO Journal,1994,13(10):2399-2410.
[13] PALMER A,GAVIN A C,NEBREDA A R.A link between MAP kinase and p34(cdc2)/cyclin B during oocyte maturation:p90(rsk) phosphorylates and inactivates the p34(cdc2) inhibitory kinase Myt1[J].The EMBO Journal,1998,17(17):5037-5047.
[14] MANNING G,WHYTE D B,MARTINEZ R,et al.The protein kinase complement of the human genome[J].Science,2002,298(5600):1912-1934.
[15] PEARSON G,ROBINSON F,BEERS GIBSON T,et al.Mitogen-activated protein (MAP) kinase pathways:regulation and physiological functions[J].Endocrine Reviews,2001,22(2):153-183.
[16] LAMBERT J D,NAGY L M.The MAPK cascade in equally cleaving spiralian embryos[J].Developmental Biology,2003,263(2):231-241.
[17] PICCO V,HUDSON C,YASUO H.Ephrin-Eph signalling drives the asymmetric division of notochord/neural precursors in Ciona embryos[J].Development,2007,134(8):1491-1497.
[18] CHAMBON J P,SOULE J,POMIES P,et al.Tail regression in Ciona intestinalis (Prochordate) involves a caspase-dependent apoptosis event associated with ERK activation[J].Development,2002,129(13):3105-3114.
[19] YANG J L,LI Y F,BAO W Y,et al.Larval metamorphosis of the mussel Mytilus galloprovincialis Lamarck,1819 in response to neurotransmitter blockers and tetraethylammonium[J].Biofouling,2011,27(2):193-199.
[20] ZHANG W,WANG Y Y,YANG J L,et al.AMPK promotes larval metamorphosis of Mytilus coruscus[J].Genes,2022,13(12):2384.
[21] SUN W J,ZHU M,WANG Y L,et al.ERK is involved in the process of acrosome reaction in vitro of the Chinese mitten crab,Eriocheir sinensis[J].Marine Biotechnology,2015,17(3):305-316.
[22] ZHANG H,OU Z K,XU M,et al.Molecular cloning and characterization of a putative mitogen-activated protein kinase (Erk1/2) gene:involvement in mantle immunity of Pinctada fucata[J].Fish &Shellfish Immunology,2018,80:63-70.
[23] SHI H,YAN X F,XU X,et al.Molecular cloning and characterization of a cDNA encoding extracellular signal-regulated kinase from Litopenaeus vannamei[J].Fish &Shellfish Immunology,2012,33(4):813-820.
[24] BURGENTS J E,BURNETT L E,STABB E V,et al.Localization and bacteriostasis of Vibrio introduced into the Pacific white shrimp,Litopenaeus vannamei[J].Developmental and Comparative Immunology,2005,29(8):681-691.
[25] CASTILLO M G,SALAZAR K A,JOFFE N R.The immune response of cephalopods from head to foot[J].Fish &Shellfish Immunology,2015,46(1):145-160.
[26] 刘志显,李嘉政,梁邻利,等.厚壳贻贝McCaspase 3-4基因的克隆及其在幼虫变态中的作用[J].水生生物学报,2022,46(8):1168-1176.LIU Z X,LI J Z,LIANG L L,et al.Molecular cloning of McCaspase 3-4 and its functions in Mytilus coruscus larval metamorphosis[J].Acta Hydrobiologica Sinica,2022,46(8):1168-1176.(in Chinese)
[27] SHIKUMA N J,PILHOFER M,WEISS G L,et al.Marine tubeworm metamorphosis induced by arrays of bacterial phage tail-like structures[J].Science,2014,343(6170):529-533.
[28] JOYCE A,VOGELER S.Molluscan bivalve settlement and metamorphosis:neuroendocrine inducers and morphogenetic responses[J].Aquaculture,2018,487:64-82.
[29] CHAMBON J P,NAKAYAMA A,TAKAMURA K,et al.ERK- and JNK-signalling regulate gene networks that stimulate metamorphosis and apoptosis in tail tissues of ascidian tadpoles[J].Development,2007,134(6):1203-1219.
[30] LV J L,ZHENG K Y,WANG X Y,et al.Advances in the extracellular signal-regulated kinase signaling pathway in silkworms,Bombyx mori (Lepidoptera)[J].Archives of Insect Biochemistry and Physiology,2023,114(4):e22054.
[31] 王晓梅,刘保忠,相建海.文蛤(Meretrix meretrix)幼虫发育过程中细胞凋亡和Caspase功能分析[J].海洋与湖沼,2009,40(2):181-186.WANG X M,LIU B Z,XIANG J H.Apoptosis and role of caspase in development of Meretrix meretrix larvae[J].Oceanologia et Limnologia Sinica,2009,40(2):181-186.(in Chinese)
[32] QU T,HUANG B Y,ZHANG L L,et al.Identification and functional characterization of two executioner caspases in Crassostrea gigas[J].PLoS One,2014,9(2):e89040.
[33] DAVIDSON B,SWALLA B J.A molecular analysis of ascidian metamorphosis reveals activation of an innate immune response[J].Development,2002,129(20):4739-4751.
[34] SUBRAMANIAN N,QADRI A.Lysophospholipid sensing triggers secretion of flagellin from pathogenic Salmonella[J].Nature Immunology,2006,7(6):583-589.
[35] WIDMANN C,GIBSON S,JARPE M B,et al.Mitogen-activated protein kinase:conservation of a three-kinase module from yeast to human[J].Physiological Reviews,1999,79(1):143-180.
[36] 吴静娴,李嘉政,胡晓梦,等.脂多糖对细菌生物被膜形成及厚壳贻贝幼虫变态的影响[J].水产学报,2022,46(11):2134-2142.WU J X,LI J Z,HU X M,et al.Effects of lipopolysaccharide on biofilm formation and larval metamorphosis of the mussel Mytilus coruscus[J].Journal of Fisheries of China,2022,46(11):2134-2142.(in Chinese)