马口鱼(Opsariichthys bidens),俗称“马口”“马鱼”“桃花鱼”“大口扒”,隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)鱼丹亚科(Danioninae)马口鱼属(Opsariichthys),在中国各江河均有分布,属于小型凶猛鱼类[1]。其肉质肥美,经济价值高,深受消费者喜爱。马口鱼生长迅速,苗种当年即可养成上市,因此,其具有极高的养殖开发价值[2]。近年来,由于过度捕捞、水环境污染日益严重,以及拦河筑坝等工程对鱼类生活环境的影响,马口鱼自然资源急剧下降[3]。而马口鱼作为辽宁省养殖前景较好的土著鱼类之一,是未来渔业资源开发的重点鱼种[4]。目前,关于马口鱼在生长特性[5]、营养成分分析[6]、胚胎发育[7-8]、人工繁殖[8]和人工养殖[9]等方面的研究已取得了显著成效,但在马口鱼精子生理学特征等方面的研究较少[10]。
近年来,本项目组在进行北方地区马口鱼人工繁殖的过程中发现,其存在受精率和出苗率较低的问题。而鱼类受精能力与精子质量密切相关,鱼类的精子质量不仅与雄性亲鱼的体型、年龄、健康状况和性腺成熟度等内在因素有关,也与精子激活液离子浓度、温度、pH及季节变化等外部因素有关[11]。郑学斌等[10]研究了不同环境因子条件(Na+、K+、Ca2+、Mg2+、Cd2+、葡萄糖和pH)对南方地区马口鱼精子活力的影响。骆小年等[8]通过对南北方地理群体间马口鱼的繁殖习性进行比较,发现南北方马口鱼亲鱼性成熟年龄、体型和繁殖期均存在较大差异,推测其不同地理群体间可能存在差异性。精子活力是评价精子质量优劣的一项重要指标,因此,有必要对北方地区马口鱼精子活力进行深入研究。本研究中,通过显微观察法,研究了用不同浓度的离子(Na+、K+、Ca2+)、葡萄糖、Tris、甘油精子激活液及温度等处理对北方马口鱼精子活力的影响,以期为提高北方地区马口鱼规模化人工繁殖受精率提供基础资料。
1 材料与方法
1.1 材料
试验用亲鱼选自辽宁省辽阳县兴大养殖场土池塘培育的马口鱼种鱼,分别于2022年5月和2023年5月挑选性腺成熟、发育良好的雄性成鱼共42尾,其体质量为215.0~445.0 g,暂养于规格为4.0 m×4.0 m×1.5 m、水深为0.8 m左右的水泥池中,池底部充气,溶解氧保持在5 mg/L以上。
1.2 方法
1.2.1 人工催情及精液采集 采用促黄体生成素释放激素类似物(LHRH-A2)6 μg/kg+地欧酮(DOM)8 mg/kg+绒毛膜促性腺激素(HCG)1 800 IU/kg复合型药物(宁波第二激素厂)对试验鱼进行催情,通过背鳍基部肌肉注射,注射药物剂量为0.5 mL/尾,注射结束后将鱼置于暂养池暂养,调节水温至20 ℃,24 h后采集精液。在不同梯度单因子精子激活液试验前,随机取3尾马口鱼,用干燥的毛巾擦干鱼体水分,轻压其下腹部,采集干净的混合精液于消毒后的培养皿中,置于冰上备用。
1.2.2 精子激活液的配制 参考张涛等[12]对高体雅罗鱼(Leuciscus idus)精子活力的试验方法,并根据马口鱼的精子特性加以改进。本研究中,设计不同梯度的温度、离子(Na+、K+、Ca2+)和非离子(葡萄糖、Tris、甘油)共7种单因子精子激活液试验(表1)。再根据单因子试验结果,搭配最佳的单因子浓度,设计复合因子精子激活液试验:激活液A(34 mmol/L Na++40 mmol/L K++17 mmol/L 葡萄糖,三者体积比为1∶1∶1)、激活液B(34 mmol/L Na++40 mmol/L K+,二者体积比为1∶1)及激活液C(34 mmol/L Na++40 mmol/L K++33 mmol/L Tris,三者体积比为1∶1∶1)。试验试剂均为国产分析纯,用纯水配制。所有溶液现用现配,以去离子水作为对照组。
表1 不同梯度单因子精子激活液设计
Tab.1 Design of single factor for sperm activation solution at different levels mmol/L
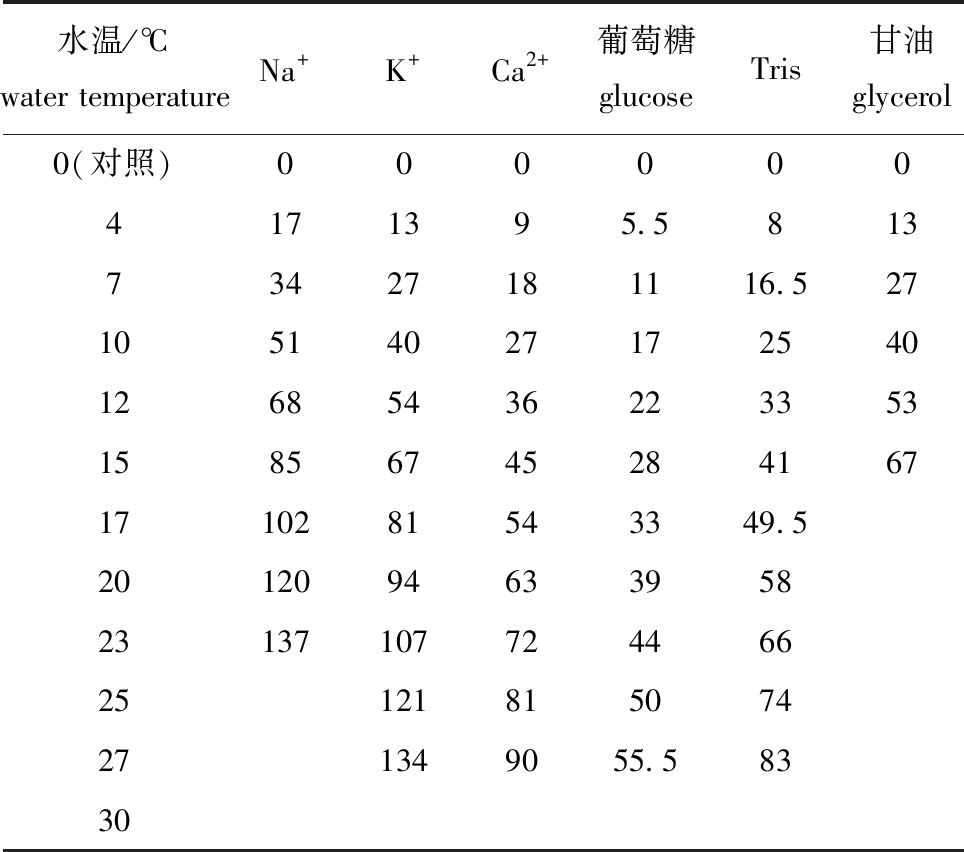
水温/℃water temperatureNa+K+Ca2+葡萄糖glucoseTris甘油glycerol0(对照)0000004171395.581373427181116.527 10 51402717254012685436223353 15 8567452841671710281543349.520120946339582313710772446625121815074271349055.58330
参考韩峰等[13]对北方须鳅(Barbatula barbatula nuda)精子活力的试验方法,设计温度为0~30 ℃。将去离子水、马口鱼混合精液及玻片等分别放入不同烧杯中,密封后置于热水浴锅或冰水浴锅中调节温度。
1.2.3 精子活力观察 参考鲁大椿等[14]的方法,采用精子快速运动时间(fast movement time,FT)、寿命(life span,LT)和激活率(activation rate,AR)作为精子活力的评价指标,并使用精子快速运动时间变化率和寿命变化率来确定试验组数据上升或下降的幅度。在室温为20~21 ℃条件下,用消毒后的解剖针挑取微量马口鱼混合精液蘸在载玻片上,并向精液中心滴一滴配制好的激活液,迅速盖上盖玻片,置于显微镜(奥林巴斯CX21型,10×10倍)下观察,并用秒表计时,记录精子快速运动时间、寿命及激活率。
1.2.4 精子活力评价指标
快速运动时间:从精子激活到70%精子转入慢速运动的时间。
寿命:从精子激活至大约90%精子死亡的时间。
精子激活率:激活起始时,随机视野中运动精子占该视野全部精子的百分比。
快速运动时间变化率(R1,%):对照组与试验组之间精子快速运动时间的变化幅度,其计算公式为
R1=(t2-t1)/t1×100%。
(1)
寿命变化率(R2,%):对照组与试验组之间精子寿命的变化幅度,其计算公式为
R2=(t4-t3)/t3×100%。
(2)
式中:t1为对照组精子快速运动时间(s);t2为试验组精子快速运动时间(s);t3为对照组寿命(s);t4为试验组寿命(s)。
1.3 数据处理
试验结果以平均值±标准差(mean±S.D.)表示,试验数据用Microsoft Excel 2010软件进行处理,采用SPSS 20.0软件进行单因素方差分析,并用Duncan法对多组样本间进行差异显著性分析,显著性水平设为0.05。
2 结果与分析
2.1 Na+对马口鱼精子活力的影响
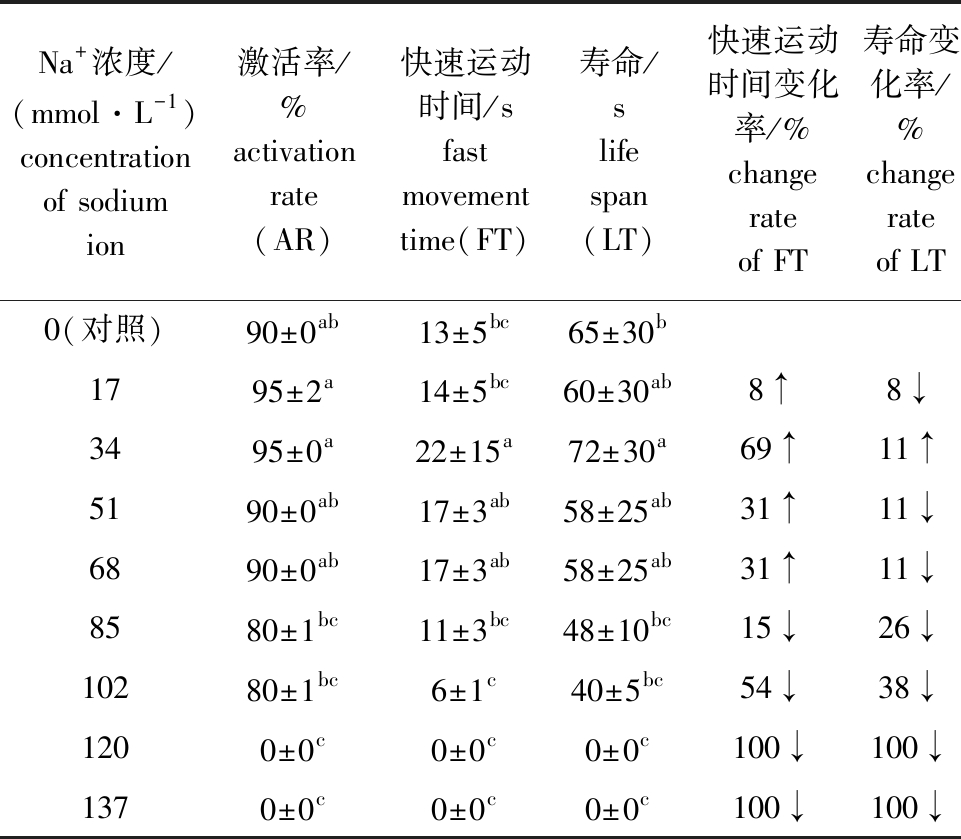
从表2可见:当Na+浓度为34 mmol/L 时,马口鱼精子活力最强,精子快速运动时间最长,为(22±15) s,快速运动时间变化率为69%,寿命也最长,为(72±30) s,寿命变化率为11%,激活率较高,为(95±0)%,该浓度下精子快速运动时间、寿命显著高于对照组(P<0.05);当Na+浓度增至102 mmol/L 时,马口鱼精子活力下降明显且出现抑制现象;当Na+≥120 mmol/L 时精子不激活。这表明,适宜的Na+浓度对马口鱼精子活力具有促进作用。
表2 马口鱼精子在不同浓度Na+溶液中的活力
Tab.2 Sperm viability of Opsariichthys bidens in different concentrations of Na+ solution
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05);↑表示与对照组相比上升,↓表示与对照组相比下降,下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences;↑ indicates an increase compared with the control group,and ↓ indicates a decrease compared with the control group,et sequentia.
Na+浓度/(mmol·L-1)concentration of sodium ion激活率/%activation rate(AR)快速运动时间/sfast movement time(FT)寿命/slife span(LT)快速运动时间变化率/%change rate of FT寿命变化率/%change rate of LT0(对照)90±0ab13±5bc65±30b1795±2a14±5bc60±30ab8↑8↓3495±0a22±15a72±30a69↑11↑5190±0ab17±3ab58±25ab31↑11↓6890±0ab17±3ab58±25ab31↑11↓8580±1bc11±3bc48±10bc15↓26↓10280±1bc6±1c40±5bc54↓38↓1200±0c0±0c0±0c100↓100↓1370±0c0±0c0±0c100↓100↓
2.2 K+对马口鱼精子活力的影响
从表3可见:当K+浓度为40 mmol/L 时,马口鱼精子活力最强,精子快速运动时间、寿命、激活率和快速时间变化率均较高,分别为(35±7)s、(94±30)s、(95±0)%和169%,该浓度下精子快速运动时间显著高于其他各组(P<0.05);当K+浓度增至107 mmol/L 时,出现明显的抑制现象;当K+≥121 mmol/L 时精子不激活。这表明,适宜的K+浓度对马口鱼精子活力具有促进作用。
表3 马口鱼精子在不同浓度K+溶液中的活力
Tab.3 Sperm viability of Opsariichthys bidens in different concentrations of K+ solution

K+浓度/(mmol·L-1)concentration of potassium ion激活率/%activation rate(AR)快速运动时间/sfast movement time(FT)寿命/slife span(LT)快速运动时间变化率/%change rate of FT寿命变化率/%change rate of LT0(对照)90±0ab13±5bc65±30ab1390±1ab15±1bc62±30ab15↑5↓2795±0a10±1bc57±30ab23↓12↓4095±0a35±7a94±30a169↑45↑5495±4a17±4b62±30ab31↑5↓6790±0ab12±5bc67±30ab8↓3↑8180±0bc14±5bc43±25bc8↑34↓9480±5bc14±4bc44±25bc8↑32↓10750±2b0±0c10±10b100↓85↓1210±0c0±0c0±0c100↓100↓1340±0c0±0c0±0c100↓100↓
2.3 Ca2+对马口鱼精子活力的影响
从表4可见:当Ca2+浓度为9~90 mmol/L时,马口鱼精子活力随Ca2+浓度的升高呈现下降的趋势;对照组精子快速运动时间和寿命除与9 mmol/L组无显著性差异外(P>0.05),均显著高于其他浓度组(P<0.05);当Ca2+浓度为36~45 mmol/L时,有一定比例精子被激活,但仅在原地颤动;当Ca2+≥54 mmol/L时,精子不激活。这表明,Ca2+对马口鱼精子活力具有抑制作用。
表4 马口鱼精子在不同浓度Ca2+溶液中的活力
Tab.4 Sperm viability of Opsariichthys bidens in different concentrations of Ca2+ solution
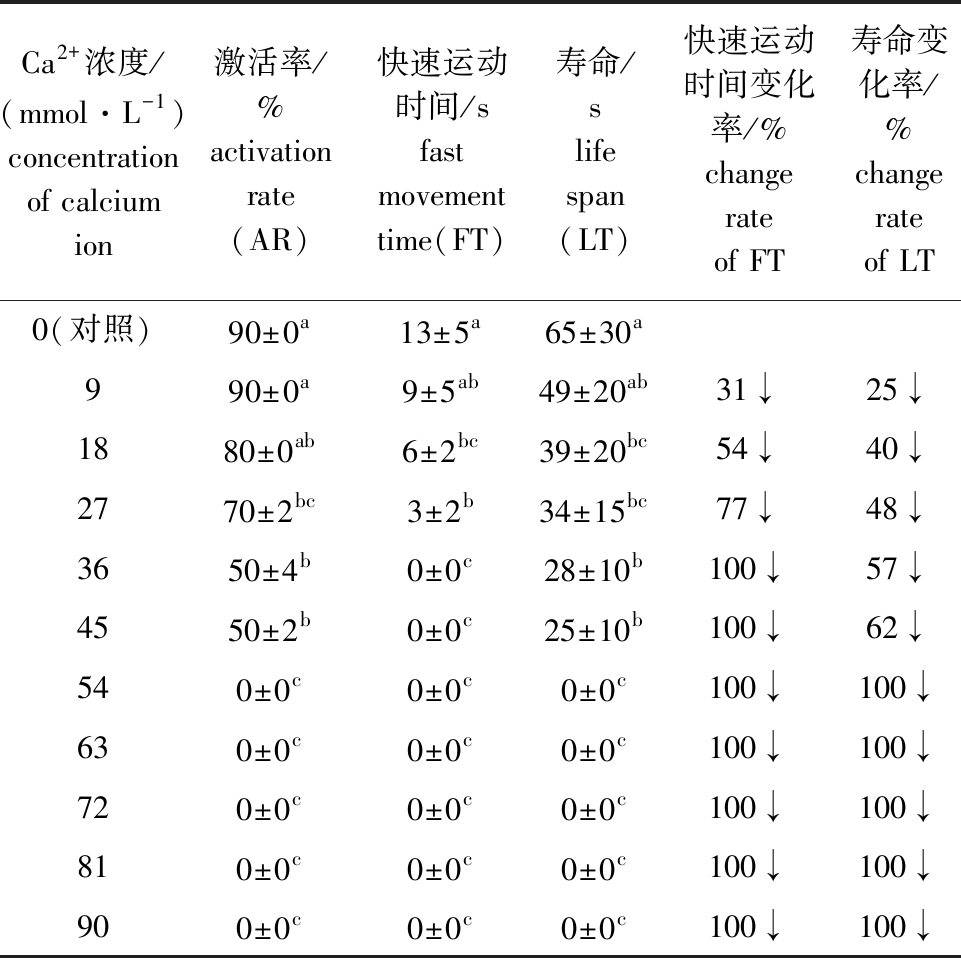
Ca2+浓度/(mmol·L-1)concentration of calcium ion激活率/%activation rate(AR)快速运动时间/sfast movement time(FT)寿命/slife span(LT)快速运动时间变化率/%change rate of FT寿命变化率/%change rate of LT0(对照)90±0a13±5a65±30a990±0a9±5ab49±20ab31↓25↓1880±0ab6±2bc39±20bc54↓40↓2770±2bc3±2b34±15bc77↓48↓3650±4b0±0c28±10b100↓57↓4550±2b0±0c25±10b100↓62↓540±0c0±0c0±0c100↓100↓630±0c0±0c0±0c100↓100↓720±0c0±0c0±0c100↓100↓810±0c0±0c0±0c100↓100↓900±0c0±0c0±0c100↓100↓
2.4 葡萄糖对马口鱼精子活力的影响
从表5可见:当葡萄糖浓度为5.5~55.5 mmol/L 时,马口鱼精子活力随浓度的升高呈现先升高后下降的趋势;当葡萄糖浓度为17 mmol/L 时,精子活力最强,精子快速运动时间、寿命、快速运动时间变化率和寿命变化率分别为(18±4)s、(69±30)s、38%和6%,该浓度下精子快速运动时间和寿命除与对照组无显著性差异外(P>0.05),显著高于其他浓度组(P<0.05);当葡萄糖浓度≥44 mmol/L 时,精子不激活。这表明,适宜浓度的葡萄糖对马口鱼精子活力有一定的增强作用。
表5 马口鱼精子在不同浓度葡萄糖溶液下的活力
Tab.5 Sperm viability of Opsariichthys bidens in different concentrations of glucose solution
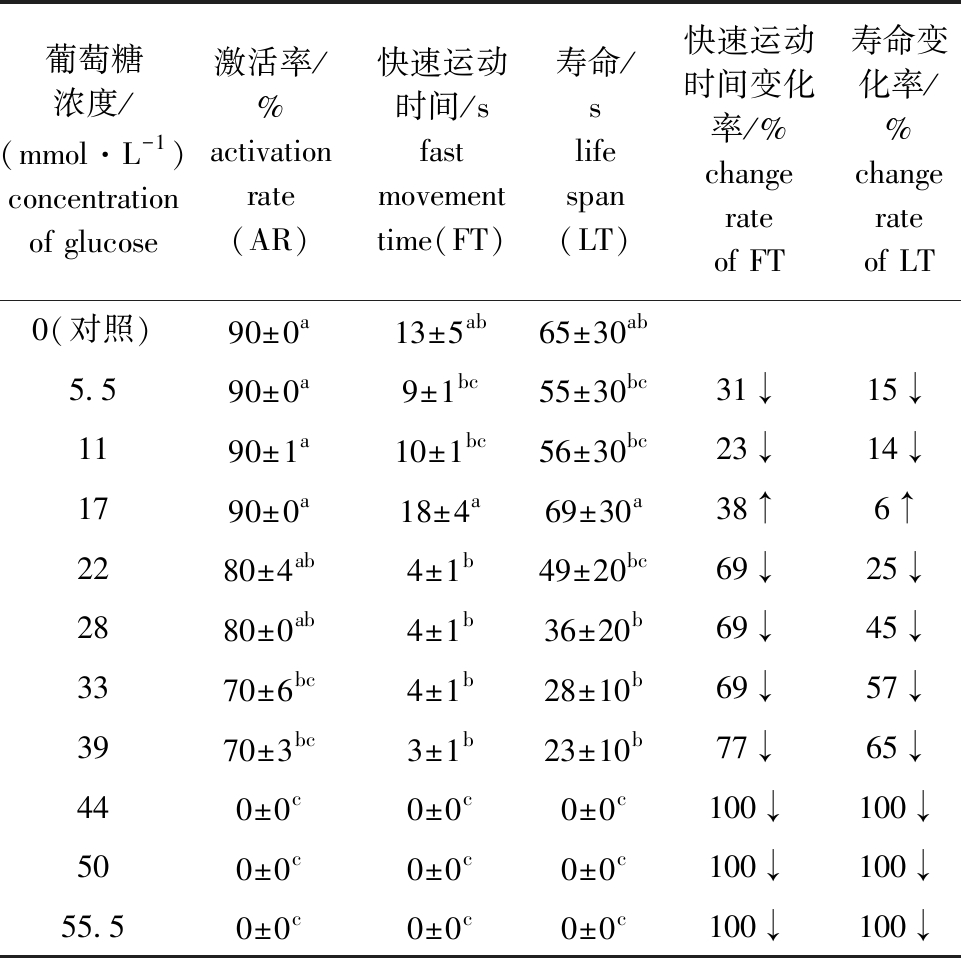
葡萄糖浓度/(mmol·L-1)concentration of glucose激活率/%activation rate(AR)快速运动时间/sfast movement time(FT)寿命/slife span(LT)快速运动时间变化率/%change rate of FT寿命变化率/%change rate of LT0(对照)90±0a13±5ab65±30ab5.590±0a9±1bc55±30bc31↓15↓1190±1a10±1bc56±30bc23↓14↓1790±0a18±4a69±30a38↑6↑2280±4ab4±1b49±20bc69↓25↓2880±0ab4±1b36±20b69↓45↓3370±6bc4±1b28±10b69↓57↓3970±3bc3±1b23±10b77↓65↓440±0c0±0c0±0c100↓100↓500±0c0±0c0±0c100↓100↓55.50±0c0±0c0±0c100↓100↓
2.5 Tris缓冲剂对马口鱼精子活力的影响
从表6可见:当Tris缓冲剂浓度为33 mmol/L 时,精子快速运动时间达到最大值(18 s±7 s),该浓度下精子快速运动时间除与对照组和16.5 mmol/L组无显著性差异外(P>0.05),显著高于其他浓度组(P<0.05);不添加Tris缓冲剂的对照组,精子寿命最长(65 s±30 s);各组间精子的激活率均无显著性差异(P>0.05)。这表明,适宜的Tris缓冲剂对马口鱼精子活力有一定的增强作用。
表6 马口鱼精子在不同浓度Tris溶液中的活力
Tab.6 Sperm viability of Opsariichthys bidens in different concentrations of Tris solution
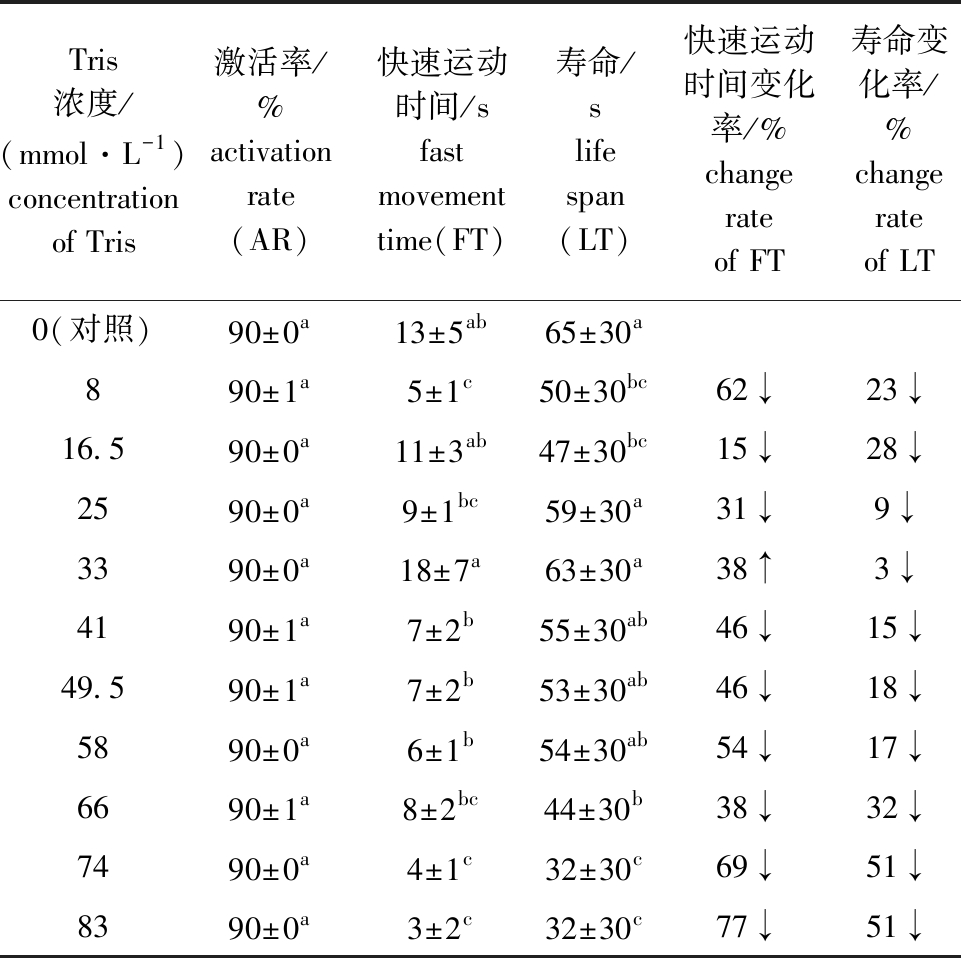
Tris浓度/(mmol·L-1)concentration of Tris激活率/%activation rate(AR)快速运动时间/sfast movement time(FT)寿命/slife span(LT)快速运动时间变化率/%change rate of FT寿命变化率/%change rate of LT0(对照)90±0a13±5ab65±30a890±1a5±1c50±30bc62↓23↓16.590±0a11±3ab47±30bc15↓28↓2590±0a9±1bc59±30a31↓9↓3390±0a18±7a63±30a38↑3↓4190±1a7±2b55±30ab46↓15↓49.590±1a7±2b53±30ab46↓18↓5890±0a6±1b54±30ab54↓17↓6690±1a8±2bc44±30b38↓32↓7490±0a4±1c32±30c69↓51↓8390±0a3±2c32±30c77↓51↓
2.6 甘油对马口鱼精子活力的影响
从表7可见:当甘油浓度为13~67 mmol/L 时,马口鱼精子活力随甘油浓度的升高呈现下降的趋势;不添加甘油的对照组,精子的快速运动时间、寿命和激活率除与13 mmol/L 甘油浓度组无显著性差异外(P>0.05),均显著高于其他浓度组(P<0.05);当甘油浓度≥44 mmol/L 时,精子不激活。这表明,甘油对马口鱼精子活力具有抑制作用。
表7 马口鱼精子在不同浓度甘油溶液中的活力
Tab.7 Sperm viability of Opsariichthys bidens in different concentrations of glycerol solution
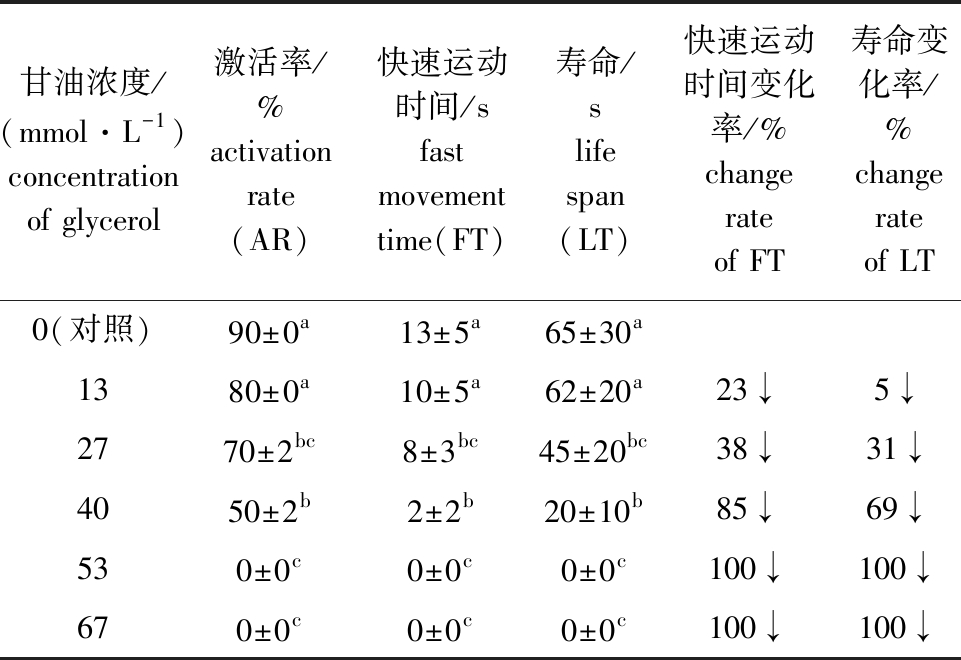
甘油浓度/(mmol·L-1)concentration of glycerol激活率/%activation rate(AR)快速运动时间/sfast movement time(FT)寿命/slife span(LT)快速运动时间变化率/%change rate of FT寿命变化率/%change rate of LT0(对照)90±0a13±5a65±30a1380±0a10±5a62±20a23↓5↓2770±2bc8±3bc45±20bc38↓31↓4050±2b2±2b20±10b85↓69↓530±0c0±0c0±0c100↓100↓670±0c0±0c0±0c100↓100↓
2.7 温度对马口鱼精子活力的影响
从表8可见:当温度为0 ℃时,去离子水溶液中的精子不激活;当温度为4~7 ℃时,有一定比例的精子被激活,但仅在原地颤动;当温度为10~23 ℃时,马口鱼精子活力随温度的升高而升高;当温度为23~30 ℃时,精子活力随温度的升高而降低;马口鱼精子活力在(20±1) ℃组时达到最强,该温度下马口鱼精子快速运动时间除与(17±1)、(23±1)、(25±1) ℃组无显著性差异外(P>0.05),均显著高于其他各组(P<0.05),且在(20±1) ℃组时精子寿命最长,为(69±30) s。这表明,马口鱼精子在温度为17~25 ℃时活力较强。
表8 马口鱼精子在不同温度溶液中的活力
Tab.8 Sperm viability of Opsariichthys bidens exposed to different temperature
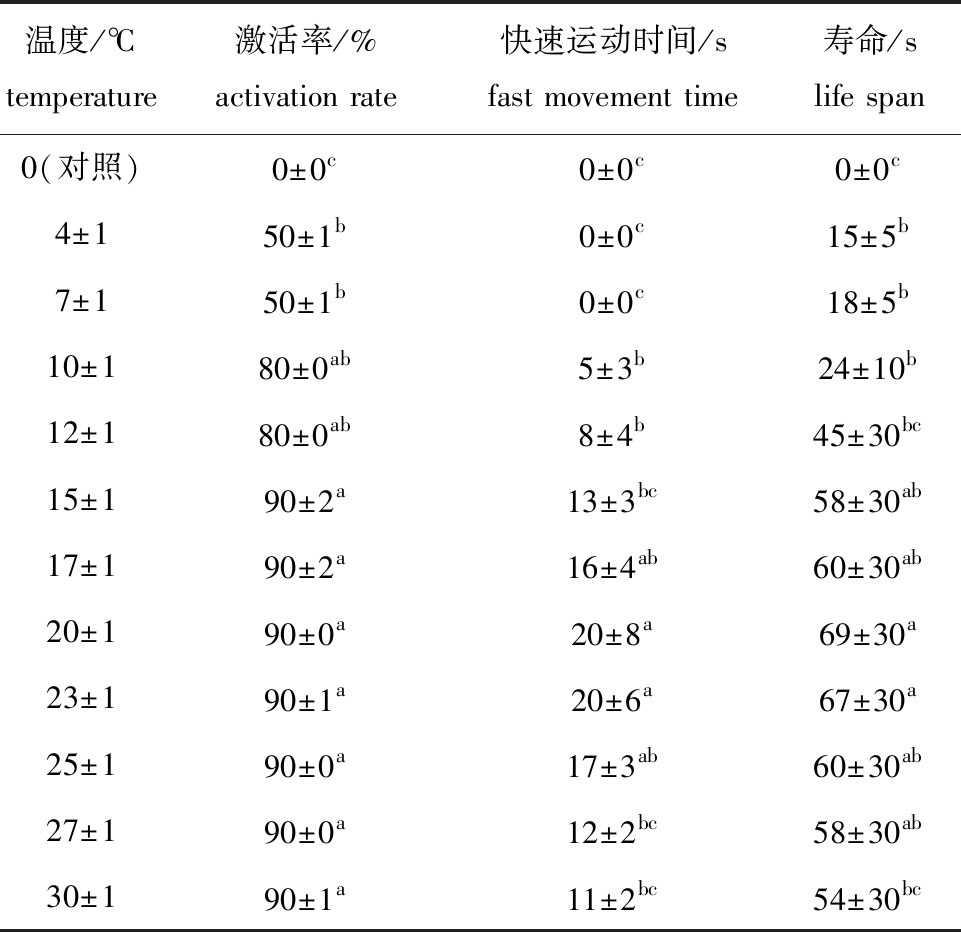
温度/℃temperature激活率/%activation rate快速运动时间/sfast movement time寿命/slife span0(对照)0±0c0±0c0±0c4±150±1b0±0c15±5b7±150±1b0±0c18±5b10±180±0ab5±3b24±10b12±180±0ab8±4b45±30bc15±190±2a13±3bc58±30ab17±190±2a16±4ab60±30ab20±190±0a20±8a69±30a23±190±1a20±6a67±30a25±190±0a17±3ab60±30ab27±190±0a12±2bc58±30ab30±190±1a11±2bc54±30bc
2.8 几种复合因子激活液对马口鱼精子活力的影响
从表9可见:在激活液B中马口鱼精子活力最强,其快速运动时间、寿命、快速运动时间变化率和寿命变化率均最高,分别为(58±21)s、(226±60)s、346%和248%;激活液B精子快速运动时间显著高于激活液C和对照组(P<0.05),各组间激活率均无显著性差异(P>0.05)。
表9 马口鱼精子在不同复合因子激活液中的活力
Tab.9 Sperm viability of Opsariichthys bidens in different compound factor activating solutions

激活液种类type of activating solution激活率/%activation rate(AR)快速运动时间/sfast movement time(FT)寿命/slife span(LT)快速运动时间变化率/%change rate of FT寿命变化率/%change rate of LT对照组 control group90±0ab13±5b65±30bA(34 mmol/L Na++40 mmol/L K++17 mmol/L 葡萄糖,三者体积比为1∶1∶1)95±0a42±23ab89±60bc223↑37↑B(34 mmol/L Na++40 mmol/L K+,二者体积比为1∶1)95±0a58±21a226±60a346↑248↑C(34 mmol/L Na++40 mmol/L K++33 mmol/L Tris,三者体积比为1∶1∶1)95±0a37±20bc131±60ab185↑102↑
3 讨论
3.1 Na+、K+、Ca2+对马口鱼精子活力的影响
鱼类精子活力受激活液中离子浓度的影响较大,筛选出不同离子的最适浓度是提高人工繁殖受精率的关键。本研究中,马口鱼精子激活液中适宜浓度的K+(40 mmol/L)、Na+(34 mmol/L )、葡萄糖(17 mmol/L ),与郑学斌等[10]试验中马口鱼精子激活液中适宜浓度的K+(67 mmol/L )、Na+(51 mmol/L )、葡萄糖(0 mmol/L )相差较大。笔者推测,这可能是由不同地理群体物种差异所致。本研究中,试验用鱼取自辽宁省辽阳县养殖群体,亲鱼体质量为215.0~445.0 g,而郑学斌等[10]试验用马口鱼则取自浙江省新昌县养殖群体,亲鱼体质量为22.9~32.1 g,两养殖群体间初次性成熟体质量规格存在较大差异,本研究中亲鱼规格较郑学斌等[10]试验中马口鱼大很多。陈乘[15]推测,由于北方马口鱼生长于温带地区,水温较低,达到性成熟所需的有效积温比南方马口鱼所需时间长,故北方地区马口鱼达到初次性成熟的体型较南方地区马口鱼大。李高岩等[16]利用中国各水系马口鱼的Cyt b基因进行系统进化分析时发现,中国各水系的马口鱼可划分为5个不同的分支,且各分支间存在较大差异。综上所述,笔者推测本研究中马口鱼群体与郑学斌等[10]试验所用马口鱼群体可能存在较大的种间差异。
渗透压的高低是抑制和激活鲤科鱼类精子活动的主要原因[17]。Na+、K+、Ca2+既是鱼类精浆的重要组成成分,也是构成精浆渗透压的主要离子[18]。鱼类精子活力与精子对渗透压和金属离子的敏感性有关[19]。鱼类精浆中Na+、K+等离子所产生的高渗环境抑制了鱼类精子活动,当精液排入水体后渗透压的改变促使精子激活,而精子激活后需大量消耗自身能量,使其活力明显降低[20]。在不同鱼类中,Na+、K+和Ca2+对精子活力的调控作用存在明显差别(表10)。Na+可以通过诱发细胞膜去极化产生动作电位,进而引起细胞内Ca2+浓度的变化,起到间接激活精子运动的作用,同时会使运动的强烈程度增大[21]。本研究中,Na+、K+浓度在一定范围内会使马口鱼精子的运动状态有不同程度的提高,说明一定浓度的Na+、K+浓度对马口鱼精子活力具有促进作用。有研究表明,K+对鲑科鱼类精子活力具有明显的抑制作用[22],而对鲤科鱼类精子活力具有一定的促进作用[17]。本研究中也得到类似的结果,适宜的K+浓度对马口鱼具有一定的促进作用,且K+最适浓度时的精子活力强于Na+最适浓度时的精子活力。
表10 几种淡水鱼类精子适宜的离子浓度
Tab.10 Suitable ion concentrations for sperm from several freshwater fish
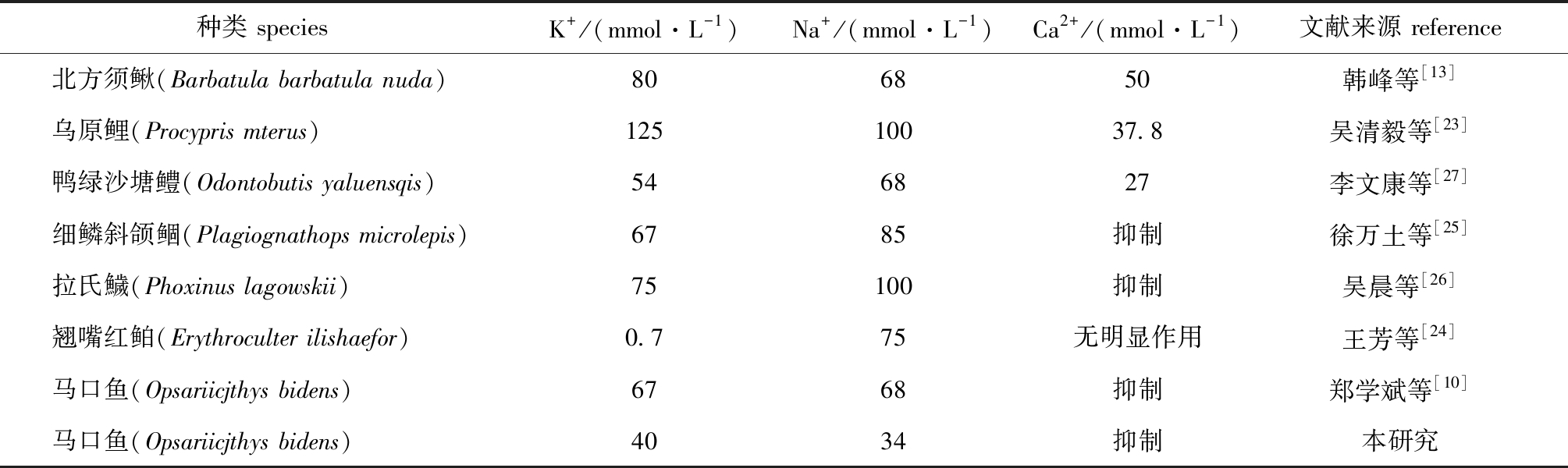
种类 speciesK+/(mmol·L-1)Na+/(mmol·L-1)Ca2+/(mmol·L-1)文献来源 reference北方须鳅(Barbatula barbatula nuda)806850韩峰等[13]乌原鲤(Procypris mterus)12510037.8吴清毅等[23]鸭绿沙塘鳢(Odontobutis yaluensqis)546827李文康等[27]细鳞斜颌鲴(Plagiognathops microlepis)6785抑制徐万土等[25]拉氏鱥(Phoxinus lagowskii)75100抑制吴晨等[26]翘嘴红鲌(Erythroculter ilishaefor)0.775无明显作用王芳等[24]马口鱼(Opsariicjthys bidens)6768抑制郑学斌等[10]马口鱼(Opsariicjthys bidens)4034抑制本研究
Ca2+对不同鱼类精子活力的作用效果可分为促进作用、无明显作用和抑制作用(表10)。其中,适宜浓度的Ca2+对北方须鳅[13]、乌原鲤(Procypris mterus)[23]的精子活力有明显的促进作用;Ca2+对翘嘴红鲌(Erythroculter ilishaefor)[24]的精子活力无明显作用;Ca2+对马口鱼、细鳞斜颌鲴(Plagiognathops microlepis)[25]和拉氏鱥(Phoxinus lagowskii)[26]的精子活力有抑制作用。
综上所述,Na+、K+和Ca2+对不同鱼类精子活力产生不同的作用效果,但具体原因还有待进一步研究。
3.2 葡萄糖、甘油、Tris对马口鱼精子活力的影响
淡水硬骨鱼类精浆中存在单糖类物质,这些物质可以提升精子活力[28-29]。体外受精鱼类在受精过程中消耗的能量可以通过外源性小分子单糖来补充[28]。适宜浓度的葡萄糖可以明显地延长白斑狗鱼(Esox lucius)[30]和丁鱥(Tinca tinca)[20]的精子活动时间和寿命。相比之下,适宜葡萄糖浓度下细鳞斜颌鲴(Plagiognathops microlepis)[25]的精子活力虽然较高,但对精子活力提升作用不明显。本研究结果与细鳞斜颌鲴精子类似,当葡萄糖浓度为0~39 mmom/L时,马口鱼精子活力均无显著性差异。Tris缓冲剂常被用于低温环境下精液的保存[31]。Tris缓冲剂对不同鱼类的调控作用不同,其对拉氏鱥[26]和北方须鳅[13]精子活力具有明显的抑制作用,对鸭绿沙塘鳢(Odontobutis yaluensqis)[27]精子活力具有明显的促进作用,而本研究中Tris缓冲剂对马口鱼精子的快速运动时间和寿命有一定的增强效果,但变化不显著,葡萄糖和Tris缓冲剂对马口鱼精子活力的提升作用不明显。甘油对部分鱼类的精子活力具有增强效果[27],而本研究中,甘油对马口鱼精子活力具有抑制作用。
综上所述,葡萄糖、Tris缓冲剂和甘油对不同鱼类精子活力产生不同的作用效果,但具体影响机理尚不明确,有待进一步研究。
3.3 水温对马口鱼精子活力的影响
一般认为,温度与精子快速运动时间是一个开口向下的二次曲线函数关系[32]。温度主要通过控制精子的活动(或能量代谢强度)来影响精子的活动强度及寿命[33]。在精子活力最高时所对应温度的两侧,无论升温或降温,马口鱼精子活力均呈下降趋势。本研究结果也属于该趋势,在水温为10~23 ℃时,马口鱼精子活力随温度的升高而升高,在20~23 ℃水温条件下,马口鱼精子活力的变化较小,当温度高于23 ℃时,精子活力呈下降趋势。马口鱼精子在温度为17~25 ℃时活力较强,说明该温度范围可能是马口鱼生存和繁殖的适宜温度。
3.4 复合因子对马口鱼精子活力的影响
在不同鱼类精子激活过程中,复合因子往往比单因子具有更好的激活效果。本研究中单因子试验发现,适宜浓度的Na+、K+、葡萄糖和Tris缓冲剂对马口鱼精子活力均有增强作用,将这4种因子的最适浓度进行自由组合,进一步探究复合因子对马口鱼精子活力的相互作用关系。结果发现,激活液A、B、C对马口鱼精子激活的快速运动时间均显著长于对照组,而激活液B相较于单一溶质的离子溶液、激活液A及激活液C对马口鱼精子具有更强的激活作用(表11),表明Na+和K+之间具有一定的协同作用。这表明,在激活液B(34 mmol/L Na++40 mmol/L K+,二者体积比为1∶1)中马口鱼精子的活力最强。由于影响鱼类精子活力的环境因子比较多,所以激活液B是否为马口鱼精子最佳激活液组合,还有待进一步试验验证。
表11 不同激活液对马口鱼精子活力影响的比较
Tab.11 Comparison of effects of different activating solutions on sperm motility of Opsariichthys bidens

激活液种类type of activating solution快速运动时间/sfast movement time寿命/slife span激活率activation rate对照 control group13±5c65±30b90±0b最适Na+浓度激活液 optimal concentration of sodium ion activator22±15bc72±30b95±0a最适K+浓度激活液 optimal concentration of potassium ion activator35±7ab94±30bc95±0a最适葡萄糖浓度激活液 optimal glucose concentration activator18±4b69±30b90±0b最适Tris浓度激活液 optimal Tris concentration activator18±7b63±30b90±0b激活液A activation solution A42±23ab89±60bc95±0a激活液B activation solution B58±21a226±60a95±0a激活液C activation solution C37±20ab131±60ab95±0a
4 结论
1)Na+和K+对马口鱼精子活力有增强效果,且其复合因子激活液B(34 mmol/L Na++40 mmol/L K+,二者体积比为1∶1)为马口鱼精子的最佳激活液,说明Na+和K+是影响北方马口鱼精子活力的主要因子,且二者之间具有一定的协同作用。
2)马口鱼精子在温度为17~25 ℃时活力较强,说明该温度范围可能是马口鱼繁殖的适宜温度。
3)实际生产中,可选择激活液B 作为北方马口鱼精子的激活液。本研究结果可为解决北方马口鱼人工授精中精子活力低问题提供有益参考。
[1] 解玉浩.东北地区淡水鱼类[M].沈阳:辽宁科学技术出版社,2007:33-34.XIE Y H.Freshwater fishes in northeast region of China[M].Shenyang:Liaoning Science and Technology Press,2007:33-34.(in Chinese)
[2] ZHANG M Z,WANG S D,GAN L,et al.Effects of fishmeal replacement with eight protein sources on growth performance,blood biochemistry and stress resistance in Opsariichthys bidens[J].Aquaculture Nutrition,2021,27(6):2529-2540.
[3] 姚崇学.珍贵稀有的马口鱼[J].中国水产,1988(5):47.YAO C X.Precious and rare maw fish[J].China Fisheries,1988(5):47.(in Chinese)
[4] 骆小年,赵兴文,段友健.辽宁省淡水土著鱼类开发利用研究进展[J].大连海洋大学学报,2020,35(2):155-160.LUO X N,ZHAO X W,DUAN Y J.Exploitation and utilization of freshwater indigenous fishes in Liaoning Province:a review[J].Journal of Dalian Ocean University,2020,35(2):155-160.(in Chinese)
[5] 钱明星,石叶忠,高心明,等.池塘养殖马口鱼的生长特性[J].水产养殖,2022,43(9):6-11,35.QIAN M X,SHI Y Z,GAO X M,et al.Growth characteristics of Opsariichthys bidens in pond culture[J].Journal of Aquaculture,2022,43(9):6-11,35.(in Chinese)
[6] 邱德林,张木子,刘嘉欣,等.野生、池塘及工厂化养殖马口鱼肌肉营养成分的比较[J].水产学报,2022,46(8):1449-1457.QIU D L,ZHANG M Z,LIU J X,et al.Comparison of nutritional ingredients of muscle in Opsariichthys bidens under wild,pond and factory farming conditions[J].Journal of Fisheries of China,2022,46(8):1449-1457.(in Chinese)
[7] 金丹璐,张清科,王友发,等.鲤科经济鱼类马口鱼(Opsariichthys bidens)胚胎发育及仔稚鱼形态与生长观察研究[J].海洋与湖沼,2017,48(4):838-847.JIN D L,ZHANG Q K,WANG Y F,et al.Observation of embryonic,larva and juvenile development of Opsariichthys bidens[J].Oceanologia et Limnologia Sinica,2017,48(4):838-847.(in Chinese)
[8] 骆小年,段友健,张晓静,等.北方马口鱼全人工繁殖、胚胎与仔鱼发育研究[J].大连海洋大学学报,2022,37(4):550-557.LUO X N,DUAN Y J,ZHANG X J,et al.Artificial propagation and embryonic and larval development of Chinese hook snout carp Opsariichthys bidens[J].Journal of Dalian Ocean University,2022,37(4):550-557.(in Chinese)
[9] 段友健,骆小年,李姣,等.马口鱼秋片鱼种北方池塘培育试验[J].辽东学院学报(自然科学版),2023,30(2):104-108.DUAN Y J,LUO X N,LI J,et al.Pond cultivation experiment of autumn fingerlings of Opsariichthys bidens in northern China[J].Journal of Liaodong University (Natural Science Edition),2023,30(2):104-108.(in Chinese)
[10] 郑学斌,张清科,朱咏梅,等.几种环境因子对马口鱼精子活力的影响[J].生物学杂志,2018,35(6):74-78.ZHENG X B,ZHANG Q K,ZHU Y M,et al.Effects of several environmental factors on the motility of sperm in Opsariichthys bidens[J].Journal of Biology,2018,35(6):74-78.(in Chinese)
[11] 苏天凤,艾红.鱼类精子活力及其超低温保存研究综述[J].上海水产大学学报,2004,13(4):343-347.SU T F,AI H.A review of research of motility and cryopreservation of fishes sperm[J].Journal of Shanghai Fisheries University,2004,13(4):343-347.(in Chinese)
[12] 张涛,李胜忠,牛建功,等.Na+、K+、葡萄糖及甘油对高体雅罗鱼精子活力的影响[J].南方农业学报,2017,48(4):734-738.ZHANG T,LI S Z,NIU J G,et al.Effects of Na+,K+,glucose and glycerinon on sperm motility of Leuciscus idus[J].Journal of Southern Agriculture,2017,48(4):734-738.(in Chinese)
[13] 韩峰,骆小年,段友健,等.Na+、K+、Ca2+、葡萄糖、pH、温度对北方须鳅精子活力的影响[J].大连海洋大学学报,2021,36(3):462-469.HAN F,LUO X N,DUAN Y J,et al.Influence of levels of Na+,K+,Ca2+,and glucose,pH and temperature on sperm vitality of loach Barbatula barbatula nuda[J].Journal of Dalian Ocean University,2021,36(3):462-469.(in Chinese)
[14] 鲁大椿,傅朝君,刘宪亭,等.我国主要淡水养殖鱼类精液的生物学特性[J].淡水渔业,1989,19(2):34-37.LU D C,FU Z J,LIU X T,et al.Biological characteristics of semen of main freshwater cultured fish in China[J].Freshwater Fisheries,1989,19(2):34-37.(in Chinese)
[15] 陈乘.南方马口鱼的繁殖生物学特性及繁育技术研究[D].长沙:湖南农业大学,2015.CHEN C.Research on the reproductive biology and artificial breeding technique of southern Opsariichthys bidens[D].Changsha:Hunan Agricultural University,2015.(in Chinese)
[16] 李高岩,穆志林,张春光.马口鱼多变量形态测量学研究[C]//中国海洋湖沼动物学会鱼类学分会第七届会员代表大会暨朱元鼎教授诞辰110周年庆学术研讨会学术论文摘要集. 北京:中国科学院动物研究所,2006:1.LI G Y,MU Z L,ZHANG C G.Study on multivariate morphometric of Opsariichthys bidens[C]//The 7th member congress of the fish branch of the Chinese Marine Limnological Zoological Society and the 110th anniversary of the birth of professor Zhu Yuanding.Beijing:Institute of Zoology,Chinese Academy of Sciences,2006:1.(in Chinese)
[17] MORISAWA M,SUZUKI K,SHIMIZU H,et al.Effects of osmolality and potassium on motility of spermatozoa from freshwater cyprinid fishes[J].The Journal of Experimental Biology,1983,107:95-103.
[18] 魏开金,王汉平,林加敬,等.氯化钠浓度对鲥鱼精子活力影响的初步观察[J].淡水渔业,1996,26(4):9-10.WEI K J,WANG H P,LIN J J,et al.Preliminary observation on the effect of sodium chloride concentration on sperm motility of shad[J].Freshwater Fisheries,1996,26(4):9-10.(in Chinese)
[19] 王永明,陈瑜,胡雨,等.宽体沙鳅精子超微结构及Na+、K+、Ca2+对其精子活力的影响[J].四川动物,2016,35(1):38-43.WANG Y M,CHEN Y,HU Y,et al.Ultrastructural observation of the sperm of Sinibotia reevesae and effect of Na+,K+ and Ca2+ on its motility[J].Sichuan Journal of Zoology,2016,35(1):38-43.(in Chinese)
[20] 苏德学,严安生,田永胜,等.阳离子、葡萄糖及渗透压对丁鱥精子活力的影响[J].水利渔业,2004,25(1):7-8.SU D X,YAN A S,TIAN Y S,et al.Effects of cation,glucose and osmotic pressure on sperm motility[J].Reservoir Fisheries,2004,25(1):7-8.(in Chinese)
[21] 徐革锋,贾钟贺,杨双英,等.尖吻和钝吻细鳞鱼(Brachymystax lenok)精子活力的观察[J].水产学杂志,2005,18(2):16-21.XU G F,JIA Z H,YANG S Y,et al.Observe the sperm motility of pointed snout Brachymystax lenok and obtuse snout Brachymystax lenok[J].Chinese Journal of Fisheries,2005,18(2):16-21.(in Chinese)
[22] MORISAWA M,SUZUKI K.Osmolality and potassium ion:their roles in initiation of sperm motility in teleosts[J].Science,1980,210(4474):1145-1147.
[23] 吴清毅,孙翰昌,李云瑶.不同浓度的K+、Ca2+和葡萄糖对乌原鲤精子活力的影响[J].水产科学,2011,30(4):202-205.WU Q Y,SUN H C,LI Y Y.Effects of different K+,Ca2+ and glucose concentrations on sperm motility in Chinese ink carp Procypris merus[J].Fisheries Science,2011,30(4):202-205.(in Chinese)
[24] 王芳,岳兴建,谢碧文,等.pH、葡萄糖以及金属离子对翘嘴红鲌精子活力的影响[J].安徽农业科学,2011,39(27):16812-16814,16884.WANG F,YUE X J,XIE B W,et al.Effects of pH,glucose and metal ions on sperm motility of Erythroculter ilishaefor[J].Journal of Anhui Agricultural Sciences,2011,39(27):16812-16814,16884.(in Chinese)
[25] 徐万土,戴海平,程顺,等.细鳞斜颌鲴精子活力观察[J].浙江海洋学院学报(自然科学版),2013,32(4):309-314.XU W T,DAI H P,CHENG S,et al.Observation the sperm motility of Plagionathops microlepis[J].Journal of Zhejiang Ocean University (Natural Science Edition),2013,32(4):309-314.(in Chinese)
[26] 吴晨,骆小年,段友健,等.不同离子浓度、温度、pH对拉氏鱥精子活力的影响[J].水产科学,2022,41(2):210-217.WU C,LUO X N,DUAN Y J,et al.Effects of different metal concentrations,temperature and pH on sperm motility of fat minnow Phoxinus lagowskii[J].Fisheries Science,2022,41(2):210-217.(in Chinese)
[27] 李文康,骆小年,邓鸿圣,等.鸭绿沙塘鳢精子生理学特征[J].中国水产科学,2022,29(11):1574-1588.LI W K,LUO X N,DENG H S,et al.Physiological characteristics of Odontobutis yaluensis sperm[J].Journal of Fishery Sciences of China,2022,29(11):1574-1588.(in Chinese)
[28] GARDINER D M.Utilization of extracellular glucose by spermatozoa of two viviparous fishes[J].Comparative Biochemistry and Physiology Part A:Physiology,1978,59(2):165-168.
[29] GREGORY R W.Occurrence of fructose in trout seminal plasma[J].Transactions of the American Fisheries Society,1968,97(2):203-204.
[30] 苏德学,严安生,田永胜,等.钠、钾、钙和葡萄糖对白斑狗鱼精子活力的影响[J].动物学杂志,2004,39(1):16-20.SU D X,YAN A S,TIAN Y S,et al.Effects of Na+,K+,Ca2+ and glucose on sperm mobility in northern pike,Esox lucius[J].Chinese Journal of Zoology,2004,39(1):16-20.(in Chinese)
[31] 刘新峰,郝志明,孙忠媛,等.Tris-葡萄糖稀释液中添加重酒石酸去甲肾上腺素、丙酸睾酮对低温保存犬精子活率的影响[J].黑龙江畜牧兽医,2009(3):115-116.LIU X F,HAO Z M,SUN Z Y,et al.Effect of adding norepinephrine bitartrate and testosterone propionate to Tris- glucose diluent on the viability of dog sperm preserved at low temperature[J].Heilongjiang Animal Science and Veterinary Medicine,2009(3):115-116.(in Chinese)
[32] 潘德博,许淑英,叶星,等.广东鲂精子主要生物学特性的研究[J].中国水产科学,1999,6(4):111-113.PAN D B,XU S Y,YE X,et al.Study on the main biological characteristics of sperm of Megalobrama hoffmanni[J].Journal of Fishery Sciences of China,1999,6(4):111-113.(in Chinese)
[33] 阮国良,冯家斌,杨代勤.渗透压、pH和温度对泥鳅精子活力及受精率的影响[J].湖北农学院学报,2004(1):22-25.RUAN G L,FENG J B,YANG D Q.Effects of osmolality,pH and temperature on sperm motility and fertilization of loach(Misgurnus anguillicaudatus)[J].Journal of Hubei Agricultural College,2004(1):22-25.(in Chinese)