南极地区一直被视为一个偏远、保持着原始环境的地方[1]。该地区常年被积雪覆盖,其酷寒、干燥和强辐射的自然条件一定程度上限制了生物的生存和繁衍,但也使得南极动植物及微生物的种类和性质具备一定的独特性[2-3]。科研人员已从极地水样[4]、土壤[5]和沉积物[6]等各类样品中,发现了数量众多的微生物种群,其中,优势种群为嗜冷/耐冷微生物,这些嗜冷/耐冷微生物不仅丰富了极地微生物菌种资源的多样性,而且为生物起源、进化及微生物分类提供了新的证据[7]。
南极大陆位于地球的最南端,环绕这个大陆的是由太平洋、大西洋和印度洋相连所形成的巨大水体——南大洋,约占全球海洋面积的 10%[8]。目前,国内外学者已从南极海域附近分离培养出了不同的菌株。如Huang等[9]从南极中山站周围的苔原土壤中分离出一株革兰氏阴性鞘单胞菌(Sphingomonas antarctica);Rigonato等[10]从南大西洋大陆架深水区和南极乔治王岛金钟湾的海洋中分离鉴定出两株蓝细菌,并证实这两株菌株为球状蓝藻(Aliterella antarctica)的新种;Sedlá![]() 等[11]从南极洲Ross Island和Eagle Island的冰川融化样品中分离出7株产生蓝紫色色素的菌株(Massilia)。
等[11]从南极洲Ross Island和Eagle Island的冰川融化样品中分离出7株产生蓝紫色色素的菌株(Massilia)。
目前,通过纯培养方式从环境中可获得的微生物低于1%[12],研究人员尝试用微生物富集、原位培养、改良培养基等方式获得更多的可培养菌种。如郑宁[13]通过富集培养基分离细菌,获得34株潜在新种;余欢[14]在培养基中添加一种氟喹诺酮类抗菌物质——诺氟沙星(NOR),分离结果显示,试验样本中梭菌科(Clostridiaceae)和变形菌门(Proteobacteria)类群的物种丰度显著上升,耐药性菌株数量也显著增加。
本研究中,在低温条件下使用3种类型培养基对伯氏肩孔南极鱼(Trematomus bernacchii)体液和肠道内容物中的微生物进行分离培养,对各属代表菌株的次级代谢产物进行功能初探。同时,选取两株分离菌株饲喂斑马鱼,对梯度降温处理下的斑马鱼生存状态进行观察和记录,并对侧翻斑马鱼的肠道基因组进行提取和分析,以期为开发和利用南极耐冷/嗜冷微生物资源提供依据,也为降低水产养殖业、冷链运输业的成本提供新思路。
1 材料与方法
1.1 材料
试验鱼:伯氏肩孔南极鱼采自中国第36次南极科考海域(69°22.505 5′ S,76°21.574 0′ E),垂钓获得后于-80 ℃超低温冰箱中保存;斑马鱼为上海海洋大学水产种质资源发掘与利用教育部重点实验室斑马鱼平台养殖的AB品系,养殖循环水pH为7.0左右,早晚各喂一次丰年虫。
菌种:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)为本实验室保存菌种;枯草芽孢杆菌(Bacillus subtilis ATCC 6633)、嗜水气单胞菌(Aeromonas hydrophila ATCC 35654)均购自广东微生物菌种保藏中心。
主要仪器:PCR仪(BIO-RAD)、水平电泳仪(BIO-RAD)、荧光显微镜(ZEISS)和旋转蒸发仪(上海秋佐科学仪器有限公司)。
主要试剂:2 × Phanta Max Master Mix(诺唯赞,P515-02);16S rDNA基因扩增引物、LB培养基、琼脂A、0.22 μm滤膜、药敏纸片[生工生物工程(上海)股份有限公司];BHI培养基(北京华威锐科化工有限公司);NB培养基(广东环凯微生物科技有限公司);FastDNA SPIN Kit for feces试剂盒(MP Biomedicals)。
1.2 方法
1.2.1 细菌分离纯化、分子鉴定及系统发育分析 取出冷冻的伯氏肩孔南极鱼样品,将其依次放置在-20、4 ℃温度下化冻。待鱼体完全解冻后,解剖并收集其体液和肠道内容物,分别稀释10-1、10-2,涂布于用海水配制的BHI、NB、LB平板上,18 ℃下培养2~3 d至单菌落长出,挑选不同形态的单菌落进行划线纯化,所有操作均在超净工作台上进行。
挑取分离纯化后的细菌扩培16 h,使用16S rDNA基因通用引物27F(5′AGAGTTTGATCCTGGCTCAG 3′)和 1492R(5′GGTTACCTTGTTACGACTT 3′)进行 PCR 扩增。PCR反应体系(20 μL):2 × Phanta Max Master Mix (10 mmol/L) 10 μL,引物27F和1492R(10 μmol/L)各1 μL,模板为1 μL,ddH2O 7 μL。PCR扩增条件:95 ℃下预变性10 min;95 ℃下变性30 s,50 ℃下退火30 s,72 ℃下延伸90 s,共进行29个循环;最后在72 ℃下再延伸10 min。PCR产物用10 g/L琼脂糖凝胶电泳检测后,将PCR产物送至生工生物工程(上海)股份有限公司进行测序,所得基因序列通过NCBI数据库进行比对,使用MEGA 6.0软件的邻接法(Neighbor-Joining method)进行系统发育分析,构建系统进化树。
1.2.2 细菌粗提物抑菌活性筛选
细菌粗提物的制备:从分离菌株各属中分别挑选一株或多株代表菌株,以1‰的菌量接种,在190 r/min、18 ℃下发酵3~4 d,以7 000×g离心10 min发酵液,获得上清液,并用等体积的乙酸乙酯萃取上清液3次,旋蒸至干,用1 mL灭菌ddH2O溶解粗提物作为待测样液。
抑菌试验:使用K-B法[15]验证待测样液的抑菌效果,阴性对照为灭菌ddH2O,指示菌E.coli、S.aureus、B.subtilis和A.hydrophila的阳性对照分别为1 mg/mL青霉素、100 μg/mL青霉素、30 μg/mL卡那霉素和1 mg/mL新霉素,使用游标卡尺测量抑菌圈直径(纸片直径包含在内),每组设置3个平行,结果取其平均值。
1.2.3 代表性菌株NB3-1、LB27-3的生理生化特性鉴定 通过细菌粗提物抑菌活性初筛,有4株细菌(LB27-3、NB3-1、BHI13-1、BHI17-1)的粗提物对指示菌有抑制生长的作用,又通过斑马鱼抑制生长的作用发现,口服菌株LB27-3、NB3-1的斑马鱼低温下存活时间更长,最终选取LB27-3、NB3-1两株菌进行后续研究。将两株菌在18 ℃下培养48 h,观察菌落表面状态、颜色(正、反面),测量菌落直径;采用标准革兰氏染色法测定革兰氏反应;分别用100 μg/mL的青霉素和50 μg/mL卡那霉素的平板涂布培养,检测其抗性;在不同温度(12、15、20、28、30、37、41 ℃)下测定其生长的温度范围[16];以1个pH单位为间隔(2~10),测定菌株生长的pH范围。
1.2.4 口服NB3-1、LB27-3细菌的斑马鱼耐低温试验
细菌计数:将20 mL菌液扩培到OD600 nm值为1.0左右,以2 000×g离心4 min收集细菌,用灭菌海水重悬再离心,设置3次重复,即可用来喂鱼。
体外攻毒试验:参照Zhang等[17]的方法,将斑马鱼分为淡水组(对照,FW)、海水组(SW)、NB3-1组和LB27-3组,每组10尾鱼,分别饲养在2 L 的鱼缸中。暂养 3 d 后加入菌液,最终缸内细菌浓度为1×106 CFU/mL,观察并记录12、24、36、48 h时斑马鱼的状态,验证菌株NB3-1、LB27-3对斑马鱼的毒性效果。
体内攻毒及低温处理试验:另取40尾斑马鱼,每组10尾鱼,暂养 3 d后,用移液枪注射10 μL相应的灭菌ddH2O至淡水组每尾斑马鱼口中,试验组每尾斑马鱼口中同样被注射10 μL海水或菌液,细菌数量为1×106 CFU[18],每日口服1次,持续4 d,期间正常饲喂丰年虫,静置2 d,再从28 ℃开始降温,每4 h降低1 ℃,直至8 ℃[19],期间观察鱼的游泳行为和状态并记录。此试验设置3次重复,3组数据用于统计学分析,斑马鱼累计死亡率以平均值±标准差(mean±S.D.)表示。
1.2.5 斑马鱼摄入NB3-1、LB27-3细菌后肠道微生物DNA提取和多样性分析 在体内攻毒及梯度降温过程中,将侧翻的斑马鱼解剖并取出肠道内容物,使用FastDNA SPIN Kit for feces试剂盒提取肠道微生物DNA,质检合格后,每组选3~5个DNA样品送至上海美吉生物医药科技有限公司测序,数据用美吉生物的生信平台(https://cloud. majorbio.com/)进行分析。
2 结果与分析
2.1 可培养细菌的物种多样性
从伯氏肩孔南极鱼的体液及肠道内容物中共分离获得34个菌株,根据16S rDNA基因序列比对发现,在门水平上,厚壁菌门(Firmicutes)数量最多(55.88%),其次是变形菌门(Proteobacteria)(44.12%);属水平上,芽孢杆菌属(Bacillus)数量最多(19株),属于分离菌中的优势类群,其次是费氏弧菌属(Aliivibrio)(6株)、产碱杆菌属(Paenalcaligenes)(6株)和伊格纳茨氏菌属(Ignatzschineria)(3株)(表1)。获得的34株菌中有33株菌的测序序列与NCBI中的有效发表菌株的相似度均在98%~100%。其中,菌株LB27-3是Bacillus优势菌属中比对序列同源性最低的菌株,菌株NB3-1与已知Ignatzschineria sp.LJ11细菌的16S rDNA基因序列一致性为97.75%,结合该菌的系统发育树结果(图1),其可能是一株潜在新种。

图1 基于16S rDNA 基因序列构建的NB3-1系统发育树
Fig.1 NB3-1 phylogenetic tree constructed based on 16S rDNA gene sequence
表1 南极鱼体表黏液、肠道中可培养细菌的16S rDNA序列比对
Tab.1 16S rDNA sequence alignment of culturable bacteria in the surface mucus and intestine of Antarctic fish

属genus 菌株编号strain No.相似性最高模式菌株(注册号)most similar model strain(registration No.)一致性/%uniformity费氏弧菌(Aliivibrio)BHI3-3-3-1BHI3-3-3-2LB2-1-1-1LB2-1-1-2NB2-2-1-1NB2-2-1-2Aliivibrio sp.A.H130426-2(LR813719.1)Aliivibrio sp.A.H130426-2(LR813719.1)Aliivibrio sp.A.H130426-2(LR813719.1)Aliivibrio sp.A.H130426-2(LR813719.1)Aliivibrio sp.A.H130426-2(LR813719.1)Aliivibrio sp.A.H130426-2(LR813719.1)99.1099.2499.1099.4499.2499.44产碱杆菌(Paenalcaligenes)NB2-2-1NB2-2-2NB1-1-2NB3-2-1NB3-2-2BHIA+1-2Paenalcaligenes faecalis(CP106841.1)Paenalcaligenes faecalis(CP106841.1)Paenalcaligenes faecalis(CP106841.1)Paenalcaligenes faecalis(CP106841.1)Paenalcaligenes faecalis(CP106841.1)Paenalcaligenes faecalis (CP106841.1)99.7999.6599.6599.7999.7998.12伊格纳茨氏菌(Ignatzschineria)NB3-1NB1-1NB2-1Ignatzschineria sp.LJ11(MG049766.1)Ignatzschineria sp.LJ11(MG049766.1)Ignatzschineria sp.LJ11(MG049766.1)97.7599.5899.72芽孢杆菌(Bacillus)BHI14-3NB12NB3-3LB3-1LB16-2NB3BHI17-3BHI13-1NB20-2NB17-1NB20-1BHI4-3NB17-2LB23-3LB16-3NB20-3BHI17-1NB2-3LB27-3Bacillus altitudinis XjGEB-71(JQ320096.1)Bacillus marisflavi LUPR60-8(MN004839.1)Bacillus marisflavi LUPR60-8(MN004839.1)Bacillus aquimaris YCY39(JF775424.1)Bacillus aerophilus 28K(MN845151.1)Bacillus aquimaris BF4(KJ524502.1)Bacillus sp.TSSAS2-12(GQ284500.1)Bacillus sp.TSSAS2-12(GQ284500.1)Bacillus sp.TSSAS2-12(GQ284500.1)Bacillus sp.TSSAS2-12(GQ284500.1)Bacillus sp.Bi15(MK940827.1)Bacillus sp.Bi15(MK940827.1)Bacillus sp.ms-22(MN726716.1)Bacillus altitudinis JYM50(MN511801.1)Bacillus sp.GJ06(KU893833.1)Bacillus sp.210_50(GQ199752.1)Bacillus pumilus HTI 3(MK521055.1)Bacillus marisflavi LUPR60-8(MN004839.1)Bacillus sp.hb117(KF863896.1)99.66100.0099.9399.6699.7999.6699.9399.7999.6699.93100.0099.9399.7399.6699.93100.00100.0099.7398.39
2.2 菌株粗提物抑菌试验
从4个属的菌株中分别随机挑选一株细菌(LB2-1-1-1、BHIA+1-2、NB3-1和LB27-3),进行抑菌效果测定,发现芽孢杆菌属(LB27-3)的细菌粗提物抑菌效果最明显,然后在该属中又挑选了3株菌进行抑菌效果测定。从表2可见:7株细菌粗提物中,有3株对嗜水气单胞菌有抑制作用,2株对金黄色葡萄球菌有抑制作用,3株对枯草芽孢杆菌有抑制作用,而无一株对大肠杆菌有抑制作用;7株菌中仅有NB3-1、LB27-3、BHI13-1、BHI17-1 4株菌对指示菌有抑菌作用。
表2 各属代表菌株粗提物对指示菌的抑菌圈直径
Tab.2 Diameter of antibacterial circles of crude extracts from representative strains in each genus against indicator bacteria mm
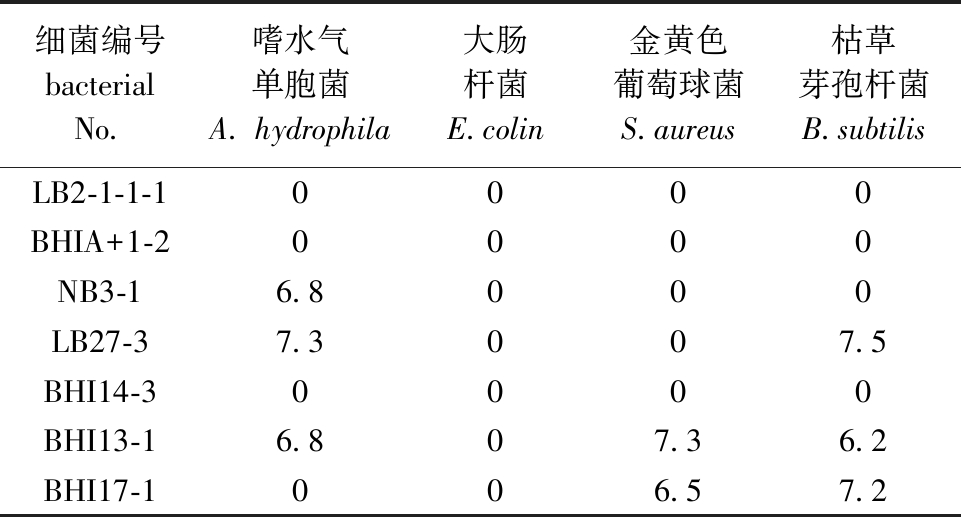
细菌编号bacterial No.嗜水气单胞菌A. hydrophila大肠杆菌E.colin金黄色葡萄球菌S.aureus枯草芽孢杆菌B.subtilisLB2-1-1-10000BHIA+1-20000NB3-16.8000LB27-37.3007.5BHI14-30000BHI13-16.807.36.2BHI17-1006.57.2
2.3 菌株NB3-1、LB27-3生理特征
荧光显微镜观察发现:菌株NB3-1(Ignatzschineria sp.LJ111)革兰氏染色呈红色,为革兰氏阴性菌;LB27-3(Bacillus sp.hb117)革兰氏染色呈紫色,为革兰氏阳性菌(图2)。18 ℃下培养48 h后,NB3-1菌落呈乳白色透亮,圆凸形,边缘光滑,菌落直径为1.0~1.5 mm;LB27-3菌落呈黄色,圆凸状,表面光滑有光泽,腐臭味,菌落直径为0.9~1.2 mm;在100 μg/mL的青霉素和50 μg/mL卡那霉素平板上菌株NB3-1均能生长,LB27-3均不能生长;菌株NB3-1生长温度范围为15~37 ℃,pH为5.0~9.0,菌株LB27-3生长温度范围为15~30 ℃,pH为5.0~10.0。

图2 NB3-1、LB27-3革兰氏染色结果
Fig.2 Colony diagram of NB3-1 and LB27-3 stained by Gram
2.4 口服NB3-1、LB27-3细菌的斑马鱼耐低温性能
体外攻毒试验48 h内,4组斑马鱼生存状态无明显差异,均无斑马鱼死亡现象,表明菌株NB3-1、LB27-3对斑马鱼的生存无毒害作用(表3)。在体内攻毒试验及梯度降温过程中,用菌株LB27-3、NB3-1、海水和淡水(对照)分别饲喂斑马鱼,再经过梯度降温处理后,试验组和淡水组均有1~2尾斑马鱼死亡,海水组无斑马鱼死亡;降至8 ℃后的第2天(D5),淡水组和海水组累计平均死亡率分别为70.0%、50.0%,LB27-3组和NB3-1组的平均死亡率分别为74.0%和72.0%,4组斑马鱼死亡率均超过50%;在降至8 ℃后的第3天(D6),淡水组和海水组的平均死亡率均达到100%,而LB27-3组和NB3-1组的平均死亡率达到81.0%和75.0%,仅有2~3尾斑马鱼存活,直至第6天(D9),这两组斑马鱼才全部死亡(表3)。
表3 降温试验中各组斑马鱼累计死亡率统计
Tab.3 Statistics of cumulative mortality rate of zebrafish in each group during cooling experiment %

时间time温度/℃temperature淡水组FW海水组SWLB27-3NB3-1D1280000D222003.0±0.13.0±0.1D3157.0±0.106.0±0.13.0±0.1D4817.0±0.18.0±0.139.0±0.111.0±0.1D5870.0±0.350.0±0.474.0±0.3172.0±0.4D68100.0±0.0100.0±0.081.0±0.175.0±0.1D78——92.0±0.285.0±0.2D88——92.0±0.290.0±0.1D98——100.0±0.0100.0±0.0
2.5 4组斑马鱼肠道微生物多样性分析
将各组侧翻的斑马鱼肠道微生物多样性组成进行分析。结果显示:在属水平上,海水组和LB27-3组斑马鱼肠道微生物中的气单胞菌(Aeromonas)属细菌占比最高,其次是希瓦氏菌(Shewanella)属、邻单胞菌(Plesiomonas)属和鲸杆菌(Cetobacterium)属;NB3-1组斑马鱼肠道微生物中弧菌(Vibrio)属占优势,超过70%,气单胞菌属、希瓦氏菌属次之,污泥单胞菌(Pelomonas)属和假单胞菌(Pseudomonas)属细菌也有少量被发现;淡水组中气单胞菌属最多,其次是希瓦氏菌属(图3)。基于Bray-Curtis距离的非度量多维尺度分析(NMDS)显示;LB27-3组和海水组距离较近,群落差异较小,这两组与淡水组差异较小;而NB3-1组斑马鱼肠道微生物单独聚集,距LB27-3组和海水组较远,微生物群落构成差异较大,形成一个独立的组群(图4)。
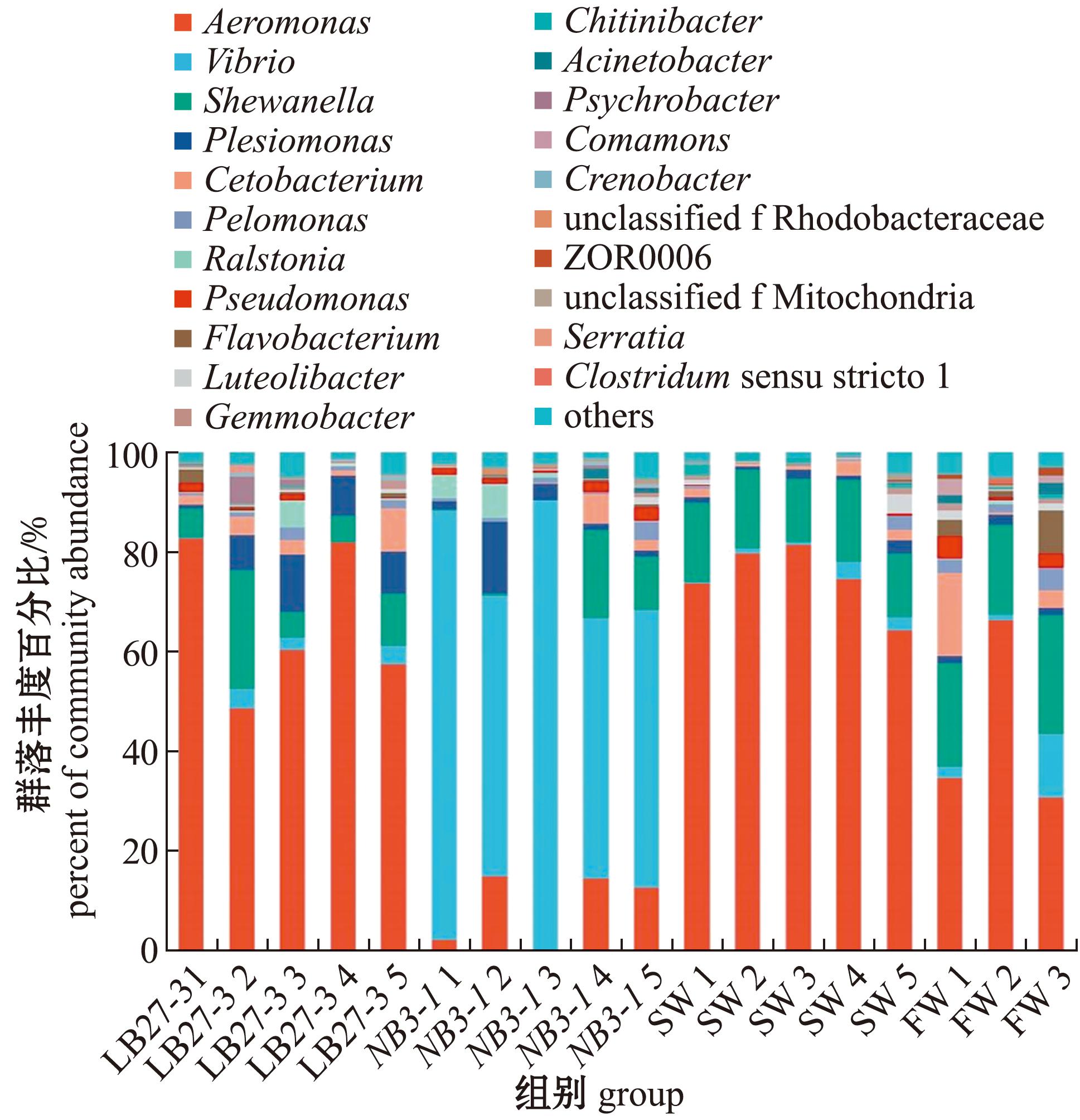
图3 基于属水平的斑马鱼肠道微生物组成分析
Fig.3 Analysis of the intestinal microbial cmposition of zebrafish based on genus level
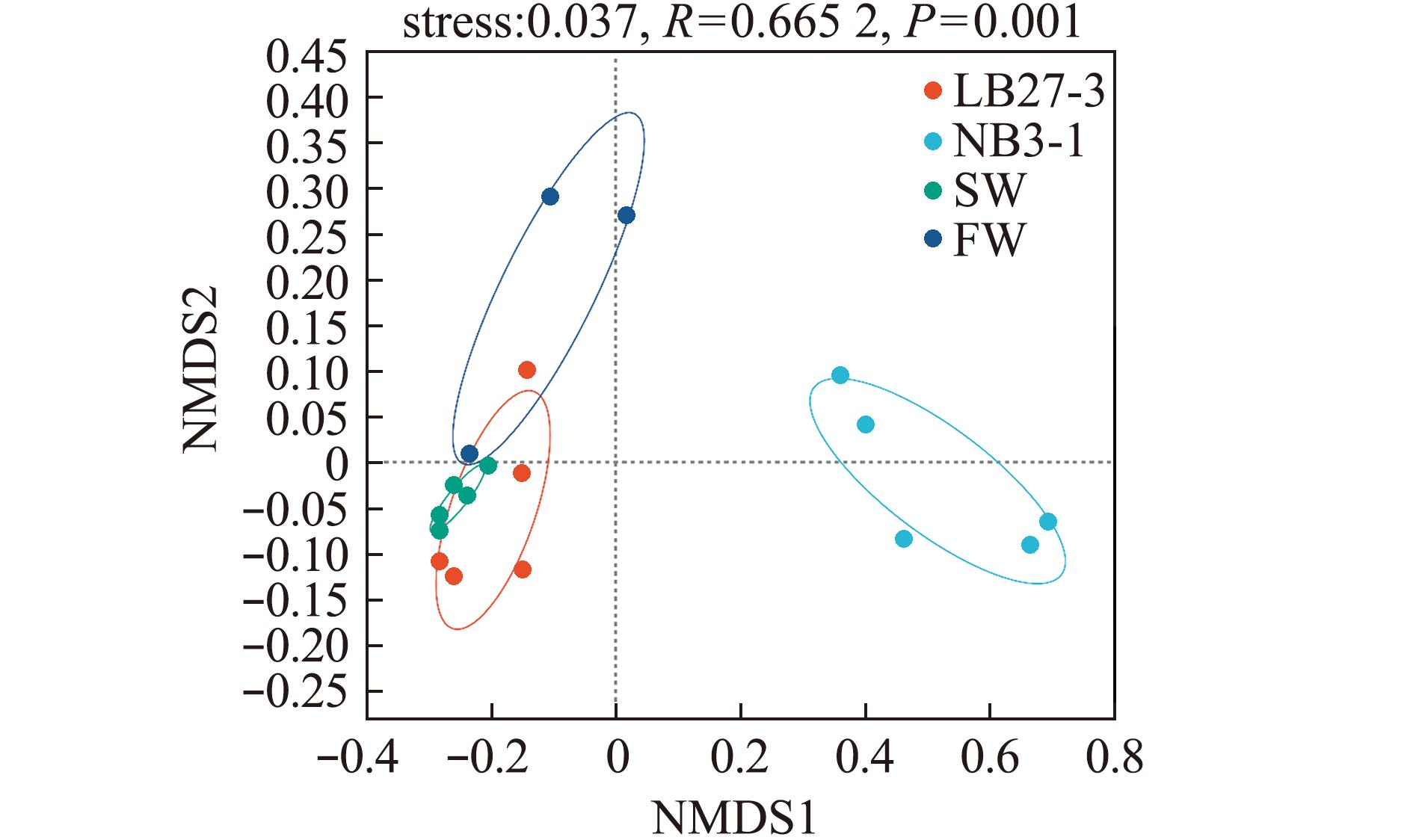
图4 基于属水平上的斑马鱼肠道微生物的非度量多维尺度分析
Fig.4 NMDS analysis of the intestinal microbiome of zebrafish based on genus level
3 讨论
3.1 南极鱼品系对菌种分离的影响
目前,南极鱼类相关的菌种分离研究,主要集中在南极鱼类的肠道微生物、皮肤微生物及肌肉微生物等[20]。本研究中,从南极中山站海域的伯氏肩孔南极鱼体液、肠道内容物样品中分离出的34株菌株中,门水平上,厚壁菌门(55.88%)为优势菌门,其次是变形菌门(44.12%);属水平上,芽孢杆菌属(55.90%)为优势菌属。这与赵文静等[21]的研究结果一致,该作者对南极伯氏肩孔南极鱼皮肤微生物进行高通量测序发现,门水平上,厚壁菌门占比最高(58.80%),其次为变形菌门(32.27%);属水平上,主要集中在芽孢杆菌属(50.34%),其次为火山岩菌属(Vulcaniibacterium)和嗜冷杆菌属(Psychrobacter)。Song等[22]对裘氏鳄头冰鱼(Champsocephalus gunnari)的肠道内容物进行Illumina Miseq测序分析发现,门水平上,厚壁菌门为优势菌门,其次是变形菌门,属水平上,梭菌属(Clostridium)为优势菌属,而鱼类肠道中常见的乳酸杆菌(Lactobacillus)和弧菌占比极低;Kim等[23]通过高通量测序对85种鱼类的肠道微生物组成分析发现,变形菌门(51.7%)和厚壁菌门(13.5%)占主导地位;Sedlá![]() 等[24]对4种南极鱼类的肠道内容物进行分离鉴定发现,变形菌门属于优势菌门,肠杆菌属(Enterobacter)属于优势菌属。这些研究表明,不同品系南极鱼的肠道内容物及体液中细菌的门类相差不大,主要为厚壁菌门和变形菌门,但是属水平上,不同品系的南极鱼肠道内容物分离鉴定出的细菌类群却存在较大差异,这种差异除了宿主(鱼的种类)因素影响外,与分离培养的条件和方式也有关系。本研究中,未能分离出拟杆菌门、放线菌门的菌株,以及嗜冷杆菌属、假单胞菌属和乳酸杆菌属这些南极鱼中的常见菌属[25],可能是培养温度偏高 (18 ℃)[6,25],或者选择的培养基类型不适宜嗜冷菌的生长。因此,后续试验考虑降至10 ℃培养,或者改变培养基种类,尝试共培养方式以获得更多种属的菌株。
等[24]对4种南极鱼类的肠道内容物进行分离鉴定发现,变形菌门属于优势菌门,肠杆菌属(Enterobacter)属于优势菌属。这些研究表明,不同品系南极鱼的肠道内容物及体液中细菌的门类相差不大,主要为厚壁菌门和变形菌门,但是属水平上,不同品系的南极鱼肠道内容物分离鉴定出的细菌类群却存在较大差异,这种差异除了宿主(鱼的种类)因素影响外,与分离培养的条件和方式也有关系。本研究中,未能分离出拟杆菌门、放线菌门的菌株,以及嗜冷杆菌属、假单胞菌属和乳酸杆菌属这些南极鱼中的常见菌属[25],可能是培养温度偏高 (18 ℃)[6,25],或者选择的培养基类型不适宜嗜冷菌的生长。因此,后续试验考虑降至10 ℃培养,或者改变培养基种类,尝试共培养方式以获得更多种属的菌株。
3.2 伯氏肩孔南极鱼分离微生物的抗菌作用
目前,过度滥用抗生素使得细菌耐药性现象越来越严重,而南极地区的微生物很可能因其对栖息地特定的适应性,进而产生尚未开发的天然产物和新型抗生素[26]。本研究中发现,菌株Ignatzschineria sp. LJ11在100 μg/mL的青霉素和50 μg/mL卡那霉素的平板上生长,该菌株与芽孢杆菌属多株菌的菌液粗提物对嗜水气单胞菌均有明显的抑制作用,芽孢杆菌属多株菌的菌液粗提物对枯草芽孢杆菌和金黄色葡萄球菌也有明显的抑制作用。目前,芽孢杆菌属主要产生多肽类抗生素[27],如杆菌肽和多粘菌素,而伊格纳茨式菌属细菌对碳青霉烯类抗生素具备广泛的耐药性[28],推测这些菌株的次级代谢产物中存在多肽类或青霉素类化合物,故对嗜水气单胞菌和枯草芽孢杆菌等常见致病菌有着广泛的抑制作用,后续可以通过多级分离纯化的方式提取纯品,并与已知的抗生素进行药效比较,从而挖掘具有生物活性良好、结构新颖的功能分子。已有研究表明,土壤真菌[29]及细菌中的放线菌[30-31]类群释放的次级代谢产物是新型抗生素的重要来源。Xiao等[20]从伯氏肩孔南极鱼的共生菌中分离出一株Serratia myotis L7-1,通过多级分离和活性验证发现,该菌的次级代谢产物Serranticin具有显著的抗菌和抗肿瘤活性;Della等[32]从伯氏肩孔南极鱼类的转录组中发现了一种新的抗菌肽(antimicrobial peptide,AMP),并通过体外合成验证了其功效;Shin等[33]从革首南极鱼(Notothenia coriiceps)、扁嘴副带腭鱼(Parachaenichthys charcoti)的基因图谱中鉴定出两种与莫罗杀素(Moronecidin)相似的抗菌肽。这些研究表明,除放线菌属和土壤真菌之外,芽孢杆菌属、伊格纳茨氏菌属和沙雷氏菌(Serratia )属等也是发掘药物先导化合物的重要来源。今后应对本研究中筛选出的有抑菌效果的菌株做进一步探究。
3.3 饲喂细菌对斑马鱼肠道微生物群落的影响
斑马鱼的肠道微生物群落构建和演替受到宿主发育阶段的显著影响,而环境因素如孵化环境和环境变迁的影响相对较小。通过饲喂特定的细菌或饲料添加剂,可以调节斑马鱼的肠道微生物群落,进而可能对宿主的健康和免疫力产生积极的影响[34]。本研究中,饲喂Ignatzschineria sp. LJ11细菌后斑马鱼肠道中,弧菌属占比较淡水组显著上升,投喂Bacillus sp.hb117细菌后的斑马鱼肠道中气单胞菌属占比较淡水组显著上升,而气单胞菌属、弧菌属均为致病菌,推测斑马鱼在进食Ignatzschineria sp.LJ11、Bacillus sp.hb117细菌后,肠道微生物中群落组成比例严重失调,最终导致斑马鱼死亡。孙雯等[35]研究发现,斑马鱼感染嗜水气单胞菌会引起自身肠道微生物OTUs数量明显下降,Alpha多样性降低,进而导致肠道生理损伤和菌群失调;Zhang等[17]在比较斑马鱼感染无乳链球菌(Streptococcus agalactiae)12、24 h后肠道微生物组成变化时发现,在种水平上,致病菌维氏气单胞菌(Aeromonas veronii)、无乳链球菌(S.Agalactiae)、梭状芽胞杆菌(Clostridium tarantellae)的相对丰度显著升高,有益菌地衣芽孢杆菌(Bacillus licheniformis)、丛毛单胞菌属(Comamonas koreensis)、罗氏菌属(Romboutsia ilealis)的相对丰度显著降低,表明无乳链球菌感染斑马鱼后通过促进其肠道致病菌的丰度而最终致鱼死亡。
4 结论
1)从伯氏肩孔南极鱼体液和肠道内容物中成功分离出34株可培养细菌,包含2个门和9个属,其中,有一株潜在新种Lgnatzschineria sp.LJ11。
2)通过对不同属的菌液粗提物进行抑菌试验,发现芽孢杆菌属中有多株菌液粗提物对指示菌有抑制作用,其中,Bacillus sp.hb117菌液粗提物对3种指示菌均有抑制作用,表明这些菌株的次级代谢产物中可能存在特殊的化合物,对嗜水气单胞菌、枯草芽孢杆菌和金黄色葡萄球菌有极强的抑制作用。
3)在斑马鱼饲喂细菌试验中,观察到投喂Ignatzschineria sp.LJ11、Bacillus sp.hb117的斑马鱼相比于淡水组在低温下存活的时间更长。多样性分析发现,投喂Bacillus sp.hb117细菌的斑马鱼肠道微生物中气单胞菌属细菌占比最高,投喂Ignatzschineria sp.LJ11细菌的斑马鱼肠道微生物中弧菌属占比最高,表明在摄入极地菌株后斑马鱼肠道微生物组成发生一定程度的变化,这可能是导致斑马鱼在低温下存活时间更长的原因之一。
[1] WALL D H.Biodiversity and ecosystem functioning in terrestrial habitats of Antarctica[J].Antarctic Science,2005,17(4):523-531.
[2] MONSALVES M T,OLLIVET-BESSON G P,AMENABAR M J,et al.Isolation of a psychrotolerant and UV-C-resistant bacterium from Elephant Island,Antarctica with a highly thermoactive and thermostable catalase[J].Microorganisms,2020,8(1):95.
[3] 张晓雯,张艳杰,李玮,等.南极独角雪冰鱼与尼罗罗非鱼Grik1基因的克隆及其在低温胁迫下的作用比较[J].大连海洋大学学报,2023,38(1):68-75.ZHANG X W,ZHANG Y J,LI W,et al.Cloning and function exploration comparison of Grik1 in Antarctic crocodile icefish(Chionodmco hamatus)and Nile tilapia(Oreochromis niloticus)exposed to cold stress[J].Journal of Dalian Ocean University,2023,38(1):68-75.(in Chinese)
[4] 翟万营,汪倩,王佳华,等.南极中山站附近海水微生物多样性和宏基因组分析[J].上海海洋大学学报,2022,31(1):288-297.ZHAI W Y,WANG Q,WANG J H,et al.Microbial diversity and metagenomic analysis of seawater microorganism near Zhongshan Station,Antarctica[J].Journal of Shanghai Ocean University,2022,31(1):288-297.(in Chinese)
[5] TAHON G,WILLEMS A.Isolation and characterization of aerobic anoxygenic phototrophs from exposed soils from the Sr Rondane Mountains,East Antarctica[J].Systematic and Applied Microbiology,2017,40(6):357-369.
[6] 张丽珉,赵琳,丛柏林.南极罗斯海区域可培养微生物分离鉴定及产低温酶能力初步筛选[J].海洋学报,2018,40(8):152-164.ZHANG L M,ZHAO L,CONG B L.Diversity of culturable bacteria and fungi isolated from Ross Sea Region of Antarctica separation,identification and initial screening for the ability to produce low-temperature enzymes[J].Haiyang Xuebao,2018,40(8):152-164.(in Chinese)
[7] GARC A-ECHAURI S A,GIDEKEL M,GUTI
A-ECHAURI S A,GIDEKEL M,GUTI RREZ-MORAGAA,et al.Isolation and phylogenetic classification of culturable psychrophilic prokaryotes from the Collins glacier in the Antarctica[J].Folia Microbiologica,2011,56(3):209-214.
RREZ-MORAGAA,et al.Isolation and phylogenetic classification of culturable psychrophilic prokaryotes from the Collins glacier in the Antarctica[J].Folia Microbiologica,2011,56(3):209-214.
[8] AZAM F,SMITH D C,STEWARD G F,et al.Bacteria-organic matter coupling and its significance for oceanic carbon cycling[J].Microbial Ecology,1994,28(2):167-179.
[9] HUANG Y,WEI Z Y,DANZENG W M,et al.Sphingomonas antarctica sp.nov.,isolated from Antarctic tundra soil[J].International Journal of Systematic and Evolutionary Microbiology,2017,67(10):4064-4068.
[10] RIGONATO J,GAMA W A,ALVARENGA D O,et al.Aliterella atlantica gen.nov.,sp.nov.,and Aliterella antarctica sp.nov.,novel members of coccoid Cyanobacteria[J].International Journal of Systematic and Evolutionary Microbiology,2016,66(8):2853-2861.
[11] ![]() I,HOLOCHOV
I,HOLOCHOV P,BUSSE H J,et al.Characterisation of waterborne psychrophilic Massilia isolates with violacein production and description of Massilia antarctica sp.nov[J].Microorganisms,2022,10(4):704.
P,BUSSE H J,et al.Characterisation of waterborne psychrophilic Massilia isolates with violacein production and description of Massilia antarctica sp.nov[J].Microorganisms,2022,10(4):704.
[12] AMANN R I,LUDWIG W,SCHLEIFER K H.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Microbiological Reviews,1995,59(1):143-169.
[13] 郑宁.沿海沉积物细菌的富集培养及菌株28AX09的生理和基因组学研究[D].济南:山东大学,2022.ZHENG N.Enrichment culture of bacteria from coastal sediments and physiological and genomic studies of strain 28AX09[D].Jinan:Shandong University,2022.(in Chinese)
[14] 余欢.诺氟沙星胁迫对近海沉积物富集培养过程中细菌群落的影响研究[D].济南:山东大学,2022.YU H.Effects of norfloxacin stress on bacterial communities during enrichment culture in offshore sediments[D].Jinan:Shandong University,2022.(in Chinese)
[15] KONG C S,CHEN J,ZOU X Y,et al.Study on drug sensitivity against Comamonas testosteroni by Kirby-Bauer disk diffusion method[J].Journal of Central South University Medical Sciences,2016,41(8):856-859.
[16] M RQUEZ S L,BLAMEY J M.Isolation and partial characterization of a new moderate thermophilic Albidovulum sp.SLM16 with transaminase activity from Deception Island,Antarctica[J].Biological Research,2019,52(1):5.
RQUEZ S L,BLAMEY J M.Isolation and partial characterization of a new moderate thermophilic Albidovulum sp.SLM16 with transaminase activity from Deception Island,Antarctica[J].Biological Research,2019,52(1):5.
[17] ZHANG Q L,LI H W,WU W,et al.The response of microbiota community to Streptococcus agalactiae infection in zebrafish intestine[J].Frontiers in Microbiology,2019,10:2848.
[18] 单颖.单核细胞增生李斯特菌:无菌斑马鱼感染模型及Mmp-9在抗细菌感染中的作用机制[D].杭州:浙江大学,2016.SHAN Y.Listeria monocytogenes:germ-free zebrafish infection model and the antibacterial role of Mmp-9 during infection[D].Hangzhou:Zhejiang University,2016.(in Chinese)
[19] HU P,LIU M L,LIU Y M,et al.Transcriptome comparison reveals a genetic network regulating the lower temperature limit in fish[J].Scientific Reports,2016,6:28952.
[20] XIAO Y,YAN F F,CUI Y K,et al.A symbiotic bacterium of Antarctic fish reveals environmental adaptability mechanisms and biosynthetic potential towards antibacterial and cytotoxic activities[J].Frontiers in Microbiology,2023,13:1085063.
[21] 赵文静,许强华.伯氏肩孔南极鱼和革首南极鱼皮肤微生物多样性的研究[J].大连海洋大学学报,2019,34(6):792-797.ZHAO W J,XU Q H.Microbial diversity on skins in two species of Antarctic fish,Trematomus bernacchii and Notothenia coriiceps[J].Journal of Dalian Ocean University,2019,34(6):792-797.(in Chinese)
[22] SONG H,LEE S,HAN D W,et al.Characterization of the gut microbiota of mackerel icefish,Champsocephalus gunnari[J].Fishes,2022,8(1):13.
[23] KIM P S,SHIN N R,LEE J B,et al.Host habitat is the major determinant of the gut microbiome of fish[J].Microbiome,2021,9(1):166.
[24] ![]() E,
E, VEC P.Composition of cultivable enteric bacteria from the intestine of Antarctic fish (Family Nototheniidae)[J].Czech Journal of Animal Science,2016,61(3):127-132.
VEC P.Composition of cultivable enteric bacteria from the intestine of Antarctic fish (Family Nototheniidae)[J].Czech Journal of Animal Science,2016,61(3):127-132.
[25] 张雨欣,罗玮,俞勇,等.南极恩克斯堡岛土壤中可培养细菌多样性[J].微生物学通报,2020,47(6):1709-1720.ZHANG Y X,LUO W,YU Y,et al.Culturable bacterial diversity in soils of Inexpressible Island,Antarctica[J].Microbiology China,2020,47(6):1709-1720.(in Chinese)
[26] ![]() K,BARRIENTOS L.Advances in Antarctic research for antimicrobial discovery:a comprehensive narrative review of bacteria from Antarctic environments as potential sources of novel antibiotic compounds against human pathogens and microorganisms of industrial importance[J].Antibiotics,2018,7(4):90.
K,BARRIENTOS L.Advances in Antarctic research for antimicrobial discovery:a comprehensive narrative review of bacteria from Antarctic environments as potential sources of novel antibiotic compounds against human pathogens and microorganisms of industrial importance[J].Antibiotics,2018,7(4):90.
[27] JAMIL B,HASAN F,HAMEED A,et al.Isolation of Bacillus subtilis MH-4 from soil and its potential of polypeptidic antibiotic production[J].Pakistan Journal of Pharmaceutical Sciences,2007,20(1):26-31.
[28] MANIAM K,ARGENTINE S.A case of sepsis due to a rare carbapenem-resistant Ignatzschineria species[J].IDCases,2021,27:e01354.
[29] TISTECHOK S,SKVORTSOVA M,MYTSYK Y,et al.The diversity and antibacterial activity of culturable Actinobacteria isolated from the rhizosphere soil of Deschampsia antarctica (Galindez Island,Maritime Antarctic)[J].Polar Biology,2021,44(9):1859-1868.
[30] ENCHEVA-MALINOVA M,STOYANOVA M,AVRAMOVAH,et al.Antibacterial potential of Streptomycete strains from Antarctic soils[J].Biotechnology,Biotechnological Equipment,2014,28(4):721-727.
[31] SILVA T R,DUARTE A W F,PASSARINI M R Z,et al.Bacteria from Antarctic environments:diversity and detection of antimicrobial,antiproliferative,and antiparasitic activities[J].Polar Biology,2018,41(7):1505-1519.
[32] DELL A PELLE G,PER G,BELARDINELLI M C,et al.Trematocine,a novel antimicrobial peptide from the Antarctic fish Trematomus bernacchii:identification and biological activity[J].Antibiotics,2020,9(2):66.
G,BELARDINELLI M C,et al.Trematocine,a novel antimicrobial peptide from the Antarctic fish Trematomus bernacchii:identification and biological activity[J].Antibiotics,2020,9(2):66.
[33] SHIN S C,AHN I H,AHN D H,et al.Characterization of two antimicrobial peptides from Antarctic fishes (Notothenia coriiceps and Parachaenichthys charcoti)[J].PLoS One,2017,12(1):e0170821.
[34] JIA P P,JUNAID M,WEN P P,et al.Role of germ-free animal models in understanding interactions of gut microbiota to host and environmental health:a special reference to zebrafish[J].Environmental Pollution,2021,279.
[35] 孙雯,王永杰,鲍俊杰,等.嗜水气单胞菌(Aeromonas hydrophila)引起斑马鱼肠道生理损伤和肠道菌群失调[J].海洋与湖沼,2023,54(4):1191-1198.SUN W,WANG Y J,BAO J J,et al.Aeromonas hydrophila caused intestinal physiological damage and intestinal microbial disorder in zebrafish[J].Oceanologia et Limnologia Sinica,2023,54(4):1191-1198.(in Chinese)