星康吉鳗(Conger myriaster)隶属于康吉鳗亚科(Congridae)康吉鳗属(Conger)[1],其肉质细嫩、营养丰富,具有较高的经济价值,是中国黄海、渤海、东海,以及日本列岛与朝鲜半岛附近海域重要的捕捞鱼类之一。同其他主要的养殖鳗鲡种类[日本鳗鲡(Anguilla japonica)、欧洲鳗鲡(A.anguilla)和美洲鳗鲡(A.rostrata)等]一样,星康吉鳗的养殖种源全部来自捕捞的野生苗种。20世纪中后期以来,世界范围内的鳗鲡野生资源出现了严重衰退[2-3],而作为有潜力的养殖新对象,提升星康吉鳗人工养殖效益已受到水产养殖者的关注。目前,中国黄海、渤海和东海沿岸地区均有星康吉鳗的人工养殖。在自然海域,星康吉鳗主要摄食底栖和游泳动物,以鱼类、虾类和头足类为主要饵料类群[4]。进一步研究发现,星康吉鳗的饵料生物组成随季节发生明显变化,但四季均以鱼类和虾类为主[5]。根据星康吉鳗摄食特点,工厂化养殖该鱼时,可饲喂新鲜的小型野杂鱼等,或者将小杂鱼等加工成肉糜,再按比例加入到其他鳗鱼类的配合饲料中,搅拌均匀后投喂[6-8]。
目前,国内外星康吉鳗的规模化养殖尚未形成,且星康吉鳗为肉食性鱼类,有关星康吉鳗营养需求的研究在国际上尚处于空白状态[9]。为适应规模化养殖的需求,亟需对星康吉鳗营养需求及配合饲料进行研究。
饲料的营养成分和鱼类对其消化吸收利用率是评价饲料营养价值的重要指标[10]。饲料的种类、性质及其所含营养成分的差异会影响养殖鱼类的生长性能、免疫、体成分组成、消化酶活性及分泌等[11-13]。根据渔业资源调查中对海捕野生星康吉鳗消化系统内食物组成的报道[5,14],以及现有的日本鳗鲡人工养殖配合饲料使用情况,本研究中进行了不同饲料饲喂星康吉鳗的养殖试验,通过测定各试验组鱼的特定生长率、增重率、表观消化率、鱼体营养成分及消化酶活性等指标,分析了不同饲料对星康吉鳗生长性能、消化生理等的影响,以期为开发星康吉鳗商品饲料提供参考依据。
1 材料与方法
1.1 材料
试验用饲料原料玉筋鱼(Ammodytes personatus)和方氏云鳚(Enedras fangi)来自山东省琅琊附近海域;虾糠(shrimp meal)为日照欣彗水产育苗有限公司馈赠的养殖凡纳滨对虾(Litopenaeus vannamei)脱壳;日本鳗鲡配合饲料为采购的中山统一幼鳗饲料;鱼粉(fish meal)为采购的农康畜秘鲁鱼粉。
1.2 方法
1.2.1 试验饲料的配制 试验设置饲料1(日本鳗鲡配合饲料83%+虾糠3%+鱼粉14%)、饲料2(日本鳗鲡配合饲料)、饲料3(玉筋鱼)、饲料4(方氏云鳚)和饲料5(玉筋鱼+方氏云鳚混合料)等5种饲料。饲料原料及饲料营养成分如表1所示。饲料制作前,将虾糠原料粉碎并过198 μm筛;玉筋鱼、方氏云鳚、虾糠和鱼粉原料置于-20 ℃冰箱中冷藏备用。饲料1和饲料2在使用时分别与水按照质量比为1∶1~1∶0.8制成黏性团状饲料,现配现用。
表1 试验原料和试验饲料营养成分含量(干物质)
Tab.1 Nutrient composition of the raw material and the experimental diets (dry matter) w/%
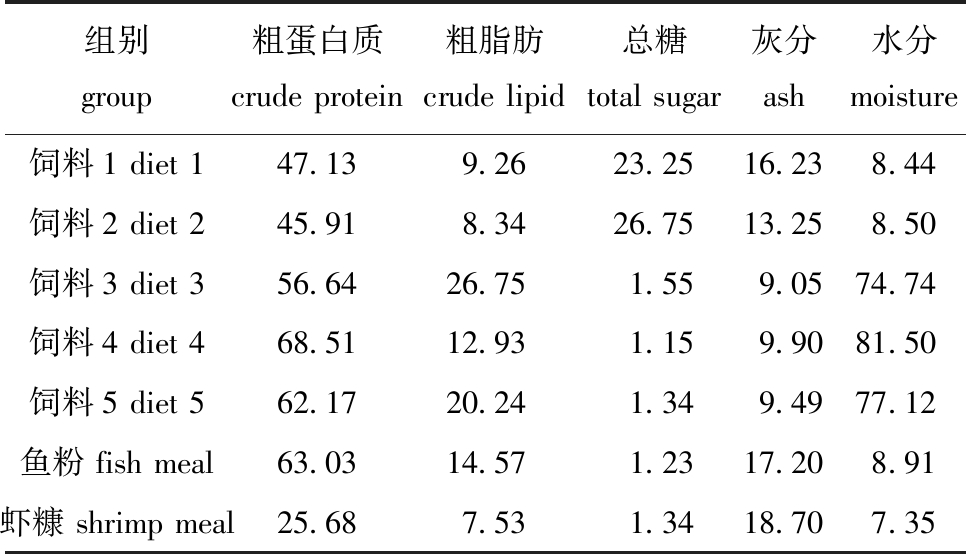
组别 group粗蛋白质 crude protein粗脂肪 crude lipid总糖 total sugar灰分 ash水分 moisture饲料1 diet 147.139.2623.2516.238.44饲料2 diet 245.918.3426.7513.258.50饲料3 diet 356.6426.751.559.0574.74饲料4 diet 468.5112.931.159.9081.50饲料5 diet 562.1720.241.349.4977.12鱼粉 fish meal63.0314.571.2317.208.91虾糠 shrimp meal25.687.531.3418.707.35
1.2.2 试验设计及饲养管理 将试验用星康吉鳗充氧运输到中国水产科学研究院黄海水产研究所琅琊基地室内养殖车间的玻璃钢养殖池(4.0 m×3.0 m×1.8 m)内,用冰鲜杂鱼进行为期2.5个月的驯养。饲养试验设置5组,每组设置3个重复。
选择健康、规格一致的星康吉鳗(体质量为53.98 g±1.23 g),称重后随机放入15个试验桶(圆柱形桶,水体体积为600 L)中,试验桶连续24 h充气,每个桶放养26尾鱼。试验期间,分别用5种饲料进行投喂,采用饱食投喂法,每日19:00投喂一次,养殖试验共进行40 d。试验期间,每天称量并记录投喂的饵料质量、摄食后残饵的质量和收集的粪便质量。试验过程中,车间的光照条件为自然光照,养殖用海水水温为25.6~27.4 ℃、盐度为29~31,溶氧水平为4.7~5.3 mg/L,氨氮浓度为0.326~0.391 mg/L,亚硝酸氮浓度为0.051~0.072 mg/L,pH为7.8~8.4。
1.2.3 生长指标的测定与计算 试验开始时,准确记录各试验桶中投放试验鱼的数量、质量。养殖试验结束时,将试验鱼饥饿处理24 h,统计各试验桶中存活鱼的总数量和总质量,计算其成活率(survival rate)、增重率(weight gain rate)、特定生长率(specific growth rate)和饲料系数(feed conversion ratio)等指标。计算公式为
RSR=100%×(Nf/Ni),
(1)
RWGR=100%×(Wf-Wi)/Wi,
(2)
RSGR=100%×(lnWf-lnWi)/t,
(3)
RFCR=100%×S/(Wf-Wi)。
(4)
式中:RSR为成活率(%);RWGR为增重率(%);RSGR为特定生长率(%/d);RFCR为饲料系数;Ni为试验初鱼数量(ind.);Nf为试验末鱼数量(ind.);Wi为试验初鱼体质量(g);Wf为试验末鱼体质量(g);S为总摄食饲料的干质量(g);t为饲养时间(d)。
1.2.4 样品采集与分析 养殖试验开始前,随机选取3尾星康吉鳗设为初始组,作为常规营养成分和消化酶活性分析结果的对照。试验结束后,从每组随机取3尾星康吉鳗,于-20 ℃下冷藏,待测全鱼常规的体成分。养殖试验期间,每日早晚各换水一次,同时用虹吸法收集新鲜成型、饱满完好及分散粪便,并在试验结束前一天停止投喂并进行粪便收集。对原料、饲料和粪便进行常规营养成分分析,采用AOAC(Association of Official Analytical Chemists)[15]描述的方法测定粗蛋白质、粗脂肪、灰分和水分含量。采用凯氏定氮仪(VELP UDK142 automatic distillation units,意大利)测定粗蛋白质含量,采用直接干燥法(105 ℃)测定水分含量,采用索氏抽提仪(Foss Twcator,Hoganas,瑞典)测定粗脂肪含量,采用分光光度法(DB12/T 847—2018)测定总糖含量,采用马弗炉高温灼烧法(550 ℃)测定灰分含量。采用电感耦合等离子体发射光谱仪(Thermo iCAP 7600 ICP-OES,美国)测定饲料、粪便中的钇含量,按照Sugiura等[16]的方法计算表观消化率(apparent digestibility coefficient,ADC)。
干物质表观消化率,以及饲料中粗蛋白质、粗脂肪、粗糖分的表观消化率计算公式为
RADC=100%×[1-(DY/FY)],
(5)
(6)
式中:RADC为干物质表观消化率![]() 为粗蛋白质、粗脂肪、粗糖分的表观消化率(%);FY为粪便中Y2O3含量(%);DY为饲料中Y2O3含量(%);F为粪便中对应营养物质的含量(%);D为饲料中对应营养物质的含量(%)。
为粗蛋白质、粗脂肪、粗糖分的表观消化率(%);FY为粪便中Y2O3含量(%);DY为饲料中Y2O3含量(%);F为粪便中对应营养物质的含量(%);D为饲料中对应营养物质的含量(%)。
1.2.5 消化酶活性的测定 试验结束后,从各平行组随机选取1尾鱼,用MS-222(260 mg/L)快速麻醉后测定体质量表观指标,并迅速解剖,取出星康吉鳗胃、肠道(前肠、中肠和后肠)组织样品置于-40 ℃冰柜中保存,用于消化酶活性测定。
使用南京建成生物科技有限公司的相关试剂盒分别测定样品的总蛋白质浓度(A045-4-2),以及胰蛋白酶(A08)、脂肪酶(A054-2-1)和淀粉酶(C016)活性。
1.3 数据处理
采用Excel 2020软件对试验数据进行处理,试验数据以平均值±标准差(mean ± S.D.)表示。利用SPSS 26.0软件进行单因素方差分析(one-way ANOVA),若差异显著,则使用Duncan方法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同饲料组星康吉鳗幼鱼生长性能的比较
从表2可见:饲料3、5组星康吉鳗的终末体质量显著高于饲料1、2、4组(P<0.05);饲料3、5组星康吉鳗的特定生长率和增重率显著高于饲料1、2组(P<0.05);饲料3、4、5组的饲料系数均显著低于饲料1、2组(P<0.05);各组试验鱼的成活率均为100%。
表2 不同饲料对星康吉鳗幼鱼生长指标的影响
Tab.2 Effects of various diets on the growth index of juvenile Conger myriaster
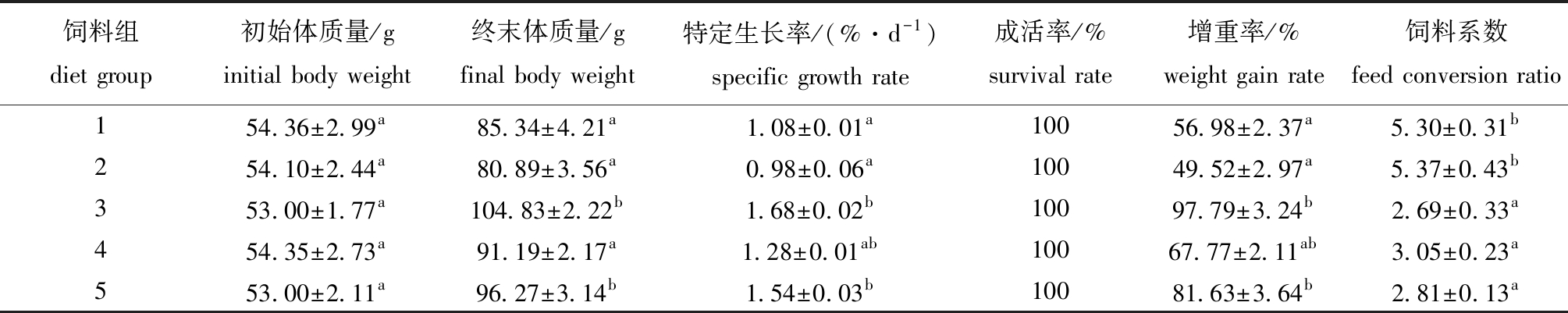
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
饲料组diet group初始体质量/ginitial body weight终末体质量/gfinal body weight 特定生长率/(%·d-1)specific growth rate成活率/%survival rate增重率/%weight gain rate饲料系数feed conversion ratio154.36±2.99a85.34±4.21a1.08±0.01a10056.98±2.37a5.30±0.31b254.10±2.44a80.89±3.56a0.98±0.06a10049.52±2.97a5.37±0.43b353.00±1.77a104.83±2.22b1.68±0.02b10097.79±3.24b2.69±0.33a454.35±2.73a91.19±2.17a1.28±0.01ab10067.77±2.11ab3.05±0.23a553.00±2.11a96.27±3.14b1.54±0.03b10081.63±3.64b2.81±0.13a
2.2 不同饲料组星康吉鳗幼鱼表观消化率的比较
从表3可见,星康吉鳗幼鱼对饲料1、2组中干物质、粗蛋白质和粗脂肪表观消化率均显著低于饲料3、4、5组(P<0.05),而各饲料组粗糖分表观消化率均无显著性差异(P>0.05)。
表3 星康吉鳗幼鱼对不同饲料的表观消化率
Tab.3 Apparent digestibility of various diets in the juvenile Conger myriaster %
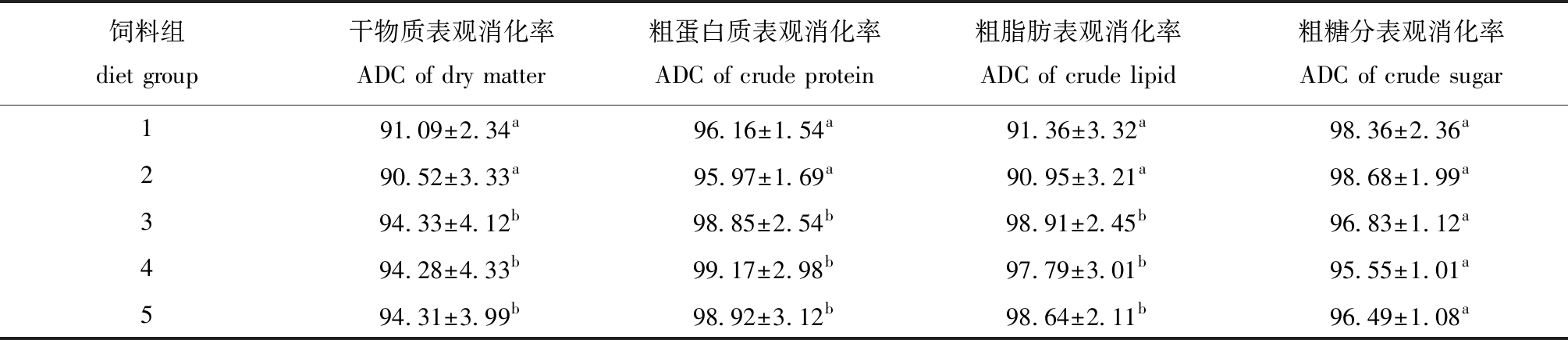
饲料组 diet group干物质表观消化率ADC of dry matter粗蛋白质表观消化率ADC of crude protein粗脂肪表观消化率ADC of crude lipid粗糖分表观消化率ADC of crude sugar191.09±2.34a96.16±1.54a91.36±3.32a98.36±2.36a290.52±3.33a95.97±1.69a90.95±3.21a98.68±1.99a394.33±4.12b98.85±2.54b98.91±2.45b96.83±1.12a494.28±4.33b99.17±2.98b97.79±3.01b95.55±1.01a 594.31±3.99b98.92±3.12b98.64±2.11b96.49±1.08a
2.3 不同饲料组星康吉鳗幼鱼体成分的比较
从表4可见:各组星康吉鳗幼鱼全鱼的水分、粗蛋白质含量无显著性差异(P>0.05);鱼体的粗脂肪和总糖含量分别为11.67%~13.84%、0.20%~0.32%,幼鱼的粗脂肪和总糖含量随饲料中粗脂肪和总糖水平(表1)的提高呈上升趋势,其中,饲料3、5组鱼体的粗脂肪含量显著高于饲料1、2组(P<0.05),饲料1、2组鱼体的总糖含量显著高于饲料4、5组(P<0.05)。
表4 不同饲料对星康吉鳗幼鱼体成分的影响(湿质量)
Tab.4 Effects of various diets on the body composition of juvenile Conger myriaster (wet weight) w/%

饲料组 diet group粗蛋白质 crude protein粗脂肪 crude lipid总糖 total sugar灰分 ash水分 moisture初始initial16.68±0.98a11.94±0.12a0.25±0.01ab2.31±0.19ab67.53±1.14a116.84±1.22a11.88±0.76a0.28±0.03b2.65±0.15b65.33±1.01a216.85±0.54a11.67±0.34a0.32±0.01b2.50±0.15b66.12±2.11a317.04±1.39a13.84±1.00b0.27±0.01ab2.10±0.20a64.66±1.31a416.98±1.02a13.03±0.86ab0.20±0.02a2.18±0.20a64.93±1.24a516.94±1.11a13.52±0.85b0.22±0.01a2.13±0.15a64.73±1.33a
2.4 不同饲料组星康吉鳗幼鱼胰蛋白酶活性的比较
鱼类消化道内蛋白酶活性与饲料中蛋白质含量紧密相关。从图1可见:星康吉鳗幼鱼各消化器官中,胰蛋白酶活性依次为前肠>胃>中肠>后肠;从整体趋势上看,各消化器官中饲料4组幼鱼的胰蛋白酶活性最高,其后酶活性大小依次为饲料5组、3组、初始组、1组、2组,这与各饲料组中蛋白质含量(表1)、粗蛋白质表观消化吸收率(表3)高低排序相符合;在胃和后肠中,饲料1、2组幼鱼的胰蛋白酶活性显著低于饲料4组(P<0.05),而与饲料3、5组则无显著性差异(P>0.05);在前肠和中肠中,饲料1、2组幼鱼的胰蛋白酶活性显著低于饲料3、4、5组(P<0.05)。
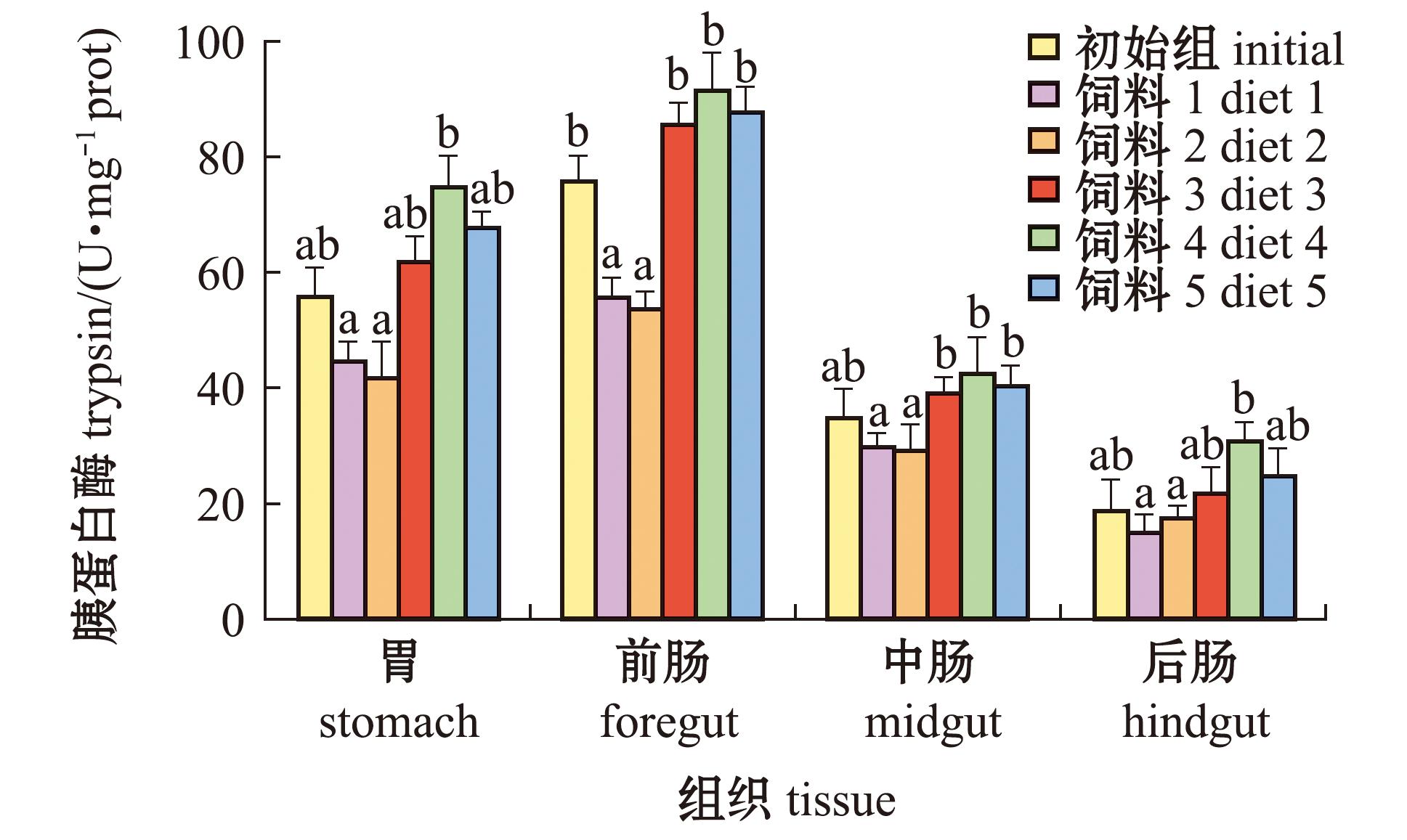
同一组织中标有不同字母者表示不同饲料组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters in same tissue are significant differences in different diet groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图1 不同饲料对星康吉鳗幼鱼胰蛋白酶活性的影响
Fig.1 Effects of various diets on the trypsin activities in juvenile Conger myriaster
2.5 不同饲料组星康吉鳗幼鱼脂肪酶活性的比较
从图2可见:5种不同饲料对星康吉鳗幼鱼消化器官脂肪酶活性的影响不同,各消化器官中脂肪酶活性依次为前肠>中肠>胃>后肠,各消化器官中饲料3组脂肪酶活性最高,其后酶活性大小依次为饲料5组、4组、初始组、1组、2组,这与各饲料组中脂肪含量(表1)、粗脂肪表观消化吸收率(表3)高低排序相一致;在前肠和中肠中,饲料1、2组幼鱼的脂肪酶活性显著低于饲料3、5组(P<0.05),饲料4组与其他各饲料组间均无显著性差异(P>0.05)。
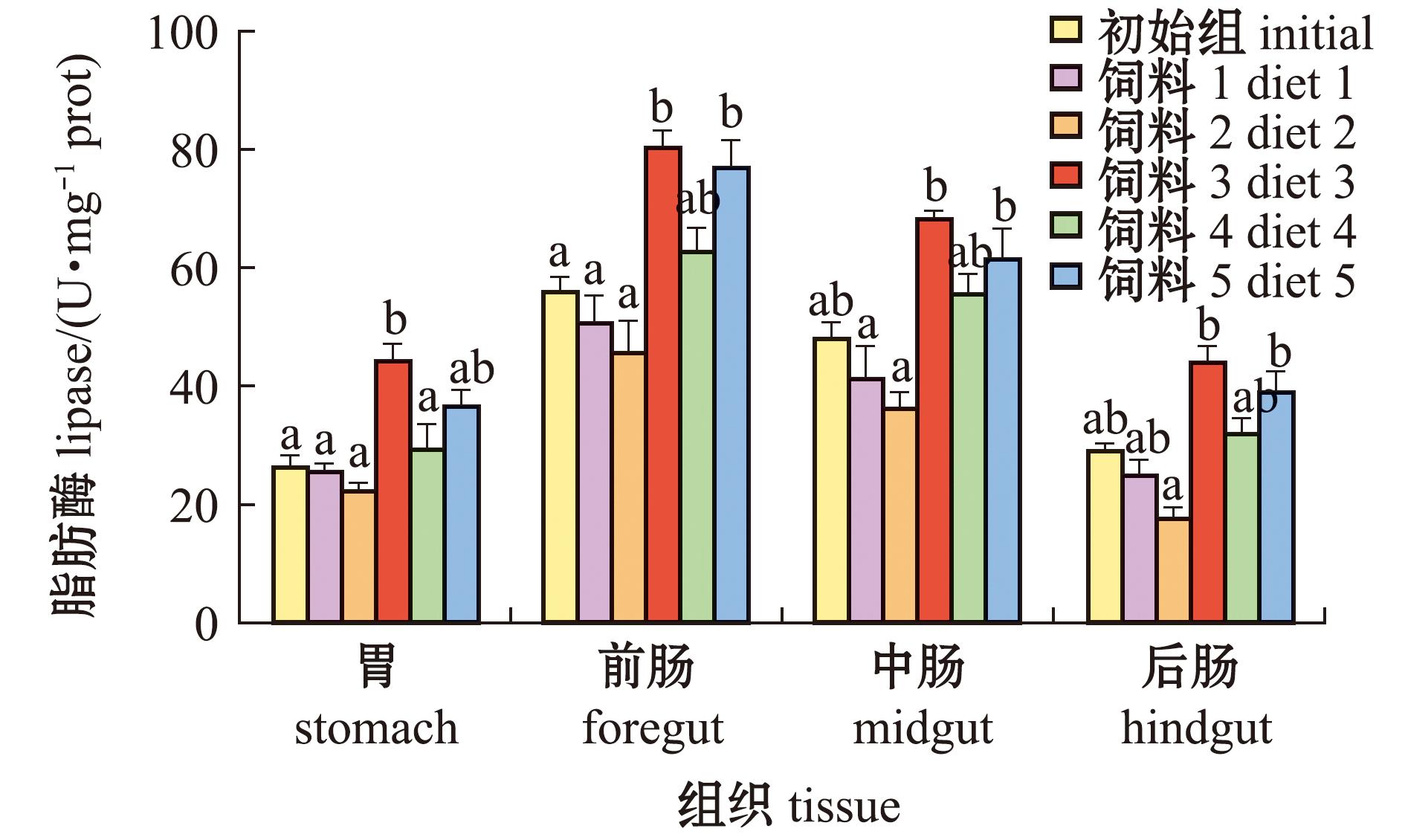
图2 不同饲料对星康吉鳗幼鱼脂肪酶活性的影响
Fig.2 Effects of various diets on the lipase activities in juvenile Conger myriaster
2.6 不同饲料组星康吉鳗幼鱼淀粉酶活性的比较
从图3可见:星康吉鳗幼鱼摄取不同饲料后,各消化器官中淀粉酶活性变化与胰蛋白酶活性有较大差异;各消化器官中淀粉酶活性依次为前肠>中肠>后肠>胃,各消化器官中饲料1、2组淀粉酶活性均显著高于饲料3、4、5组和初始组(P<0.05),各器官中淀粉酶活性依次为饲料2组>1组>3组>5组>4组,这与各饲料总糖分含量(表1)、粗糖分表观消化吸收率(表3)高低排序一致。

图3 不同饲料对星康吉鳗幼鱼淀粉酶活性的影响
Fig.3 Effects of various diets on the amylase activities in juvenile Conger myriaster
3 讨论
3.1 不同饲料对星康吉鳗幼鱼生长性能的影响
鱼类的生长与饲料的利用程度关系密切。本研究中发现,星康吉鳗幼鱼摄食粗蛋白质水平较高的饲料时,其特定生长率、增重率较高,饲料系数较低,其中,用玉筋鱼饲料投喂的星康吉鳗幼鱼生长性能最优,其饲料粗蛋白质含量为56.64%,但当粗蛋白质含量提高到某一水平后,不再对鱼体的生长与饲料转换率具有显著的促进作用。出现上述情况的原因可能是当饲料中的蛋白质含量满足鱼类对于蛋白质的最大需求时,多余的蛋白质被用作供能物质而被消耗,造成鱼类的生长性能下降,饲料系数升高[17-18]。
脂肪是饲料中重要的营养物质,同时对鱼类生长、代谢起着重要作用[19]。本研究中,随着饲料脂肪水平的增加,星康吉鳗幼鱼的增重率、特定生长率均显著上升,饲料系数显著下降,其中,用玉筋鱼饲料投喂的星康吉鳗幼鱼生长性能最优,该饲料的粗脂肪含量为26.75%。而用两种日本鳗鲡配合饲料投喂的幼鱼饲料系数相对较高,原因可能是这两种配合饲料的脂肪含量相对较低,未达到星康吉鳗幼鱼生长过程中对必需脂肪酸的需求量,表现为较低的生长速度和较高的饲料系数[20]。有研究表明,饲料中添加适量脂肪可以起到分担蛋白质供能的作用,不仅能够节省蛋白质,还能降低饲料成本和氮排放量[21],但是添加过量的脂肪不仅会降低鱼类的生长,还会使鱼体肝脏、腹腔等部位形成多余的脂肪沉积[22]。Pei等[23]研究了饲喂不同脂肪含量的饲料对异育银鲫(Carassius auratus gibelio)和长吻鮠(Leiocassis longirostris)幼鱼生长性能的影响,发现饲料中脂肪含量为15%~18%时,两者的生长性能均达到最优,而过高与过低的脂肪含量均会抑制其生长。本研究中未出现因饲料脂肪过量而导致星康吉鳗幼鱼增重率和特定生长率下降的情况,因此,星康吉鳗配合饲料中的最适脂肪水平还有待进一步探索。
本研究中,两种日本鳗鲡配合饲料组幼鱼的总糖含量明显高于玉筋鱼、方氏云鳚、玉筋鱼+方氏云鳚3种饲料组(动物性饲料组),但增重率、特定生长率却比这3组低,部分原因可能是因为肉食性鱼类比其他食性鱼类对饲料糖类的利用能力低[24]。罗源[25]研究了添加不同糖水平(0%、7%、14%、21%、28%)的饲料对珍珠龙胆石斑鱼(Epinephelus lanceolatus ♂×E.fuscoguttatus ♀)幼鱼生长与体成分的影响,发现饲料中添加7%~28%的玉米淀粉,对幼鱼生长不会产生影响,但可以减少饲料中蛋白质的比重。本研究中,采用不同饲料饲喂星康吉鳗幼鱼,糖源不同,同时也未控制不同饲料中粗蛋白质和粗脂肪水平,可能是导致本研究结果与珍珠龙胆石斑鱼研究结果不同的原因。饲料中糖分过低或过高都会对鱼体生长产生抑制作用,因此,星康吉鳗配合饲料中最适糖分也尚需进一步研究。
3.2 不同饲料对星康吉鳗幼鱼表观消化率、体成分的影响
饲料原料的表观消化率是决定蛋白质原料可适用性的重要因素,营养物质表观消化率可以反映养殖鱼类对饲料营养物质的消化及利用程度[26]。本研究表明,玉筋鱼、方氏云鳚、玉筋鱼+方氏云鳚3种饲料组的干物质、蛋白质和粗脂肪表观消化率显著高于两种日本鳗鲡配合饲料组,表明鲜杂鱼比配合饲料更有利于星康吉鳗幼鱼的消化吸收。饲料原料中蛋白质的含量是影响鱼类生长性能的重要因素,粗蛋白的表观消化率可以体现饲料原料的蛋白质品质[27]。试验过程中,饲料蛋白质含量越高,粗蛋白质消化吸收率也越高,结合各饲料投喂星康吉鳗幼鱼的增重率结果,粗蛋白质表观消化率排序反映出两方面的问题:一是方氏云鳚饲料的粗蛋白质含量较玉筋鱼饲料高出11.87%,且同为动物蛋白,幼鱼对方氏云鳚饲料中粗蛋白质的表观消化率高出玉筋鱼饲料0.32%的情况下,幼鱼的增重率却降低了30.02%,推测可能是因为高出的蛋白质被吸收后有较大部分转化为供能物质,未转化为鱼体蛋白质组成物质,这说明星康吉鳗幼鱼的饲料并非蛋白质含量越高越好,应充分考虑试验鱼营养需求的均衡性;二是幼鱼对方氏云鳚饲料中粗蛋白质的表观消化率高于玉筋鱼饲料,这可能与饲料中的氨基酸模式有关,玉筋鱼饲料分解出的氨基酸更利于星康吉鳗幼鱼蛋白质的沉积。
本研究中,不同饲料组星康吉鳗幼鱼鱼体的水分、粗蛋白质含量分别为64.66%~67.53%、16.68%~17.04%,且各组间无显著性差异,说明当前的不同饲料并未对星康吉鳗全鱼粗蛋白质及水分沉积造成影响。随着饲料中粗脂肪水平的升高,星康吉鳗幼鱼鱼体的粗脂肪含量呈上升趋势,其中,投喂玉筋鱼、玉筋鱼+方氏云鳚饲料的星康吉鳗鱼体粗脂肪含量显著高于投喂两种日本鳗鲡配合饲料。脂肪是鱼体重要的储能物质,Phan等[28]研究表明,鱼体脂肪含量会随着饲料脂肪水平的提高而升高,该结果与本研究结果相同。同时,本研究结果也与对斑石鲷(Oplegnathus punctatus)和团头鲂(Megalobrama amblycephala)的研究结果类似[29-30]。本研究表明,随着饲料中总糖含量的升高,星康吉鳗幼鱼鱼体总糖分含量相应升高,但相应试验组星康吉鳗幼鱼的增重率等生长指标却较低,同时鱼体成分中的粗蛋白质、粗脂肪相应含量也较低。Peragón等[31]对虹鳟(Oncorhynchus mykiss)的研究发现,当饲料中缺少糖分时,一些重要氨基酸被用于糖异生,而非用于鱼体蛋白质合成。
3.3 不同饲料对星康吉鳗幼鱼消化酶活性的影响
鱼类生长与其消化和吸收功能密切相关,鱼类对蛋白质的消化吸收主要通过内源性消化酶对食物进行酵解来完成[32]。本研究中,投喂5种不同饲料的星康吉鳗幼鱼胰蛋白酶活性在各消化器官中均为前肠最高。星康吉鳗幼鱼胃、肠道胰蛋白酶活性变化可能与不同饲料的营养组成成分有关,随着饲料中蛋白质含量升高,消化器官中蛋白酶活性水平升高,其中,玉筋鱼、方氏云鳚、玉筋鱼+方氏云鳚3种饲料组的星康吉鳗前肠和中肠胰蛋白酶活性均显著高于两种日本鳗鲡配合饲料组,这可能是由于动物源性饲料中高蛋白质含量和某些微量活性物质刺激了胰蛋白酶的分泌。有研究发现,投喂配合饲料的珍珠龙胆石斑鱼肠、胃中胰蛋白酶活性显著高于投喂鲜杂鱼组[33],投喂配合饲料的军曹鱼(Rachycentron canadum)肠、胃中胰蛋白酶活性高于投喂鲜杂鱼组[34],这些研究结果均与本研究结果不同。今后的研究需从胰蛋白酶基因表达变化、肠道菌群结构与特征等角度进一步阐释其差异性机制。
鱼类脂肪酶主要由肝胰脏分泌,经胆管、胰管输送入肠道,胃、肠黏膜也能分泌脂肪酶[35]。本研究表明,投喂5种不同饲料的星康吉鳗幼鱼脂肪酶活性在各消化器官中均为前肠最高,其次为中肠、后肠和胃。鱼类对脂肪的消化和吸收与哺乳动物相似,前肠作为脂肪消化主要场所,其脂肪酶活性也最高[35]。鱼类脂肪酶活性与饲料中脂肪含量的关系较为复杂,大多数鱼类脂肪酶活性与饲料脂肪含量呈正相关关系。本研究中,星康吉鳗幼鱼各消化器官中检测到的脂肪酶活性随饲料脂肪含量的增加而升高,其中在前肠和中肠,玉筋鱼、玉筋鱼+方氏云鳚饲料组的脂肪酶活性显著高于两种日本鳗鲡配合饲料组。类似的研究结果在黑尾近红鲌(Ancherythroculter nigrocauda)、欧洲舌齿鲈 (Dicentrarchus labrax) 等鱼类上也有报道[36-37]。
鱼类的淀粉酶主要由肝胰脏生成,其对饲料中所含淀粉的消化利用能力会随淀粉酶分泌的多寡而出现差异,且在各消化器官或同一消化器官的各个部位中,其活性也会有所不同[38]。美国红鱼(Sciaenops ocellatus)各个消化器官淀粉酶活性分布结果显示,前肠淀粉酶活性大于后肠、胃[39]。本研究中,星康吉鳗幼鱼淀粉酶活性的分布结果与美国红鱼一致,且两种日本鳗鲡配合饲料组星康吉鳗各消化器官中淀粉酶活性显著高于其他3种动物性饲料组。欧红霞等[40]研究表明,摄食人工配合饲料的大口黑鲈(Micropterus salmoides)肠、肝胰脏和幽门盲囊中淀粉酶活性显著高于摄食冰鲜杂鱼。本研究结果与对大口黑鲈淀粉酶活性的研究结果相似,可能是因为星康吉鳗幼鱼更适应对配合饲料中碳水化合物的消化。
4 结论
1)饲喂玉筋鱼组、方氏云鳚组、玉筋鱼与方氏云鳚混合料组的星康吉鳗幼鱼的生长性能、饲料系数、饲料表观消化率(干物质、粗蛋白质、粗脂肪),以及胰蛋白酶、脂肪酶活性显著优于饲喂日本鳗鲡配合饲料处理组和日本鳗鲡配合饲料组,其中,饲喂玉筋鱼组的效果最佳。这为后续人工养殖星康吉鳗幼鱼的饲料投喂提供了参考依据。
2)玉筋鱼组饲料中粗蛋白质含量为56.64%,粗脂肪含量为26.75%,总糖含量为1.55%。星康吉鳗未来配合饲料中最适的蛋白质、脂肪和糖分水平有待进一步探索。通过饲喂不同饲料对试验鱼生长、饲料利用、表观消化率、体成分和消化酶活性方面指标的综合分析,建议参考玉筋鱼的营养成分组成,开发星康吉鳗的商品饲料配方。
[1] 张春光.中国动物志:硬骨鱼纲.鳗鲡目、背脊鱼目[M].北京:科学出版社,2010:199-203.ZHANG C G.Fauna Sinica: Osteichthyes,Anguilliformes,Notacanthiformes[M].Beijing:Science Press,2010.(in Chinese)
[2] 张婷婷,赵峰,张涛,等.中国鳗鱼产业发展及其资源保护建议[J].渔业信息与战略,2019,34(4):235-243.ZHANG T T,ZHAO F,ZHANG T,et al.Development of eel aquaculture industry and its resource conservation in China[J].Fishery Information &Strategy,2019,34(4):235-243.(in Chinese)
[3] 邓彦,唐文乔,张媛媛,等.长江口鳗苗网兼捕鱼类物种多样性及其群聚结构[J].水生生物学报,2023,47(1):168-176.DENG Y,TANG W Q,ZHANG Y Y,et al.Species diversity and assemblage structure of fishes bycatch in elver nets in Yangtze River Estuary[J].Acta Hydrobiologica Sinica,2023,47(1):168-176.(in Chinese)
[4] 刘西方,刘贺,薛莹,等.海州湾星康吉鳗的摄食生态特征[J].中国水产科学,2015,22(3):517-527.LIU X F,LIU H,XUE Y,et al.Feeding ecology of Conger myriaster in Haizhou Bay[J].Journal of Fishery Sciences of China,2015,22(3):517-527.(in Chinese)
[5] 刘鸿雁,孙彤彤,曾晓起,等.崂山湾人工鱼礁区星康吉鳗摄食生态及食物网结构[J].应用生态学报,2018,29(4):1339-1351.LIU H Y,SUN T T,ZENG X Q,et al.Feeding ecology of Conger myriaster and structure of the food webs in artificial reef zone,Laoshan Bay,China[J].Chinese Journal of Applied Ecology,2018,29(4):1339-1351.(in Chinese)
[6] 张永明,张斯荷,庄乾华,等.星康吉鳗工厂化养殖技术[J].养殖与饲料,2020,19(10):38-39.ZHANG Y M,ZHANG S H,ZHUANG Q H,et al.Conger myriaster factory aquaculture technology[J].Animals Breeding and Feed,2020,19(10):38-39.(in Chinese)
[7] 赵新宇,史宝,王成刚,等.投喂频率对工厂化循化水养殖星康吉鳗生长、生理指标及其水质的影响[J].渔业科学进展,2023,44:1-14.ZHAO X,SHI B,WANG C G,et al.Effects of feeding frequency on the growth,physiological indices and water quality of Conger myriaster reared in industrial recirculating aquaculture systems[J].Progress in Fishery Sciences,2023,44:1-14.(in Chinese)
[8] ZHAO X Y,SHI B,WANG C B,et al.Effects of dietary supplementation of compound probiotics on growth,non-specific immunity,intestinal digestive enzyme,and microbiota of white spotted Conger (Conger myriaster) in recirculating aquaculture system[J].Aquaculture International,2023:1-26.
[9] 杨浩,史宝,牛化欣,等.星康吉鳗生物学与生态学的研发现状与展望[J].海洋科学,2020,44(6):152-158.YANG H,SHI B,NIU H X,et al.Advances and future prospects in Conger myriaster research[J].Marine Sciences,2020,44(6):152-158.(in Chinese)
[10] 韩庆炜,梁萌青,姚宏波,等.鲈鱼对7种饲料原料的表观消化率及其对肝脏、肠道组织结构的影响[J].渔业科学进展,2011,32(1):32-39.HAN Q W,LIANG M Q,YAO H B,et al.Effects of seven feed ingredients on growth performance,and liver and intestine histology of Lateolabrax japonicas[J].Progress in Fishery Sciences,2011,32(1):32-39.(in Chinese)
[11] NGUYEN H Y N,TRINH T L,BARUAH K,et al.Growth and feed utilisation of Nile tilapia (Oreochromis niloticus) fed different protein levels in a clear-water or biofloc-RAS system[J].Aquaculture,2021,536:736404.
[12] 李婷婷,褚志鹏,李创举,等.饲料中不同脂肪源对杂交鲟幼鱼生长性能、体成分、养分表观消化率、肝脏脂肪代谢酶活性和血清生化指标的影响[J].动物营养学报,2021,33(6):3447-3460.LI T T,CHU Z P,LI C J,et al.Effects of different lipid sources in diet on growth performance,body composition,nutrient apparent digestibilities,liver lipid metabolism enzymes activities and serum biochemical parameters of juvenile hybrid sturgeon[J].Chinese Journal of Animal Nutrition,2021,33(6):3447-3460.(in Chinese)
[13] NAFEES M S M,KAMARUDIN M S,KARIM M,et al.Effects of dietary starch sources on growth,nutrient utilization and liver histology of juvenile tinfoil barb (Barbonymus schwanenfeldii,Bleeker 1853)[J].Aquaculture Reports,2022,23:101069.
[14] 张波,唐启升.东、黄海六种鳗的食性[J].水产学报,2003,27(4):307-314.ZHANG B,TANG Q S.Feeding habits of six species of eels in East China Sea and Yellow Sea[J].Journal of Fisheries of China,2003,27(4):307-314.(in Chinese)
[15] HORWITZ W.Official methods of analysis of AOAC international[M].17th edition,Gaithersburg (Maryland):AOAC International,2005:1-44.
[16] SUGIURA S H,DONG F M,RATHBONE C K,et al.Apparent protein digestibility and mineral availabilities in various feed ingredients for salmonid feeds[J].Aquaculture,1998,159(3/4):177-202.
[17] JIANG S T,WU X Y,LUO Y,et al.Optimal dietary protein level and protein to energy ratio for hybrid grouper (Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus ♂) juveniles[J].Aquaculture,2016,465:28-36.
[18] SAGADA G,CHEN J M,SHEN B Q,et al.Optimizing protein and lipid levels in practical diet for juvenile northern snakehead fish (Channa argus)[J].Animal Nutrition,2017,3(2):156-163.
[19] 艾庆辉,严晶,麦康森.鱼类脂肪与脂肪酸的转运及调控研究进展[J].水生生物学报,2016,40(4):859-868.AI Q H,YAN J,MAI K S.Research progresses of lipids and fatty acids transport in fish[J].Acta Hydrobiologica Sinica,2016,40(4):859-868.(in Chinese)
[20] 刘阳洋,于海波,武文一,等.饲料脂肪水平对匙吻鲟生长、体组成、消化酶活性、血清生化及抗氧化性能的影响[J].水产学报,2018,42(12):1940-1956.LIU Y Y,YU H B,WU W Y,et al.Effects of dietary lipid levels on growth,body composition,digestive enzyme activities,serum biochemical indexes and antioxidant performance of Polyodon spathula[J].Journal of Fisheries of China,2018,42(12):1940-1956.(in Chinese)
[21] 邢薇,郁欢欢,于凤祥,等.饲料脂肪水平对杂交鲟幼鱼生长、饲料消化率、抗氧化水平和肌肉脂肪酸组成的影响[J].水生生物学报,2021,45(2):250-258.XING W,YU H H,YU F X,et al.Effects of dietary lipid levels on growth performance,feed digestibility,antioxidant status and fillet fatty acid compositions of juvenile hybrid sturgeon[J].Acta Hydrobiologica Sinica,2021,45(2):250-258.(in Chinese)
[22] CHANG J,NIU H X,JIA Y D,et al.Effects of dietary lipid levels on growth,feed utilization,digestive tract enzyme activity and lipid deposition of juvenile Manchurian trout,Brachymystax lenok (Pallas)[J].Aquaculture Nutrition,2018,24(2):694-701.
[23] PEI Z,XIE S,LEI W,et al.Comparative study on the effect of dietary lipid level on growth and feed utilization for gibel carp (Carassius auratus gibelio) and Chinese longsnout catfish (Leiocassis longirostris Günther)[J].Aquaculture Nutrition,2004,10(4):209-216.
[24] 詹秋羽,郑普强,王骥腾,等.虾蟹类对糖类的利用和代谢[J].动物营养学报,2020,32(3):1062-1075.ZHAN Q Y,ZHENG P Q,WANG J T,et al.Utilization and metabolism of carbohydrate in shrimps and crabs[J].Chinese Journal of Animal Nutrition,2020,32(3):1062-1075.(in Chinese)
[25] 罗源.不同饲料糖水平及糖脂比对珍珠龙胆石斑鱼幼鱼生长、饲料利用及体组成的影响[D].海口:海南大学,2016.LUO Y.Effects of dietary carbohydrate levels and carbohydrate-to-lipid ratios on growth,feed utilization and body composition of hybrid grouper(Epinephelus lanceolatus ♂×Epinephelus fuscoguttatus ♀) juveniles[D].Haikou:Hainan University,2016.(in Chinese)
[26] 贾冰玉,邹峰余,徐杰杰,等.发酵菜籽粕对黄颡鱼表观消化率、肝脏及肠道健康的影响[J].水生生物学报,2024,48(1):34-43.JIA B Y,ZOU F Y,XU J J,et al.Fermented rapeseed meal on apparent digestibility, liver and intestinal health of yellow catfish (Tachysurus fulvidraco)[J].Acta Hydrobiologica Sinica,2024,48(1):34 -43. (in Chinese)
[27] 邹方起,马世峰,陈颖,等.鱼类对乙醇梭菌蛋白中营养物质的表观消化率[J].饲料工业,2024,45(2):18-24.ZOU F Q,MA S F,CHEN Y,et al.Nutrient apparent digestibility of Clostridium autoethanogenum protein for fish[J].Feed Industry,2024,45(2):18-24.
[28] PHAN L T,KALS J,MASAGOUNDER K,et al.Effect of dietary carbohydrate and fat supplementation on the yield and chemical composition of fillet and the location of fat deposition in striped catfish (Pangasius hypophthalmus),African catfish (Clarias gariepinus) and snakehead (Channa striata)[J].Aquaculture Reports,2021,21:100806.
[29] WANG J T,LIU T,ZHENG P Q,et al.Effect of dietary lipid levels on growth performance,body composition,and feed utilization of juvenile spotted knifejaw Oplegnathus punctatus[J].Aquaculture Reports,2021,21:100797.
[30] LI X F,LIU W B,JIANG Y Y,et al.Effects of dietary protein and lipid levels in practical diets on growth performance and body composition of blunt snout bream (Megalobrama amblycephala) fingerlings[J].Aquaculture,2010,303(1/2/3/4):65-70.
[31] PERAG N J,BARROSO J B,GARC
N J,BARROSO J B,GARC A-SALGUERO L,et al.Carbohydrates affect protein-turnover rates,growth,and nucleic acid content in the white muscle of rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1999,179(1/2/3/4):425-437.
A-SALGUERO L,et al.Carbohydrates affect protein-turnover rates,growth,and nucleic acid content in the white muscle of rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1999,179(1/2/3/4):425-437.
[32] 张美红,胡重江,李英文.国内外关于鱼类胰蛋白酶的研究进展[J].饲料工业,2006,27(2):20-22.ZHANG M H,HU C J,LI Y W.Research progress on trypsin from fish in countries[J].Feed Industry,2006,27(2):20-22.(in Chinese)
[33] YE G L,DONG X H,YANG Q H,et al.A formulated diet improved digestive capacity,immune function and intestinal microbiota structure of juvenile hybrid grouper (Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus ♂) when compared with chilled trash fish[J].Aquaculture,2020,523:735230.
[34] 杨奇慧,周歧存,郑海娟,等.不同饲料对军曹鱼组织消化酶活力的影响[J].水产科学,2008,27(12):633-636.YANG Q H,ZHOU Q C,ZHENG H J,et al.Effects of different diets on digestive enzymatic activities in several tissues of juvenile cobia(Rachycentron canadum)[J].Fisheries Science,2008,27(12):633-636.(in Chinese)
[35] 冯健,覃志彪.4种不同脂肪源对太平洋鲑生长和体组成的影响[J].水生生物学报,2006,30(3):256-261.FENG J,QIN Z B.Effects of four dietary lipids on the performance of growth and body composition in Pacific salmon,Oncorhynchuy[J].Acta Hydrobiologica Sinica,2006,30(3):256-261.(in Chinese)
[36] 李伟东.饲料脂肪水平对黑尾近红鲌生长性能、鱼体成分及消化酶活性的影响[D].武汉:武汉轻工大学,2014.LI W D.Effect of dietary lipid level on growth performance,body composition and digestive enzyme activities of Ancherythroculter nigrocauda[D].Wuhan:Wuhan Polytechnic University,2014.(in Chinese)
[37] GARC A-MEIL
A-MEIL N I,ORD
N I,ORD
 EZ-GRANDE B,MACHAHUA C,et al.Effects of dietary protein-to-lipid ratio on digestive and absorptive processes in sea bass fingerlings[J].Aquaculture,2016,463:163-173.
EZ-GRANDE B,MACHAHUA C,et al.Effects of dietary protein-to-lipid ratio on digestive and absorptive processes in sea bass fingerlings[J].Aquaculture,2016,463:163-173.
[38] 李明月,高云红,万金铭,等.黄条鰤幼鱼胃排空特征、消化酶活性及摄食调控基因表达[J].水产学报,2022,46(6):906-916.LI M Y,GAO Y H,WAN J M,et al.Gastric evacuation characteristics,digestive enzyme activity and appetite-related genes expression in juvenile yellowtail kingfish(Seriola aureovittata)[J].Journal of Fisheries of China,2022,46(6):906-916.(in Chinese)
[39] 李军.美国红鱼消化酶活性及饲料原料体外消化率相关性研究[D].杭州:浙江大学,2006.LI J.Study on digestive enzyme activities of Sciaenops ocellatus and digestibility coefficients on feedstuff in vitro[D].Hangzhou:Zhejiang University,2006.(in Chinese)
[40] 欧红霞,王广军,谢骏,等.摄食不同饲料对大口黑鲈消化道指数和淀粉酶活性的影响[J].上海海洋大学学报,2018,27(5):674-682.OU H X,WANG G J,XIE J,et al.Effects of different feed on digestive tract index and amylase activity of Micropterus salmoides[J].Journal of Shanghai Ocean University,2018,27(5):674-682.(in Chinese)