刺参(Apostichopus japonicus)是中国北方沿海主要养殖海珍品种类之一,具有独特的风味及营养价值,是著名的“海八珍”之一[1]。随着刺参养殖业的迅速发展,其天然的优质饵料马尾藻、鼠尾藻经长期使用已出现供应不足的现象,制约了刺参养殖行业的可持续发展[2]。因此,开发新型、高效、低成本的大型海藻作为刺参饲料势在必行。大型绿藻因其生物量巨大,尤其受到关注,如浒苔作为刺参饲料已被广泛研究。对浒苔的利用包括直接粉碎、与酿酒酵母菌混合发酵及纤维素酶酶解后用于刺参饲料,用这些饲料饲喂的刺参特定生长率均较对照组显著增加,其中,纤维素酶酶解后的浒苔饲料和酿酒酵母混合发酵后的浒苔饲料还能够提高刺参的消化率、纤维素酶活性和非特异性免疫能力,证实浒苔在一定程度上可代替马尾藻和鼠尾藻,作为刺参饲料使用[3-5]。但浒苔脂肪含量接近马尾藻的两倍,而刺参消化系统中脂肪酶的活性最低[3,6],因此,浒苔并不是马尾藻的理想代替物。
石莼(Ulva lactuca )是一种大型海藻,属于绿藻门(Chlorophyta)石莼科(Ulvaceae)石莼属(Ulva),在中国沿海均有分布。近几年来,以石莼为主要危害属的绿潮频繁暴发,对沿海海域造成了极大的经济、社会和生态影响[7-8]。目前,打捞是处理石莼属绿潮最常用的方式,打捞后的石莼多是丢弃和腐烂,造成了浪费和二次污染。在此情况下,有学者对石莼的利用进行了研究,如将石莼代替30%马尾藻用作刺参饲料,但刺参增重率仅为马尾藻饲料组增重率的55.21%[6],这可能是由于石莼相比马尾藻具有高蛋白质等特点,而刺参摄食率及蛋白质消化效率会随着饲料蛋白质含量的升高而降低[9]。
刺参对不同藻粉饲料的干物质表观消化率仅为9.63%~15.84%,而石莼又具有高蛋白质等特点[9]。针对石莼营养物质不易被刺参消化吸收及刺参对石莼饲料利用率低等问题,可考虑利用合适菌种对石莼进行发酵处理。细菌所产生的蛋白酶、纤维素酶等活性物质可将石莼中难以被利用的大分子蛋白质、纤维素及抗营养因子加以分解,从而改善其成分结构,将不易被消化吸收的成分转化为游离氨基酸、多肽及还原糖,更容易被刺参采食、消化和吸收。孙兴[10]研究发现,以脱胶海带粉为主的混合藻粉饲料经酵母菌、芽孢杆菌和乳酸菌发酵后,其可溶性还原糖含量提升了3.84倍,粗纤维由24.62%下降到19.62%。Zhang等[11]发现,投喂发酵商品饲料的南美白对虾增重率较直接投喂商品饲料提高了42.07%。此外,以发酵海带渣代替商品饲料投喂刺参的研究也有较多报道,结果表明,发酵后海带渣饲料的粗纤维含量减少了6%~7%,小肽含量提高了0.3%~0.4%,游离氨基酸含量提高了0.06%~0.07%,投喂效果也与鼠尾藻无显著性差异[12-13]。总之,发酵可以将海藻中大分子物质和抗营养因子通过自身的代谢活动转化为更有效的营养物质,并且能产生消化酶等对动物有益的活性物质,这些物质在刺参消化吸收中起重要作用。
本研究中,以分离自自然海域腐烂石莼的特基拉芽孢杆菌X8(Bacillus tequilensis)作为发酵剂,以发酵产物中还原糖、游离氨基酸和多肽为评价指标,采用单因素试验与响应面法对石莼发酵工艺条件进行优化,并进一步探究了石莼发酵饲料对刺参生长性能和消化性能的影响,以期为石莼发酵饲料的研发及刺参养殖提供理论依据和数据支持。
1 材料与方法
1.1 材料
试验用石莼采集于山东省烟台市沿海地区(北纬37°17′,东经119°55′);发酵菌种为特基拉芽孢杆菌X8,由烟台大学藻类生物技术实验室从腐烂石莼中筛选分离并保藏。
1.2 方法
1.2.1 发酵单因素试验 分别测定不同发酵温度、含水率和接种菌量条件下石莼发酵产物中游离氨基酸、多肽及还原糖含量的变化。
温度对发酵饲料品质的影响试验:将石莼粉过孔径为380 μm的筛后烘干,取80 g石莼粉加入500 mL锥形瓶中,加入海水使其含水率达40%,接种特基拉芽孢杆菌X8的量为2×106 CFU/g(干质量),分别置于温度为20、25、30、35、40 ℃的振荡培养箱(180 r/min)中发酵7 d,每组设置3个平行。
含水率对发酵饲料品质的影响试验:将石莼粉过孔径为380 μm的筛后烘干,取80 g石莼粉加入500 mL发酵罐中,接种菌量为2×106 CFU/g(干质量),加入海水使其含水率分别为30%、40%、50%、60%、70%,置于温度30 ℃、180 r/min的振荡培养箱中发酵7 d,每组设置3个平行。
接种菌量对发酵饲料品质的影响试验:将石莼粉过孔径为380 μm的筛后烘干,取80 g石莼粉加入500 mL发酵罐中,加入海水使其含水率达40%,接种菌量分别为1×106、2×106、3×106、4×106、5×106 CFU/g(干质量),置于温度为30 ℃、180 r/min的振荡培养箱中发酵7 d,每组设置3个平行。
发酵完成后,采用5点取样法,将样品搅拌混匀于80 ℃下烘干后,用体积分数为10%的三氯乙酸沉淀蛋白后过滤。采用茚三酮比色法测定游离氨基酸含量[14],采用双缩脲法测定多肽含量[15],采用斐林法测定还原糖含量[16]。
1.2.2 满意度函数-响应面法优化发酵饲料工艺 采用Design-Expert 8.0软件进行响应面Box-Behnken试验设计,选取对石莼发酵有显著影响的温度、含水率和接种菌量3个影响因素为自变量,以刺参易消化吸收的游离氨基酸、多肽和还原糖含量为响应值,以1、0、-1作为各因素的高、中、低水平值,设计3因素3水平17组试验,并建立数学模型,考察各因素对响应值的影响程度。由于发酵产物中还原糖、游离氨基酸和多肽含量变化趋势并不完全一致,故采用满意度函数法将多个响应值转化为单相应值优化,以期获得整体最优。响应面设计因素与水平见表1。
表1 响应面设计因素与水平
Tab.1 Factors and levels of Box-Behnken design

水平levelA温度/℃temperatureB含水率/%moistureC接种菌量/(CFU·g-1)inoculation amount-125403×106030504×106135605×106
总体满意度根据Derringer等[17]提出的公式计算:
(1)
式中:D为总体满意值;wn为第n个响应值的权;dn为第n个响应的满意度值,dn定义为
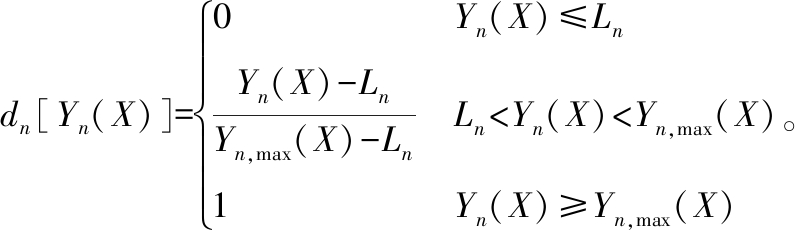
(2)
式中:Yn(X)为第n个响应值;Ln为第n个响应值的规定下限;Yn,max(X)为第n个响应值所不能超过的最大上限。
在整个试验中,综合考虑试验指标还原糖、游离氨基酸和多肽对饲料品质的影响,采用主观赋权法,设定还原糖、小分子物质(游离氨基酸和多肽)权重皆为1,发酵饲料游离氨基酸(或多肽)含量均超过5%,还原糖含量均超过0.8%,因此,在计算满意度函数时,以5%、0.8%分别为游离氨基酸(或多肽)及还原糖的下限,二者均不可能超过最大上限15%与2.2%。为此,定义满意度函数d1、d2为
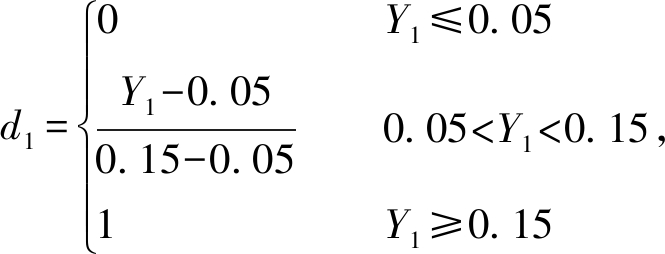
(3)
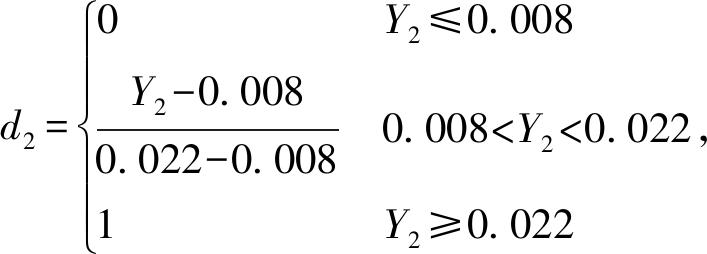
(4)
(5)
式中: Y1为游离氨基酸(或多肽)的响应值;Y2为还原糖的响应值;d1为游离氨基酸(或多肽)的满意度;d2为还原糖的满意度;D为总体满意度。
1.2.3 刺参养殖试验 石莼发酵完毕后于35 ℃下烘干,-4 ℃冰箱中保存备用。采用室内模拟试验,试验设3个处理组,每组设3个平行,分别为石莼发酵饲料组、石莼未发酵干粉饲料组和商品饲料组。各组饲料主要组成及营养成分见表2、表3。每个处理组放30只健康的刺参幼体(湿质量为6.48 g±0.84 g),分别在9个塑料容器(长×宽×高为40 cm×30 cm×25 cm)中养殖。采用连续曝气人工海水养殖30 d,每天投喂一次,投喂饲料质量约为刺参湿质量的4%,每7 d更换一次养殖海水,每次更换1/3。养殖期间,水温为15~17 ℃,盐度为25~35,pH为7.5~8.0,溶解氧为5.5~6.0 mg/L。
表2 试验饲料配方(干质量)
Tab.2 Experimental diet formula (dry weight) w/%
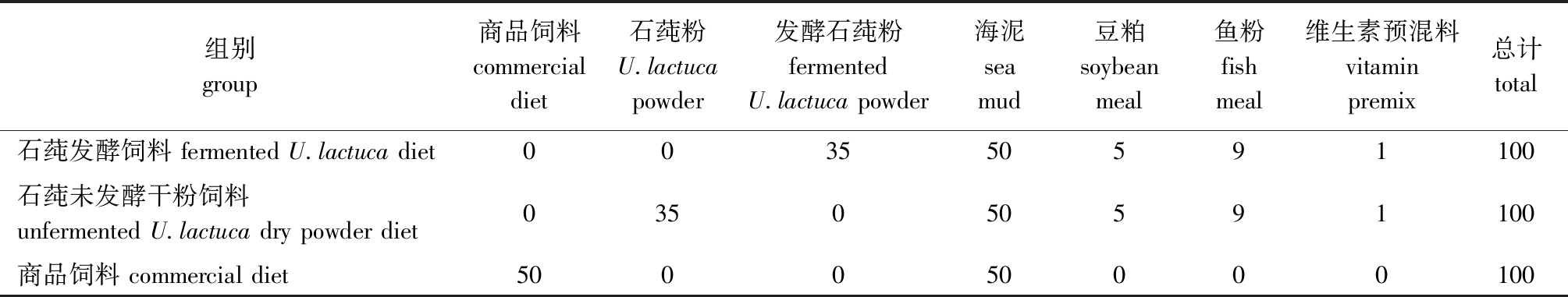
注:商品饲料由马尾藻粉、鱼粉、豆粕和维生素预混料组成。
Note:the commercial diet is composed of Sargasso powder,fish meal,soybean meal,and vitamin premix.
组别group商品饲料commercial diet石莼粉U.lactucapowder发酵石莼粉fermentedU.lactuca powder海泥sea mud豆粕soybean meal鱼粉fish meal维生素预混料vitamin premix总计total石莼发酵饲料 fermented U.lactuca diet003550591100石莼未发酵干粉饲料unfermented U.lactuca dry powder diet 035050591100商品饲料 commercial diet500050000100
表3 试验饲料营养成分(干质量)
Tab.3 Proximate nutritional composition (dry weight) in the experimental diets w/%
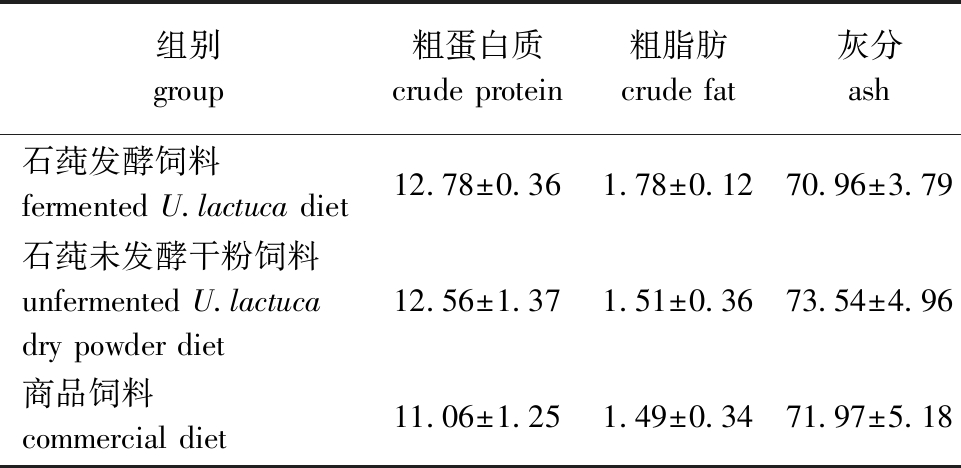
组别group粗蛋白质crude protein粗脂肪crude fat灰分ash 石莼发酵饲料fermented U.lactuca diet12.78±0.361.78±0.1270.96±3.79石莼未发酵干粉饲料unfermented U.lactucadry powder diet 12.56±1.371.51±0.3673.54±4.96商品饲料commercial diet 11.06±1.251.49±0.3471.97±5.18
1.2.4 刺参生长性能测定 在测定刺参湿质量前,将刺参饥饿24 h后于解剖托盘上称重。增重率(weight gain rate,WGR)、特定生长率(specific growth rate,SGR)、饲料转化率(feed conversion rate,FCE)和摄食率(intake rate,IR)计算公式分别为
RWGR=(Wt-W0)/W0×100%,
(6)
RSGR=(lnWt-lnW0)/t×100%,
(7)
EFCE=(Wt-W0)/C×100%,
(8)
RIR=C/[(Wt+W0)/2×t]×100%。
(9)
式中:RWGR为增重率(%);RSGR为特定生长率(%/d);EFCE为饲料转化率(%);RIR为摄食率(%/d);Wt为试验终末刺参的平均湿质量(g);W0为试验初始刺参的平均湿质量(g);t为养殖时间(d);C为摄食饲料的干质量(g)。
1.2.5 刺参消化酶活性测定 养殖30 d后停止喂食,饥饿24 h使刺参肠道内容物排空,从每个试验组随机选取3只刺参,取其肠道于液氮中速冻后置于-80 ℃超低温冰箱中保存,用于消化酶活性的测定。纤维素酶活力测定采用3,5-二硝基水杨酸法,酶活单位定义为:在40 ℃条件下,每分钟水解CMC-Na释放出相当于1.0 μg葡萄糖含量时所需的酶量为1个酶活力单位(U)[18]。蛋白酶活力测定采用福林-酚试剂法,酶活单位定义为:在37 ℃条件下,每分钟水解干酪素释放1.0 μg酪氨酸含量时所需的酶量为1个酶活力单位(U)[19]。脂肪酶活力测定采用橄榄油乳化液法,酶活单位定义为:在37 ℃条件下,每分钟水解脂肪释放1.0 μmol脂肪酸含量时所需的酶量为1个酶活力单位(U)[20]。淀粉酶活力测定采用碘-淀粉显色法,酶活单位定义为:在37 ℃条件下,5 min内水解1 mg淀粉所需的酶量为1个酶活单位(U)[21]。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,利用Design-Expert 8.0软件进行响应面法优化设计与分析。使用SPSS 27软件进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05。采用Origin 2022软件绘图。
2 结果与分析
2.1 发酵单因素试验
2.1.1 温度对发酵产物中游离氨基酸、多肽和还原糖含量的影响 从图1、图2可见:当发酵温度为20~40 ℃时,发酵饲料中游离氨基酸、多肽和还原糖含量随温度升高呈先上升后下降的趋势;当温度为30 ℃时,游离氨基酸、多肽和还原糖含量达到最大值,除与35 ℃组无显著性差异(P>0.05)外,与其他温度组均存在显著性差异(P<0.05);当温度高于30 ℃时,发酵饲料中游离氨基酸、多肽和还原糖含量则随温度上升呈下降的趋势。

标有不同字母者表示发酵后氨基酸或多肽总和在组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significant differences in the total amount of amino acids or peptides after fermentation in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
图1 温度对石莼发酵饲料游离氨基酸及多肽含量的影响
Fig.1 Effect of temperature on the content of free amino acids and peptides in fermented Ulva lactuca diet
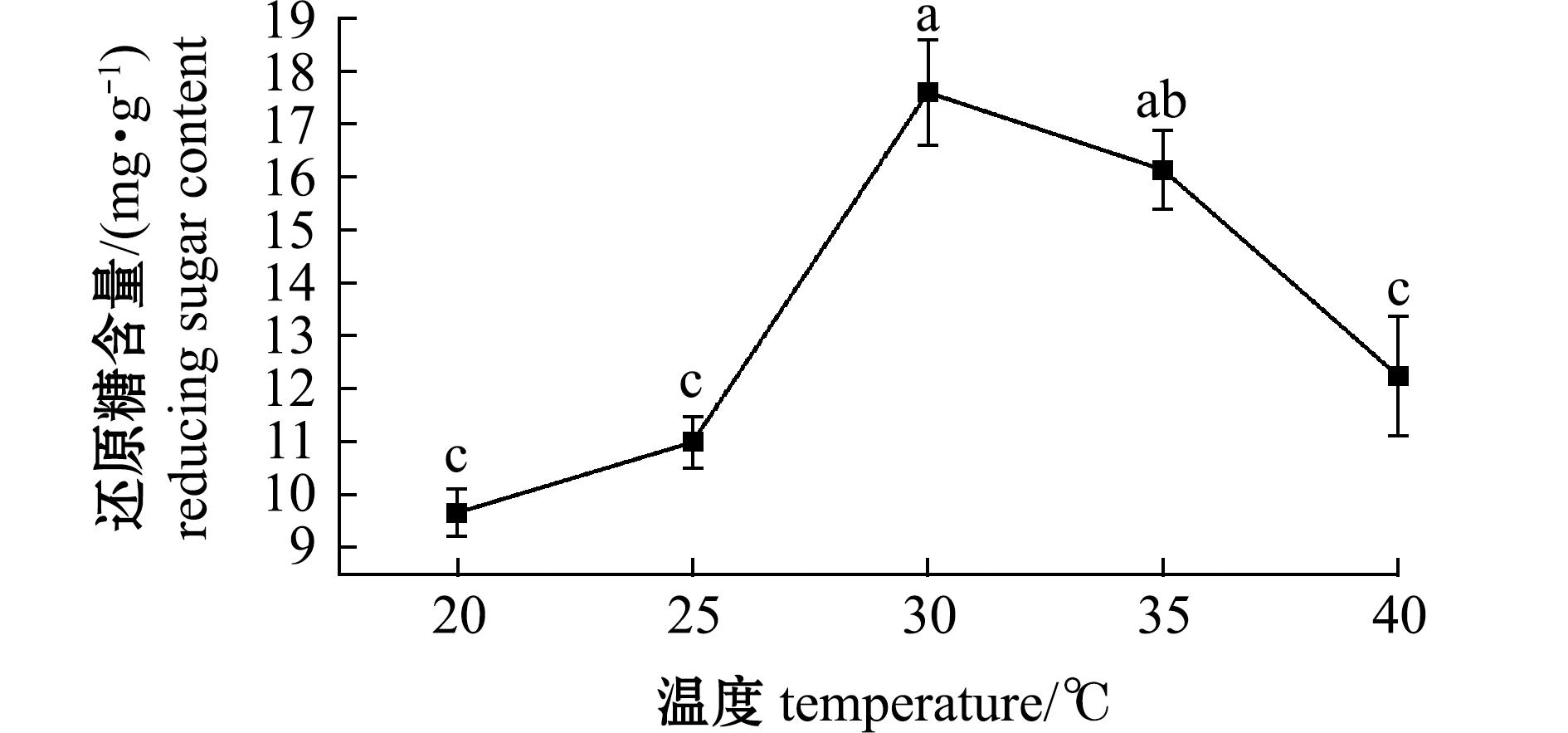
图2 温度对石莼发酵饲料还原糖含量的影响
Fig.2 Effect of temperature on reducing sugar content of fermented Ulva lactuca diet
2.1.2 含水率对发酵产物中游离氨基酸、多肽和还原糖含量的影响 从图3、图4可见:随物料含水率的增加,发酵饲料中游离氨基酸、多肽和还原糖含量呈先增加后减少的趋势;物料含水率达到50%~60%时,游离氨基酸、多肽和还原糖较其他组显著增加(P<0.05),且在物料含水率为50%时,饲料中游离氨基酸、多肽和还原糖含量达到最大值;当含水率高于60%时,发酵饲料中游离氨基酸、多肽和还原糖含量减少。

图3 含水率对石莼发酵饲料游离氨基酸及多肽含量的影响
Fig.3 Effect of moisture on the contents of free amino acids and peptides in fermented Ulva lactuca diet
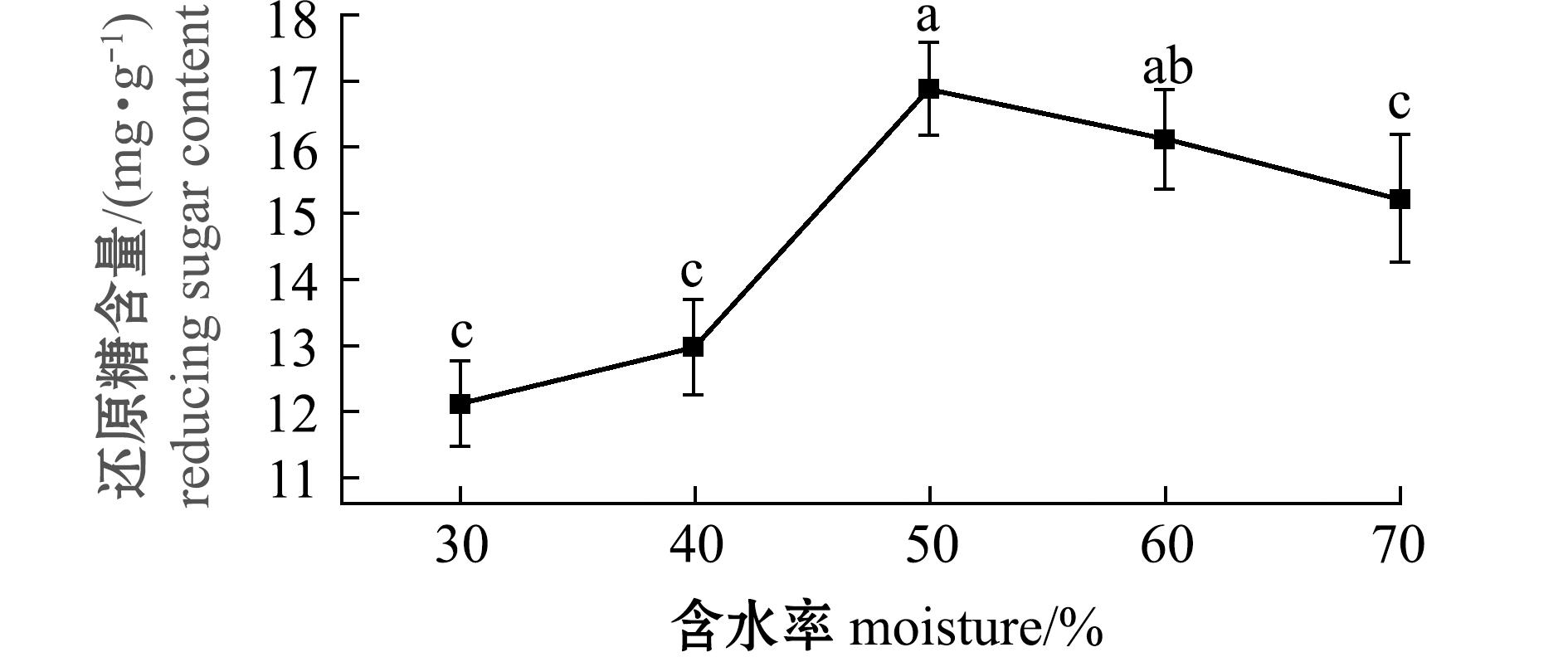
图4 含水率对石莼发酵饲料还原糖含量的影响
Fig.4 Effect of moisture on reducing sugar content of fermented Ulva lactuca diet
2.1.3 接种菌量对发酵产物中游离氨基酸、多肽和还原糖含量的影响 从图5、图6可见:接种菌量会影响发酵效果,随接种菌量的增加,发酵饲料中的游离氨基酸、多肽和还原糖含量呈先增加后减少的趋势;当接种菌量为4×106 CFU/g时,发酵饲料中游离氨基酸、多肽和还原糖含量最大。因此,本试验条件下发酵的最佳接种菌量是4×106 CFU/g。
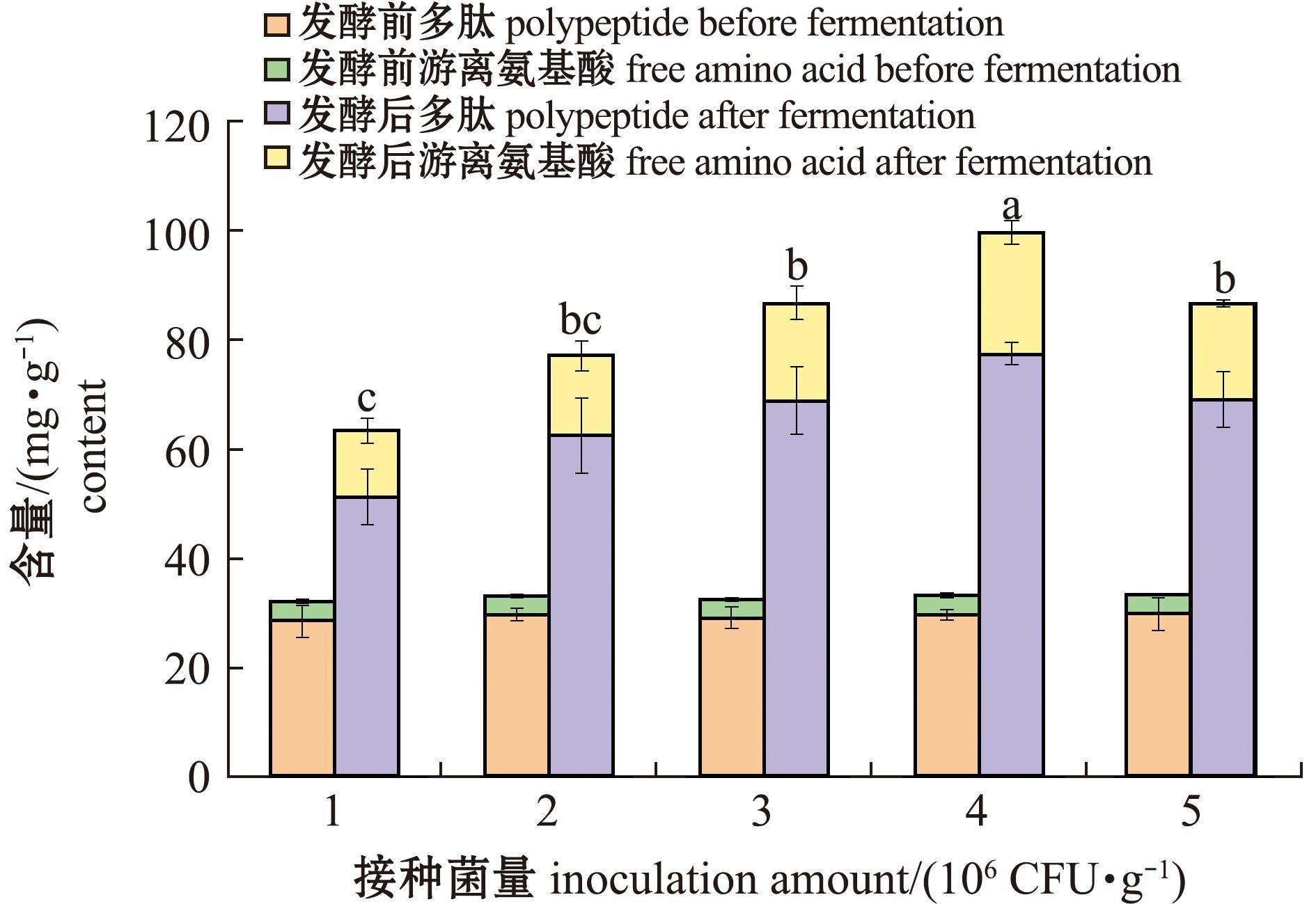
图5 接种菌量对石莼发酵饲料游离氨基酸及多肽含量的影响
Fig.5 Effect of inoculation amount on the contents of free amino acids and peptides in fermented Ulva lactuca diet
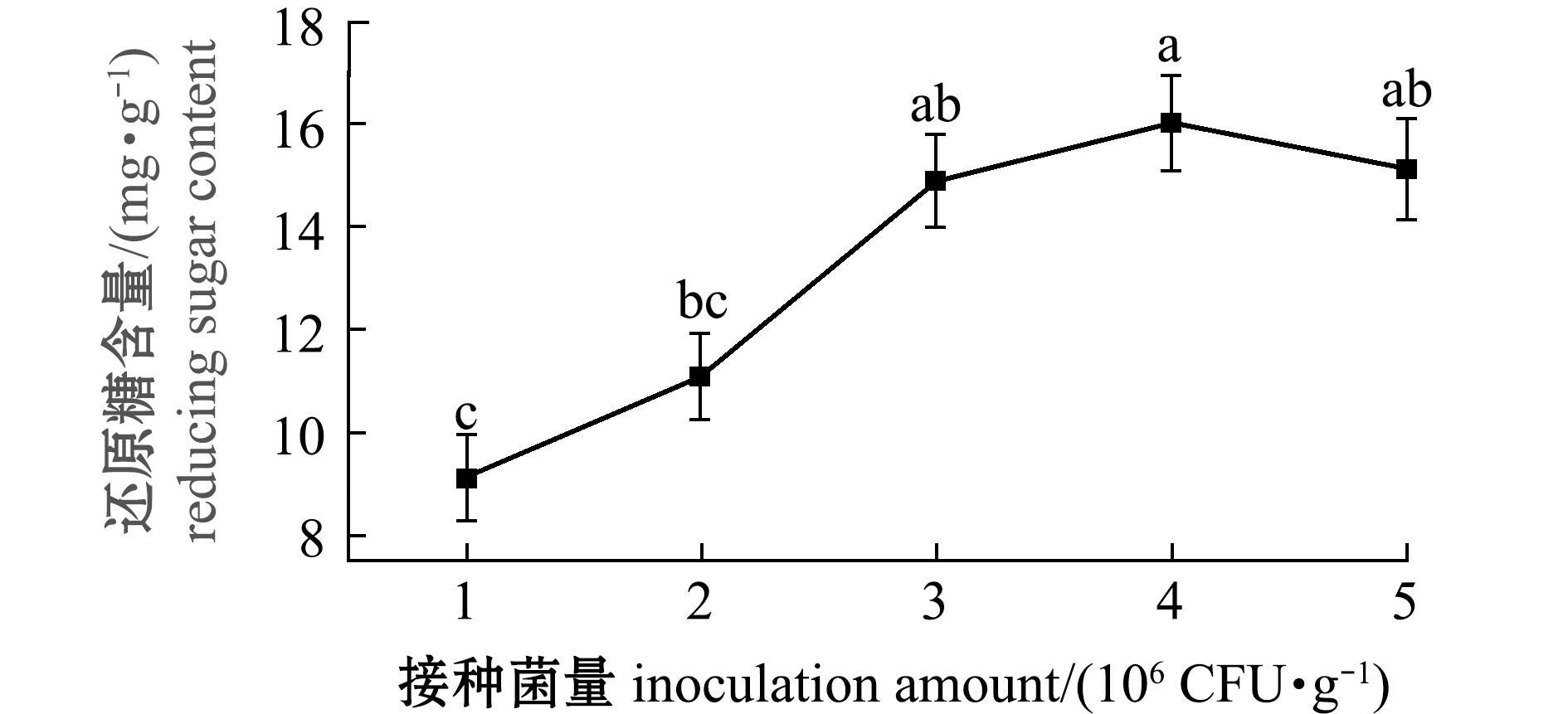
图6 接种菌量对石莼发酵饲料还原糖含量的影响
Fig.6 Effect of inoculation amount on reducing sugar content of fermented Ulva lactuca diet
2.2 满意度函数-响应面法联用优化发酵条件
2.2.1 响应面优化结果 结合满意度函数将总体满意度(D)作为响应面值进行响应面试验设计,试验结果见表4,响应面结果方差分析见表5。
表4 响应面试验设计及结果
Tab.4 Design and results of Box-Behnken for response surface methodology
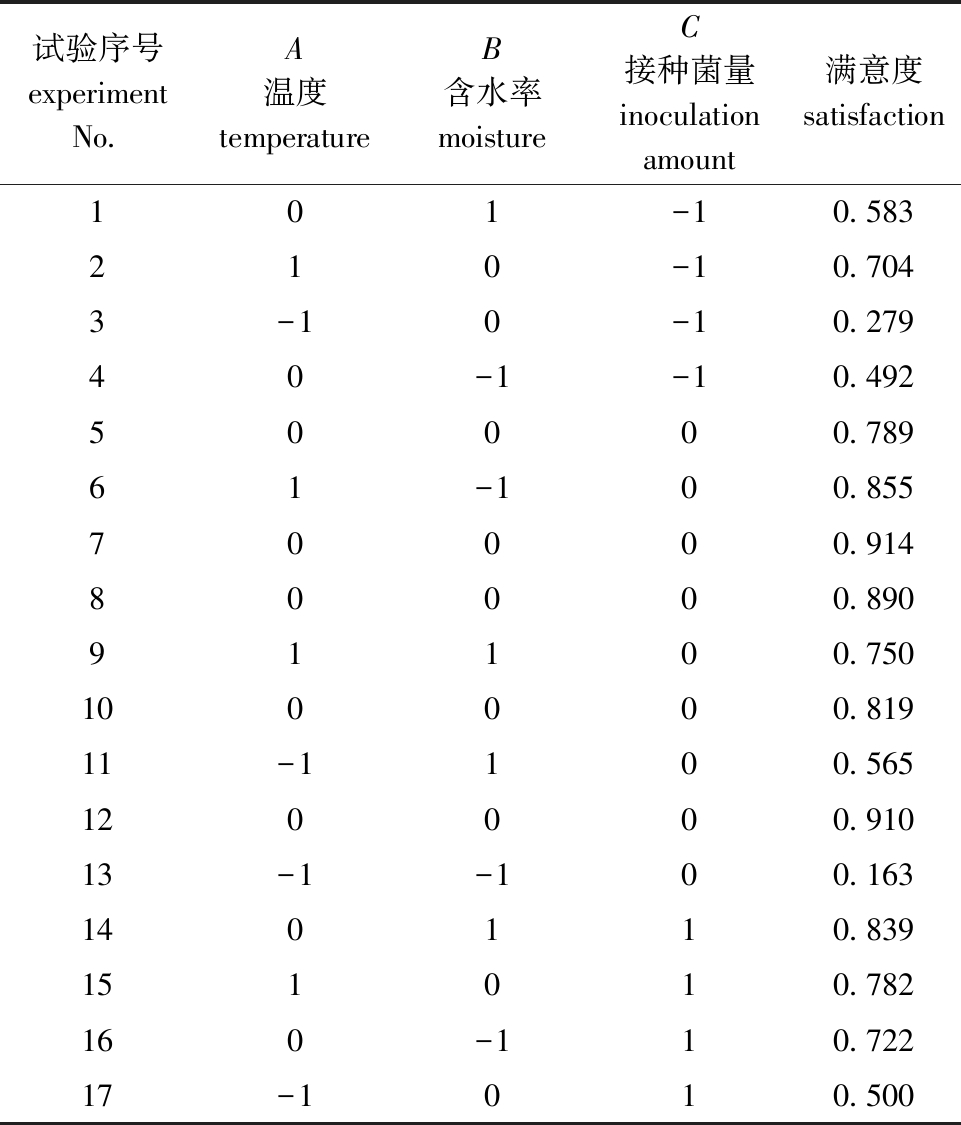
试验序号experiment No.A温度temperatureB含水率moisture C接种菌量inoculation amount满意度satisfaction101-10.583210-10.7043-10-10.27940-1-10.49250000.78961-100.85570000.91480000.89091100.750100000.81911-1100.565120000.91013-1-100.163140110.839151010.782160-110.72217-1010.500
表5 回归方程的方差分析
Tab.5 Variance analysis of regression equation
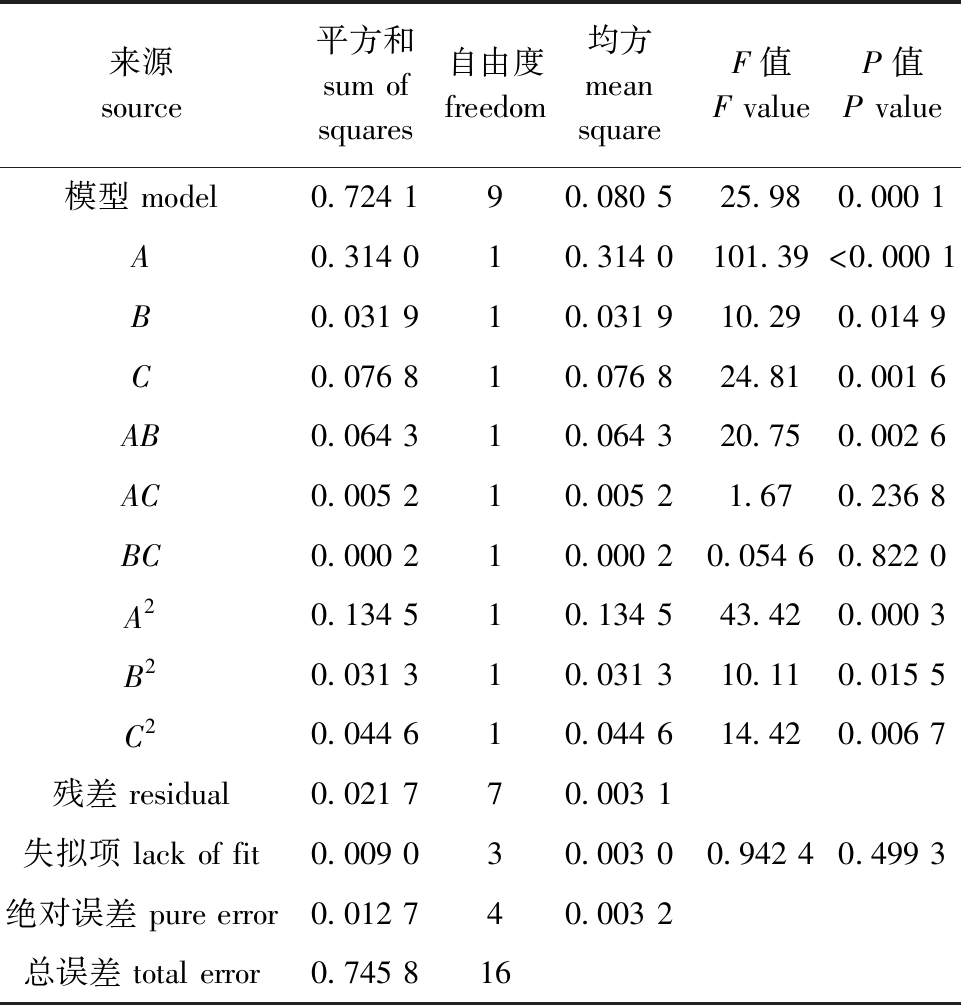
来源source平方和sum of squares自由度freedom均方mean squareF值F valueP值P value模型 model0.724 190.080 525.980.000 1A0.314 010.314 0101.39<0.000 1B0.031 910.031 910.290.014 9C0.076 810.076 824.810.001 6AB0.064 310.064 320.750.002 6AC0.005 210.005 21.670.236 8BC0.000 210.000 20.054 60.822 0A20.134 510.134 543.420.000 3B20.031 310.031 310.110.015 5C20.044 610.044 614.420.006 7残差 residual0.021 770.003 1失拟项 lack of fit0.009 030.003 00.942 40.499 3绝对误差 pure error0.012 740.003 2总误差 total error0.745 816
使用Design-expert 8.0软件对试验数据进行处理,得到相应的多元拟合回归方程为
Y=0.848 2+0.198 1A+0.063 1B+0.098 0C-0.126 7AB-0.036 0AC+0.006 5BC-0.178 7A2-0.086 2B2-0.103 0C2。(10)
从表5可见,该回归模型的F=25.98(P<0.05),说明该多元回归模型效果显著,拟合度较好;失拟项中F=0.942 4(P>0.05),说明该模型与石莼发酵的实际工艺情况拟合程度良好,可以预测最佳发酵条件;A(温度)、B(含水量)、C(接种菌量)均有显著性影响(P<0.05),影响大小依次为A>C>B。
2.2.2 交互作用分析及最优条件的确定 各因素与响应值之间的关系,以及各因素之间的交互作用可以通过响应面图和等高线图反映出来。从图7可见,各曲面图均存在峰值,这说明满意度值存在最大值,温度和含水量对满意度的交互影响的坡度较陡,其等高线较为密集且形成半椭圆形,表明这两个因素之间的交互作用显著( P<0. 05),这与表5中的方差分析结果一致。采用Design-expert 8.0软件可预测石莼理论最佳条件及效果,即发酵温度为32.574 ℃、含水率为50.027%、接种菌量为4.386时,总体满意度为0.918。结合实际操作,调整后的最佳发酵条件:温度为33 ℃、含水率为50%、接种菌量为4.4×106 CFU/g,在此条件下进行发酵,发酵产物中游离氨基酸含量为45.0 mg/g,多肽含量为96.0 mg/g,还原糖含量为20.8 mg/g,满意度为0.912,与预测值基本一致,表明该模型预测准确,具有实用价值。
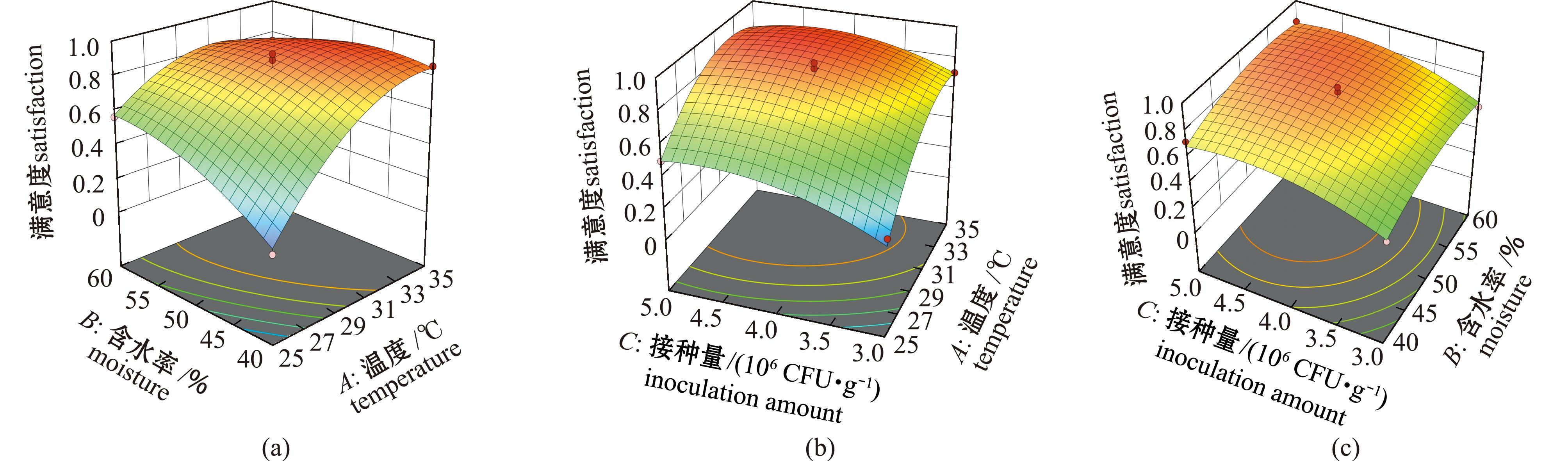
图7 各因素交互作用对满意度影响的响应面曲面图
Fig.7 Response surface diagram of the influence of the interaction of various factors on satisfaction
2.3 刺参养殖试验
2.3.1 刺参生长性能 从表6可见:石莼发酵组刺参的增重率和特定生长率最高(分别为66.19%±8.18%和1.69%±0.10%),显著高于石莼未发酵干粉饲料组(P<0.05),与商品饲料组相比无显著性差异(P>0.05);石莼发酵饲料组的饲料转化率显著高于商品饲料组和石莼未发酵干粉饲料组(P<0.05);不同饲料组间的摄食率无显著性差异(P>0.05)。
表6 不同饲料对刺参生长性能的影响
Tab.6 Effect of different diets on the growth performance of Apostichopus japonicus

注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
组别 group增重率WGR/%特定生长率SGR/(%·d-1)饲料转化率FCE/%摄食率IR/(%·d-1)石莼发酵饲料组 fermented U.lactuca diet group66.19±8.18a1.69±0.10a45.96±2.90a4.98±1.02a石莼未发酵干粉饲料组unfermented U.lactuca dry powder diet group 36.75±8.65b1.04±0.21b20.55±4.83c5.19±1.36a商品饲料组 commercial diet group63.53±1.18a1.64±0.02a35.53±0.66b5.23±0.18a
2.3.2 刺参消化性能 从表7可见,石莼发酵组刺参的消化酶活力显著高于石莼未发酵干粉饲料组和商品饲料组(P<0.05),其中,纤维素酶活力分别是后两者的3.1倍、2.9倍,蛋白酶活力分别是后两者的3.0倍、2.9倍,脂肪酶活力分别是后两者的1.2倍、1.3倍,淀粉酶活力分别是后两者的1.4倍、1.4倍。
表7 不同饲料对刺参消化性能的影响
Tab.7 Effect of different diets on the digestive performance of Apostichopus japonicus U/mg

组别group纤维素酶活力cellulase activity 蛋白酶活力protease activity脂肪酶活力lipase activity淀粉酶活力amylase activity石莼发酵饲料组 fermented U.lactuca diet group2.23±0.09a4.69±0.22a0.81±0.04a61.50±2.94a石莼未发酵干粉饲料组unfermented U.lactuca dry powder diet group 0.76±0.05b1.56±0.11b0.69±0.01b45.45±2.29b商品饲料组 commercial diet group0.88±0.05b1.64±0.08b0.64±0.08b45.51±1.25b
3 讨论
3.1 发酵条件对石莼发酵饲料品质的影响
温度会影响蛋白质、核酸等大分子的结构功能及细胞膜的流动性,从而影响微生物的生长、繁殖和代谢,同样也会影响酶活性,适当地提高温度可以提高发酵产物[22]。研究表明,蛋白酶活性的最适温度为40 ℃,纤维素酶活性的最适温度为55~60 ℃[23-24]。本研究中石莼的最佳发酵温度为30 ℃,与上述研究结果不一致,这可能是与菌种耐热性有关。本研究所用菌种为特基拉芽孢杆菌,筛选自常年水温不超过25 ℃的海水养殖海区,菌种很容易因温度过高而受到影响,虽然温度高于30 ℃酶活性会升高,但菌的生长代谢会受到影响从而降低产酶量。李景等[25]研究也发现,发酵温度在47 ℃时的多肽含量显著低于37 ℃时。本研究中最佳发酵温度为30 ℃,这一结果与张倩芳等[26]所研究的枯草芽孢杆菌最佳发酵温度一致。这说明温度既能影响酶活性又能影响细菌生长,而饲料发酵后的成分又受酶活性和微生物生长数量及状态共同影响,因此,温度是影响发酵的主要因素之一。
含水率也是影响最终发酵质量的关键因素,含水率通过影响发酵物中溶解氧和营养物质的传递,从而影响发酵菌种的正常生长代谢[27]。本研究中的石莼发酵属于固态发酵,固态发酵最大的缺点是缺乏自由水,低自由水含量会减少营养物质和代谢物的扩散,从而影响菌的正常营养需求并影响酶的活性。Pieper等[28]通过对不同含水率的小麦进行发酵研究,证实了含水率对发酵的影响。含水率也应根据发酵底物的特征、发酵微生物的特征、发酵温度及发酵时间决定。本研究中所用石莼粉含水率较低,发酵用微生物为好氧型芽孢杆菌,在保证自由水的前提下又要保证氧气的流通,因此,发酵含水率最适为50%。
发酵过程中初始菌的数量由接种菌量决定,在前期试验中得出,特基拉芽孢杆菌孢子从发芽生长到成熟期产酶能力不断增强,但特基拉芽孢杆菌的生长形态不是统一的,只有充足的接种菌量才能保证在一定的发酵时间内有大量的特基拉芽孢杆菌达到成熟期,进而使酶活性达到最高值,因此,适当的初始菌浓度可以缩短菌种的生长增殖期,菌体能更迅速地分泌酶,使其更快进入发酵阶段并避免感染其他杂菌[29]。Iram等[30]通过优化接种菌量和其他因素最大限度地提高了纤维素酶和木聚糖酶的产量。由此可见,在实际发酵中应当适当加大接种菌量,达到饱和点后无须再继续加大接种菌量,既能提高发酵效率又能节约成本。
3.2 不同饲料对刺参生长性能的影响
刺参的生长性能受海水温度、盐度和pH等多方面影响,但相比于环境因素,刺参更容易被所摄食饵料的营养含量影响。本研究中,采用3种不同饲料饲喂刺参,并测定了刺参的生长指标,其中,增重率、特定生长率均可以反映出刺参生长性能的优劣[31],而饲料转化率及摄食率均为评价饲料优劣及影响动物生长的关键原因[9]。本研究结果表明,3种不同饲料间的摄食率无显著性差异,说明石莼干粉饲料、石莼发酵饲料与商业饲料相比,对刺参未发酵的适口性相当,这可能与3种饲料主体都为大型海藻,风味相差不大有关。石莼发酵饲料组的粗蛋白质和粗脂肪与石莼未发酵干粉饲料组差距不大,但石莼发酵饲料组刺参生长速度明显高于石莼未发酵干粉饲料组,这可能是由于石莼中含有较多的粗纤维和粗蛋白质,直接用于饲料不利于刺参的消化与吸收[2]。而石莼经过发酵,其分子结构发生了改变,其发酵产生的纤维素酶能将石莼中粗纤维水解成刺参更好吸收利用的葡萄糖等还原糖,蛋白酶能将复杂的蛋白质大分子水解为更好利用的游离氨基酸及小分子多肽,这充分说明发酵能改善饲料品质,提高刺参生长速度。李永凯等[32]也在益生菌发酵饲料研究中阐明了此观点。石莼发酵饲料组与商品饲料组刺参生长性能无显著性差异,可能因为商品饲料的主要原料为刺参传统饲料马尾藻,对刺参具有良好的适口性,且与刺参生长所需营养相匹配,而石莼通过发酵后将大分子蛋白分解成易消化吸收的多肽及游离氨基酸,从而也匹配刺参所需的营养水平。3组饲料转化率均有显著性差异,其中未发酵石莼饲料和商品饲料的转化率较低,这说明刺参并未能更好地吸收消化未发酵石莼发酵饲料组和商品饲料组中的营养物质,可能与刺参肠道中的纤维素酶和蛋白酶等活性较低有关[33]。本研究通过对刺参消化酶的测定也证实了这一观点。
综上,经过30 d的喂养试验,结果初步表明,刺参生长性能的提高与发酵将粗纤维、粗蛋白质等大分子物质分解成易消化吸收的游离氨基酸、多肽和还原糖等小分子物质有关,同时也表明,发酵后的石莼可以代替商品饲料作为刺参的饲料。
3.3 不同饲料对刺参消化性能的影响
纤维素酶、蛋白酶、淀粉酶和脂肪酶是刺参的主要消化酶[34]。不同饲料组对刺参消化酶活性有显著影响,消化酶的活性直接影响营养物质的吸收,而营养吸收与刺参的生长发育密切相关。本研究表明,石莼发酵饲料组的刺参纤维素酶、蛋白酶、脂肪酶及淀粉酶均显著高于石莼未发酵干粉饲料组和商品饲料组,发酵饲料对消化有益,这与Wang等[35]的研究结果一致。本研究中,石莼发酵完成后于35 ℃下烘干,并于-4 ℃冰箱中保存,保证了菌种和消化酶等物质的活性,后期通过对发酵饲料中菌种数量及酶活性测定发现,石莼发酵饲料在发酵完成后一周内活性物质无明显差异,投喂刺参后,饲料中的特基拉芽孢杆菌进入刺参肠道并维持一定数量,代谢酶类等物质起到提高刺参消化酶活力的作用。还有一种可能性是由于发酵饲料本身中含有菌种发酵所产生的多种酶,这些酶进入刺参肠道并保持酶活性,也可能导致刺参消化酶活性提高,具体原因还需进一步探究。综上,石莼发酵饲料具有提高刺参消化酶活性的作用。秦博[5]的研究中也发现,在刺参饲料中添加纤维素酶,刺参生长性能也得到了改善。另有研究表明,相比于未发酵的藻类,刺参对发酵后藻类氮的吸收率可由20%提高到52.7%,氮的吸收效率与氮的存在形式有直接关系,而蛋白酶的存在又影响氮的存在形式[36]。本研究中,发酵饲料组刺参肠道蛋白酶活性比未发酵饲料组提高近3倍,进一步证实了上述观点。
此外,本研究中还发现,投喂发酵饲料不仅能提高刺参的生长性能和消化性能,还能一定程度上对水质有改善作用,氨氮是海参养殖中具有代表性的一类污染物,当水体中氨氮含量过高时会影响刺参的生长、免疫、代谢和呼吸等生理活动。由于发酵饲料中存在一定数量的活菌,在其进入水体后会降解因刺参代谢活动及过量饵料分解所产生的氨氮,从而达到一定的净化水质作用,相关试验仍在进行中,现有数据初步表明,发酵饲料在对养殖刺参的生长和健康方面起到积极作用。
4 结论
1)本研究选用特基拉芽孢杆菌进行石莼发酵,得到最优发酵条件为发酵温度33 ℃、含水率50%、接种菌量4.4×106CFU/g,在此条件下进行发酵,发酵产物中游离氨基酸含量为45 mg/g,多肽含量为96 mg/g,还原糖含量为20.8 mg/g,满意度为0.912,与预测值基本一致。说明该优化基本准确,具有实用价值。
2)通过刺参喂养试验发现,石莼发酵饲料组饲料转化率及消化酶活性显著高于石莼未发酵干粉饲料组和商品饲料组,增重率与商品饲料组相差不大,但显著高于石莼未发酵干粉饲料组,表明发酵后的石莼改善了饲料品质,更有利于刺参的消化吸收。本研究验证了优化后发酵石莼工艺的可靠性,为石莼发酵饲料的研发及刺参养殖提供了理论依据。
[1] SUN W H,LENG K L,LIN H, et al.Analysis and evaluation of chief nutrient composition in different parts of Stichopus japonicus[J].Chinese Journal of Animal Nutrition,2010,22(1):212-220.
[2] HAN Q X,KEESING J K,LIU D Y.A review of sea cucumber aquaculture,ranching,and stock enhancement in China[J].Reviews in Fisheries Science &Aquaculture,2016,24(4):326-341.
[3] LI X,WANG Y,JIANG X D,et al. Utilization of different seaweeds (Sargassum polycystum, Sargassum thunbergii, Sargassum horneri, Enteromorpha prolifera, Macrocystis pyrifera,and the residue of M. pyrifera) in the diets of sea cucumber Apostichopus japonicus (Selenka, 1867) [J].Algal Research,2022,61:102591.
[4] 李猛.浒苔生物饲料的制备工艺及在刺参养殖中的应用研究[D].上海:上海海洋大学,2016.LI M.Preparation processes of Enteromorpha prolifera base biological feed and its application to Apostichopus japonicus culture[D].Shanghai:Shanghai Ocean University,2016.(in Chinese)
[5] 秦搏.浒苔和纤维素酶在刺参饲料中的应用研究[D].上海:上海海洋大学,2015.QIN B.Study on Enteromorpha prolifera and cellulase in feed of sea cucumber(Apostichopus japonicus Selenka)[D].Shanghai:Shanghai Ocean University,2015.(in Chinese)
[6] 白伟,吴香莹,左然涛,等.饲料中添加不同海藻对刺参幼参生长、免疫、消化及营养组成的影响[J].大连海洋大学学报,2020,35(2):169-176.BAI W,WU X Y,ZUO R T,et al.Effects of dietary sea weed levels on growth,immunity,digestion and nutritional composition of juvenile sea cucumber Apostichopus japonicas Selenka[J].Journal of Dalian Ocean University,2020,35(2):169-176.(in Chinese)
[7] 宋秀凯,付萍,姜向阳,等.山东近岸海域典型生态灾害的特征和变化趋势[J].海洋开发与管理,2021,38(6):31-36.SONG X K,FU P,JIANG X Y,et al.Characteristics and trends of typical ecological disasters in coastal waters of Shandong Province[J].Ocean Development and Management,2021,38(6):31-36.(in Chinese)
[8] SUN Y Q,LIU J L,XIA J,et al.Research development on resource utilization of green tide algae from the Southern Yellow Sea[J].Energy Reports,2022,8(S4):295-303.
[9] 夏苏东.刺参幼参摄食行为与蛋白质营养需要研究[D].青岛:中国科学院研究生院(海洋研究所),2012.XIA S D.Researches on feeding behavior and dietary protein requirement of sea cucumber Apostichopus japonicus(Selenka)[D].Qingdao:University of Chinese Academy of Sciences(Institute of Oceanology,Chinese Academy of Sciences),2012.(in Chinese)
[10] 孙兴.刺参固态发酵饲料的制备及应用[D].大连:大连工业大学,2015.SUN X.Production of solid state fermentation feed and its application in Apostichopus japonicas cultivation[D].Dalian:Dalian Polytechnic University,2015.(in Chinese)
[11] ZHANG M Z,PAN L Q,FAN D P,et al.Study of fermented feed by mixed strains and their effects on the survival,growth,digestive enzyme activity and intestinal flora of Penaeus vannamei[J].Aquaculture,2021,530:735703.
[12] 李利华.刺参发酵饵料工艺条件优化及养殖试验中的应用[D].哈尔滨:哈尔滨工业大学,2013.LI L H.Process optimization of cucumbers fermented food and application in the breeding trials[D].Harbin:Harbin Institute of Technology,2013.(in Chinese)
[13] 赵祥忠.微生物发酵技术在制备海带渣饲料中的应用研究[D].济南:山东轻工业学院,2012.ZHAO X Z.Study on the application of microbial fermentation technology in the preparation of kelp slag feed[D].Jinan:Shandong Polytechnic University,2012.(in Chinese)
[14] 阮伸.茚三酮比色测定氨基酸的改良[J].化学世界,1986,27(8):357-360.RUAN S.Improvement of determination of amino acids by ninhydrin colorimetry[J].Chemical World,1986,27(8):357-360.(in Chinese)
[15] 李建武.生物化学实验原理和方法[M].北京:北京大学出版社,1994.LI J W.Principles and methods of biochemical experiments[M].Beijing:Peking University Press,1994.(in Chinese)
[16] 金恒启,李树章.斐林试剂配方的改进[J].解放军医学高等专科学校学报,1999(4):51-52.JIN H Q,LI S Z.Improvement of formula of Fehling’s solution[J].Clinical Journal of Medical Officer,1999(4):51-52.(in Chinese)
[17] DERRINGER G,SUICH R.Simultaneous optimization of several response variable[J].Journal of Quality Technology,1980,12(4):214-219.
[18] 张晓丽,吴望君,袁璐,等.饲料中纤维素酶活力的测定方法研究[J].中国饲料,2019(17):104-107.ZHANG X L,WU W J,YUAN L,et al.Determination of cellulase activity in feed[J].China Feed,2019(17):104-107.(in Chinese)
[19] 赵玉莲.“福林酚法”分析蛋白酶活性的探讨[J].中国调味品,1986,11(6):3-8.ZHAO Y L.Discussion on the analysis of protease activity by “Flynnphenol method” [J].Chinese Condiment,1986,11(6):3-8.(in Chinese)
[20] 李锦才,钟响,马泽雄.脂肪酶活力检测方法分析[J].食品安全导刊,2016(6):91-92.LI J C,ZHONG X,MA Z X.Analysis of detection methods of lipase activity[J].China Food Safety Magazine,2016(6):91-92.(in Chinese)
[21] 王晓红.产低温淀粉酶菌株的筛选及其酶学性质的研究[D].乌鲁木齐:新疆农业大学,2006.WAHG X H,Study on the screening and enzymetic properties of a novel cold-active amylase-producing strain[D].Urumqi:Xinjiang Agricultural University,2006.(in chinese)
[22] YANG L J,ZENG X F,QIAO S Y.Advances in research on solid-state fermented feed and its utilization:the pioneer of private customization for intestinal microorganisms[J].Animal Nutrition,2021,7(4):905-916.
[23] 宋金凤,孙振江,李永恒,等.纤维素水解酶适用性和水解工艺的研究[J].当代化工,2021,50(5):1148-1154,1175.SONG J F,SUN Z J,LI Y H,et al.Study on the applicability and hydrolysis process of cellulose hydrolase[J].Contemporary Chemical Industry,2021,50(5):1148-1154,1175.(in Chinese)
[24] 李小强.山药蛋白酶解多肽液及多肽酒制备工艺研究[D].武汉:湖北工业大学,2012.LI X Q.Process research on yam peptides by enzymolysis method and preparation of peptide wine[D].Wuhan:Hubei University of Technology,2012.(in Chinese)
[25] 李景,陈定刚,马龙.响应面优化枯草芽孢杆菌发酵豆粕制备ACE抑制肽条件[J].中国油脂,2018,43(6):31-35.LI J,CHEN D G,MA L.Optimization of fermentation conditions for preparation of ACE inhibitory peptides from soybean meal by Bacillus subtilis using response surface methodology[J].China Oils and Fats,2018,43(6):31-35.(in Chinese)
[26] 张倩芳,李敏,栗红瑜,等.燕麦麸皮枯草芽孢杆菌固态发酵工艺优化[J].农产品加工,2023(14):39-41,45.ZHANG Q F,LI M,LI H Y,et al.Optimization of solid-state fermentation process of oat bran by Bacillus subtilis[J].Farm Products Processing,2023(14):39-41,45.(in Chinese)
[27] CHO S,PARK J W,KIM S O,et al.Effective conditions of moisture content,inoculumrate,and medium composition for the production of cellulase,amylase,andxylanase by fermentation of slaughterhouse rumen contents[J].The Journal of Animal and Plant Sciences,2013,23(2):398-404.
[28] PIEPER R,HACKL W,KORN U,et al.Effect of ensiling triticale,barley and wheat grains at different moisture content and addition of Lactobacillus plantarum (DSMZ 8866 and 8862) on fermentation characteristics and nutrient digestibility in pigs[J].Animal Feed Science and Technology,2011,164(1/2):96-105.
[29] YANG Y,LAN G Q,TIAN X Y,et al.Effect of fermentation parameters on natto and its thrombolytic property[J].Foods,2021,10(11):2547.
[30] IRAM A,CEKMECELIOGL U D,DEMIRCI A.Optimization of the fermentation parameters to maximize the production of cellulases and xylanases using DDGS as the main feedstock in stirred tank bioreactors[J].Biocatalysis and Agricultural Biotechnology,2022,45:102514.
[31] 刘海洋,王晋,陈立颖,等.陆生植物替代藻粉对幼年刺参生长和免疫的影响[J].资源开发与市场,2014,30(11):1287-1289.LIU H Y,WANG J,CHEN L Y,et al.Effects of replacement of algae powder by terrestrial plants on growth and immunity of juvenile sea cucumber Apostichopus japonicus[J].Resource Development &Market,2014,30(11):1287-1289.(in Chinese)
[32] 李永凯,毛胜勇,朱伟云.益生菌发酵饲料研究及应用现状[J].畜牧与兽医,2009,41(3):90-93.LI Y K,MAO S Y,ZHU W Y.Current situation in research and application of fermented feed with probiotics[J].Animal Husbandry &Veterinary Medicine,2009,41(3):90-93.(in Chinese)
[33] YINGST J Y.The utilization of organic matter in shallow marine sediments by an epibenthic deposit-feeding holothurian[J].Journal of Experimental Marine Biology and Ecology,1976,23:55-69.
[34] WEN B,GAO Q F,DONG S L,et al.Effects of dietary inclusion of benthic matter on feed utilization,digestive and immune enzyme activities of sea cucumber Apostichopus japonicus (Selenka)[J].Aquaculture,2016,458:1-7.
[35] WANG J H,ZHAO L Q,LIU J F,et al.Effect of potential probiotic Rhodotorula benthica D30 on the growth performance,digestive enzyme activity and immunity in juvenile sea cucumber Apostichopus japonicus[J].Fish &Shellfish Immunology,2015,43(2):330-336.
[36] 袁成玉.海参饲料研究的现状与发展方向[J].水产科学,2005,24(12):54-56.YUAN C Y.Current status and development of feed in sea cucumber[J].Fisheries Science,2005,24(12):54-56.(in Chinese)