香螺(Neptunea cumingii)自然分布于中国、日本、韩国及俄罗斯等东亚地区海域,为中国黄渤海习见种,是一种重要的底栖腹足类动物[1-3]。香螺营养丰富,味道鲜美,具有较高的营养价值和经济价值[4]。近年来,随着捕捞强度的增大及栖息地环境被破坏,香螺野生资源量已大幅减少[5]。在自然条件下,香螺食性广泛且生长速度较快,极具人工增养殖潜力。因此,为进一步开展香螺资源保护及人工增养殖等相关工作,对香螺繁殖特性进行相关研究具有重要的意义。
标准化人工育苗是实现香螺人工增养殖的前提,而种螺养殖又是人工育苗的重要技术步骤。目前,对香螺的研究主要集中在群体遗传[6-7]、胚胎发育[8-9]、摄食习性[10-11]及应激反应[12-13]等方面,在涉及香螺繁殖生物学的研究中,Park等[14]研究表明,韩国西海岸香螺繁殖期为每年5—8月,繁殖盛期水温为18~23 ℃;高岩等[15]对香螺性腺组织显微结构及精卵超显微结构进行了详尽观察,提出香螺卵母细胞营养方式为自体合成及异体合成两种方式共存。然而,此前的研究中并未涉及中国海域人工养殖条件下的香螺性腺发育及繁殖周期,因此,有必要开展中国海域内香螺性腺发育规律相关研究。本研究中,在山东省烟台市四十里湾海域开展香螺人工养殖试验,利用常规组织切片结合肉眼观察的方法,对雌、雄香螺生殖系统的主要组织进行连续切片观察,将香螺性腺发育阶段进行分期并结合水温条件展开分析,以期为香螺遗传育种及人工育苗工作提供技术参考。
1 材料与方法
1.1 材料
试验用香螺亲本于2022年9月采自山东省威海龙须岛海域,壳高为(81.46±4.41)mm,体质量为(58.09±10.70)g,共计269枚;以1龄栉孔扇贝(Chlamys farreri)作为饵料生物,吊笼养殖于山东烟台四十里湾海域。
1.2 方法
1.2.1 组织切片样品的采集与制备 从2022年11月开始每月采集15枚香螺,敲碎螺壳,剥离出完整软体部,肉眼观察并记录香螺生殖系统结构;迅速取出位于螺旋部的性腺,用剪刀取约5 mm厚的精巢和卵巢,以及处于繁殖盛期的雄性贮精囊及雌性囊腺体组织,经过固定、脱水、透明和石蜡包埋后,用组织切片机(KD-202A)连续切成5 μm组织薄片,后经摊片、烤片和贴片等操作后,以伊红染色法对组织染色并以中性树胶封片,在显微镜(Olympus BX41)下观察每张切片,选取有代表性的样品用数字目镜(DYS-1000)进行拍照。至翌年6月中旬大部分香螺产卵结束后,将剩余个体用沸水全部处死,统计雌、雄香螺个数。
1.2.2 水温监测 利用表层水温计现场测定海水表层温度,精确至0.2 ℃。
1.3 数据处理
利用ImageJ(1.53 k)测量各个时期生殖细胞胞径及核径,采用R(V4.2.3)软件进行数据分析,采用卡方检验进行性比分析,差异显著性水平设为0.05。
2 结果与分析
2.1 水温条件的变化
从图1可见:11月首次采样时水温为14.4 ℃,此后水温持续降低,至翌年2月水温达到本次试验最低值(2.6 ℃);之后又逐渐升高,至2023年6月最后一次采样,水温升至整个试验周期的最高值(17.4 ℃)。

图1 采样海区水温变化
Fig.1 Changes in water temperature in the sampling area
2.2 香螺雄性生殖系统及精子发生
2.2.1 香螺雄性生殖系统 香螺雄性生殖系统(图2A)由交接口、交接器、贮精囊、输精管和精巢5部分组成。香螺精巢(图2C)覆盖于肝脏上方,呈黄色或杏黄色,精巢由被膜及内部的精小叶构成。被膜分为两层:外层为腹膜,由一层扁平上皮细胞构成,被染成蓝色;内层为白膜,由具有弹性的疏松结缔组织构成,白膜的结缔组织向精巢内延伸,将精巢分隔成精小叶。繁殖季节,精小叶膨大,解剖可见呈管状结构。精小叶内壁边缘有生殖细胞聚集形成的精小囊,精小囊外覆有一层滤泡细胞;精小叶中央为空腔,为精子排出通道。
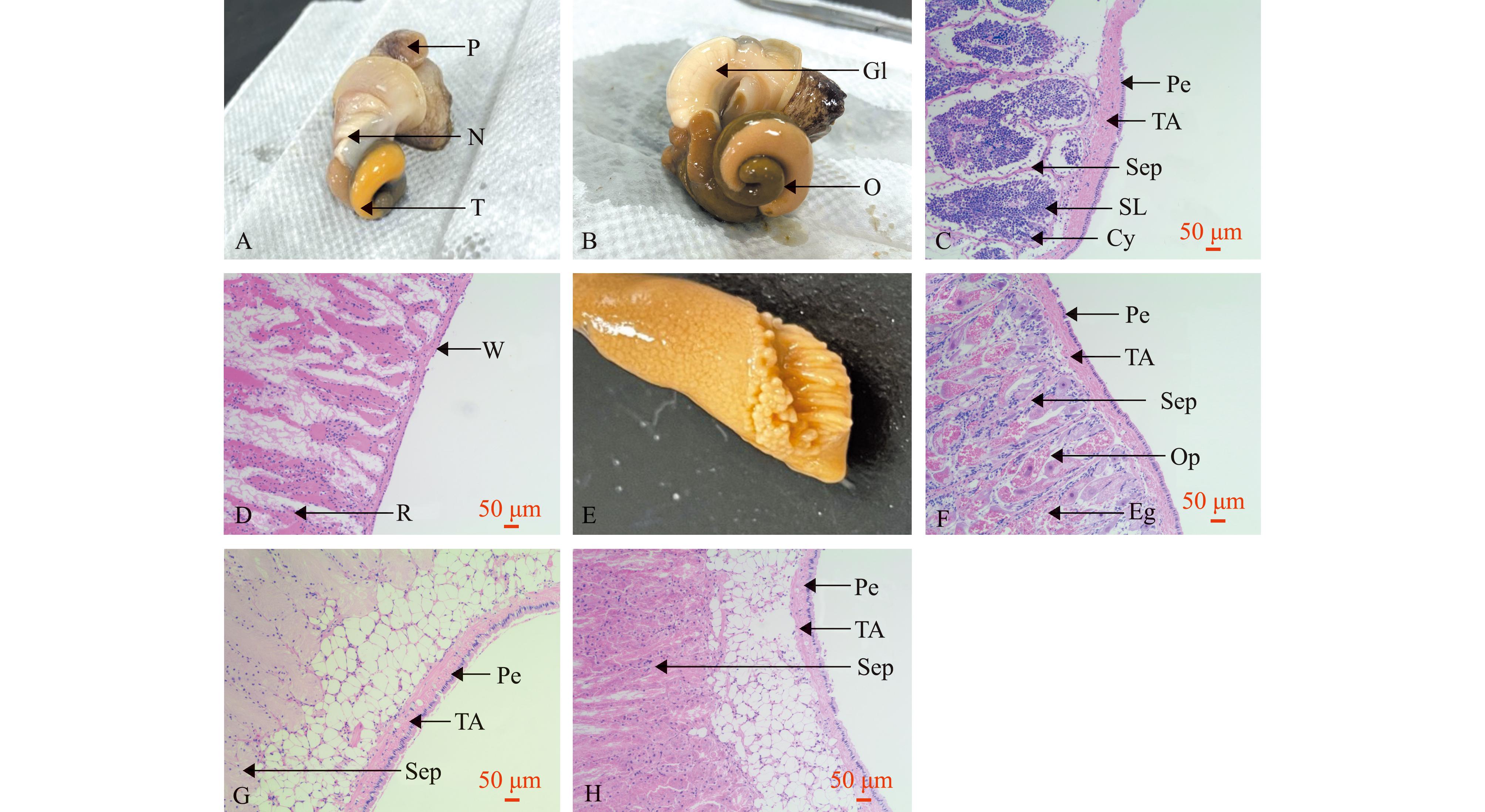
A—雄性香螺生殖系统;B—雌性香螺生殖系统;C—精巢显微结构;D—贮精囊显微结构;E—卵巢切面;F—卵巢显微结构;G—蛋白腺显微结构;H—缠卵腺显微结构。P—交接器;N—贮精囊;T—精巢;Gl—囊腺体;O—卵巢;Pe—被膜;TA—白膜;Sep—隔膜;SL—精小叶;Cy—精小囊;W—囊壁;R—结缔组织细胞;Op—产卵板;Eg—嗜酸性颗粒。
A—the reproductive system of male N.cumingii;B—the reproductive system of female N.cumingii;C—microstructure of testis;D—microstructure of seminal receptacle;E—ovarian section;F—ovarian microstructure;G—microstructure of gland;H—microstructure of nidamental gland. P—petasma;N—seminal receptacle;T—testis;Gl—gland;O—ovary;Pe—peritoneum;TA—tunica albuginea;Sep—septum;SL—seminiferous lobules;Cy—cyst;W—capsule wall;R—connective tissue cell;Op—oviposition plate;Eg—eosinophilic granules.
图2 香螺生殖系统及组织显微结构
Fig.2 Morphological structure and histological microstucture of reproductive system in Neptunea cumingii
贮精囊(图2D)位于外套膜后方,由囊壁及其内部的结缔组织构成,非繁殖季节不明显,繁殖季节外观呈囊状,乳白色。囊壁由一层被膜构成,细胞较薄,细胞核偏向一极;囊主体由众多结缔组织细胞组成管束状结构,管腔内有网状组织,结缔组织细胞较大且形状不规则,其细胞核偏向一极。
2.2.2 香螺精巢发育分期及季节分布 显微观察发现,香螺性腺发育分期时间界限不明显,通常精小叶内各阶段生殖细胞并存,且存在分批成熟、分批排放现象。因此,基于精巢形态变化及组织切片观察结果,将香螺性腺发育分为增殖期、生长期、成熟与排放期和退化期4个时期。
增殖期:从5月开始,香螺精巢较薄,紧贴于肝脏外侧。组织切片显示:精小叶间隙较大,间介组织较多,呈网状,被染成粉红色;精小叶内无成熟精子,精原细胞于精小叶内开始大量增殖,在精小叶内占比最高,精小叶中央空腔被染成深色的生殖细胞覆盖(图3A)。
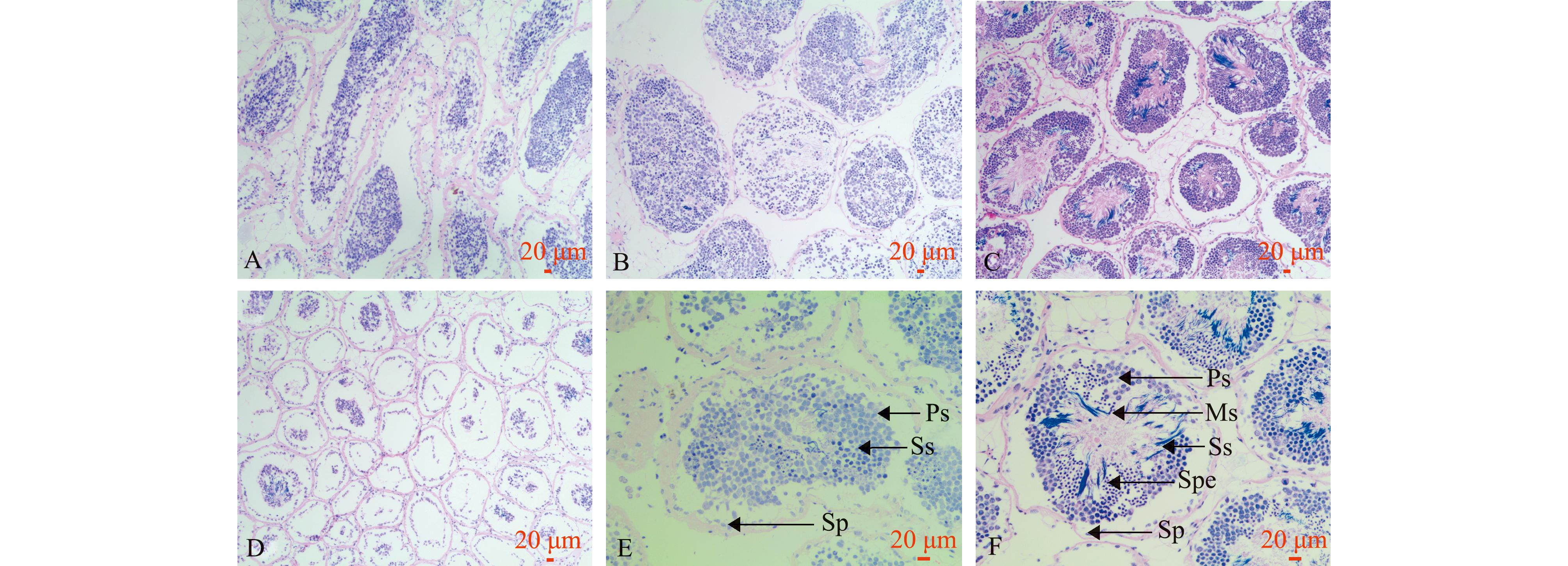
A—增殖期;B—生长期;C—成熟与排放期;D—退化期;E—生长期精巢;F—成熟与排放期精巢。Ps—初级精母细胞;Ss—次级精母细胞;Sp—精原细胞;Ms—成熟精子;Spe—精细胞。A~D放大100倍,E、F放大200倍。
A—proliferation stage;B—growth stage;C—maturity and releasing stage;D—involution stage;E—testis in growth stage;F—testis in maturity and releasing stage. Ps—primary spermatocyte;Ss—Secondary spermatocyte;Sp—Spermatogonium;Ms—mature sperm;Spe—Spermatotid.A-D,×100;E and F,×200.
图3 香螺精巢发育分期及不同阶段的精细胞
Fig.3 Developmental stages and different developmental phase of germ cells in testis of Neptunea cumingii
生长期:11月—翌年1月,香螺精巢均处于生长期,本试验中开始观察时精巢已处于生长期,增殖期与生长期交界点未观测。香螺精巢在外观上最为饱满,生长后期轻轻切开精巢被膜,可见精小叶呈管状,但难以单根剥离。组织切片显示:精小叶间仍存在网状间质细胞;精小叶腔内最为饱满,各期雄性生殖细胞均可见,但成熟精子数量较少,大部分细胞处于精母细胞阶段(图3B)。
成熟与排放期:2—4月,香螺精巢体积迅速变小,但贮精囊膨大,呈乳白色。组织切片显示:精小叶间隙增大,网状间质细胞开始出现;精小叶腔内细胞开始减少,出现大量成熟精子,其鞭毛呈束状,被染成深色,精母细胞数量减少;随着精子的释放,精小叶中央空腔开始裸露(图3C)。
退化期:3—4月,香螺排精后精巢进入短暂退化期,仅3、4月部分个体可见,且不同个体退化期稍有不同。此阶段精巢体积最小,贮精囊与上期相比变化不大。组织切片显示:精小叶间隙与成熟及排放期差别不大,间质组织分布较少;精小叶腔内大部分空出,内壁分布有少量生殖细胞,少量精小叶内残留未排出的成熟精子(图3D)。
2.2.3 香螺精子发生 香螺精子在精小叶内发生,根据生殖细胞的形态结构、大小、发育程度及分布等特点,将雄性生殖细胞分为精原细胞、初级精母细胞、次级精母细胞、精细胞和精子5个发育阶段。各阶段雄性生殖细胞特点如表1及图3E、F所示。
表1 香螺各发育阶段雄性生殖细胞特征
Tab.1 Characteristics of male germ cell of Neptunea cumingii in different developmental stages

分期stage出现时期及位置time and location细胞特点cytological characteristic细胞核特点nucleus characteristic精原细胞spermatogonium在性腺发育各个阶段均能发现,在退化期和增殖期占比最多;位于精小叶内壁上形状不规则,多呈近椭圆形,细胞较大,胞径为3.44~10.25 μm细胞核占据细胞绝大部分,嗜碱性,被染成浅蓝色初级精母细胞primary spermatocyte在增殖期和生长期大量出现;位于精小叶内壁边缘呈圆形或椭圆形,细胞膜不清晰;细胞与精原细胞大小相当,胞径为5.02~8.30 μm被染成浅蓝色,细胞质不可见次级精母细胞secondary spermato-cyte出现时间短,多在生长期和成熟与排放期出现;较初级精母细胞稍靠近精小叶中央呈卵圆形,细胞较为清晰;细胞较初级精母细胞小,胞径为5.39~7.03 μm被染成深蓝色,细胞核外围出现少量细胞质精细胞spermatotid在成熟与排放期大量出现;精细胞位于精小叶腔靠近中央位置呈卵圆形,部分精细胞开始拖尾;精细胞较初级精母细胞小,胞径为2.07~2.49 μm细胞核高度浓缩,呈深蓝色,外围少量细胞质精子spermatozoon在成熟与排放期大量出现;头朝内壁,尾朝中央,成簇分布于精小叶内精子已分化出尾状鞭毛结构,精子尾巴长短差别较大,总体范围为18.56~60.54 μm细胞核高度浓缩,整体被染成深蓝色
2.3 香螺雌性生殖系统及卵子发生
2.3.1 香螺雌性生殖系统 雌性生殖系统(图2B)由产卵器、囊腺体、受精囊、输卵管及卵巢5部分组成。香螺卵巢(图2E、F)与精巢位置一致,均覆盖在肝脏表面,呈土黄色,由被膜及内部的产卵板组成。被膜由外层腹膜和内层结缔组织白膜组成,白膜向卵巢内部延伸,与生殖上皮组成产卵板。产卵板上分布有众多滤泡细胞,滤泡腔内分布有游离的嗜酸性颗粒,无细胞结构,被染成红色。滤泡壁上分布有雌性生殖细胞,被染成蓝色。
囊腺体所处位置与雄性贮精囊位置类似,位于外套膜后方。囊腺体由紧贴在一起的蛋白腺(图2G)和缠卵腺(图2H)组成,蛋白腺颜色较浅,半透明;缠卵腺颜色较深,繁殖季节充满白色膏状物质,呈乳白色。囊腺体整体具一层被膜,与精巢及卵巢被膜类似。被膜外层为腹膜,内层为结缔组织白膜,白膜向腺体内延伸,在腺体外层形成疏松网状结缔组织结构后,继续向内延伸,将囊腺体分隔成单独的小室。蛋白腺部分被染成浅粉色,腺体内细胞相对较少,各单独小室结构明显;缠卵腺内细胞被染色较深,细胞数量较多。两种腺体细胞形状均不规则,胞内被大量嗜酸性物质填充。
2.3.2 香螺卵巢发育分期及季节分布 基于所观察的性腺发育情况及不同雌性生殖细胞所占比例,将香螺卵巢发育也分为增殖期、生长期、成熟与排放期和退化期4个时期。
增殖期:11—翌年2月,卵巢较薄,约占螺旋部切面的1/3。组织切片显示:滤泡细胞形状不规则,前期滤泡间隙较大,随着发育的进行滤泡间隙缩小;滤泡腔内分布有被染成红色的嗜酸性颗粒,但密度不高;滤泡壁分布有大量卵原细胞,在滤泡生殖细胞中占大多数;后期少量个体滤泡纤毛上开始出现小生长期卵母细胞,未见大生长期卵母细胞及成熟卵子(图4A)。
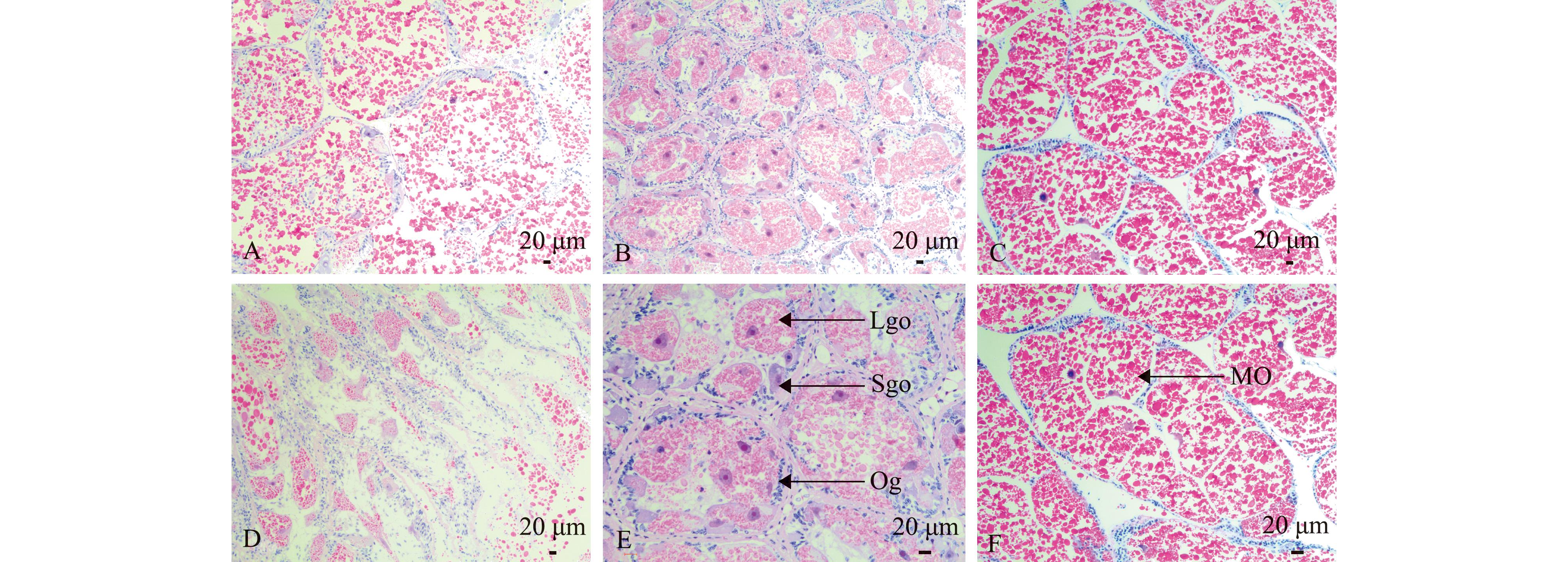
A—增殖期;B—生长期;C—成熟与排放期;D—退化期;E—生长期卵巢;F—成熟与排放期卵巢。Og—卵原细胞;Sgo—小生长期卵母细胞;Lgo—大生长期卵母细胞;MO—成熟卵子。
A—proliferation stage;B—growth stage;C—maturity and releasing stage;D—involution stage;E—ovary in growth stage;F—ovary in maturity and releasing stage. Og—Oogonium;Sgo—Small growing oocyte;Lgo—Large growing oocyte;MO—mature oocyte.
图4 香螺卵巢发育分期及不同阶段的卵母细胞
Fig.4 Developmental stages of ovary and oocyte
生长期:3—4月,香螺卵巢较为饱满,部分个体透过卵囊被膜已看到产卵板膨大似颗粒状。组织切片显示:滤泡细胞间质减少,细胞间几乎无空隙;滤泡腔内嗜酸性颗粒增多,后随生长期的进行逐渐减少;卵原细胞未见明显减少,小生长期卵母细胞开始成批出现,且细胞体积逐渐增大,细胞内有卵黄物质积累,变化为大生长期卵母细胞,未见成熟卵子(图4B)。
成熟与排放期:5—6月,香螺卵巢体积达到最大,囊腺体也极为膨大,缠卵腺呈乳白色,轻轻划破即溢出大量膏状组织。组织切片显示:滤泡互相挤压,间质细胞消失;部分生殖细胞呈卵圆形,大部分形状不规则,卵膜透亮,部分细胞因相互挤压无法分清界限;细胞内卵黄物质大量积累,呈块状,被染成红色。卵巢内以成熟卵子为主(图4C)。
退化期:6月以后,退化期与增殖期分界点并未观测。此阶段香螺卵巢体积最小,囊腺体回缩,与增殖期相差不大,仍极易分辨。组织切片显示:滤泡细胞间空隙明显增大,生出部分网状间质细胞;
滤泡腔内嗜酸性颗粒减少,残留大量形状、大小不一的空腔。部分滤泡残留未排出的成熟卵子,但细胞核崩解,细胞异化;滤泡壁上分布大量卵原细胞,占滤泡中生殖细胞大多数(图4D)。
2.3.3 香螺卵子发生 香螺雌性生殖细胞在滤泡内发生,根据雌性生殖细胞形态、分布位置、出现时期及大小等组织观察结果,将香螺卵子发生过程分为卵原细胞、小生长期卵母细胞、大生长期卵母细胞及成熟卵子4个阶段。各时期雌性生殖细胞特点如表2及图4E、F所示。
表2 香螺各发育阶段雌性生殖细胞特征
Tab.2 Characteristics of germ cell of female Neptunea cumingii in different developmental stages
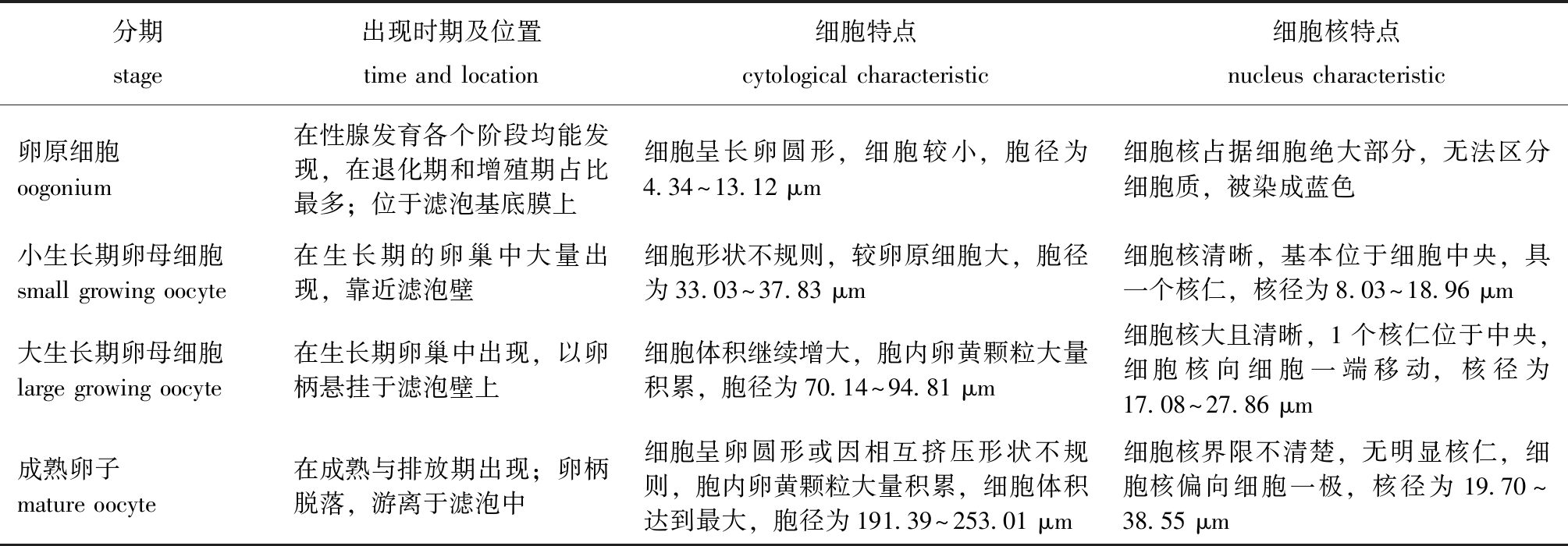
分期stage出现时期及位置time and location细胞特点cytological characteristic细胞核特点nucleus characteristic卵原细胞oogonium在性腺发育各个阶段均能发现,在退化期和增殖期占比最多;位于滤泡基底膜上细胞呈长卵圆形,细胞较小,胞径为4.34~13.12 μm细胞核占据细胞绝大部分,无法区分细胞质,被染成蓝色小生长期卵母细胞small growing oocyte在生长期的卵巢中大量出现,靠近滤泡壁细胞形状不规则,较卵原细胞大,胞径为33.03~37.83 μm细胞核清晰,基本位于细胞中央,具一个核仁,核径为8.03~18.96 μm大生长期卵母细胞large growing oocyte在生长期卵巢中出现,以卵柄悬挂于滤泡壁上细胞体积继续增大,胞内卵黄颗粒大量积累,胞径为70.14~94.81 μm细胞核大且清晰,1个核仁位于中央,细胞核向细胞一端移动,核径为17.08~27.86 μm成熟卵子mature oocyte在成熟与排放期出现;卵柄脱落,游离于滤泡中细胞呈卵圆形或因相互挤压形状不规则,胞内卵黄颗粒大量积累,细胞体积达到最大,胞径为191.39~253.01 μm细胞核界限不清楚,无明显核仁,细胞核偏向细胞一极,核径为19.70~38.55 μm
2.4 香螺雌、雄性比
本试验中共统计了252枚香螺个体,未发现性畸变个体,其中,雌性179只,雄性73只,性别比为2.45∶1。经卡方检验,该比值与期望比值(1∶1)存在极显著性差异(P<0.01),表明此批采集的香螺性别比例严重偏离自然状态。
3 讨论
3.1 香螺性腺发育与环境因素的关系
贝类繁殖行为受自身生物学特性及众多环境因素影响[16-18],因海底盐度等环境因素相对稳定,其对底栖腹足类动物繁殖行为影响较小,故水温和食物可得性是腹足类动物性腺发育研究中最重要的环境因子[19-20]。相关研究表明,贝类繁殖需要特定的温度范围,较高温度会加速贝类性腺发育速率,低温会限制贝类配子发育及成熟[21]。本试验中,雌性香螺性腺成熟与排放期集中在5—6月,与国内有关野生香螺报道的产卵时间一致[8],虽与国外相关研究中产卵时间有所差异[14],但产卵水温均集中在16~23 ℃,表明水温条件是决定香螺性腺发育周期的重要环境因素;香螺雌、雄性腺生长期均处于年度水温较低条件下,低温并未限制其配子的发育,这与对脉红螺(Rapana venosa)[19]、皮氏蛾螺(Volutharpa ampullacea)[22]和风信标扇贝(Patinopecten caurinus)[23]等贝类的研究结果较为一致,表明除水温外,还有其他环境条件是贝类性腺发育的制约因素。
营养物质贮存情况被普遍认为也是较为重要的环境条件[20,24]。香螺最适生存温度为20 ℃左右[12],春秋两季是香螺捕食最为活跃的时期,其蓄积了大量营养物质,因此,香螺在冬春季节有足够营养物质供给性腺发育。本试验中,采用香螺与栉孔扇贝同笼混养的方式为其提供饵料,保证了其充足营养供应及贮存,使得香螺产卵期与野生条件下[8]较为一致,且本批次香螺不同个体间性腺发育阶段也较为接近。因此,本试验中所采用的养殖方式可以作为香螺种螺的蓄养方式。
3.2 香螺性腺发育分期及雌、雄性成熟特征
腹足类动物性腺发育分期至今无统一的标准。Chung等[25]将香螺精巢发育分为生长期、成熟期、排放期和恢复期4个阶段,Park等[14]将香螺卵巢发育分为增殖期、生长期、成熟期、排放期和恢复期5个阶段。本试验中,并未观察到雌、雄配子成熟与排放有清晰界限,且同一个体精子为分批成熟、多次排放类型,故参考细角螺(Hemifusus ternatanus)[26]及管角螺(Hemifusus tuba)[27]等腹足类动物性腺发育分期,将成熟期与排放期合并,称为成熟与排放期;组织切片结果显示,香螺性腺发育基本无休止期,这与对台湾东风螺(Babylonia formosae)[20]的研究结果一致。因此,结合滤泡细胞及生殖细胞形态,笔者将香螺性腺发育分为增殖期、生长期、成熟与排放期和退化期4个阶段。
滤泡内营养物质的积累情况在水产动物性腺发育分期中是重要的参考标准[28]。本试验中,在香螺雌性性腺发育各个阶段,滤泡内均可见到被染成红色的嗜酸性颗粒,且嗜酸性颗粒数量随发育的进行产生变化。有研究表明,香螺卵母细胞营养方式为自体合成与异体合成两种方式并存,在异体合成方式中,滤泡细胞分泌的卵黄前体等营养物质被卵母细胞通过内吞作用吸收,转化为卵黄颗粒[15]。本试验中,卵黄颗粒与滤泡中的嗜酸性颗粒形态极为相似,且滤泡中的嗜酸性颗粒在卵巢生长期逐渐减少,同时卵母细胞中的卵黄颗粒不断增多,由此推测,滤泡内的嗜酸性颗粒起到为香螺卵母细胞发育提供营养的作用。
本试验中观察还发现,香螺雌、雄性腺发育时期不一致,精巢比卵巢提早成熟1~4个月。同样,香螺交配与产卵不同步,雌、雄个体均进化出了精子贮存结构,以适应其提前交配的繁殖方式。在采取体内交配繁殖方式的水生动物中,雄性先熟和提前交配现象均较为常见,如长蛸(Octopus minor)[29]、许氏平鲉(Sebastes schlegelii)[30]等,这被认为是一种为增加交配机会、提升后代生存概率而采用的繁殖策略。
3.3 香螺性比分析
香螺雌、雄异体,雄性触角右后方有一片状交接器,极易区分。本试验中,香螺亲本为9月采捕自山东省威海市龙须岛附近海域的样品,雌性明显偏多,且未发现性畸变及性逆转个体。推测原因可能有两方面:一是香螺为躲避高温及索饵等生理需求,存在短距离的洄游或潜沙躲避行为,且雌、雄洄游时间或出沙时间有差异,这在类似物种N.arthritica[31]中有过报道;二是香螺可能存在性逆转或性畸变现象,在其他腹足类动物[26-27]的研究中,性比偏离期望值多归因于此种原因。本次试验中无不同水温条件下野生个体采捕记录,也未观察到处于性逆转过程中的个体,香螺性比失常具体原因及相关机理尚需后续深入研究。
4 结论
1)香螺为雌、雄异体腹足类动物,雌、雄性腺发育均可分为增殖期、生长期、成熟与排放期和退化期4个阶段,雌、雄性腺发育不同步,但均为水温较低时期进入快速发育阶段。
2)雄性生殖细胞经过精原细胞、初级精母细胞、次级精母细胞、精细胞和精子5个阶段,不同生殖细胞具有分批成熟、排放的特点;雌性生殖细胞经过卵原细胞、小生长期卵母细胞、大生长期卵母细胞和成熟卵子4个阶段,同一个体中生殖细胞成熟、排放较为同步。
3)本试验条件下,同种性别不同个体间性腺发育阶段较为接近,表明本试验中的养殖模式是香螺人工苗种繁育过程中可取的种螺蓄养模式。
[1] 郭栋,刘修泽,王爱勇,等.辽东湾香螺资源的分布研究[J].水产科学,2015,34(11):718-721.GUO D,LIU X Z,WANG A Y,et al.Stock distribution of whelk Neptunea arthritica Crosse in Liaodong Bay[J].Fisheries Science,2015,34(11):718-721.(in Chinese)
[2] AN J E,CHOI J D,RYU D K.Age and growth of the Neptunea (Barbitonia) arthritica cumingii in the west sea of Korea[J].The Korean Journal of Malacology,2014,30(1):25-32.
[3] HAO Z L,YANG L M,ZHAN Y Y,et al.The complete mitochondrial genome of Neptunea arthritica cumingii Crosse(Gastropoda:Buccinidae)[J].Mitochondrial DNA Part B,Resources,2016,1(1):220-221.
[4] 郝振林,王煜,于洋洋,等.香螺肌肉营养成分分析及评价[J].大连大学学报,2016,37(6):66-70.HAO Z L,WANG Y,YU Y Y,et al.Analysis and evaluation of nutritive composition in the muscle of Neptunea arthritica cumingii Crosse (Gastropoda:Buccinidae)[J].Journal of Dalian University,2016,37(6):66-70.(in Chinese)
[5] CHUNG E Y,KIM S Y,PARK G M,et al.Germ cell differentiation and sexual maturation of the female Neptunea(Barbitonia) arthritica cumingii(Crosse,1862) (Gastropoda:Buccinidae)[J].Malacologia,2006,48:65-76.
[6] MA P Z,ZHANG T,LI H Z,et al.Construction and characterization of microsatellite markers for the neptune whelk,Neptunea cumingii[J].Molecular Biology Reports,2022,49(9):9065-9069.
[7] 隋娜.利用微卫星标记分析不同地理亚群香螺群体的遗传多样性[D].大连:辽宁师范大学,2008.SUI N.The analysis of the genetic diversity of different populations of Neptunea cumingii Crosse using SSR marker[D].Dalian:Liaoning Normal University,2008.(in Chinese)
[8] 于洋洋,李靖,吴薇,等.香螺繁殖生物学及人工繁育技术研究进展[J].河北渔业,2019(4):54-56.YU Y Y,LI J,WU W,et al.An introduction to current research of reproductive biology and artificial propagation of Naptunea cumingi Crosse[J].Hebei Fisheries,2019(4):54-56.(in Chinese)
[9] HAO Z L,LIU H Y,YU Y Y,et al.Reproductive characteristics and variations in the biochemical composition of Neptunea arthritica cumingii Crosse through embryonic development[J].Aquaculture Research,2021,52(1):1-11.
[10] 朱建业.不同饲料对香螺生长的影响及肝脏转录组分析[D].大连:大连海洋大学,2020.ZHU J Y.Effects of different feeds on the growth of snail and analysis of liver transcriptome[D].Dalian:Dalian Ocean University,2020.(in Chinese)
[11] YANG M J,FENG J E,YU Z L,et al.Comparative analysis of the feeding habits of Rapana venosa and Neptunea arthritica cumingii near Zhangzi Island,China,based on stable isotope ratios and fatty acid profiles[J].Aquaculture Research,2021,52(5):1846-1854.
[12] 张旭峰,杨大佐,周一兵,等.温度、盐度对香螺幼螺耗氧率和排氨率的影响[J].大连海洋大学学报,2014,29(3):251-255.ZHANG X F,YANG D Z,ZHOU Y B,et al.Impacts of temperature and salinity on oxygen consumption rate and ammonia excretion rate in juvenile whelk Neptunea cumingii[J].Journal of Dalian Ocean University,2014,29(3):251-255.(in Chinese)
[13] YU Z L,HU Z,SONG H,et al.Aggregation behavior of juvenile Neptunea cumingii and effects on seed production[J].Journal of Oceanology and Limnology,2020,38(5):1590-1598.
[14] PARK G,KIM Y H,KIM E J,et al.Oogenesis and reproductive cycle in Neptunea (Barbitonia) arthritica cumingii on the west coast of Korea[J].Korean Journal of Malacology,2006,22(1):1-11.
[15] 高岩,侯林,周革.香螺卵母细胞营养方式的研究[J].安徽农学通报,2008,14(11):36-38.GAO Y,HOU L,ZHOU G.Study on nutritional mode of oogenesis in Naptunea cumingi Crosse(Gastropoda:Prosobranchia)[J].Anhui Agricultural Science Bulletin,2008,14(11):36-38.(in Chinese)
[16] OKUMU![]()
![]() H P.Seasonal variations in the meat weight,condition index and biochemical composition of mussels (Mytilus edulis L.) in suspended culture in two Scottish Sea lochs[J].Aquaculture,1998,159(3/4):249-261.
H P.Seasonal variations in the meat weight,condition index and biochemical composition of mussels (Mytilus edulis L.) in suspended culture in two Scottish Sea lochs[J].Aquaculture,1998,159(3/4):249-261.
[17] POWER A J,KEEGAN B F.Seasonal patterns in the reproductive activity of the red whelk,Neptunea antiqua (Mollusca:Prosobranchia) in the Irish Sea[J].Journal of the Marine Biological Association of the United Kingdom,2001,81(2):243-250.
[18] FUJINAGA K,OYAMA Y.Reproductive ecology of the neptune whelk Neptunea polycostata with special reference to maturity size,reproductive cycle,and sex ratio[J].Nippon Suisan Gakkaishi,2007,73(2):256-262.
[19] 毕进红,李琪,张志新,等.山东沿海脉红螺的性腺发育和生殖周期[J].中国水产科学,2015,22(6):1243-1252.BI J H,LI Q,ZHANG Z X,et al.Gonadal maturation and the reproductive cycle of Rapana venosa along the coast of Shandong Province[J].Journal of Fishery Sciences of China,2015,22(6):1243-1252.(in Chinese)
[20] 柯才焕,李复雪.台湾东风螺的生殖腺组织学和生殖周期[J].台湾海峡,1991,10(3):21-28,103-104.KE C H,LI F X.Histology of gonad and reproductive cycle of Babylonia formosae[J].Journal of Oceanography in Taiwan Strait,1991,10(3):21-28,103-104.(in Chinese)
[21] FENG J X,GAO Q F,DONG S L,et al.Trophic relationships in a polyculture pond based on carbon and nitrogen stable isotope analyses:a case study in Jinghai Bay,China[J].Aquaculture,2014,428/429:258-264.
[22] 韩森荣.皮氏蛾螺经济性状与繁殖生物学的初步研究[D].大连:大连海洋大学,2022.HAN S R.Preliminary study on economic characters and reproductive biology of Volutharpa ampullacea Perryi[D].Dalian:Dalian Ocean University,2022.(in Chinese)
[23] 朱星海,孙红振,杨祖晶,等.风信标扇贝的性腺发育与繁殖周期规律研究[J].中国海洋大学学报(自然科学版),2019,49(2):52-58.ZHU X H,SUN H Z,YANG Z J,et al.Studies on gonadal development and the reproductive cycle of Patinopecten caurinus[J].Periodical of Ocean University of China(Natural Sciences Edition),2019,49(2):52-58.(in Chinese)
[24] BÖTTGER S A,MCCLINTOCK J B.Effects of inorganic and organic phosphate exposure on aspects of reproduction in the common sea urchin Lytechinus variegatus (Echinodermata:Echinoidea)[J].The Journal of Experimental Zoology,2002,292(7):660-671.
[25] CHUNG E Y,KIM S Y,RYOU D K.Ultrastructure of germ cells during spermatogenesis and structural changes in the seminal vesicle in male Neptunea (Barbitonia) arthritica cumingii (Crosse,1862)[J].Fisheries and Aquatic Sciences,2005,8(1):17-26.
[26] 曹伏君,罗杰,李长玲,等.细角螺的生殖系统组织学研究[J].热带海洋学报,2010,29(6):57-64.CAO F J,LUO J,LI C L,et al.Study on the reproductive system of Hemifusus ternatanus[J].Journal of Tropical Oceanography,2010,29(6):57-64.(in Chinese)
[27] 区小玲,苏翔驹,何俊锋,等.广西北部湾管角螺性腺发育与繁殖规律研究[J].中国海洋大学学报(自然科学版),2015,45(11):20-28.OU X L,SU X J,HE J F,et al.Studies on the gonadal development and reproductive pattern of Hemifusus tuba (Gmelin) inhabiting beibu gulf,Guangxi,China[J].Periodical of Ocean University of China(Natural Sciences Edition),2015,45(11):20-28.(in Chinese)
[28] 李霞.水产动物组织胚胎学[M].2版.北京:中国农业出版社,2019:76-77.LI X.Histoembryology of aquatic animals[M].2nd ed.Beijing:China Agriculture Press,2019:76-77.(in Chinese)
[29] 刘畅.长蛸生活史养殖技术研究[D].青岛:中国海洋大学,2013.LIU C.Studies on culture of the life cycle of Octopus minor(Sasaki,1920)[D].Qingdao:Ocean University of China,2013.(in Chinese)
[30] 李睿.许氏平鲉(Sebastes schlegelii)卵巢中精子的定位及精子储存机制的初探[D].青岛:中国海洋大学,2019.LI R.Localization of sperm in ovary of Sebastes schlegelii and preliminary study on the mechanism of sperm storage[D].Qingdao:Ocean University of China,2019.(in Chinese)
[31] FUJINAGA K.Ecological studies on the life history of the neptune whelk Neptunea arthritica[J].Memoirs of the Graduate School of Fisheries Sciences,Hokkaido University,2003,50(1):1-61.