弧菌病是世界范围内水产养殖中的主要病害之一,其中,鳗弧菌(Vibrio anguillarum)是海水鱼养殖中常见的条件致病菌,常伴随较高的死亡率,在世界许多国家和地区均有报道[1]。1893 年,Canestrini[2]首次从鳗鲡(Anguilla japonica)中分离得到该菌,将其命名为Bacterium anguillarum,后由Bergeman[3]在1909年将其命名为Vibrio anguillarum(鳗弧菌)。鳗弧菌能导致斜带石斑鱼(Epinephelus coioides)[4]、半滑舌鳎(Cynoglossus semilaevis)[5]和虹鳟(Oncorhynchus mikiss)[6]等多种鱼类患出血性败血症,发病症状通常为体表不同程度的充血、出血、溃烂和肌肉坏死。目前,对鳗弧菌的鉴定,除传统的生理生化方法外,还有通过测定16S rRNA、hsp 60基因[7]序列及使用基于vah4和rtxA两种毒力基因设计的特异性引物进行双重PCR检测[8]等其他研究方法。
多纹钱蝶鱼(Selenotoca multifasciata)隶属于金钱鱼科(Scatophagidae)钱蝶鱼属(Selenotoca),俗称“银鼓鱼”,广泛分布于印度尼西亚、泰国、大洋洲及中国等多数地区[9]。多纹钱蝶鱼具有耐高温、抗病性强、生长周期短和生长速度快等特点,兼具观赏和食用价值,市场应用前景广阔。目前,有关多纹钱蝶鱼病害方面的研究较少,仅见罗璋等[10]和杨林狄等[11]从暴发疾病的天津和北部湾养殖区多纹钱蝶鱼中分离鉴定出海豚链球菌。
2023年2月,广西壮族自治区钦州市某网箱养殖区多纹钱蝶鱼病害频发,并造成大量死亡。患病鱼主要症状表现为反应迟钝,食欲减退,单侧眼球突出、充血,体表溃烂。为探究疾病暴发的原因,现场采集患病多纹钱蝶鱼的病原菌,并对其进行分离鉴定、毒力基因检测、药物敏感性试验及致病性研究,以期为该病的致病机理研究及有效防控提供科学参考。
1 材料与方法
1.1 材料
具有典型患病症状的濒死多纹钱蝶鱼采自广西壮族自治区钦州市某养殖网箱,发病水域水温为18.3 ℃,pH为8.02,盐度为28.12,溶解氧为9.14 mg/L。病鱼体质量为0.7~1.0 kg,体长为22~25 cm;健康多纹钱蝶鱼采自湛江市某养殖场,体质量为 7~10 g,体长为 5.5~8.0 cm,在水温为 20~22 ℃的塑料大桶中暂养7 d,确认无发病和死亡后进行人工回归感染试验。
细菌生化鉴定管、抗菌药物均购自杭州微生物试剂有限公司;细菌 DNA 提取试剂盒购自天根生化科技有限公司;PCR 所用试剂均购自大连宝生物有限公司;引物合成均由生工生物工程(广州)有限公司完成。
1.2 方法
1.2.1 病原菌分离纯化 挑取患病鱼的肝、脾和肾组织及皮肤溃烂处组织,划线接种于胰酪大豆胨琼脂(TSA)上,在生化培养箱28 ℃下倒置培养24 h,对菌落形态进行观察。挑取长势相似、形态一致的单个菌落进行纯化培养,纯化2~3次后得到单一优势菌株,收集后添加甘油于-80 ℃冰箱中保存。
1.2.2 菌株形态及生化特征分析 将分离获得的纯培养菌接种于 TSA 平板和硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(TCBS)平板上,于28 ℃下倒置培养,并挑取单菌落进行革兰氏染色,观察其菌落形态;在羊血琼脂平板上划线,28 ℃下恒温倒置培养24~48 h后观察是否有溶血圈;挑取单菌落接种于细菌生化反应管中,根据《常见细菌系统鉴定手册》[12]对菌株进行初步鉴定。
1.2.3 16S rRNA和dnaJ基因序列测定 利用细菌DNA提取试剂盒提取分离菌株的基因组DNA,然后分别采用16S rRNA基因引物27F/1492R和dnaJ基因引物进行PCR扩增(表1)。PCR体系和反应条件均参照伍元植等[13]的方法。扩增获得的PCR产物送至生工生物工程(广州)有限公司进行测序。将测序结果上传至NCBI中,用BLASTn程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行Blast比对,并使用MEGA 7.0软件构建N-J 系统发育树。
表1 引物信息
Tab.1 Information of the primers

基因 gene引物序列(5′-3′) sequence of primer(5′-3′) 目标条带/bp product size退火温度/℃annealing temp16S rRNAF:AGAGTTTGATCMTGGCTCAGR:GGTTACCTTGTTACGACTT1 50055[14]dnaJF:GTGATTTTTACGAAGTATTAGGCR:GGTTAAATCRTCRAARAACTT1 13055[15]vah1F:GCTAGGAGCTCTACGCGAGTGTTTTGR:GCTAGTCTAGATTTGCGCGTTATTAG40060[16]empAF:TCCTCGCAGCCTCTATR:TGGTAACGGACTTTGACTT18460[17]virCF:TCCTTCCTTGTGGTTAGCATTGR:GCCTCCGCAATAATCCAGTC34455[18]virAF:TTATTGGGCCTTTCGGATACTGR:CTGGGTAACCTGTCGGATTATC46855[18]angMF:CCTGAAGTTGAGCCTCGTAAGR:CGCTTTGATGCTGAAGTTGAC50055[18]ompUF:TTTGGTTGTACGTTAGTGAAGGTTR:AAGCAGGCGTTTTAAATCTATGAC1 15650[19]flaAF:ATAGCGGATTTAGCAAGTR:CAGAGCCAATGTGGAGAT1 41452[20]
1.2.4 人工感染试验 健康多纹钱蝶鱼暂养7 d后,随机分为16组,每组20尾鱼。将上述分离的鳗弧菌菌株用胰酪大豆胨液体培养基(TSB)活化8 h,采用平板计数法计数,用无菌PBS(0.1 mol/L,pH 7.4)10倍梯度稀释成5个浓度组(108~104 CFU/mL)的菌悬液,对试验组每尾鱼腹腔注射50 μL菌悬液,对照组注射等量PBS,然后分别置于0.3 m3的玻璃钢水桶中,每天换水1次,换水量为1/3,攻毒注射后观察14 d,每天观察3次,及时对濒死试验鱼进行剖检,并记录试验鱼的异常行为,再挑取肝、脾、肾组织及溃烂处组织进行细菌分离鉴定,以生理生化检测结果及16S rRNA 和dnaJ基因序列分析作为重新分离回收到原感染菌的判定指标。采用改良寇氏法[21]进行数据处理,求出各试验组中受试动物的半数致死量(median lethal dose,LD50)。
1.2.5 毒力基因检测 采用PCR检测菌株溶血素基因vah1、金属蛋白基因empA、细菌鞭毛蛋白基因flaA、外膜蛋白基因ompU、铁吸收系统核糖体多肽合成酶基因angM及细胞表面成分抗原合成有关蛋白基因virA和virC等毒力相关基因的携带情况。各毒力基因引物序列、退火温度及扩增片段大小见表1。PCR体系同“1.2.3节”。扩增产物由生工生物工程(广州)有限公司进行测序。
1.2.6 组织病理学观察 取正常和自然感染发病的多纹钱蝶鱼各组织置于体积分数为10%的中性福尔马林中固定,用乙醇洗涤数次后逐级脱水,在二甲苯溶液中透明后进行石蜡包埋、切片(4~6 μm)和伊红染色,在显微镜下观察并对典型病变组织进行拍照。
1.2.7 药敏试验 参考贾春红等[22]的方法,对3株菌进行29种抗菌药物敏感性测定,根据药敏纸片生产厂家推荐的判断标准,结合美国临床实验室标准化协会(CLSI)药敏试验判断标准判断药敏结果。
2 结果与分析
2.1 患病多纹钱蝶鱼的临床症状
患病鱼离群独游,眼球突出、眼眶周围充血(图 1A、B),体表明显出血、溃烂(图1C、D),腹部膨大,有较多腹水,泄殖腔突出(图1E),体表溃烂(图 1F)。剖检可见,肠道红肿且充满黏稠液体(图1G、H),肝脏呈土黄色,脾脏肿大(图1G、I)。

A~F—外观症状;G~I—内脏器官症状。
A-F—exterior symptoms;G-I—symptoms of visceral organs.
图1 患病多纹钱蝶鱼的临床症状
Fig.1 Clinical symptoms of diseased Selenotoca multifasciata
2.2 病原菌鉴定
2.2.1 菌落及菌体形态 菌株在TCBS培养基中培养48 h后,形成微微隆起的黄色、圆形且边缘整齐的光滑菌落(图2A);革兰氏染色观察均为两端钝圆的短杆状革兰氏阴性菌(图 2B);在TSA固体培养基中培养24 h后,形成乳白色微凸圆润菌落(图2C);在血琼脂平板培养基上形成 β 溶血的菌落(图2D)。
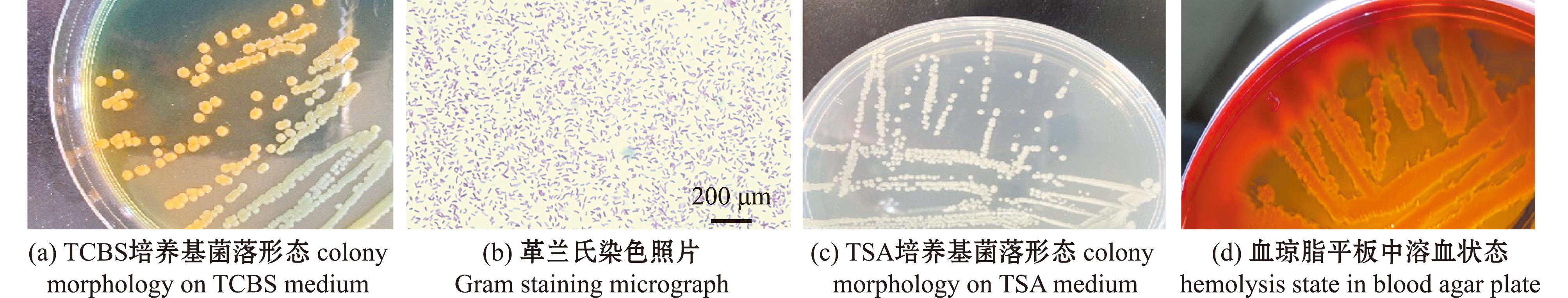
图2 分离菌株的菌落和菌体形态特征
Fig.2 Colony and morphological characteristics of isolated strains
2.2.2 生理生化特征 3 株分离菌株在4、15、28、35 ℃下均能生长,可在3%~8% NaCl胨水中生长;菌株均可发酵葡萄糖、蔗糖、甘露糖和阿拉伯糖,不发酵肌醇;V-P试验均呈阳性,赖氨酸、β-半乳糖苷酶、精氨酸双水解酶均呈阴性(表2)。
表2 菌株QZ991、QZ992、QZ993的主要生化指标检测
Tab.2 Main biochemical characteristics of QZ991,QZ992,and QZ993 strains
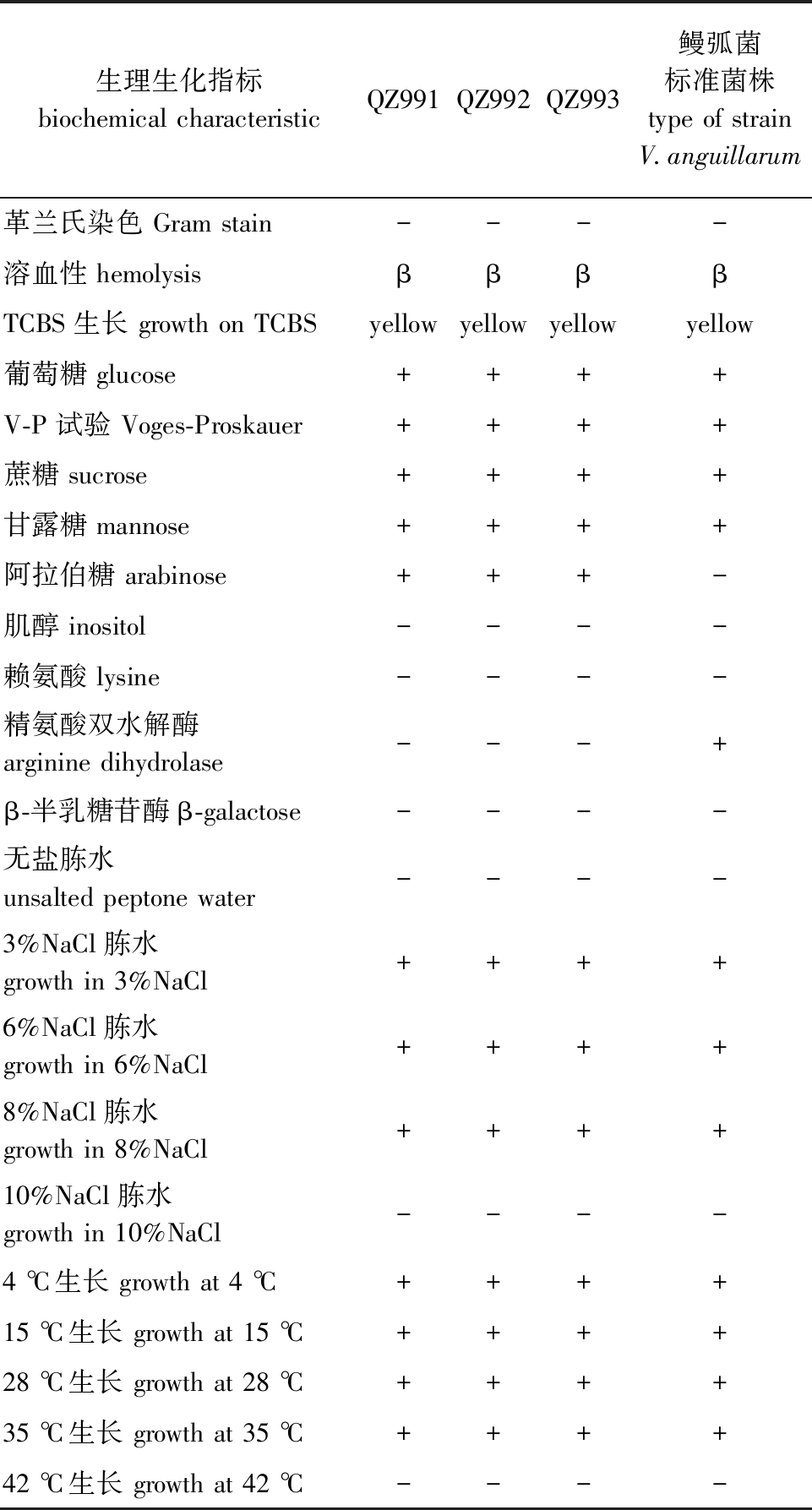
注:+表示结果为阳性;-表示结果为阴性。
Note:+represents positive reaction results;-represents negative reaction results.
生理生化指标biochemical characteristicQZ991QZ992QZ993鳗弧菌标准菌株 type of strain V.anguillarum革兰氏染色 Gram stain----溶血性 hemolysisββββTCBS生长 growth on TCBS yellowyellowyellowyellow葡萄糖 glucose++++V-P试验 Voges-Proskauer++++蔗糖 sucrose++++甘露糖 mannose++++阿拉伯糖 arabinose+++-肌醇 inositol----赖氨酸 lysine----精氨酸双水解酶 arginine dihydrolase---+β-半乳糖苷酶β-galactose----无盐胨水 unsalted peptone water----3%NaCl胨水 growth in 3%NaCl++++6%NaCl胨水 growth in 6%NaCl++++8%NaCl胨水 growth in 8%NaCl++++10%NaCl胨水 growth in 10%NaCl----4 ℃生长 growth at 4 ℃++++15 ℃生长 growth at 15 ℃++++28 ℃生长 growth at 28 ℃++++35 ℃生长 growth at 35 ℃++++42 ℃生长 growth at 42 ℃----
2.2.3 分子生物学鉴定 分离菌株的16S rRNA和dnaJ基因PCR扩增产物大小与预计符合,将测定的序列分别在 NCBI上进行Blast比对分析,结果显示,3株分离菌均与鳗弧菌同源性最高,一致性均达到99%以上。基于16S rRNA和dnaJ基因构建的N-J系统发育树显示,3株菌均与鳗弧菌聚为一支(图3、图4)。结合生理生化试验结果和分子生物学鉴定结果,最终确认分离病原菌为鳗弧菌。

图3 基于 16S rRNA 基因构建的系统进化树
Fig.3 Phylogenetic tree reconstructions based on analysis of the 16S rRNA gene
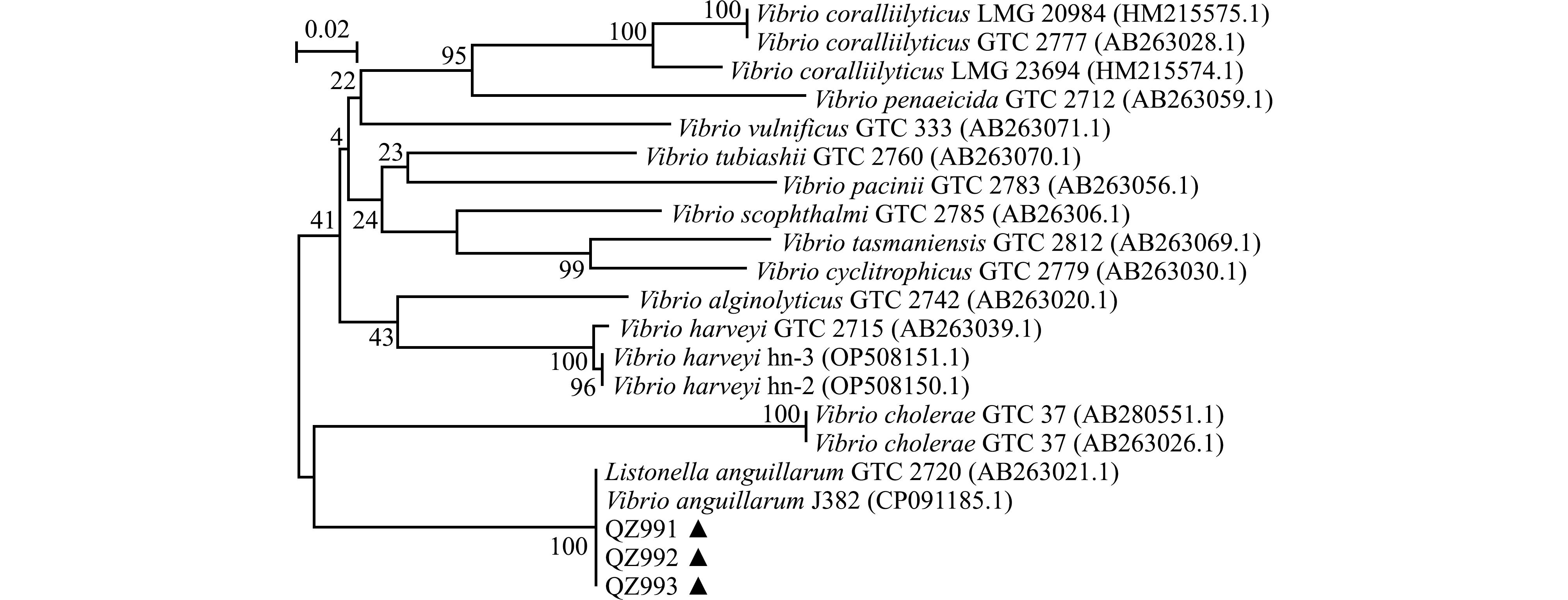
图4 基于dnaJ基因构建的系统进化树
Fig.4 Phylogenetic tree reconstructions based on analysis of the dnaJ gene
2.3 人工感染试验
3株分离菌株的LD50分别为5.10×105、4.33×105、2.45×106 CFU/mL,试验组鱼在感染后活力减弱,集中死亡时间节点为 24 h(表3),体表出现较大面积的溃烂灶,皮肤肌肉坏死、溶解,腹部膨胀,鳃盖充血(图5A、B),眼球突出、浑浊(图5C),个别鱼体吻部红肿(图 5D)。解剖可见,腹腔充满积液,肠内充满淡黄色黏液,脾脏肿大,肝脏充血(图5E、F),与自然感染发病多纹钱蝶鱼相似。从濒死鱼病灶处分离纯化的菌株,经再次鉴定确认为原感染菌,对照组鱼无发病死亡。

A~D—外观症状;E、F—内脏器官症状。
A-D—exterior symptoms;E and F—symptoms of visceral organs.
图5 人工感染发病多纹钱蝶鱼主要症状
Fig.5 Main symptoms of artificially infected Selenotoca multifasciata
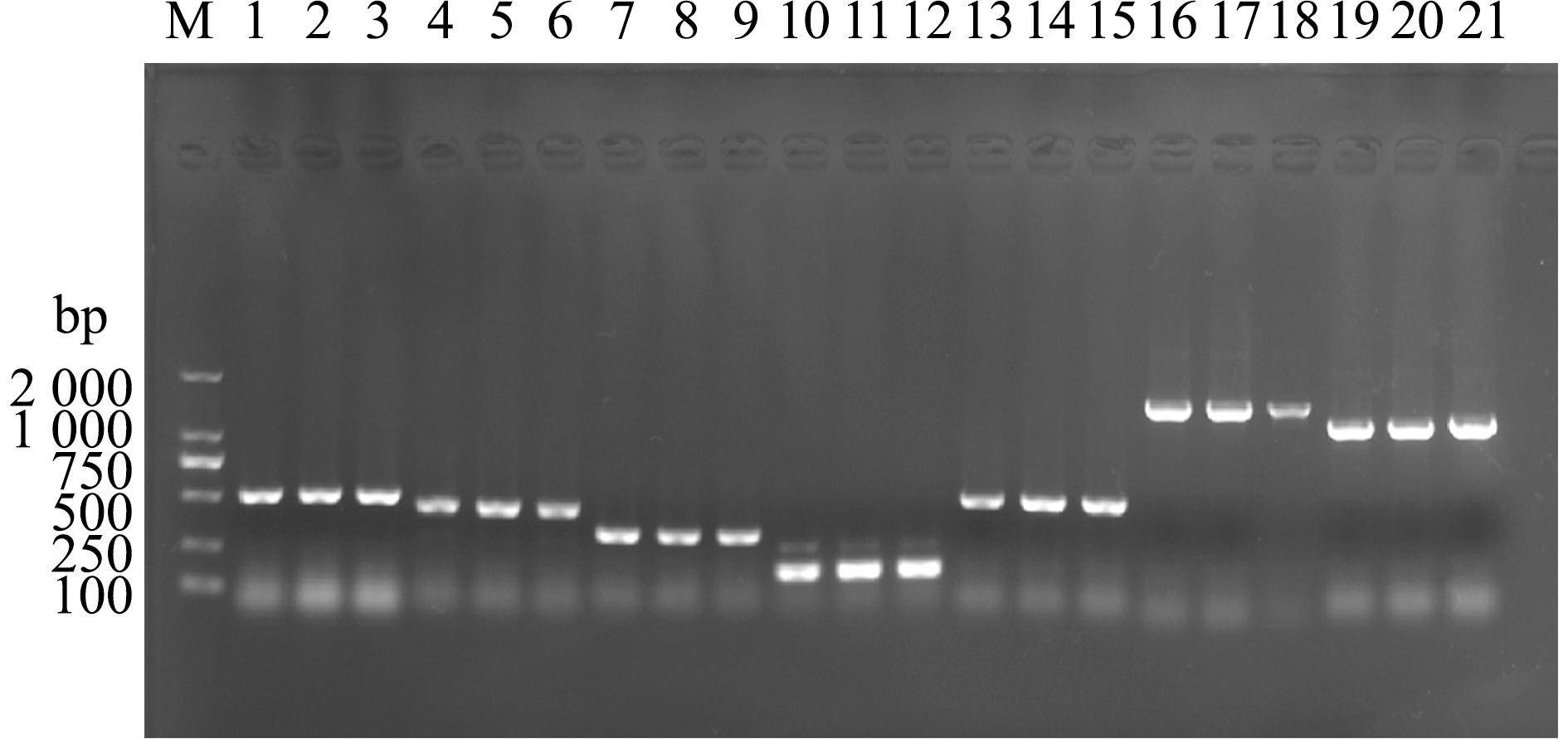
M—DNA marker 2000;1,2,3—virA;4,5,6—vah1;7,8,9—virC;10,11,12—empA;13,14,15—angM;16,17,18—flaA;19,20,21—ompU;1,4,7,10,13,16,19—QZ991;2,5,8,11,14,17,20—QZ992;3,6,9,12,15,18,21—QZ993.
图6 鳗弧菌主要毒力基因的PCR检测
Fig.6 PCR detection of major virulence genes of Vibrio anguillarum
表3 鳗弧菌攻毒多纹钱蝶鱼结果
Tab.3 Results of Selenotoca multifasciata infected with Vibrio anguillarum
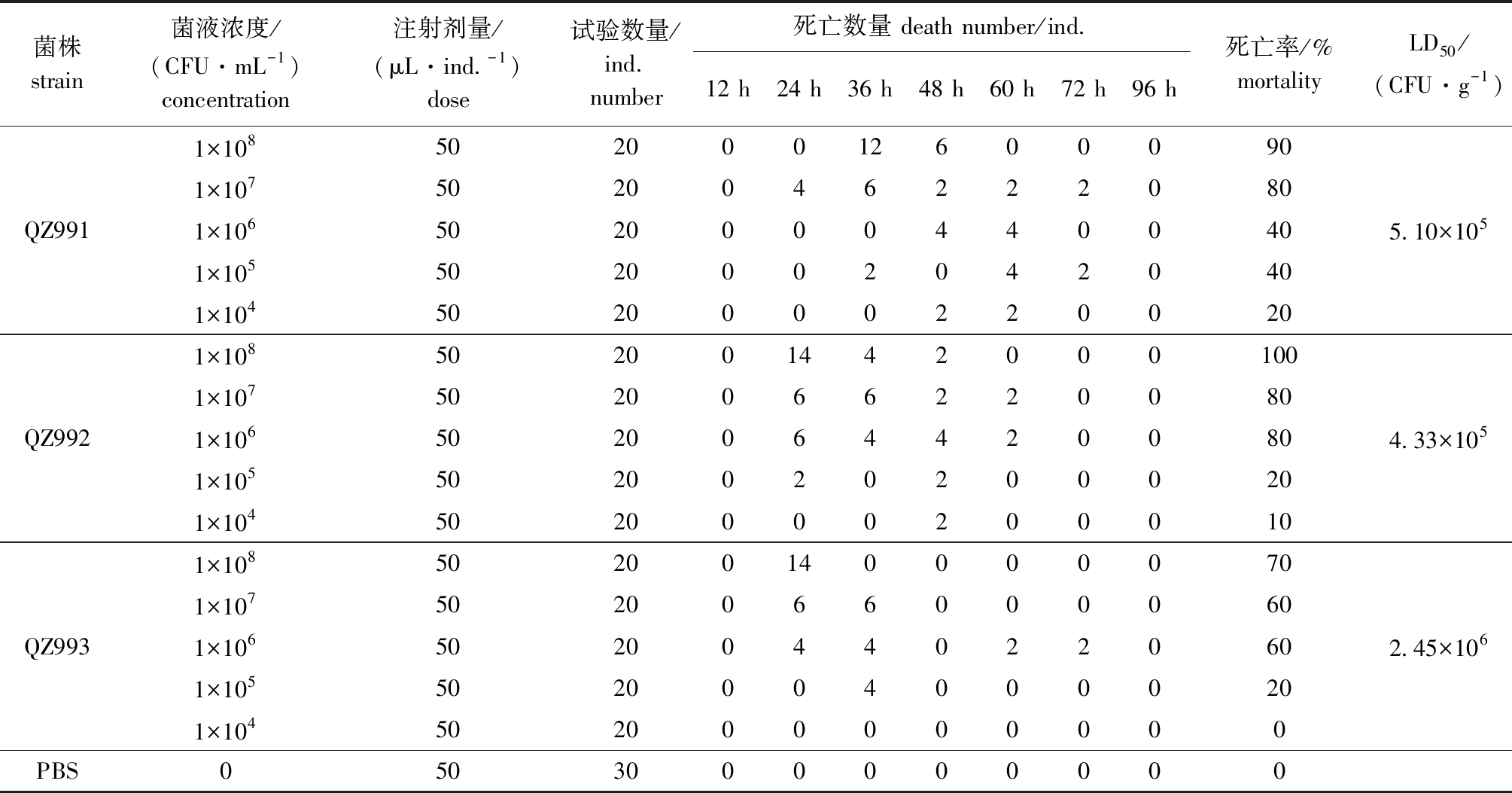
菌株strain菌液浓度/(CFU·mL-1)concentration注射剂量/(μL·ind.-1)dose试验数量/ind.number死亡数量 death number/ind.12 h24 h36 h48 h60 h72 h96 h死亡率/%mortalityLD50/(CFU·g-1)1×108502000126000901×1075020046222080QZ9911×10650200004400405.10×1051×10550200020420401×10450200002200201×1085020014420001001×1075020066220080QZ9921×10650200644200804.33×1051×10550200202000201×10450200002000101×108502001400000701×1075020066000060QZ9931×10650200440220602.45×1061×10550200040000201×104502000000000PBS0503000000000
2.4 毒力基因检测
对3株鳗弧菌的virA、vah1、virC、empA、angM、flaA、ompU 7种毒力基因进行PCR检测,均扩增出了预期大小的片段(图 6)。将测序获得的序列通过Blast比对,发现这7种毒力基因与鳗弧菌序列的一致性为99%~100%,表明3株鳗弧菌均含有7种主要的毒力基因。
2.5 组织病理学变化
对患病鱼组织病理观察发现,与健康多纹钱蝶鱼病理切片(图 7A~H)对比均有不同程度的病变,患病多纹钱蝶鱼眼球的脉络膜血管细胞崩解、脱落(图7a);鳃有炎症细胞浸润,鳃小片坏死脱落(图7b);肠道固有膜充血并伴随炎性细胞浸润现象(图7c);心肌间质水肿伴炎症细胞浸润,间隙增大,有出血现象(图7d);肝细胞肿胀、空泡化,结缔组织间出现炎性细胞浸润现象(图7e);脾有多处局灶性坏死(图7f);肾有病理性充血和炎性细胞浸润现象,肾小管萎缩(图7g);脑膜疏松,毛细血管充血伴随淋巴细胞浸润(图7h)。
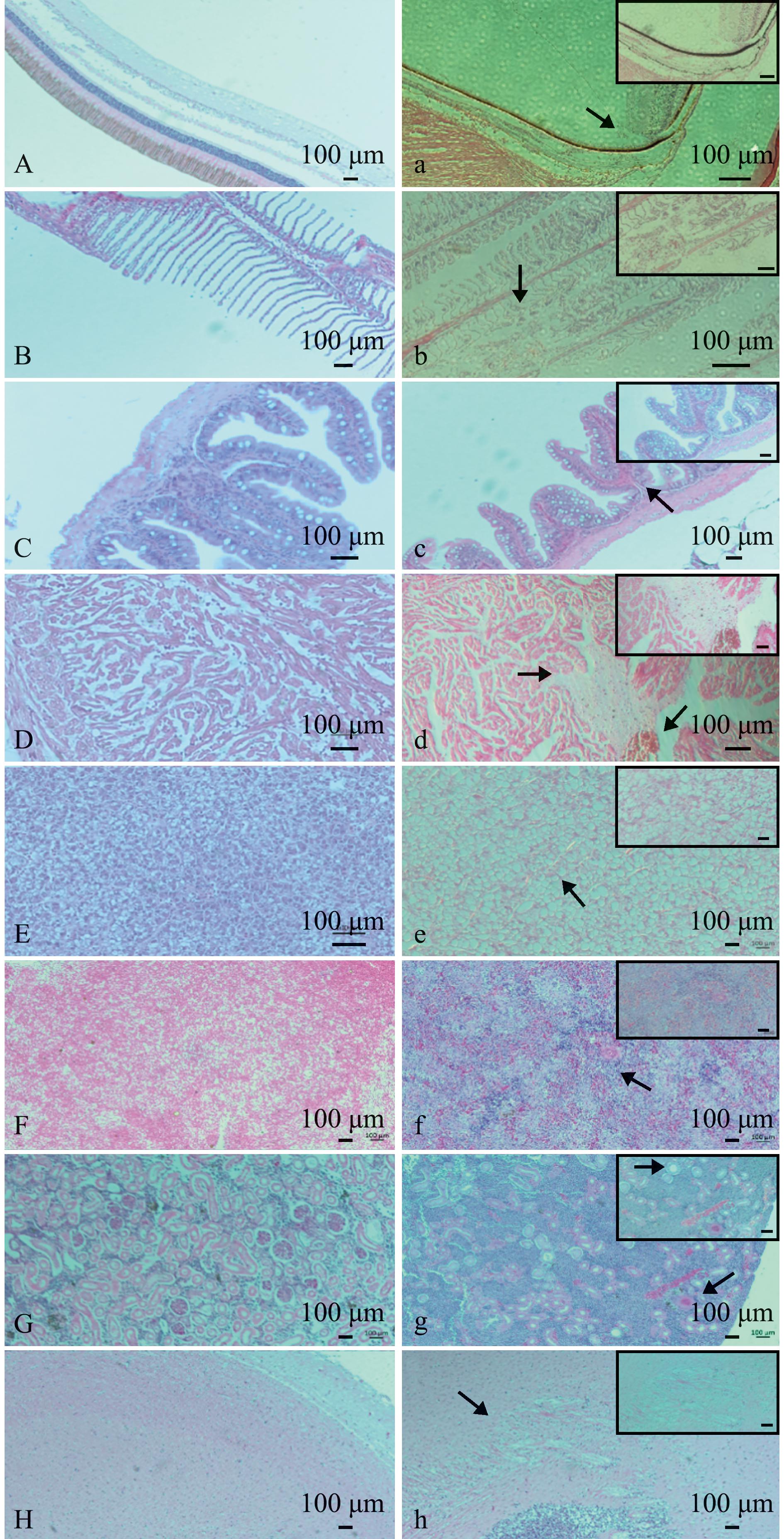
A~H—正常鱼的眼球、鳃丝、肠道、心肌、肝脏、脾脏、肾脏和脑组织;a~h—患病鱼的眼球、腮丝、肠道、心肌、肝脏、脾脏、肾脏和脑组织。
A-H—normal eyeball,gill filament,intestinal tract,myocardium appearance,liver,spleen,kidney,and brain;a-h—diseased eyeball,gill filament,intestinal tract,myocardium,liver,spleen,kidney,and brain.
图7 多纹钱蝶鱼感染鳗弧菌后的组织病理学变化
Fig.7 Histopathological changes in Selenotoca multifasciata infected with Vibrio anguillarum
2.6 药敏试验
3株鳗弧菌均对多粘菌素B、庆大霉素、四环素类、喹诺酮类和多数头孢烯类(头孢呋辛、头孢他啶、头孢曲松和头孢哌酮)表现为敏感;均对头孢氨苄、头孢拉定、万古霉素、克林霉素、大环内酯类和多数β-内酰胺类(青霉素、苯唑西林、氨苄西林、羧苄西林)表现为耐药;而对丁胺卡那、卡那霉素、新霉素、米诺环素、哌拉西林、复方新诺明表现出不同的敏感性(表4)。
表4 鳗弧菌 QZ991、QZ992、QZ993对不同抗菌药物的敏感性
Tab.4 Antibacterial activities of Vibrio anguillarum pathogens QZ991,QZ992,and QZ993 to different antimicrobial agents
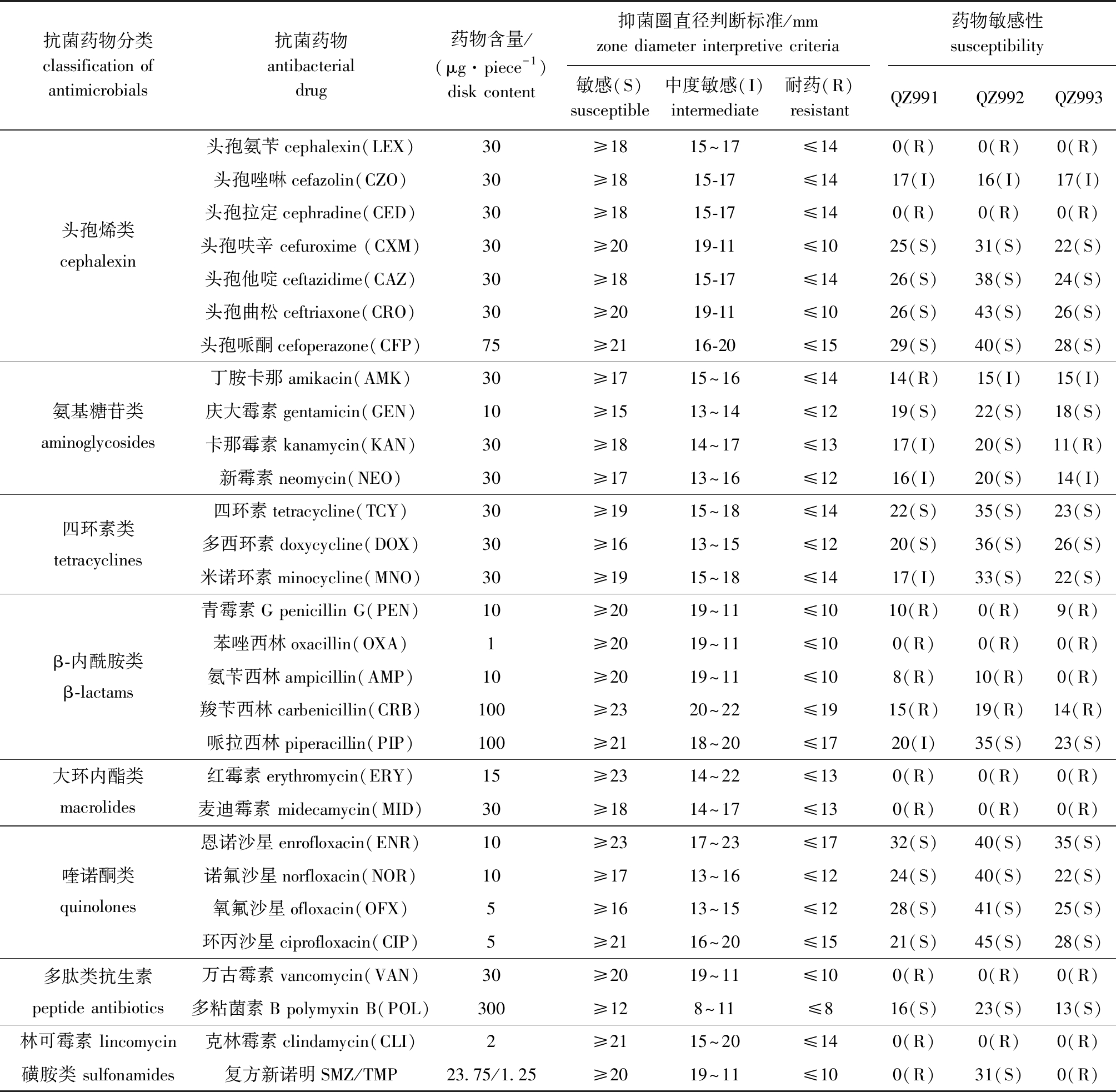
抗菌药物分类classification of antimicrobials抗菌药物antibacterial drug药物含量/(μg·piece-1)disk content抑菌圈直径判断标准/mmzone diameter interpretive criteria药物敏感性susceptibility敏感(S)susceptible中度敏感(I)intermediate耐药(R)resistantQZ991QZ992QZ993头孢氨苄cephalexin(LEX)30≥1815~17≤140(R)0(R)0(R)头孢唑啉cefazolin(CZO)30≥1815-17≤1417(I)16(I)17(I)头孢拉定cephradine(CED)30≥1815-17≤140(R)0(R)0(R)头孢烯类cephalexin头孢呋辛 cefuroxime (CXM)30≥2019-11≤1025(S)31(S)22(S)头孢他啶ceftazidime(CAZ)30≥1815-17≤1426(S)38(S)24(S)头孢曲松ceftriaxone(CRO)30≥2019-11≤1026(S)43(S)26(S)头孢哌酮cefoperazone(CFP)75≥2116-20≤1529(S)40(S)28(S)丁胺卡那amikacin(AMK)30≥1715~16≤1414(R)15(I)15(I)氨基糖苷类aminoglycosides庆大霉素gentamicin(GEN)10≥1513~14≤1219(S)22(S)18(S)卡那霉素kanamycin(KAN)30≥1814~17≤1317(I)20(S)11(R)新霉素neomycin(NEO)30≥1713~16≤1216(I)20(S)14(I)四环素tetracycline(TCY)30≥1915~18≤1422(S)35(S)23(S)四环素类tetracyclines多西环素doxycycline(DOX)30≥1613~15≤1220(S)36(S)26(S)米诺环素minocycline(MNO)30≥1915~18≤1417(I)33(S)22(S)青霉素G penicillin G(PEN)10≥2019~11≤1010(R)0(R)9(R)苯唑西林oxacillin(OXA)1≥2019~11≤100(R)0(R)0(R)β-内酰胺类β-lactams氨苄西林ampicillin(AMP)10≥2019~11≤108(R)10(R)0(R)羧苄西林carbenicillin(CRB)100≥2320~22≤1915(R)19(R)14(R)哌拉西林piperacillin(PIP)100≥2118~20≤1720(I)35(S)23(S)大环内酯类macrolides红霉素erythromycin(ERY)15≥2314~22≤130(R)0(R)0(R)麦迪霉素 midecamycin(MID)30≥1814~17≤130(R)0(R)0(R)恩诺沙星enrofloxacin(ENR)10≥2317~23≤1732(S)40(S)35(S)喹诺酮类quinolones诺氟沙星norfloxacin(NOR)10≥1713~16≤1224(S)40(S)22(S)氧氟沙星ofloxacin(OFX)5≥1613~15≤1228(S)41(S)25(S)环丙沙星ciprofloxacin(CIP)5≥2116~20≤1521(S)45(S)28(S)多肽类抗生素peptide antibiotics万古霉素vancomycin(VAN)30≥2019~11≤100(R)0(R)0(R)多粘菌素B polymyxin B(POL)300≥128~11≤816(S)23(S)13(S)林可霉素 lincomycin克林霉素clindamycin(CLI)2≥2115~20≤140(R)0(R)0(R)磺胺类 sulfonamides复方新诺明SMZ/TMP23.75/1.25≥2019~11≤100(R)31(S)0(R)
3 讨论
3.1 菌株的分离鉴定
鳗弧菌感染宿主范围较广,是一种对多种鱼类、甲壳类动物和双壳类动物具有强致病性的细菌,有超过90种水生生物对鳗弧菌易感[23],其感染过程在宿主中进展迅速,宿主在初次接触病原体后2 d内就会引起感染,最快可在5 d内死亡[24]。
本研究中,3株菌的形态学、生理生化鉴定结果显示,菌株与文献中描述的鳗弧菌特性最为相似[25],但在发酵阿拉伯糖和精氨酸双水解酶反应中结果不一致,推测出现偏差可能与菌株宿主来源、地理环境和自身变异等因素有关。另外,由于有些菌株无法通过传统鉴定方法准确鉴定到菌种[12],且仅以16S rRNA基因对弧菌的鉴定及系统发育学分析易导致错误判断结果[26]。因此,许多学者致力于寻找其他单拷贝的功能基因作为新的分子鉴定标准。有研究发现,dnaJ基因在不同弧菌种内高度保守且具有较好的分辨率,基于dnaJ基因建立的弧菌PCR检测方法具有便捷、准确的优点[16]。为提高准确度,本研究中利用生化鉴定并结合16S rRNA和dnaJ基因扩增的方法进行弧菌鉴定,以16S rRNA和dnaJ为分子标记构建的系统发育树均显示,3株优势菌与鳗弧菌聚为一支,同时,以dnaJ为分子标记的系统发育树还准确地将同种弧菌聚为一支,由此证实,dnaJ基因适于弧菌属细菌的种间分类。
3.2 鳗弧菌的致病性
鳗弧菌主要通过其致病因子作用于宿主产生致病性。目前,研究人员已鉴定出多种与鳗弧菌致病过程有关的毒力因子,包括溶血素(Hemolysin)、胞外酶(Metalloprotease)、鞭毛蛋白(Flagellin)、外膜蛋白(Outer membrane protein,OMP)、铁吸收系统(Siderophor)等[27-28]。基于此,本研究中为深入探讨分离株的致病能力,选用溶血素基因vah1、金属蛋白酶基因empA、细菌鞭毛蛋白基因flaA、外膜蛋白基因ompU、铁吸收系统核糖体多肽合成酶基因angM、细胞表面成分抗原合成有关蛋白基因virA和virC 7 种毒力基因进行检测,结果均成功扩增并经测序验证,3 株鳗弧菌均含有 7 种毒力基因。利用分离的病原进行回归感染后发现,该菌株能复制自然发病多纹钱蝶鱼的体表溃烂、腹腔积液和肠道膨胀等症状,且可从患病个体中再次分离得到该菌株。QZ991、 QZ992、 QZ993的LD50分别为5.10×105、 4.33×105、 2.45×106 CFU/mL,结合7 种与致病力相关毒力基因的检测结果,提示本研究中分离的菌株对多纹钱蝶鱼有较强的致病性。
感染鳗弧菌的典型外部临床症状包括皮肤溃疡、眼球突出和肠道膨胀,此外,肛门、鼻腔、鳃和口也是鱼类感染鳗弧菌外部症状的区域,可见其体表病变症状较多,且差异明显[29]。本研究中,未观察到广西壮族自治区网箱患病多纹钱蝶鱼表现出特殊症状,但值得注意的是,菌株自然感染和人工感染多纹钱蝶鱼的肝脏表现出不同症状,前者呈苍白贫血状态,后者呈充血状态。对于肝脏病变表现出的差异,在以往研究中也有呈土黄色[30]或出血发红[7]的报道。Schmidt等[31]也发现,鳗弧菌同一菌株感染可表现出不同的临床症状,这可能与感染方式有关。另外,本研究中溃疡病多纹钱蝶鱼的病理损伤多集中在鳃、肝脏和肠道等组织中,具体表现为鳃小片坏死脱落,肠道固有膜充血,肝细胞肿胀、空泡化,这与其他鱼类如虹鳟(Oncorhynchus mykis)[32]、欧洲鳗鲡(Anguilla anguilla)[33]感染鳗弧菌的病理特征相似。在患病多纹钱蝶鱼的其余组织器官中均观察到病理改变,提示鳗弧菌可造成多纹钱蝶鱼系统性的病理损伤。
3.3 鳗弧菌病害的控制
国内外曾有学者对不同来源鳗弧菌分离株进行药敏试验,结果表明,抗生素耐药性存在空间差异,可能与不同区域使用的抗生素类型差异和耐药机制的发展有关[34]。研究显示,不同来源的鳗弧菌分离株对庆大霉素、四环素和喹诺酮类药物的敏感性最普遍,对氨苄西林的耐药性最普遍[35-36]。目前,水产养殖中的弧菌感染通常使用氨基糖苷类、四环素类和喹诺酮类等抗菌药物治疗[37]。本次水产养殖区域分离的3株鳗弧菌均对四环素类和喹诺酮类药物较为敏感,这与前人研究结果基本相符。近年来,相关部门提倡科学规范用药,已明令禁止多类药物在水产养殖中使用,根据研究结果并结合农业农村部渔业渔政管理局发布的《水产养殖用药明白纸 2022 年 1、2 号》,推荐交替使用水产用多西环素和恩诺沙星进行治疗,以防长期单一用药产生耐药性[38]。此外,水产养殖过程中还应鼓励接种疫苗[39],适当使用饲料添加剂[40-41],以提高鱼类的存活率,进一步提高水产养殖的盈利能力。本研究中,考查了3株鳗弧菌对 29种抗生素的耐药性,为选用防控水产养殖动物鳗弧菌感染的抗生素提供了基础数据。
4 结论
1)本研究中首次报道了鳗弧菌感染多纹钱蝶鱼,扩大了鳗弧菌的天然宿主范围。
2)鳗弧菌导致多纹钱蝶鱼肝、脾和肾等多脏器产生不同程度的病变,病理切片结果主要表现为充血、出血、坏死和炎性细胞浸润等,说明鳗弧菌可造成多纹钱蝶鱼系统性的病理损伤。
3)分离获得的QZ991、 QZ992 和 QZ9933 株鳗弧菌均携带7 种毒力基因,其LD50分别为 5.10×105、 4.33×105、 2.45×106 CFU/mL,说明其属于强毒株型。
4)3株鳗弧菌均对多粘菌素B、庆大霉素、四环素类、喹诺酮类和多数头孢烯类等多种药物敏感,在水产养殖过程中推荐交替使用四环素类的盐酸多西环素粉(水产用)和喹诺酮类的恩诺沙星粉(水产用)。
[1] YANG G H,WANG C,WANG X T,et al.Complete genome sequence of the marine fish pathogen Vibrio anguillarum and genome-wide transposon mutagenesis analysis of genes essential for in vivo infection[J].Microbiological Research,2018,216:97-107.
[2] CANESTRINI G.Lamalattia dominate delleanguille[J].Atti Ist Veneto Sci Lett Arti Cl Sci Mat Nat,1893,7:809-814.
[3] BERGMAN A M.Die roten Beulenkrankheit ds Aales[J].Berichteaus der Koniglichen Bayerischen Biologischen Versuchs-station,1909,2:10-54.
[4] HUANG J B,WU Y C,CHI S C.Dietary supplementation of Pediococcus pentosaceus enhances innate immunity,physiological health and resistance to Vibrio anguillarum in orange-spotted grouper (Epinephelus coioides)[J].Fish &Shellfish Immunology,2014,39(2):196-205.
[5] WANG W W,XU Q,ZANG S Q,et al.Inflammatory reaction and immune response of half-smooth tongue sole (Cynoglossus semilaevis) after infection with Vibrio anguillarum[J].Fish &Shellfish Immunology, 2023,141:109043.
[6] 赵鹏.虹鳟鱼常见细菌性疾病的防治技术[J].黑龙江水产,2015(6):24-26.ZHAO P.Control techniques for common bacterial diseases of Oncorhynchus mykiss [J].Heilongjiang Fisheries,2015(6):24-26.(in Chinese)
[7] 李媛媛,蔡琰,张连英,等.大口黑鲈源鳗弧菌的分离鉴定[J].淡水渔业,2023,53(3):46-53.LI Y Y,CAI Y,ZHANG L Y,et al.Isolation and identification of Vibrio anguillarum from Micropterus salmoides[J].Freshwater Fisheries,2023,53(3):46-53.(in Chinese)
[8] 孙晶晶,高晓建,张晓君,等.病原性鳗弧菌(Vibrio anguillarum)双重PCR与LAMP检测方法的建立[J].渔业科学进展,2015,36(6):49-55.SUN J J,GAO X J,ZHANG X J,et al.Detection of pathogenic Vibrio anguillarum by using duplex PCR and LAMP assays[J].Progress in Fishery Sciences,2015,36(6):49-55.(in Chinese)
[9] 刘鉴毅,李琪,孙艳秋,等.多纹钱蝶鱼胚胎发育及胚后发育观察[J].中国水产科学,2021,28(8):978-987.LIU J Y,LI Q,SUN Y Q,et al.Embryonic and post-embryonic development of Selenotoca multifasciata[J].Journal of Fishery Sciences of China,2021,28(8):978-987.(in Chinese)
[10] 罗璋,许杰,韩进刚,等.银鼓鱼病原菌(海豚链球菌)的分离与鉴定[J].华中农业大学学报,2012,31(1):95-99.LUO Z,XU J,HAN J G,et al.Isolation and identification of pathogenetic Streptococcus iniae from Selenotoca multifasciata[J].Journal of Huazhong Agricultural University,2012,31(1):95-99.(in Chinese)
[11] 杨林狄,贾新蕾,黄增朝,等.银鼓鱼海豚链球菌的分离、鉴定及毒力基因检测[J].大连海洋大学学报,2023,38(2):233-241.YANG L D,JIA X L,HUANG Z C,et al.Isolation,identification and virulence gene detection of Streptococcus iniae in silver scat(Selenotoca multifasciata)[J].Journal of Dalian Ocean University,2023,38(2):233-241.(in Chinese)
[12] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.DONG X Z,CAI M Y.Handbook of identification of common bacterial systems[M].Beijing:Science Press,2001.(in Chinese)
[13] 伍元植,简纪常,蔡双虎.乌鳢出血病的病原及组织病理学研究[J].广东海洋大学学报,2017,37(4):41-45.WU Y Z,JIAN J C,CAI S H.Isolation,identification and pathohistological observation of Channa argus infected by Aeromonas sobria[J].Journal of Guangdong Ocean University,2017,37(4):41-45.(in Chinese)
[14] 赵浩航,康旭,黄子威,等.大口黑鲈肠道益生菌的分离与鉴定[J].广东海洋大学学报,2023,43(4):62-68.ZHAO H H,KANG X,HUANG Z W,et al.Isolation and identification of intestinal probiotics from Micropterus salmoides[J].Journal of Guangdong Ocean University,2023,43(4):62-68.(in Chinese)
[15] 陈静,童桂香,黄鸾玉,等.基于dnaJ基因的弧菌PCR检测方法[J].南方农业学报,2018,49(6):1228-1234.CHEN J,TONG G X,HUANG L Y,et al.PCR detection method for Vibrios based on dnaJ gene[J].Journal of Southern Agriculture,2018,49(6):1228-1234.(in Chinese)
[16] ROCK J L,NELSON D R.Identification and characterization of a hemolysin gene cluster in Vibrio anguillarum[J].Infection and Immunity,2006,74(5):2777-2786.
[17] 李倩.抗生素对鳗弧菌T6SS表达的影响及鳗弧菌毒力相关基因的筛选[D].上海:上海海洋大学,2019.LI Q.Effect of antibiotics on expression of T6SS in Vibrio anguillarum and screening of virulence-related genes of Vibrio anguillarum[D].Shanghai:Shanghai Ocean University,2019.(in Chinese)
[18] 鲁雪.鳗弧菌6个毒力基因的多重PCR与基因芯片检测技术的建立以及创新检测技术的初步探索[D].青岛:中国海洋大学,2010.LU X.Development of multiplex PCR for simultaneous microarray detection of six virulence factors of Vibrio anguillarum and primary exploration of innovative detection technologies[D].Qingdao:Ocean University of China,2010.(in Chinese)
[19] 杨慧,陈吉祥,公衍军,等.致病性鳗弧菌W-1外膜蛋白ompU基因克隆及在大肠杆菌中的表达[J].中国海洋大学学报(自然科学版),2006,36(sup 1):105-108,14.YANG H,CHEN J X,GONG Y J,et al.Cloning and expressing in E.coli of an outer membrane protein ompU gene from the pathogenic Vibrio anguillarum W-1[J].Periodical of Ocean University of China(Natural Science Edition),2006,36(sup 1):105-108,14.(in Chinese)
[20] 葛慕湘,靳晓敏,房海,等.大菱鲆源鳗弧菌毒力基因的检测及序列分析[J].中国兽医学报,2014,34(8):1267-1271,1277.GE M X,JIN X M,FANG H,et al.Detection and sequence analysis of virulence genes of Vibrio anguillarum isolated from turbot(Scophthalmus maximus)[J].Chinese Journal of Veterinary Science,2014,34(8): 1267-1271,1277.(in Chinese)
[21] 陈贺,吴灶和,王蓓,等.无乳链球菌灭活疫苗对罗非鱼的免疫效果[J].广东海洋大学学报,2012,32(6):50-56.CHEN H,WU Z H,WANG B,et al.Immune protective effect of Streptococcus agalactiae inactivated vaccine on tilapia(Oreochromis niloticus)[J].Journal of Guangdong Ocean University,2012,32(6):50-56.(in Chinese)
[22] 贾春红,李淑芳,张继东.3株方斑东风螺病原性弧菌对35种常用抗菌药物的敏感性试验[J].广东海洋大学学报,2013,33(3):97-100.JIA C H,LI S F,ZHANG J D.Investigation of drug resistance of 3 strains pathogenic Vibrios isolated from Babylonia areolate to 35 antimicrobial drugs[J].Journal of Guangdong Ocean University,2013,33(3):97-100.(in Chinese)
[23] HICKEY M E,LEE J L.A comprehensive review of Vibrio (Listonella) anguillarum:ecology,pathology and prevention[J].Reviews in Aquaculture,2018,10(3):585-610.
[24] MIKKELSEN H,LUND V,MARTINSEN L C,et al.Variability among Vibrio anguillarum O2 isolates from Atlantic cod (Gadus morhua L.):characterisation and vaccination studies[J].Aquaculture,2007,266(1/2/3/4):16-25.
[25] ![]() T,et al.Similarities and differences between vibriosis in European sea bass caused by Vibrio anguillarum and Vibrio harveyi[J].Veterinarski Arhiv,2022,92(4):509-524.
T,et al.Similarities and differences between vibriosis in European sea bass caused by Vibrio anguillarum and Vibrio harveyi[J].Veterinarski Arhiv,2022,92(4):509-524.
[26] 陈星,唐金利,姜宫凌侠,等.海洋弧菌鉴定与分类相关功能基因研究进展[J].广东海洋大学学报,2020,40(1):116-125.CHEN X,TANG J L,JIANG G L X,et al.Research progress on functional genes related to identification and classification of Vibrio spp.[J].Journal of Guangdong Ocean University,2020,40(1):116-125.(in Chinese)
[27] DENKIN S M,NELSON D R.Regulation of Vibrio anguillarum empA metalloprotease expression and its role in virulence[J].Applied and Environmental Microbiology,2004,70(7):4193-4204.
[28] MAZOY R,V ZQUEZ F,LEMOS M L.Isolation of heme-binding proteins from Vibrio anguillarum using affinity chromatography[J].FEMS Microbiology Letters,1996,141(1):19-23.
ZQUEZ F,LEMOS M L.Isolation of heme-binding proteins from Vibrio anguillarum using affinity chromatography[J].FEMS Microbiology Letters,1996,141(1):19-23.
[29] BAUDIN LAURENCIN F,GERMON E.Experimental infection of rainbow trout, Salmo gairdneri R.,by dipping in suspensions of Vibrio anguillarum:ways of bacterial penetration;influence of temperature and salinity[J].Aquaculture,1987,67(1/2):203-205.
[30] 张晓君,秦国民,阎斌伦,等.半滑舌鳎病原鳗利斯顿氏菌表型及分子特征研究[J].海洋学报,2009,31(5):112-122.ZHANG X J,QIN G M,YAN B L,et al.Phenotypic and molecular characterization of pathogenic Listonell anguillarum isolated from half-smooth tongue sole Cynoglossus semilaevis[J].Acta Oceanologica Sinica,2009,31(5):112-122.(in Chinese)
[31] SCHMIDT J G,KORBUT R,OHTANI M,et al.Zebrafish (Danio rerio) as a model to visualize infection dynamics of Vibrio anguillarum following intraperitoneal injection and bath exposure[J].Fish &Shellfish Immunology,2017,67:692-697.
[32] CEYLAN M,DUMAN M,INAN S,et al.The study of histopathologic changes of experimental infection with Listonella (Vibrio) anguillarum in rainbow trout[J].Journal of Research in Veterinary Medicine,2019,38(1):59-66.
[33] CONFORTO E,V LCHEZ-G
LCHEZ-G MEZ L,PARRINELLO D,et al.Role of mucosal immune response and histopathological study in European eel (Anguilla anguilla L.) intraperitoneal challenged by Vibrio anguillarum or Tenacibaculum soleae[J].Fish &Shellfish Immunology,2021,114:330-339.
MEZ L,PARRINELLO D,et al.Role of mucosal immune response and histopathological study in European eel (Anguilla anguilla L.) intraperitoneal challenged by Vibrio anguillarum or Tenacibaculum soleae[J].Fish &Shellfish Immunology,2021,114:330-339.
[34] BLANCO P,HERNANDO-AMADO S,REALES-CALDERON J A,et al.Bacterial multidrug efflux pumps: much more than antibiotic resistance determinants[J].Microorganisms,2016,4(1):14.
[35] PARIN U,ERBAS G,SAVASAN S,et al.Antimicrobial resistance of Vibrio (Listonella) anguillarum isolated from rainbow trouts (Oncorhynchus mykiss)[J].Indian Journal of Animal Research,2019, 53(11): 1522-1525.
[36] VASEEHARAN B,RAMASAMY P,MURUGAN T,et al.In vitro susceptibility of antibiotics against Vibrio spp.and Aeromonas spp.isolated from Penaeus monodon hatcheries and ponds[J].International Journal of Antimicrobial Agents,2005,26(4):285-291.
[37] ZAGO V,VESCHETTI L,PATUZZO C,et al.Resistome,mobilome and virulome analysis of Shewanella algae and Vibrio spp.strains isolated in Italian aquaculture centers[J].Microorganisms,2020,8(4):572.
[38] TENDENCIA E A,DELA PE A L D.Level and percentage recovery of resistance to oxytetracycline and oxolinic acid of bacteria from shrimp ponds[J].Aquaculture,2002,213(1/2/3/4):1-13.
A L D.Level and percentage recovery of resistance to oxytetracycline and oxolinic acid of bacteria from shrimp ponds[J].Aquaculture,2002,213(1/2/3/4):1-13.
[39] WALI A,BALKHI M.Fish vaccination and therapeutics[J].International Journal of Multidisciplinary Research and Development,2016,3:55-60.
[40] LI C H,LU X J,LI D F,et al.Passive protective effect of chicken egg yolk immunoglobulins against experimental Vibrio anguillarum infection in ayu (Plecoglossus altivelis)[J].Fish &Shellfish Immunology,2014,37(1):108-114.
[41] VOLPATTI D,CHIARA B,FRANCESCA T,et al.Growth parameters,innate immune response and resistance to Listonella (Vibrioan guillarum) of Dicentrarchus labrax fed carvacrol supplemented diets[J].Aquaculture Research,2013,45:31-44.