鳗鲡(Angulla spp.)俗称“鳗鱼”,其肉质鲜美、营养价值高,是世界重要的经济鱼类。中国鳗鲡养殖产量约占全球的70%,主要养殖种类包括日本鳗鲡(Anguilla japonica)、欧洲鳗鲡(A.anguilla)和美洲鳗鲡(A.rostrata)[1-3]。随着养殖集约化程度的不断提高,养殖鳗鲡细菌性疾病频繁发生,其中,气单胞菌(A.spp.)是鳗鲡养殖过程中最常见的一类致病菌[4],包括嗜水气单胞菌(A.hydrophila)、维氏气单胞菌(A.veronii)、温和气单胞菌(A.sobria)和豚鼠气单胞菌(A.caviae)等,该菌可引起鳗鲡烂鳃、赤皮、穿孔、出血性败血症、肠炎和流行性溃疡等,给鳗鲡养殖产业带来了巨大的经济损失。
据相关研究报道,鳗鲡源气单胞菌菌株致病力不仅受感染细菌数量影响,而且与气单胞菌所携带毒力基因的种类和数量密切相关[5]。因此,深入了解鳗鲡源气单胞菌的毒力特性和耐药特性,不仅对有效防控鳗鲡气单胞菌病具有十分重要的意义,还可以避免盲目使用抗菌药物,保障水产品质量安全。本研究中,对分离自患病鳗鲡的41株气单胞菌进行了毒力基因和耐药性分析,以期为鳗鲡气单胞菌病的防治提供参考依据,保障鳗鲡养殖业的绿色高质量发展及其产品的质量安全。
1 材料与方法
1.1 材料
供试菌株:2017—2019年从患病鳗鲡鱼体分离获得的41株气单胞菌。
主要仪器与试剂:PCR仪(美国BIO-RAD公司);实时荧光定量PCR仪(美国ABI公司);PCR相关试剂和细菌基因组DNA提取试剂盒购自宝生物(大连)有限公司;试验用相关引物由生工生物工程(上海)股份有限公司合成;琼脂糖为SIGMA公司产品。
供试药物:酰胺醇类(甲砜霉素、氟苯尼考)、喹诺酮类(恩诺沙星、盐酸环丙沙星)、四环素类(盐酸多西环素)、磺胺类(磺胺二甲嘧啶、磺胺间甲氧嘧啶钠、磺胺嘧啶)和氨基糖苷类(硫酸新霉素)。
1.2 方法
1.2.1 供试菌株的种属鉴定 取过夜培养的供试菌株培养液,按细菌基因组DNA提取试剂盒说明书提取并纯化供试菌株基因组DNA,使用细菌16S rRNA通用引物及gyrB、rpoD管家基因特异性引物(表1),从供试菌株基因组DNA中扩增得到16S rRNA序列和gyrB、rpoD管家基因序列。PCR扩增产物经琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司进行测序,并将测序结果上传至NCBI的Blast系统进行同源性比对分析。
表1 gyrB、rpoD管家基因的引物序列和扩增条件[6]
Tab.1 Primers sequences and amplification conditions for gyrB and rpoD[6]

引物primer序列(5′-3′)sequence(5′-3′)退火温度/℃annealing temperature产物/bpproduct sizegyrBF:TCCGGCGGTCTGCACGGCGT561 124R:TTGTCCGGGTTGTACTCGTCrpoDF:GACCCGTGAAGGCGAAATCGAC55760R:TTTTGGCGCGGCGGGCCTTGG
1.2.2 毒力基因检测 通过PCR扩增检测供试菌株的主要毒力基因,包括溶血素(hly)、气溶素(aer)、丝氨酸胞外蛋白酶(ahpA)、热稳定细胞兴奋性肠毒素(ast)、热不稳定性细胞兴奋性肠毒素(alt)、细胞毒性肠毒素(act)和热敏感性胞外蛋白酶(epr)7种胞外毒力基因,其PCR扩增引物见表2。将与预期片段大小一致的 PCR 扩增产物片段测序验证。
表2 气单胞菌7种毒力基因的引物序列
Tab.2 Sequences and sources of the primers used for amplification of 7 virulence genes in Aeromonas spp.

引物primer序列(5′-3′)sequence(5′-3′)产物/bpproduct size参考文献referencehlyF:GGCGTGATTCGACAAGGAGA1 203熊静等[5]R:ACATCCAGATTCGGCACGAaerF:CCTATGGCCTGAGCGAGAAG431边宇[7]R:CCAGTTCCAGTCCCACCACTahpAF:TGCCCATCGCTTCAGTTCA719张德锋等[6]R:GTGCGGCTGAACATGTAGTCAastF:ATCGTCAGCGACAGCTTCTT504付乔芳等[8]R:CTCATCCCTTGGCTTGTTGTaltF:TGACCCAGTCCTGGCACGGC442胡萌[9]R:GGTGATCGATCACCACCAGCactF:GAGAAGGTGACCACCAAGAACA232胡萌[9]R:AACTGACATCGGCCTTGAACTCeprF:CTAGGAGGCGGGCA432郭婧[10]R:ATGACACTCTTGCTCACCACCC
1.2.3 抗菌药物感受性检测 采用微量肉汤稀释法,按无菌操作规范要求,将供试药物的初始浓度配制成200 mg/L,再用胰蛋白胨大豆肉汤(TSB)培养基按2n倍比依次稀释成11个浓度,另设1个空白对照组,后依次接入浓度为106 CFU/mL的待测菌悬液和培养基(体积比为1∶1),于(28±2)℃恒温培养箱中培养24 h,每种供试药物设置3个平行,观察试验结果。对照组菌株生长良好时,以肉眼观察到能抑制菌株生长的最低药物浓度作为其对鳗鲡源气单胞菌的MIC。
1.2.4 抗菌药物敏感性及耐药性判定标准 参照美国临床实验室标准化协会(CLSI)发布的药物敏感性及耐药标准,划分气单胞菌对抗菌药物的敏感性及耐药性判定范围(表3)。
表3 气单胞菌的抗菌药物体外敏感性判定参考值
Tab.3 Decision reference value for antimicrobial susceptibility of Aeromonas spp. in vitro
μg/mL
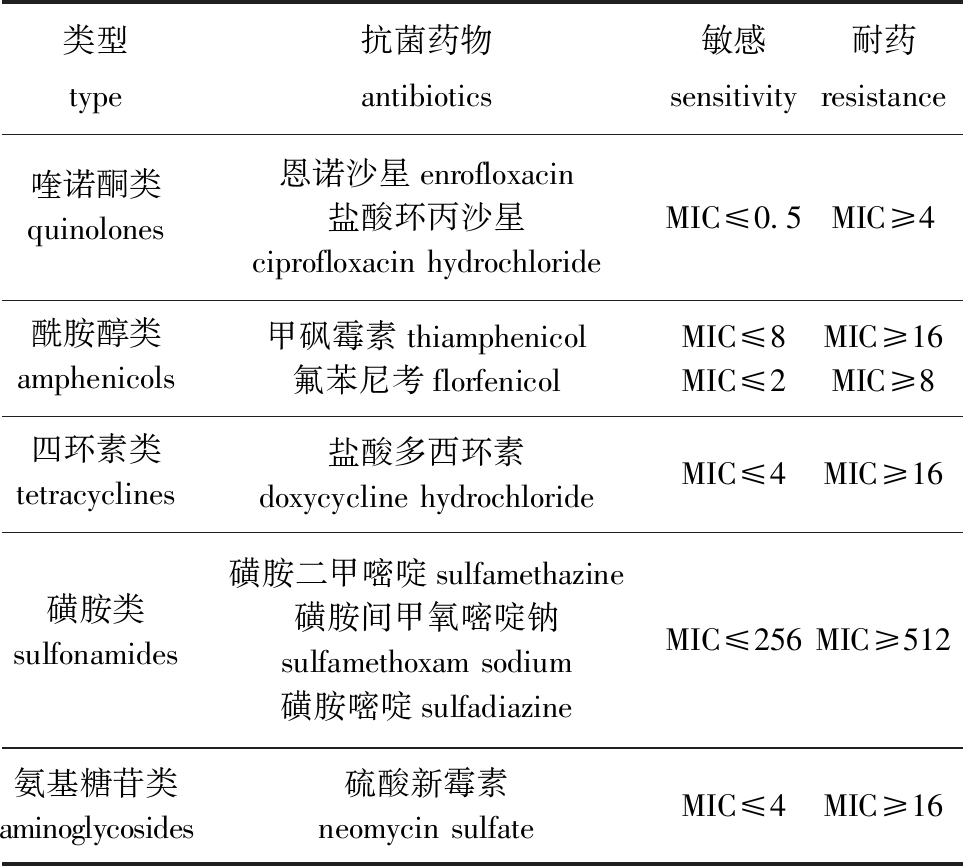
类型type抗菌药物antibiotics敏感sensitivity耐药resistance喹诺酮类quinolones恩诺沙星enrofloxacin盐酸环丙沙星ciprofloxacin hydrochlorideMIC≤0.5MIC≥4酰胺醇类amphenicols甲砜霉素thiamphenicol氟苯尼考florfenicolMIC≤8MIC≤2MIC≥16MIC≥8四环素类tetracyclines盐酸多西环素doxycycline hydrochlorideMIC≤4MIC≥16磺胺类sulfonamides磺胺二甲嘧啶sulfamethazine磺胺间甲氧嘧啶钠sulfamethoxam sodium磺胺嘧啶sulfadiazineMIC≤256MIC≥512氨基糖苷类aminoglycosides硫酸新霉素neomycin sulfateMIC≤4MIC≥16
1.2.5 耐药基因检测 以鳗鲡源气单胞菌的基因组DNA为模板,通过SYBR Green qPCR方法分析鳗鲡源气单胞菌中15种主要耐药基因携带情况,主要包括四环素类[11](tetA、tetB、tetC、tetM)、喹诺酮类[12](qnrA、qnrS)、酰胺醇类(cfr、floR、catA、cmlA)、磺胺类[13-15](sul1、sul2、dfrA1)和氨基糖苷类(aac(6′)-Ib、aph(2′)-Id)(表4)。
表4 耐药基因引物序列
Tab.4 Primer sequences of drug resistance genes

药物antibiotics引物primer序列(5′-3′)sequence(5′-3′) 参考文献reference四环素类tetracyclinestetAF:GCTGTTTGTTCTGCCGGAAAR:GGTTAAGTTCCTTGAACGCAAACTtetBF:AGTGCGCTTTGGATGCTGTAR:AGCCCCAGTAGCTCCTGTGAtetCF:CATATCGCAATACATGCGAAAAAR:AAAGCCGCGGTAAATAGCAAtetMF:CATCATAGACACGCCAGGACATATR:CGCCATCTTTTGCAGAAATCAZhu等[11]喹诺酮类quinolonesqnrAF:ATTTCTCACGCCAGGATTTGR:GCAGATCGGCATAGCTGAAGqnrSF:GTATAGAGTTCCGTGCGTGTGAR:GGTTCGTTCCTATCCAGCGATT刘宇等[12]酰胺醇类amide alcoholscfrF:GCAAAATTCAGAGCAAGTTACGAAR:AAAATGACTCCCAACCTGCTTTATfloRF:ATTGTCTTCACGGTGTCCGTTAR:CCGCGATGTCGTCGAACTcatAF:GGGTGAGTTTCACCAGTTTTGATTR:CACCTTGTCGCCTTGCGTATAcmlAF:TAGGAAGCATCGGAACGTTGATR:CAGACCGAGCACGACTGTTGZhu等[11]磺胺类sulfonamidessul1F:CGCACCGGAAACATCGCTGCACR:TGAAGTTCCGCCGCAAGGCTCGsul2F:TCATCTGCCAAACTCGTCGTTAR:GTCAAAGAACGCCGCAATGTdfrA1F:GGAATGGCCCTGATATTCCAR:AGTCTTGCGTCCAACCAACAG赵晓雨等[13],Li等[14]氨基糖苷类aminoglycosidesaac(6′)-IbF:GTTTGAGAGGCAAGGTACCGTAAR:GAATGCCTGGCGTGTTTGAaph(2′)-IdF:TGAGCAGTATCATAAGTTGAGTGAAAAGR:GACAGAACAATCAATCTCTATGGAATGRasschaert等[15]
2 结果与分析
2.1 供试菌株的鉴定
通过对供试菌株进行分子生物学鉴定可得,本实验室近年来从患病鳗鲡上分离获得的41株气单胞菌,包含维氏气单胞菌(27株,占66%)、嗜水气单胞菌(6株,占15%)、达卡气单胞菌(A.dhakensis)(5株,占12%)、双壳气单胞菌(A.bivalves)(2株,占5%)和豚鼠气单胞菌(1株,占2%)。
2.2 毒力基因检测
从图1可见:alt的阳性检出率最高,达75.6%(31/41),其次是aer,阳性检出率为58.5%(24/41);act、ahpA、epr、hly、ast的阳性检出率分别为34.1%(14/41)、19.5%(8/41)、19.5%(8/41)、14.6%(6/41)和12.2%(5/41)。在41株鳗鲡源气单胞菌中,含有7、5、4、3、2、1个毒力基因的菌株数分别为3、2、4、14、8、4株,6株不含毒力基因。(图2)
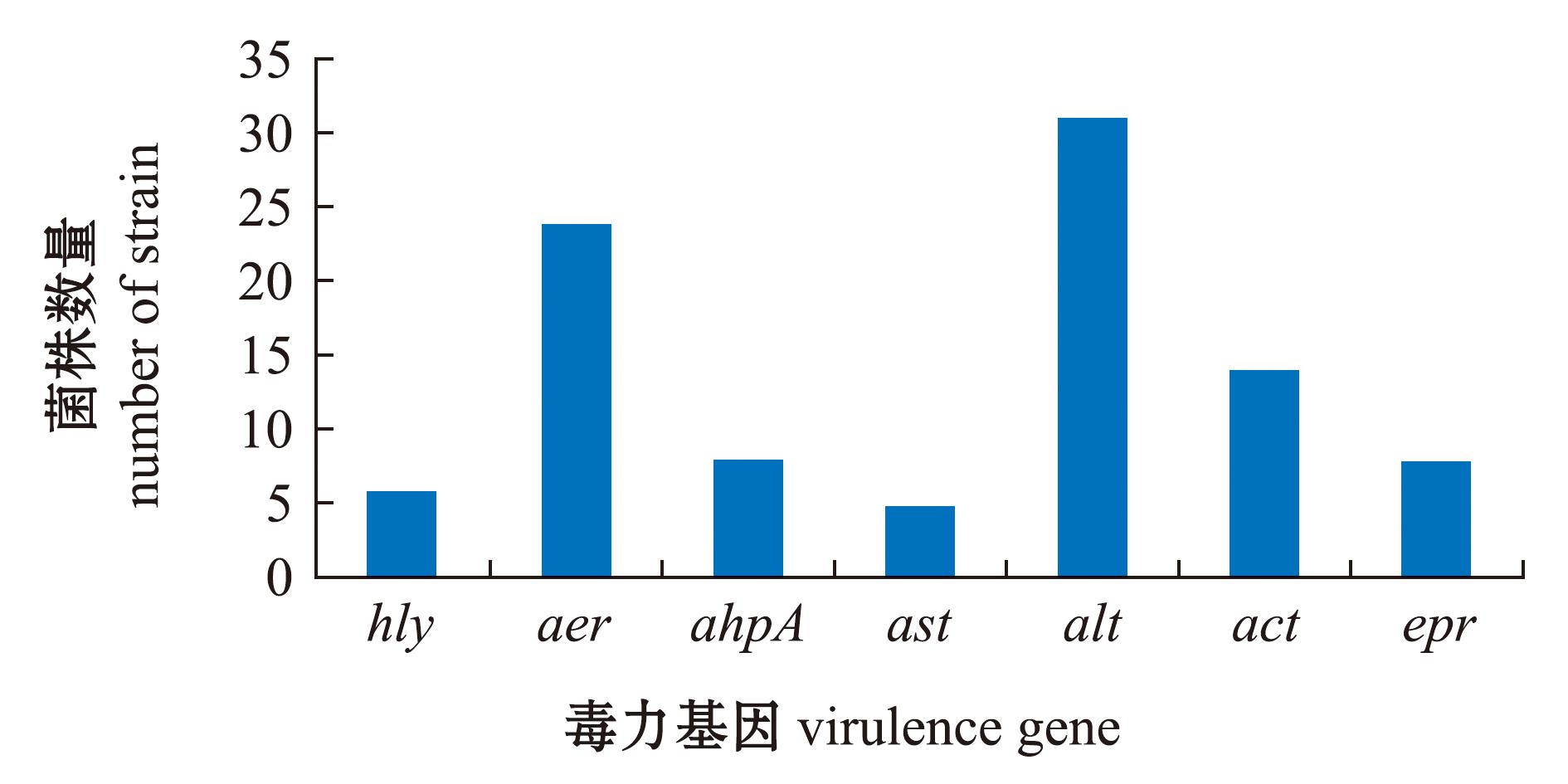
图1 41株鳗鲡源气单胞菌中不同毒力基因分布
Fig.1 Distribution of different virulence genes in 41 Aeromonas spp.strains in Angulla spp.
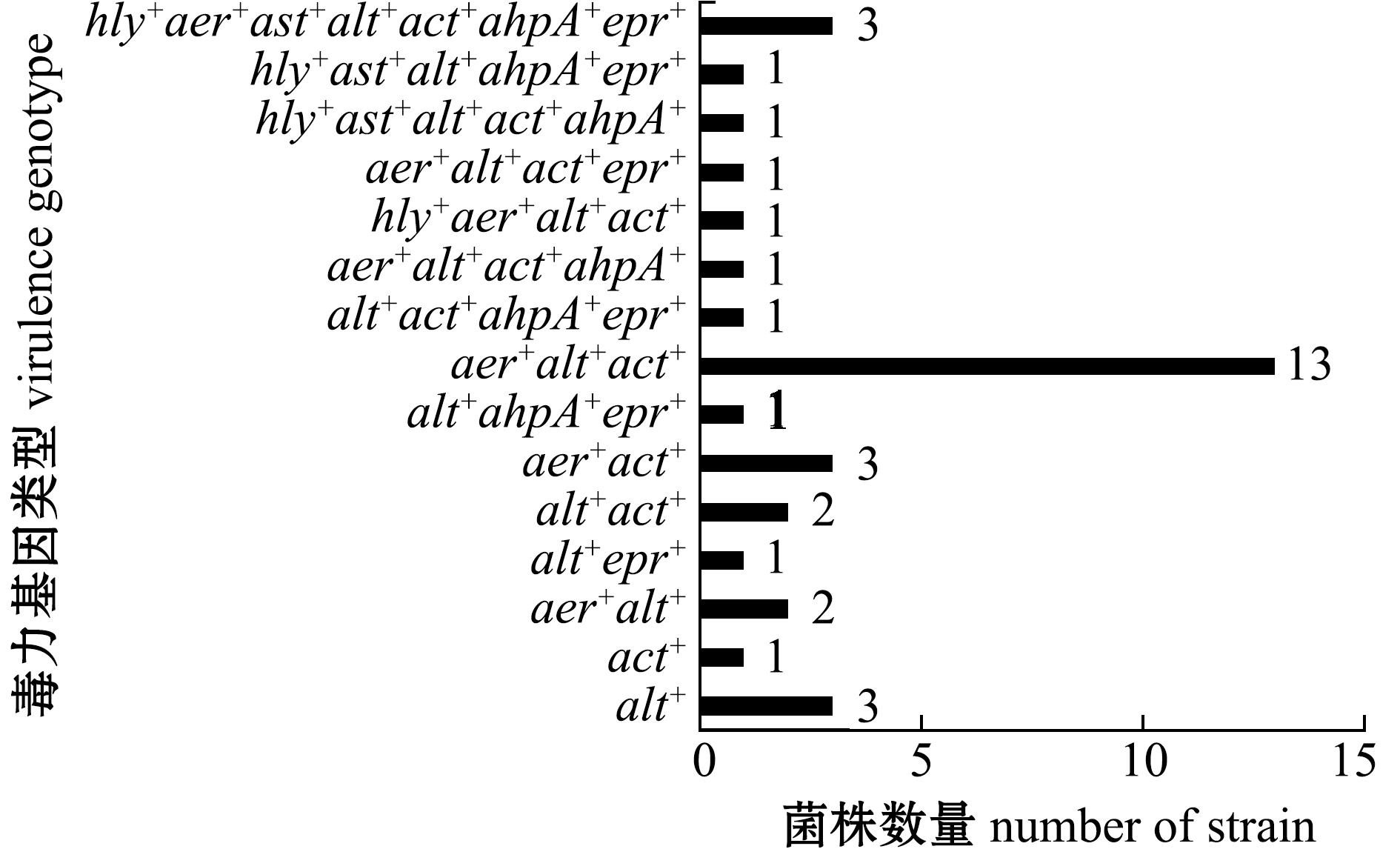
图2 41株鳗鲡源气单胞菌的毒力基因型
Fig.2 Virulence genotypes of 41 Aeromonas spp.strains in Angulla spp.
2.3 鳗鲡源气单胞菌总体耐药性
从表5可见:41株鳗鲡源气单胞菌对所测抗菌药物的敏感性表现不一,其中,对酰胺醇类(甲砜霉素和氟苯尼考)的耐药率最高,均为100%;其次,对喹诺酮类、四环素类也相对耐药,耐药率均高于68.30%,而对磺胺类和氨基糖苷类药物耐药率均高于46.34%。
表5 9种抗菌药物对鳗鲡源气单胞菌的MIC频数分布及敏感率、耐药率(n=41)
Tab.5 MIC frequency distribution,sensitivity rate,and drug resistance rate of 41 Aeromonas spp. strains in Angulla spp. to 9 antimicrobial agents(n=41)
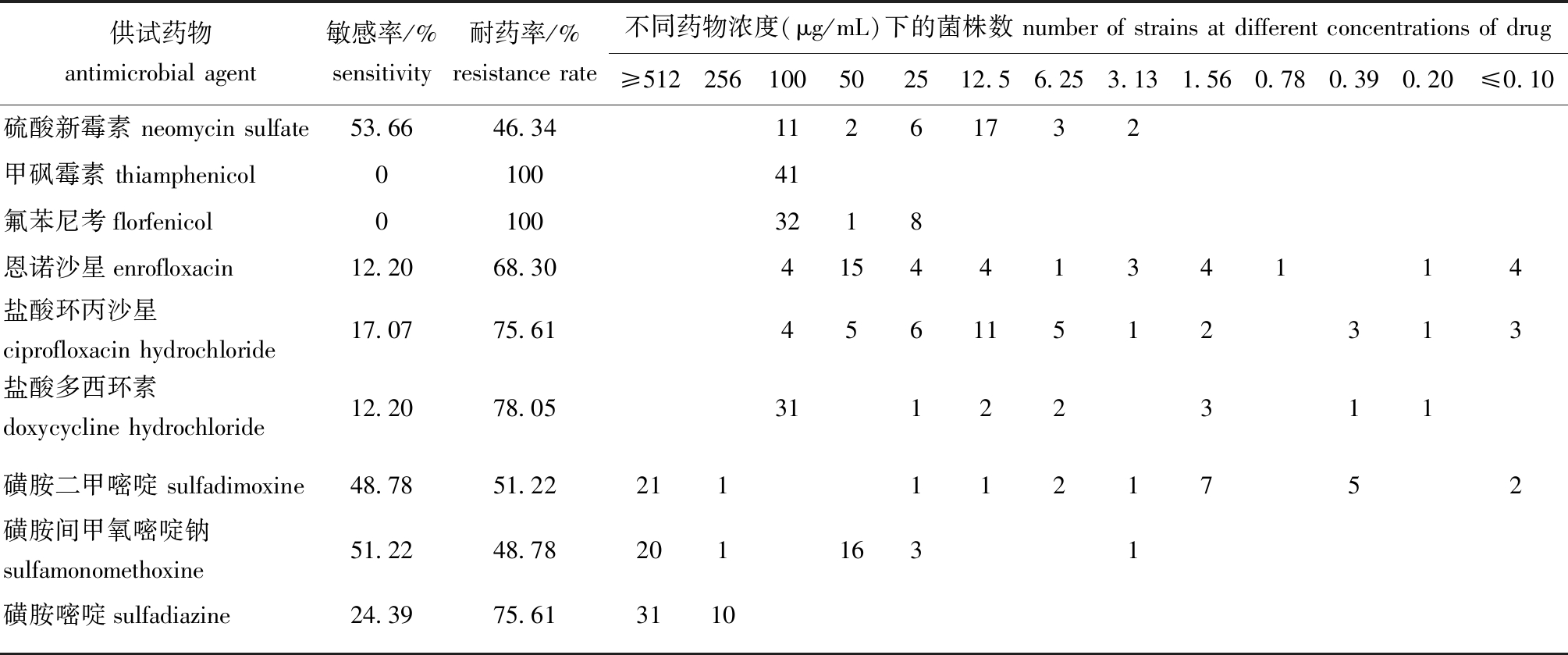
供试药物antimicrobial agent敏感率/%sensitivity耐药率/%resistance rate不同药物浓度(μg/mL)下的菌株数 number of strains at different concentrations of drug ≥512256100502512.56.253.131.560.780.390.20≤0.10硫酸新霉素 neomycin sulfate53.6646.3411261732甲砜霉素 thiamphenicol010041氟苯尼考florfenicol01003218恩诺沙星enrofloxacin12.2068.3041544134114盐酸环丙沙星ciprofloxacin hydrochloride17.0775.6145611512313盐酸多西环素doxycycline hydrochloride12.2078.0531122311磺胺二甲嘧啶 sulfadimoxine48.7851.222111121752磺胺间甲氧嘧啶钠sulfamonomethoxine51.2248.782011631磺胺嘧啶sulfadiazine24.3975.613110
参照美国临床实验室标准化协会(CLSI)发布的药物敏感性及耐药标准,41株鳗鲡源气单胞菌中多重耐药率高达100%。其中,8、7、6、5、4、3重耐药菌株分别占34.15%(14/41)、29.27%(12/41)、7.32%(3/41)、12.20%(5/41)、12.20%(5/41)和4.88%(2/41)。
2.4 耐药基因检测
从图3可见:酰胺醇类耐药基因floR与cmlA、磺胺类耐药基因sul1和氨基糖苷类耐药基因aac(6′)-Ib的携带率最高,均为100%(41/41);喹诺酮类耐药基因qnrS的携带率次高,为85.3%(35/41);磺胺类耐药基因sul2的携带率为78.0%(32/41);四环素类耐药基因tetA、tetB、tetC、tetM的携带率分别为34.1%(14/41)、73.2%(30/41)、51.2%(21/41)和48.8%(20/41);喹诺酮类耐药基因qnrA的携带率为36.6%(15/41);酰胺醇类耐药基因cfr的携带率为22.0%(9/41);磺胺类耐药基因dfrA1的携带率61.0%(25/41);未检出酰胺醇类耐药基因catA和氨基糖苷类耐药基因aph(2′)-Id。这表明,75.6%(31/41)的鳗鲡源气单胞菌同时携带四环素类、喹诺酮类、酰胺醇类、磺胺类和氨基糖苷类抗菌药物耐药基因。

图3 耐药基因检测
Fig.3 Identification of the antibiotics resistance gens in Aeromonas spp.
41株鳗鲡源气单胞菌中携带多重耐药基因的菌株占100%,其中,携带6、7、8、9、10、11、12重耐药基因的菌株数分别为7、3、6、8、9、4、4株,携带6重耐药基因的菌株占17.1%,携带12重耐药基因的菌株占9.8%,这表明,100%的鳗鲡源气单胞菌携带6重以上耐药基因。
2.5 耐药表型、耐药基因型及毒力基因比较
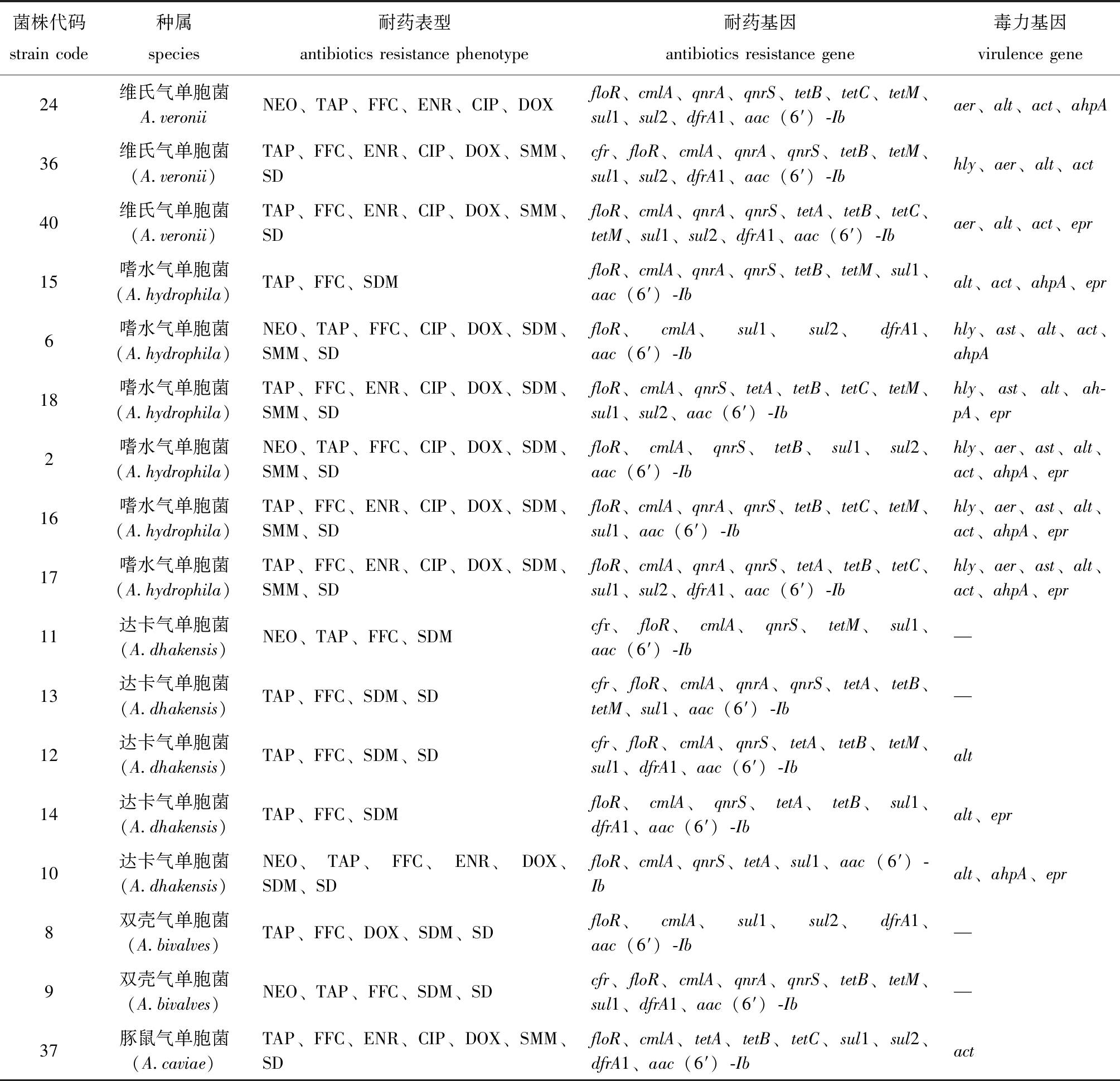
分析耐药表型、耐药基因型及毒力基因检测结果发现,至少对3种所测抗菌药物产生耐药及至少携带6种耐药基因的菌株均高达100%,且有56.10%的菌株至少携带3种及以上毒力基因,其中,分离株17能够同时耐受8种所测抗菌药物且同时携带11种耐药基因和7种毒力基因(表6)。由此可见,本研究中所分离的部分鳗鲡源气单胞菌携带的耐药基因数量繁多,出现严重的多重耐药现象,且毒力较强。
表6 鳗鲡源气单胞菌耐药表型、耐药基因型及毒力基因携带特性
Tab.6 Characteristics of the drug resistance phenotype,resistance genes and virulence genes in Aeromonas spp.strains in Angulla spp.

菌株代码strain code种属species耐药表型antibiotics resistance phenotype耐药基因antibiotics resistance gene毒力基因virulence gene27维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOX、SMM、SDfloR、cmlA、qnrS、tetB、tetC、sul1、sul2、dfrA1、aac(6′)-Ib—41维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOX、SMM、SDfloR、cmlA、qnrA、qnrS、tetA、tetB、tetC、tetM、sul1、sul2、dfrA1、aac(6′)-Ib—1维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOX、SDM、SDfloR、cmlA、qnrS、sul1、sul2、aac(6′)-Ibalt3维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOX、SDM、SDfloR、cmlA、tetB、tetM、sul1、sul2、aac(6′)-Ibalt5维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOXfloR、cmlA、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt20维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOX、SDM、SDcfr、floR、cmlA、qnrS、tetA、tetB、tetC、tetM、sul1、sul2、dfrA1、aac(6′)-Ibalt、act21维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOX、SDM、SDfloR、cmlA、qnrA、qnrS、tetB、tetC、sul1、sul2、aac(6′)-Ibare、act22维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOXfloR、cmlA、qnrS、tetB、tetC、sul1、sul2、aac(6′)-Ibalt、act26维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOX、SMM、SDcfr、floR、cmlA、qnrS、tetB、tetC、sul1、sul2、dfrA1、aac(6′)-Ibare、act31维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOX、SMM、SDfloR、cmlA、qnrS、tetB、tetM、sul1、sul2、dfrA1、aac(6′)-Ibare、act34维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOX、SMM、SDfloR、cmlA、qnrS、tetC、sul1、sul2、dfrA1、aac(6′)-Ibare、alt4维氏气单胞菌(A.veronii)TAP、FFC、SDM、SDfloR、cmlA、tetM、sul1、sul2、aac(6′)-Ibaer、alt、act7维氏气单胞菌(A.veronii)NEO、TAP、FFC、SDMfloR、cmlA、qnrS、sul1、sul2、aac(6′)-Ibaer、alt、act19维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOX、SDM、SDfloR、cmlA、qnrS、tetB、tetC、sul1、sul2、aac(6′)-Ibaer、alt、act23维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOXcfr、floR、cmlA、qnrA、qnrS、tetB、tetC、sul1、aac(6′)-Ibaer、alt、act25维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOX、SDfloR、cmlA、qnrA、qnrS、tetA、tetB、tetC、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act28维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOX、SDM、SMM、SDfloR、cmlA、qnrS、tetA、tetB、tetC、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act29维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOX、SMM、SDfloR、cmlA、qnrA、qnrS、tetC、tetM、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act30维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOXfloR、cmlA、qnrS、tetB、tetM、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act32维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOX、SMM、SDfloR、cmlA、qnrA、qnrS、tetA、tetB、tetC、tetM、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act33维氏气单胞菌(A.veronii)TAP、FFC、DOX、SMM、SDfloR、cmlA、tetB、tetC、tetM、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act35维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOX、SMM、SDfloR、cmlA、qnrS、tetC、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act38维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOX、SMMfloR、cmlA、qnrS、tetA、tetB、tetM、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act39维氏气单胞菌(A.veronii)NEO、TAP、FFC、ENR、CIP、DOX、SMM、SDcfr、floR、cmlA、qnrS、tetB、tetM、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act
表6(续) 鳗鲡源气单胞菌耐药表型、耐药基因型及毒力基因携带特性
Tab.6 Characteristics of the drug resistance phenotype,resistance genes and virulence genes in Aeromonas spp.strains in Angulla spp.
注:ND—未检出;NEO—硫酸新霉素;TAP—甲砜霉素;FFC—氟苯尼考;ENR—恩诺沙星;CIP—盐酸环丙沙星;DOX—盐酸多西环素;SDM—磺胺二甲嘧啶;SMM—磺胺间甲氧嘧啶钠;SD—磺胺嘧啶。
Note:ND—not detected;NEO—neomycin sulphate;TAP—thiamphenicol;FFC—florfenicol;ENR—enrofloxacin;CIP—ciprofloxacin hydrochloride;DOX—doxycycline hydrochloride;SDM—sulfadimoxine;SMM—sulfamonomethoxine;SD—sulfadiazine.
菌株代码strain code种属species耐药表型antibiotics resistance phenotype耐药基因antibiotics resistance gene毒力基因virulence gene24维氏气单胞菌A.veroniiNEO、TAP、FFC、ENR、CIP、DOXfloR、cmlA、qnrA、qnrS、tetB、tetC、tetM、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act、ahpA36维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOX、SMM、SDcfr、floR、cmlA、qnrA、qnrS、tetB、tetM、sul1、sul2、dfrA1、aac(6′)-Ibhly、aer、alt、act40维氏气单胞菌(A.veronii)TAP、FFC、ENR、CIP、DOX、SMM、SDfloR、cmlA、qnrA、qnrS、tetA、tetB、tetC、tetM、sul1、sul2、dfrA1、aac(6′)-Ibaer、alt、act、epr15嗜水气单胞菌(A.hydrophila)TAP、FFC、SDMfloR、cmlA、qnrA、qnrS、tetB、tetM、sul1、aac(6′)-Ibalt、act、ahpA、epr6嗜水气单胞菌(A.hydrophila)NEO、TAP、FFC、CIP、DOX、SDM、SMM、SDfloR、cmlA、sul1、sul2、dfrA1、aac(6′)-Ibhly、ast、alt、act、ahpA18嗜水气单胞菌(A.hydrophila)TAP、FFC、ENR、CIP、DOX、SDM、SMM、SDfloR、cmlA、qnrS、tetA、tetB、tetC、tetM、sul1、sul2、aac(6′)-Ibhly、ast、alt、ah-pA、epr2嗜水气单胞菌(A.hydrophila)NEO、TAP、FFC、CIP、DOX、SDM、SMM、SDfloR、cmlA、qnrS、tetB、sul1、sul2、aac(6′)-Ibhly、aer、ast、alt、act、ahpA、epr16嗜水气单胞菌(A.hydrophila)TAP、FFC、ENR、CIP、DOX、SDM、SMM、SDfloR、cmlA、qnrA、qnrS、tetB、tetC、tetM、sul1、aac(6′)-Ibhly、aer、ast、alt、act、ahpA、epr17嗜水气单胞菌(A.hydrophila)TAP、FFC、ENR、CIP、DOX、SDM、SMM、SDfloR、cmlA、qnrA、qnrS、tetA、tetB、tetC、sul1、sul2、dfrA1、aac(6′)-Ibhly、aer、ast、alt、act、ahpA、epr11达卡气单胞菌(A.dhakensis)NEO、TAP、FFC、SDMcfr、floR、cmlA、qnrS、tetM、sul1、aac(6′)-Ib—13达卡气单胞菌(A.dhakensis)TAP、FFC、SDM、SDcfr、floR、cmlA、qnrA、qnrS、tetA、tetB、tetM、sul1、aac(6′)-Ib—12达卡气单胞菌(A.dhakensis)TAP、FFC、SDM、SDcfr、floR、cmlA、qnrS、tetA、tetB、tetM、sul1、dfrA1、aac(6′)-Ibalt14达卡气单胞菌(A.dhakensis)TAP、FFC、SDMfloR、cmlA、qnrS、tetA、tetB、sul1、dfrA1、aac(6′)-Ibalt、epr10达卡气单胞菌(A.dhakensis)NEO、TAP、FFC、ENR、DOX、SDM、SDfloR、cmlA、qnrS、tetA、sul1、aac(6′)-Ibalt、ahpA、epr8双壳气单胞菌(A.bivalves)TAP、FFC、DOX、SDM、SDfloR、cmlA、sul1、sul2、dfrA1、aac(6′)-Ib—9双壳气单胞菌(A.bivalves)NEO、TAP、FFC、SDM、SDcfr、floR、cmlA、qnrA、qnrS、tetB、tetM、sul1、dfrA1、aac(6′)-Ib—37豚鼠气单胞菌(A.caviae)TAP、FFC、ENR、CIP、DOX、SMM、SDfloR、cmlA、tetA、tetB、tetC、sul1、sul2、dfrA1、aac(6′)-Ibact
3 讨论
3.1 不同种类气单胞菌的流行趋势
气单胞菌属为兼性厌氧的革兰氏阴性杆菌,广泛存在于淡水、半咸水乃至海水中[16]。目前已报道的有嗜水气单胞菌、维氏气单胞菌、豚鼠气单胞菌、温和气单胞菌和杀鲑气单胞菌等30余种,可引起水生动物烂鳃、赤皮、穿孔、肠炎、竖鳞和出血性败血症等,给水产养殖业带来了巨大的经济损失[6]。通常认为,嗜水气单胞菌是淡水鱼类的主要致病菌[17]。然而,张德锋等[6]研究表明,维氏气单胞菌是中国南方地区鱼源气单胞菌的主要流行菌种之一,其流行范围和规模甚至超过了嗜水气单胞菌;邓玉婷等[18]研究表明,正常养殖状况下,不管是从鱼组织还是从养殖环境中分离获得的气单胞菌种类主要为维氏气单胞菌(占60.28%);Hu等[17]也发现,在病鱼中分离的气单胞菌以维氏气单胞菌为主,占全部气单胞菌数量的60%,嗜水气单胞菌次之,为33%。本研究从患病鳗鲡中分离获得41株气单胞菌,分别被鉴定为维氏气单胞菌、嗜水气单胞菌、达卡气单胞菌、双壳气单胞菌和豚鼠气单胞菌5个种类,其中,维氏气单胞菌占比最高,为66%(27/41),嗜水气单胞菌次之,为15%(6/41),而达卡气单胞菌、双壳单胞菌、豚鼠气单胞菌的占比分别为12%、5%和2%。由此可见,鳗鲡源维氏气单胞菌数量是嗜水气单胞菌的4.5倍,与上述文献报道的鱼类气单胞菌病原以维氏气单胞菌为主相符合,说明维氏气单胞菌是目前鳗鲡气单胞菌病的主要流行菌种。
3.2 鳗鲡源气单胞菌毒力基因的分布情况
气单胞菌作为水产养殖过程中最常见的一类致病菌,其致病机制非常复杂,包括黏附、侵袭、体内增殖和产生毒素等一系列过程。一般认为,其致病力由多种毒力因子相互协同而产生,即与其携带毒力基因的种类和数量密切相关[19]。据研究报道,与致病性强弱直接相关的毒力因子有hly、aer、ahpA、ast、alt、act、epr等[20-21],这些毒力基因已被广泛用于判定气单胞菌的潜在致病力。刘杰等[22]和龙苏等[23]分别检测了47株黄沙鳖源嗜水气单胞菌和5株胡子鲇源气单胞菌中6种毒力基因act、alt、aer、hly、aha、ahpA的分布情况,结果均发现,同时携带6种被检毒力基因的菌株致病力最强,缺失部分毒力基因的菌株致病力大幅下降;朱永肖[19]研究发现,病鱼源气单胞菌至少携带3种以上毒力基因,其中,携带aer、hly毒力基因及ast、alt、ahpA的2种或3种毒力基因的菌株致病力较强。为初步探索鳗鲡源气单胞菌毒力因子与其潜在致病力的关系,本研究中选择上述7种与毒力相关的基因对41株鳗鲡源气单胞菌进行了检测分析。结果发现,alt的阳性检出率最高,主要毒力基因型为aer+alt+act+,56.10%的气单胞菌至少携带3种及以上的毒力基因,其中,编号为2、16、17的嗜水气单胞菌同时携带所检7种毒力基因,结合他人的研究结果,笔者推测,这3株嗜水气单胞菌对鳗鲡的致病力较强,但仍需进一步研究证实。今后可针对不同基因型的气单胞菌进行统一的人工感染,比较不同菌株的致病力差异,明晰不同毒力基因对鳗鲡的致病作用及机制,为鳗鲡气单胞菌病暴发的预警提供理论支撑。
3.3 鳗鲡源气单胞菌耐药基因的分布及其与耐药表型的相关性
由于抗菌药物的普遍使用,导致病原菌对药物的选择压力增大,或由于理化因素的综合作用逐渐产生多重耐药现象,不仅影响抗菌药物对水生动物细菌性疾病的防控能力,而且影响水产品的质量安全。本研究中,药物敏感性试验结果发现,41株气单胞菌均为多重耐药,对至少3种所测抗菌药物耐药,这与吴小梅等[24]发现93.5%的鳗鲡源气单胞菌为多重耐药及高智玲等[25]发现水产源嗜水气单胞菌均为多重耐药的结果一致。本研究中,所有供试菌株对酰胺醇类药物中甲砜霉素、氟苯尼考的耐药率均为100%,且所有供试菌株中酰胺醇类耐药基因floR、cmlA的检出率均为100%,说明floR、cmlA两种耐药基因检出结果与耐药表型一致,此与王小亮等[26]的研究结果存在差异,这可能与菌株来源或外界环境有关[27]。然而,本研究中未检出catA耐药基因,猜测catA可能不是介导酰胺醇类的主要耐药因素。本研究中,87.5%对四环素类药物耐药的菌株携带四环素耐药基因,其中tetB的检出率高于tetA、tetC、tetM,这与Roberts等[28]研究维氏气单胞菌的四环素耐药基因时发现tetB的检出率较高相一致;本研究中,100%携带sul1基因型的菌株对磺胺类药物耐药,71.1%携带qnrS基因型的菌株对喹诺酮类药物耐药,与耐药表型结果具有一致性。此外,还有一些菌株未检出四环素类耐药基因tetA、tetB、tetC、tetM的任何一种,或未检出喹诺酮类耐药基因qnrA、qnrS的任何一种,却对四环素类或喹诺酮类耐药,或者反之,即有些菌株检测到对四环素类、喹诺酮类药物耐药,但未检测到相应的耐药基因,而有些菌株虽然检测到四环素类、喹诺酮类耐药基因,但未表现出相应的耐药表型,说明耐药基因与耐药表型结果不完全一致。推测可能是因为其耐药性由其他耐药基因决定或存在其他耐药机制[29-30]。
4 结论
1)本研究中从近年来分离自患病鳗鲡的菌株中鉴定出41株气单胞菌,其中,维氏气单胞菌占比最高,为嗜水气单胞菌的4.5倍,说明维氏气单胞菌是目前鳗鲡气单胞菌病的主要流行菌种。
2)56.10%的供试菌株携带3种及以上所检毒力基因,其中,3株菌株同时携带7种所检毒力基因,推测其具有强致病力。
3)对供试菌株进行了5大类9种抗菌药物敏感性分析,呈现高水平多重耐药现象,100%的供试菌株携带6重以上耐药基因,且耐药基因与耐药表型不完全一致。因此,为防止耐药气单胞菌的进一步产生和扩散,加重其所致疾病的防治难度,以及引起水产品质量安全问题,在生产实践中应合理使用抗菌药物治疗鳗鲡气单胞菌病。
[1] 冯建军,郭松林,林鹏.欧洲鳗鲡免疫球蛋白轻链基因的克隆及表达分析[J].华中农业大学学报,2015,34(5):81-89.FENG J J,GUO S L,LIN P.Molecular cloning and expression analysis of immunoglobulin light chain gene in Anguilla anguilla[J].Journal of Huazhong Agricultural University,2015,34(5):81-89.(in Chinese)
[2] 赵金平,段丽华,郭松林.鳗鲡病原菌外膜蛋白三联表达载体的构建、表达与表达产物的纯化[J].华中农业大学学报,2015,34(3):104-110.ZHAO J P,DUAN L H,GUO S L.Construction,expression and purification of triple expression vector of outer membrane protein of three pathogens isolated from diseased eels[J].Journal of Huazhong Agricultural University,2015,34(3):104-110.(in Chinese)
[3] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会.2022中国渔业统计年鉴[M].北京:中国农业出版社,2022.Fishery Administration of the Ministry of Agriculture and Rural Affairs,National Fisheries Technology Extension Center,China Society of Fisheries.2022 China fishery statistical yearbook[M].Beijing:China Agriculture Press,2022.(in Chinese)
[4] 郭松林.鳗鲡病原菌的分类鉴定及相关免疫基础研究[D].厦门:集美大学,2006.GUO S L.Classification and identification of pathogenic bacteria of eel and related immune basic research[D].Xiamen:Jimei University,2006.(in Chinese)
[5] 熊静,赖晓健,余钦,等.7株鳗鲡致病性气单胞菌毒力基因胞外产物及其活性比较[J].华中农业大学学报,2017,36(1):76-85.XIONG J,LAI X J,YU Q,et al.Analysis of virulence genes,extracellular products and activities among seven Aeromonas strains isolated from eels[J].Journal of Huazhong Agricultural University,2017,36(1):76-85.(in Chinese)
[6] 张德锋,刘礼辉,李宁求,等.我国南方地区鱼源气单胞菌不同种类的流行特征[J].水产科学,2015,34(11):673-682.ZHANG D F,LIU L H,LI N Q,et al.Epidemic characteristics of different species of Aeromonas in diseased fish in southern China[J].Fisheries Science,2015,34(11):673-682.(in Chinese)
[7] 边宇.致病性维氏气单胞菌多重PCR检测方法的建立及初步应用[D].长春:吉林农业大学,2013.BIAN Y.Establishment and preliminary application of multiplex PCR diagnostic method on Aeromonas veronii[D].Changchun:Jilin Agricultural University,2013.(in Chinese)
[8] 付乔芳,邱军强,胡鲲,等.嗜水气单胞菌国内分离株的毒力因子分布与致病性相关性分析[J].生物学杂志,2011,28(6):53-57.FU Q F,QIU J Q,HU K,et al.The analyse of virulence factors-pathogenicity relationships of Aeromonas hydrophila strains isolated from China[J].Journal of Biology,2011,28(6):53-57.(in Chinese)
[9] 胡萌.江苏地区气单胞菌分离鉴定及强毒株生物学特性分析[D].南京:南京农业大学,2012.HU M.Isolation and identification of Aeromonas from Jiangsu and characterizations of virulent strains[D].Nanjing:Nanjing Agricultural University,2012.(in Chinese)
[10] 郭婧.嗜水气单胞菌分离株毒力基因型分析及胞外蛋白酶的表达、提取和蛋白研究[D].南京:南京农业大学,2009.GUO J.Analysis of types virulence genotypes in the different strains of Aeromonas hydrophila and expression,extraction and analysis of extracellular protease[D].Nanjing:Nanjing Agricultural University,2009.(in Chinese)
[11] ZHU Y G,JOHNSONT A,SU J Q,et al.Diverse and abundant antibiotic resistance genes in Chinese swine farms[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(9):3435-3440.
[12] 刘宇,直俊强,石奥,等.畜禽粪便中典型抗生素抗性基因的检测和分析[J].四川环境,2021,40(3):12-18.LIU Y,ZHI J Q,SHI A,et al.Detection and analysis of typical antibiotic resistance genes in animal manure[J].Sichuan Environment,2021,40(3):12-18.(in Chinese)
[13] 赵晓雨,苏浩昌,徐煜,等.渔用氧化剂对水源水和池塘水中磺胺类抗性基因sul1的去除作用[J].南方水产科学,2021,17(3):46-53.ZHAO X Y,SU H C,XU Y,et al.Removal of sulphonamide resistance sul1 gene in water source and pond water by fishery oxidants in aquaculture[J].South China Fisheries Science,2021,17(3):46-53.(in Chinese)
[14] LI S S,WEI R J,LIN Y Z,et al.A preliminary study of antibiotic resistance genes in domestic honey produced in China[J].Foodborne Pathogens and Disease,2021,18(12):859-866.
[15] RASSCHAERT G,HOUF K,IMBERECHTS H,et al.Comparison of five repetitive-sequence-based PCR typing methods for molecular discrimination of Salmonella enterica isolates[J].Journal of Clinical Microbiology,2005,43(8):3615-3623.
[16] BEAZ-HIDALGO R,FIGUERAS M J.Aeromonas spp.whole genomes and virulence factors implicated in fish disease[J].Journal of Fish Diseases,2013,36(4):371-388.
[17] HU M,WANG N,PAN Z H,et al.Identity and virulence properties of Aeromonas isolates from diseased fish,healthy controls and water environment in China[J].Letters in Applied Microbiology,2012,55(3):224-233.
[18] 邓玉婷,谭爱萍,张瑞泉,等.广东主要水产养殖地区气单胞菌耐药状况的调查分析[J].南方农业学报,2019,50(11):2375-2383.DENG Y T,TAN A P,ZHANG R Q,et al.Antimicrobial resistance of Aeromonas isolates from aquaculture areas in Guangdong[J].Journal of Southern Agriculture,2019,50(11):2375-2383.(in Chinese)
[19] 朱永肖.河南沿黄渔区气单胞菌的毒力与耐药性研究[D].新乡:河南师范大学,2018.ZHU Y X.The study on the virulence and resistance of Aeromonas in the Yellow River drainage basin of Henan[D].Xinxiang:Henan Normal University,2018.(in Chinese)
[20] SEN K,RODGERS M.Distribution of six virulence factors in Aeromonas species isolated from US drinking water utilities:a PCR identification[J].Journal of Applied Microbiology,2004,97(5):1077-1086.
[21] 郭睿,刘年锋,江小斌,等.6株鱼源嗜水气单胞菌的分子鉴定与毒力基因分析检测[J].福建水产,2014,36(2):87-95.GUO R,LIU N F,JIANG X B,et al.Molecular characterization of six strains of Aeromonas hydrophila isolated from fish as well as detection and analysis of virulence genes[J].Journal of Fujian Fisheries,2014,36(2):87-95.(in Chinese)
[22] 刘杰,黄艳华,黄钧,等.黄沙鳖源嗜水气单胞菌的致病力与毒力基因型相关性[J].中国水产科学,2015,22(4):698-706.LIU J,HUANG Y H,HUANG J,et al.Studies on the correlation with pathogenicity and virulence genes of Aeromonas hydrophila by Truogx sinensis[J].Journal of Fishery Sciences of China,2015,22(4):698-706.(in Chinese)
[23] 龙苏,韩书煜,牛志伟,等.胡子鲶致病性气单胞菌的分离鉴定及其致病力与毒力基因型相关性[J].水产学报,2016,40(3):308-317.LONG S,HAN S Y,NIU Z W,et al.Isolation and identification of pathogenic Aeromonas in Clarias fuscus and analysis of the correlation between its pathogenicity and virulence genotypes[J].Journal of Fisheries of China,2016,40(3):308-317.(in Chinese)
[24] 吴小梅,林茂,鄢庆枇,等.美洲鳗鲡及其养殖水体分离耐药菌的多样性和耐药性分析[J].水产学报,2015,39(7):1043-1053.WU X M,LIN M,YAN Q P,et al.Diversity and antimicrobial susceptibility of drug-resistant bacteria isolated from Anguilla rostrata and the farming water[J].Journal of Fisheries of China,2015,39(7):1043-1053.(in Chinese)
[25] 高智玲,纪雪,陈萍,等.致病性嗜水气单胞菌的分离鉴定及耐药性分析[J].中国人兽共患病学报,2016,32(4):400-405,411.GAO Z L,JI X,CHEN P,et al.Identification and antimicrobial resistance of pathogenic Aeromonas hydrophila[J].Chinese Journal of Zoonoses,2016,32(4):400-405,411.(in Chinese)
[26] 王小亮,徐立蒲,王静波,等.北京市主要养殖鱼类病原菌药物敏感性分析[J].北京农业,2012(36):79-81.WANG X L,XU L P,WANG J B,et al.The assay on sensibility of pathogens isolated from main cultured fish in Beijing[J].Beijing Agriculture,2012(36):79-81.(in Chinese)
[27] 靳晓敏,葛慕湘,张艳英,等.不同来源嗜水气单胞菌耐药基因检测[J].淡水渔业,2015,45(3):84-87,92.JIN X M,GE M X,ZHANG Y Y,et al.Detection of resistance genes in Aeromonas hydrophila strains[J].Freshwater Fisheries,2015,45(3):84-87,92.(in Chinese)
[28] ROBERTS M T M,ENOCH D A,HARRIS K A,et al.Aeromonas veronii biovar sobriabacteraemia with septic arthritis confirmed by 16S rDNA PCR in an immunocompetent adult[J].Journal of Medical Microbiology,2006,55(Pt 2):241-243.
[29] 苟小兰,王利,刘港彪.齐口裂腹鱼维氏气单胞菌的耐药性分析[J].西南民族大学学报(自然科学版),2013,39(5):674-678.GOU X L,WANG L,LIU G B.Analysis of drug resistance in Aeromonas veronii isolated from Schizothorax prenanti[J].Journal of Southwest University for Nationalities (Natural Science Edition),2013,39(5):674-678.(in Chinese)
[30] SUZUKI S,HOA P T P.Distribution of quinolones,sulfonamides,tetracyclines in aquatic environment and antibiotic resistance in Indochina[J].Frontiers in Microbiology,2012,3:67.