凡纳滨对虾(Litopenaeus vannamei)是中国主要的对虾养殖品种,具有生长速度快、抗病能力强和经济价值高等养殖优势[1]。随着凡纳滨对虾养殖业集约化程度的提高,养殖密度不断增大,水质持续恶化,疾病频发已成为制约对虾养殖业发展的主要因素[2]。根据感染病原的不同,虾类疾病主要分为病毒性疾病、细菌性疾病和寄生虫疾病。凡纳滨对虾养殖中常见的病毒性疾病包括白斑综合征(WSSV)[3]、桃拉综合征(TSV)[4]、传染性皮下及造血组织坏死病(IHHNV)[5]、虾血细胞虹彩病毒病(SHIV)[6]等;凡纳滨对虾的主要细菌性病原有弧菌(Vibrio)[7]、气单胞菌(Aeromonas)[8]和假单胞菌(Pseudomonas)[9]等,可引起对虾急性肝胰腺坏死病(AHPND)、白便综合征(WSF)等疾病;凡纳滨对虾寄生虫感染引起的寄生虫病主要有微孢子虫病(EHP)[10]、拟阿脑虫病(Paranophrys carcini spiralis)[11]和纤毛虫病(Ciliate)[12]等,同样给中国对虾养殖业带来了极大的经济损失。由于目前仍无疗效稳定、成本低廉和使用方便的产品化疫苗,抗生素仍然是治疗对虾疾病的主要药物,但伴随而来的药物残留和病原菌耐药性问题不容忽视[13]。
近年来,益生菌因具有无毒、无残留、无抗药性和无污染等特点,被广泛应用于水产养殖业。研究表明,益生菌具有抑制病原菌增殖、促进营养物质吸收利用及增强宿主抗病力的作用[14]。地衣芽孢杆菌(Bacillus licheniformis)属芽孢杆菌科,为革兰氏阳性菌,在土壤、堆肥和动物肠道中广泛分布,具有耐高温、耐酸和耐胆盐等特点,能以孢子的形式抵抗恶劣环境,具有较强的环境适应能力[15]。该菌可通过产生抗菌活性物质抑制致病菌增殖[16],同时还可通过分泌丰富的胞外酶系来降解水体中的饵料、排泄物和浮游生物残体等残留有机物,避免有机物分解耗氧及败坏水质[17]。对水产动物研究发现,饲喂地衣芽孢杆菌后,异育银鲫(Carassiusauratus gibelio)体质量及表观消化率显著增加,饵料系数明显降低,肠道组织中蛋白酶活性显著提高[18];在饲料或养殖水体中添加地衣芽孢杆菌,凡纳滨对虾的生长性能和肝胰脏免疫酶活性显著提高[19],抗白斑综合征病毒感染能力明显增强[20]。由此可见,地衣芽孢杆菌具有开发为水产动物益生菌制剂的潜力。
目前,应用于水产动物的益生菌菌株大多分离自陆生动物,其宿主特性和生存环境与水生动物明显不同:一方面,水产动物为变温动物,而陆生动物为恒温动物,二者体温具有差异;另一方面,陆生动物胃肠道结构及环境pH与水产动物有较大差别。而菌株的生长、细菌素产量及其在肠道中的定植能力均受环境pH和温度的影响,因此,与其他来源益生菌相比,宿主源益生菌具有更好的定植能力和益生效果[21]。为获得虾源益生菌菌株,本研究中从健康凡纳滨对虾肠道内筛选出一株菌株,从形态学、生理生化及分子特征等方面对该菌株进行了鉴定,并对其耐受性、安全性及生长特性进行了评估,以期为凡纳滨对虾微生态制剂的开发与应用提供科学依据。
1 材料与方法
1.1 材料
健康凡纳滨对虾体长为(5.2±0.2)cm,体质量为(3.1±0.4)g,购自天津立达海水资源开发有限公司,用于肠道益生菌菌株的分离和安全性检测试验。在凡纳滨对虾育苗及养殖期间,未向饲料及养殖水体中添加抗生素及益生菌制剂。
病原菌拮抗试验所用菌株为副溶血弧菌(Vibrio parahaemolyticus)、嗜水气单胞菌(Aeromonas hydrophila)和维氏气单胞菌(Aeromonas veronii),均由天津农学院水产生态及养殖重点实验室保存并提供。
益生菌筛选所用MRS培养基,益生菌耐受性、生长特性及安全性检测所用LB培养基的配制均参考《分子克隆实验指南》[22]。
1.2 方法
1.2.1 芽孢杆菌初筛及纯化 用体积分数为75%的乙醇擦拭凡纳滨对虾体表,无菌环境中采集对虾完整肠道组织,并使用匀浆器研磨匀浆,置于80 ℃水浴锅中水浴10 min。随后,用质量分数为0.9%的无菌生理盐水对匀浆液进行10倍梯度稀释,分别取0.1 mL各稀释度样品涂布于MRS固体培养基上,37 ℃下恒温培养24 h。选择菌落清晰、分散的平板,挑取单菌落进行纯化,获得一株具有耐高温能力的菌株,并命名为RHVJ,随后将该菌株纯培养后保存到甘油中备用。
1.2.2 菌株的形态学观察及生理生化特征鉴定 将纯化后的单菌落接种到MRS固体培养基上,37 ℃下培养24 h,观察菌落形态;挑取单菌落进行革兰氏(购自北京索莱宝科技有限公司)染色,镜检观察细菌菌体形态及颜色。按照细菌微量生化反应管(购自杭州微生物试剂有限公司)使用说明书对分离菌株的生化特征进行测定,参考《伯杰细菌鉴定手册》[23]进行归类判定。
1.2.3 分子生物学鉴定 挑取单菌落接种至MRS液体培养基中,37 ℃下培养24 h,使用细菌基因组DNA提取试剂盒(购自北京百泰克生物技术有限公司)提取菌液DNA。使用16S rDNA通用引物27F(5′AGAGTTTGATCATGGCTCAG 3′)和1492R(5′GGTTACCTTGTTACGACTT 3′),以及gyrB基因通用引物UP1(5′GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA 3′)和UP2r(5′AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRT- CNGTCAT 3′)进行PCR扩增。
PCR扩增反应体系(25 μL):2×Taq PCR Master Mix 10 μL,上、下游引物各1 μL,DNA模板2 μL,无菌双蒸水11 μL。PCR反应程序:95 ℃下预变性4 min,94 ℃下变性1 min,55 ℃下退火1 min,72 ℃下延伸1 min,共进行30个循环;最后在72 ℃下再延伸10 min,4 ℃下结束反应。扩增产物经10 g/L琼脂糖凝胶检测后,送至生工生物工程(上海)股份有限公司测序,测序所得序列通过NCBI-Blast在线软件进行检索分析,采用MEGA 6.0软件构建系统发育树。
1.2.4 菌株RHVJ耐受性试验 将菌株RHVJ接种到LB液体培养基中,37 ℃下培养至对数生长期,用于耐胆盐、耐pH和耐高温试验。
1)耐胆盐试验。取RHVJ菌株菌液,以2%(体积分数,下同)的接种量分别接种于胆盐质量浓度为0、0.2、0.4、0.6、0.8、1.0、1.2 g/L 的LB液体培养基中。37 ℃下恒温培养24 h后,使用分光光度计测定菌液在600 nm波长处的吸光值(OD600 nm),每个胆盐浓度组设置3个平行。
2)耐pH试验。将待测菌液以10%的接种量分别接种于pH为1、3、5、7、9、11的LB液体培养基中,37 ℃下恒温培养24 h后,使用分光光度计测定菌液OD600 nm值,每个pH组设置3个平行。
3)耐高温试验。将RHVJ菌液以5%的接种量分别接种于12组等量LB液体培养基中,其中,6组分别在 37、50、60、70、80、90 ℃条件下水浴5 min,另外6组分别在37、50、60、70、80、90 ℃条件下水浴15 min。水浴结束后,37 ℃下恒温培养24 h,用分光光度计测定菌液的OD600 nm值,每组设置3个平行。
1.2.5 菌株RHVJ生长特性测定 参照罗璋等[24]的方法,将等量(50 mL)LB液体培养基分装至250 mL锥形瓶中,使用NaOH(1 mol/L)或HCl(1 mmol/L)和NaCl调节LB液体培养基中的pH和盐度。随后,将连续传代两次培养的RHVJ菌液按2%的接种量接种于LB培养基中。在37 ℃和pH 7.0条件下,检测盐度分别为0、20、30、40、50时RHVJ的生长特性;在37 ℃和盐度20条件下,检测pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0时RHVJ的生长特性;在pH 7.0和盐度20的条件下,检测培养温度分别为27、32、37、42 ℃时RHVJ的生长特性。以上各组均设置3个平行,并在恒温摇床中以150 r/min培养,每2 h测定一次菌液OD600 nm值,直至48 h检测完毕。
1.2.6 病原菌拮抗试验 用牛津杯法[25]检测RHVJ对病原菌(副溶血弧菌、嗜水气单胞菌和维氏气单胞菌)的拮抗能力。将待测菌株RHVJ和病原菌传代培养后分别制备为1×107 、1×106 CFU/mL的菌悬液。将牛津杯竖直放置于已均匀涂布病原菌菌液的LB固体培养基上,随后注入200 μL RHVJ菌液,密封,37 ℃下培养24 h,测量抑菌圈大小,每种浓度的病原菌设置3个平行。
1.2.7 菌株RHVJ安全性检测 将40尾健康凡纳滨对虾随机分为4组,每组放置10尾虾。其中,3组对虾肌肉注射100 μL浓度分别为1×106、1×107、1×108 CFU/mL的RHVJ菌悬液;1组(对照组)对虾肌肉注射等量无菌生理盐水。连续观察7 d,记录对虾发病死亡情况。
1.3 数据处理
采用Graph Pad Prism 7.0软件进行统计分析。数据集采用Shapiro-Wilk检验法进行正态性检验。对于呈正态分布的数据,采用单因素方差分析和Tukey多重比较进行差异分析;对于非参数数据集,采用Kruskal-Wallis检验和Dunn多重比较进行差异分析。显著性水平设为0.05。
2 结果与分析
2.1 菌株形态特征和生理生化特性
从健康凡纳滨对虾肠道中分离获得一株菌株RHVJ,对其菌落形态进行观察,结果显示,该菌单菌落边缘整齐,为圆形、不透明,有乳白色的凸起(图1(a))。革兰氏染色结果显示,RHVJ为革兰氏阳性杆状细菌(图1(b))。生理生化试验结果表明:分离菌株能分解葡萄糖、淀粉、山梨醇、七叶苷、水杨素和尿素,并具有产酸和产气的能力;可使明胶液化;ONPG、V-P、甲基红、精氨酸双水解酶和硝酸盐还原等试验结果均为阳性;不可分解胆汁七叶苷、肌醇、卫茅醇、乳糖、葡萄糖酸盐、枸橼酸盐和酒石酸盐;不可利用赖氨酸和鸟氨酸;N-乙酰葡萄糖胺、硫化氢和蛋白胨水(靛基质)试验结果呈阴性(表1)。根据该菌株的形态学特征和生理生化特性,初步判定菌株RHVJ属于芽孢杆菌属(Bacillus)。
表1 菌株RHVJ的生理生化特性
Tab.1 Physiological and biochemical characteristics of the strain RHVJ

生化项目 biochemical item结果 resultV-P试验V-P test+甲基红试验methyl red test+葡萄糖glucose+乳糖lactose—淀粉amylum+葡萄糖酸盐gluconate—赖氨酸lysine—鸟氨酸ornithine—山梨醇sorbitol+卫茅醇weimao alcohol—尿素urea+水杨素salicin+枸橼酸盐(西蒙氏)citrate (Simmons)—N-乙酰葡萄糖胺N-acetylglucosamine—精氨酸双水解酶arginine dihydrolase+硝酸盐还原nitrate reduction+肌醇inositol—蛋白胨水(靛基质)peptone water(indole)—酒石酸盐tartrate—硫化氢hydrogen sulfide—七叶苷aescin+胆汁七叶苷bile aescin—β-半乳糖苷ONPG+明胶gelatin+
注:+表示阳性;—表示阴性。
Note:+ positive;—negative.
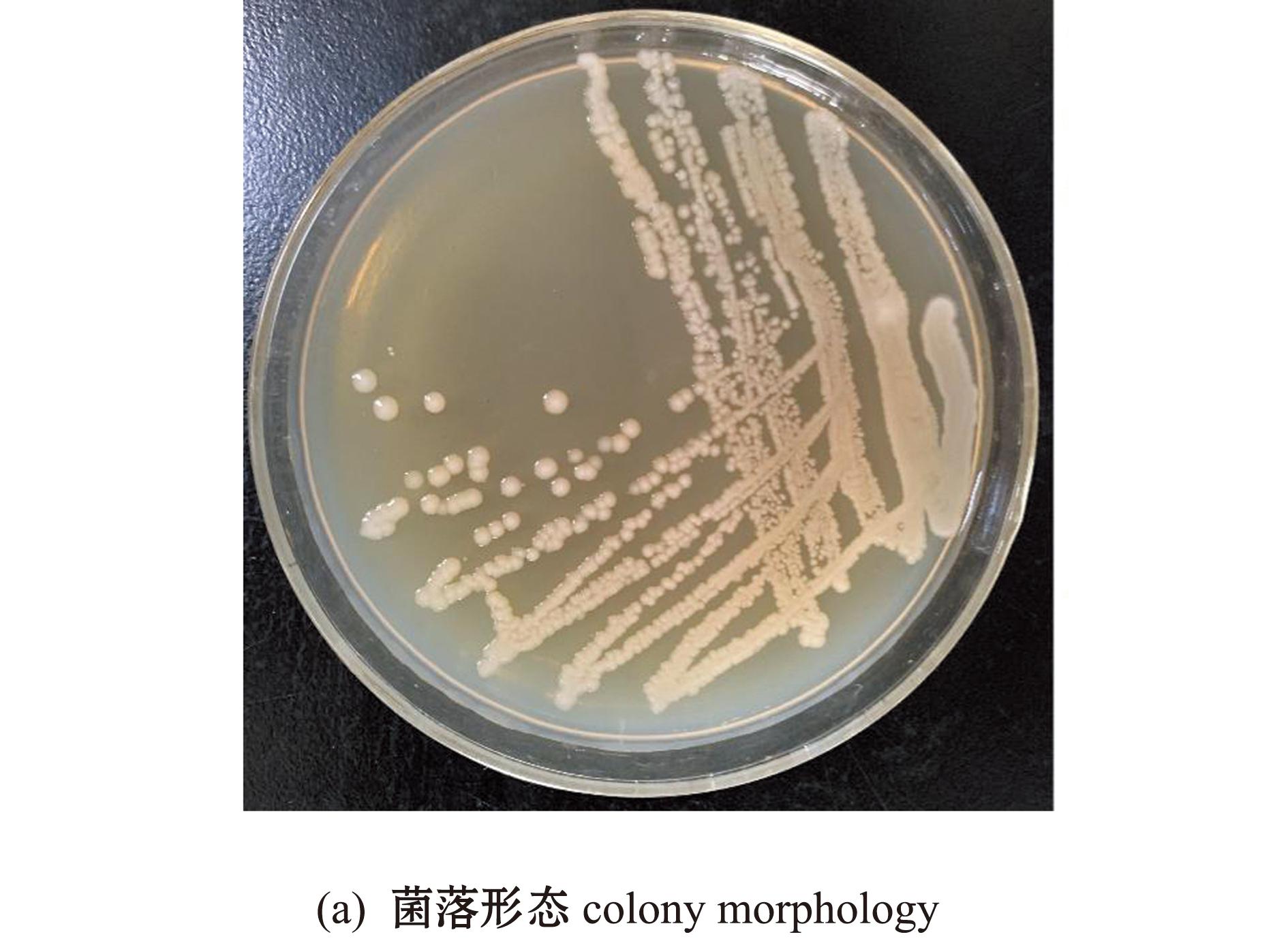
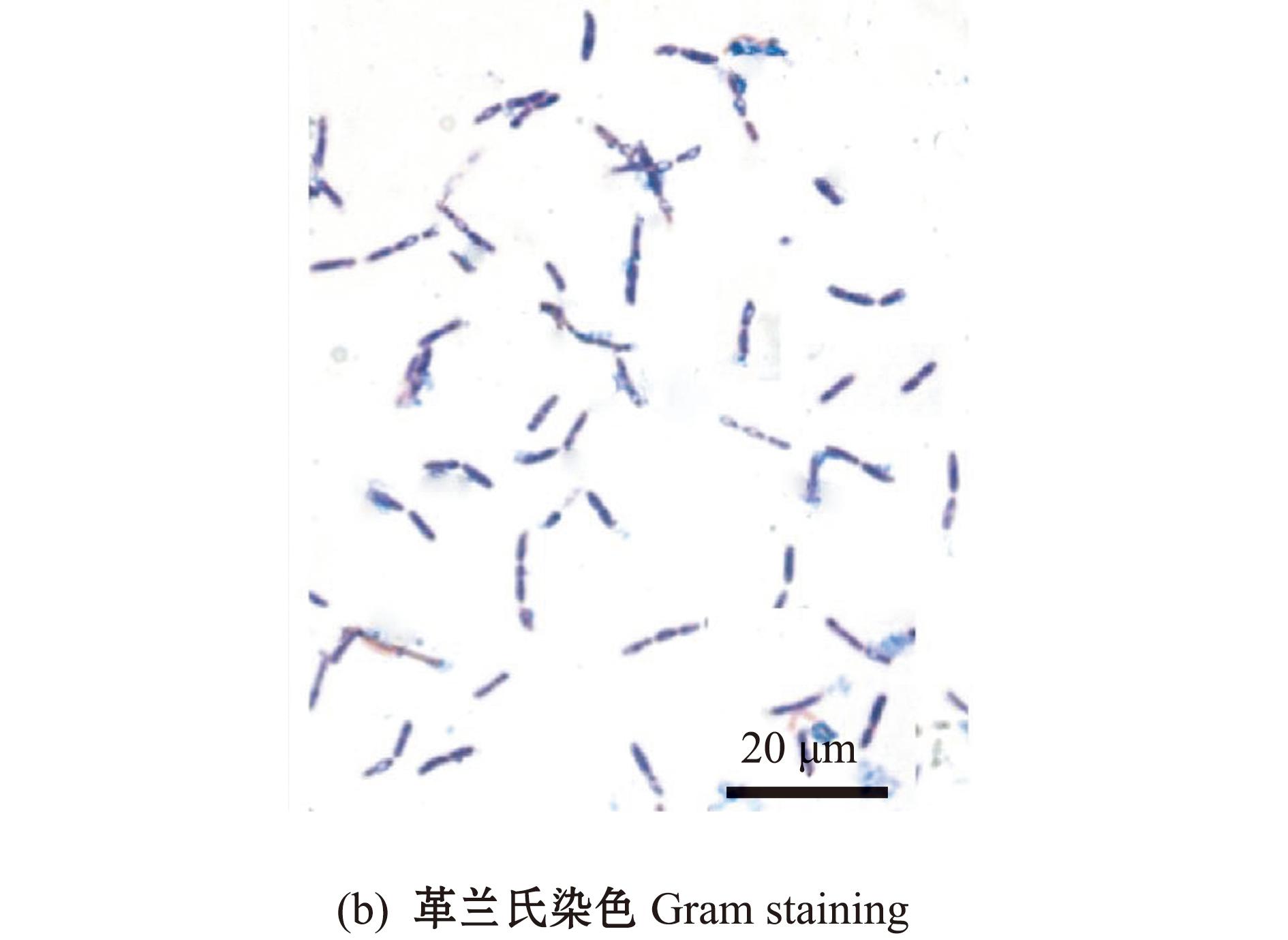
图1 菌株RHVJ的菌落形态和菌体形态
Fig.1 Colony morphology and micro-morphology of strain RHVJ
2.2 分子生物学特征
以RHVJ基因组DNA为模板,通过16S rDNA扩增获得大小为1 411 bp的基因片段(图2(a))。将扩增后测序所得序列在NCBI上进行Blast同源性比对,结果表明,菌株RHVJ与地衣芽孢杆菌标准菌株MH305331.1、NR074923.1基因序列的一致性为100%。用MEGA 6.0软件构建系统发育树,结果显示,菌株RHVJ与地衣芽孢杆菌KR018738.1、MH305331.1和LN774355.1的亲缘关系最近,聚为一支(图3)。
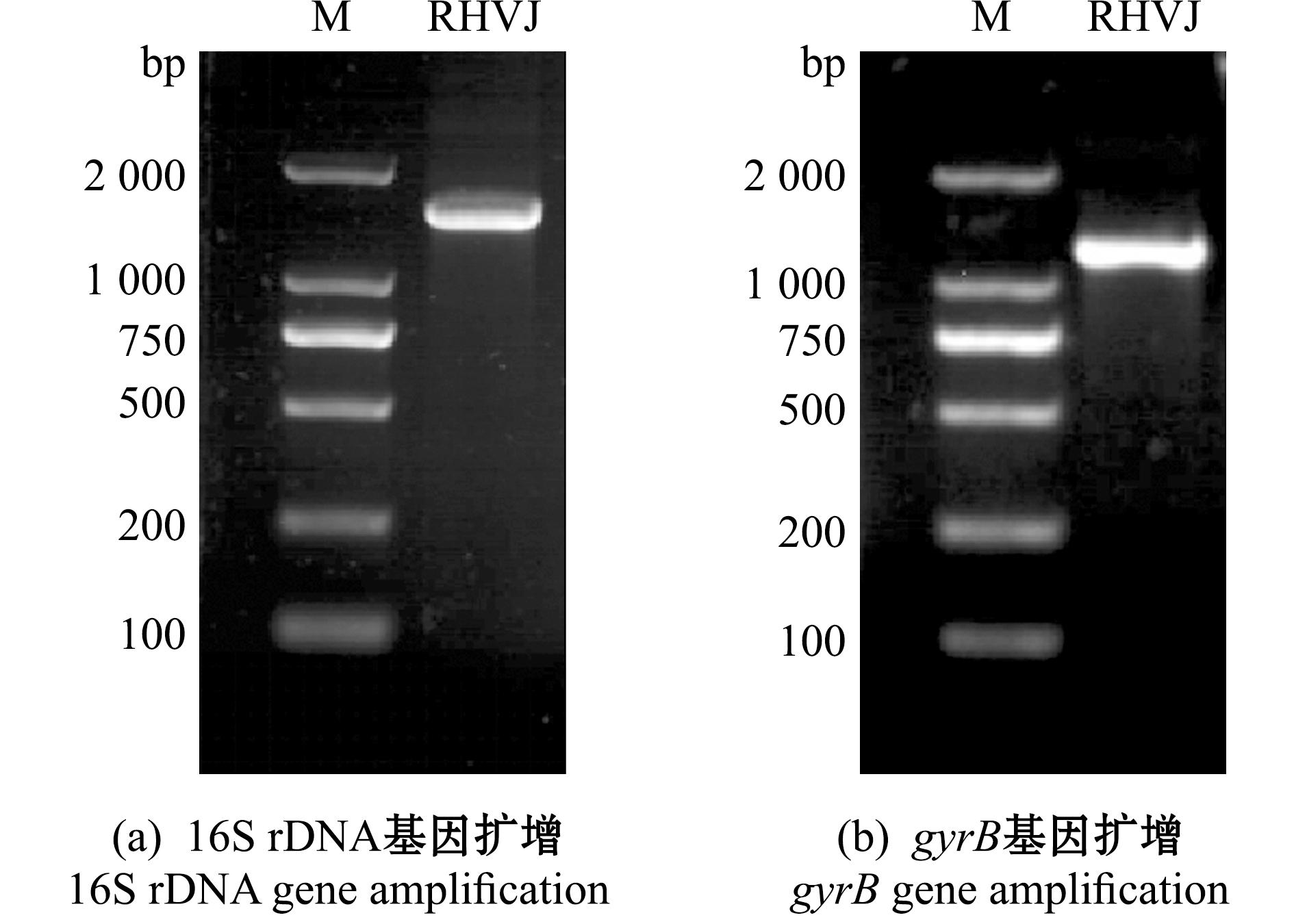
图2 菌株RHVJ的基因扩增电泳
Fig.2 Electrophoresis of gene amplification of strain RHVJ
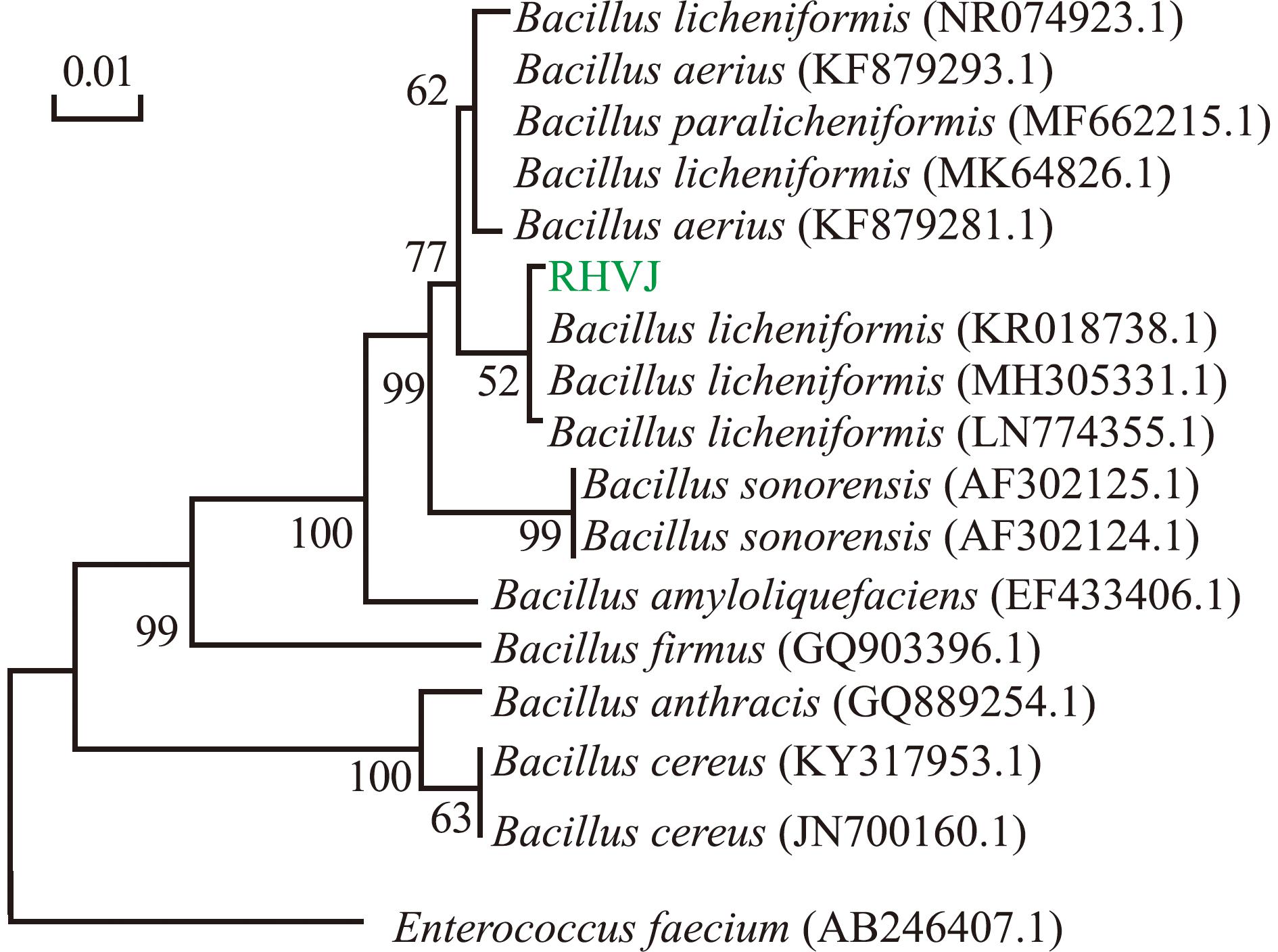
图3 基于16S rDNA扩增序列构建的菌株RHVJ系统发育树
Fig.3 Phylogenetic tree of strain RHVJ constructed by 16S rDNA amplification sequence
菌株RHVJ gyrB基因扩增所得的基因片段为1 143 bp(图2(b));将gyrB基因序列在NCBI中进行比对,结果表明,菌株RHVJ与地衣芽孢杆菌CP038186.1、CP023729.1基因序列的一致性为100%。在系统发育树中,菌株RHVJ与地衣芽孢杆菌KF952577.1聚为一支(图4)。
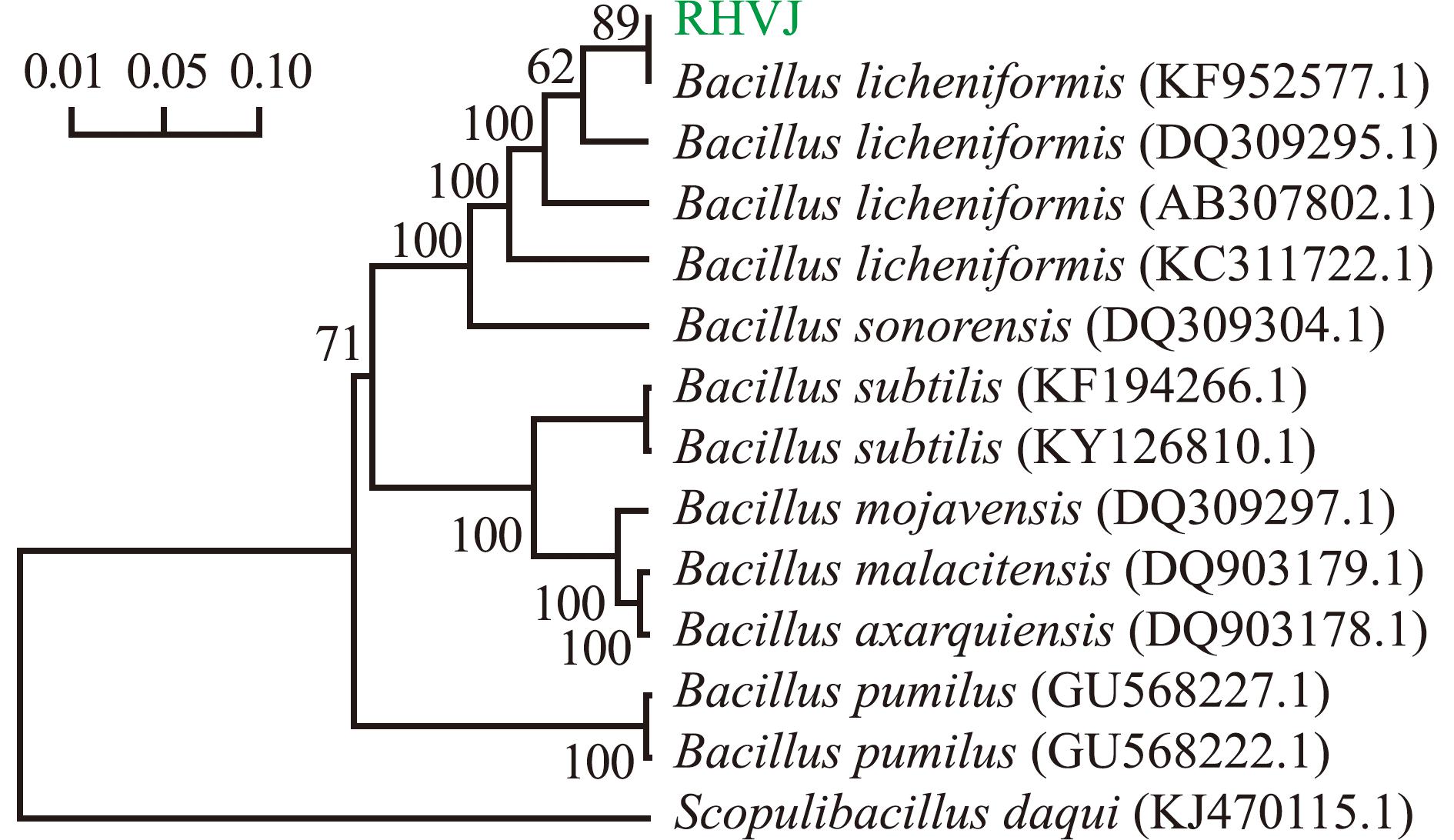
图4 基于gyrB扩增序列构建的菌株RHVJ系统发育树
Fig.4 Phylogenetic tree of strain RHVJ constructed by gyrB amplification sequence
综合RHVJ菌落与菌体形态、生理生化特征及16S rDNA、gyrB序列分析结果,最终判定菌株RHVJ为地衣芽孢杆菌。
2.3 病原菌拮抗试验
病原菌拮抗试验结果表明,地衣芽孢杆菌RHVJ对副溶血弧菌和维氏气单胞菌的生长具有抑制作用,抑菌圈直径分别为15、9 mm,而对嗜水气单胞菌生长则无影响(表2)。
表2 菌株RHVJ对指示菌的抑制效果
Tab.2 Inhibition effect of strain RHVJ on indicator bacteria

菌株strain抑菌圈直径/mmdiameter of inhibition zone维氏气单胞菌(Aeromonas veronii)9副溶血弧菌(Vibro parahaemolyticus)15嗜水气单胞菌(Aeromonas hydrophila)0
2.4 安全性试验
安全性试验结果显示,对凡纳滨对虾注射不同浓度(1.0×106、1.0×107、1.0×108 CFU/mL)地衣芽孢杆菌RHVJ后,7 d内均未引起虾死亡,表明菌株RHVJ对凡纳滨对虾具有安全性。
2.5 耐受性试验
2.5.1 胆盐耐受 从图5(a)可见,37 ℃下恒温培养24 h后,菌株RHVJ在胆盐质量浓度为0~1.2 g/L的LB液体培养基中均具有增殖能力,但随着胆盐浓度的升高,菌株RHVJ的增殖能力减弱。其中,在胆盐质量浓度为0.2~0.6 g/L条件下,RHVJ菌液浓度与对照组(0 g/L)无显著性差异(P>0.05);在胆盐质量浓度为0.8~1.2 g/L条件下,RHVJ菌液浓度较对照组显著降低(P<0.05)。
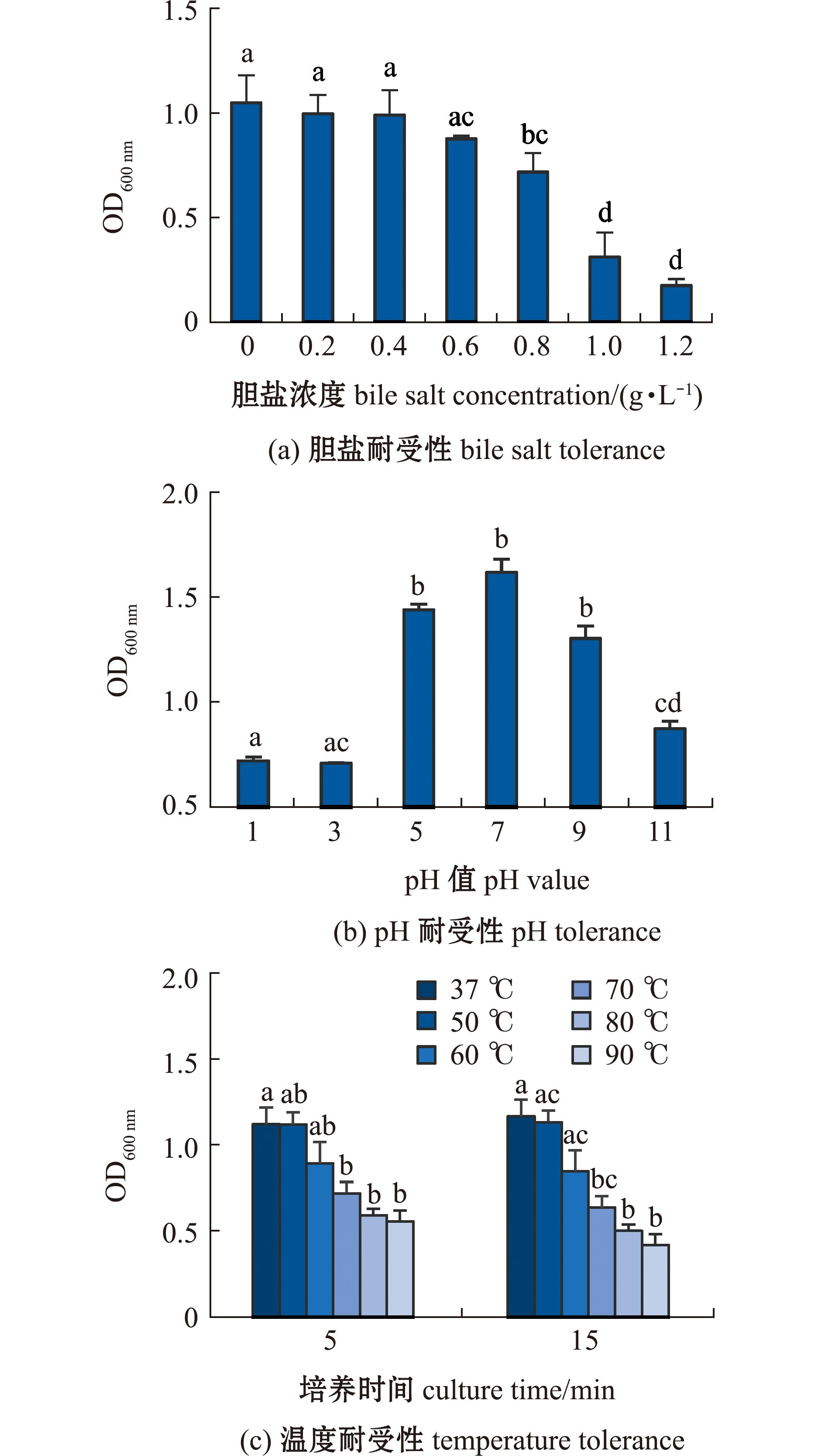
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences.
图5 菌株RHVJ耐受性试验
Fig.5 Tolerance test of strain RHVJ
2.5.2 pH耐受 从图5(b)可见,37 ℃下培养24 h后,与中性pH(pH 7)条件相比,菌株RHVJ的增殖速率随pH的升高或降低均减小。其中,菌液终浓度在pH分别为5、7、9的培养环境中显著高于pH为1、3、11的培养环境(P<0.05)。
2.5.3 高温耐受 从图5(c)可见,经不同温度处理后的菌株RHVJ均可继续增殖,但其生长速率随处理温度的升高而受到明显抑制。与37 ℃处理组相比,经过高温(70~90 ℃)处理后的RHVJ菌株培养24 h后的终浓度显著降低(P<0.05);而37、50、60 ℃处理组的菌液终浓度则无明显差异(P>0.05)。此外,高温处理菌液5、15 min对其终浓度无显著性影响(P>0.05)。
2.6 菌株RHVJ的生长特性
菌株RHVJ在27、32、37、42 ℃温度条件下均可生长,其中,在27 ℃条件下生长速率最快,细菌终浓度最高(图6(a))。
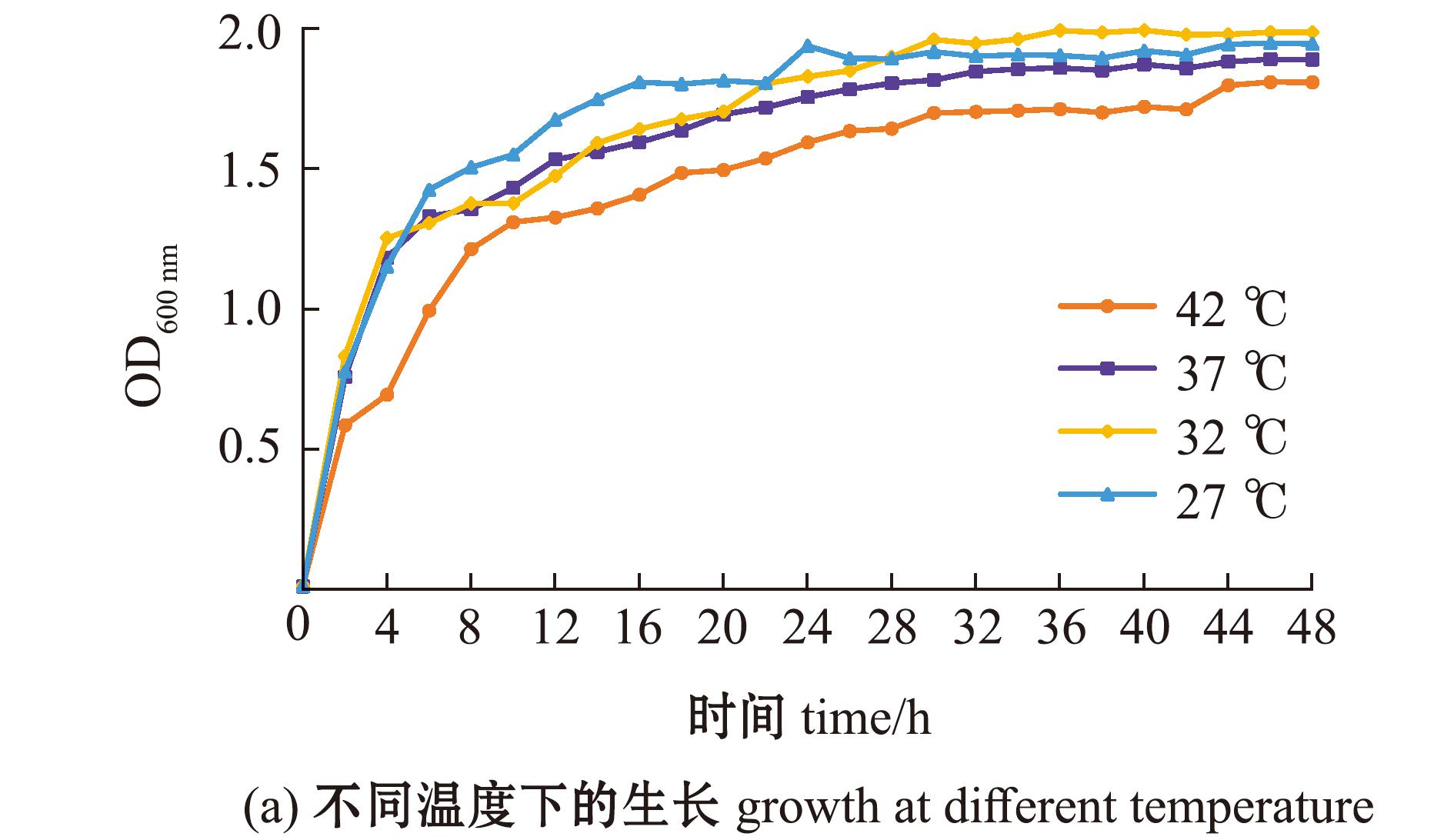
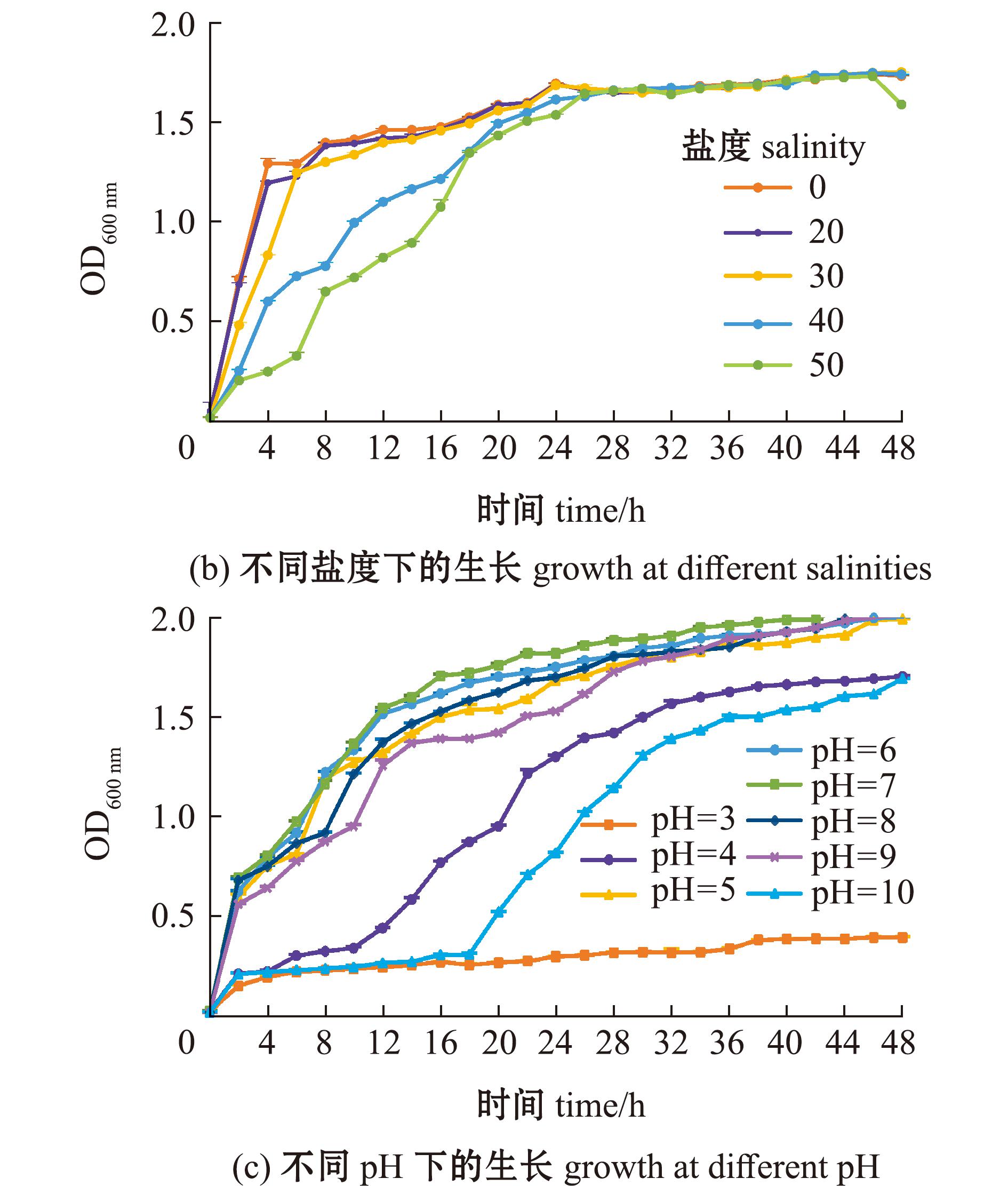
图6 菌株RHVJ生长曲线
Fig.6 Growth curve of strain RHVJ
菌株RHVJ在0~50盐度条件下均可生长,并可得到终浓度相近的菌液。其中,培养0~22 h时,菌株RHVJ在0~30盐度条件下生长速率较快,在40和50盐度条件下生长受到抑制(图6(b))。
菌株在pH为4~10环境条件下均可生长,pH为5~9时可得到终浓度相近的菌液。其中,当pH为3时,该菌生长受到抑制;当pH分别为4、10时,细菌生长延滞期明显延长;当pH为7时,该菌可获得最快生长速率(图6(c))。
综上,当温度为27 ℃、pH为7、盐度为20时,菌株RHVJ可获得最适生长环境。
3 讨论
3.1 菌株RHVJ的分离鉴定
水产动物胃肠道及养殖水环境是水产动物源益生菌筛选的主要来源[26]。本研究中,从健康凡纳滨对虾肠道中分离出一株高温耐受性强的菌株RHVJ,形态学观察结果显示,该菌具有芽孢杆菌属的关键表型特征[27],其生化特性与从奶牛瘤胃中筛选到的地衣芽孢杆菌[28]一致。随后,对菌株RHVJ的16S rDNA和gyrB序列进行分析比对,结果显示,该菌基因序列与地衣芽孢杆菌一致性高达100%,在系统发育树上聚为同一分支。综合以上结果,可以确定本研究中分离到的菌株RHVJ为地衣芽孢杆菌[29]。
3.2 菌株RHVJ对病原菌的拮抗作用
近年来,细菌性疾病的暴发给凡纳滨对虾养殖业带来了不可估量的损失。因此,应用具有病原菌拮抗特性的益生菌对抗潜在病原体至关重要。研究表明,地衣芽孢杆菌可通过释放抗菌肽、溶菌酶、生物表面活性剂、细菌素和苯乙酸等物质抑制病原菌生长[30]。王建超[31]和黄晓东等[32]发现,分离自鲤(Cyprinus carpio)和中华绒螯蟹(Eriocheir sinensis)肠道的地衣芽孢杆菌对弗氏柠檬酸杆菌(Citrobacter freundii)、金黄色葡萄球(Staphylococcus aureus)和嗜水气单胞菌的生长均有抑制作用。方卫东等[29]从海水养殖区底泥筛选到一株可产纤维素酶的地衣芽孢杆菌,该菌对溶藻弧菌(Vibrio alginolyticus)、副溶血弧菌、哈维氏弧菌(Vibrio harveyi)、嗜水气单胞菌具有拮抗效果。本研究中,从凡纳滨对虾肠道中筛选得到的地衣芽孢杆菌RHVJ为养殖对虾常见致病菌,对维氏气单胞菌和副溶血弧菌均表现出拮抗作用,提示其可用于预防及治疗维氏气单胞菌和副溶血弧菌感染引起的细菌性疾病。然而,菌株RHVJ对嗜水气单胞菌生长未产生影响,这表明,在实际生产中使用不同配伍的益生菌混合制剂,可增强其对更广泛潜在病原体的抑制作用。
3.3 菌株RHVJ 对凡纳滨对虾的安全性评价
就益生菌应用而言,只有无毒素的候选菌种才应被考虑纳入益生菌使用范围,并且需要通过动物体内试验来进行安全性评价[33]。目前,芽孢杆菌属中的某些菌种已被作为益生菌添加到养殖动物饲料中,并已取得良好效果。尽管如此,从复杂微生物群落中分离出的细菌是否存在潜在致病性仍不容忽视,如从患病金鱼(Carassius auratus)肝脏内分离到的一株地衣芽孢杆菌,其产生的内毒素可引起金鱼嗜睡、厌食等症状[33]。因此,安全性试验是益生菌筛选及开发过程中的重要环节。安健等[34]将剂量为1×105~1×109 CFU/g 的地衣芽孢杆菌HS140菌液注射至黄颡鱼(Tachysurus fulvidraco)体内,7 d内未引起黄颡鱼死亡,表明该菌对黄颡鱼无致病性。本研究中,注射1×106~1×108 CFU/mL浓度的地衣芽孢杆菌RHVJ,7 d内未引起凡纳滨对虾死亡,表明该菌对凡纳滨对虾无致病性,具备在水产养殖中应用的安全性。
3.4 地衣芽孢杆菌RHVJ的耐受性及生长特性
胃肠道内的胃液和胆汁可通过破坏细胞膜,进而引起DNA损伤的方式发挥其抗菌作用[35]。因此,具有耐消化道低pH和胆盐等不利环境因素能力的益生菌菌株才能在动物消化道中定植[36]。同时,在饲料制备过程中,添加到饲料中的益生菌菌株活性会受到高温制粒的影响,一些对高温敏感的菌株若未进行包被或其他工艺处理,可能会在饲料制粒过程中失活。因此,具有耐酸、耐胆盐和耐高温能力的益生菌菌株在实际生产和应用过程中可能会更好地发挥其益生作用。孟小亮[37]发现,分离自黄颡鱼肠道的地衣芽孢杆菌,在pH为2~4、胆盐质量浓度为0.15~0.60 g/L、温度为90~100 ℃的培养环境中仍可生长。分离自中华绒螯蟹的地衣芽孢杆菌对高温(90 ℃)及弱酸(pH 5)同样具有一定耐受性[38]。本研究中,地衣芽孢杆菌RHVJ在酸性(pH 为1~6)、高胆盐质量浓度(1.2 g/L)及高温环境(90 ℃)中仍可生长,表明该菌株可耐受胃肠道环境。
本研究中,还对菌株RHVJ生长特性进行了研究。结果显示,RHVJ菌株在温度27 ℃、pH 7、盐度20的环境条件下生长良好。此外,尽管盐度(0~50)、pH(4~10)和温度(27~42 ℃)等不同条件对地衣芽孢杆菌RHVJ的生长产生了一定影响,但培养48 h后,该菌仍进行了增殖并获得了较高的终浓度,表明菌株RHVJ具有较好的环境适应性。同时,本试验结果为从凡纳滨对虾肠道分离出的地衣芽孢杆菌提供了一个相对优化的生长条件,为进一步研究该菌提供了有益参考。
4 结论
1)从凡纳滨对虾肠道中筛选出一株菌株RHVJ,经鉴定为地衣芽孢杆菌。
2)菌株RHVJ具体外抑菌能力,对凡纳滨对虾无致病性,安全性良好。
3)菌株RHVJ具耐高温、耐胆盐和耐酸性能,表明该菌可耐受胃肠道环境。
本研究结果丰富了水产益生菌候选菌株的种类,为凡纳滨对虾微生态制剂的开发与应用提供了科学依据。
[1] MOSS S M,MOSS D R,ARCE S M,et al.The role of selective breeding and biosecurity in the prevention of disease in penaeid shrimp aquaculture[J].Journal of Invertebrate Pathology,2012,110(2):247-250.
[2] LI F H,XIANG J H.Recent advances in researches on the innate immunity of shrimp in China[J].Developmental and Comparative Immunology,2013,39(1/2):11-26.
[3] GROSS PS,BARTLETT T C,BROWDY C L,et al.Immune gene discovery by expressed sequence tag analysis of hemocytes and hepatopancreas in the Pacific white shrimp,Litopenaeus vannamei,and the Atlantic white shrimp,L.setiferus[J].Developmental and Comparative Immunology,2001,25(7):565-577.
[4] 黄新新,莫胜兰,陆承平.RT-PCR法检测我国东南沿海凡纳滨对虾的桃拉综合征病毒[J].中国病毒学,2005,20(5):546-548.
HUANG X X,MO S L,LU C P.RT-PCR detection of Taura syndrome virus in Penaeus vannami from southeast seaside of China[J].Virologica Sinica,2005,20(5):546-548.(in Chinese)
[5] 张娜,谢艳辉,袁俊杰,等.传染性皮下及造血器官坏死病毒诱导南美白对虾抗白斑综合征病毒感染的初步研究[J].中国动物检疫,2016,33(11):94-97.
ZHANG N,XIE Y H,YUAN J J,et al.A preliminary study on induced resistance to white spot syndrome virus infection in Penaeus vannamei through pre-infection with infectious hypodermal and hematopoietic necrosis virus[J].China Animal Health Inspection,2016,33(11):94-97.(in Chinese)
[6] 施礼科,叶键,王力,等.一例南美白对虾十足目虹彩病毒来源初探[J].科学养鱼,2022(12):56-57.
SHI L K,YE J,WANG L,et al.Preliminary study on the source of a case of Penaeus vannamei decapod iridovirus[J].Scientific Fish Farming,2022(12):56-57.(in Chinese)
[7] 吴俊敏,王艺,郝婧薇,等.湛江地区患病对虾池塘中副溶血性弧菌的MLST分型和新型耐药毒株的分离鉴定[J].大连海洋大学学报,2023,38(1):59-67.
WU J M,WANG Y,HAO J W,et al.MLST typing of Vibrio parahaemolyticus from diseased shrimp ponds in Zhanjiang area and isolation and identification of novel drug-resistant strains[J].Journal of Dalian Ocean University,2023,38(1):59-67.(in Chinese)
[8] ZHOU H H,GAI C L,YE G F,et al.Aeromonas hydrophila,an emerging causative agent of freshwater-farmed whiteleg shrimp Litopenaeus vannamei[J].Microorganisms,2019,7(10):450.
[9] 李文珍,王洪奇,王俊义,等.中国对虾红腿病致病菌的研究[J].水产科学,1992,11(6):1-6.
LI W Z,WANG H Q,WANG J Y,et al.Studies on pathogenic bacterium of Chinese prawn (Penaeus orientalis)“red-leg” disease[J].Fisheries Science,1992,11(6):1-6.(in Chinese)
[10] 彭张明,陈妃业,蒲桂川.对虾肝胰腺微孢子虫病与虾肝肠胞虫关系的研究进展[J].水产学杂志,2020,33(5):74-81.
PENG Z M,CHEN F Y,PU G C.Research progress on relationship between hepatopancreatic microsporidiosis and Enterocytozoon hepatopenaei in penaeid shrimp:a review[J].Chinese Journal of Fisheries,2020,33(5):74-81.(in Chinese)
[11] 周丽,宫庆礼,俞开康.人工越冬对虾拟阿脑虫病病理组织观察[J].海洋湖沼通报,1997(1):33-37.
ZHOU L,GONG Q L,YU K K.Observations on the histopathology of a systemic ciliate (Paranophrys carcini spiralis) disease in the over-wintering prawn,Penaeus chinensis[J].Transaction of Oceanology and Limnology,1997(1):33-37.(in Chinese)
[12] 石彭灵,刘兰海,杨品红,等.凡纳滨对虾感染纤毛虫期间对环境因子的响应[J].湖南文理学院学报(自然科学版),2022,34(1):26-30,74.
SHI P L,LIU L H,YANG P H,et al.Response of environmental factors to Litopenaeus vannamei infected with Ciliates in freshwater culture[J].Journal of Hunan University of Arts and Science(Nature Science Edition),2022,34(1):26-30,74.(in Chinese)
[13] BRUGMAN S,IKEDA-OHTSUBO W,BRABER S,et al.A comparative review on microbiota manipulation:lessons from fish,plants,livestock,and human research[J].Frontiers in Nutrition,2018,5:80.
[14] WU Z B,QI X Z,QU S Y,et al.Dietary supplementation of Bacillus velezensis B8 enhances immune response and resistance against Aeromonas veronii in grass carp[J].Fish &Shellfish Immunology,2021,115:14-21.
[15] VANAKI P,ZABOLI F,KABOOSI H,et al.Isolation and identification of keratinolytic probiotic Bacillus licheniformis bacteria from the soil below poultry slaughterhouse waste[J].Brazilian Journal of Biology,2022,84:e257473.
[16] VINOJ G,VASEEHARAN B,THOMAS S,et al.Quorum-quenching activity of the AHL-lactonase from Bacillus licheniformis DAHB1 inhibits Vibrio biofilm formation in vitro and reduces shrimp intestinal colonisation and mortality[J].Marine Biotechnology,2014,16(6):707-715.
[17] DINDHORIA K,KUMAR S,BALIYAN N,et al.Bacillus licheniformis MCC 2514 genome sequencing and functional annotation for providing genetic evidence for probiotic gut adhesion properties and its applicability as a bio-preservative agent[J].Gene,2022,840:146744.
[18] 刘波,刘文斌,王恬.地衣芽孢杆菌对异育银鲫消化机能和生长的影响[J].南京农业大学学报,2005,28(4):80-84.
LIU B,LIU W B,WANG T.Effects of Bacillus licheniformis on digestive performance and growth of allogynogenetic crucian[J].Journal of Nanjing Agricultural University,2005,28(4):80-84.(in Chinese)
[19] 刘强强,陈旭,谢家俊,等.饲料或养殖水体中添加地衣芽孢杆菌对凡纳滨对虾生长性能和免疫力的影响[J].动物营养学报,2017,29(8):2808-2816.
LIU Q Q,CHEN X,XIE J J,et al.Effects of adding Bacillus licheniformis to diet or aquaculture water on growth performance and immunity of Litopenaeus vannamei[J].Chinese Journal of Animal Nutrition,2017,29(8):2808-2816.(in Chinese)
[20] 孙博超,杨运楷,李玉宏,等.饲料中添加复合芽孢杆菌对凡纳滨对虾抗病毒感染能力及抗病基因表达的影响[J].渔业科学进展,2019,40(3):113-121.
SUN B C,YANG Y K,LI Y H,et al.Effects of single or mixed Bacillus on WSSV infection and immune-related gene expression in Litopenaeus vannamei[J].Progress in Fishery Sciences,2019,40(3):113-121.(in Chinese)
[21] 张碧云,杨红玲,汪攀,等.鱼类肠道微生物与宿主免疫系统相互作用研究进展[J].微生物学报,2021,61(10):3046-3058.
ZHANG B Y,YANG H L,WANG P,et al.Advances in the interactions between intestinal microorganisms and host immune system in fish[J].Acta Microbiologica Sinica,2021,61(10):3046-3058.(in Chinese)
[22] 黄培堂.分子克隆实验指南(精编版)[J].生物技术通讯,2008,19(6):865.
HUANG P T.Guide to molecular cloning experiment (refined edition)[J].Letters in Biotechnology,2008,19(6):865.(in Chinese)
[23] 布坎南 R E.伯杰细菌鉴定手册:第9版[M].北京:科学出版社,1995.
BUCHANAN R E.Berger’s Handbook of Bacterial Identification:9th edition[M].Beijing:Science Press,1985.(in Chinese)
[24] 罗璋,陈昌福,白晓慧,等.枯草芽孢杆菌BHI344培养条件的优化[J].中国饲料,2007(10):41-43.
LUO Z,CHEN C F,BAI X H,et al.Optimization of Bacillus subtilus BHI344 cultivation conditions[J].China Feed,2007(10):41-43.(in Chinese)
[25] 马绪荣,苏德模.药品微生物学检验手册[M].北京:科学出版社,2000.
MA X R,SU D M.Handbook of microbiological examination of drugs[M].Beijing:Science Press,2000.(in Chinese)
[26] HAI N V.The use of probiotics in aquaculture[J].Journal of Applied Microbiology,2015,119(4):917-935.
[27] 倪鑫鑫,龚海燕,马顶虹,等.芽孢杆菌生理生化特性分析[J].安徽农学通报,2015,21(7):47-48,58.
NI X X,GONG H Y,MA D H,et al.Analysis of physiological and biochemical characteristics about Bacillus[J].Anhui Agricultural Science Bulletin,2015,21(7):47-48,58.(in Chinese)
[28] 李畅洋,高炳南,任雨龙,等.牛瘤胃微生物的分离鉴定与生化特性分析[J].中国畜牧兽医,2022,49(5):1757-1764.
LI C Y,GAO B N,REN Y L,et al.Isolation,identification and biochemical characteristics analysis of bovine rumen functional bacteria[J].China Animal Husbandry &Veterinary Medicine,2022,49(5):1757-1764.(in Chinese)
[29] 方卫东,唐旭,刘源森,等.一株海洋生境芽孢杆菌FA08的筛选、鉴定及其酶学特性和抗菌性能分析[J].海洋与湖沼,2015,46(5):1228-1234.
FANG W D,TANG X,LIU Y S,et al.Screening and identification,enzyme characteristics,and antibacterial activity of a marine Bacillus strain fa08[J].Oceanologia et Limnologia Sinica,2015,46(5):1228-1234.(in Chinese)
[30] 何李黎.地衣芽孢杆菌ZJU12所产细菌素的分离纯化及其理化性质和基因克隆的研究[D].杭州:浙江大学,2006.
HE L L.Isolation and purification of bacteriocin produced by Bacillus licheniformis ZJU12,and study on its physicochemical properties and gene cloning[D].Hangzhou:Zhejiang University,2006.(in Chinese)
[31] 王建超.芽孢杆菌的筛选鉴定及对鲤鱼免疫和消化功能影响[D].长春:吉林农业大学,2016.
WANG J C.Screening and identification of Bacillus’s and its effects on immune and digestive function of carp[D].Changchun:Jilin Agricultural University,2016.(in Chinese)
[32] 黄晓东,张健,朱元宏,等.蟹源弗氏柠檬酸杆菌拮抗菌PNB3的分离鉴定与安全性分析[J].上海海洋大学学报,2021,30(4):653-663.
HUANG X D,ZHANG J,ZHU Y H,et al.Isolation,identification and safety analysis of antagonistic strain PNB3 against crab-pathogenic Citrobacter freundii[J].Journal of Shanghai Ocean University,2021,30(4):653-663.(in Chinese)
[33] SAHA M,BANDYOPADHYAY P K.In vivo and in vitro antimicrobial activity of phytol,a diterpene molecule,isolated and characterized from Adhatoda vasica Nees.(Acanthaceae),to control severe bacterial disease of ornamental fish,Carassius auratus, caused by Bacillus licheniformis PKBMS16[J].Microbial Pathogenesis,2020,141:103977.
[34] 安健,曹海鹏,陈百尧,等.解淀粉芽孢杆菌的安全性分析[J].动物医学进展,2013,34(1):16-19.
AN J,CAO H P,CHEN B Y,et al.Safety analysis of Bacillus amyloliquefaciens[J].Progress in Veterinary Medicine,2013,34(1):16-19.(in Chinese)
[35] RUIZ L,MARGOLLES A,S NCHEZ B.Bile resistance mechanisms in Lactobacillus and Bifidobacterium[J].Frontiers in Microbiology,2013,4:396.
NCHEZ B.Bile resistance mechanisms in Lactobacillus and Bifidobacterium[J].Frontiers in Microbiology,2013,4:396.
[36] HASSAAN M,SOLTAN M,GHONEMY M.Effect of synbiotics between Bacillus licheniformis and yeast extract on growth,hematological and biochemical indices of the Nile tilapia (Oreochromis niloticus)[J].The Egyptian Journal of Aquatic Research,2014,40:199-208.
[37] 孟小亮.黄颡鱼肠道益生菌的筛选及其应用研究[D].武汉:华中农业大学,2010.
MENG X L.Selection and application of probiotics from intestional tract of yellow cartfish Pelteobagrus fulvidraco[D].Wuhan:Huazhong Agricultural University,2010.(in Chinese)
[38] 郝向举.中华绒螯蟹(Eriocheir sinensis)肠道益生芽孢杆菌(Bacillus)的筛选、生长特性及其应用效果研究[D].苏州:苏州大学,2010.
HAO X J.Screening of probiotic Bacillus from intestine of Chinese mitten crab (Eriocheir sinensis) and study on its growth character and application effect[D].Suzhou:Soochow University,2010.(in Chinese)