干露为水生动物脱离水体暴露于空气中的状态。对于水生动物来说,长时间干露失水是一种强烈的低氧胁迫,会影响其正常生理代谢,引发氧化应激反应,损害机体稳态,从而导致活体损伤甚至死亡[1-2]。受潮汐等自然因素影响,贝类、甲壳类和鱼类等主要潮间带生物会经常处于干露状态[2-4]。为了提高运输效率、降低成本,部分虾、蟹、蛤、刺参和海胆等水产动物在生产运输过程中常采用干露运输方式[5]。可见,研究干露胁迫下水生动物的生理变化及响应机制具有重要的意义。
干露引发的缺氧胁迫会影响水生动物存活、抗氧化能力及免疫功能。研究发现,低温干露条件下运输凡纳滨对虾(Litopenaeus vannamei)、三疣梭子蟹(Portunus trituberculatus)、欧洲青蟹(Carcinus maenas)和厚壳贻贝(Mytilus coruscus),可以实现较高的存活率[3,6-9]。超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、丙二醛(MDA)和热休克蛋白(Hsp70)随干露时间的不同呈规律性变化,这些指标已被广泛用于检测干露对机体生理代谢的影响程度。菲律宾蛤仔内脏团中SOD的活力在干露胁迫下显著增强,鳃中SOD的活力在入水恢复后显著升高[5]。干露和再浸润下,拟穴青蟹(Scylla paremamosain)鳃和肝胰腺中SOD、T-AOC活性在不同时间点均显著升高[10]。干露胁迫可诱导日本囊对虾(Marsupenaeus japonicus)强烈的氧化应激反应,影响其抗氧化酶活性[11]。干露胁迫和入水恢复会显著影响三疣梭子蟹肝胰脏T-AOC水平和Hsp70表达量[12]。在干露胁迫下,拟穴青蟹凋亡抑制蛋白基因IAP、Bcl-2的表达量上调,使得BAX/Bcl-2比率保持稳定,抑制细胞凋亡的发生;而干露后再浸润会增强其BAX基因表达量,造成BAX/Bcl-2比率显著升高,进而激活线粒体凋亡通路,使得Caspase活性升高最终引发细胞凋亡[13-14]。
中间球海胆(Strongylocentrotus intermedius)营养丰富、性腺色泽好、口感佳,市场消费需求较大[15]。自1989年从日本引入中国后,中间球海胆现已成为中国北方重要的海水养殖品种,其苗种、成体运输通常采用低温干法。目前,有关干露对中间球海胆影响的研究报道仅限于T-AOC、SOD和MDA等抗氧化指标的测定[16],尚未深入研究海胆应对干露胁迫维持稳态的作用机制。本研究中,通过探究干露和再浸润条件下中间球海胆的抗氧化能力、体腔细胞凋亡、凋亡相关基因Caspase-3、Caspase-9的变化特征,以及检测免疫相关基因LYZ、TLR1的表达情况,揭示中间球海胆响应干露胁迫的分子特征,以期为提高海胆干法运输存活率、拓展养殖空间提供有益参考。
1 材料与方法
1.1 材料
试验用中间球海胆幼苗健康、身体完整,购自大连市旅顺育苗场,其湿质量为(3.57±0.63)g,壳径为(3.2±0.3)cm。海胆通过短暂低温干法运回实验室后,在(11±1)℃的过滤海水(盐度30,pH 7.9)中暂养14 d后开始试验。暂养期间,连续充气,光照周期为12L∶12D,每隔1 d换水一次,每次换水1/2,每天按海胆体质量的10%投喂鲜石莼。
1.2 方法
1.2.1 干露试验 试验分为干露胁迫和胁迫后入水恢复两个阶段。用滤网将海胆捞出后,置于4 ℃塑料保温箱中(湿度为70%~80%)进行干露试验。分别在干露0 h(记为A0 h)、12 h(A12 h)、24 h(A24 h)、36 h(A36 h)及放入海水中恢复12 h时(W12 h)取样。试验设置3个平行,每个平行组海胆起始数量均为60枚,其中30枚用于组织取样,每6枚海胆的各组织分别混合,另外30枚用于统计干露胁迫后的存活率。试验期间不投饵,海胆入水恢复并统计存活率的养殖条件与暂养条件保持一致。
1.2.2 样品采集 将海胆置于冰盘上,迅速用1 mL注射器从围口膜处插入体腔,收集体腔液置于无菌离心管中,按体积比为1∶1的比例加入抗凝剂(包含20 mmol/L Tris-HCl、0.5 mol/L NaCl、70 mmol/L EDTA,pH 7.5)混匀。取2 mL混匀的体腔液用于细胞凋亡检测,剩余体腔液分装至3个1.5 mL离心管中,离心 (3 000 g,5 min,4 ℃)后弃上清液,沉淀的体腔细胞经液氮冷冻后于-80 ℃超低温冰箱中保存用于下一步试验。
1.2.3 酶活力指标测定 使用南京建成生物工程研究所的试剂盒测定海胆体腔液中T-AOC、MDA含量及T-SOD酶活力。
1.2.4 基因表达荧光定量分析 采用TransZol Up Plus RNA Kit (全式金)对海胆体腔细胞进行总RNA提取。用10 g/L琼脂糖凝胶电泳检测RNA的完整性,用SimpliNano超微量分光光度计(Biochrom)检测RNA的纯度及浓度。使用PrimeScriptTM RT reagent Kit 合成cDNA模板。基于NCBI数据库中LYZ、TLR1、Caspase-3、Caspase-9的编码序列,采用Primer Premier 5.0设计实时荧光定量引物(表1),选取18S rRNA为内参基因,利用LightCycler实时荧光定量仪(Roche)进行PCR扩增。反应体系(共20 μL):Super Mix 10 μL,cDNA 2 μL,上、下游引物(10 μmol/L)各0.4 μL,用ddH2O补足至20 μL。反应程序:94 ℃下预变性30 s;94 ℃下变性5 s,60 ℃下退火30 s,共进行45个循环,并运行熔解曲线确定扩增产物的特异性。每个样品设置3个平行。
表1 实时荧光定量PCR引物序列
Tab.1 Primers sequence for qRT-PCR

引物 primer 引物序列 sequence(5′-3′)Caspase-3F:GCAACACCCAAGACCAACTR:TTCTGGCAGGCTTGTCTTCCaspase-9F:CGATGCCCGACTTTGAATGGR:AGCGTCACCTGCGGCTTTATLYZF:GTCGGCTCTCTATCGTGTGGR:GTGTATGCGGGCAAAATCCTTLR1F:AATGGAGCCCGTATGTAGR:GATTCTGCTGTGAGGTGT18SF:GTTCGAAGGCGATCAGATACR:CTGTCAATCCTCACTGTGTC
采用2-ΔΔCt法[17]计算各基因在干露及再浸润胁迫下海胆体腔细胞中的表达量。其中,以干露0 h在体腔细胞中的表达量作为背景值,其他组的数据表示为相对于基线水平的表达量变化倍数。
1.2.5 体腔细胞凋亡检测 使用Annexin V-FITC细胞凋亡检测试剂盒(碧云天),通过Annexin V/Propidium Iodide (PI)双染色法进行凋亡细胞测定。每组设置3个平行,从每个平行组分别取体腔液2 mL,以1 000 g离心5 min,弃上清,沉淀的体腔细胞经PBS漂洗并重悬,再次以1 000 g离心5 min,弃上清,加入Annexin V-FITC结合液重悬细胞。然后加入10 μL Annexin V-FITC,室温避光孵育15 min,以1 000 g离心5 min,弃上清,再加入5 μL Propidium Iodide (PI)试剂,冰浴避光放置。在1 h内使用FACSAriaII流式细胞仪(美国BD公司)检测细胞凋亡情况。
1.3 数据处理
试验结果均以平均值±标准差(mean±S.D.)表示,利用SPSS 19.0软件进行单因素方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 干露胁迫和入水恢复过程中海胆的存活率
从图1可见:与干露0 h相比,随干露时间的延长,中间球海胆存活率呈降低趋势;干露12 h时中间球海胆全部存活,24 h时存活率降至80%,36 h时降至57.5%,入水恢复12 h后的存活率与36 h相同。这表明,中间球海胆具有一定的耐干露能力,在低温条件下离水运输24 h内再入水养殖,海胆苗的存活率较高。
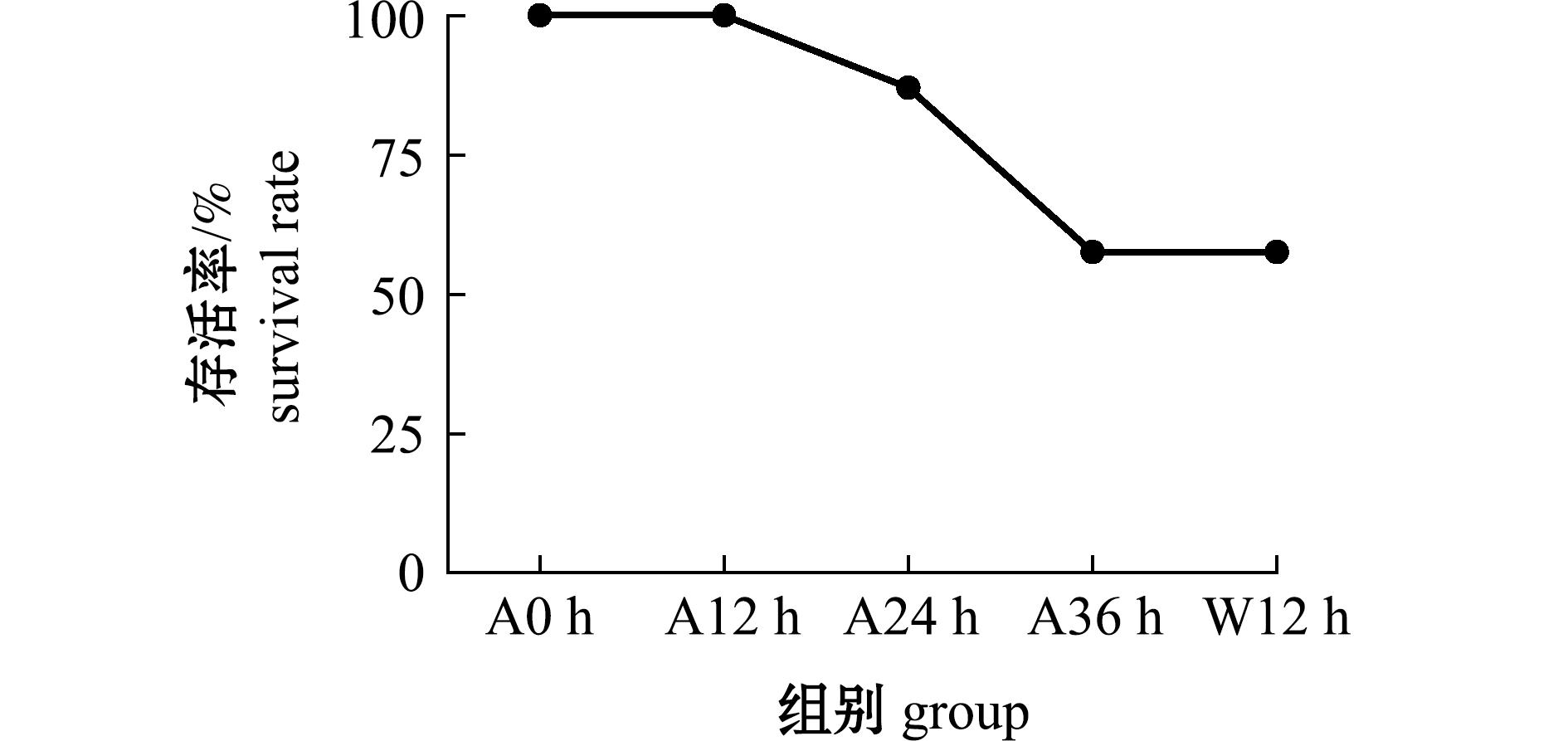
图1 干露胁迫(0~36 h)和入水恢复(12 h)过程中中间球海胆的存活率
Fig.1 Survival rates of Strongylocentrotus intermedius during different exposure times and subsequent 12 h recovery
2.2 干露胁迫和入水恢复过程中中间球海胆体腔液酶活力的变化
从表2可见:随干露时间的延长,中间球海胆体腔细胞中T-SOD、MDA、T-AOC含量均呈先升高后降低的趋势;干露12 h时,海胆T-SOD酶活力最高,随后在干露24、36 h及入水恢复12 h时T-SOD活力均有所降低,但均未达到显著性差异(P>0.05);干露12 h时,海胆MDA含量最高且显著高于24、36 h干露组(P<0.05),略高于对照组(干露0 h)和入水恢复12 h组(P>0.05);干露12 h时,海胆T-AOC水平最高且显著高于其他干露组和入水恢复12 h组(P<0.05),随后在36 h时降至最低,入水恢复12 h后略有回升。
表2 干露胁迫和入水恢复过程中海胆体腔细胞抗氧化酶活力的变化
Tab.2 Changes in the antioxidant enzyme activities in Strongylocentrotus intermedius coelomocytes during different exposure times and subsequent recovery
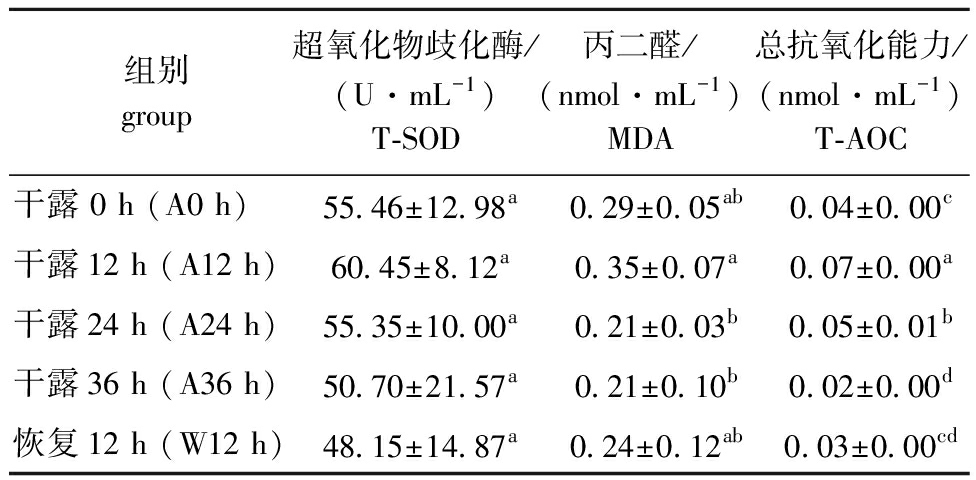
组别 group超氧化物歧化酶/(U·mL-1) T-SOD丙二醛/(nmol·mL-1) MDA总抗氧化能力/(nmol·mL-1)T-AOC干露 0 h (A0 h)55.46±12.98a0.29±0.05ab0.04±0.00c干露12 h (A12 h)60.45±8.12a0.35±0.07a0.07±0.00a干露24 h (A24 h)55.35±10.00a0.21±0.03b0.05±0.01b干露36 h (A36 h)50.70±21.57a0.21±0.10b0.02±0.00d恢复12 h (W12 h)48.15±14.87a0.24±0.12ab0.03±0.00cd
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
2.3 干露胁迫和入水恢复过程中中间球海胆体腔细胞免疫基因LYZ、TLR1的表达
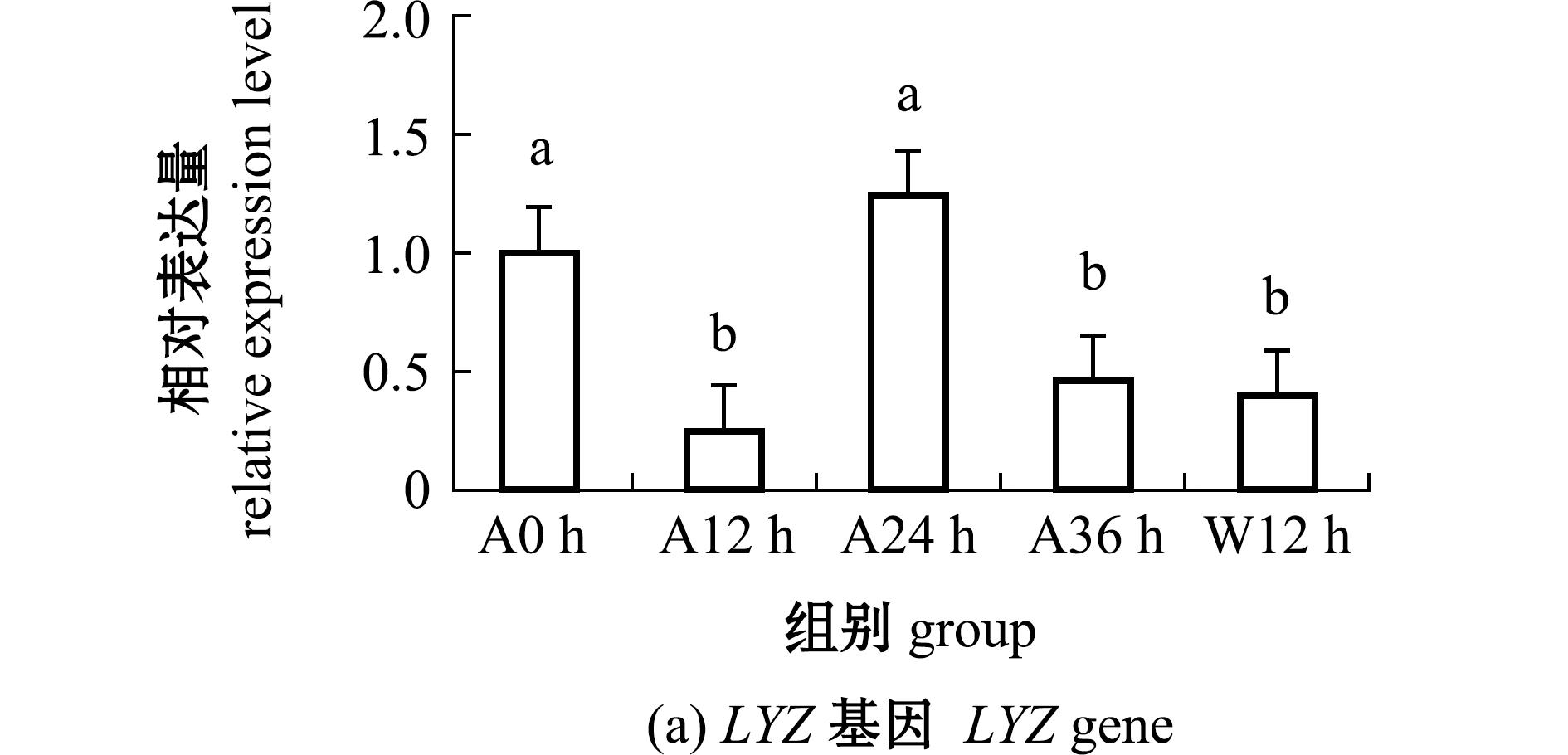
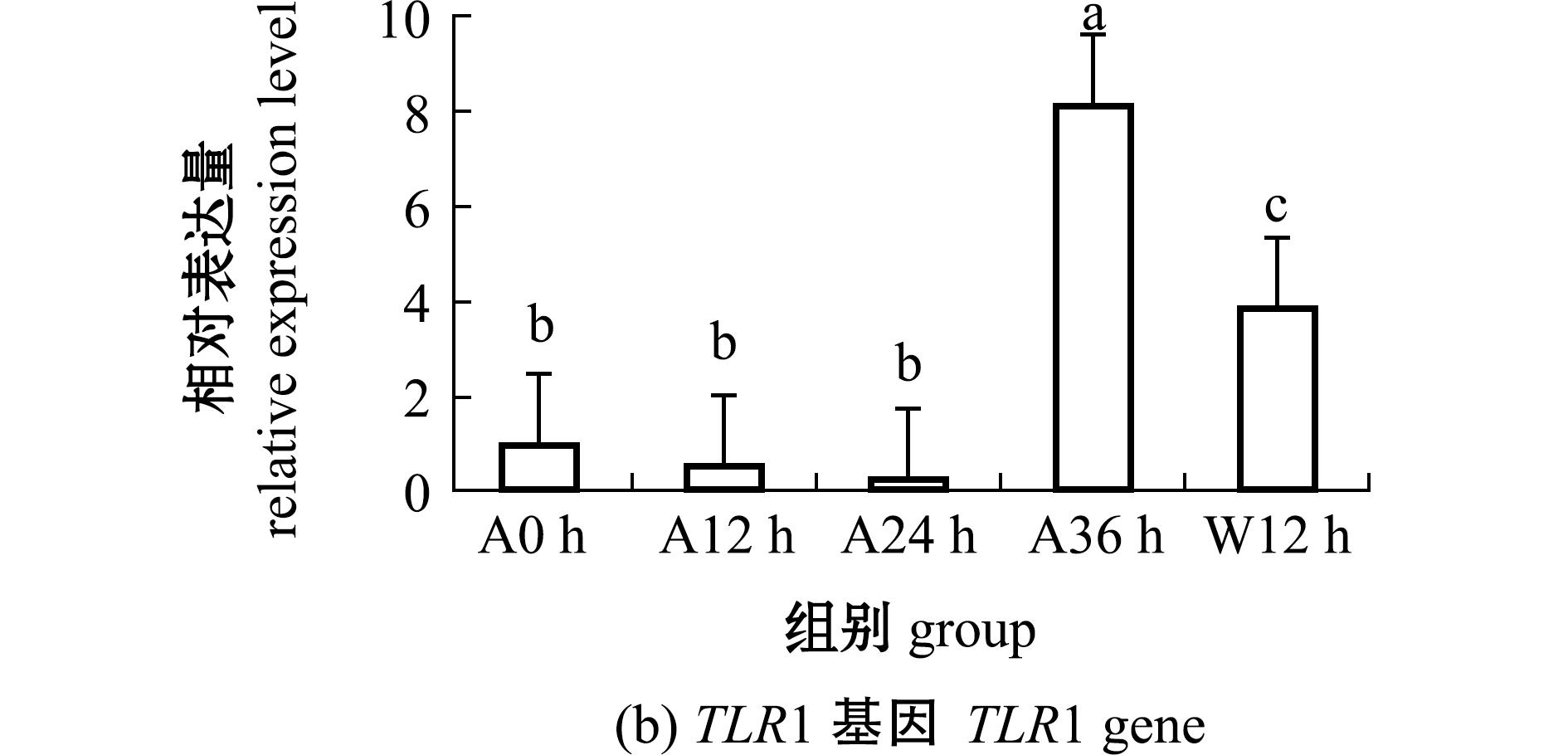
从图2可见:在低温条件下,随着干露时间的延长,海胆体腔细胞LYZ和TLR1基因的表达量均呈先降低后升高再降低的变化趋势;干露24 h时,LYZ基因表达量最高且显著高于其他干露组和恢复组(P<0.05);而干露24 h时,TLR1基因表达量却处于最低水平,之后开始升高,干露36 h时达到最高值且显著高于其他组(P<0.05),复水12 h时,TLR1基因表达量较干露36 h时显著降低(P<0.05)。
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.
图2 干露胁迫和入水恢复过程中海胆体腔细胞中LYZ、TLR1基因表达量的变化
Fig.2 Changes in LYZ and TLR1 genes expression in Strongylocentrotus intermedius coelomocytes during different exposure times and subsequent recovery
2.4 干露胁迫和入水恢复过程中中间球海胆体腔细胞凋亡及其相关基因的表达
为了查明干露对中间球海胆内稳态的影响,采用流式细胞仪检测了干露胁迫和入水恢复对体腔细胞凋亡率的影响。对各干露胁迫组凋亡早、晚期细胞(图3)进行统计,在正常生理状态下,海胆体腔细胞的凋亡率较低,随着干露时间的延长,细胞的凋亡率呈先升高后降低的变化趋势,干露12 h时细胞的凋亡率显著升高(P<0.05),24 h时凋亡的体腔细胞数量有所减少,36 h时细胞凋亡率大幅降低(P<0.05),并接近对照组水平(P>0.05),入水恢复12 h后细胞凋亡率略有回升(表3)。
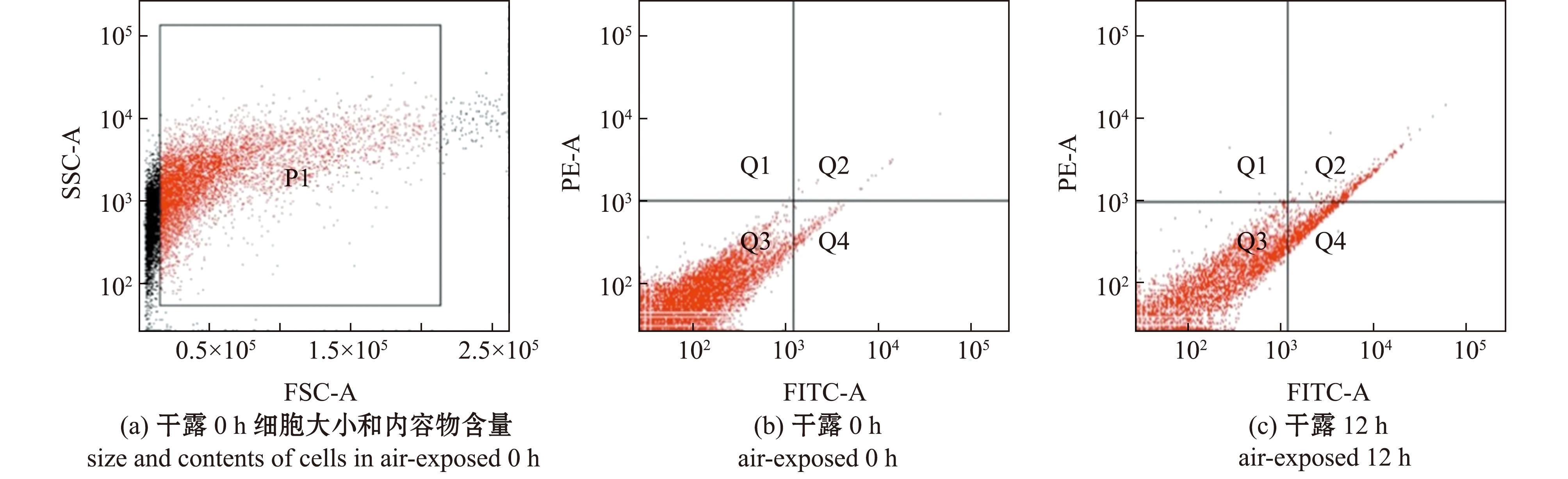
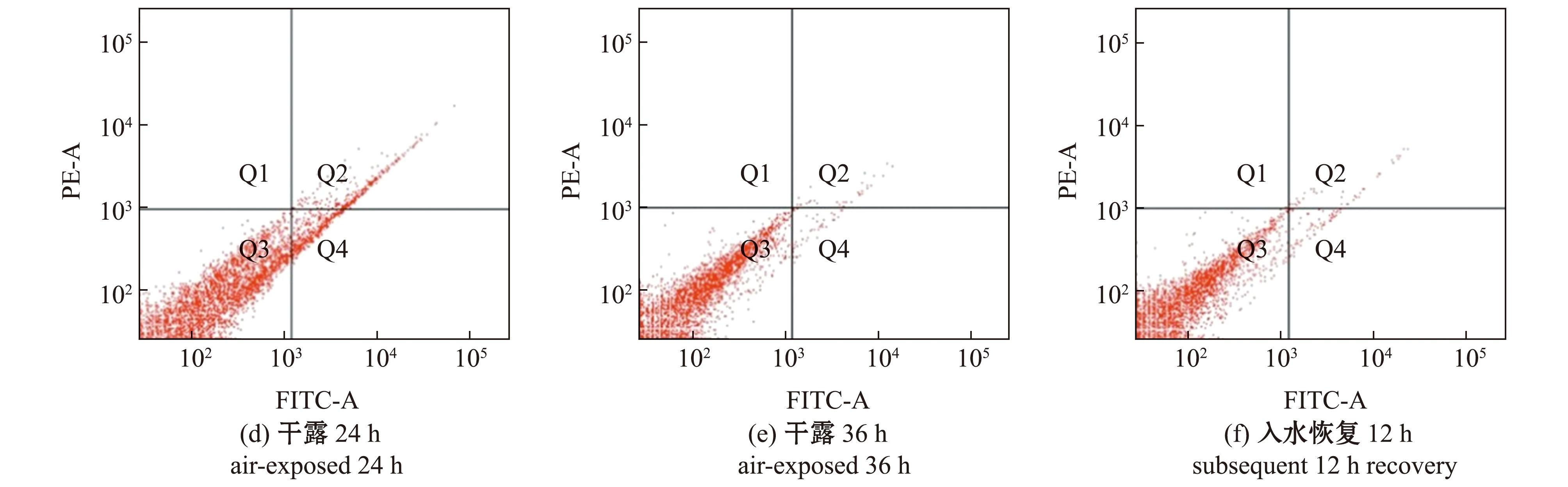
P1为截取的有效区域;Q1区域为已无细胞膜的细胞碎片或非凋亡导致的坏死细胞;Q2区域为PE和Annexin V标记的晚期凋亡细胞;Q3为正常(活)细胞;Q4区域为Annexin V标记的发生早期凋亡的细胞。
P1 is the effective area of the interception;Q1 region is cell fragments without cytomembranes,or necrotic cells caused by non-apoptotic reasons;Q2 and Q4 regions are the Annexin V-labeled cells with early apoptosis,the PE and Annexin V-labeled cells with complete apoptosis;Q3 is normal (living) cells.
图3 干露胁迫和入水恢复过程中海胆体腔细胞凋亡的可视化检测
Fig.3 Observation on apoptosis in Strongylocentrotus intermedius coelomocytes during different exposure times and subsequent recovery
表3 干露胁迫和入水恢复过程中海胆体腔细胞的凋亡率
Tab.3 Apoptosis rate in Strongylocentrotus intermedius coelomocytes during different exposure times and subsequent recovery
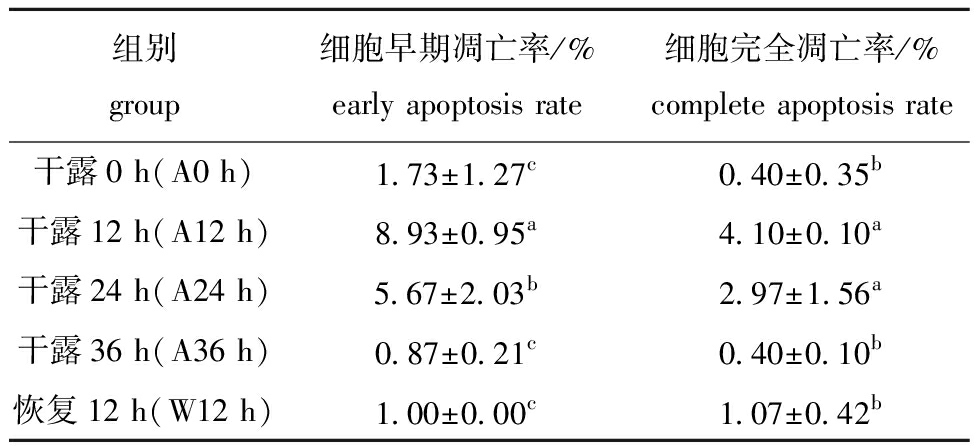
组别group细胞早期凋亡率/%early apoptosis rate细胞完全凋亡率/%complete apoptosis rate干露0 h(A0 h)1.73±1.27c0.40±0.35b干露12 h(A12 h)8.93±0.95a4.10±0.10a干露24 h(A24 h)5.67±2.03b2.97±1.56a干露36 h(A36 h)0.87±0.21c0.40±0.10b恢复12 h(W12 h)1.00±0.00c1.07±0.42b
从图4(a)可见:在正常生理状态下,中间球海胆体腔细胞中Caspase-3基因痕量表达,随着干露时间的延长,其表达水平呈现先升高后降低的趋势;干露24 h时,Caspase-3表达量达到最高,为干露12 h时的21倍(P<0.05),干露36 h时,该基因表达量急剧降低(P<0.05),入水恢复12 h时,Caspase-3表达量降至0 h水平(P>0.05)。
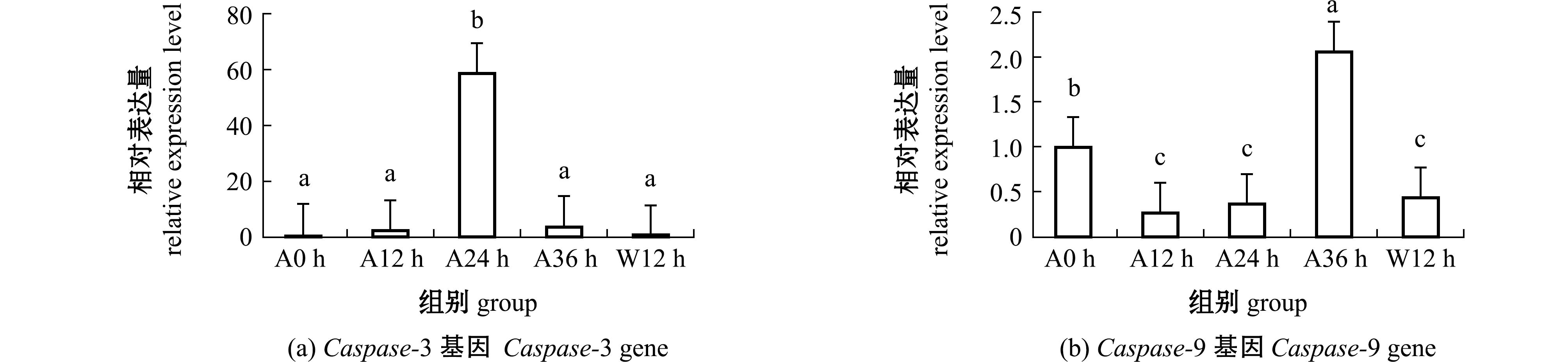
图4 干露胁迫和入水恢复过程中海胆体腔细胞Caspase-3、Caspase-9基因表达量的变化
Fig.4 Changes in Caspase-3 and Caspase-9 genes expression levels in Strongylocentrotus intermedius coelomocytes during different exposure times and subsequent recovery
从图4(b)可见:随干露时间的延长,海胆Caspase-9基因的表达量呈现类似TLR1基因的表达特征,于干露36 h时达到峰值,为正常生理状态下表达量的2倍(P<0.05),而干露12、24 h和入水恢复12 h时,其表达量均显著降低(P<0.05)。
3 讨论
3.1 干露对中间球海胆抗氧化能力的影响
在贝类、虾、蟹和海胆等水生经济动物干法运输过程中,由于低氧、pH和盐度的改变,会引起机体代谢异常从而影响其免疫功能,严重时会导致其死亡[5,16]。大量研究表明,干露作为强烈的缺氧应激会诱导机体产生大量活性氧自由基(ROS),破坏机体稳态[1,6,10-12]。生物会进化出一套抗氧化酶系统及时清除ROS,减少和避免氧化损伤对机体造成的损害[6]。
SOD在抗氧化防御体系中能够最先清除ROS,维持体内自由基动态平衡。SOD活力与ROS含量有着必然联系,适量的ROS可以激活SOD活性,过量的ROS则抑制其表达。本研究中发现,中间球海胆体腔细胞T-SOD活力在干露12 h时最高,并随着干露时间的延长而降低,但未达到显著性差异,可能是由于胁迫产生的ROS未达到引起SOD活力变化的阈值[12]。
MDA是机体脂质在自由基过氧化作用下的终产物[18],其含量变化直接反映细胞膜氧化损伤的程度,现已被广泛用于评价干露对水生生物细胞膜的氧化损伤[5,6,11,12,16]中。本研究中发现,干露12 h体腔细胞的MDA含量显著高于干露0、24、36 h,说明此干露时间会强烈影响中间球海胆的正常膜结构,这与王钰等[5]报道的干露12 h后菲律宾蛤仔内脏团MDA水平显著高于对照组的结果一致。由此推测,离水12 h的低氧胁迫会诱导水生动物进行活跃的无氧代谢,并产生大量破坏膜结构的负氧离子,导致细胞质膜受损。而随着干露时间的延长,海胆与蛤仔等具有一定耐干露能力的物种一样,通过积累SOD等抗氧化物质维持活性氧的动态平衡,随后在入水恢复过程中海胆的有氧代谢逐渐恢复到正常水平,使得干露24、36 h及入水恢复12 h时测出的MDA含量均与对照组无显著性差异。
T-AOC主要包括体内抗氧化酶体系和抗氧化物质体系,其变化可以反映机体对不良刺激的代偿能力及体内活性氧自由基的代谢情况,现已被广泛用于评估水生动物干露胁迫下的抗氧化能力[5,6,12,16,19]。本研究中发现,干露12 h时中间球海胆T-AOC水平显著高于对照组,而此时T-SOD活力保持在高水平,MDA含量也迅速增多,这表明SOD为中间球海胆抗氧化酶体系的核心成员,能够有效清除缺氧应激中机体产生的过量ROS。随着干露时间的延长,24 h时海胆T-AOC水平显著下降,到36 h时显著低于对照组,表明抗氧化物质体系不断地被消耗。入水恢复12 h时,T-AOC水平基本恢复到正常水平,而T-SOD的活力也非常接近对照组水平。由此推断,在干露后的入水恢复过程中,中间球海胆类似于三疣梭子蟹[12],主要通过抗氧化物质体系和抗氧化酶体系共同来维持机体ROS平衡。
3.2 干露对中间球海胆免疫相关基因表达的影响
溶菌酶是生物固有免疫的重要效应分子。本研究表明,溶菌酶基因LYZ在正常生理状态(干露0 h)下的表达水平与姬南京等[20]发现LYZ基因在海胆体腔液中的表达结果一致。干露24 h时LYZ基因表达水平显著升高。综合干露24 h时海胆T-AOC活力降低和存活率较高的试验结果,推测干露24 h时由于海胆抗氧化活力的降低导致病原侵入,在海胆防御系统中起至关重要作用的体腔细胞通过大量表达溶菌酶直接作用于入侵病原体[21]。
TLR作为重要的模式识别受体(PRR)通过识别病原相关模式分子(PAMP),激活无脊椎动物先天免疫系统产生炎症因子、抗菌肽等进行免疫应答,以清除抗原性物质。王轶南等[22]从中间球海胆中克隆到TLR1基因,作为持家型基因其在体腔液中的表达量显著高于其他组织,通过识别细菌和β-D-葡聚糖参与免疫应答。在石斑鱼(Epinephelus coioides)[23]、虹鳟(Oncorhynchus mykiss)[24]等鱼类中TLR1主要表达于头肾,暗示TLR1在固有免疫中发挥重要作用。本研究中发现,TLR1基因对中间球海胆干露36 h的响应表达最强,显著高于0、12、24 h及恢复12 h时,而此时LYZ的表达则受到抑制。由此推测,海胆濒临死亡时体腔细胞TLR1启动促炎性因子、抗菌肽和急性期蛋白的合成[25],进而替代溶菌酶成为主要免疫效应分子,维持海胆的基础免疫防御水平。
3.3 干露对中间球海胆体腔细胞凋亡及其相关基因表达的影响
长时间干露胁迫产生的过量ROS,不仅会氧化脂类、蛋白质,还会穿透细胞核核膜,对DNA造成直接损伤,并激活细胞凋亡的酶系统,抑制DNA聚合酶的活性及阻碍DNA修复,最终导致细胞凋亡的产生[2]。作为基因控制的细胞主动程序性死亡方式,细胞凋亡的发生有利于维持机体内稳态。本研究中发现,中间球海胆干露12、24 h时,发生凋亡的体腔细胞数量显著多于对照组和其他处理组,这表明干露不超过24 h时,中间球海胆能够通过细胞凋亡、高表达溶菌酶等主动适应策略保持内环境稳定,从而保证长时间离水运输的海胆有较高的存活率。
Caspase-3是Caspase家族中最重要的成员,绝大多数触发细胞凋亡的因素,最终都需要通过Caspase-3介导的信号传递途径[26]。Caspase-9是凋亡线粒体途径的关键蛋白酶,其活化后激活Caspase-3前体,从而使活化的Caspase-3执行效应子的作用,引起细胞凋亡[27]。本研究中发现,中间球海胆Caspase-3的表达在干露后24 h达到最高水平,而流式细胞仪检测到12 h时凋亡体腔细胞数量最多,暗示Caspase-3执行的细胞凋亡滞后,推测干露12 h时大量体腔细胞凋亡是由外源性死亡受体通路启动,使得Caspase-3基因的表达在24 h时表现出时间效应。中间球海胆干露36 h时Caspase-9的相对表达量为2.06±0.14,稍高于干露0~24 h时表达值的和(1.53±0.11),暗示由累积的ROS在干露胁迫36 h后激活体腔细胞中的Caspase-9,进而启动线粒体凋亡途径[28]。
4 结论
1)中间球海胆具有一定耐干露的能力,在低温(4 ℃)条件下离水运输不超过24 h可以保证海胆较高的存活率。
2)干露胁迫对海胆体腔细胞MDA含量、T-AOC水平具有显著影响,MDA含量、T-AOC水平在干露12 h后均有所升高,其中后者显著高于对照组和其他胁迫组;12 h时T-SOD活力虽无显著性升高,但保持高活力。表明以SOD为核心的抗氧化物质在中间球海胆响应干露和再浸润胁迫的氧化应激中发挥重要作用。
3)体腔细胞中LYZ、TLR1基因在不同干露时间点差异表达,二者分别在干露24、36 h时达到表达最大值,且显著高于其他胁迫组(P<0.05),36 h时TLR1表达量仍显著高于对照组水平。表明干露和再浸润胁迫下LYZ和TLR1等固有免疫分子参与抵御病原入侵。
4)干露12 h后体腔细胞凋亡率最高,干露24 h时有下降趋势,Caspase-3、Caspase-9的表达量依次在干露24、36 h时达到最高水平,且均显著高于对照组和其他胁迫组(P<0.05)。表明干露胁迫对中间球海胆体腔细胞的存活具有重要影响,Caspase依赖性细胞凋亡是机体干露胁迫下维持内环境稳定的重要方式。
[1] DUAN Y F,ZHANG J S,DONG H B,et al.Effect of desiccation and resubmersion on the oxidative stress response of the kuruma shrimp Marsupenaeus japonicus[J].Fish &Shellfish Immunology,2016,49:91-99.
[2] NU EZ-HERNANDEZ D M,FELIX-PORTILLO M,PEREGRINO-URIARTE A B,et al.Cell cycle regulation and apoptosis mediated by p53 in response to hypoxia in hepatopancreas of the white shrimp Litopenaeus vannamei[J].Chemosphere,2018,190:253-259.
EZ-HERNANDEZ D M,FELIX-PORTILLO M,PEREGRINO-URIARTE A B,et al.Cell cycle regulation and apoptosis mediated by p53 in response to hypoxia in hepatopancreas of the white shrimp Litopenaeus vannamei[J].Chemosphere,2018,190:253-259.
[3] DONG Z G,MAO S A,CHEN Y H,et al.Effects of air-exposure stress on the survival rate and physiology of the swimming crab Portunus trituberculatus[J].Aquaculture,2019,500:429-434.
[4] GONG C,LIU C,LI H,et al.The transformation of energy metabolism and endoplasmic reticulum stress regulation in Pacific oyster Crassostrea gigas under air exposure[J].Invertebrate Survival Journal,2019:72-83.
[5] 王钰,王文文,谢深涵,等.干露及恢复过程中菲律宾蛤仔免疫指标的变化[J].农学学报,2021,11(4):38-43.
WANG Y,WANG W W,XIE S H,et al.The effects of air exposure and recovery on immune parameters of Ruditapes philippinarum[J].Journal of Agriculture,2021,11(4):38-43.(in Chinese)
[6] 邓高威,段健诚,王玉,等.干露胁迫对脊尾白虾存活率及氧化应激反应的影响[J].水产科学,2021,40(2):244-249.
DENG G W,DUAN J C,WANG Y,et al.Effects of air exposure stress on survival rate and response to oxidative stress in ridgetail white prawn Exopalaemon carinicauda[J].Fisheries Science,2021,40(2):244-249.(in Chinese)
[7] MCGAW I J,WHITELEY N M.Effects of acclimation and acute temperature change on specific dynamic action and gastric processing in the green shore crab,Carcinus maenas[J].Journal of Thermal Biology,2012,37(8):570-578.
[8] 孙煜阳,童巧琼,王文,等.厚壳贻贝在不同温度下的干露耐受性研究[J].生物学杂志,2017,34(4):42-46.
SUN Y Y,TONG Q Q,WANG W,et al.Study on enduring exposure and desiccation ability of Mytilus coruscus in different temperature and humidity conditions[J].Journal of Biology,2017,34(4):42-46.(in Chinese)
[9] WANG Q J,JU X,CHEN Y K,et al.Effects of l-carnitine against H2O2-induced oxidative stress in grass carp ovary cells (Ctenopharyngodon idellus)[J].Fish Physiology and Biochemistry,2016,42(3):845-857.
[10] 顾文彬.拟穴青蟹干露胁迫应答及其细胞凋亡机制的研究[D].浙江大学,2020.
GU W B.The apoptosis responding mechanism under air-exposure stress in mub crab Scylla paremamosain[D].Zhejiang University,2020.
[11] 段亚飞,董宏标,王芸,等.干露胁迫对日本囊对虾抗氧化酶活性的影响[J].南方水产科学,2015,11(4):102-108.
DUAN Y F,DONG H B,WANG Y,et al.Effect of desiccation on antioxidant enzyme activities of kuruma shrimp(Marsupenaeus japonicus)[J].South China Fisheries Science,2015,11(4):102-108.(in Chinese)
[12] 姜娜,王芳,路允良,等.干露对三疣梭子蟹抗氧化和应激能力的影响[J].水产学报,2014,38(12):1996-2004.
JIANG N,WANG F,LU Y L,et al.Effects of air-exposure stress on antioxidant capacity and stress response of swimming crab(Portunus trituberculatus)[J].Journal of Fisheries of China,2014,38(12):1996-2004.(in Chinese)
[13] GU W B,ZHOU Y L,TU D D,et al.Identification and characterization of apoptosis regulator Bax involved in air-exposure stress of the mud crab,Scylla paramamosain Estampador,1949[J].Crustaceana,2017,90(11/12):1373-1390.
[14] GU W B,ZHOU Z K,TU D D,et al.Molecular cloning and characterization of an inhibitor of apoptosis protein in the mud crab Scylla paramamosain:its potential anti-apoptosis role under air exposure stress[J].Fisheries Science,2017,83(5):715-723.
[15] 常亚青,王子臣,王国江.温度和藻类饵料对虾夷马粪海胆摄食及生长的影响[J].水产学报,1999,23(1):69-76.
CHANG Y Q,WANG Z C,WANG G J.Effect of temperature and algae on feeding and growth in sea urchin,Strongylocentrotus intermedius[J].Journal of Fisheries of China,1999,23(1):69-76.(in Chinese)
[16] 吕德亮,李敏,乔雁冰,等.干露对中间球海胆抗氧化酶活性和免疫基因表达的影响[C]//2018年中国水产学会学术年会论文摘要集.西安:中国水产学会,2018:115.
LÜ D L,LI M,QIAO Y B,et al.Effects of air-exposure stress on the antioxidant enzyme activities and immune gene expression of sea urchin Strongylocentrotus intermedius[C]//Abstracts of the 2018 academic annual conference of the Chinese Society of Fisheries.Xi’an:Chinese Society of Fisheries,2018:115.(in Chinese)
[17] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T)) Method[J].Methods,2001,25(4):402-408.
[18] 李涌泉,王兰,刘娜,等.镉对长江华溪蟹酶活性及脂质过氧化的影响[J].水生生物学报,2008,32(3):373-379.
LI Y Q,WANG L,LIU N,et al.Effects of cadmium on enzyme activity and lipid peroxidation in freshwater crab Sinopotamon yangtsekiense[J].Acta Hydrobiologica Sinica,2008,32(3):373-379.(in Chinese)
[19] 王茁宇,杨春桥,王秋举,等.干露时间对凡纳滨对虾抗氧化功能的影响[J].水产科学,2021,40(5):651-660.
WANG Z Y,YANG C Q,WANG Q J,et al.Effects of air exposure period on antioxidant function of Pacific white shrimp Litopenaeus vannamei[J].Fisheries Science,2021,40(5):651-660.(in Chinese)
[20] 姬南京,杨芸菲,丁君,等.虾夷马粪海胆溶菌酶基因全长cDNA的克隆与表达分析[J].中国水产科学,2013,20(5):950-957.
JI N J,YANG Y F,DING J,et al.Cloning and expression analysis of a sea urchin(Strongylocentrotus intermedius) lysozyme gene[J].Journal of Fishery Sciences of China,2013,20(5):950-957.(in Chinese)
[21] 孟繁伊,麦康森,马洪明,等.棘皮动物免疫学研究进展[J].生物化学与生物物理进展,2009,36(7):803-809.
MENG F Y,MAI K S,MA H M,et al.The evolution of echinoderm immunology[J].Progress in Biochemistry and Biophysics,2009,36(7):803-809.(in Chinese)
[22] 王轶南,于卓,刘洋,等.虾夷马粪海胆TLR基因cDNA克隆及表达分析[J].大连海洋大学学报,2014,29(4):329-335.
WANG Y N,YU Z,LIU Y,et al.Cloning and expression analysis of TLR cDNA from sea urchin Strongylocentrotus intermedius[J].Journal of Dalian Ocean University,2014,29(4):329-335.(in Chinese)
[23] WEI Y C,PAN T S,CHANG M X,et al.Cloning and expression of Toll-like receptors 1 and 2 from a teleost fish,the orange-spotted grouper Epinephelus coioides[J].Veterinary Immunology and Immunopathology,2011,141(3/4):173-182.
[24] PALTI Y,RODRIGUEZ M F,GAHR S A,et al.Identification,characterization and genetic mapping of TLR1 loci in rainbow trout (Oncorhynchus mykiss)[J].Fish &Shellfish Immunology,2010,28(5/6):918-926.
[25] TAKEDA K,AKIRA S.TLR signaling pathways[J].Seminars in Immunology,2004,16(1):3-9.
[26] HENGARTNER M O.The biochemistry of apoptosis[J].Nature,2000,407(6805):770-776.
[27] LUO X,BUDIHARDJO I,ZOU H,et al.Bid,a Bcl2 interacting protein,mediates cytochrome c release from mitochondria in response to activation of cell surface death receptors[J].Cell,1998,94(4):481-490.
[28] BRENTNALL M,RODRIGUEZ-MENOCAL L,DE GUEVARA R L,et al.Caspase-9,caspase-3 and caspase-7 have distinct roles during intrinsic apoptosis[J].BMC Cell Biology,2013,14:32.