方斑东风螺(Babylonia areolata)隶属于软体动物门(Mollusca)腹足纲(Gastropoda)前鳃亚纲(Prosobranchia)新腹足目(Neogastropoda)蛾螺科(Buccinidae)东风螺属(Babylonia),俗称“花螺”“海猪螺”,主要分布于中国福建、广东、广西和海南等地。方斑东风螺具有生长速度快、养殖周期短、肉质鲜美、营养丰富和经济价值高等优点。近年来,方斑东风螺已成为海南、广东和福建等中国南方各省重要的海水养殖品种[1]。随着方斑东风螺养殖密度和养殖规模的逐年增加,育苗和养殖过程中病害频繁暴发,造成了严重的经济损失,特别是夏季水温升高,会对方斑东风螺工厂化养殖产业发展造成严重影响[2]。
目前,方斑东风螺最常见的养殖模式是采用室外水泥池流水养殖,配合顶部遮荫和池底铺砂。养殖过程中方斑东风螺分泌的大量黏液和残饵粪便,若不及时清理,会导致有机物沉积,细菌大量繁殖,最终使得底质恶化[3]。同时,由于方斑东风螺具有潜砂习性,底质环境恶化不仅影响其生长发育,还易带来病害风险。已有研究表明,底质类型和底砂粒径与潜砂水生动物的存活、生长、行为及对病害的抵抗能力等密切相关[4-5]。日本对虾(Penaeus japonicus)在砂泥底质下存活率最高,而在无底质下的存活率最低[6]。截形斧蛤(Donax trunculus)的代谢活性和生长速率在中、粗粒底质中最高,在极粗砂底质中较低[7]。此外,室外水泥池养殖模式通常缺少健全的水处理系统和底砂清洗装置,常采用洗砂、换砂或在底质中添加益生菌的方式改善底质,但存在工作强度大、生产效率低、对养殖对象扰动大和水利用率低等问题[8]。
陶粒是以黏土、粉煤灰等为主要原料,经配料、成球和高温烧制等工艺加工而成的球形材料,其表面粗糙、比表面积大、孔隙率高,能够承受水流的冲刷[9],使布水均匀、流态稳定。此外,陶粒具有较高的生物、化学稳定性,不含重金属离子及其他有害物质,是一种惰性无机滤料[10],且无二次污染的风险。有研究表明,陶粒可通过固定微生物高效净水,是一种优质的自净底质材料[11-12]。目前,尚未见陶粒应用于方斑东风螺实际生产中的研究报道。本研究中,分析了陶粒材质及其粒径大小对方斑东风螺生长、存活和养殖水质的影响,并借助高通量测序技术分析不同底质微生物群落结构的变化,探讨陶粒作为方斑东风螺室外水泥池养殖底质材料的可行性,以期为方斑东风螺规模化养殖中底质筛选提供参考依据。
试验在海南省文昌市金雨海洋养殖基地室外水泥养殖池中进行。试验用方斑东风螺来自本地方斑东风螺育苗场,选择规格均匀、健康和活力较好的个体进行试验。试验设置海砂(SS)、粗陶粒(CC,粒径为2.0~4.0 mm)、细陶粒(FC,粒径为1.0~2.0 mm)和海砂+粗陶粒混合(SS+CC,各占50%)4个不同底质的试验组。
1.2.1 不同底质对方斑东风螺存活、生长的影响试验 试验用长方形养殖池(长×宽×高为3.6 m×1.4 m×1.0 m)体积为5.04 m3,池内布设气石和进、排水管口,平均分成4个不同底质试验组(1.8 m×0.7 m×1.0 m),每个试验组平均分隔成3个平行组(0.6 m×0.7 m×1.0 m)。池底部铺设12 cm高的塑料螺架,其上覆有245 μm的筛绢网,在筛绢上铺设厚度为5 cm的底质材料,注入经预沉降消毒处理过的海水20 cm,养殖池上方使用95%的防晒网遮光。
方斑东风螺经消毒清洗后均匀放入池内,每个平行组放入200粒方斑东风螺,总质量为(900.00±5.00)g,养殖密度为480粒/m3。入池后每天8:00投饵一次,投饵时停水、停气30 min。投喂人工合成颗粒饲料,饲料系数为1%~2%。分别在投喂后30、60 min时检查残饵情况并记录东风螺潜砂和爬壁情况,并根据摄食情况调整投饲量。试验采用流水方式进行培育,养殖用水为经砂滤沉淀的自然海水,养殖过程中保持水温为(30.2±2.7)℃,pH为7.95±0.14,盐度为33±1,连续充气,控制溶解氧在5 mg/L以上。试验共进行45 d。
试验开始前从每个平行组随机选20粒方斑东风螺,记录其体质量、壳高和壳宽(表1),不同试验组方斑东风螺的初始平均体质量为(4.692±1.033) g,壳高为(28.13±2.27)mm,壳宽为(17.57±1.43)mm。
表1 不同试验组方斑东风螺的初始体质量、壳高和壳宽
Tab.1 Initial body weight,shell height and shell width of Babylonia areolata in different experimental groups
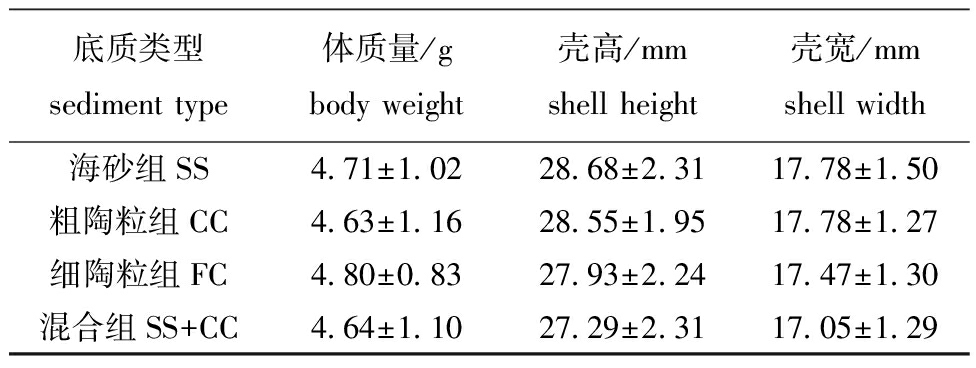
底质类型sediment type体质量/gbody weight壳高/mm shell height壳宽/mmshell width海砂组SS4.71±1.0228.68±2.3117.78±1.50粗陶粒组CC4.63±1.1628.55±1.9517.78±1.27细陶粒组FC4.80±0.8327.93±2.2417.47±1.30混合组SS+CC4.64±1.1027.29±2.3117.05±1.29
1.2.2 不同底质对方斑东风螺养殖水质的影响试验 试验用4个白色塑料箱(48 cm×37 cm×20 cm),铺设5 cm厚的4种底质(海砂、细陶粒、粗陶粒和50%海砂+50%粗陶粒),加入经砂滤沉淀的海水,高于砂层5 cm,每个试验组放入85粒方斑东风螺,保持相同的养殖密度(480粒/m3)。试验开始前将方斑东风螺均匀置于试验体系内暂养1 d,保持连续充气。试验开始后于每日8:00投喂1%螺体质量的人工颗粒饲料,分别于投喂前和投喂后2、6、12、24 h时取水样,检测水体中氨氮![]() 和亚硝酸盐氮
和亚硝酸盐氮![]() 含量。
含量。
1.2.3 水质的检测 试验过程中每日投饵前检测一次养殖池内水质情况,采用台式酸度计(雷磁力 PHS-3E)检测pH值,采用手持折光仪器(德力西 DLX-ARH100)检测盐度,采用溶解氧、温度测量仪(美国维赛 YSI DO200A)检测溶解氧和水温。采用多参数水质分析仪(YSI 9500)检测![]() 和NO2--N含量[13]。
和NO2--N含量[13]。
1.2.4 生长性能的测定 每日统计方斑东风螺死亡数量,并在试验结束后计算存活率,即
RS=(N0-Nt)/N0×100%。
(1)
式中:RS为存活率(%);N0、Nt分别为试验初始和结束时方斑东风螺的死亡数量。
试验开始和试验结束时从每个平行组随机取20粒试验螺,测量方斑东风螺的平均体质量、壳高、壳宽,并计算体质量特定生长率(specific growth rate)、壳高特定生长率和壳宽特定生长率,计算公式为
RSG1=(lnW1-lnW0)/t×100%,
(2)
RSG2=(lnH1-lnH0)/t×100%,
(3)
RSG3=(lnB1-lnB0)/t×100%。
(4)
式中:RSG1、RSG2、RSG3分别为体质量、壳高和壳宽特定生长率(%/d);W0、W1分别为试验开始和结束时随机取20粒方斑东风螺样本的平均体质量(g) ;H0、H1分别为试验开始和结束时样本的平均壳高(mm);B0、B1分别为试验开始和结束时样本的平均壳宽(mm);t为试验时间(d)。
1.2.5 底质微生物群落的测定 试验结束后,从每个平行组随机取3个底砂样本,置于无菌冻存管冻存(-20 ℃),低温送至天津诺禾致源公司进行样品基因组16S rRNA扩增和测序,并对数据进行分析。PCR扩增区域为V3~V4,引物序列为341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC)。将Illumina MiSeq测序得到的原始序列经处理后得到有效序列,采用QIIME 软件进行生物信息学分析,根据序列的相似度将序列归为多个OTUs,基于OTU计算微生物群落的丰富度指数(Chao 1)和多样性指数(Shannon、Simpson)。采用PICRUSt软件进行菌群的功能和代谢途径预测分析[14],将OTUs与KEGG数据库进行比对,获得不同的数据库功能预测信息。
试验数据均以平均值±标准差(mean±S.D.)表示。所有数据采用Excel 2021进行初步调整。采用SPSS 19.0软件进行单因素方差分析(one-way ANOVA)和Duncan法组间多重比较,显著性水平设为0.05。
从图1可见:不同底质材料对方斑东风螺的存活率无显著性影响(P>0.05);试验期间,各试验组方斑东风螺的存活率均大于95%,其中,FC组和SS组的存活率最高(均为99.5%),其次为SS+CC组(98.5%)和CC组(97.0%)。由此可见,室外水泥池养殖条件下,方斑东风螺的存活率与池底铺砂类型和粒径大小相关性不大。
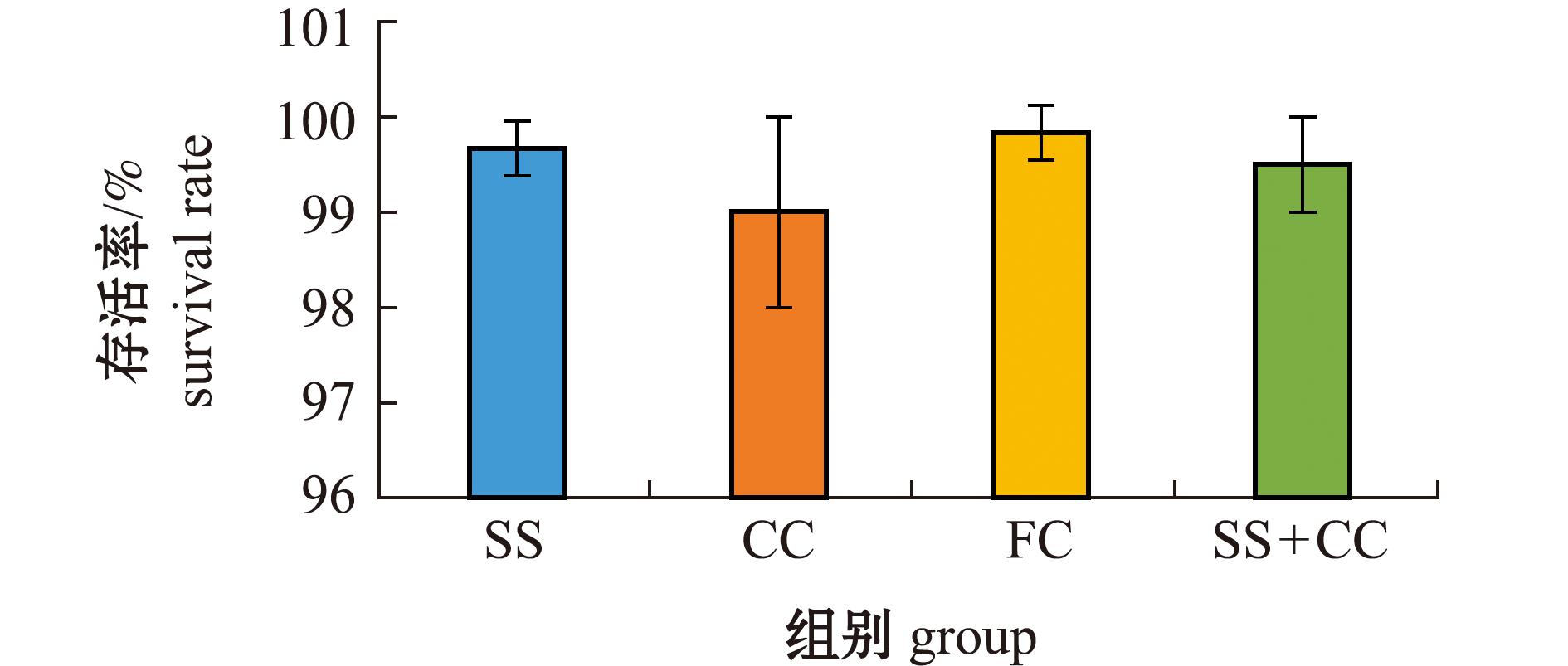
图1 不同底质中方斑东风螺的存活率
Fig.1 Survival rate of Babylonia areolata under different substrates
从表2可见:不同底质对方斑东风螺的体质量特定生长率和体宽特定生长率有显著性影响(P<0.05),但对壳高特定生长率无显著性影响(P>0.05);FC组的体质量特定生长率最高,显著高于其他底质组(P<0.05),且底质中含陶粒的FC组和CC组显著高于底质中含海砂的SS组和SS+CC组(P<0.05);FC组的体宽特定生长率显著高于SS组(P<0.05),与CC组和SS+CC组无显著性差异(P>0.05);4个试验组的体高特定生长率无显著性差异(P>0.05)。
表2 不同底质中方斑东风螺的特定生长率
Tab.2 Specific growth rate of Babylonia areolata under different substrates %/d
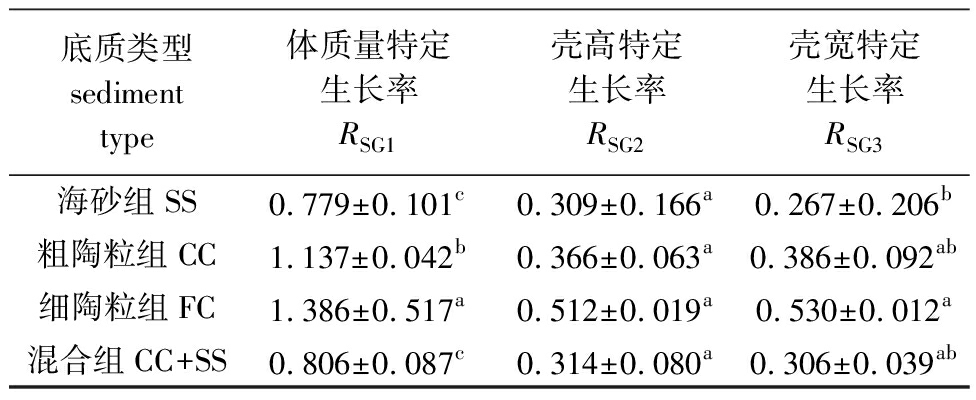
底质类型sediment type体质量特定生长率RSG1壳高特定生长率RSG2壳宽特定生长率RSG3海砂组SS0.779±0.101c0.309±0.166a0.267±0.206b粗陶粒组CC1.137±0.042b0.366±0.063a0.386±0.092ab细陶粒组FC1.386±0.517a0.512±0.019a0.530±0.012a混合组CC+SS0.806±0.087c0.314±0.080a0.306±0.039ab
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences.
Observed species指数和Chao 1指数反映样品中群落的丰富度。Shannon指数及Simpson指数反映群落的多样性。本研究中,不同底质微生物Alpha多样性分析显示:各组Chao 1指数、Observed species指数依次为CC>FC>SS+CC>SS,Shannon指数依次为SS+CC>FC>CC>SS,表明CC组微生物群落丰富度最高但多样性较低,SS组丰富度和多样性较低,FC组的丰富度和多样性均较高(表3)。
表3 不同底质中微生物群落的丰富度和多样性
Tab.3 Diversity and richness of bacterial community from different substrates
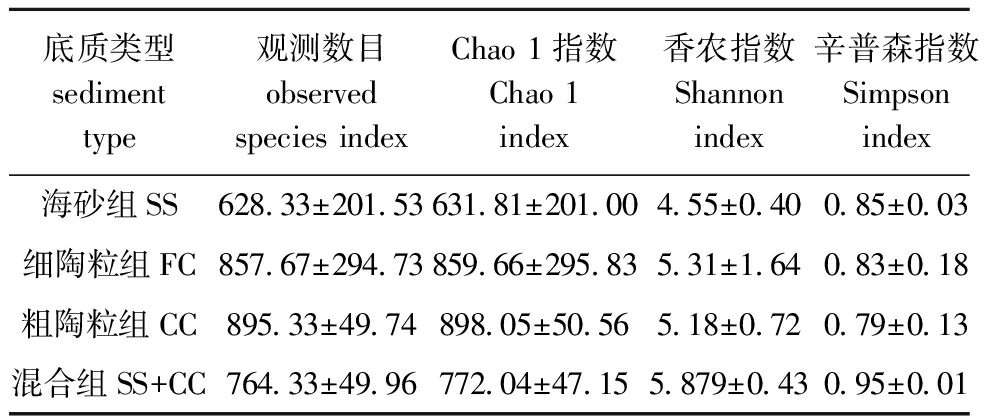
底质类型sediment type观测数目observed species indexChao 1指数Chao 1 index香农指数Shannon index辛普森指数Simpson index海砂组SS628.33±201.53631.81±201.004.55±0.400.85±0.03细陶粒组FC857.67±294.73859.66±295.835.31±1.640.83±0.18粗陶粒组CC895.33±49.74898.05±50.565.18±0.720.79±0.13混合组SS+CC764.33±49.96772.04±47.155.879±0.430.95±0.01
不同底质微生物的韦恩图分析显示:底质材质对微生物群落结构组成有较大影响;在所有样品中共得到3 440个OTUs,其中,FC、CC、SS+CC、SS组分别有1 820、1 736、1 458、1 290个OTUs,4种底质共有430个OTUs,占总数的12.5%;FC、CC、SS+CC、SS组所特有的OTUs分别为618、534、346、342个(图2),说明陶粒底质的微生物群落更丰富。
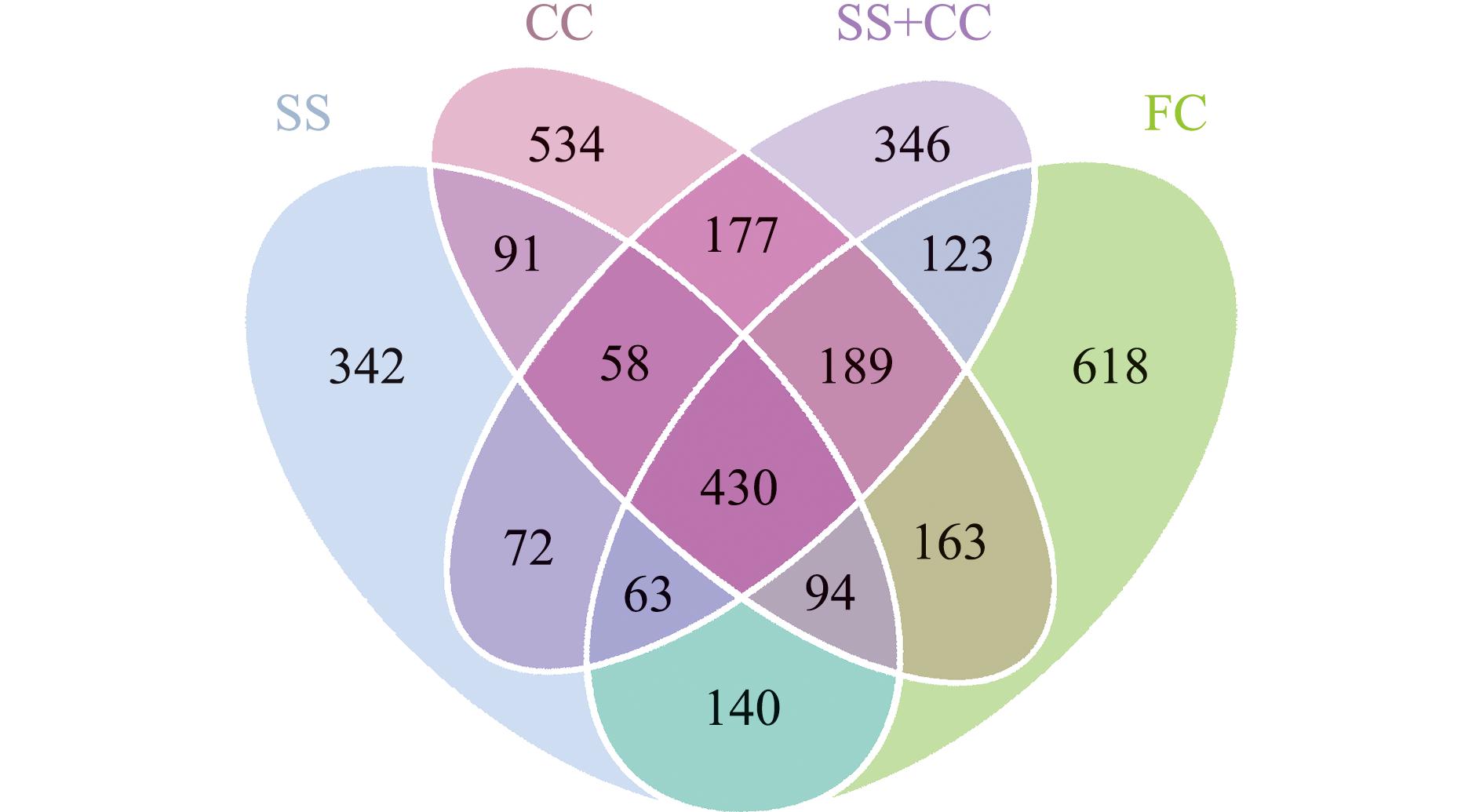
图2 各样品OTUs的韦恩图
Fig.2 Venn diagram of OTUs of all sample
在门水平上,方斑东风螺养殖底质中微生物前10分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)、疣微菌门(Verrucomicrobiota)、蓝细菌门(Cyanobacteria)、浮霉菌门(Planctomycetota)、黏球菌门(Myxococcota)和异常球菌门(Deinococcota)(图3(a))。其中,厚壁菌门和变形菌门的丰度占总丰度的86.65%~93.75%,FC组和CC组厚壁菌门的相对丰度较低,变形菌门的相对丰度则较高;FC、CC、SS+CC组中拟杆菌门和浮霉菌门的相对丰度高于SS组;FC组中酸杆菌门的相对丰度高于其他3组。
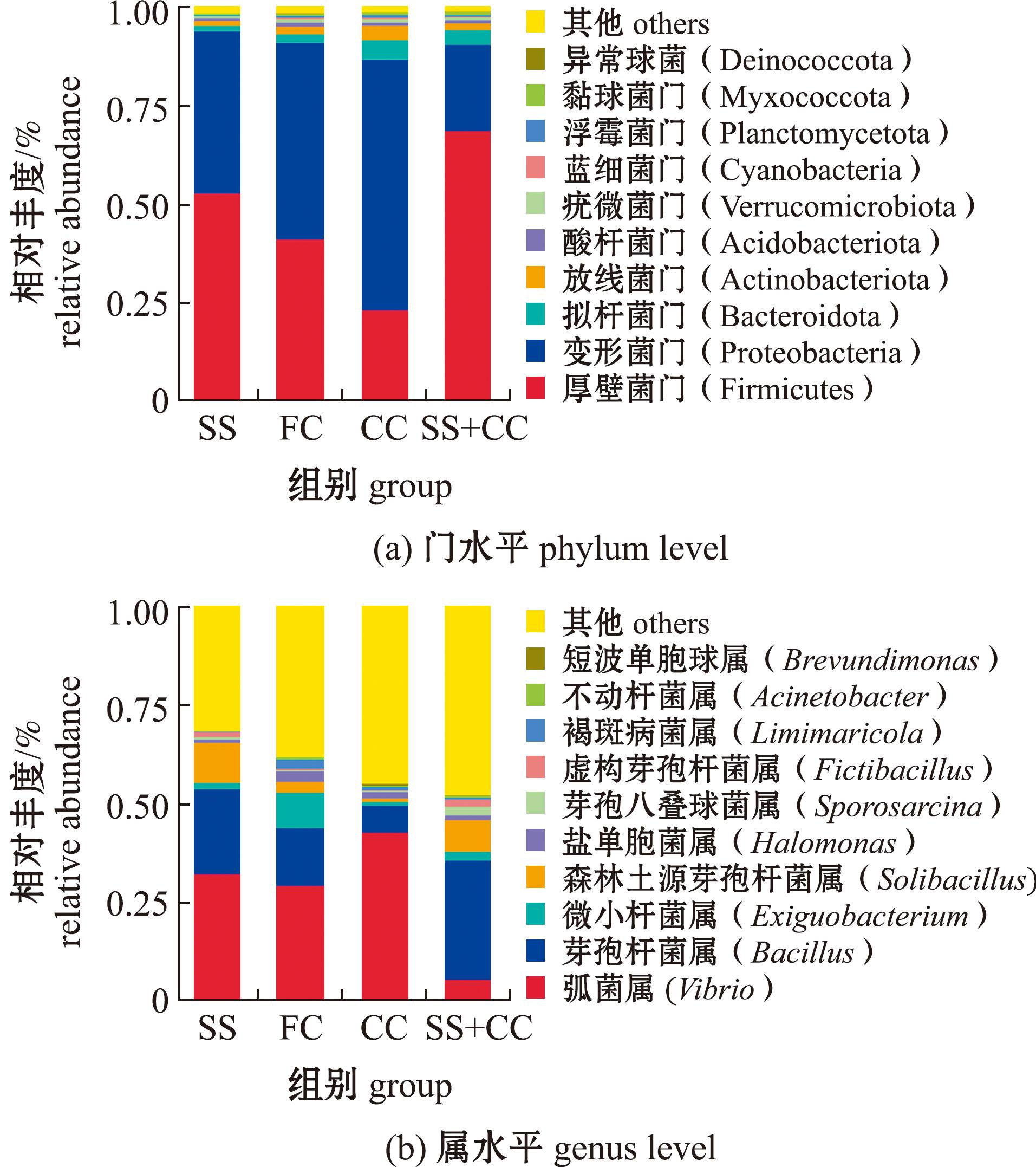
图3 不同底质中微生物群落组成
Fig.3 Microbial community composition under different substrates
在属水平上,各组的优势菌属为弧菌属(Vibrio),CC组和SS组弧菌属的相对丰度分别占总丰度的42.81%和32.36%,而FC组和SS+CC组仅分别占29.44%和5.56%;CC组芽孢杆菌属(Bacillus)的相对丰度低于其他3组,仅占6.78%;SS组和SS+CC组森林土源芽孢杆菌属(Solibacillus)的相对丰度较高,分别占10.08%和8.16%;FC组和CC组盐单胞菌属(Halomonas)的相对丰度较高,分别占2.62%和1.66%;FC组微小杆菌属(Exiguobacterium)的相对丰度高于其他组,达到9.22%(图3(b))。
基于KEGG数据库进一步对底质样品中的微生物功能类别相对丰度进行预测,KEGG通路二级功能层面上丰度排名前35的预测功能基因及其丰度见图4。其中,FC组有19个功能基因通路的相对丰度增加,有15个功能基因通路相对丰度降低,丰度改变的通路主要与微生物不同物质的代谢相关;相对丰度增加的通路包括氨基酸代谢、辅因子与维生素代谢、膜转运、新陈代谢、异生素的生物降解与代谢和能量代谢等相关通路,相对丰度降低的功能基因通路有酶家族、碳水化合物代谢、复制与修复、核苷酸代谢和萜类与聚酮类化合物代谢等相关通路。CC组能量代谢、运输与分解代谢、其他次生代谢产物、生物合成、脂质代谢和翻译等通路的相对丰度增加。而SS组在核苷酸代谢、萜类与聚酮类化合物代谢、转录、缺乏特征和细胞过程与信号等功能基因通路丰度升高,氨基酸代谢、辅因子与维生素代谢和膜转运等功能基因通路丰度降低,其通路丰度的变化与FC组具有显著性差异。
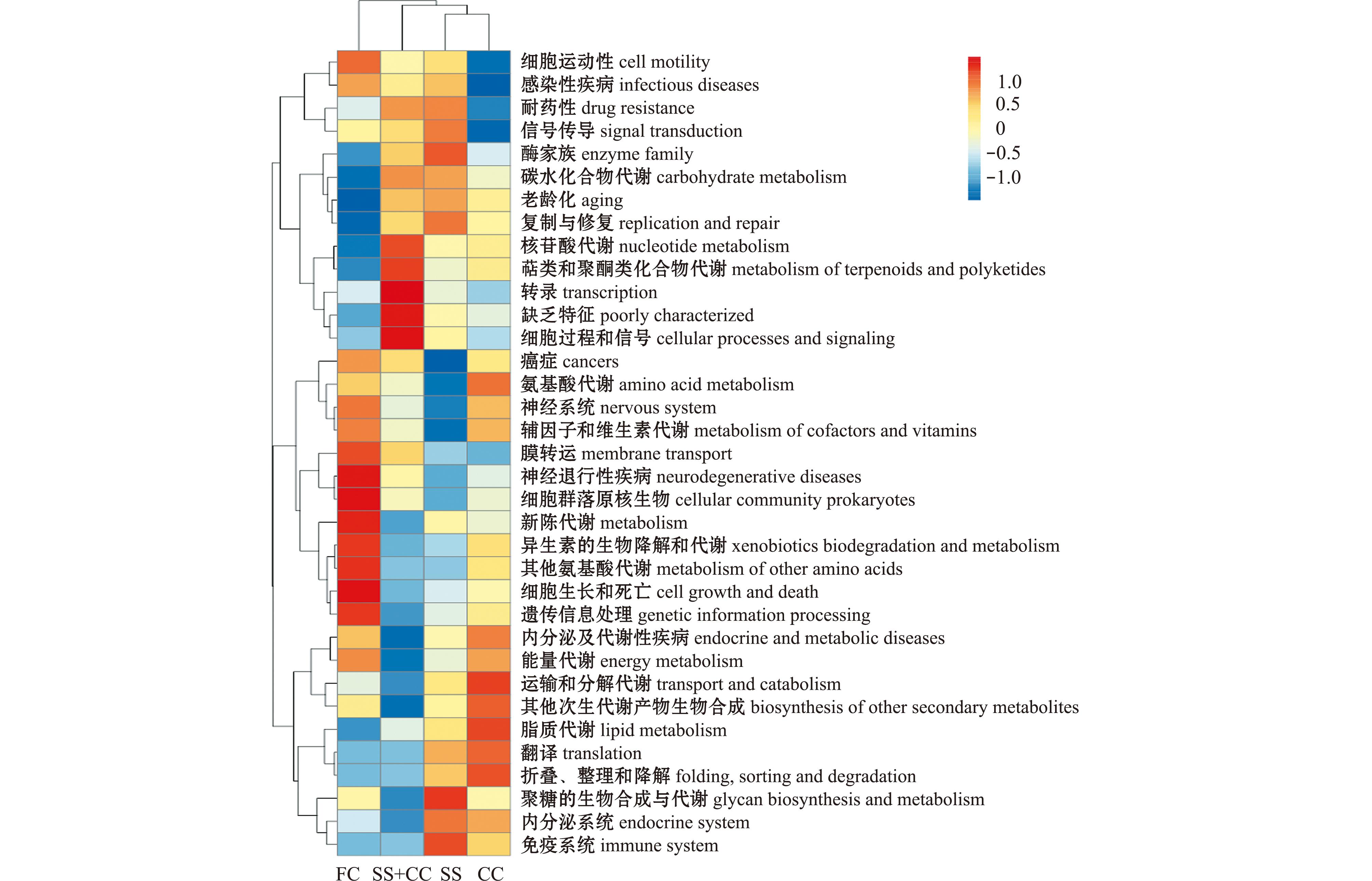
图4 微生物功能预测聚类热图(二级功能层)
Fig.4 Microbial function prediction clustering heat map(hierarchy level 2)
从图5(a)可见:方斑东风螺培育水体中![]() 的初始质量浓度小于2 mg/L,随着时间的延长,各组养殖水体中
的初始质量浓度小于2 mg/L,随着时间的延长,各组养殖水体中![]() 质量浓度均呈上升趋势;2 h时,SS组和SS+CC组的
质量浓度均呈上升趋势;2 h时,SS组和SS+CC组的![]() 质量浓度显著高于FC组和CC组(P<0.05);24 h时,各组
质量浓度显著高于FC组和CC组(P<0.05);24 h时,各组![]() 质量浓度均高于6 mg/L,其中SS组和SS+CC组达到了6.70 mg/L,显著高于FC组和CC组(P<0.05)。
质量浓度均高于6 mg/L,其中SS组和SS+CC组达到了6.70 mg/L,显著高于FC组和CC组(P<0.05)。
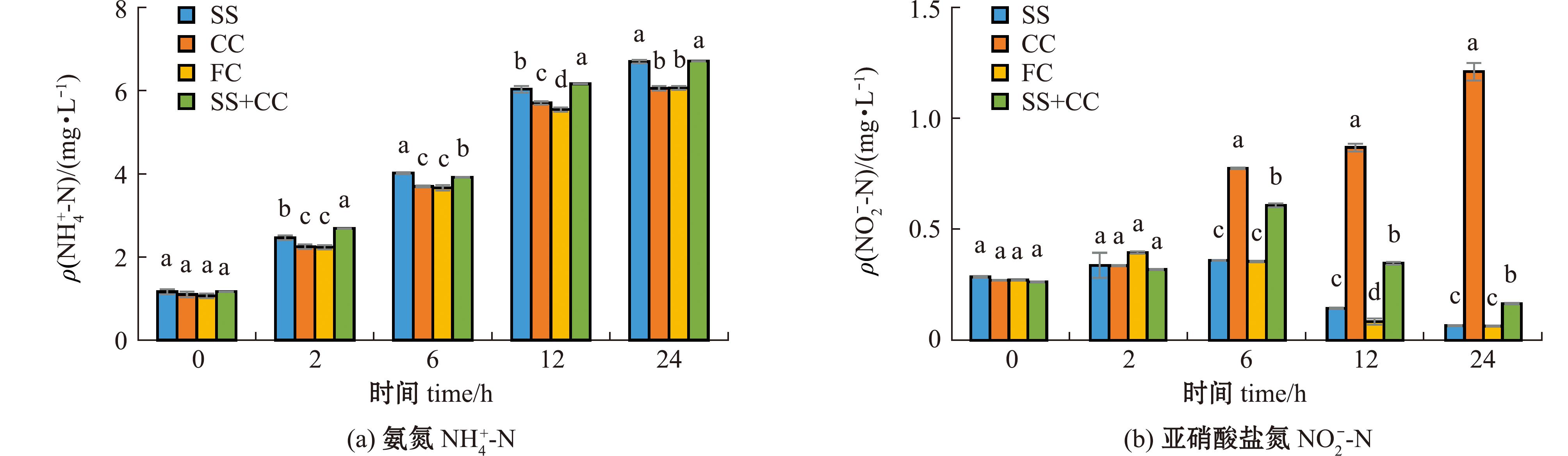
标有不同字母者表示同一时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
The means with different letters in different groups in the same time are significantly different at the 0.05 probability level,and the means with the same letter within the same column are not significant differences among groups.
图5 不同底质对水体中![]() 质量浓度的影响
质量浓度的影响
Fig.5 Effects of different sediments on the mass concentrations of ![]() in water
in water
从图5(b)可见:方斑东风螺培育水体中![]() 的初始质量浓度小于0.5 mg/L;6 h时CC组和SS+CC组的
的初始质量浓度小于0.5 mg/L;6 h时CC组和SS+CC组的![]() 质量浓度显著升高(P<0.05),随后CC组的
质量浓度显著升高(P<0.05),随后CC组的![]() 质量浓度持续升高,其他3组的
质量浓度持续升高,其他3组的![]() 质量浓度均降低;24 h时,CC组的
质量浓度均降低;24 h时,CC组的![]() 质量浓度超过1.0 mg/L,显著高于另外3组(P<0.05)。CC组和SS+CC组
质量浓度超过1.0 mg/L,显著高于另外3组(P<0.05)。CC组和SS+CC组![]() 质量浓度出现显著上升,可能是由于底砂粒径过大,不利于吸附养殖水体中
质量浓度出现显著上升,可能是由于底砂粒径过大,不利于吸附养殖水体中![]()
大多数潜砂水生动物对底质具有选择性,但对不同底质也具有一定适应性。射线美丽蚌(Lampsilis radiata)除软泥底质外,对其他底质适应性也较强,而椭圆蚌(Elliptio dilatata)则无明显的底质选择性[15]。本研究表明,陶粒作为人造底质对方斑东风螺的存活率无显著性影响,这与杨章武等[16]发现,在池底铺砂情况下不同底质不影响方斑东风螺正常生长与存活的研究结果一致。海砂是方斑东风螺自然生活的底质环境,而陶粒作为人造底质材料,并未影响方斑东风螺的存活率,说明方斑东风螺能够较快适应不同底质环境且无选择性。此外,底砂粒径也会影响潜砂动物的潜砂能力,进而对其存活和生长产生影响。太湖河蚬(Corbicula fluminea)偏好细砂,魁蚶(Scapharca broughtonii)偏好中砂和细砂[17-18]。本研究中观察发现,粗陶粒组和海砂+粗陶粒混合组的方斑东风螺在投喂前后钻出和潜入砂层的速度明显慢于海砂组和细陶粒组,原因可能是粗陶粒粒径过大,影响方斑东风螺钻砂行为。此外,室外养殖池在遇暴雨天气时,由于粗陶粒间孔隙较大,水体交换速度过快,引起水体盐度快速波动,易导致方斑东风螺出现应激现象。
潘英等[19]研究表明,管角螺(Hemifusus tuba)稚螺对4种不同底质(泥砂、泥、全砂和对照组)均具有较好的适应性,且不同底质对其存活率无明显影响,但对其生长有一定影响。与此结果相似,本研究表明,不同底砂对方斑东风螺养殖存活率无显著性影响,但对其特定生长率有显著性影响,细陶粒组和粗陶粒组的体质量特定生长率均显著高于海砂组和海砂+粗陶粒混合组。对于具有潜砂习性的方斑东风螺,陶粒圆滑的结构可以更好地减少潜砂所造成的能量消耗,因而可以有更多能量用于生长[19]。此外,细陶粒组的壳宽特定生长率显著大于海砂组,说明细陶粒还有利于增加方斑东风螺的肥满度。这与叶乐等[20]对比3种不同粒径的底砂发现,细砂组的特定生长率高于粗砂组的研究结果相一致。本研究中还发现,养殖过程中海砂组砂层表面有明显黑斑,在试验结束时,海砂组和混合组有部分方斑东风螺螺壳表面存在黑斑,其原因可能是由于海砂粒径小,水体流通性较差,导致有机物堆积在砂层和螺壳表面。
微生物群落多样性指数是反映物种丰富度和均匀度的综合指标,微生物群落稳定性对生态系统的功能起着重要的作用[21]。目前普遍认为,群落多样性低易导致群落结构崩溃,并产生水质恶化问题,对应的环境会变得相对脆弱,由此增大养殖病害暴发的几率[22]。本研究中发现,粗陶粒组微生物群落的丰富度最高,但多样性较低,海砂组丰富度和多样性均较低,细陶粒组的丰富度和多样性均较高,表明陶粒的设置影响了养殖池底质的微生物群落,细陶粒作为底质材料会增加物种的丰富度和多样性。与海砂不同,陶粒具有多孔结构,更适合微生物的附着[23]。
底质类型和粒径对底质微生物的物种丰度有显著性影响。本研究中各组菌门分布显示,变形菌门和厚壁菌门是各组的优势菌,在各组中分别占比达21.6%~63.3%和23.3%~68.7%。在海砂组和海砂+粗陶粒混合组中厚壁菌门丰度高于变形菌门,而在细陶粒组和粗陶粒组中变形菌门丰度高于厚壁菌门。细陶粒组和粗陶粒组中浮霉菌门的相对丰度高于海砂组。变形菌门被认为是水产养殖中主要的共生菌[24],变形菌门和浮霉菌门均具有去除污水中有机物的作用[25-26],表明陶粒作为底质能有效调节养殖水质。拟杆菌门普遍存在于海洋环境中,本研究中,检测到的黄杆菌科也属于拟杆菌门,具有水解碳聚合物和蛋白质等有机物的功能,同时消耗水体中过量的氮和磷[27],对维持水体生态系统平衡具有重要作用,其在含陶粒的细陶粒组、粗陶粒组和海砂+粗陶粒混合组中相对丰度较高,在细陶粒组中还发现,酸杆菌门丰度比其他3组高。在自然环境中,酸杆菌门在养分循环中起着重要作用,其通过降解各种碳源(糖和蛋白质等)和减少硝酸盐实现碳氮循环[28]。微生物群落物种相对丰度的变化结果表明,细陶粒对维持水体平衡和促进养分循环具有积极作用。
在属水平上,各组呈现较大差异。细陶粒组的弧菌属丰度低于粗陶粒组和海砂组,说明使用细陶粒作为底质对抵抗病原弧菌具有积极作用。据统计,国内外约有20种致病弧菌可导致养殖贝类出现大规模死亡现象[29]。当水中的溶解氧分层之后,水体底层水质恶化,病原菌会因为氨氮含量的增加而大量滋生,水质会进一步恶化[30]。芽孢杆菌在自然环境中普遍存在,是水产养殖中最常用的益生菌之一,可以改善水质和维持水产养殖池塘中益生菌环境,抑制病原体的生态位[31]。本研究中,粗陶粒组芽孢杆菌相对丰度较低。微小杆菌是环境污染生物修复中的新秀,有些菌属具有溶磷作用和高COD去除率,可用于高盐度、高浓度有机废水处理[32]。盐单胞菌属于异养硝化细菌,在自然界中分布广泛,具有脱氮功能[33]。异养硝化细菌能够在利用有机碳源生长的同时将含氮化合物硝化生成羟胺、亚硝酸盐和硝酸盐等产物,多数还能同时进行好氧反硝化作用,直接将硝化产物转化为含氮气体[34]。本研究中,这两种菌属的相对丰度在细陶粒组中最高,表明细陶粒具有脱氮除磷和去除COD的功能。
底砂不仅是潜砂水生动物的栖息地,还是氮、磷等有机物积累和细菌繁殖的场所,在一定条件下,底砂会吸附养殖水体中的营养盐,但在生物扰动等作用下又会重新将其释放到养殖水体中[35]。本研究中发现,底砂类型对水质指标影响显著,在养殖24 h内2个陶粒组![]() 含量均小于海砂组和海砂+粗陶粒混合组,原因是陶粒有利于盐单胞菌富集,而盐单胞菌作为异养硝化菌具有脱氮作用。此外,底砂粒径对水质指标也有一定影响。在养殖6 h时,粗陶粒组和海砂+粗陶粒混合组
含量均小于海砂组和海砂+粗陶粒混合组,原因是陶粒有利于盐单胞菌富集,而盐单胞菌作为异养硝化菌具有脱氮作用。此外,底砂粒径对水质指标也有一定影响。在养殖6 h时,粗陶粒组和海砂+粗陶粒混合组![]() 含量出现升高,显著高于其他组,尤其是粗陶粒组
含量出现升高,显著高于其他组,尤其是粗陶粒组![]() 含量持续升高,原因是粗陶粒组中的芽孢杆菌丰度最低,而芽孢杆菌可以分解饲料残渣和废物,降解水中有机物,从而减少
含量持续升高,原因是粗陶粒组中的芽孢杆菌丰度最低,而芽孢杆菌可以分解饲料残渣和废物,降解水中有机物,从而减少![]() 的积累,故导致粗陶粒组
的积累,故导致粗陶粒组![]() 含量出现升高。
含量出现升高。
1)方斑东风螺室外养殖过程中,陶粒材质和粒径大小对方斑东风螺的存活无显著性影响,但对其特定生长率有显著性影响。
2)粒径为1.0~2.0 mm的细陶粒底质能够提高方斑东风螺体质量特定生长率,说明细陶粒底质有促生长作用。
3)细陶粒组的底质微生物群落丰富度和多样性较高,表明其对环境变化具有一定的耐受性。
4)细陶粒有助于去除水中有机物、维持水体平衡及促进养分循环的细菌相对丰度升高,并对抵抗病原弧菌、防止水质恶化具有积极作用。在生产过程中,可以用粒径为1.0~2.0 mm的细陶粒代替海砂作为底质材料进行方斑东风螺室外规模化养殖。
[1] 姚高友,吴浩敏,谭杰,等.不同人工饵料对方斑东风螺幼虫生长及存活的影响[J].水产科学,2018,37(1):115-119.
YAO G Y,WU H M,TAN J,et al.Effects of different artificial diets on growth and survival of larval snail Babylonia areolata[J].Fisheries Science,2018,37(1):115-119.(in Chinese)
[2] 董杨,符书源,王国福.海南省方斑东风螺养殖业的发展及其前景展望[J].科学养鱼,2011(12):39-40.
DONG Y,FU S Y,WANG G F.Development and prospect of Babylonia quadrata aquaculture in Hainan Province[J].Scientific Fish Farming,2011(12):39-40.(in Chinese)
[3] 王志成,梁志辉,彭银辉,等.方斑东风螺室内水泥池养殖研究[J].水产科学,2010,29(1):40-43.
WANG Z C,LIANG Z H,PENG Y H,et al.Culture of snail Babylonia aerolata in indoor concrete tanks[J].Fisheries Science,2010,29(1):40-43.(in Chinese)
[4] 张沛东,张倩,张秀梅,等.底质类型对中国明对虾存活、生长及行为特征的影响[J].中国水产科学,2014,21(5):1079-1086.
ZHANG P D,ZHANG Q,ZHANG X M,et al.The effect of substrate type on survival,growth,and behavior of Fenneropenaeus chinensis[J].Journal of Fishery Sciences of China,2014,21(5):1079-1086.(in Chinese)
[5] 王骏博.底质对东方鲎幼体存活的影响[J].福建农业科技,2008(2):77-78.
WANG J B.Effect of sediment on the survival of oriental horseshoe crab larvae[J].Fujian Agricultural Science and Technology,2008(2):77-78.(in Chinese)
[6] 臧维玲,戴习林,姚庆祯,等.底质对日本对虾幼虾生长的影响[J].上海水产大学学报,2003,12(1):72-75.
ZANG W L,DAI X L,YAO Q Z,et al.The effect of substrate on growth of Penaeus japonicus juvenile[J].Journal of Shanghai Fisheries University,2003,12(1):72-75.(in Chinese)
[7] HUZR D L,LASTRA M,L PEZ J.The influence of sediment grain size on burrowing,growth and metabolism of Donax trunculus L.(Bivalvia:Donacidae)[J].Journal of Sea Research,2002,47(2):85-95.
PEZ J.The influence of sediment grain size on burrowing,growth and metabolism of Donax trunculus L.(Bivalvia:Donacidae)[J].Journal of Sea Research,2002,47(2):85-95.
[8] 刘永.方斑东风螺的养殖技术[J].水产养殖,2006,27(1):22-24.
LIU Y.Cultivation techniques of Babylonia quadrata[J].Journal of Aquaculture,2006,27(1):22-24.(in Chinese)
[9] 姚智文,李德生,于连群,等.生物陶粒在水处理中的应用[J].中国资源综合利用,2007,25(11):15-17.
YAO Z W,LI D S,YU L Q,et al.Application of biological ceramsite in water treatment[J].China Resources Comprehensive Utilization,2007,25(11):15-17.(in Chinese)
[10] 查建明,张苗苗,王立久.生物陶粒在污水处理中作滤料的研究与应用[J].广东建材,2005,21(1):8-10.
ZHA J M,ZHANG M M,WANG L J.Research and application of biological ceramsite as filter material in sewage treatment[J].Guangdong Building Materials,2005,21(1):8-10.(in Chinese)
[11] 陈爽,王良恺,文涛,等.新型粉煤灰陶粒固定化有效微生物群落对模拟水产养殖废水净化效果[J].浙江农林大学学报,2020,37(4):761-768.
CHEN S,WANG L K,WEN T,et al.Purification effect of immobilized effective microorganism community of fly ash ceramsite on aquaculture wastewater[J].Journal of Zhejiang A &F University,2020,37(4):761-768.(in Chinese)
[12] 郑纪盟,高霄龙,邱天龙,等.不同底质对方斑东风螺生长及存活的影响[J].海洋科学,2015,39(11):1-6.
ZHENG J M,GAO X L,QIU T L,et al.Effect of different bottom substrate materials on the growth and survival of spotted babylon(Babylonia areolata)[J].Marine Sciences,2015,39(11):1-6.(in Chinese)
[13] 隋丽英,于秀玲,辛乃宏,等.养殖水中氨氮和亚硝酸盐氮的快速测定[J].海湖盐与化工,1998,27(2):4-6.
SUI L Y,YU X L,XIN N H,et al.Rapid determination of concentration of ammonia and nitrite in aquacultural water[J].Sea-Lake Salt and Chemical Industry,1998,27(2):4-6.(in Chinese)
[14] LANGILLE M G I,ZANEVELD J,CAPORASO J G,et al.Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J].Nature Biotechnology,2013,31(9):814-821.
[15] HUEHNER M K.Field and laboratory determination of substrate preferences of unionid mussels[J].Ohio Journal of Science,1987,87(1):29-32.
[16] 杨章武,谢阳,蔡清海,等.不同环境条件对方斑东风螺幼螺生长、存活的影响[J].福建水产,2007,29(2):33-37.
YANG Z W,XIE Y,CAI Q H,et al.The effect of different environmental conditions on growth and survival of young Babylonia aerolata[J].Journal of Fujian Fisheries,2007,29(2):33-37.(in Chinese)
[17] SCHMIDLIN S,BAUR B.Distribution and substrate preference of the invasive clam Corbicula fluminea in the River Rhine in the region of Basel (Switzerland,Germany,France)[J].Aquatic Sciences,2007,69(1):153-161.
[18] 周珊珊,张秀梅,刘旭绪,等.魁蚶稚贝的底质选择性及其潜沙能力评价[J].水产学报,2015,39(6):867-875.
ZHOU S S,ZHANG X M,LIU X X,et al.Substrate preference and burrowing ability assessment of the juvenile Scapharca broughtonii[J].Journal of Fisheries of China,2015,39(6):867-875.(in Chinese)
[19] 潘英,陈锋华,李斌,等.管角螺对几种环境因子的耐受性试验[J].水产科学,2008,27(11):566-569.
PAN Y,CHEN F H,LI B,et al.Tolerance of trumpet Hemifusus tuba(Gmelin) to several environmental factors[J].Fisheries Science,2008,27(11):566-569.(in Chinese)
[20] 叶乐,赵旺,胡静,等.底砂粒径对方斑东风螺存活、生长和养殖底质的影响[J].琼州学院学报,2016,23(2):80-85.
YE L,ZHAO W,HU J,et al.Influence of sand grain size on the survival and growth of spotted babylon Babylonia areolata and on sediment quality in the industrial farming[J].Journal of Qiongzhou University,2016,23(2):80-85.(in Chinese)
[21] 傅松哲.宏基因组测序技术在入海排污口污水监测中的研究进展[J].大连海洋大学学报,2022,37(6):903-912.
FU S Z.Research progress of metagenomic sequencing technology in monitoring of marine sewage outfalls:a review[J].Journal of Dalian Ocean University,2022,37(6):903-912.(in Chinese)
[22] 裘琼芬,张德民,叶仙森,等.象山港网箱养殖对近海沉积物细菌群落的影响[J].生态学报,2013,33(2):483-491.
QIU Q F,ZHANG D M,YE X S,et al.The bacterial community of coastal sediments influenced by cage culture in Xiangshan Bay,Zhejiang,China[J].Acta Ecologica Sinica,2013,33(2):483-491.(in Chinese)
[23] 赵晓杰,李晓莉,陶玲,等.陶粒浮床系统酶活性变化与水质净化效果相关性分析[J].淡水渔业,2015,45(6):63-69.
ZHAO X J,LI X L,TAO L,et al.Study on variation of enzyme activity in ceramsite floating bed and its relatio with removal of pollutants[J].Freshwater Fisheries,2015,45(6):63-69.(in Chinese)
[24] SAKAMI T,FUJIOKA Y,SHIMODA T.Comparison of microbial community structures in intensive and extensive shrimp culture ponds and a mangrove area in Thailand[J].Fisheries Science,2008,74(4):889-898.
[25] WAGNER M,AMANN R,LEMMER H,et al.Probing activated sludge with oligonucleotides specific for proteobacteria:inadequacy of culture-dependent methods for describing microbial community structure[J].Applied and Environmental Microbiology,1993,59(5):1520-1525.
[26] MIURA Y,HIRAIWA M N,ITO T,et al.Bacterial community structures in MBRs treating municipal wastewater:relationship between community stability and reactor performance[J].Water Research,2007,41(3):627-637.
[27] NIELSEN P H,MIELCZAREK A T,KRAGELUND C,et al.A conceptual ecosystem model of microbial communities in enhanced biological phosphorus removal plants[J].Water Research,2010,44(17):5070-5088.
[28] ZHANG Y T,DING K,YRJ L
L K,et al.Introduction of broadleaf species into monospecific Cunninghamia lanceolata plantations changed the soil Acidobacteria subgroups composition and nitrogen-cycling gene abundances[J].Plant and Soil,2021,467(1/2):29-46.
K,et al.Introduction of broadleaf species into monospecific Cunninghamia lanceolata plantations changed the soil Acidobacteria subgroups composition and nitrogen-cycling gene abundances[J].Plant and Soil,2021,467(1/2):29-46.
[29] 张颖雪,苏洁,樊景凤,等.海水养殖贝类弧菌病流行暴发及其环境影响因素研究进展[J].海洋环境科学,2020,39(3):480-487.
ZHANG Y X,SU J,FAN J F,et al.Outbreaks of vibriosis in mariculture shellfish and its research progress[J].Marine Environmental Science,2020,39(3):480-487.(in Chinese)
[30] 李博超,韩俊丽,高海涛,等.灿烂弧菌对刺参养殖的危害及防控方法[J].科学养鱼,2017(2):61-62.
LI B C,HAN J L,GAO H T,et al.Harm of Vibrio brilliant to Stichopus japonicus culture and its prevention and control methods[J].Scientific Fish Farming,2017(2):61-62.(in Chinese)
[31] KUEBUTORNYE F K A,ABARIKE E D,LU Y S.A review on the application of Bacillus as probiotics in aquaculture[J].Fish &Shellfish Immunology,2019,87:820-828.
[32] BHARTI N,YADAV D,BARNAWAL D,et al.Exiguobacterium oxidotolerans,a halotolerant plant growth promoting rhizobacteria,improves yield and content of secondary metabolites in Bacopa monnieri (L.) Pennell under primary and secondary salt stress[J].World Journal of Microbiology and Biotechnology,2013,29(2):379-387.
[33] SIVAPRAKASAM S,MAHADEVAN S,SEKAR S,et al.Biological treatment of tannery wastewater by using salt-tolerant bacterial strains[J].Microbial Cell Factories,2008,7:15.
[34] 孙雪梅,李秋芬,张艳,等.一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性[J].微生物学报,2012,52(6):687-695.
SUN X M,LI Q F,ZHANG Y,et al.Phylogenetic analysis and nitrogen removal characteristics of a heterotrophic nitrifying-aerobic denitrifying bacteria strain from marine environment[J].Acta Microbiologica Sinica,2012,52(6):687-695.(in Chinese)
[35] 刘峰,高云芳,王立欣,等.水域沉积物氮磷赋存形态和分布的研究进展[J].水生态学杂志,2011,32(4):137-144.
LIU F,GAO Y F,WANG L X,et al.Review on nitrogen and phosphorus forms and distribution in sediments[J].Journal of Hydroecology,2011,32(4):137-144.(in Chinese)