大口黑鲈(Micropterus salmoides)俗称加州鲈,隶属于鲈形目(Perciformes)棘臀鱼科(Centvarchidae)黑鲈属(Micropterus)[1],是世界上产量最大的淡水鱼类之一。大口黑鲈具有生长能力强、发病率低和耐低温等优点,且富含蛋白质、钙以及人体必需的多种氨基酸和维生素等营养物质,被誉为“淡水黄鱼”[2]。近年来,随着集约化养殖的日益发展,鲈养殖中出现了许多新问题,高密度、高投喂量等粗放式养殖方式极易引起水质恶化、鱼病发生等问题,这对鲈养殖的可持续发展产生了严重影响。
微藻是水生生态系统的重要组成部分,其主要通过光合作用汲取能量,补充自身,不仅可作为水产养殖的优质饲料,同时还能改善水环境质量。1957年首次报道了利用微藻处理污水,随着研究的不断深入,藻类生长速率快、光合速率强且可以固定二氧化碳等优点逐渐被发现,随之将其用于净化养殖水体。微藻的光合作用可以完成无机物质向有机物质的转变,将水环境中的氮、磷等营养物质吸收同化,同时对碳的固定也有较好的应用前景,在净化水体方面有较大的作用[3]。
微生态制剂(microbial preparation)亦称“益生菌”(probiotic),是一类对宿主有益的活性微生物[4]。“益生菌”一词在1965年被首次使用,Lilly等[5]将其定义为某些微生物所分泌的、能刺激其他微生物生长的物质。20世纪90年代,在全国学术研讨会上正式提出了“微生态制剂”一词。目前,国内外微生态制剂的主要品种有很多,如芽孢杆菌对水产养殖动物的生长繁殖具有较强的促进作用,并已得到了广泛应用[6]。微生态制剂不仅可以去除水环境中的氨氮和亚硝酸盐,同时还能生成某些抗病因子,遏制病原菌的生长,减少药物残留,降低鱼病发生率,并有效抑制水体中有害物质的生成,防止水体污染和富营养化[7]。除净化水质外,微生态制剂还可以通过改善水产动物内生态平衡,调节动物肠道菌群,促进有益微生物繁殖,提高蛋白酶、消化酶等活性,刺激水产动物机体免疫系统发育等,从而提高鱼类对疾病的抵抗力,保证其健康生长[8-9]。随着微生态制剂技术研究的不断深入,其将成为水产养殖发展的重要技术支撑。本研究中,比较了养殖水体中添加小球藻(Chlorella vulgaris)、枯草芽孢杆菌(Bacillus subtilis)及菌藻混合对大口黑鲈养殖水环境、生长及肝脏抗氧化酶活性的影响,以期为大口黑鲈健康养殖提供有益参考。
1 材料与方法
1.1 材料
试验用大口黑鲈购自江苏中水东泽农业发展股份有限公司,体质量为(11.71±0.90)g。
普通小球藻购自中国科学院淡水藻种库(FACHB),在实验室用BG11液体培养基对藻种进行扩大培养,终密度为1×109 cells/L。
枯草芽孢杆菌购自山东众海发生物科技有限公司,活菌含量为1×1011 CFU/g。
大口黑鲈饲料由无锡通威生物科技有限公司特种料分公司提供,饲料中粗蛋白质含量≥46.00%,粗纤维含量≤6.0%,粗脂肪含量≥6.0%,粗灰分含量≤16.0%,总磷含量≥1.20%,赖氨酸含量≥2.30%,水分含量≤12.0%。
1.2 方法
1.2.1 试验设计 试验设置小球藻组(记为加藻组,每升水体中添加量为6.25 mL)、枯草芽孢杆菌组(加菌组,每升水体中添加量为0.75 mg)和小球藻+枯草芽孢杆菌组(菌藻混合组,二者的添加量与单一组相同)3个试验组,同时设置1个空白对照组,每组设置3个平行。试验用圆形聚乙烯桶容积为1 000 L,养殖试验用水体积为800 L,用增氧泵曝气7 d后使用,每个圆形聚乙烯桶中放入50尾大口黑鲈。试验期间,每天9:00和17:00定时投喂饲料,各组饲料投喂量是空白组大口黑鲈总体质量的3%。试验期间不换水,试验场地为露天环境,各试验桶能接受自然光照。由于取样、天气原因有水体蒸发,在每次取样后将水补充到初始量。用充气泵全天增氧。养殖试验共进行60 d,试验组每隔10 d添加一次菌藻。整个试验过程中未出现自然死鱼情况。
1.2.2 样品采集 试验前采集一次水样,作为养殖用水本底值,试验开始后每隔10 d采集一次水样,共采样7 次,置于1 L聚乙烯瓶中,于4 ℃冰箱中保存。
每隔10 d分别从各桶中随机取6尾大口黑鲈,立即测定其体质量。每隔20 d从各桶中随机选取3尾鱼用作酶活性分析,取其肝脏,置于2 mL离心管中,于-80 ℃超低温冰箱中保存。
1.2.3 养殖水体中水质指标测定 分别采用过硫酸钾氧化-紫外分光光度法、硝酸-硫酸消解法测定总氮(TN)、总磷(TP)含量;采用YSI Pro Plus水质检测仪测定溶氧(DO)含量;分别采用纳氏试剂光度法、紫外分光光度法、N-(1-萘基)-乙二胺分光光度法测定氨氮![]() 硝酸盐氮
硝酸盐氮![]() 和亚硝酸盐氮
和亚硝酸盐氮![]() 含量。
含量。
1.2.4 生长性能指标测定 增重率(RWG,%)、存活率(RS,%)和特定生长率(RSG,%/d)计算公式分别为
RWG=100%×(Wt-W0)/W0,
(1)
RS=100%×Nt/N0,
(2)
RSG=100%×(lnWt-lnW0)/t。
(3)
式中:Wt、W0分别为试验末和试验初始鱼体质量(g);t为试验持续时间(d);Nt和N0分别为试验末和试验初鱼数量(尾)。
1.2.5 酶活性指标测定 按照质量(g)与体积(mL)为1∶9的比例向肝脏样品中加入pH为7.2~7.4的PBS缓冲液,充分研磨,之后置于冷冻离心机(2 500 r/min,4 ℃)离心20 min,离心后取2 mL上清液待测。按照试剂盒操作步骤测定肝脏过氧化氢酶(CAT)、溶菌酶(LZM)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)活性,以及丙二醛(MDA)、微量还原型谷胱甘肽(GSH)含量,试剂盒均购自建成(南京)生物工程研究所。
1.3 数据处理
试验数据用Excel 2019进行整理,并以平均值±标准误(mean±S.E.)表示。采用SPSS 25软件进行单因素方差分析(one-way ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 藻、菌及其组合对养殖水环境指标的影响
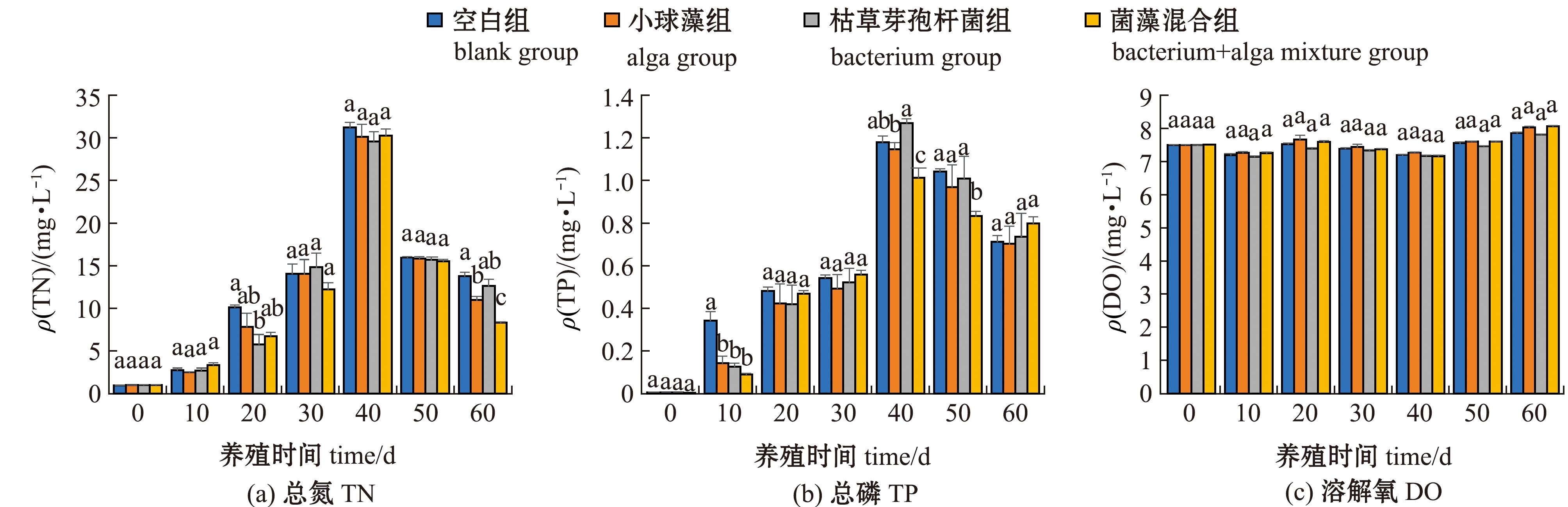
2.1.1 大口黑鲈养殖水中TN、TP和DO含量的变化 从图1可见:养殖试验期间,空白组和加菌/藻试验组水体中TN和TP含量均呈先升高后降低的变化趋势,而DO含量则无明显变化;菌藻混合组水体中的TN含量在0~50 d 时与空白组无显著性差异(P>0.05),在60 d时较其他组显著降低(P<0.05),其中较空白组降低了39.4%,表明菌藻混合组去氮效果最显著;菌藻混合组水体中的TP含量在10 d时较空白组显著降低(P<0.05),在40、50 d时较其他组显著降低(P<0.05),在40 d时较空白组降低了14.2%;空白组和试验组水体中的DO含量在0~60 d时均未出现显著性差异(P>0.05)。
标有不同字母者表示同一时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
The means with different letters within the same time are significantly different in the different groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences,et sequentia.
图1 大口黑鲈养殖水中TN、TP和DO含量的变化
Fig.1 Changes in TN,TP and DO concentrations in Micropterus salmoides culture water
2.1.2 大口黑鲈养殖水中![]() 和
和![]() 含量的变化 从图2可见:养殖试验期间,空白组和加菌/藻试验组水体中
含量的变化 从图2可见:养殖试验期间,空白组和加菌/藻试验组水体中![]() 含量呈先升高后降低再升高的变化趋势,菌藻混合组水体中
含量呈先升高后降低再升高的变化趋势,菌藻混合组水体中![]() 含量分别在10、40 d时较空白组显著降低(P<0.05),在20、30 d时较其他组显著降低(P<0.05),在60 d时略低于空白组;空白组和试验组水体中
含量分别在10、40 d时较空白组显著降低(P<0.05),在20、30 d时较其他组显著降低(P<0.05),在60 d时略低于空白组;空白组和试验组水体中![]() 含量呈一直升高的变化趋势,菌藻混合组水体中
含量呈一直升高的变化趋势,菌藻混合组水体中![]() 含量在40~60 d时较空白组显著降低(P<0.05);空白组和试验组水体中
含量在40~60 d时较空白组显著降低(P<0.05);空白组和试验组水体中![]() 含量呈先升高后降低的变化趋势,菌藻混合组水体中的
含量呈先升高后降低的变化趋势,菌藻混合组水体中的![]() 含量在40、50 d时较其他组显著降低(P<0.05),在60 d时略低于其他组(P>0.05)。
含量在40、50 d时较其他组显著降低(P<0.05),在60 d时略低于其他组(P>0.05)。
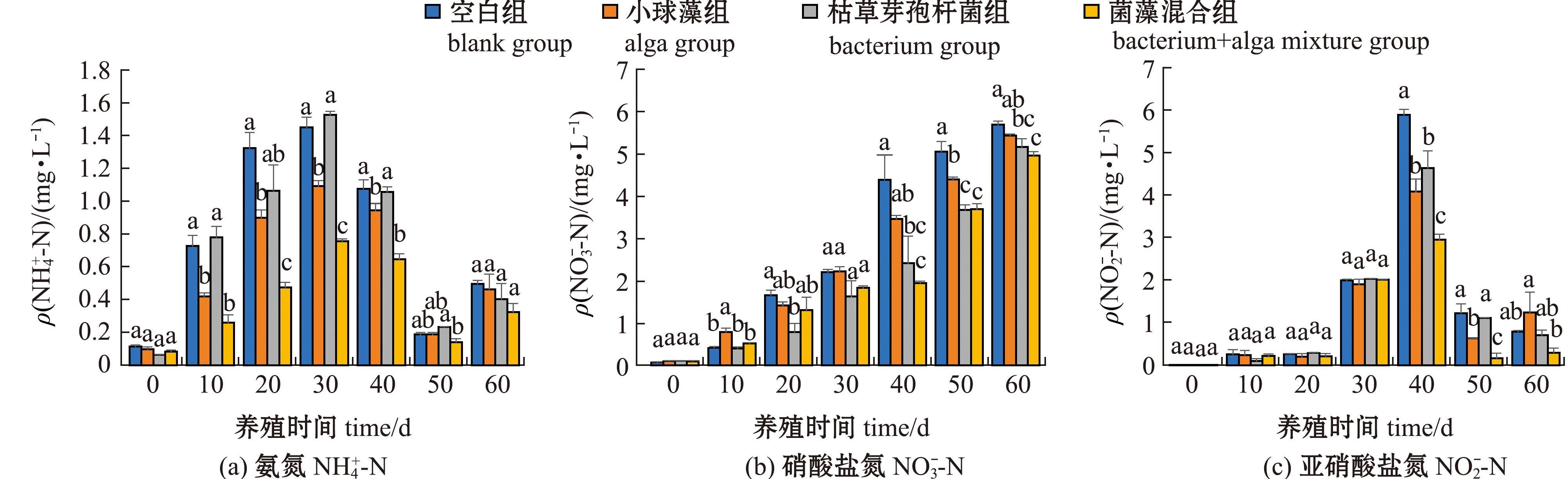
图2 大口黑鲈养殖水中![]() 和
和![]() 含量的变化
含量的变化
Fig.2 Changes in ![]() concentrations in Micropterus salmoides culture water
concentrations in Micropterus salmoides culture water
2.2 藻、菌及其组合对大口黑鲈生长性能的影响
从表1可见:养殖试验结束时,加藻组、加菌组和菌藻混合组大口黑鲈的增重率和特定生长率均较空白组有所提高,但仅菌藻混合组的终末体质量、增重率和特定生长率较空白组有显著性提高(P<0.05);各组存活率无显著性差异(P>0.05),均为100%。
表1 不同处理组大口黑鲈生长性能的变化
Tab.1 Changes in growth performance of Micropterus salmoides in different treatment groups
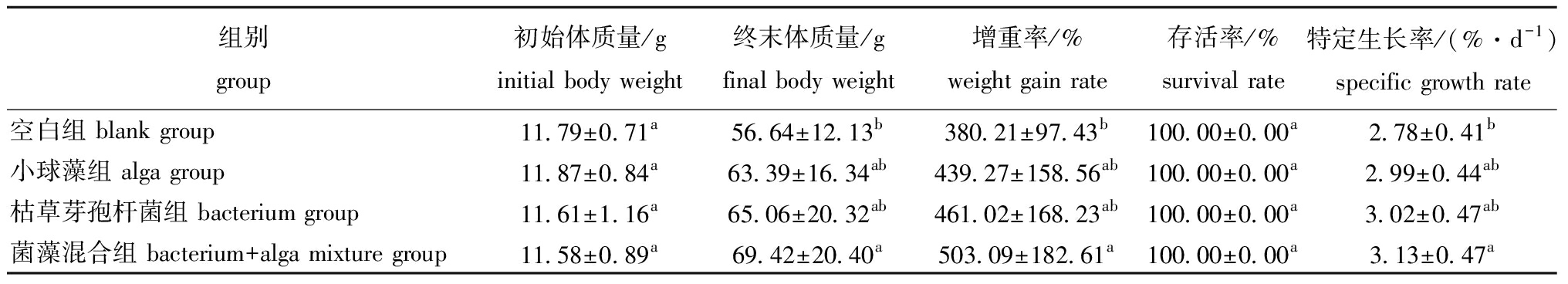
组别group初始体质量/ginitial body weight终末体质量/gfinal body weight增重率/%weight gain rate存活率/%survival rate特定生长率/(%·d-1)specific growth rate空白组 blank group11.79±0.71a56.64±12.13b380.21±97.43b100.00±0.00a2.78±0.41b小球藻组 alga group11.87±0.84a63.39±16.34ab439.27±158.56ab100.00±0.00a2.99±0.44ab枯草芽孢杆菌组 bacterium group11.61±1.16a65.06±20.32ab461.02±168.23ab100.00±0.00a3.02±0.47ab菌藻混合组 bacterium+alga mixture group11.58±0.89a69.42±20.40a503.09±182.61a100.00±0.00a3.13±0.47a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level,and the means with the same letter within the same column are not significant differences.
2.3 藻、菌及其组合对大口黑鲈肝脏免疫酶活性的影响
从图3可见:养殖试验期间,空白组与加菌/藻试验组鱼肝脏GSH和MDA含量总体上均呈一直升高的变化趋势;加菌/藻试验组鱼肝脏GSH含量在40~60 d时较空白组显著升高(P<0.05),尤其是菌藻混合组的升高效果最显著,在60 d时显著高于其他组(P<0.05),其中较空白组升高了178.3%;加菌/藻试验组鱼肝脏MDA含量在40~60 d时较空白组显著降低(P<0.05),尤其是菌藻混合组的降低效果最显著,在60 d时显著低于其他组(P<0.05),其中较空白组降低了44.7%。
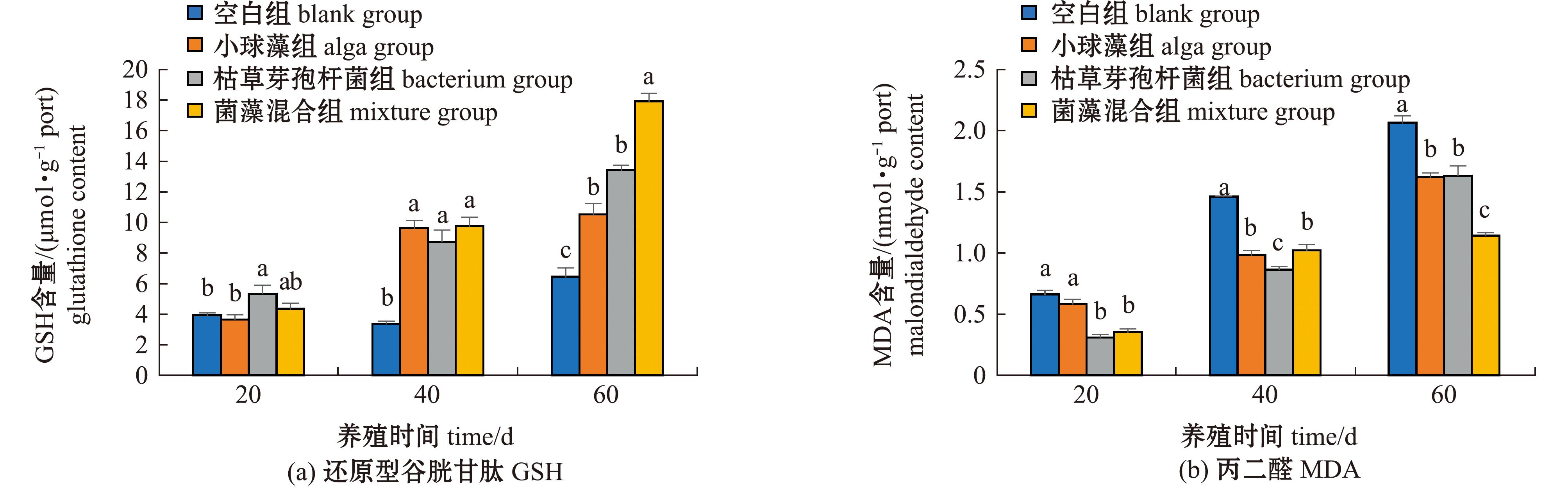
图3 大口黑鲈肝脏GSH和MDA含量的变化
Fig.3 Changes in glutathione and malondialdehyde concentrations in Micropterussal salmoides liver
从图4可见:养殖试验期间,空白组和加菌/藻试验组鱼肝脏CAT、SOD、GSH-PX和LZM活力均呈一直升高的变化趋势;加菌/藻试验组鱼肝脏中这4种酶活力在20~60 d时均较空白组显著升高(P<0.05),尤其是菌藻混合组的升高效果最显著,4种酶活力在40~60 d时显著高于其他组(P<0.05),在60 d时菌藻混合组的CAT、SOD、GSH-PX和LZM活力分别较空白组升高了90.6%、62.4%、82.7%、67.5%。
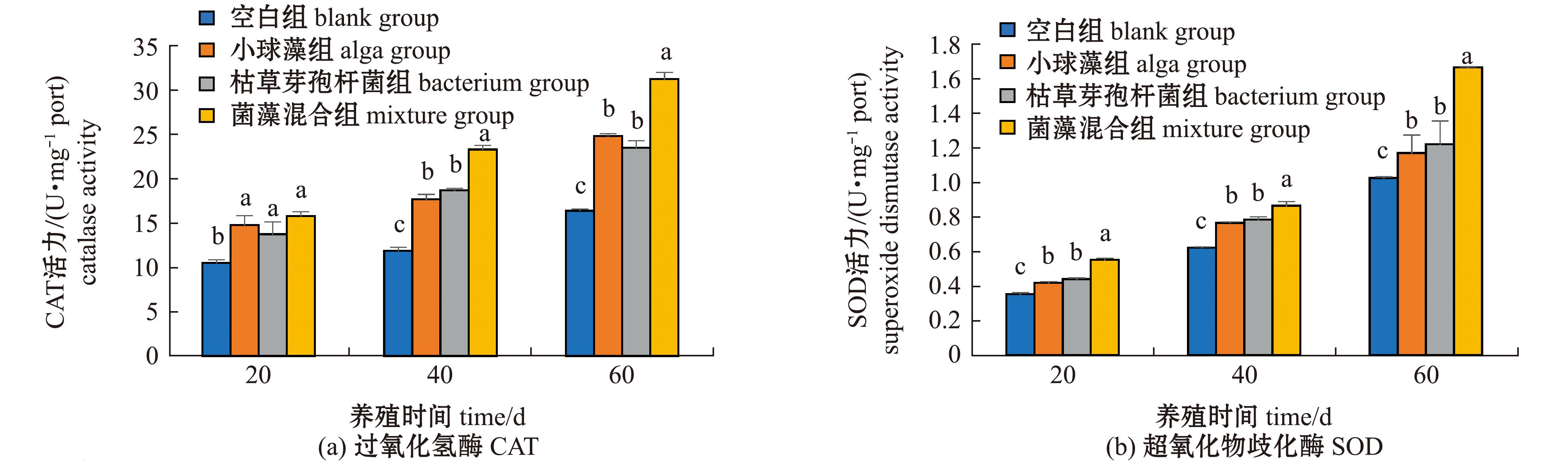
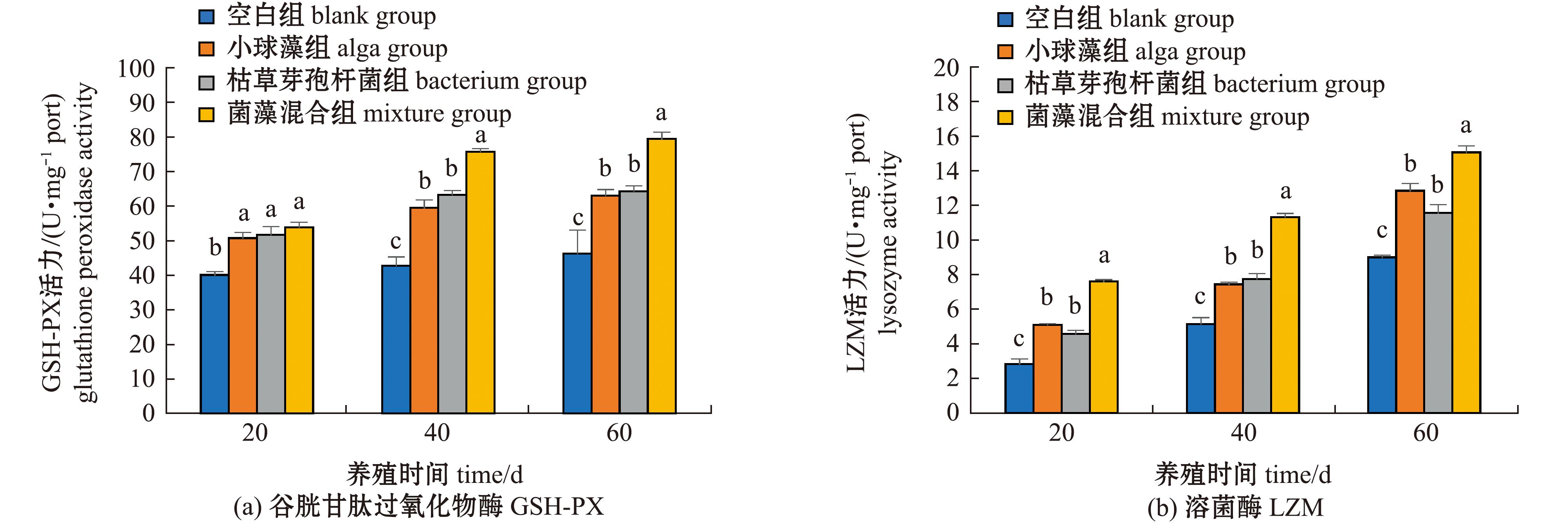
图4 大口黑鲈肝脏CAT、SOD、GSH-PX和LZM活力的变化
Fig.4 Changes in catalase,superoxide dismutase,glutathione peroxidase and lysozyme in Micropterus salmoides liver
3 讨论
3.1 藻、菌及菌藻组合对大口黑鲈养殖水环境指标的影响
3.1.1 对TN、TP和DO指标的影响 在养殖环境中同时添加菌和藻,不仅因为细菌和微藻在利用无机物、有机物、氧气和二氧化碳时有互补的生理特性,微藻还可以吸收氮、磷等营养元素供自身生命活动,而微藻光合作用产生的氧气可以供好氧菌呼吸,微藻死亡分泌在水中的物质可供其氧化分解,细菌呼吸、微藻夜间呼吸产生的二氧化碳和大气中的二氧化碳又可用于微藻光合作用[10]。李祯[11]研究发现,各种微藻对于去除水中的氮、磷都有一定效果,且不同微藻对于氮、磷的去除率不同,小球藻对TN、TP的去除率分别能达到52.02%和74.30%。刘丽平等[12]将小球藻与芽孢杆菌混合组成体系,发现其不仅具有良好的环境适应能力,而且能够有效去除海水养殖水中的氮、磷。本研究中发现,养殖水体中同时添加小球藻和枯草芽孢杆菌的混合组,TN、TP含量在养殖40 d时开始减少,这可能是因为随温度升高,菌藻长势较好,对水体有一定净化作用,菌藻混合组在60 d时TN含量比空白组降低了39.4%,在40 d时TP含量比空白组降低了14.2%。这与刘丽平等[12]的研究结果一致,该研究发现,菌藻混合对TN、TP去除率分别达75.34%和93.04%,效果上与本研究结果有一定差异。原因可能是小球藻和枯草芽孢杆菌对养殖水体的净化受多方面因素影响,不但与菌藻种类相关,还可能与菌藻形态结构及活性有关。
水体DO浓度对养殖生物也起着至关重要的作用,同时也会影响到氮、磷的存在形式。本研究中,养殖水体中DO含量较为稳定,且试验组与空白组在整个试验阶段均未出现显著性差异,原因可能是整个试验阶段曝气充足,消耗的DO很快得以补充,而菌藻混合组则可能出现小球藻产生的氧气持续用于枯草芽孢杆菌细胞代谢的情况。
3.1.2 对![]() 和
和![]() 指标的影响 水质状况直接决定了鱼类能否健康生长,在养殖过程中,对水质影响最大的是鱼类粪便及残饵,其被微生物分解成
指标的影响 水质状况直接决定了鱼类能否健康生长,在养殖过程中,对水质影响最大的是鱼类粪便及残饵,其被微生物分解成![]() 等无机小分子,导致水中游离态的氮浓度升高,在引起水质恶化的同时还会对鱼类产生毒害作用,并且为某些致病菌提供了营养,增加了鱼类致病的危
等无机小分子,导致水中游离态的氮浓度升高,在引起水质恶化的同时还会对鱼类产生毒害作用,并且为某些致病菌提供了营养,增加了鱼类致病的危![]() 是
是![]() 转化为
转化为![]() 的中间产物,其对鱼类的毒害作用远高于
的中间产物,其对鱼类的毒害作用远高于![]() 和
和![]() 但高浓度的
但高浓度的![]() 也会对养殖生物产生不良影响[14]。
也会对养殖生物产生不良影响[14]。
本研究中,各组养殖水体中的![]() 和
和![]() 含量随养殖时间的延长均呈先升高后降低的趋势,
含量随养殖时间的延长均呈先升高后降低的趋势,![]() 含量则均呈一直升高的趋势,但试验组上升速率较空白组缓慢,表明粪便或残饵中的有害物质无法完全被消耗,而养殖水体中添加菌藻复合体对
含量则均呈一直升高的趋势,但试验组上升速率较空白组缓慢,表明粪便或残饵中的有害物质无法完全被消耗,而养殖水体中添加菌藻复合体对![]() 和
和![]() 均有一定的降解作用,这与赵志瑞等[15]发现,运用菌藻复合体系去除尾水中
均有一定的降解作用,这与赵志瑞等[15]发现,运用菌藻复合体系去除尾水中![]() 的效果尤为显著的结果相同。有关养殖水体中添加菌和藻对
的效果尤为显著的结果相同。有关养殖水体中添加菌和藻对![]() 和
和![]() 含量影响的研究已有诸多报道,马红芳等[16]在水产养殖尾水中添加栅藻后发现,在一定时间内可使
含量影响的研究已有诸多报道,马红芳等[16]在水产养殖尾水中添加栅藻后发现,在一定时间内可使![]() 含量降低90%;何海生[17]研究蛋白核小球藻和空心菜对凡纳滨对虾养殖水体氮处理效果时发现,养殖过程中
含量降低90%;何海生[17]研究蛋白核小球藻和空心菜对凡纳滨对虾养殖水体氮处理效果时发现,养殖过程中![]() 和
和![]() 含量随养殖的进行逐渐升高,但联合处理组的去除效果明显优于单独处理组,这与本研究结果完全一致。本研究中,随着养殖的进行,小球藻和枯草芽孢杆菌可以在一定程度上降低
含量随养殖的进行逐渐升高,但联合处理组的去除效果明显优于单独处理组,这与本研究结果完全一致。本研究中,随着养殖的进行,小球藻和枯草芽孢杆菌可以在一定程度上降低![]() 和
和![]() 含量,但去除率未能达到上述研究的效果,这可能与小球藻和枯草芽孢杆菌的添加量及饲料投喂量有关。
含量,但去除率未能达到上述研究的效果,这可能与小球藻和枯草芽孢杆菌的添加量及饲料投喂量有关。
综合水质指标分析,同时添加小球藻和枯草芽孢杆菌可以有效去除养殖水体中的![]() 和
和![]() 对TN、TP也有一定的去除效果,可起到净化水质的目的。
对TN、TP也有一定的去除效果,可起到净化水质的目的。
3.2 藻、菌及菌藻组合对大口黑鲈生长性能的影响
小球藻为绿藻门小球藻属普生性单细胞绿藻,是一种球形单细胞淡水藻类,其含有许多水生动物生长所需要的营养物质,其中,小球藻所特有的生长因子(CGF)更是可以提供高含量的蛋白质、叶绿素、维生素和矿物质等[18]。阙江龙等[19]研究发现,在饲料中添加小球藻可以显著改善草鱼(Ctenopharyngodon idella)的肌肉品质,促进其生长性能的优化,同时提高机体免疫能力。枯草芽孢杆菌是一类革兰氏阳性菌,在土壤和腐败有机质中分布较广[20]。枯草芽孢杆菌属于微生态制剂,微生态制剂应用于水产行业已30余年,目前微生态制剂主要用于水产养殖动物的水质净化、动物消化吸收及环境改善等方面,复合微生态制剂作为饲料添加剂,不仅可以起到改良水质的作用,同时还能提高养殖动物抗病力,节约药物成本[21]。1986年,Kozasa[22]研究发现,用分离出的东洋芽孢杆菌(Bacillus toyoi)与土著菌混合后拌饲饲喂日本鳗鲡(Anguilla japonica)后,鱼的死亡率从60%降低到5%。随后越来越多的有益微生物被发现,益生菌在水产养殖业中由此得到了迅速发展。研究发现,复合微生态制剂能维持肠道内微生态环境平衡,同时效果要比单一微生态制剂更为显著,如邓希海等[23]研究发现,复合微生态制剂中各种成分可以发挥协同作用,显著改善鲈生长性能,从而改善其肌肉品质。
本研究中,菌藻混合组与空白组相比,增重率和特定生长率均显著提高,说明同时添加小球藻和枯草芽孢杆菌对大口黑鲈的生长具有良好的促进作用,但单藻/菌组增重率和特定生长率均与空白组无显著性差异。只添加小球藻对大口黑鲈无显著促生长作用,原因可能是小球藻中的活性成分虽影响鱼体的新陈代谢,但并未影响鱼体中生长激素的表达,所以与空白组无显著性差异,这与Shiau等[24]研究发现,由于鱼体内存在负反馈调节机制,当小球藻浓度达到一定程度时,藻类活性多糖会刺激机体代谢水平升高,消耗过多能量反而会出现抑制鱼类增长的情况一致。枯草芽孢杆菌对水产动物消化酶活力的影响不尽相同,枯草芽孢杆菌在低鱼粉情况下可以提高珍珠龙胆石斑鱼肠道蛋白酶和淀粉酶活力[25],而在草鱼饲料中添加枯草芽孢杆菌则会显著降低肠道蛋白酶活力,显著提高肠淀粉酶活力[26]。本研究中,只添加芽孢杆菌对大口黑鲈生长的促进作用不显著,原因可能是其产生的酶抑制了部分鱼体内源性酶,延缓了内源性酶对营养物质的分解,导致不能显著促进其生长,这与陈晓瑛等[27]研究发现,在饲料中添加复合芽孢杆菌对鱼体内源性酶可能存在抑制作用而导致鱼体生长性能变化不显著的结果一致。本研究中,各组成活率均为100%,说明小球藻和枯草芽孢杆菌对大口黑鲈成活率无影响。
综合生长指标分析,同时添加小球藻和枯草芽孢杆菌可以通过配合互为补充,在一定程度上起到促进大口黑鲈生长的作用。
3.3 藻、菌及菌藻组合对大口黑鲈肝脏抗氧化酶和免疫酶活性的影响
鱼类免疫系统是由抗氧化酶和其他非酶类抗氧化物质构成的抗氧化系统,其作用是可以减少鱼类抗体的自由基和活性氧,并以此来降低氧化损伤的影响。SOD活性反映了机体清除自由基的能力;MDA是机体脂质过氧化物的终产物,反映细胞的受损程度;GSH主要作用是控制细胞氧化还原状态和维持细胞正常生理功能;GSH-PX能促进GSH将代谢产生的过氧化物还原成无害物质,防止细胞受损;CAT作用于代谢产生的过氧化氢,是一种对鱼类代谢具有重要作用的氧化还原酶[28-29]。本研究中,养殖水体中添加小球藻或枯草芽孢杆菌均显著提高了大口黑鲈肝脏GSH含量,降低了MDA含量,增强了SOD、GSH-PX和CAT的活性,这与何海生[17]发现,小球藻可以显著提高凡纳滨对虾肝胰腺SOD、CAT活性和GSH含量的研究结果,以及张冬梅等[30]发现,枯草芽孢杆菌可以显著增加大口黑鲈幼鱼CAT、SOD、GSH-PX活性及显著降低MDA含量的研究结果一致。而菌藻混合组对上述抗氧化酶的促进效果显著优于单菌/藻组,分析原因可能是菌藻可以有机地协作促进有益菌团的形成,这与于永霞等[31]研究发现,菌藻共生型生物絮团可以显著提高罗非鱼抗氧化酶活性的研究结果一致。
在脊椎动物中,鱼类属于较低等的地位,其免疫系统可分为特异性免疫和非特异性免疫两种类型,鱼的非特异性免疫系统包括抗细菌、抗病毒和抗寄生虫等,其中,以抗细菌为主要特征,这也是鱼类和其他脊椎动物最主要的区别之一[32]。鱼类的免疫器官包括胸腺、头肾和肝脏,其中,肝脏不仅能反映鱼体生理、病理状况,同时还是代谢酶的重要场所,并能迅速将机体代谢过程中的有毒有害物质转化,因此,肝脏对鱼体健康具有重要影响[33]。LZM是鱼体免疫系统中的一类重要酶,其可以通过刺激鱼类的免疫系统提高鱼的抗病力和免疫力,同时能够抑制革兰氏阳性菌在鱼体组织内生长,从而降低细菌对鱼体的致病性,减少病原菌感染鱼体导致的死亡[34]。本研究中发现,养殖水体中添加小球藻显著提高了大口黑鲈肝脏LZM活性,这与阙江龙等[19]研究发现,小球藻可以显著提高草鱼LZM活性的研究结果一致;还与张冬梅等[30]研究发现,枯草芽孢杆菌可以通过增加大口黑鲈抗氧化酶和免疫酶活性提高其抗氧化能力和免疫能力,降低促炎因子的表达,维持机体正常结构的研究结果一致。杜瑞玉[35]研究发现,枯草芽孢杆菌可以显著提高大口黑鲈肠道LZM活性,维持肠道健康,这与本研究中加菌组显著提高LZM活性的结果一致。菌藻混合组增强大口黑鲈机体免疫的效果优于单菌/藻组,分析原因可能是菌藻协作刺激激活了大口黑鲈非特异性免疫功能,增强了机体免疫能力,这与刘蕾[36]在饲料中同时添加戊糖乳杆菌和钝顶螺旋藻联后,不仅能使对虾肠道维持较好的免疫状态,同时对于提高对虾的免疫能力具有协同作用的研究结果一致,但具体作用机制还有待进一步探究。
综合免疫酶指标分析,添加小球藻或枯草芽孢杆菌可在一定程度上促进大口黑鲈免疫性能的增强,且藻菌协同效果更优。
4 结论
1)在大口黑鲈养殖中同时添加小球藻和枯草芽孢杆菌能够影响养殖水环境。选择合适的菌/藻种添加,有益于对水环境的调控,能为大口黑鲈提供一个健康绿色的养殖环境。
2)在大口黑鲈养殖水体中同时添加小球藻和枯草芽孢杆菌能影响其生长性能,并显著改善其免疫活性,提高其养殖产量和经济效益。
[1] 王寿兵,程力日见,刘兴国.大口黑鲈养殖池塘溶解氧适宜性评价[J].淡水渔业,2022,52(5):83-89.
WANG S B,CHENG L R J,LIU X G.Suitability evaluation of dissolved oxygen in aquaculture ponds of Micropterus salmoides[J].Freshwater Fisheries,2022,52(5):83-89.(in Chinese)
[2] 李永娟,霍雅文,杜瑜,等.大口黑鲈营养生物学及配合饲料研究进展[J].饲料研究,2016(23):39-44.
LI Y J,HUO Y W,DU Y,et al.Research progress on nutritional biology and compound feed of largemouth bass[J].Feed Research,2016(23):39-44.(in Chinese)
[3] ZHU L D,WANG Z M,SHU Q,et al.Nutrient removal and biodiesel production by integration of freshwater algae cultivation with piggery wastewater treatment[J].Water Research,2013,47(13):4294-4302.
[4] 王芸,郑宗林.微生态制剂在水产养殖中的应用研究进展[J].饲料与畜牧,2013(2):18-24.
WANG Y,ZHENG Z L.Research progress on the application of microecological agents in aquaculture[J].Animal Agriculture,2013(2):18-24.(in Chinese)
[5] LILLY D M,STILLWELL R H.Probiotics:growth-promoting factors produced by microorganisms[J].Science,1965,147(3659):747-748.
[6] 席峰,张春晓,鲁康乐.不同微生态制剂对海月水母生存与生长的影响[J].饲料研究,2019,42(1):15-20.
XI F,ZHANG C X,LU K L.The influence of different probiotics on the surviral and growth of the moon jellyfish(Aurelia aurita)[J].Feed Research,2019,42(1):15-20.(in Chinese)
[7] 孙德文,詹勇,许梓荣.微生态制剂在水产养殖中的应用[J].淡水渔业,2002,32(3):54-57.
SUN D W,ZHAN Y,XU Z R.Application of microecological agents in aquaculture[J].Freshwater Fisheries,2002,32(3):54-57.(in Chinese)
[8] PAN K C,HE M Q.Effects of microbe additive on growth performance and digestive enzyme activities of carp,Cyprinus carpio L.[J].Feed Industry,1997,18(10):41-45.
[9] 丁贤,李卓佳,陈永青,等.芽孢杆菌对凡纳对虾生长和消化酶活性的影响[J].中国水产科学,2004,11(6):580-584.
DING X,LI Z J,CHEN Y Q,et al.Effects of probiotics on growth and activities of digestive enzymes of Pennaus vannamei[J].Journal of Fishery Sciences of China,2004,11(6):580-584.(in Chinese)
[10] 王晓焱.藻菌共生系统微藻对黑臭水氮磷和有机物的降解研究[D].淄博:山东理工大学,2021.
WANG X Y.Degradation of nitrogen,phosphorus and organic matters for black odorous water by microalgae in the algae-bacteria symbiotic system[D].Zibo:Shandong University of Technology,2021.(in Chinese)
[11] 李祯.菌藻共生系统净化海水养殖尾水的研究[D].广州:华南农业大学,2020.
LI Z.Study on purification of mariculture tailwater by microalgae-probiotics symbiosis system[D].Guangzhou:South China Agricultural University,2020.(in Chinese)
[12] 刘丽平,李赟,潘鲁青,等.海水小球藻-芽孢杆菌复合体系去除海水养殖中氮磷污染的研究[J].中国海洋大学学报(自然科学版),2022,52(11):43-55.
LIU L P,LI Y,PAN L Q,et al.Studies on removal of nitrogen and phosphorus pollution by Chlorella sp.-Bacillus sp.consortium in mariculture[J].Periodical of Ocean University of China(Nature Science Edition),2022,52(11):43-55.(in Chinese)
[13] CHEW S F,IP Y K.Excretory nitrogen metabolism and defence against ammonia toxicity in air-breathing fishes[J].Journal of Fish Biology,2014,84(3):603-638.
[14] 何杰,朱健,徐跑,等.亚硝态氮![]() 对吉富罗非鱼的毒性及相关因子[J].海洋湖沼通报,2012(2):69-76.
对吉富罗非鱼的毒性及相关因子[J].海洋湖沼通报,2012(2):69-76.
HE J,ZHU J,XU P,et al.The toxicity of nitrite  of Oceanology and Limnology,2012(2):69-76.(in Chinese)
of Oceanology and Limnology,2012(2):69-76.(in Chinese)
[15] 赵志瑞,吴海淼,马超,等.菌藻复合体系氮代谢性能及菌群特征[J].环境科学,2023,44(5):2965-2973.
ZHAO Z R,WU H M,MA C,et al.Nitrogen metabolism and flora characteristics of bacteria algae complex system[J].Environmental Science,2023,44(5):2965-2973.(in Chinese)
[16] 马红芳,李鑫,胡洪营,等.栅藻LX1在水产养殖废水中的生长、脱氮除磷和油脂积累特性[J].环境科学,2012,33(6):1891-1896.
MA H F,LI X,HU H Y,et al.Growth,removal of nitrogen and phosphorus,and lipid accumulation property of Scenedesmus sp.LX1 in aquaculture wastewater[J].Environmental Science,2012,33(6):1891-1896.(in Chinese)
[17] 何海生.小球藻和空心菜对南美白对虾养殖水环境及生长特性调控研究[D].上海:上海海洋大学,2018.
HE H S.Regulating effects of the Chlorella vulgaris and Ipomoea aquatica on aquatic environment and growth characterization of Penaeus vannamei cultured in pond[D].Shanghai:Shanghai Ocean University,2018.(in Chinese)
[18] 罗柳茵,李家泳,陈卓,等.小球藻在水产动物饲料中的应用研究进展[J].粮食与饲料工业,2016(6):55-57,61.
LUO L Y,LI J Y,CHEN Z,et al.Research progress in the application of aquatic animal feed of chlorella[J].Cereal &Feed Industry,2016(6):55-57,61.(in Chinese)
[19] 阙江龙,饶毅,徐先栋,等.小球藻对草鱼生长、免疫、消化酶活性和肌肉的影响[J].水产科学,2023,42(5):839-846.
QUE J L,RAO Y,XU X D,et al.Effects of green alga Chlorella pyrenoidosa on growth performance,immune function,digestive enzyme activities and muscle quality of grass carp Ctenopharyngodon idellus[J].Fisheries Science,2023,42(5):839-846.(in Chinese)
[20] 程洪斌,刘晓桥,陈红漫.枯草芽孢杆菌防治植物真菌病害研究进展[J].上海农业学报,2006,22(1):109-112.
CHENG H B,LIU X Q,CHEN H M.Research advance in controlling plant fungous diseases by Bacillus subtilis[J].Acta Agriculturae Shanghai,2006,22(1):109-112.(in Chinese)
[21] 肖艳.微生态制剂在水产养殖中的应用及存在的问题[J].渔业致富指南,2021(14):12-18.
XIAO Y.Application and existing problems of microecological agents in aquaculture[J].Fishery Guide to be Rich,2021(14):12-18.(in Chinese)
[22] KOZASA M.Toyocerin(Bacillus toyoi)as growth promoter for animal feeding[J].Microbiol Aliment Nutr,1986,4(2):121-135.
[23] 邓希海,黄进,刘哲.微生态制剂对鲈鱼生长性能、血清生化指标、抗氧化能力和免疫力的影响[J].中国饲料,2022(12):62-65.
DENG X H,HUANG J,LIU Z.Effects of microecological agents on growth performance,biochemical indexes,antioxidant capacity and immunity of perch[J].China Feed,2022(12):62-65.(in Chinese)
[24] SHIAU S Y,YU Y P.Dietary supplementation of chitin and chitosan depresses growth in tilapia,Oreochromis niloticus×O.aureus[J].Aquaculture,1999,179(1/2/3/4):439-446.
[25] 李军亮,杨奇慧,谭北平,等.低鱼粉饲料添加枯草芽孢杆菌对珍珠龙胆石斑鱼幼鱼生长、消化酶活性、抗氧化酶活性及其mRNA表达的影响[J].水产学报,2019,43(4):1126-1137.
LI J L,YANG Q H,TAN B P,et al.Effect of low-fishmeal diet with Bacillus subtilis on growth performance,digestive enzyme activity,antioxidant enzyme activity and its mRNA expression of juveniles Epinephelus lanceolatu♂ × E.fuscoguttatus♀[J].Journal of Fisheries of China,2019,43(4):1126-1137.(in Chinese)
[26] 鞠守勇,李金山.枯草芽孢杆菌对草鱼生长性能、肠道消化酶及抗氧化酶活性的影响[J].淡水渔业,2018,48(5):99-105.
JU S Y,LI J S.Effect of dietary Bacillus subtilis on growth performance,digestive enzymes activity and anti-oxidation function of Ctenopharyngodon idellus[J].Freshwater Fisheries,2018,48(5):99-105.(in Chinese)
[27] 陈晓瑛,伏枥龙,王国霞,等.3种添加剂对花鲈消化酶活力、前肠组织结构及营养物质表观消化率的影响[J].动物营养学报,2020,32(12):5985-5993.
CHEN X Y,FU L L,WANG G X,et al.Effects of 3 additives on digestive enzyme activities,organizational structure of foregut and nutrient apparent digestibility of Japanese sea bass(Lateolabrax japonicus)[J].Chinese Journal of Animal Nutrition,2020,32(12):5985-5993.(in Chinese)
[28] LI X K,LI P,ZHOU Q C,et al.Application prospect of replacement of fish meal with spray-dried egg meal in diets for swimming crab (Portunus trituberculatus)[J].Aquaculture Reports,2023,32:101745.
[29] XU C,GONG H H,NIU L L,et al.Maternal exposure to dietary uranium causes oxidative stress and thyroid disruption in zebrafish offspring[J].Ecotoxicology and Environmental Safety,2023,265:115501.
[30] 张冬梅,颜浩骁,罗茂林,等.饲料中添加枯草芽孢杆菌对大口黑鲈幼鱼生长、肠道组织结构、抗氧化能力、免疫能力和肠炎的影响[J].动物营养学报,2022,34(1):575-588.
ZHANG D M,YAN H X,LUO M L,et al.Effects of dietary Bacillus subtilis on growth,intestinal tissue structure,antioxidant capacity,immunity and enteritis of juvenile largemouth bass(Micropterus salmoides)[J].Chinese Journal of Animal Nutrition,2022,34(1):575-588.(in Chinese)
[31] 于永霞,罗国芝,刘文畅,等.罗非鱼藻菌共处型生物絮团养殖系统的初步探究[J].淡水渔业,2019,49(5):80-85,92.
YU Y X,LUO G Z,LIU W C,et al.Preliminary study on culturing tilapia (GIFT,Oreochromis niloticus) with algal-bacterial biofloc technology[J].Freshwater Fisheries,2019,49(5):80-85,92.(in Chinese)
[32] 张碧云,杨红玲,汪攀,等.鱼类肠道微生物与宿主免疫系统相互作用研究进展[J].微生物学报,2021,61(10):3046-3058.
ZHANG B Y,YANG H L,WANG P,et al.Advances in the interactions between intestinal microorganisms and host immune system in fish[J].Acta Microbiologica Sinica,2021,61(10):3046-3058.(in Chinese)
[33] 刘俞辰.黄鳝主要免疫器官的早期发育研究[D].上海:上海海洋大学,2022.
LIU Y C.Early development of main immune organs in rice-field eel (Monopterus albus)[D].Shanghai:Shanghai Ocean University,2022.(in Chinese)
[34] ACKERMAN P A,IWAMA G K,THORNTON J C.Physiological and immunological effects of adjuvanted Aeromonas salmonicida vaccines on juvenile rainbow trout[J].Journal of Aquatic Animal Health,2000,12(2):157-164.
[35] 杜瑞玉.酵母水解物和枯草芽孢杆菌在大口黑鲈饲料中的应用效果研究[D].重庆:西南大学,2022.
DU R Y.Evaluation of yeast hydrolysate and Bacillus subtilis as feed additives in largemouth bass(Micropterus salmoides)[D].Chongqing:Southwest University,2022.(in Chinese)
[36] 刘蕾.戊糖乳杆菌和钝顶螺旋藻联用对凡纳滨对虾生长、消化、免疫、肠道菌群和抗病力的影响[D].海口:海南大学,2022.
LIU L.Effects of Lactobacillus pentosus combined with Arthrospira platensis on the growth performance,digestive ability,immunity,intestinal microbiota and disease resistance of Litopenaeus vannamei[D].Haikou:Hainan University,2022.(in Chinese)